Периодический закон и Периодическая система
Гурына Ира
Химия для 9 классаВ начале XX века была создана теория строения атома, на основе которой периодический закон в настоящее время формулируется так: «Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атома.»
- Между положением элемента в периодической системе и его электронным строением существует связь.
- Порядковый номер элемента в периодической системе равен заряду ядра атома (следовательно, порядковый номер показывает число протонов в ядре и число электронов в атоме).
- Каждый период начинается элементом, в атомах которого начинает застраиваться новый электронный слой, причём номер этого слоя равен номеру периода (следовательно, номер периода показывает число электронных слоёв в атомах элементов данного периода).

- Элементы, атомы которых обладают сходными по строению электронными оболочками, попадают в одну подгруппу периодической системы. У всех элементов главных подгрупп электронами заполняется внешний электронный слой, причём число электронов на этом слое равно номеру группы.
У элементов I и II групп электронами заполняется s-подуровень, поэтому они называются s-элементами. У элементов III-VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов. У элементов побочных подгрупп происходит заполнение электронами d-подуровня предпоследнего слоя, а у лантаноидов и актиноидов f-подуровня предпредпоследнего слоя.
- Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 2 электрона являются металлическими, 2 – 5 электронов – переходными, 4 – 8 электронов – неметаллическими.
В периоде с возрастанием заряда ядра атомов металлические свойства уменьшаются, а неметаллические усиливаются. Это связано с увеличением числа электронов на последнем слое.
Это связано с увеличением числа электронов на последнем слое.
В главной подгруппе с возрастанием заряда ядра атомов металлические свойства усиливаются, а неметаллические уменьшаются. Это связано с увеличением числа электронных слоёв, а следовательно с уменьшением сил притяжения электронов последнего слоя к ядру.
Периодическое повторение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и повторением электронных структур атома.
Химическая активность элементов определяется строением внешнего электронного слоя. Активность галогенов объясняется нехваткой 1 электрона до завершения внешнего слоя. У инертных элементов внешний электронный слой завершён, поэтому они химически неактивны. У атомов щелочных металлов 1 электрон на последнем слое является как бы лишним.
Полезные ссылки
Источник материала
Периодическая система как условная запись периодического закона (видео)
Характеристика элементов по положению в таблице Менделеева (видео)
Изменение свойств элементов и их соединений по периодам и группам (видео)
Периодический закон и Периодическая система химических элементов (видео)
Описание элемента по положению в Периодической системе (видео)
Закономерности изменения электроотрицательности элементов в группе и периоде (видео)
Дополнительные материалы
Периодический закон и периодическая система элементов Менделеева (видео)
Периодическая система элементов (видео)
Поделиться Share Tweet
Заряд ядра атома, теория и примеры
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Атомы любых веществ являются электрически нейтральными частицами. Атом состоит из ядра и совокупности электронов. Ядро несет положительный заряд, суммарный заряд которого равен сумме зарядов всех электронов атома.
Общие сведения о заряде ядра атома
Заряд ядра атома определяет местоположение элемента в периодической системе Д.И. Менделеева и соответственно химические свойства вещества, состоящего их этих атомов и соединений этих веществ. Величина заряда ядра равна:
где Z – номер элемента в таблице Менделеева, e – величина заряда электрона или .
Элементы с одинаковыми числами Z, но разными атомными массами называют изотопами. Если элементы имеют одинаковые Z, то у них ядро имеет равное число протонов, а если атомные массы различны, то число нейтронов в ядрах этих атомов разное. Так, у водорода имеется два изотопа: дейтерий и тритий.
Если элементы имеют одинаковые Z, то у них ядро имеет равное число протонов, а если атомные массы различны, то число нейтронов в ядрах этих атомов разное. Так, у водорода имеется два изотопа: дейтерий и тритий.
Ядра атомов имеют положительный заряд, так как состоят из протонов и нейтронов. Протоном называют стабильную частицу, принадлежащую классу адронов, являющуюся ядром атома водорода. Протон – это положительно заряженная частица. Ее заряд равен по модулю элементарному заряду, то есть величине заряда электрона. Заряд протона часто обозначают как , тогда можно записать, что:
Масса покоя протона () примерно равна:
Подробнее о протоне можно узнать, прочитав раздел «Заряд протона».
Эксперименты по измерению заряда ядра
Первым заряды ядер измерил Мозли в 1913 г. Измерения были косвенными. Ученый определил связь между частотой рентгеновского излучения () и зарядом ядра Z.
где C и B – постоянные не зависящие от элемента для рассматриваемой серии излучения.
Напрямую заряд ядра измерил Чедвик в 1920 г. Он проводил рассеивание – частиц на металлических пленках, по сути, повторяя опыты Резерфорда, которые привели Резерфорда к построению ядерной модели атома.
В этих экспериментах – частицы пропускались через тонкую металлическую фольгу. Резерфорд выяснил, что в большинстве случаев частицы проходили сквозь фольгу, отклоняясь на малые углы от первоначального направления движения. Это объясняется тем, что – частицы отклоняются под воздействием электрических сил электронов, которые имеют значительно меньшую массу, чем – частицы. Иногда, довольно редко – частицы отклонялись на углы превышающие 90o. Этот факт Резерфорд объяснил наличием в атоме заряда, который локализован в малом объеме, и этот заряд связан с массой, которая много больше, чем у – частицы.
Для математического описания результатов своих экспериментов Резерфорд вывел формулу, которая определяет угловое распределение – частиц после их рассеяния атомами. При выводе этой формулы ученый использовал закон Кулона для точечных зарядов и при этом считал, что масса ядра атома много больше, чем масса – частицы. Формулу Резерфорда можно записать как:
При выводе этой формулы ученый использовал закон Кулона для точечных зарядов и при этом считал, что масса ядра атома много больше, чем масса – частицы. Формулу Резерфорда можно записать как:
где n – количество рассеивающих ядер на единицу площади фольги; N – число – частиц, которые проходят за 1 секунду через единичную площадку, перпендикулярно к направлению потока – частиц; – количество частиц, которые рассеиваются внутри телесного угла – заряд центра рассеяния; – масса – частицы; – угол отклонения – частиц; v – скорость – частицы.
Формулу Резерфорда (3) можно использовать для того, чтобы найти заряд ядра атома (Z), если провести сравнение числа падающих – частиц (N) с числом (dN) частиц рассеянных под углом , то функция будет зависеть только от заряда рассеивающего ядра. Проводя опыты и применяя формулу Резерфорда Чедвик нашел заряды ядер платины, серебра и меди.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Nuclear Charge
Корпускуляризм
Корпускуляризм — это теория, предложенная Декартом, согласно которой вся материя состоит из мельчайших частиц.
Рене Декарт
Рене Декарт был известным математиком и философом 16-го века, который выдвинул теорию корпускуляризма об атоме.
Полупроводники
Полупроводники — это термин для описания металлоидов, которые способны проводить ток при подаче электрической энергии за счет движения электронов, но измерения проводимости не такие высокие, как у металлов, из-за меньшего количества электронов, несущих заряд или менее упорядоченная структура.
Ионное соединение
Ионное соединение представляет собой связь, которая образуется между металлами и неметаллами с образованием большой ионной решетки. Атомы водорода под воздействием большого количества тепла и давления вынуждены объединяться, образуя более крупный атом гелия
Принцип неопределенности
Принцип неопределенности Гейзенберга используется для описания взаимосвязи между импульсом и положением электрона. Где, если точное положение электрона известно, импульс будет неопределенным.
Гейзенберг
Вернер Гейзенберг был немецким физиком, пионером в области квантовой механики. Он разработал принцип неопределенности относительно импульса и положения электрона.
Он разработал принцип неопределенности относительно импульса и положения электрона.
Лепестки
Лепестки относятся к форме электронных волн и области с наибольшей вероятностью, где этот электрон как частица может быть найден.
Принцип исключения Паули
Исключение Паули относится к теории, согласно которой каждый электрон может иметь только уникальный набор из 4 квантовых чисел, и никакие два электрона не могут иметь одинаковые квантовые числа
Квантовые числа
Квантовые числа — это термин, используемый для описания присвоения чисел электронам как математической функции для описания их импульса и энергии.
Модель Бора
Модель Бора относится к трактовке электронов как частиц, вращающихся вокруг ядра.
Квантовая механика
Термин квантовая механика относится к уровням энергии и теоретической области физики и химии, где математика используется для объяснения поведения субатомных частиц.
Впадина
Впадина — это самая нижняя точка поперечной волны.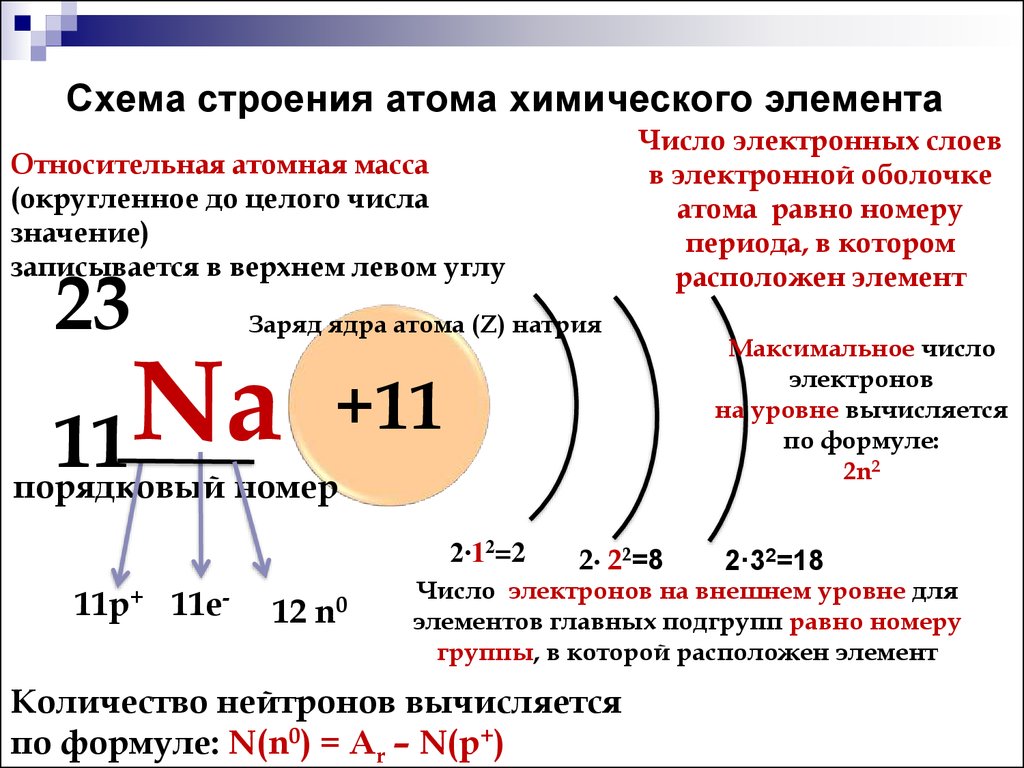
Пик
Пик — это самая высокая точка поперечной волны.
Колебательные моды
Колебательные моды — это термин, используемый для описания постоянного движения в молекуле. Обычно это вибрации, вращения и перемещения.
Erwin Schrodinger
Эрвин Шредингер был австрийским физиком, который использовал математические модели для усовершенствования модели Бора об электроне и создал уравнение для предсказания вероятности нахождения электрона в заданном положении.
Щелочной металл
Щелочные металлы, находящиеся в группе 1 периодической таблицы (формально известной как группа IA), настолько реакционноспособны, что обычно встречаются в природе в сочетании с другими элементами. Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.
Щелочноземельные металлы
Щелочноземельные металлы являются второй по реакционной способности группой элементов в периодической таблице. Они находятся в группе 2 периодической таблицы (формально известной как группа IIA).
Неизвестные элементы
Неизвестные элементы (или трансактиниды) являются самыми тяжелыми элементами периодической таблицы. Это мейтнерий (Mt, атомный номер 109), дармштадтий (Ds, атомный номер 110), рентгений (Rg, атомный номер 111), нихоний (Nh, атомный номер 113), московий (Mc, атомный номер 115), ливерморий (Lv , атомный номер 116) и теннессин (Ts, атомный номер 117).
Постпереходный металл
Постпереходные металлы находятся между переходными металлами (слева) и металлоидами (справа). К ним относятся алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi).
Oganesson
Oganesson (Og) — радиоактивный элемент с атомным номером 118 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 18. Он имеет символ Og.
Теннессин
Теннессин (Ts) — радиоактивный элемент с атомным номером 117 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Он находится в группе 17. Он имеет символ Ts.
Он находится в группе 17. Он имеет символ Ts.
Ливерморий
Ливерморий (Lv) — радиоактивный элемент с атомным номером 116 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Он находится в группе 16. Он имеет символ Lv.
Московий
Московий (Mc) — радиоактивный металл с атомным номером 115 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 15. Он имеет символ Mc.
Флеровий
Флеровий (Fl) — радиоактивный металл с атомным номером 114 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 14. Он имеет символ Fl.
Нихоний
Нихоний (Nh) — радиоактивный металл с атомным номером 112 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 13. Он имеет символ Nh.
Copernicium
Copernicium (Cr) — радиоактивный металл с атомным номером 112 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Это переходный металл группы 11. Он имеет символ Rg.
Рентгений
Рентгений (Rg) — радиоактивный металл с атомным номером 111 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 11. Он имеет символ Rg.
Darmstadtium
Darmstadtium (Ds) — радиоактивный металл с атомным номером 110 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 10. Он имеет символ Ds
Мейтнерий
Мейтнерий (Mt) — радиоактивный металл с атомным номером 109 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств. этого. Это переходный металл группы 9.. Он имеет символ Mt
Хассий
Хассий (Hs) — радиоактивный металл с атомным номером 108 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 8. Он имеет символ Hs.
Это переходный металл группы 8. Он имеет символ Hs.
Борий
Борий (Bh) — радиоактивный металл с атомным номером 107 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 7. Он имеет символ Bh.
Сиборгий
Сиборгий (Sg) — радиоактивный металл с атомным номером 106 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 6. Он имеет символ Sg.
Дубний
Дубний (Db) — радиоактивный металл с атомным номером 105 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 5. Он имеет символ Db.
Резерфордий
Резерфордий (Rf) — радиоактивный металл с атомным номером 104 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 4. Он имеет символ Rf.
Он имеет символ Rf.
Lawrencium
Lawrencium (Lr) — серебристо-белый радиоактивный металл с атомным номером 103 в периодической таблице. Это актиноидный металл с символом Lr.
Нобелий
Нобелий (No) — радиоактивный металл с атомным номером 102 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это актиноидный металл с символом № 9.0003
Менделевий
Менделевий (Md) — радиоактивный металл с атомным номером 101 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это актиноидный металл с символом Md.
Фермий
Фермий (Fm) — серебристо-белый радиоактивный металл с атомным номером 100 в периодической таблице. Это актиноидный металл с символом Fm.
Эйнштейний
Эйнштейний (Es) — серебристо-белый радиоактивный металл с атомным номером 99 в периодической таблице. Это актиноидный металл с символом Es.
Калифорний
Калифорний (Cf) — серебристо-белый радиоактивный металл с атомным номером 98 в периодической таблице. Это актиноидный металл с символом Cf.
Это актиноидный металл с символом Cf.
Берклий
Берклий (Bk) — серебристый радиоактивный металл, имеющий атомный номер 97 в периодической таблице. Это актиноидный металл с символом Bk.
Кюрий
Кюрий (Cm) — серебристо-белый радиоактивный металл с атомным номером 96 в периодической таблице. Это актиноидный металл с символом Cm.
Америций
Америций (Am) представляет собой радиоактивный металл серебристого цвета, имеющий атомный номер 95 в периодической таблице. Это актиноидный металл с символом Am.
Плутоний
Плутоний (Pu) представляет собой серебристый радиоактивный металл, имеющий атомный номер 94 в периодической таблице. Это актиноидный металл с символом Pu.
Нептуний
Нептуний (Np) — серебристый радиоактивный металл с атомным номером 93 в периодической таблице. Это актиноидный металл с символом Np.
Протактиний
Протактиний (Па) представляет собой блестящий серебристый радиоактивный металл с атомным номером 91 в периодической таблице. Это актиноидный металл с символом Pa.
Это актиноидный металл с символом Pa.
Торий
Торий (Th) — серебристо-белый радиоактивный металл с атомным номером 90 в периодической таблице. Это актиноидный металл с символом Th.
Актиний
Актиний (Ac) представляет собой серебристый радиоактивный металл с атомным номером 89.в периодической таблице. Это актиноидный металл с символом Ac.
Радий
Радий (Ra) — металл серебристо-белого цвета, имеющий атомный номер 88 в периодической таблице. Это щелочноземельный металл с символом Ra, расположенный во 2-й группе периодической таблицы.
Франций
Франций (Fr) считается металлом серого цвета, имеющим атомный номер 87 в периодической таблице. Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
Радон
Радон (Rn) представляет собой бесцветный радиоактивный газ без запаха, неметалл, который имеет атомный номер 86 в периодической таблице в группе 18. Он имеет символ Rn.
Астатин
Астатин (At) — радиоактивный неметалл с атомным номером 85 в периодической таблице в 17-й группе. Он имеет символ At.
Он имеет символ At.
Полоний
Полоний (Po) — серебристо-серый металл с атомным номером 84 в периодической таблице в 16-й группе. Он имеет символ Po.
Висмут
Висмут (Bi) — твердый стальной серый металл, имеющий атомный номер 83 в периодической таблице в 15-й группе. Он имеет символ Bi.
Свинец
Свинец (Pb) — мягкий серый металл, имеющий атомный номер 82 в периодической таблице в 14-й группе. Он имеет символ Pb.
Таллий
Таллий (Tl) — мягкий серый металл, имеющий атомный номер 81 в периодической таблице в 13-й группе. Он имеет символ Tl.
Ртуть
Ртуть (Hg) представляет собой жидкий металл серебристого цвета, имеющий атомный номер 80 в периодической таблице. Это переходный металл группы 12. Он имеет символ Hg.
Золото
Золото (Au) — мягкий металл золотистого цвета, имеющий атомный номер 79 в периодической таблице. Это переходный металл группы 11. Он имеет символ Au.
Платина
Платина (Pt) — тяжелый белый металл с атомным номером 78 в периодической таблице. Это переходный металл группы 10. Он имеет символ Pt.
Это переходный металл группы 10. Он имеет символ Pt.
Иридий
Иридий (Ir) — тяжелый белый металл с атомным номером 77 в периодической таблице. Это переходный металл группы 9.. Он имеет символ Ir.
Осмий
Осмий (Os) представляет собой твердый мелкий черный порошок или сине-белый металл с атомным номером 76 в периодической таблице. Это переходный металл группы 8. Он имеет символ Os.
Рений
Рений (Re) — металл серебристо-белого цвета, имеющий атомный номер 75 в периодической таблице. Это переходный металл группы 7. Он имеет символ Re.
Вольфрам
Вольфрам (W) — металл серо-стального цвета, имеющий атомный номер 74 в периодической таблице. Это переходный металл группы 6. Он имеет символ W.
Тантал
Тантал (Ta) представляет собой металл серого цвета, имеющий атомный номер 73 в периодической таблице. Это переходный металл группы 5. Он имеет символ Та.
Гафний
Гафний (Hf) — металл серебристого цвета с атомным номером 72 в периодической таблице. Это переходный металл группы 4. Он имеет символ Hf.
Это переходный металл группы 4. Он имеет символ Hf.
Лютеций
Лютеций (Lu) — металл серебристо-белого цвета, имеющий атомный номер 71 в периодической таблице. Это лантаноидный металл. Он имеет символ Лу.
Иттербий
Иттербий (Yb) представляет собой металл серебристого цвета с атомным номером 70 в периодической таблице. Это лантаноидный металл. Он имеет символ Yb.
Тулий
Тулий (Tm) представляет собой металл серебристого цвета с атомным номером 69 в периодической таблице. Это лантаноидный металл. Он имеет обозначение Tm.
Эрбий
Эрбий (Er) — металл серебристого цвета, имеющий атомный номер 68 в периодической таблице. Это лантаноидный металл. Он имеет символ Er.
Гольмий
Гольмий (Но) — металл серебристого цвета, имеющий атомный номер 67 в периодической таблице. Это лантаноидный металл. Он имеет символ Хо.
Диспрозий
Диспрозий (Dy) представляет собой серебристый металл с атомным номером 66 в периодической таблице. Это лантаноидный металл. Он имеет символ Dy.
Это лантаноидный металл. Он имеет символ Dy.
Тербий
Тербий (Tb) представляет собой металл серебристо-серого цвета, имеющий атомный номер 65 в периодической таблице. Это лантаноидный металл. Он имеет символ Tb.
Гадолиний
Гадолиний (Gd) — металл серебристо-белого цвета, имеющий атомный номер 64 в периодической таблице. Это лантаноидный металл. Он имеет символ Gd.
Европий
Европий (Eu) — металл серебристо-белого цвета, имеющий атомный номер 63 в периодической таблице. Это лантаноидный металл. Он имеет символ Eu.
Самарий
Самарий (Sm) представляет собой металл серебристого цвета с атомным номером 62 в периодической таблице. Это лантаноидный металл. Он имеет символ Sm.
Прометий
Прометий (Pm) — редкий металл с атомным номером 61 в периодической таблице. Это лантаноидный металл. Он имеет символ Pm.
Неодим
Неодим (Nd) — металл серебристо-белого цвета, имеющий атомный номер 60 в периодической таблице. Это лантаноидный металл. Он имеет символ Nd.
Это лантаноидный металл. Он имеет символ Nd.
Празеодим
Празеодим (Pr) представляет собой серебристо-белый металл с атомным номером 59 в периодической таблице. Это лантаноидный металл. Он имеет обозначение Pr.
Церий
Церий (Ce) представляет собой металл серо-железного цвета, имеющий атомный номер 58 в периодической таблице. Это лантаноидный металл. Он имеет символ Ce.
Лантан
Лантан (La) — мягкий серебристо-белый металл с атомным номером 57 в периодической таблице. Это лантаноидный металл. Он имеет символ La.
Барий
Барий (Ba) — мягкий серебристо-белый металл с атомным номером 56 в периодической таблице. Это щелочноземельный металл, расположенный во 2-й группе периодической таблицы. он имеет символ Ba.
Цезий
Цезий (Cs) — мягкий металл серого цвета, имеющий атомный номер 55 в периодической таблице. Это щелочной металл и находится в группе 1 периодической таблицы. он имеет символ Cs.
Ксенон
Ксенон (Хе) существует в виде бесцветного газа без запаха и химически инертен. Он имеет атомный номер 54 в периодической таблице и принадлежит к группе 18, Благородные газы. Это неметалл с символом Xe.
Он имеет атомный номер 54 в периодической таблице и принадлежит к группе 18, Благородные газы. Это неметалл с символом Xe.
Йод
Йод (I) представляет собой пурпурно-серый твердый неметалл. Он имеет атомный номер 53 в периодической таблице. Он расположен в группе 17, галогены. Он имеет символ I.
Теллур
Теллур (Te) — серебристо-белый полуметалл с атомным номером 52 в периодической таблице. Он расположен в 16 группе периодической таблицы. Он имеет символ Те.
Сурьма
Сурьма (Sb) представляет собой твердый хрупкий серебристо-белый полуметалл с атомным номером 51 в периодической таблице. Он расположен в 15 группе периодической таблицы. Он имеет символ Sb.
Олово
Олово (Sn) — серебристо-белый металл с атомным номером 50 в периодической таблице. Он расположен в 14 группе периодической таблицы. Он имеет обозначение Sn.
Индий
Индий (In) — серебристо-белый металл с атомным номером 49 в периодической таблице. Он расположен в 13 группе периодической таблицы. Он имеет символ В.
Он имеет символ В.
Кадмий
Кадмий (Cd) — бело-голубой металл с атомным номером 48 в периодической таблице. Это переходный металл, расположенный в 12-й группе периодической таблицы. Он имеет обозначение Cd.
Серебро
Серебро (Ag) — металл серебра, имеющий атомный номер 47 в периодической таблице. Это переходный металл, расположенный в 11-й группе периодической таблицы. Он имеет символ Ag.
Палладий
Палладий (Pd) — серебристо-белый металл с атомным номером 46 в периодической таблице. Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет обозначение Pd.
Родий
Родий (Rh) — хрупкий серебристо-белый металл с атомным номером 45 в периодической таблице. Это переходный металл, расположенный в 9-й группе периодической таблицы. Он имеет обозначение Rh.
Рутений
Рутений (Ru) представляет собой хрупкий металл серебристо-серого цвета, имеющий атомный номер 44 в периодической таблице. Это переходный металл, расположенный в 8-й группе периодической таблицы. Имеет обозначение Ru.
Имеет обозначение Ru.
Технеций
Технеций (Tc) представляет собой серебристо-серый металл с атомным номером 43 в периодической таблице. Это переходный металл, расположенный в 7-й группе периодической таблицы. Он имеет символ Tc.
Молибден
Молибден (Mo) представляет собой серебристо-белый металл с атомным номером 42 в периодической таблице. Это переходный металл, расположенный в 6-й группе периодической таблицы. Он имеет обозначение Mb.
Ниобий
Ниобий (Nb) — блестящий белый металл с атомным номером 41 в периодической таблице. Это переходный металл, расположенный в группе 5 периодической таблицы. Он имеет символ Nb.
Цирконий
Цирконий (Zr) представляет собой серо-белый металл с атомным номером 40 в периодической таблице. Это переходный металл, расположенный в 4-й группе периодической таблицы. Он имеет символ Zr.
Иттрий
Иттрий (Y) — серебристый металл с атомным номером 39 в периодической таблице. Это переходный металл, расположенный в группе 3 периодической таблицы. Он имеет символ Y.
Он имеет символ Y.
Как определить заряд атома
Обновлено 01 марта 2020 г.
Ли Джонсон
Отзыв: Лана Бандоим, B.S.
Определить заряд атома легко в большинстве случаев, но не во всех. Атомы удерживаются вместе благодаря электромагнитным силам между протонами в ядре и окружающими его электронами, а это означает, что большую часть времени на самом деле не так много работы.
Но когда элементы теряют или приобретают электрон (или более одного) и становятся ионами , все становится немного сложнее, и вам нужно свериться с периодической таблицей, чтобы узнать, какой заряд может быть.
Заряд элементов
В своих стандартных формах элементы не имеют чистого заряда . Количество положительно заряженных протонов идеально уравновешено количеством отрицательно заряженных электронов, и заряды на каждом из них противоположны, но одинаковой величины.
Это имеет смысл как «естественное» состояние атома, потому что, если бы они содержали общий заряд, они были бы гораздо более реактивными и, вероятно, не оставались бы в одном и том же состоянии очень долго, прежде чем взаимодействовать с чем-либо. Так что в большинстве случаев заряд атома одинаков: ноль.
Так что в большинстве случаев заряд атома одинаков: ноль.
Понимание ионов
Ионы — это названия атомов, которые приобрели или потеряли один или несколько электронов, в результате чего у них остался общий заряд. Атомы, потерявшие электрон, приобретают положительный заряд и становятся катионами.
Атомы, приобретающие электрон, приобретают суммарный отрицательный заряд и становятся анионами. Это просто названия для положительно и отрицательно заряженных ионов, которые помогают отличить их от нейтральных атомов и друг от друга.
Важно понять об ионах то, что это единственные типы атомов с чистый расход . Для удобства химики (да и вообще ученые в большинстве случаев) принимают заряд электрона равным -1, а заряд протона равен +1.
На самом деле это очень специфические количества заряда, ± 1,602 × 10 -19 кулонов, но работать с такими крошечными величинами редко бывает необходимо. Для большинства вычислений вы рассматриваете это как «единицу» заряда (иногда обозначаемую символом и ), и все намного проще.
Заряды по Периодической таблице для ионов
Положение элемента в таблице Менделеева (см. Ресурсы) говорит вам о типе ионов, которые он образует: элементы справа образуют анионы (отрицательный заряд), а элементы слева образуют катионы (положительный заряд).
Это связано с тем, что периодическая таблица устроена в соответствии с количеством электронов в самой внешней «оболочке» атома, а ионы образуются из атомов, которые либо теряют, либо приобретают электроны, так что их внешние оболочки заполнены. Каждая «группа» периодической таблицы связана с различным зарядом иона.
Первые две группы имеют элементы только с одним или двумя электронами на внешних оболочках, группы 1 и 2 соответственно. Они теряют электроны, чтобы получить заряд +1 или +2, а элементы группы 13 имеют три электрона во внешней оболочке и образуют ионы с зарядом +3.
Элементы группы 14 имеют четыре электрона на своих внешних оболочках и обычно связаны ковалентно, но они получат заряд +4, если образуют ион.

