Группа периодической системы — Википедия
Материал из Википедии — свободной энциклопедии
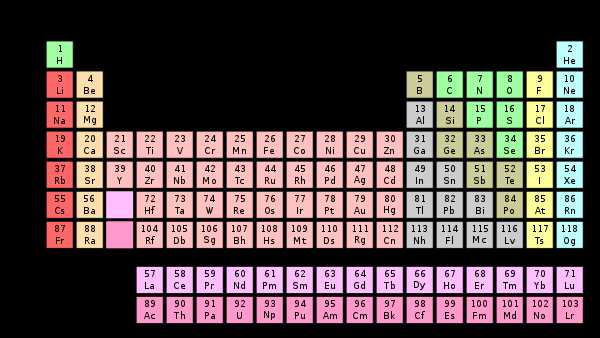
Гру́ппа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.
Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп). Элементы одной подгруппы обладают сходными химическими свойствами.
С возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение
С 1989 года Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного варианта периодической системы утверждена длиннопериодная форма[1]. В связи с этим IUPAC рекомендует сплошную нумерацию групп: арабскими цифрами от 1 до 18.
Несмотря на это, продолжают применяться ставшие традиционными системы нумерации с использованием
ru.wikipedia.org
почему большие периоды таблицы менделеева разделены на ряды, а группы на подгруппы?
В таблице каждый химический элемент имеет атомный номер, который определяется числом протонов в ядре атома, т. е. атомный номер численно равен заряду ядра. Таким образом, основной признак, который определяет химический элемент, — это заряд его ядра. Массу атома в основном определяют протоны и нейтроны, составляющие ядро. Периодом называется ряд элементов, расположенных в порядке возрастания атомных масс, начинающийся со щелочного металла (за исключением первого периода; он начинается с водорода) и заканчивающийся инертным газом. В первый период входят только два элемента, во второй и третий — по восемь (эти периоды называются малыми) . Четвертый период образован восемнадцатью элементами, а пятый и шестой — еще большим числом элементов. Чтобы определить, какая подгруппа — главная, а какая — побочная, важно помнить, что в состав главных подгрупп входят элементы как малых, так и больших периодов. Побочные подгруппы образованы только элементами больших периодов. Например, в состав главной подгруппы II группы входят элементы второго и третьего периодов — бериллий Be и магний Mg. Побочная подгруппа начинается с элемента четвертого (большого) периода — цинка Zn. И еще одно отличие: главная подгруппа, как правило, состоит из большего числа элементов, чем побочная (в VIII группе наоборот) . В малых периодах, как было отмечено выше, по мере увеличения атомного номера элемента наблюдается закономерное увеличение числа электронов, находящихся на внешнем электронном слое атомов элементов. Как следствие этого от щелочного металла к галогену уменьшаются металлические свойства элементов и увеличиваются неметаллические свойства. Эта же закономерность проявляется и в свойствах веществ, образованных этими элементами. Так, например, оксид лития проявляет основные свойства, оксид бериллия — амфотерные. Высшие оксиды остальных элементов являются кислотными (кислородное соединение фтора является не оксидом, а фторидом) . В главной подгруппе по мере увеличения атомного номера элемента наблюдается усиление металлических свойств элемента и уменьшение неметаллических. Это можно объяснить следующим образом. У элементов V группы на внешнем электронном слое по пять электронов. Однако внешние электроны у атома висмута находятся дальше от ядра и поэтому слабее удерживаются около него. Поэтому атомы висмута могут отдавать электроны, иначе говоря, проявлять металлические свойства, что не характерно для азота. Такая же закономерность в свойствах элементов и их соединений наблюдается в любой группе. Так, IV группа начинается с двух неметаллов — углерода С и кремния Si, далее следует германий Ge с промежуточными свойствами, и заканчивается группа очовом Sn и свинцом РЬ — металлами. Изменяются в группах и свойства соединений: оксид углерода (IV) — кислотный оксид, а оксид свинца обладает основными свойствами. Периодический закон позволил систематизировать свойства химических элементов и их соединений.
почему большие периоды таблицы менделеева разделены на ряды, а группы на подгруппы?
В таблице каждый химический элемент имеет атомный номер, который определяется числом протонов в ядре атома, т. е. атомный номер численно равен заряду ядра. Таким образом, основной признак, который определяет химический элемент, — это заряд его ядра. Массу атома в основном определяют протоны и нейтроны, составляющие ядро.Периодом называется ряд элементов, расположенных в порядке возрастания атомных масс, начинающийся со щелочного металла (за исключением первого периода; он начинается с водорода) и заканчивающийся инертным газом. В первый период входят только два элемента, во второй и третий — по восемь (эти периоды называются малыми) . Четвертый период образован восемнадцатью элементами, а пятый и шестой — еще большим числом элементов.
Чтобы определить, какая подгруппа — главная, а какая — побочная, важно помнить, что в состав главных подгрупп входят элементы как малых, так и больших периодов.
Побочные подгруппы образованы только элементами больших периодов. Например, в состав главной подгруппы II группы входят элементы второго и третьего периодов — бериллий Be и магний Mg. Побочная подгруппа начинается с элемента четвертого (большого) периода — цинка Zn. И еще одно отличие: главная подгруппа, как правило, состоит из большего числа элементов, чем побочная (в VIII группе наоборот) .
В малых периодах, как было отмечено выше, по мере увеличения атомного номера элемента наблюдается закономерное увеличение числа электронов, находящихся на внешнем электронном слое атомов элементов. Как следствие этого от щелочного металла к галогену уменьшаются металлические свойства элементов и увеличиваются неметаллические свойства. Эта же закономерность проявляется и в свойствах веществ, образованных этими элементами. Так, например, оксид лития проявляет основные свойства, оксид бериллия — амфотерные. Высшие оксиды остальных элементов являются кислотными (кислородное соединение фтора является не оксидом, а фторидом) .
В главной подгруппе по мере увеличения атомного номера элемента наблюдается усиление металлических свойств элемента и уменьшение неметаллических.
Это можно объяснить следующим образом. У элементов V группы на внешнем электронном слое по пять электронов. Однако внешние электроны у атома висмута находятся дальше от ядра и поэтому слабее удерживаются около него. Поэтому атомы висмута могут отдавать электроны, иначе говоря, проявлять металлические свойства, что не характерно для азота.
Такая же закономерность в свойствах элементов и их соединений наблюдается в любой группе. Так, IV группа начинается с двух неметаллов — углерода С и кремния Si, далее следует германий Ge с промежуточными свойствами, и заканчивается группа очовом Sn и свинцом РЬ — металлами.
Изменяются в группах и свойства соединений: оксид углерода (IV) — кислотный оксид, а оксид свинца обладает основными свойствами.
Периодический закон позволил систематизировать свойства химических элементов и их соединений.
otvet.mail.ru
