Что такое валентность химических элементов. Определяем валентность химических элементов
Одной из важных в изучении школьных тем является курс, касающийся валентности. Об этом пойдет речь в статье.
Валентность – что это такое?
Валентность в химии означает свойство атомов химического элемента привязывать к себе атомы другого элемента. В переводе с латыни – сила. Выражается она в числах. Например, валентность водорода всегда будет равняться единице. Если взять формулу воды – Н2О, ее можно представить в виде Н – О – Н. Один атом кислорода смог связать с собой два атома водорода. Значит, количество связей, которые создает кислород, равно двум. И валентность этого элемента будет равняться двум.
В свою очередь, водород будет двухвалентным. Его атом может быть соединен только с одним атомом химического элемента. В данном случае с кислородом. Говоря точнее, атомы в зависимости от валентности элемента, образуют пары электронов. Сколько таких пар образовано – таковой и будет валентность. Числовое значение именуется индексом. У кислорода индекс 2.
Числовое значение именуется индексом. У кислорода индекс 2.
Как определить валентность химических элементов по таблице Дмитрия Менделеева
Посмотрев на таблицу элементов Менделеева, можно заметить вертикальные ряды. Их называют группами элементов. От группы зависит и валентность. Элементы первой группы имеют первую валентность. Второй – вторую. Третьей – третью. И так далее.
Есть также элементы с постоянным индексом валентности. Например, водород, группа галогенов, серебро и так далее. Их необходимо выучить обязательно.
Как определить валентность химических элементов по формулам?
Иногда сложно определить по таблице Менделеева валентность. Тогда нужно смотреть конкретную химическую формулу. Возьмем оксид FeO. Здесь и у железа, как у кислорода, индекс валентности будет равняться двум. А вот в оксиде Fe2O3 – по-другому. Железо будет трехвалентным.
Нужно помнить всегда разные способы определения валентности и не забывать их. Знать постоянные ее числовые значения. У каких элементов они есть. И, конечно, пользоваться таблицей химических элементов. А также изучать отдельные химические формулы. Лучше представлять их в схематическом виде: Н – О – Н, например. Тогда видны связи. И количество черточек (тире) будет числовым значением валентности.
У каких элементов они есть. И, конечно, пользоваться таблицей химических элементов. А также изучать отдельные химические формулы. Лучше представлять их в схематическом виде: Н – О – Н, например. Тогда видны связи. И количество черточек (тире) будет числовым значением валентности.
Существует несколько определений понятия «валентность». Чаще всего этим термином называют способность атомов одного элемента присоединять определённое число атомов других элементов. Часто у тех, кто только начинает изучать химию, возникает вопрос: Как определить валентность элемента?. Сделать это несложно, зная несколько правил.
Валентности постоянные и переменные
Рассмотрим соединения HF, h3S и Cah3. В каждом из этих примеров один атом водорода присоединяет к себе только один атом другого химического элемента, значит его валентность равна одному. Значение валентности записывают над символом химического элемента римскими цифрами.
В приведённом примере атом фтора связан только с одним одновалентным атомом H, значит валентность его тоже равна 1. Атом серы в h3S присоединяет к себе уже два атома H, поэтому она в данном соединении двухвалентна. С двумя водородными атомами связан и кальций в его гидриде Cah3, а значит, и его валентность равна двум.
Атом серы в h3S присоединяет к себе уже два атома H, поэтому она в данном соединении двухвалентна. С двумя водородными атомами связан и кальций в его гидриде Cah3, а значит, и его валентность равна двум.
Кислород в подавляющем большинстве своих соединений двухвалентен, то есть образует две химические связи с другими атомами.
Атом серы в первом случае присоединяет к себе два кислородных атома, то есть всего образует 4 химические связи (один кислород образует две связи, значит сера — два раза по 2), то есть валентность ее равна 4.
В соединении SO3 сера присоединяет уже три атома O, поэтому и валентность ее равна 6 (три раза образует по две связи с каждым атомом кислорода). Атом кальция же присоединяет только один атом кислорода, образуя с ним две связи, значит, его валентность такая же, как и у O, то есть равна 2.
Обратите внимание на то, что атом H одновалентен в любом соединении. Всегда (кроме иона гидроксония h4O(+)) равна 2 валентность кислорода. По две химические связи как с водородом, так и с кислородом образует кальций. Это элементы с постоянной валентностью. Кроме уже указанных, постоянную валентность имеют:
Это элементы с постоянной валентностью. Кроме уже указанных, постоянную валентность имеют:
- Li, Na, K, F — одновалентны;
- Be, Mg, Ca, Zn, Cd — обладают валентностью, равной II;
- B, Al и Ga — трехвалентны.
Атом серы, в отличие от рассмотренных случаев, в соединении с водородом имеет валентность, равную II, а с кислородом может быть и четырех- и шестивалентна. Про атомы таких элементов говорят, что они имеют переменную валентность. При этом максимальное ее значение в большинстве случаев совпадает с номером группы, в которой находится элемент в Периодической системе (правило 1).
Из этого правила есть много исключений. Так, элемент 1 группы медь, проявляет валентности и I, и II. Железо, кобальт, никель, азот, фтор, напротив, имеют максимальную валентность, меньшую, чем номер группы. Так, для Fe, Co, Ni это II и III, для N — IV, а для фтора — I.
Минимальное значение валентности всегда соответствует разнице между числом 8 и номером группы (правило 2).
Однозначно определить, какова же валентность элементов, у которых она переменная, можно только по формуле определенного вещества.
Определение валентности в бинарном соединении
Рассмотрим, как определить валентность элемента в бинарном (из двух элементов) соединении. Здесь возможны два варианта: в соединении валентность атомов одного элемента известна точно или же обе частицы с переменной валентностью.
Случай первый:
Случай второй:
Определение валентности по формуле трехэлементной частицы.
Далеко не все химические вещества состоят из двухатомных молекул. Как определить валентность элемента в трёхэлементной частице? Рассмотрим этот вопрос на примере формул двух соединения K2Cr2O7.
Если же вместо калия в формуле будет присутствовать железо, или другой элемент с переменной валентностью, нам потребуется знать, какова же валентность кислотного остатка. Например, нужно вычислить валентности атомов всех элементов в соединении с формулой FeSO4.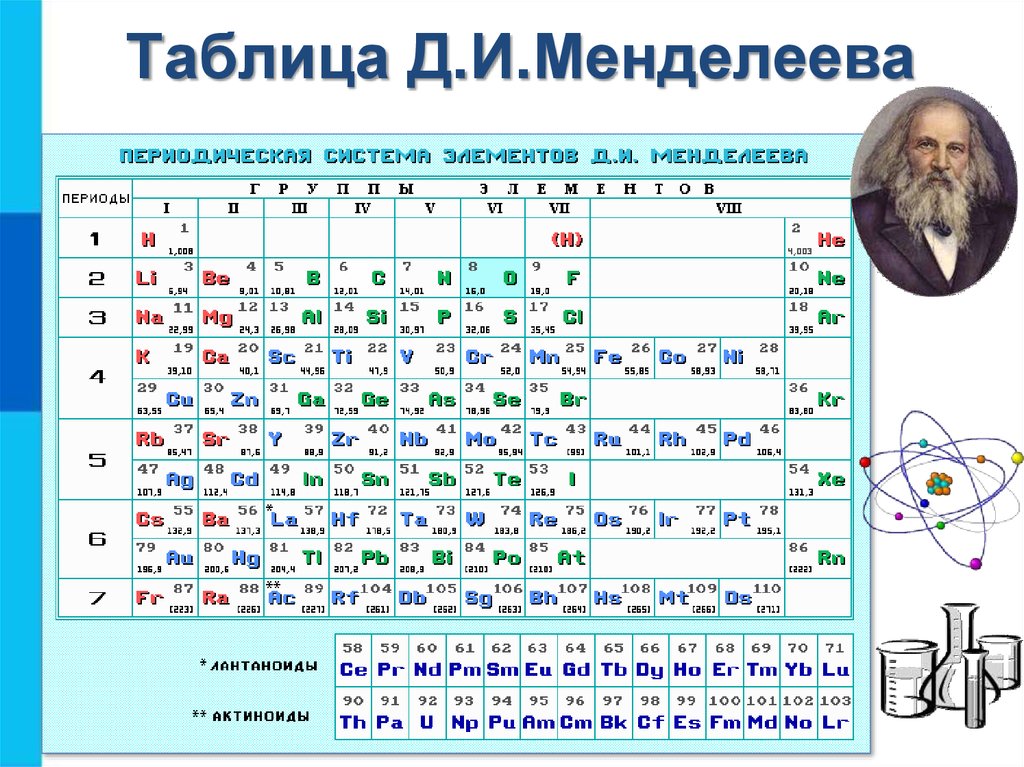
Следует отметить, что термин «валентность» чаще использую в органической химии. При составлении формул неорганических соединений чаще используют понятие «степень окисления».
В этой статье рассмотрим способы и поймем, как определить валентность элементов таблицы Менделеева.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева . В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор – одновалентен; h3O, где кислород – двухвалентен; Nh4, где азот – трёхвалентен.
Как определить валентность по таблице Менделеева.

Таблица Менделеева содержит в себе химические элементы, которые размещены в ней по определенным принципам и законам. Каждый элемент стоит на месте, который определяется его характеристиками и свойствами и каждый элемент имеет свой номер. Горизонтальные линии называются периодами, которые возрастают от первой строки вниз. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Кроме того, в таблице есть группы, которых всего восемь. Элементы размещаются в столбцах по вертикали. Здесь их размещение неравномерно – с одной стороны больше элементов (главная группа), с другой – меньше (побочная группа).
Валентностью называют способность атома образовывать некоторое количество химических связей с атомами других элементов. по таблице Менделеева поможет понять знание видов валентности.
Для элементов побочных подгрупп (а к ним относятся только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений. Или постоянно держать под рукой таблицу валентности элементов .
Также придется заучить валентности химических элементов, которые имеют более двух значений. Или постоянно держать под рукой таблицу валентности элементов .
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример:
1. Запишем формулу:
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы :
5. Сделаем проверку:
Таблица характерных значений валентностей некоторых атомов химических соединений.
Элементы | Валентность | Примеры соединений |
H 2 , HF, Li 2 O, NaCl, KBr | ||
O, Mg, Ca, Sr, Ba, Zn | H 2 O, MgCl 2 , CaH 2 , SrBr 2 , BaO, ZnCl 2 | |
CO 2 , Ch5, SiO 2 , SiCl 4 | ||
CrCl 2 , CrCl 3 , CrO 3 | ||
H 2 S, SO 2 , SO3 | ||
NH 3 , NH 4 Cl, HNO 3 | ||
PH 3 , P 2 O 5 , H 3 PO 4 | ||
SnCl 2 , SnCl 4 , PbO, PbO 2 | ||
HCl, ClF 3 , BrF 5 , IF 7 |
Инструкция
Таблица представляет собой структуру, в которой расположены химические элементы по своим принципам и законам.
Также таблица разделена на «подъезды» – группы, которых всего восемь. Как в любом подъезде квартиры находятся слева и справа, так и здесь химические элементы располагаются по такому же . Только в данном варианте их размещение неравномерно – с одной стороны больше элементов и тогда говорят о главной группе, с другой – меньше и это свидетельствует о том, что группа побочная.
Валентность – это способность элементов образовывать химические связи. Существует постоянная, которая не меняется и переменная, имеющая различное значение в зависимости от того, в состав какого вещества входит элемент.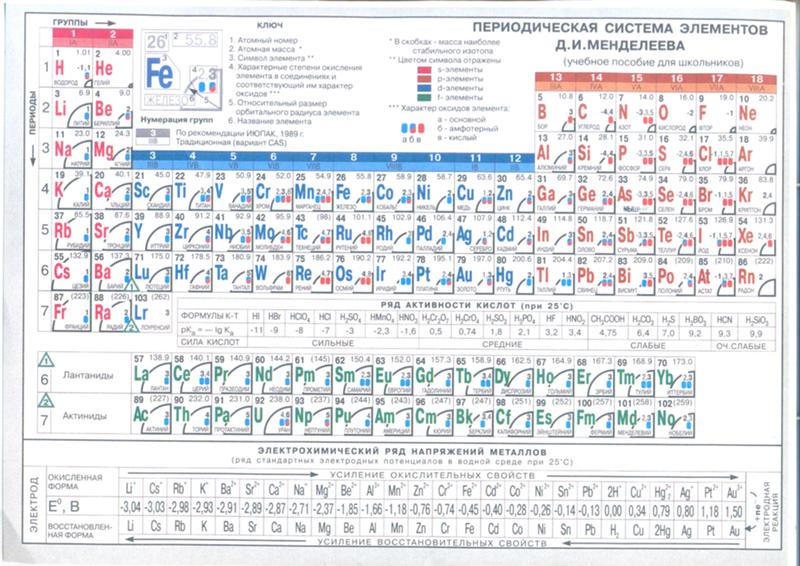 При определении валентности по таблице Менделеева необходимо обратить внимание на такие характеристики: № группы элементы и ее тип (то есть главная или побочная группа). Постоянная валентность в этом случае определяется по номеру группы главной подгруппы. Чтобы узнать значение переменной валентности (если таковая есть, причем, обычно у ), то нужно из 8 (всего 8 – отсюда такая цифра) вычесть № группы, в которой располагается элемент.
При определении валентности по таблице Менделеева необходимо обратить внимание на такие характеристики: № группы элементы и ее тип (то есть главная или побочная группа). Постоянная валентность в этом случае определяется по номеру группы главной подгруппы. Чтобы узнать значение переменной валентности (если таковая есть, причем, обычно у ), то нужно из 8 (всего 8 – отсюда такая цифра) вычесть № группы, в которой располагается элемент.
Пример № 1. Если посмотреть на элементы первой группы главной подгруппы (щелочные ), то можно сделать вывод, что все они имеют валентность, равную I (Li, Na, К, Rb, Cs, Fr).
Пример № 2. Элементы второй группы главной подгруппы (щелочно-земельные металлы) соответственно имеют валентность II (Be, Mg, Ca, Sr, Ba, Ra).
Пример № 3. Если говорить о неметаллах, то например, Р (фосфор) находится в V группе главной подгруппы. Отсюда его валентность будет равна V. Кроме этого фосфор имеет еще одно значение валентности, и для ее определения необходимо выполнить действие 8 – № элемента.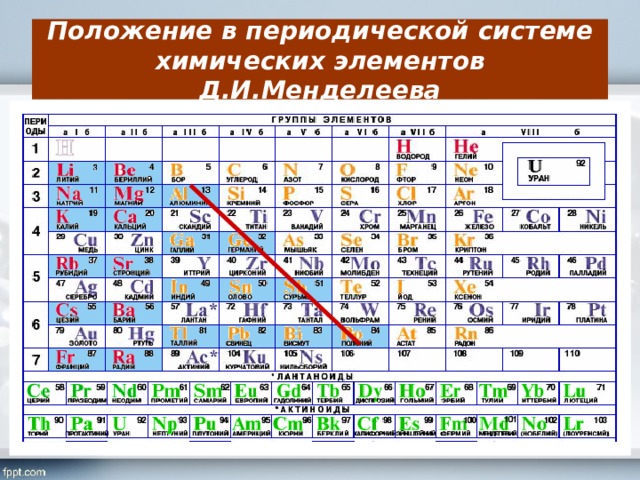
Пример № 4. Галогены находятся в VII группе главной подгруппы. Значит, их валентность будет равна VII. Однако учитывая, что это неметаллы, то нужно произвести арифметическое действие: 8 – 7 (№ группы элемента) = 1. Следовательно, другая валентность равна I.
Для элементов побочных подгрупп (а к ним только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений.
Видео по теме
Обратите внимание
Будьте внимательны при определении металлов и неметаллов. Для этого обычно в таблице даны обозначения.
Источники:
- как правильно произносить элементы таблицы менделеева
- какая валентность у фосфора? X
Со школы или даже раньше каждый знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами называют валентностью элемента .
Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами называют валентностью элемента .
Инструкция
Каждому элементу в таблице присвоен определенный порядковый номер (H – 1, Li – 2, Be – 3 и т.д.). Этот номер соответствует ядра (количеству протонов в ядре) и числу электронов, вращающихся вокруг ядра. Число протонов, таким образом, равно числу электронов, и это говорит о том, что в обычных условиях атом электрически .
Деление на семь периодов происходит по числу энергетических уровней атома. Атомы первого периода имеют одноуровневую электронную оболочку, второго – двухуровневую, третьего – трехуровневую и т.д. При заполнении нового энергетического уровня начинается новый период.
Первые элементы всякого периода характеризуются атомами, имеющими по одному электрону на внешнем уровне, – это атомы щелочных металлов. Заканчиваются периоды атомами благородных газов, имеющими полностью заполненный электронами внешний энергетический уровень: в первом периоде инертные газы имеют 2 электрона, в последующих – 8. Именно по причине похожего строения электронных оболочек группы элементов имеют сходные физико- .
Именно по причине похожего строения электронных оболочек группы элементов имеют сходные физико- .
В таблице Д.И. Менделеева присутствует 8 главных подгрупп. Такое их количество обусловлено максимально возможным числом электронов на энергетическом уровне.
Внизу периодической системы выделены лантаноиды и актиноиды в качестве самостоятельных рядов.
С помощью таблицы Д.И. Менделеева можно пронаблюдать периодичность следующих свойств элементов: радиуса атома, объема атома; потенциала ионизации; силы сродства с электроном; электроотрицательности атома; ; физических свойств потенциальных соединений.
Четко прослеживаемая периодичность расположения элементов в таблице Д.И. Менделеева рационально объясняется последовательным характером заполнения электронами энергетических уровней.
Источники:
- Таблица Менделеева
Рассматривая формулы различных соединений, нетрудно заметить, что число атомов одного и того же элемента в молекулах различных веществ не одинаково.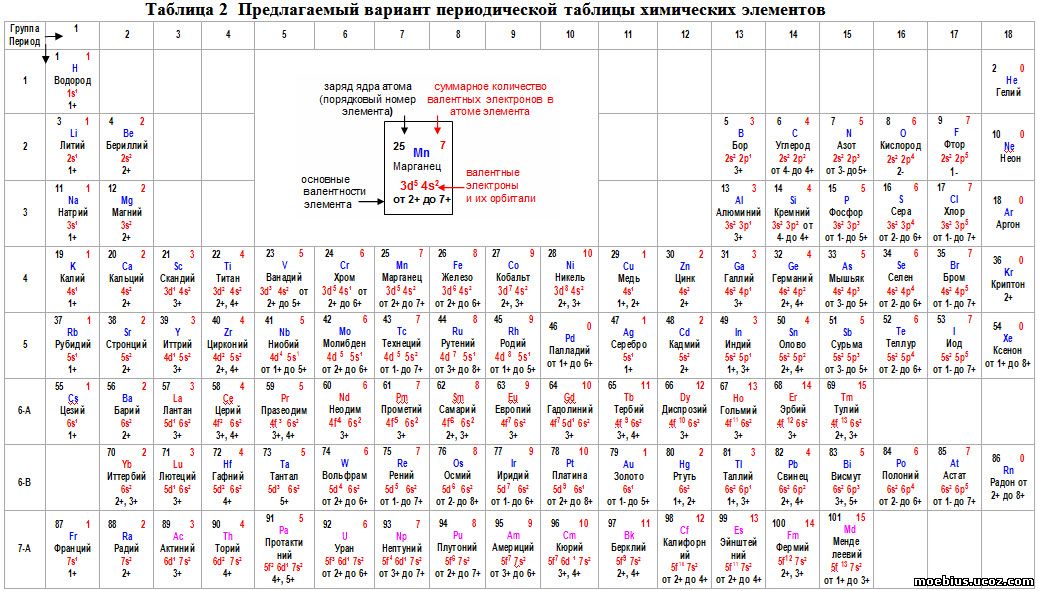 Например, HCl, NH 4 Cl, H 2 S, H 3 PO 4 и т.д. Число атомов водорода в этих соединениях изменяется от 1 до 4. Это характерно не только для водорода.
Например, HCl, NH 4 Cl, H 2 S, H 3 PO 4 и т.д. Число атомов водорода в этих соединениях изменяется от 1 до 4. Это характерно не только для водорода.
Как же угадать, какой индекс поставить рядом с обозначением химического элемента? Как составляются формулы вещества? Это легко сделать, когда знаешь валентность элементов, входящих в состав молекулы данного вещества.
– это свойство атома данного элемента присоединять, удерживать или замещать в химических реакциях определённое количество атомов другого элемента. За единицу валентности принята валентность атома водорода. Поэтому иногда определение валентности формулируют так:валентность – это свойство атома данного элемента присоединять или замещать определённое количество атомов водорода.
Если к одному атому данного элемента прикрепляется один атом водорода, то элемент одновалентен, если два – двухвалентен и т.д. Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О. Кислород считается постоянно двухвалентным.
Кислород считается постоянно двухвалентным.
Постоянная валентность:
I – H, Na, Li, K, Rb, Cs
II – O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
III – B, Al, Ga, In
Но как поступить в том случае, если элемент не соединяется с водородом? Тогда валентность необходимого элемента определяют по валентности известного элемента. Чаще всего её находят, используя валентность кислорода, потому что в соединениях его валентность всегда равно 2.Например, не составит труда найти валентность элементов в следующих соединениях: Na 2 O (валентность Na – 1, O – 2), Al 2 O 3 (валентность Al – 3, O – 2).
Химическую формулу данного вещества можно составить, только зная валентность элементов. Например, составить формулы таких соединений, как CaO, BaO, CO, просто, потому что число атомов в молекулах одинаково, так как валентности элементов равны.
А если валентности разные? Когда мы действуем в таком случае? Необходимо запомнить следующее правило: в формуле любого химического соединения произведение валентности одного элемента на число его атомов в молекуле равно произведению валентности на число атомов другого элемента. Например, если известно, что валентность Mn в соединении равна 7, а O – 2, тогда формула соединения будет выглядеть так Mn 2 O 7.
Например, если известно, что валентность Mn в соединении равна 7, а O – 2, тогда формула соединения будет выглядеть так Mn 2 O 7.
Как же мы получили формулу?
Рассмотрим алгоритм составления формул по валентности для состоящих из двух химических элементов.
Существует правило, что число валентностей у одного химического элемента равно числу валентностей у другого . Рассмотрим на примере образования молекулы, состоящей из марганца и кислорода.
Будем составлять в соответствии с алгоритмом:
1. Записываем рядом символы химических элементов:
Mn O
2. Ставим над химическими элементами цифрами их валентности (валентность химического элемента можно найти в таблице периодической системы Менделева, у марганца – 7, у кислорода – 2.
3. Находим наименьшее общее кратное (наименьшее число, которое делится без остатка на 7 и на 2). Это число 14. Делим его на валентности элементов 14: 7 = 2, 14: 2 = 7, 2 и 7 будут индексами, соответственно у фосфора и кислорода. Подставляем индексы.
Подставляем индексы.
Зная валентность одного химического элемента, следуя правилу: валентность одного элемента × число его атомов в молекуле = валентность другого элемента × число атомов этого (другого) элемента, можно определить валентность другого.
Mn 2 O 7 (7 · 2 = 2 · 7).
2х = 14,
х = 7.
Понятие о валентности было введено в химию до того, как стало известно строение атома. Сейчас установлено, что это свойство элемента связано с числом внешних электронов. Для многих элементов максимальная валентность вытекает из положения этих элементов в периодической системе.
5 слов английского языка, которые невозможно произнести правильно с первого раза / Хабр
О произношении английских слов есть много шуток. Потому что большинство лексем произносится как попало и одна и та же буква может даже в одном слове обозначать несколько разных звуков.
Многие из таких слов невозможно произнести правильно, если заранее не знаешь, как это делать.
Отличный пример уровня Intermediate — слово «queue» (очередь).
Потому что произносится оно как [kjuː]. Наши преподаватели часто шутят, что можно отбросить четыре из пяти букв слова и все равно прочитать его правильно.
Но в английском есть и такие слова, которые вообще нереально произнести правильно, если заранее не подсмотреть в транскрипцию. О них сегодня и поговорим.
Сложные слова и конкурс Spelling bee
В США и Британии среди школьников и студентов очень популярен конкурс Spelling bee.
Участнику говорят слово, а ему необходимо правильно произнести его по буквам. Несмотря на мнимую простоту, это довольно сложно, ведь очень многие английские фонемы сложились под влиянием исторических факторов и их написание не соответствует общим правилам произношения.
Конкурс стал настолько популярен, что сегодня его проводят в более чем 20 странах мира. Даже в тех, где английский не является официальным государственным языком.
В этой статье мы собрали некоторые из слов, которые принимали участие в Spelling Bee и вызвали больше всего трудностей у участников.
Полковник
[ˈkɜː(r).nəl]
При произношении слова четко слышится звук [r] вместо буквы l. Но почему вообще буква L передает звук [r]? Как всегда, виновата история.
В XV-XVI веке английский язык активно заимствовал военные слова из французского. К примеру, именно тогда в военном деле распространились слова cavalerie, infanterie, citadelle, canon и, собственно, coronel. Да-да, именно coronel, с буквой r.
Французы в свою очередь, сами утащили слово coronel у итальянцев, но сделали это несколько небрежно, ведь на итальянском слово звучало как colonello. Из-за диссимиляции первая «l» превратилась в «r».
В XVI-XVII веке английские лингвисты активно переводили итальянские труды по военному делу и под их влиянием слово coronel приблизили к итальянскому оригиналу — его стали писать как colonel.
При этом сохранилось два равнозначных варианта произношения — и французское через [r], и итальянское через [l].
Тем не менее французский вариант kor-o-nel закрепился и стал основным. За несколько веков он потерял гласную и его стали произносить как ker-nel.
Так и получилось, что язык английский, слово итальянское, а произношение — французское. Запутаться проще простого.
Лейтенант
[lefˈten.ənt]
Еще одно военное звание в списке самых сложных для произношения слов. Оно особенно сложное для русскоговорящих, потому что включаются «ложные друзья переводчика». Лейтенант — что может быть проще?
Потому что оно произносится как lef-ten-nent. Откуда там вообще взялся звук [f], сейчас объясним.
В английском языке есть слово «lieu» — [luː], которое переводится как «земельный надел». Еще одно слово с французскими корнями «tenant» — [‘tenənt] переводится как владелец или арендатор. То есть «lieutenant» — буквально переводится как «землевладелец».
Нас интересует именно слово «lieu». В старофранцузском у него была также другая форма — «leuf». И исследователи лингвистики считают, что именно она повлияла на произношение слова. В Средние века существовала форма «leuftenant», которая использовалась наравне с «lieutenant». И так исторически сложилось, что в письменной форме «lieutenant» вытеснило другие варианты, но звук [f] в произношении остался.
И исследователи лингвистики считают, что именно она повлияла на произношение слова. В Средние века существовала форма «leuftenant», которая использовалась наравне с «lieutenant». И так исторически сложилось, что в письменной форме «lieutenant» вытеснило другие варианты, но звук [f] в произношении остался.
Интересно, что таким грешит только британский вариант. В американском произношении все более стандартно: [lu:ˈten.ənt].
Анемона
[əˈnem.ə.ni]
Анемона — это травянистое растение, которое еще зовут ветреница. И главная лингвистическая шутка здесь в том, что буква «e» в конце слова озвучивается.
Мы настолько привыкли к тому, что в окончании английских слов буква «e» в абсолютном большинстве ситуаций тихая, что по-другому воспринимать лексику крайне сложно. Anemone кажется обычным словом, для которого можно применить обычные правила. Но нет.
У слова древнегреческое происхождение. И состоит оно из лексемы ἄνεμο, которая обозначает ветер и матронимического суффикса -ώνη. То есть, анемона — это «дочь ветров». Собственно, поэтому она и сейчас носит названия ветреница.
То есть, анемона — это «дочь ветров». Собственно, поэтому она и сейчас носит названия ветреница.
Но в древнегреческом этот суффикс произносился как [-oni]. В такой форме слово попало в латинский, а оттуда и в староанглийский. Самое интересное, что произношение не изменилось. Так что за современную путаницу можно сказать большое спасибо грекам.
Сложность этого слова даже обыгрывали в мультике «Найти Немо».
Гегемония
[hɪˈɡem.ə.ni]
Одно из самых труднозапоминаемых слов для человека, который учит английский как второй. Ложные друзья в этом способствуют.
В русском языке есть слово «гегемония». Но если по-честному, это довольно кривая калька с древнегреческого. В английский язык слово попало тоже из древнегреческого, но сохранило свое оригинальное звучание.
И тут дело даже не в сложности самого слова — оно практически обычное. А в восприятии его русскоязычными.
Переучиться и перестать называть его на английском как [ge. ɡem.ə.ni] очень сложно. Даже люди с уровнем Fluent спотыкаются на нем. А если еще учесть, что в британском и американском английском есть два разных варианта произношения слова, то многие просто избегают его совсем, чтобы не напрягать мозги лишний раз.
ɡem.ə.ni] очень сложно. Даже люди с уровнем Fluent спотыкаются на нем. А если еще учесть, что в британском и американском английском есть два разных варианта произношения слова, то многие просто избегают его совсем, чтобы не напрягать мозги лишний раз.
Хор
[kwaɪər]
Легким движением руки буквосочетания CH превращается в звук KW. Неожиданно? О, да. Ведь многие студенты так и хотят произнести его как привычное «хор» с английским акцентом. Вот только получается совсем неприлично, так что не пытайтесь этого повторить.
Причина такого странного произношения — снова старофранцузский. Так сказать, спонсор большинства странностей в английском.
В древнегреческом языке было слово χορός, которое, собственно, означает «хор» и произносится как [хорос]. В латынь оно перешло практически без изменений — chorus. А французы молодцы. На старофранцузском слово вдруг стало выглядеть как «quire» или «quaer» и стало произноситься по французским правилам.
Под влиянием норманнского языка оно перешло в английский, но его написание немного изменилось ближе к латинскому варианту. В результате получилось странно. Написание вроде как латинское, но не совсем. Произношение вроде как французское, но тоже не совсем.
Бонус. GIF
Онлайн-издание Mashable провело настоящее исследование, как люди произносят популярные термины из интернета. Так вот, 70% людей произносят слово GIF как [gif]. И только 30% — [dʒif].
Интересно, что истинным считается как раз второй вариант — именно такое произношение подразумевал Стив Уилхайт, изобретатель формата файлов .gif.
Штука в том, что словари дают основным вариантом произношения как раз [gif].
Это один из тех примеров, когда общественность влияет на произношение отдельного слова и со временем неправильный вариант произношения распространяется настолько сильно, что становится правильным. Собственно, львиная доля английского произношения слов была создана именно так.
Хотите больше слов? Их есть у меня.
Самостоятельно запоминать все эти транскрипции — то еще удовольствие. Но можно сделать это куда приятнее с помощью интерактивного учебника EnglishDom. Регистрируйтесь на бесплатный пробный урок с опытными преподавателями и оцените его возможности самостоятельно.
Онлайн-школа EnglishDom.com — вдохновляем выучить английский через технологии и человеческую заботу
Только для читателей Хабра первый урок с преподавателем в интерактивном цифровом учебнике бесплатно! А при покупке занятий получите до 3 уроков в подарок!
Получи целый месяц премиум-подписки на приложение ED Words в подарок. Введи промокод march3021 на этой странице или прямо в приложении ED Words. Промокод действителен до 01.05.2021.
Наши продукты:
Учи английские слова в мобильном приложении ED Words
Учи английский от А до Z в мобильном приложении ED Courses
Установи расширение для Google Chrome, переводи английские слова в интернете и добавляй их на изучение в приложении Ed Words
Учи английский в игровой форме в онлайн тренажере
Закрепляй разговорные навыки и находи друзей в разговорных клубах
Смотри видео лайфхаки про английский на YouTube-канале EnglishDom
19.
 За пределами периодической системы . Исчезающая ложка [Или удивительные истории из жизни периодической таблицы Менделеева]
За пределами периодической системы . Исчезающая ложка [Или удивительные истории из жизни периодической таблицы Менделеева]Нижний край таблицы Менделеева овеян тайной. Высокорадиоактивные элементы редко встречаются в природе, поэтому люди склонны интуитивно полагать, что нестабильные, легко распадающиеся элементы и будут самыми редкими. Так, например, редчайшим элементом является в высшей степени неустойчивый франций, который встречается в земной коре только как промежуточный продукт. В естественной среде атомы франция распадаются быстрее, чем атомы любого другого элемента. И все же самым редким элементом на Земле является вовсе не франций. Такой вот парадокс, и решение этого парадокса лежит за привычными и удобными рамками таблицы Менделеева. За решениями мы должны отправиться в удивительный край под названием «остров стабильности» – Новый Свет физиков-ядерщиков. Остров стабильности – своего рода Америка, на которую современные ученые-первооткрыватели возлагают большие надежды, ведь на сегодняшний день это самая удачная, если не единственная, возможность расширить границы периодической таблицы элементов.
Как известно, Вселенная на 90 % состоит из водорода. Оставшиеся 10 % составляет гелий. Все остальное вещество, включая нашу Землю массой 6 х 1024 кг, укладывается в статистическую погрешность. В этих миллионах миллиардов килограммов содержится ничтожное количество редчайшего элемента астата – лишь несколько десятков грамм. Чтобы хоть как-то представить эти пропорции, вообразите, что вы оставили свой «Бьюик Астат» на огромном паркинге и не можете его найти. В поисках машины вам придется пройти ряд за рядом, этаж за этажом, осматривая каждую машину. Небольшая оговорка: паркинг, на котором вам предстоит искать машину, составляет 100 миллионов парковочных мест в ширину, столько же в длину и 100 миллионов этажей в высоту. Более того, таких паркингов вам придется обойти ни много ни мало, а 160 – лишь в этом случае масштабы поиска вашей машины будут сопоставимы с поисками астата в земной коре. Вам ничего не останется, кроме как махнуть рукой и отправиться восвояси.
Поскольку астат является самым редким элементом, возникает вполне естественный вопрос: как ученым удалось его обнаружить? Дело в том, что они немного схитрили. Если в древней земной коре и был астат, он давно уже распался. Но астат в свою очередь является продуктом распада других радиоактивных элементов, которые испускают альфа– или бета-частицы. Зная общее количество исходных элементов (обычно это элементы, соседствующие с ураном в таблице Менделеева) и рассчитав вероятность появления астата в результате их распада, ученые могут назвать приблизительное количество атомов астата, существующих на Земле в любой момент времени, а также атомов некоторых других элементов. Так, например, франций, отделенный в таблице от астата лишь одной клеткой, существует на нашей планете в количестве от 550 до 850 г в любой момент времени.
Если в древней земной коре и был астат, он давно уже распался. Но астат в свою очередь является продуктом распада других радиоактивных элементов, которые испускают альфа– или бета-частицы. Зная общее количество исходных элементов (обычно это элементы, соседствующие с ураном в таблице Менделеева) и рассчитав вероятность появления астата в результате их распада, ученые могут назвать приблизительное количество атомов астата, существующих на Земле в любой момент времени, а также атомов некоторых других элементов. Так, например, франций, отделенный в таблице от астата лишь одной клеткой, существует на нашей планете в количестве от 550 до 850 г в любой момент времени.
Как ни странно, астат – более стабильный элемент, чем франций. Если взять миллион самых долгоживущих изотопов астата, половина из них распадётся через 400 минут. Половина такого же количества изотопов франция продержится всего-то 20 минут. Франций нестабилен настолько, что не имеет практического применения. Несмотря на то что в земной коре франций содержится в достаточном (хоть и мизерном) количестве, чтобы ученые могли напрямую его обнаружить, им никогда не удастся собрать столько атомов франция, чтобы его можно было увидеть невооруженным глазом. Если бы это все же удалось сделать, такое количество радиоактивного франция немедленно убило бы своего первооткрывателя. На сегодняшний день рекордное количество франция, полученного за один раз, составляет 10 тысяч атомов.
Если бы это все же удалось сделать, такое количество радиоактивного франция немедленно убило бы своего первооткрывателя. На сегодняшний день рекордное количество франция, полученного за один раз, составляет 10 тысяч атомов.
Получение видимого количества астата – задача, которая наверняка также останется невыполнимой. Тем не менее астат имеет важное практическое применение: его быстродействующие радиоактивные изотопы используются в медицине. Когда ученые под руководством нашего старого знакомого Эмилио Сегре впервые синтезировали астат в 1939 году, они решили изучить его свойства на морских свинках, сделав животным инъекции. В таблице Менделеева астат расположен прямо под йодом и ведет себя в организме подобно этому элементу: у морских свинок астат накапливался в щитовидной железе. Астат является единственным химическим элементом, открытие которого было подтверждено не приматами.
Странные сходства между астатом и францием начинаются с их ядер. Внутри ядер астата и франция, как и во всех других атомах, соперничают разные силы: сильные ядерные взаимодействия (силы притяжения) и электростатические силы (способные отталкивать частицы).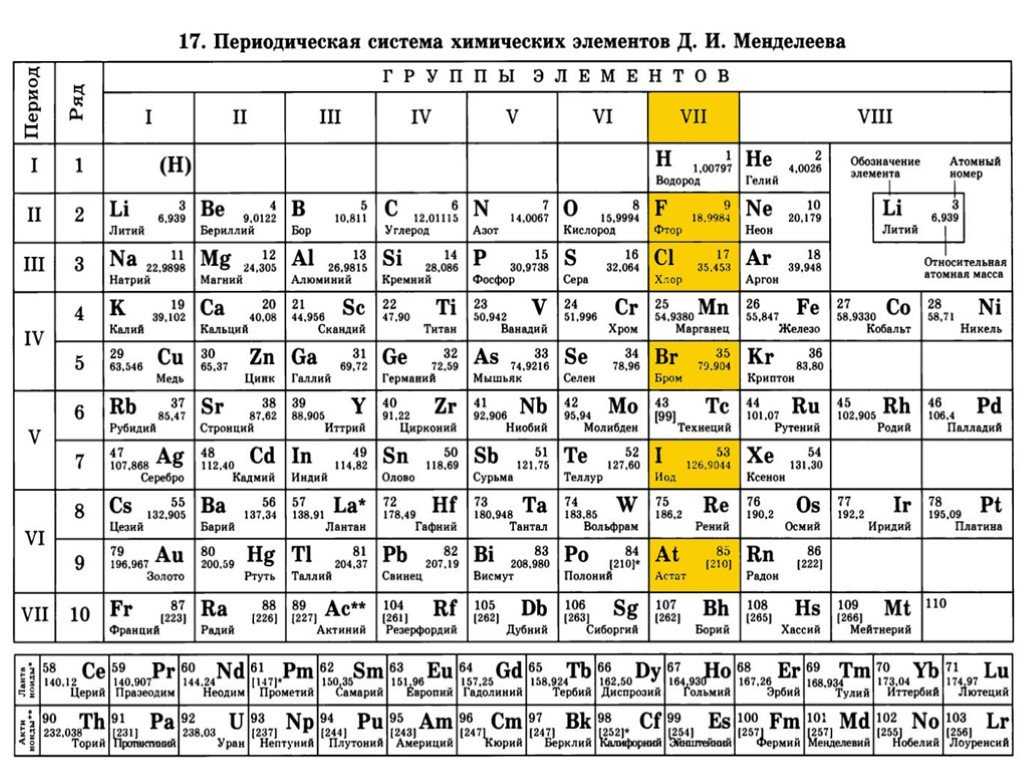 Сильное ядерное взаимодействие – самая мощная из фундаментальных сил природы, но, как ни парадоксально, руки у нее коротки, словно тоненькие лапки огромного тираннозавра. Если частицы отдаляются друг от друга всего на несколько триллионных сантиметра, ядерные силы теряют всю свою мощь. По этой причине они редко проявляются за пределами атомных ядер и черных дыр. Но на подвластных ему небольших расстояниях эти взаимодействия в сотни раз мощнее электростатических сил. Это хорошо, поскольку они крепко удерживают протоны и нейтроны в ядре, не давая электростатическим силам разорвать атомные ядра на части.
Сильное ядерное взаимодействие – самая мощная из фундаментальных сил природы, но, как ни парадоксально, руки у нее коротки, словно тоненькие лапки огромного тираннозавра. Если частицы отдаляются друг от друга всего на несколько триллионных сантиметра, ядерные силы теряют всю свою мощь. По этой причине они редко проявляются за пределами атомных ядер и черных дыр. Но на подвластных ему небольших расстояниях эти взаимодействия в сотни раз мощнее электростатических сил. Это хорошо, поскольку они крепко удерживают протоны и нейтроны в ядре, не давая электростатическим силам разорвать атомные ядра на части.
На периферии ядер такого размера, как у франция и астата, сильное ядерное взаимодействие практически сравнивается с электростатическими силами, поэтому удержать все протоны и нейтроны в таком ядре становится очень сложно. У франция 87 протонов, и они совершенно не хотят соприкасаться друг с другом. Еще в ядре франция насчитывается порядка 130 нейтронов, которые образуют неплохой буфер между положительно заряженными частицами. Но в то же время они делают ядро столь массивным, что сильному взаимодействию не удается распространиться до самых границ и погасить центробежные силы. Именно поэтому франций (и по схожим причинам астат) являются крайне нестабильными элементами. Соответственно, логично предположить, что ядра с еще бо?льшим количеством протонов, чем у франция, должны испытывать на себе еще более мощные силы отталкивания, и более тяжелые атомы окажутся еще менее стабильными, чем франций.
Но в то же время они делают ядро столь массивным, что сильному взаимодействию не удается распространиться до самых границ и погасить центробежные силы. Именно поэтому франций (и по схожим причинам астат) являются крайне нестабильными элементами. Соответственно, логично предположить, что ядра с еще бо?льшим количеством протонов, чем у франция, должны испытывать на себе еще более мощные силы отталкивания, и более тяжелые атомы окажутся еще менее стабильными, чем франций.
Однако это лишь отчасти верно. Вспомните Марию Гёпперт-Майер («Мать из С. Д. получила Нобелевскую премию»). Мы уже говорили о том, что она разработала теорию о долгоживущих «магических» элементах. Так она называла элементы, в атомах которых содержится два, восемь, двадцать, двадцать восемь и т. д. протонов или нейтронов. Стабильность таких элементов оказалась гораздо выше, чем у их соседей по периодической системе. Другие количества протонов и нейтронов – например, девяносто два – также образуют компактные и довольно стабильные ядра, в которых сильные взаимодействия надежно удерживают протоны вместе. Именно поэтому уран гораздо устойчивее франция и астата, хотя и тяжелее их. По мере того как мы спускаемся все ниже и ниже по периодической системе, элемент за элементом, борьба между сильными взаимодействиями и электрическими силами все сильнее напоминает резко снижающийся график биржевого тикера. На нем прослеживается общая тенденция к понижению, но в то же время возникают многочисленные флуктуации, когда берет верх то одна сила, то другая[169].
Именно поэтому уран гораздо устойчивее франция и астата, хотя и тяжелее их. По мере того как мы спускаемся все ниже и ниже по периодической системе, элемент за элементом, борьба между сильными взаимодействиями и электрическими силами все сильнее напоминает резко снижающийся график биржевого тикера. На нем прослеживается общая тенденция к понижению, но в то же время возникают многочисленные флуктуации, когда берет верх то одна сила, то другая[169].
Исходя из этого общего принципа, ученые предположили, что срок существования элементов тяжелее урана будет асимптотически приближаться к 0,0. Но по мере того, как в 1950-е и 1960-е годы удавалось синтезировать все более тяжелые элементы, стало происходить нечто неожиданное. Теоретически магические ядра должны встречаться до бесконечности, и оказалось, что гораздо ниже урана должен располагаться элемент с условно стабильным ядром – № 114. Более того, ученые из Калифорнийского университета в Беркли вычислили, что 114-й элемент может существовать значительно дольше, чем атомы примерно десяти предшествующих ему тяжелых элементов. Учитывая, как ничтожен период полураспада изотопов этих элементов (в лучшем случае – несколько микросекунд), подобная идея казалась нелогичной и дикой. Упаковка все новых протонов и нейтронов в искусственные ядра напоминает упаковку взрывчатки: чем больше частиц в ядре, тем более сильное напряжение оно испытывает. Но казалось, что элемент № 114 должен быть исключительно стабильным для такого крупного атома. Не менее странно (как минимум на бумаге) было и то, что элементы с атомными номерами 112 и 116 также должны испытывать на себе положительное влияние близости 114-й клетки. Даже имея «почти магическое» количество протонов, они должны были обладать сравнительно высокой стабильностью. Ученые окрестили это скопление элементов «островом стабильности».
Учитывая, как ничтожен период полураспада изотопов этих элементов (в лучшем случае – несколько микросекунд), подобная идея казалась нелогичной и дикой. Упаковка все новых протонов и нейтронов в искусственные ядра напоминает упаковку взрывчатки: чем больше частиц в ядре, тем более сильное напряжение оно испытывает. Но казалось, что элемент № 114 должен быть исключительно стабильным для такого крупного атома. Не менее странно (как минимум на бумаге) было и то, что элементы с атомными номерами 112 и 116 также должны испытывать на себе положительное влияние близости 114-й клетки. Даже имея «почти магическое» количество протонов, они должны были обладать сравнительно высокой стабильностью. Ученые окрестили это скопление элементов «островом стабильности».
Вдохновившись собственной метафорой и ощутив себя отважными мореплавателями, ученые принялись готовиться к завоеванию этого острова. Они обсуждали поиски «Атлантиды химических элементов», а некоторые, подобно старинным мореходам, даже вычерчивали в сепии карты неизведанных ядерных морей. Казалось, никто бы не удивился, если бы эти моря кишели спрутами. Попытки достичь этого острова сверхтяжелых элементов породили одну из самых захватывающих физических дисциплин. Ученые пока не добрались до этих берегов (чтобы получить по-настоящему стабильные «дважды магические» элементы, требуется искать способы внедрения все новых нейтронов в элементы-мишени), но уже прочесывают отмели, отыскивая удобную бухту, чтобы высадиться на берег.
Казалось, никто бы не удивился, если бы эти моря кишели спрутами. Попытки достичь этого острова сверхтяжелых элементов породили одну из самых захватывающих физических дисциплин. Ученые пока не добрались до этих берегов (чтобы получить по-настоящему стабильные «дважды магические» элементы, требуется искать способы внедрения все новых нейтронов в элементы-мишени), но уже прочесывают отмели, отыскивая удобную бухту, чтобы высадиться на берег.
Причудливая карта легендарного «острова стабильности» – области сверхтяжелых элементов. Ученые надеются, что этот «остров» позволит им значительно расширить границы современной таблицы Менделеева. В левом нижнем углу – символ свинца (Pb), край основной, «континентальной», части периодической системы. Он отделен проливом нестабильных элементов от острова, где высятся условно стабильные пики тория и урана. Далее открывается бескрайнее море. Автор карты – Юрий Цолакович Оганесян, работающий в Объединенном институте ядерных исследований (Дубна)
Неудивительно, что перед «островом стабильности» раскинулась область очень неустойчивых элементов, примерно в центре которой находится франций.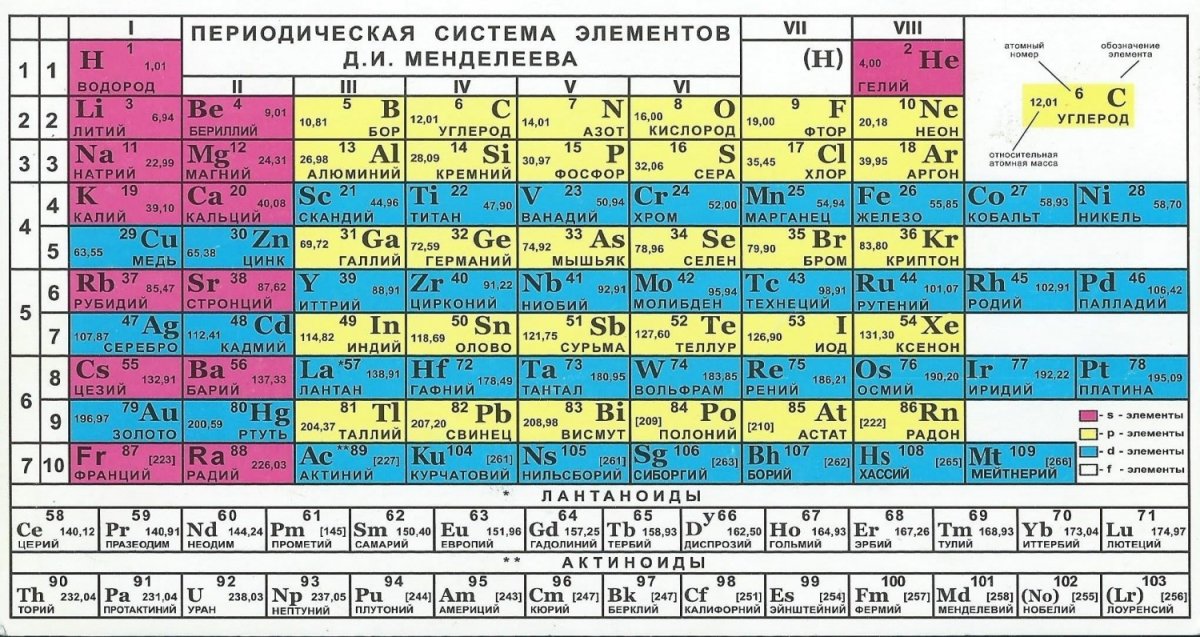 Восемьдесят седьмой элемент находится между магическим ядром № 82 и условно стабильным ядром № 92. Поэтому некоторые нейтроны и протоны франция постоянно «норовят выпрыгнуть» из атома и отправиться в свободное плавание. На самом деле, из-за крайне непрочной структуры ядра франций не только является самым нестабильным элементом, встречающимся в природе, но и уступает по стабильности даже всем искусственно полученным элементам вплоть до сто четвертого – резерфордий. Если правомерно
Восемьдесят седьмой элемент находится между магическим ядром № 82 и условно стабильным ядром № 92. Поэтому некоторые нейтроны и протоны франция постоянно «норовят выпрыгнуть» из атома и отправиться в свободное плавание. На самом деле, из-за крайне непрочной структуры ядра франций не только является самым нестабильным элементом, встречающимся в природе, но и уступает по стабильности даже всем искусственно полученным элементам вплоть до сто четвертого – резерфордий. Если правомерно
выделить на карте такой «пролив нестабильности», то франций будет пускать пузырьки с самого его дна.
Однако франций в природе встречается чуть чаще, чем астат. Почему? Дело в том, что многие радиоактивные элементы, расположенные вокруг урана, на том или ином промежуточном этапе распада превращаются во франций. А что же франций? Вместо того чтобы подвергаться обычному альфа-распаду и в результате (потеряв два протона) превращаться в астат, этот атом более чем в 99,9 % случаев облегчает свое перегруженное ядро, претерпевая бета-распад, и становится радием. Затем радий проходит целый ряд стадий альфа-распада, минуя астат. Иными словами, механизм радиоактивного распада многих нестабильных атомов на клетке франция немного пробуксовывает – именно поэтому количество франция в земной коре измеряется несколькими сотнями граммов. В то же время франций не позволяет своим атомам превращаться в астат, из-за чего астат является еще более редким. Загадка решена.
Затем радий проходит целый ряд стадий альфа-распада, минуя астат. Иными словами, механизм радиоактивного распада многих нестабильных атомов на клетке франция немного пробуксовывает – именно поэтому количество франция в земной коре измеряется несколькими сотнями граммов. В то же время франций не позволяет своим атомам превращаться в астат, из-за чего астат является еще более редким. Загадка решена.
Итак, с проливом разобрались, а что же с «островом стабильности»? Весьма маловероятно, что химикам удастся синтезировать все возможные элементы вплоть до очень крупных магических ядер. С другой стороны, возможно, все же удастся получить элемент № 114, затем № 126 и продолжать путь к «острову» уже оттуда. Некоторые ученые полагают, что при добавлении электронов к сверхтяжелым ядрам стабильность таких атомов может повыситься. Возможно, электроны будут действовать как пружины и амортизаторы, впитывая ту энергию, которую атомы обычно тратят на саморазрушение. Если эта гипотеза подтвердится, возможно, будут синтезированы и элементы после 140-го, 160-го и 180-го номеров. «Остров стабильности» превратится в архипелаг-цепочку. Такие стабильные «острова» будут отстоять все дальше друг от друга. Но, возможно, ученые смогут постепенно преодолевать эти огромные расстояния в новом периодическом архипелаге – как полинезийцы на своих лодках осваивали Океанию.
«Остров стабильности» превратится в архипелаг-цепочку. Такие стабильные «острова» будут отстоять все дальше друг от друга. Но, возможно, ученые смогут постепенно преодолевать эти огромные расстояния в новом периодическом архипелаге – как полинезийцы на своих лодках осваивали Океанию.
Самое интересное заключается в том, что эти новые элементы не будут просто утяжеленными аналогами известных сегодня элементов, а могут обладать совершенно новыми свойствами (вспомните, как сильно свинец отличается от кремния и углерода). Согласно некоторым расчетам, если электроны смогут укротить сверхтяжелое ядро и повысить его стабильность, то и ядро сможет управлять электронами. В таком случае электроны, возможно, начнут заполнять оболочки и орбитали атома в необычном порядке. Элемент, который согласно периодическому закону должен проявлять свойства тяжелого металла, может слишком рано заполнить свои орбитали; в таком случае получится элемент типа металлического благородного газа.
Не хотелось бы гневить богов, но ученые уже придумали названия для этих гипотетических элементов. Вероятно, вы заметили, что тяжелые элементы в самом низу таблицы имеют трехбуквенные, а не двухбуквенные обозначения, причем все они начинаются с и. Опять же, все дело во влиянии древнегреческого и латыни. Еще не открытый элемент 119 Uue называется «унунений», сто двадцать второй элемент Ubb – унбибий и т. д.[170] Эти элементы получат «настоящие» названия лишь после того, как их удастся синтезировать, но пока ученые могут просто «пометить» их латинскими словами-формулами – и не только их, но и другие элементы, вызывающие наибольший интерес, например, магическое ядро 184, названное «уноктквадий». (И слава богу! Прямо на наших глазах отмирает привычная двухчастная классификация видов в биологии – та самая, в которой домашняя кошка называется Felis catus. На смену ей приходят хромосомные обозначения ДНК, напоминающие штрихкоды. Прощай, Homo sapiens, человек разумный, здравствуй ТЦАТЦГГТЦАТТГГ… Таким образом, элементы на «у-» остаются одним из последних бастионов латыни в науке – там, где этот язык некогда доминировал[171].
Вероятно, вы заметили, что тяжелые элементы в самом низу таблицы имеют трехбуквенные, а не двухбуквенные обозначения, причем все они начинаются с и. Опять же, все дело во влиянии древнегреческого и латыни. Еще не открытый элемент 119 Uue называется «унунений», сто двадцать второй элемент Ubb – унбибий и т. д.[170] Эти элементы получат «настоящие» названия лишь после того, как их удастся синтезировать, но пока ученые могут просто «пометить» их латинскими словами-формулами – и не только их, но и другие элементы, вызывающие наибольший интерес, например, магическое ядро 184, названное «уноктквадий». (И слава богу! Прямо на наших глазах отмирает привычная двухчастная классификация видов в биологии – та самая, в которой домашняя кошка называется Felis catus. На смену ей приходят хромосомные обозначения ДНК, напоминающие штрихкоды. Прощай, Homo sapiens, человек разумный, здравствуй ТЦАТЦГГТЦАТТГГ… Таким образом, элементы на «у-» остаются одним из последних бастионов латыни в науке – там, где этот язык некогда доминировал[171]. )
)
Итак, как далеко может зайти подобное путешествие с острова на остров? Доведется ли нам наблюдать пики маленьких вулканов, теряющиеся далеко в бесконечности за границами периодической системы, и называть их какими-нибудь протяжными именами вроде э-э-э-э-э…энний, элемент № 999? Увы, нет. Даже если ученые найдут способ склеивания сверхтяжелых элементов и смогут бросить якорь на очень далеких «островках стабильности», то их, образно выражаясь, практически сразу смоет в бушующий атомный океан.
Чтобы понять причину, вернемся к рассказу об Альберте Эйнштейне и к той величайшей ошибке, которую он совершил в своей научной карьере. Несмотря на распространенное мнение поклонников Эйнштейна, он получил Нобелевскую премию по физике отнюдь не за Специальную или Общую теорию относительности. Награда была присуждена Эйнштейну за объяснение странного квантово-механического явления, которое называется фотоэлектрическим эффектом. Он одним из первых доказал, что квантовая механика – не просто неуклюжая система допущений, призванная обосновать непостижимые эксперименты, а самая настоящая реальность, пусть и необычная. Тот факт, что именно Эйнштейн объяснил явление фотоэффекта, можно назвать иронией судьбы сразу по двум причинам. Во-первых, с возрастом Эйнштейн становился все придирчивее и постепенно стал воспринимать квантовую механику с изрядным скептицизмом. Ее статистическая и глубоко вероятностная природа слишком напоминала Эйнштейну азартные игры, именно поэтому он однажды произнес свой знаменитый афоризм «Бог не играет в кости». Эйнштейн был неправ, и как жаль, что большинство людей так и не услышали фразу, которую в ответ произнес Нильс Бор: «Эйнштейн, прекратите указывать Богу, что ему делать».
Тот факт, что именно Эйнштейн объяснил явление фотоэффекта, можно назвать иронией судьбы сразу по двум причинам. Во-первых, с возрастом Эйнштейн становился все придирчивее и постепенно стал воспринимать квантовую механику с изрядным скептицизмом. Ее статистическая и глубоко вероятностная природа слишком напоминала Эйнштейну азартные игры, именно поэтому он однажды произнес свой знаменитый афоризм «Бог не играет в кости». Эйнштейн был неправ, и как жаль, что большинство людей так и не услышали фразу, которую в ответ произнес Нильс Бор: «Эйнштейн, прекратите указывать Богу, что ему делать».
Во-вторых, Эйнштейн всю жизнь пытался согласовать квантовую механику и теорию относительности в непротиворечивую и стройную «теорию всего», но это ему не удалось. Правда, кое-что получилось. Иногда при столкновении двух теорий они блестяще дополняют друг друга: релятивистские уточнения скорости электрона помогли понять, почему ртуть (мой любимый химический элемент) при комнатной температуре является жидкостью, а не твердым веществом.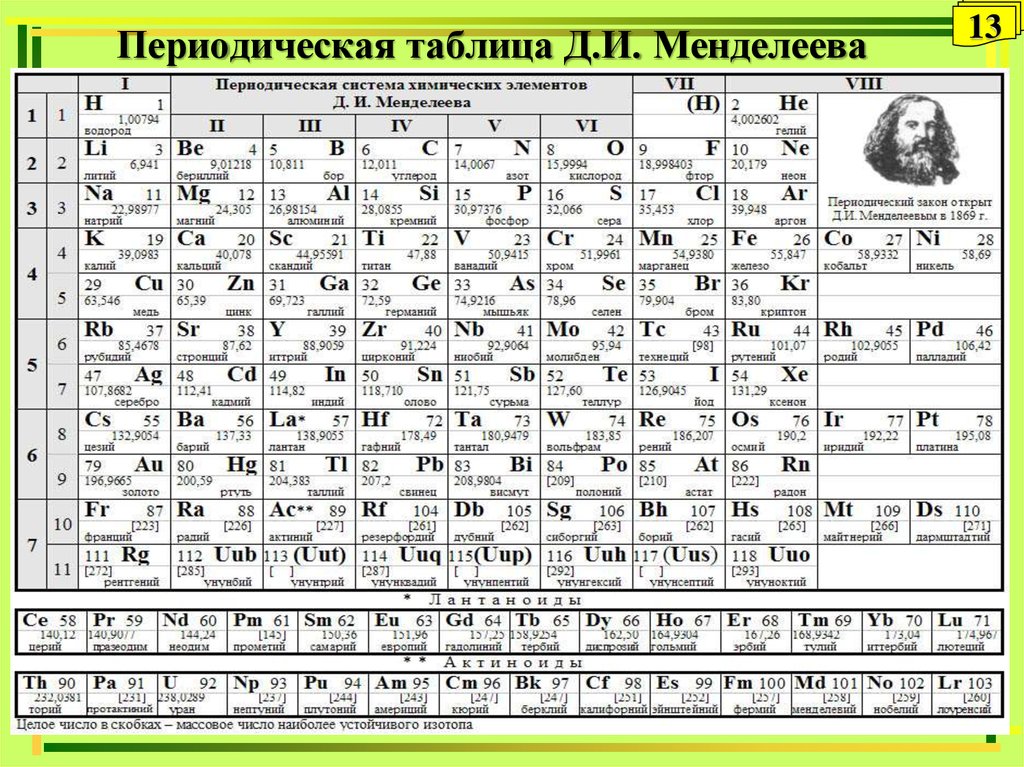 Нам бы никогда не удалось создать элемент № 99, эйнштейний, если бы мы не знали обеих этих теорий. Но в целом идеи Эйнштейна о силе тяжести, скорости света и относительности не вполне согласуются с квантовой механикой. В некоторых ситуациях, где две эти теории вступают в плотный контакт – например, в черных дырах, – рушатся любые причудливые уравнения.
Нам бы никогда не удалось создать элемент № 99, эйнштейний, если бы мы не знали обеих этих теорий. Но в целом идеи Эйнштейна о силе тяжести, скорости света и относительности не вполне согласуются с квантовой механикой. В некоторых ситуациях, где две эти теории вступают в плотный контакт – например, в черных дырах, – рушатся любые причудливые уравнения.
Возможно, это столкновение теорий и знаменует предел периодической системы. Вновь обратимся к аналогии между электронами и планетами. Как известно, Меркурий совершает оборот вокруг Солнца всего за три земных месяца, а у Нептуна на это уходит 165 земных лет. Так и электроны, расположенные на внутренних атомных оболочках, вращаются вокруг ядра гораздо быстрее, чем электроны внешних оболочек. Точная скорость электрона зависит от отношения количества протонов в ядре к постоянной тонкой структуры альфа, рассмотренной в предыдущей главе. По мере того как это отношение приближается к единице, скорость электрона становится все ближе к скорости света.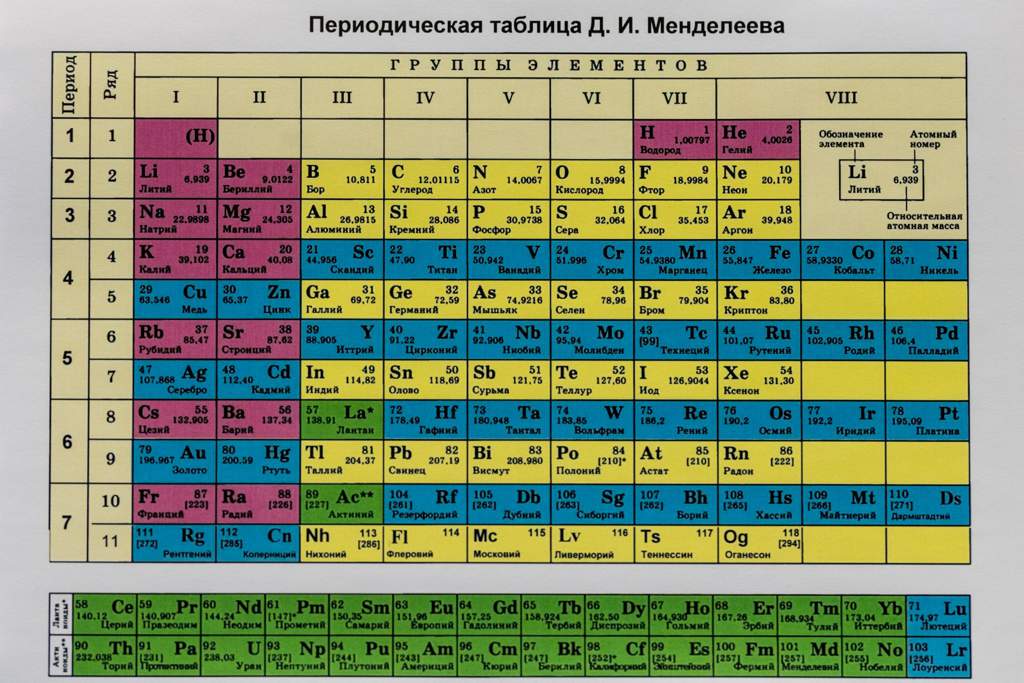 Но не забывайте, что, по современным расчетам, значение постоянной тонкой структуры составляет около 1/137. Если в атоме элемента будет более 137 протонов, скорость вращения его электронов должна превысить скорость света – а согласно теории относительности Эйнштейна, это невозможно.
Но не забывайте, что, по современным расчетам, значение постоянной тонкой структуры составляет около 1/137. Если в атоме элемента будет более 137 протонов, скорость вращения его электронов должна превысить скорость света – а согласно теории относительности Эйнштейна, это невозможно.
Итак, гипотетический элемент № 137 должен оказаться последним. Ему уже придумали название «фейнманий» – в честь знаменитого физика Ричарда Фейнмана, впервые указавшего на этот предел. Кстати, именно Фейнман назвал константу альфа «одной из величайших проклятых тайн физики» – теперь вы понимаете почему. После того как неукротимая сила квантовой механики врежется в неподвижную теорию относительности, одна из этих сил должна будет уступить. Никто не знает какая.
Некоторые физики, всерьез воспринимающие возможность путешествий во времени, полагают, что в теории относительности может быть лазейка, позволяющая особым (недоступным для наблюдения) частицам, тахионам, двигаться быстрее скорости света, которая составляет около 300 000 километров в секунду. Вся загвоздка, связанная с тахионами, заключается в том, что они, возможно, движутся против хода времени – то есть в прошлое. Поэтому, если когда-нибудь химикам удастся синтезировать «фейнманий-плюс-один» – унтриоктий, не устремятся ли его внутренние электроны в прошлое, пока остальная часть атома будет оставаться в нашем времени? Вероятно, нет. Гораздо логичнее предположить, что скорость света жестко ограничивает предельный размер атома и просто уничтожает все возникающие за фейнманием «островки стабильности», точно как в 1950-е годы атомная бомба стерла с лица земли коралловые атоллы.
Вся загвоздка, связанная с тахионами, заключается в том, что они, возможно, движутся против хода времени – то есть в прошлое. Поэтому, если когда-нибудь химикам удастся синтезировать «фейнманий-плюс-один» – унтриоктий, не устремятся ли его внутренние электроны в прошлое, пока остальная часть атома будет оставаться в нашем времени? Вероятно, нет. Гораздо логичнее предположить, что скорость света жестко ограничивает предельный размер атома и просто уничтожает все возникающие за фейнманием «островки стабильности», точно как в 1950-е годы атомная бомба стерла с лица земли коралловые атоллы.
Означает ли это, что периодическая таблица вскоре закончится? Станет застывшей и неизменной, как окаменелость?
Нет, нет и еще раз нет.
* * *
Если на Земле когда-нибудь высадятся инопланетяне, это еще совершенно не значит, что мы сможем с ними поговорить. Дело далеко не ограничивается тем фактом, что никто из них не знает слова «Земля» и не сможет его произнести. Общение инопланетян может происходить при помощи феромонов или световых импульсов, а не звуков.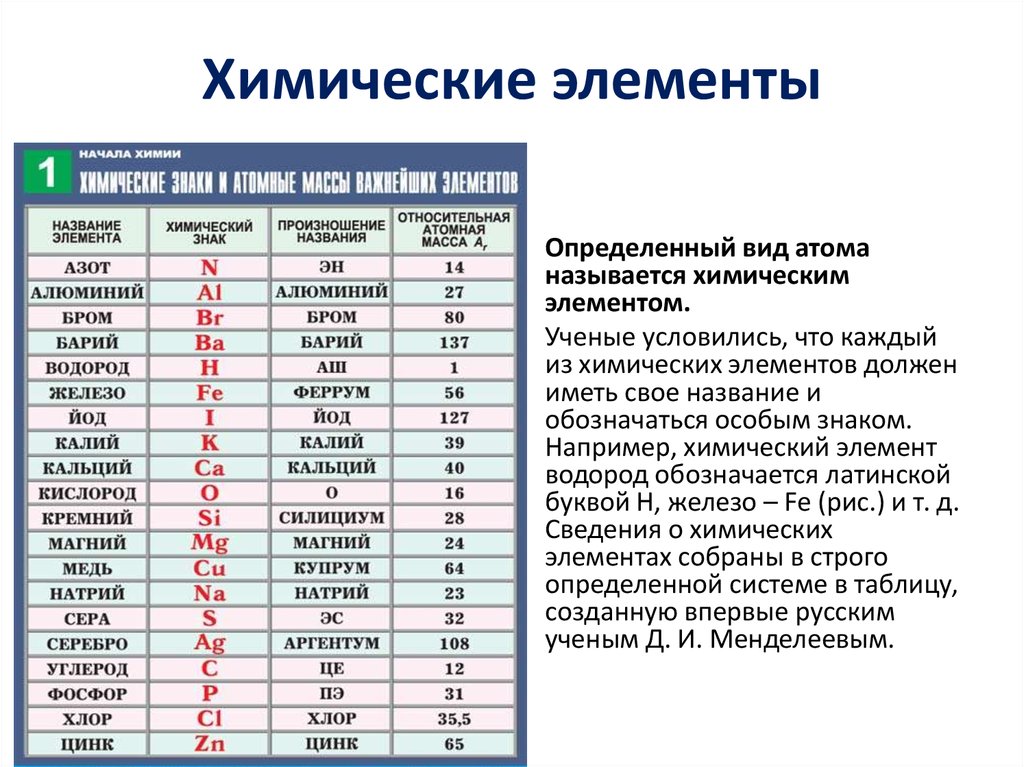 Кроме того, если учесть маловероятную возможность их неуглеродного происхождения, инопланетяне могут оказаться весьма ядовитыми. Даже если мы сможем войти с ними в контакт, наши основные ценности – любовь, боги, уважение, семья, деньги, мир – могут оказаться для них совершенно непостижимы. Те немногие вещи, которые мы сможем им предложить и рассчитывать, что пришельцы их поймут, – это числа, например л, и периодическая система элементов.
Кроме того, если учесть маловероятную возможность их неуглеродного происхождения, инопланетяне могут оказаться весьма ядовитыми. Даже если мы сможем войти с ними в контакт, наши основные ценности – любовь, боги, уважение, семья, деньги, мир – могут оказаться для них совершенно непостижимы. Те немногие вещи, которые мы сможем им предложить и рассчитывать, что пришельцы их поймут, – это числа, например л, и периодическая система элементов.
Разумеется, речь идет о законах периодической системы, поскольку привычная нам таблица, напоминающая замок с двумя башнями и изображенная на форзаце любого учебника по химии, – это лишь один из возможных способов организации химических элементов. Когда в школе учились наши бабушки и дедушки, таблица Менделеева мало напоминала современную – в ней было всего восемь столбцов. Она больше походила на календарь: длинные последовательности переходных металлов заверстывались в ней на новую строку, подобно тому как в месяцах года иногда в отдельный столбик записывают 30-е или 31-е число. Более того, многие пытались уложить лантаноиды в основной части таблицы, и из-за этого возникала полная неразбериха.
Более того, многие пытались уложить лантаноиды в основной части таблицы, и из-за этого возникала полная неразбериха.
Никто не пытался дать переходным металлам чуть больше места, пока Гленн Сиборг и его коллеги все из того же Калифорнийского университета в Беркли не перерисовали всю периодическую систему. Эта работа продолжалась с конца 30-х до начала 60-х годов. Дело было не только в том, что в таблицу добавлялись новые элементы. Сиборг с коллегами осознали, что некоторые элементы, например актиний, не вписываются в привычную схему. Опять же, может показаться странным, но в те времена многие ученые воспринимали периодический закон не слишком серьезно. Они полагали, что лантаноиды и их странная химия представляют собой серию странных исключений из строгих правил периодической системы, что ниже лантаноидов уже не окажется элементов, которые прячут лишние электроны у себя в оболочках и из-за этого совершенно не похожи по свойствам на обычные переходные металлы. Но химия лантаноидов повторилась. Иначе и не могло быть: ведь в этом заключается категорический императив химической науки, то самое свойство элементов, которое будет понятно даже инопланетянам. Они распознали бы это свойство не менее уверенно, чем Сиборг. Он впервые обратил внимание на то, какой необычной химией обладают металлы, следующие в таблице за актинием, элементом № 89.
Иначе и не могло быть: ведь в этом заключается категорический императив химической науки, то самое свойство элементов, которое будет понятно даже инопланетянам. Они распознали бы это свойство не менее уверенно, чем Сиборг. Он впервые обратил внимание на то, какой необычной химией обладают металлы, следующие в таблице за актинием, элементом № 89.
Актиний сыграл ключевую роль в придании периодической системе элементов ее современных очертаний. Сиборг с коллегами решили извлечь из таблицы все известные на тот момент тяжелые элементы (сегодня называемые «актиноидами») и вынести их в отдельную строку под основной частью таблицы. За счет освободившегося места переходные металлы получили дополнительное пространство. Их больше не располагали в виде треугольников, а выстраивали в виде дополнительных столбцов – таких новых столбцов получилось 10. Такой вариант таблицы оказался настолько удобен, что многие ученые приняли новую сиборговскую модель. Потребовалось некоторое время, чтобы избавиться от ретроградов, не желавших отказываться от старой таблицы. Только в 1970 году периодический календарь окончательно уступил место периодическому замку – настоящему брустверу современной химии.
Только в 1970 году периодический календарь окончательно уступил место периодическому замку – настоящему брустверу современной химии.
Но никто не утверждает, что такая форма таблицы идеальна. Столбчатый вариант оставался преобладающим со времен Менделеева, но сам Менделеев разработал около тридцати разных начертаний периодической системы, а к 1970 году набралось уже более семисот вариантов. Некоторые химики предпочитают отсекать одну из башен замка и приставлять ее к башне с другой стороны, так что таблица начинает смахивать на аляповатую лестницу. Другие возятся с гелием и водородом, расставляя их по разным углам таблицы. Таким образом они пытаются подчеркнуть, что эти элементы, у которых нет октета электронов, обладают весьма необычными химическими свойствами.
На самом деле, стоит только начать экспериментировать с формой периодической системы, как понимаешь, что варианты далеко не ограничиваются прямоугольными контурами[172]. Например, одна из интересных современных таблиц напоминает соты, где шестиугольные поля с элементами разворачиваются по спирали все дальше и дальше. Водород находится в центре такой схемы. Астрономам и астрофизикам нравится начертание, в котором водородное «Солнце» располагается в центре схемы, а вокруг него, как по орбитам, «вращаются» остальные элементы, напоминающие планеты и спутники. Биологи вычерчивают периодическую систему в виде спирали, похожей на ДНК, а самые увлеченные экспериментаторы выполняли таблицу даже по принципу настольной игры парчиси: столбцы и ряды записываются сразу по обе стороны листа, заверстываясь за край страницы. В США был даже выдан патент на игрушку-пирамидку, собираемую по принципу кубика Рубика, на вращающихся гранях которой изображены символы элементов.
Водород находится в центре такой схемы. Астрономам и астрофизикам нравится начертание, в котором водородное «Солнце» располагается в центре схемы, а вокруг него, как по орбитам, «вращаются» остальные элементы, напоминающие планеты и спутники. Биологи вычерчивают периодическую систему в виде спирали, похожей на ДНК, а самые увлеченные экспериментаторы выполняли таблицу даже по принципу настольной игры парчиси: столбцы и ряды записываются сразу по обе стороны листа, заверстываясь за край страницы. В США был даже выдан патент на игрушку-пирамидку, собираемую по принципу кубика Рубика, на вращающихся гранях которой изображены символы элементов.
Люди с музыкальными склонностями наносили элементы на нотный стан, а наш старый знакомый Уильям Крукс, любитель-спиритист, придумал два замечательных и причудливых варианта периодической системы: один в форме лютни, другой – в виде кренделя. Мне очень нравятся таблицы-пирамиды. Они расширяются от вершины книзу и наглядно демонстрируют, как возникают новые орбитали и как все большее количество элементов аккуратно вписывается в общую систему. Еще мне нравится вариант «в разрезе», который закручивается в середине. Изобразить его я бы не смог, могу только сказать, что он похож на ленту Мёбиуса.
Еще мне нравится вариант «в разрезе», который закручивается в середине. Изобразить его я бы не смог, могу только сказать, что он похож на ленту Мёбиуса.
Более того, сегодня начертания периодической системы вышли из плоскости и перестали быть двухмерными. Отрицательно заряженные антипротоны, которые Эмилио Сегре открыл в 1955 году, образуют гармоничное единство с антиэлектронами (позитронами). Из этих частиц уже удалось получить атомы антивещества – например, антиводород. Теоретически каждому элементу может соответствовать свой «антиэлемент», не исключена и возможность существования целой периодической таблицы антиэлементов. Такую зазеркальную таблицу мы можем только представить, но уже в наше время ученые исследуют новые формы материи, которые, возможно, позволят открыть сотни и даже тысячи новых «элементов».
Во-первых, существуют суператомы. Эти скопления, включающие в себя от восьми до ста атомов одного элемента, обладают сверхъестественной способностью «притворяться» отдельными атомами других элементов. Например, если правильно сгруппировать тринадцать атомов алюминия, они начинают проявлять такие же свойства, как ядовитый бром. В химических реакциях атом брома и такое скопление атомов алюминия совершенно неразличимы. Этому поразительному сходству не мешает даже то, что такое скопление в тринадцать раз крупнее атома брома, а алюминий не имеет ничего общего со столбцом ядовитых галогенов-лакриматоров. Другие скопления атомов алюминия напоминают по свойствам атомы благородных газов, полупроводники, кальций и иные элементы, расположенные в совершенно других областях периодической системы.
Например, если правильно сгруппировать тринадцать атомов алюминия, они начинают проявлять такие же свойства, как ядовитый бром. В химических реакциях атом брома и такое скопление атомов алюминия совершенно неразличимы. Этому поразительному сходству не мешает даже то, что такое скопление в тринадцать раз крупнее атома брома, а алюминий не имеет ничего общего со столбцом ядовитых галогенов-лакриматоров. Другие скопления атомов алюминия напоминают по свойствам атомы благородных газов, полупроводники, кальций и иные элементы, расположенные в совершенно других областях периодической системы.
Описанный механизм работает так. Атомы упорядочиваются в виде многогранника, в котором каждый атом «имитирует» протон или нейтрон коллективного ядра. Электроны в такой структуре могут свободно перемещаться внутри ядерного пузыря, и все атомы совместно пользуются электронами. Ученые придумали для обозначения такого состояния вещества немного иронический термин «желий» (от слова «желе»). В зависимости от формы многогранника и от количества в нем граней и углов желий может выдавать в общее пользование большее или меньшее количество электронов.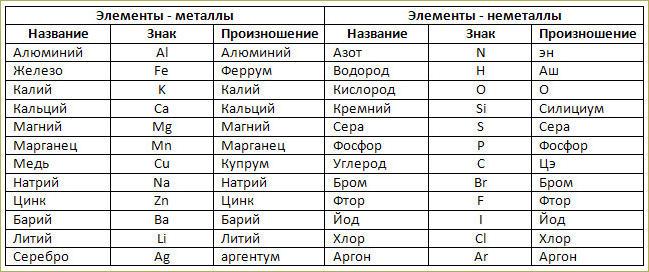 Если наберется семь таких электронов, кластер будет проявлять свойства брома, то есть галогена. Если четыре – желий напоминает по свойствам кремний, полупроводник. Атомы натрия также могут объединяться в желий и «подражать» другим элементам. Вполне возможно, что и многие другие элементы могут имитировать совершенно иные элементы, и вообще все элементы могут имитировать все другие элементы, и так далее, до полной неразберихи. Эти открытия наталкивают ученых на разработку параллельных периодических систем, в которых нашлось бы место для классификации всех подобных экзотических образований. Новые таблицы можно сравнить с полупрозрачными иллюстрациями из старинных анатомических атласов, которые нужно накладывать на «скелет» – таблицу Менделеева.
Если наберется семь таких электронов, кластер будет проявлять свойства брома, то есть галогена. Если четыре – желий напоминает по свойствам кремний, полупроводник. Атомы натрия также могут объединяться в желий и «подражать» другим элементам. Вполне возможно, что и многие другие элементы могут имитировать совершенно иные элементы, и вообще все элементы могут имитировать все другие элементы, и так далее, до полной неразберихи. Эти открытия наталкивают ученых на разработку параллельных периодических систем, в которых нашлось бы место для классификации всех подобных экзотических образований. Новые таблицы можно сравнить с полупрозрачными иллюстрациями из старинных анатомических атласов, которые нужно накладывать на «скелет» – таблицу Менделеева.
Впрочем, даже такие странные образования, как желий, по крайней мере, напоминают обычные атомы. Но есть и еще один способ углубления периодической таблицы. В физике существует понятие «квантовая точка». Ее можно сравнить с голографическим или виртуальным атомом, который тем не менее подчиняется всем законам квантовой механики. Квантовые точки получаются из разных элементов, однако наиболее легко получать их из индия. Это серебристый металл, дальний родственник алюминия. Он расположен прямо на границе между металлами и полупроводниками.
Квантовые точки получаются из разных элементов, однако наиболее легко получать их из индия. Это серебристый металл, дальний родственник алюминия. Он расположен прямо на границе между металлами и полупроводниками.
Для создания квантовой точки ученым требуется сконструировать крошечную колонну, едва различимую глазом. По виду она напоминает знаменитую Башню Дьявола[173]. Подобно геологическому монолиту, такая микроскопическая «башня» состоит из слоев. Снизу вверх в ней укладываются следующие вещества: полупроводник, тонкий изолирующий слой (керамика), индий, более толстый слой керамики и металлическая верхушка. На верхушку подается положительный электрический заряд, притягивающий электроны. Электроны устремляются вниз, пока не достигают изолятора, который для них обычно непроницаем. Однако если изолятор достаточно тонок, то электрон (который на фундаментальном уровне представляет собой просто волну) включает какую-то квантово-механическую магию и «туннелирует» прямиком к индию.
В этот момент ученые отключают электричество, перехватывая улетевший электрон.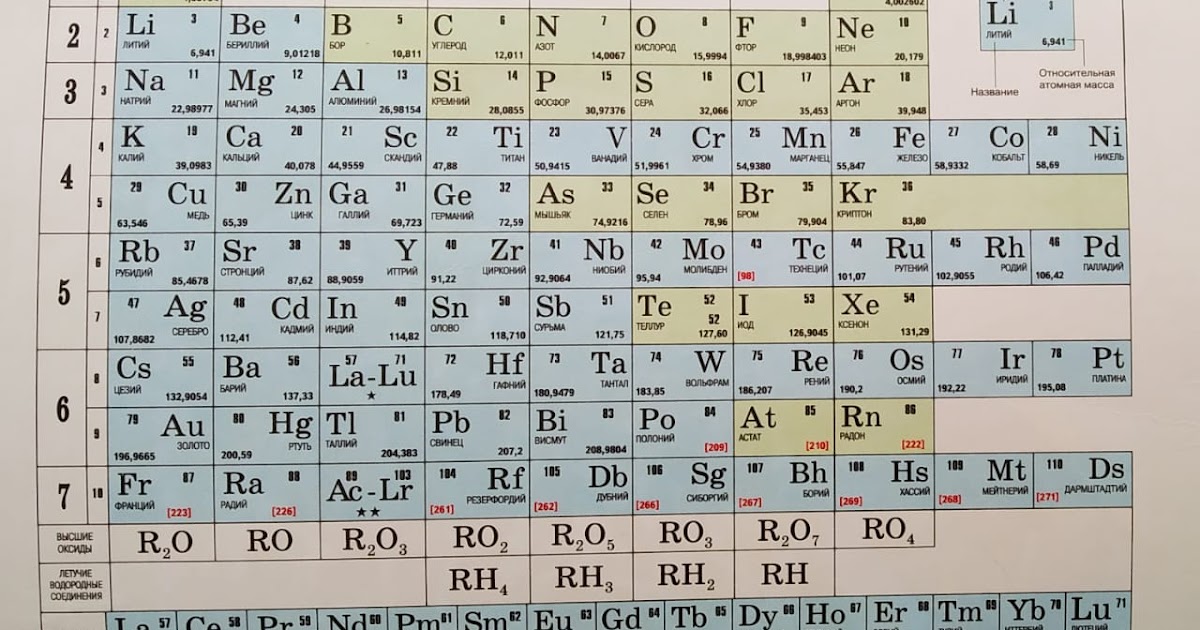 Атомная решетка индия такова, что электроны могут свободно перемещаться между атомами, однако поглощение электрона атомом здесь случается сравнительно редко. Электрон словно парит над слоем атомов, мобильный, но дискретный, и если слой индия достаточно тонок и узок, то порядка тысячи атомов индия объединяются и действуют как единое целое, совместно используя захваченный электрон. Возникает некий суперорганизм. Если внедрить в квантовую точку два или более электронов, то внутри индия они примут противоположные спины и рассредоточатся по гигантским орбиталям и оболочкам. Сказать, что это странно, – ничего не сказать. Фактически мы получаем колоссальные атомы, подобные тем, что образуются в конденсате Бозе – Эйнштейна, но без тех хлопот, которые связаны с охлаждением субстанции до миллиардной доли градуса выше абсолютного нуля. Причем такие опыты – отнюдь не забава, оторванная от реальности. Квантовые точки демонстрируют невероятный потенциал для создания квантовых компьютеров нового поколения.
Атомная решетка индия такова, что электроны могут свободно перемещаться между атомами, однако поглощение электрона атомом здесь случается сравнительно редко. Электрон словно парит над слоем атомов, мобильный, но дискретный, и если слой индия достаточно тонок и узок, то порядка тысячи атомов индия объединяются и действуют как единое целое, совместно используя захваченный электрон. Возникает некий суперорганизм. Если внедрить в квантовую точку два или более электронов, то внутри индия они примут противоположные спины и рассредоточатся по гигантским орбиталям и оболочкам. Сказать, что это странно, – ничего не сказать. Фактически мы получаем колоссальные атомы, подобные тем, что образуются в конденсате Бозе – Эйнштейна, но без тех хлопот, которые связаны с охлаждением субстанции до миллиардной доли градуса выше абсолютного нуля. Причем такие опыты – отнюдь не забава, оторванная от реальности. Квантовые точки демонстрируют невероятный потенциал для создания квантовых компьютеров нового поколения. Ученые получают возможность управлять отдельными электронами и совершать вычисления с их помощью. Это гораздо более быстрая и чистая техника, чем прокачка миллиардов электронов через полупроводниковые интегральные схемы Джека Килби, сконструированные в середине прошлого века.
Ученые получают возможность управлять отдельными электронами и совершать вычисления с их помощью. Это гораздо более быстрая и чистая техника, чем прокачка миллиардов электронов через полупроводниковые интегральные схемы Джека Килби, сконструированные в середине прошлого века.
Периодическая система также преобразится под влиянием исследований, связанных с квантовыми точками. Эти точки настолько плоские, что и форма электронных оболочек в них очень своеобразная. В настоящий момент представляется, что периодическая система плоских элементов значительно отличается от той, которая известна нам сегодня. Во-первых, она более узкая, так как в ней правило октетов не соблюдается. Электроны заполняют оболочки быстрее, между инертными благородными газами насчитывается меньше элементов. Тем не менее многие квантовые точки весьма бурно реагируют друг с другом, вступая во взаимодействия и образуя… ну, кто их знает, что они образуют. В отличие от суператомов, никаких аналогий между «элементами» из квантовых точек и обычными элементами провести не удается.
Завершая книгу, следует признать, что сиборговская таблица, напоминающая замок с двумя башнями, укрепленный двумя рвами из лантаноидов и актиноидов, еще долгие годы будет красоваться в кабинетах химии. Это очень наглядная схема, по которой удобно и легко учиться. Но мне хотелось бы устыдить издателей учебников по химии: сиборговскую таблицу читатель зачастую видит уже на обложке, но почти никто из издателей хотя бы на заднем форзаце не готов напечатать еще несколько не менее наглядных и наводящих на размышление вариантов таблицы. Объемные фигуры, теснящиеся на странице, сближающие, казалось бы, совершенно разные элементы, стимулируют воображение. Я очень хотел бы пожертвовать хотя бы тысячу долларов какой-нибудь некоммерческой группе энтузиастов, которые не покладая рук выдумывали бы все новые варианты таблицы, какие только можно себе представить. Современная периодическая таблица долго и исправно служила нам, но, если удастся по-новому представить и начертить ее, это будет великое достижение для всего человечества (или как минимум его части). Более того, если когда-нибудь нас посетят инопланетяне, они по достоинству оценят нашу изобретательность, изучив такую схему. А если пофантазировать как следует – кто знает, вдруг они найдут среди наших таблиц тот вариант, который будет им знаком.
Более того, если когда-нибудь нас посетят инопланетяне, они по достоинству оценят нашу изобретательность, изучив такую схему. А если пофантазировать как следует – кто знает, вдруг они найдут среди наших таблиц тот вариант, который будет им знаком.
Не исключено, конечно, что старый добрый замок с башнями восхитит пришельцев своей изумительной и чистой простотой. Возможно, несмотря на все альтернативные варианты расположения элементов и все знания о суператомах и квантовых точках, которыми может обладать инопланетная цивилизация, они увидят в нашей периодической таблице что-то новое. Мы будем рассказывать им, как читать различные уровни информации, заложенные в таблицу Менделеева, а они – восторженно свистеть (или издавать другие сигналы), поражаясь тому, как красиво людям удалось расставить все химические элементы в такой наглядной периодической таблице.
Как произносится слово “химические элементы”
Как произносится слово “химические элементы” – painenglish. com
com
Как произносится химические элементы
Мартин inПроизношение, Научный английский Тег химические элементы, медь, железо, свинец, слушать, произношение
Ниже вы можете найти список наиболее важных химических элементов и их правильное произношение. Элементы, которые часто произносятся неправильно, выделены красным цветом. Ранее я писал о железе и меди. Напомню также, что в английском языке буква y (которая появляется в таких элементах, как бериллий или иттрий) не произносится как немецкая ü, см. здесь. Если они разные, первая строка для каждого элемента соответствует британскому произношению, а вторая строка — американскому произношению. (Источники: Oxford Advanced Learner’s Dictionary, Longman Pronunciation Dictionary).
Помимо произношения, путаница часто возникает в случаях ртути (не ртуть, ложный друг, связанный с немецким Quecksilber ), калия ( Kalium на немецком языке), натрия ( Natrium на немецком языке), вольфрама (или вольфрам; Wolfram на немецком языке), кремний (не силикон) и фосфор (не фосфор).
| 1 | Водород | Х | ˈhaɪdrədʒən | слушай |
| 2 | Гелий | Он | ˈhiːliəm | слушай |
| 3 | Литий | Ли | ˈlɪθiəm | слушай |
| 4 | Бериллий | Быть | bəˈrɪliəm | слушай |
| 5 | Бор | Б | ˈbɔːrɒn ˈbɔːrɑːn | слушай |
| 6 | Углерод | С | ˈkɑːbən ˈkɑːrbən | слушай |
| 7 | Азот | Н | ˈnaɪtrədʒən | слушай |
| 8 | Кислород | О | ˈɒksɪdʒən ˈɑːksɪdʒən | слушай |
| 9 | Фтор | Ф | ˈflɔːriːn;ˈflʊəriːn ˈflɔːriːn;ˈflʊriːn | слушай |
| 10 | Неон | Не | ˈniːɒn ˈniːɑːn | слушай |
| 11 | Натрий | Нет | ˈsəʊdiəm ˈsoʊdiəm | слушай |
| 12 | Магний | мг | mæɡˈniːziəm | слушай |
| 13 | Алюминий | Ал | ˌæljəˈmɪniəm;ˌæləˈmɪniəm ˌæljəˈmɪniəm;ˌæləˈmɪniəm | слушай |
| 14 | Кремний | Си | ˈsɪlɪkən | слушай |
| 15 | Фосфор | Р | ˈfɒsfərəs ˈfɑːsfərəs | слушай |
| 16 | Сера | С | ˈsʌlfə(r) ˈsʌlfər | слушай |
| 17 | Хлор | Кл | ˈklɔːriːn | слушай |
| 18 | Аргон | Ар | ˈɑːɡɒn ˈklɔːriːn | слушай |
| 19 | Калий | К | pəˈtæsiəm | слушай |
| 20 | Кальций | Са | ˈkælsiəm | слушай |
| 21 | Скандий | Sc | ˈskændiəm | слушай |
| 22 | Титан | Ти | tɪˈteɪniəm | слушай |
| 23 | Ванадий | В | vəˈneɪdiəm | слушай |
| 24 | Хром | Кр | тысяч рублей тысяч рублей | слушай |
| 25 | Марганец | Мн | ˈmæŋɡəniːz | слушай |
| 26 | Железо | Фе | ˈaɪən ˈaɪərn | слушай |
| 27 | Кобальт | Ко | ˈkəʊbɔːlt ˈkoʊbɔːlt | слушай |
| 28 | Никель | Ni | nɪkl | слушай |
| 29 | Медь | Медь | ˈkɒpə(r) ˈkɑːpər | слушай |
| 30 | Цинк | Цинк | номер | слушай |
| 31 | Галлий | Га | ˈɡæliəm | слушай |
| 32 | Германий | Гэ | dʒɜːˈmeɪniəm dʒɜːrˈmeɪniəm | слушай |
| 33 | Мышьяк | Как | ˈɑːsnɪk ˈɑːrsnɪk | слушай |
| 34 | Селен | Se | səˈliːniəm | слушай |
| 35 | Бром | Бр | ˈbrəʊmiːn ˈbroʊmiːn | слушай |
| 36 | Криптон | Кр | ˈkrɪptɒn ˈkrɪptɑːn | слушай |
| 37 | Рубидий | руб | rʊˈbɪdiəm | слушай |
| 38 | Стронций | Ср | ˈstrɒntiəm;ˈstrɒnʃiəm ˈstrɑːntiəm;ˈstrɑːnʃiəm | слушать |
| 39 | Иттрий | Д | ˈɪtriəm | слушай |
| 40 | Цирконий | Зр | zɜːˈkəʊniəm zɜːrˈkoʊniəm | слушай |
| 41 | Ниобий | № | naɪˈəʊbiəm naɪˈoʊbiəm | слушай |
| 42 | Молибден | Пн | məˈlɪbdənəm | слушать |
| 43 | Технеций | ТК | tekˈniːʃɪəm | слушай |
| 44 | Рутений | Ру | ruːˈθiːniəm | слушай |
| 45 | Родий | Рх | ˈrəʊdiəm ˈroʊdiəm | слушай |
| 46 | Палладий | Пд | pəˈleɪdiəm | слушай |
| 47 | Серебро | Аг | ˈsɪlvə(r) ˈsɪlvər | слушай |
| 48 | Кадмий | CD | ˈkædmiəm | слушай |
| 49 | Индий | В | ˈɪndiəm | слушай |
| 50 | Олово | Сн | тɪн | слушай |
| 51 | Сурьма | Сб | ˈæntɪməni ˈæntɪmoʊni | слушай |
| 52 | Теллур | Те | teˈljʊəriəm teˈlʊriəm | слушай |
| 53 | Йод | я | ˈaɪədiːn ˈaɪədaɪn | слушай |
| 54 | Ксенон | Хе | ˈzenɒn;ˈziːnɒn ˈzenɑːn;ˈziːnɑːn | слушай |
| 55 | Цезий | цезий | ˈsiːziəm | слушай |
| 56 | Барий | Ба | ˈbeəriəm ˈberiəm | слушай |
| 57 | Лантан | Ла | ˈlænθənəm | слушай |
| 58 | Церий | Се | ˈsɪəriəm ˈsɪriəm | слушай |
| 59 | Празеодим | Пр | ˌpreɪziəʊˈdɪmiəm ˌpreɪzioʊˈdɪmiəm | слушай |
| 60 | Неодим | Нд | ˌniːəʊˈdɪmiəm ˌniːoʊˈdɪmiəm | слушай |
| 61 | Прометий | вечера | prəˈmiːθiəm prəˈmiːθiəm | слушай |
| 62 | Самарий | См | səˈmeəriəm səˈmeriəm | слушай |
| 63 | Европий | ЕС | jʊərˈəʊpiəm jʊrˈoʊpiəm | слушай |
| 64 | Гадолиний | Гд | ˌɡædəˈlɪniəm | слушай |
| 65 | Тербий | Тб | ˈtɜːbiəm ˈtɜːrbiəm | слушай |
| 66 | Диспрозий | Дай | dɪsˈprəʊziəm dɪsˈproʊziəm | слушай |
| 67 | Гольмий | Хо | ˈhəʊlmiəm ˈhoʊlmiəm | слушай |
| 68 | Эрбий | Er | ˈɜːbiəm ˈɜːrbiəm | слушай |
| 69 | Тулий | Тм | ˈθuːliəm;ˈθjuːliəm ˈθjuːliəm | слушай |
| 70 | Иттербий | Ыб | ɪˈtɜːbiəm ɪˈtɜːrbiəm | слушай |
| 71 | Лютеций | Лу | luːˈtiːʃiəm;luːˈtiːsiəm luːˈtiːʃiəm | слушай |
| 72 | Гафний | Хф | ˈhæfniəm | слушай |
| 73 | Тантал | Та | ˈtæntələm | слушай |
| 74 | Вольфрам | Вт | ˈtʌŋstən | слушай |
| 75 | Рений | перед | ˈriːniəm | слушай |
| 76 | Осмий | ОС | ˈɒzmiəm ˈɑːzmiəm | слушай |
| 77 | Иридий | Ир | ɪˈrɪdiəm | слушай |
| 78 | Платина | Пт | plætɪnəm | слушай |
| 79 | Золото | Золото | ɡəʊld ɡɡəʊld | слушай |
| 80 | Меркурий | рт. ст. ст. | ˈmɜːkjəri ˈmɜːrkjəri | слушай |
| 81 | Таллий | Тл | ˈθæliəm | слушай |
| 82 | Свинец | Пб | светодиод | слушай |
| 83 | Висмут | Би | ˈbɪzməθ | слушай |
| 84 | Полоний | По | pəˈləʊniəm pəˈloʊniəm | слушай |
| 85 | Астатин | В | ˈæstətiːn | слушай |
| 86 | Радон | Рн | ˈreɪdɒn ˈreɪdɑːn | слушай |
| 87 | Франций | Пт | frænsiəm | слушай |
| 88 | Радий | Ра | ˈreɪdiəm | слушай |
| 89 | Актиний | Ас | ækˈtɪniəm | слушай |
| 90 | Торий | -й | -йˈθɔːriəm | слушай |
| 91 | Протактиний | Па | ˌprəʊtækˈtɪniəm ˌproʊtækˈtɪniəm | слушай |
| 92 | Уран | У | juˈreɪniəm | слушай |
| 93 | Нептуний | Нп | nepˈtjuːniəm nepˈtjuːniəm;nepˈtuːniəm | слушай |
| 94 | Плутоний | Пу | pluːˈtəʊniəm pluːˈtoʊniəm | слушай |
| 95 | Америций | Ам | ˌæməˈrɪsiəm;ˌæməˈrɪʃiəm | слушай |
| 96 | Кюриум | См | ˈkjʊəriəm ˈkjʊriəm | слушай |
| 97 | Берклиум | Бк | bɜːˈkiːliəm;ˈbɜːkliəm ˈbɜːrkliəm | слушай |
| 98 | Калифорния | См. | ˌkælɪˈfɔːniəm ˌkælɪˈfɔːrniəm | слушай |
| 99 | Эйнштейний | Эс | aɪnˈstaɪniəm aɪnˈstaɪniəm | слушай |
| 100 | Фермиум | ФМ | ˈfɜːmiəm ˈfɜːrmiəm | слушай |
| 101 | Менделевий | Мд | ˌmendəˈliːviəm;ˌmendəˈleɪviəm | слушай |
| 102 | Нобелий | № | nəʊˈbiːliəm;nəʊˈbeliəm noʊˈbiːliəm;noʊˈbeliəm | слушай |
| 103 | Лоуренсиум | Лр | lɒˈrensiəm lɔːˈrensiəm | слушай |
| 104 | Резерфордий | РФ | ˌrʌðəˈfɔːdiəm ˌrʌðərˈfɔːrdiəm | слушай |
| 105 | Дубниум | Дб | ˈdʌbniəm ˈduːbniəm | слушать |
| 106 | Сиборгиум | Сг | siːˈbɔːɡiəm ˈsiːˈbɔːrɡiəm | слушай |
| 107 | Борий | Бх | ˈbɔːriəm | слушай |
| 108 | Хассиум | Гс | ˈhæsiəm | слушай |
| 109 | Мейтнерий | Мт | maɪtˈnɪəriəm maɪtˈnɪriəm | слушать |
| 110 | Дармштадтиум | Дс | ˈdɑːmʃtætiəm ˈdɑːrmʃtætiəm | слушай |
Мартин
Комментарии закрыты.
Этот веб-сайт использует файлы cookie для улучшения вашего опыта. Мы предполагаем, что вы согласны с этим, но вы можете отказаться, если хотите. Настройки файлов cookieПРИНЯТЬ
Политика конфиденциальности и использования файлов cookie
Единственный справочник по чешскому произношению, который вам когда-либо понадобится
Загрузите БЕСПЛАТНОЕ руководство по чешскому алфавиту!
Если вы хотите овладеть чешским языком и говорить свободно, вы должны сначала выучить буквы чешского алфавита. И вам нужны физические рабочие листы для практики.
Эта электронная книга НЕОБХОДИМА для всех, кто только начинает изучать чешский язык!
Скачайте БЕСПЛАТНО Практика чешского языка в формате PDF сегодня и выучите чешский язык в кратчайшие сроки!
Это обязательное руководство для начинающих
Похожие уроки
Содержание
- Введение в чешское произношение
- Почему правильное произношение в чешском языке важно?
- Секреты изучения правильного чешского произношения
- Как скачать бесплатную электронную книгу на чешском языке
- Связанные уроки
1.
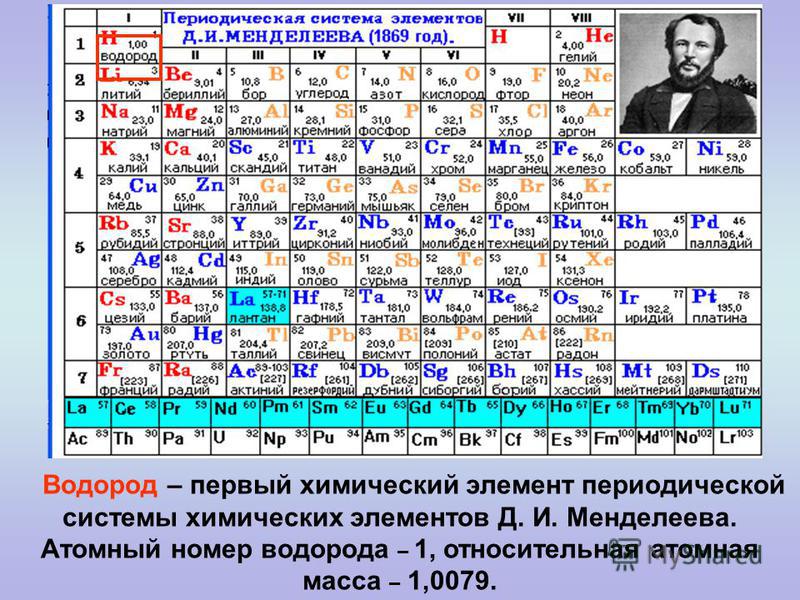 Знакомство с чешским произношением
Знакомство с чешским произношениемTop
Большим преимуществом чешского языка является то, что, в отличие от английского, он произносится так же, как и пишется. Однако для того, чтобы произносить все звуки, которые содержит чешский язык, в сочетании с латинским алфавитом используются дополнительные буквы с диакритическими знаками (маленькие знаки над буквой). Диакритических знаков всего несколько – хачек (крючок), чарка (отметка длины), кружек (круг), и они изменяют произношение буквы. При написании они выглядят так: háček (č), charka (á), kroužek (ů).
Прежде чем перейти к чешским звукам, давайте быстро вспомним систему письма, просто чтобы познакомиться с произношением. Чешский алфавит состоит из 42 букв, из которых 26 такие же, как в английском, плюс 16 дополнительных с диакритическими знаками. Это 8 лишних гласных (á, é, í, ý, ó, ú/ů, ě) и 8 лишних согласных (ž, š, č, ř, ď, ť, ň плюс «ch»). «Ch» в чешском алфавите считается одной буквой и занимает особое место после «h». Его произношение отличается от английского.
Его произношение отличается от английского.
1) Согласные
Чешские согласные делятся на четыре категории:
- твердые – (h, ch, k, r, g, d, t, n)
- мягкий – (ž, š, č, ř, c, j, ď, ť, ň)
- амбивалентный – (b, f, l, m, p, s, v, z)
- необычный – (q, w, x). Они почти исключительно используются только в иностранных словах
Это деление важно с точки зрения склонения (способ изменения окончаний существительных, местоимений и числительных в чешском языке) и способов написания.
Обратите внимание, что произношение (p, t, k) в чешском языке не сопровождается придыханием (струей воздуха), как в английском языке. Следовательно, эти звуки будут иметь более резкое, перевернутое и сухое звучание, чем обычные звуки p, t, k с придыханием в английском и большинстве других западноевропейских языков.
Произношение твердых согласных (эффект грубого звука)
- h произносится как [h] в слове «твердый» (без придыхания)
- ch произносится как [j] в испанском имени «Хосе»
- k произносится как [k] в слове «King» (без придыхания)
- r произносится как [r] в слове «Грузовик», но более взволнованно (язык вибрирует, когда r скатывается с языка)
- g произносится как [g] в слове «Grow» (не так, как вообще!)
- d произносится как [d] в слове «собака», но звучит тверже
- t произносится как [t] в слове «Table», но более твердый звук «t»
- n произносится как [n] в слове «Норвегия»
Произношение мягких согласных (эффект мягкого звука)
- ž произносится как «Версия».

- š произносится как «Short».
- č произносится как «чешский».
- ř произносится нажатием кончика языка на нёбо, при этом остальная часть языка может свободно вибрировать.
- ď произносится так же, как в «Герцог», но мягче.
- ť произносится как в «Репетиторе», но мягче.
- ň произносится как «Новый», но мягче.
- c произносится как в «Улицах».
- j произносится как «Ярд».
Чтобы произнести ď, ť, ň, кончик языка нужно приложить к задней
верхней десне и над передними зубами. Звук должен быть похож на д, т, н, но намного мягче.
Произношение амбивалентных согласных
(может быть мягким или твердым в зависимости от обстоятельств)
- B произносится как [b] в слове «Большой».
- F произносится как [f] в слове «Ферма».
- L произносится как [l] в слове «Lonely».
- М произносится как [м] в слове «Утро».
- P произносится как [p] в слове «Push» (без придыхания)
- S произносится как [s] в слове «Similar».

- V/W произносится как [v] в слове «Victim».
- Z произносится как [z] в «Zoo».
Произношение необычных согласных
(встречаются в иностранных заимствованных словах)
- Q как [q] в «Quick»
- Нравится [v] в «Жертве»
- X нравится [x] в «Сложном»
2) Гласные
В чешском языке есть долгие и краткие гласные. Долгие гласные должны произноситься длиннее кратких, и длина должна быть заметной. Долгая гласная обозначается долгой чертой (čárka) над буквой. Выглядит это так: á, í или в случае буквы u есть два типа ú с длинным знаком (čárka) и ů с маленьким кружочком (kroužek). Оба произносятся одинаково.
Произношение 7 коротких гласных (a, e, i/y, o, u, ě)
- a произносится как [a] в «But».
- e произносится как [e] в слове «Met».
- i/y также произносится как [i] в слове «сидеть».
- o произносится как [o] в слове «опустить».
- u произносится как [u] в слове «Смотри».

- ě произносится как [y+e] в слове «Да».
Произношение 7 долгих гласных (á, é, í/ý, ó, ú/ů)
- á произносится как [a] в слове «Отец»
- é произносится как [e] в «Shed», но длиннее
- í/ý произносится как [ i ] в «Cheep».
- — произносится как [ o ] в «Fall».
- ú/ů произносится как [u] в слове «School», но длиннее
Произношение мягких i / í и твердых y / ý в чешском языке одинаково по звучанию.
Гласные ú / ů также произносятся одинаково, хотя пишутся по-разному. Эта форма двух разных написаний связана с историей развития чешского языка.
С точки зрения грамматики гласная ú всегда пишется в начале слова (например, úkol = «задача») или после префикса (например, zúročit = «платить проценты за что-то»).
С другой стороны, гласная ů всегда ставится в основе слова (kůže = «кожа») или в конце (domů = («идти домой»).
При написании отдельных букв чешского алфавита, звуки следующие:
а [ á ], б [ бе ], с [ с ], č [ че ], д [ де ], ď [ ďé ], е [ é ], f [ эф ], g [ gé ], h [ há ], ch [ chá ], i [ í ], y [ ý ], j [ jé ], k [ ká ], l [ el ], m [ em ], n [ en ], ň [ eň ], о [ ó ], p [ pé ], q [ qé ], r [ er ], ř [ eř ], s [ es ], š [ eš], t [ té ], t´[ t´ é ], u / ú / ů [ ú ], v [ вэ ], w [ двожите вэ ], x [ икс ], y / ý [ ypsilon / ý ], z [ зэт ], ž [ жет ] .
Например:
ČSAD = [čé-es-á-dé] = České autobusové dráhy (“Чешские автобусные маршруты”)
Диакритические знаки очень важны, и их нельзя опускать, поскольку они часто меняют значение слова. . Если слово произносится слишком коротко или слишком долго, значение становится другим.
Вот пример того, что может произойти при неправильном произнесении:
- byt = «квартира» X být = «быть»
- žila = “(она) жила” X žíla = “кровеносный сосуд”.
2. Почему правильное произношение в чешском языке важно?
Верх
Правильное произношение важно, очень важно. Некоторые говорят, что это даже важнее, чем идеальное знание грамматики! С чего бы это?
1) Хорошее понимание
Если при изучении чешского языка для вас важно общение с носителями языка, вам необходимо, чтобы вас понимали, когда вы говорите, и вы должны уметь понимать носителей языка. Ведь без понимания назначение языка ничтожно! Чтобы быть понятым, нужно уметь говорить на языке так, чтобы он был знаком носителям языка или, по крайней мере, был узнаваем ими.
Изучая новый язык, вы поймете, что чем больше вы продвигаетесь, тем сложнее он становится! Например, почти в каждом языке есть словарный запас, который может выглядеть одинаково на письме, но поскольку слова произносятся по-разному, они имеют очень разные значения. Это означает, что вы можете произнести слово по-чешски, и из-за небольшого изменения произношения значение слова полностью изменится. Понятно, что это может привести к довольно неловким ситуациям! В худшем случае ваш неправильно произнесенный чешский язык будет звучать искаженно для носителя языка.
Знание нюансов произношения слова или буквы также поможет вам лучше понимать разговорный чешский язык.
Не беспокойтесь, если вам будет тяжело; вы учитесь, и с нашей помощью в CzechClass101 у вас не будет проблем с неправильным произношением, если вы будете внимательно следовать нашим советам и примерам.
2) Хорошее общение
Неправильное произношение чешского или любого другого языка может привести к большому разочарованию, потому что вы не можете выразить то, что имеете в виду, и вас не поймут правильно. Даже если у вас есть полное знание чешской грамматики и вы можете написать ее как носитель языка, незнание того, как правильно говорить на ней, только создаст очень неприятное общение со всеми вокруг.
Даже если у вас есть полное знание чешской грамматики и вы можете написать ее как носитель языка, незнание того, как правильно говорить на ней, только создаст очень неприятное общение со всеми вокруг.
3) Хорошее впечатление
Даже если вы новичок, вы сможете правильно говорить на любом языке. Таким образом, вы обязательно произведете хорошее впечатление на носителей языка, и когда вы будете говорить более бегло, вы, вероятно, заработаете гораздо больше уважения, чем неуклюжий новичок, который не особо заботится о правильном произношении.
Люди часто проявляют большое терпение к тому, кто учится говорить на новом языке, но носители языка с большей вероятностью будут обращаться к вам и вступят с вами в разговор, если вы усердно поработаете над своим акцентом. Это просто потому, что вы сможете понять друг друга! Таким образом, мастерство произношения может означать разницу между отсутствием или большим количеством друзей, говорящих по-чешски. Это также сослужит вам хорошую службу на рабочем месте и сделает вас популярным среди чешскоязычных менеджеров, работодателей или сотрудников.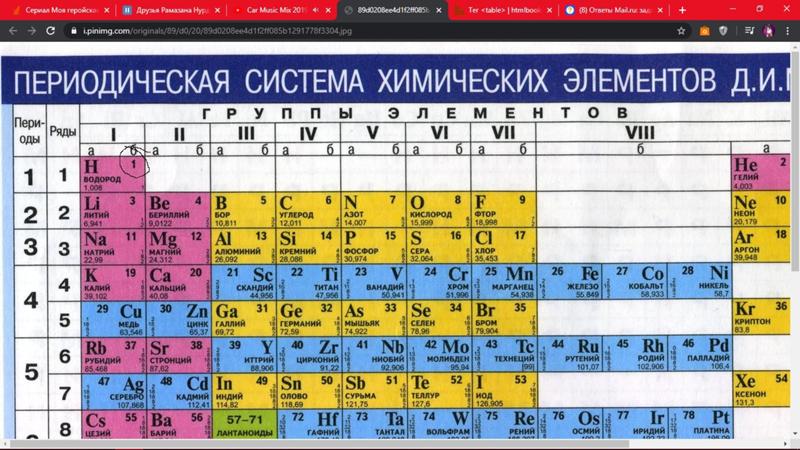
Научиться правильно говорить по-чешски – это еще и знак уважения не только к языку, но и к носителям языка и их обычаям.
3. Секреты правильного чешского произношения
Top
1) Используйте инструменты для записи голоса, чтобы улучшить свое произношение использование наших записей с носителями чешского языка. Они доступны не только для того, чтобы продемонстрировать вам, как следует произносить чешский словарь, но также предложения и диалоги. Смотрите и слушайте их снова и снова, чтобы тренировать свой слух, и следите за устами учителя, когда он говорит на видеоуроках. Затем скопируйте речь как можно лучше. Позже вы можете записать себя, чтобы услышать, звучите ли вы как носитель языка, и сравнить себя с носителями языка. Отлично подходит для самомотивации.
2) Потренируйтесь перед зеркалом.
И убедитесь, что вы копируете правильные движения губ и рта.
3) Используйте наш словарь CzechClass101!
Используйте чешский словарь, предоставленный CzechClass101, для поиска слов и прослушивания произношения. Это будет иметь большое значение для того, чтобы дать вам представление о том, как правильно произносить слово или букву.
Это будет иметь большое значение для того, чтобы дать вам представление о том, как правильно произносить слово или букву.
4) Тренируй свой слух к языку!
Старайтесь чаще слушать чешскую музыку и записанные книги, а также смотреть много чешских фильмов и/или телепередач на чешском языке. Это приучит ваш слух к языку, и вы удивитесь, как быстро уловите акцент. Помните, именно так мы учились говорить, когда были маленькими — в основном, слушая, как говорят взрослые, и повторяя то, что они говорят!
5) Практика, практика, практика…
Повторение одного и того же может быть скучным, но при изучении нового языка вы создаете новые пути в своем мозгу. Чтобы они остались и стали привычными, вам нужно часто повторять правильное произношение.
6) Подружитесь с носителем чешского языка.
Не стесняйтесь обращаться к ним по-чешски! Попросите их исправить вас, когда вы сделаете ошибку в произношении – это прекрасный способ попрактиковаться и выучить язык из первых рук, а также завести новых друзей.
7) Тренируйте произношение с преподавателем чешского языка!
Если вы серьезный студент и не знаете, где познакомиться с носителями чешского языка, рассмотрите возможность инвестирования в план Premium PLUS от CzechClass101. Это означает, что у вас будет собственный учитель чешского языка, с которым можно попрактиковаться в произношении, и многое другое! Отправляйте записи своего разговора по-чешски и получайте отзывы от своего преподавателя чешского языка.
4. Как скачать бесплатное руководство по чешскому алфавиту
Top
Загрузите БЕСПЛАТНОЕ руководство по чешскому алфавиту!
Если вы хотите овладеть чешским языком и говорить свободно, вы должны сначала выучить буквы чешского алфавита. И вам нужны физические рабочие листы для практики.
Эта электронная книга НЕОБХОДИМА для всех, кто только начинает изучать чешский язык!
Скачайте БЕСПЛАТНО Практика чешского языка в формате PDF сегодня и выучите чешский язык в кратчайшие сроки!
Это обязательное руководство для начинающих
Войдите в систему со своей бесплатной пожизненной учетной записью, и мы предоставим вам учебное пособие по чешскому языку в формате PDF, которое охватывает буквы алфавита, рабочие листы и викторину, чтобы проверить себя… — абсолютно БЕСПЛАТНО!
3 причины учить чешский язык с помощью уроков в формате PDF
Давайте теперь подробнее рассмотрим, как изучение чешского языка в формате PDF может помочь вам достичь своей мечты вдвое быстрее, чем обычные видео- или аудиоуроки!
① Экономия минут на тарифном плане
Изучение чешского языка с помощью уроков в формате PDF может значительно сократить использование данных. После загрузки урока или инструмента вы можете получить к нему доступ в автономном режиме через свой компьютер или смартфон в любое время и в любом месте, независимо от доступа в Интернет. И как только вы загрузите уроки чешского языка в формате PDF, вы действительно сможете получить к ним доступ быстрее, чем заходить в систему и пытаться сделать это через действующий сайт. Таким образом, изучение чешского с помощью уроков в формате PDF не только сэкономит минуты на вашем тарифном плане, но и значительно сэкономит ваше время, а уроки суммируются!
После загрузки урока или инструмента вы можете получить к нему доступ в автономном режиме через свой компьютер или смартфон в любое время и в любом месте, независимо от доступа в Интернет. И как только вы загрузите уроки чешского языка в формате PDF, вы действительно сможете получить к ним доступ быстрее, чем заходить в систему и пытаться сделать это через действующий сайт. Таким образом, изучение чешского с помощью уроков в формате PDF не только сэкономит минуты на вашем тарифном плане, но и значительно сэкономит ваше время, а уроки суммируются!
② Распечатайте и возьмите с собой все уроки чешского языка и PDF-инструменты в любом месте
Иногда крошечного экрана смартфона недостаточно, особенно когда вы пытаетесь узнать что-то новое. Самое замечательное в уроках, инструментах или файлах в формате PDF то, что их можно быстро распечатать и взять с собой куда угодно после загрузки. На самом деле, распечатка уроков чешского в формате PDF может сэкономить вам время по сравнению с просмотром материала на смартфоне с маленьким экраном — даже с учетом дополнительного времени на печать!
③ Отличное учебное пособие для улучшения запоминания и усвоения материала
Изучение видео- или аудиоуроков онлайн — отличный способ выучить язык, поскольку учащиеся могут воспроизводить и перематывать фрагменты столько раз, сколько необходимо, пока урок не будет освоен.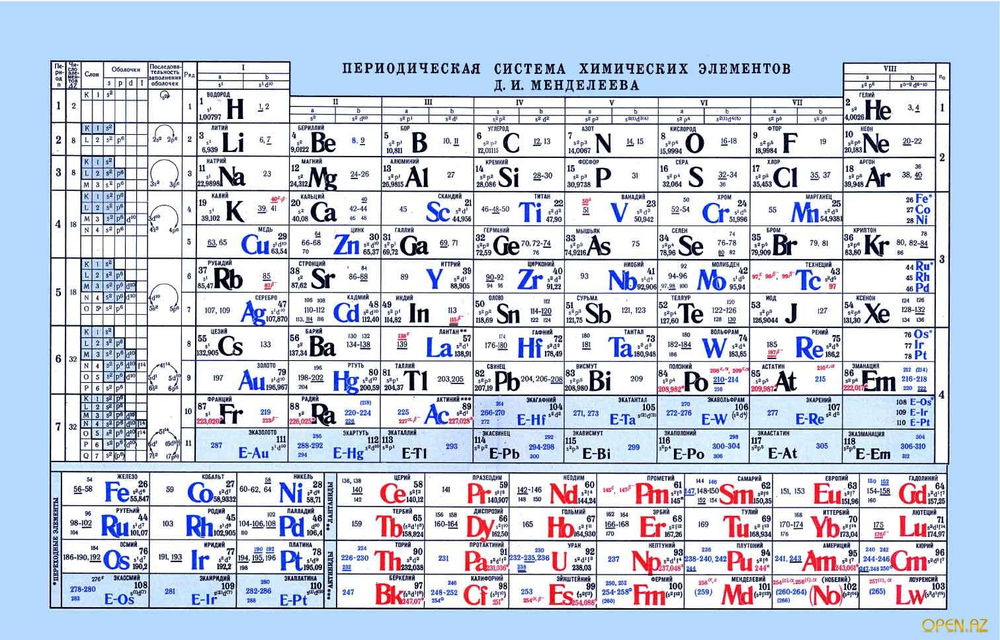 Но когда вы снова просматриваете те же уроки чешского языка в формате PDF, происходит невероятная вещь: ваше запоминание значительно улучшается! Благодаря повторению с временными интервалами повторное видение информации в письменном формате помогает укрепить информацию в вашем уме и улучшить как ее запоминание, так и припоминание. Преимущества изучения чешского языка с помощью уроков в формате PDF быстро складываются в значительную экономию времени для вас, вашего тарифного плана и вашей мечты об изучении нового языка!
Но когда вы снова просматриваете те же уроки чешского языка в формате PDF, происходит невероятная вещь: ваше запоминание значительно улучшается! Благодаря повторению с временными интервалами повторное видение информации в письменном формате помогает укрепить информацию в вашем уме и улучшить как ее запоминание, так и припоминание. Преимущества изучения чешского языка с помощью уроков в формате PDF быстро складываются в значительную экономию времени для вас, вашего тарифного плана и вашей мечты об изучении нового языка!
Почему мы его раздаем?
Обучение чтению и письму является обязательным для всех начинающих. Несмотря на то, что вы получаете видеоуроки о том, как писать на чешском языке в CzechClass101, вам все равно понадобятся рабочие листы для практики. Вот почему вы получаете это учебное пособие в формате PDF в подарок.
5. Похожие уроки
Top
Вы знаете, как поздороваться по-чешски? Это самая основная фраза, которую вам нужно будет произнести и услышать в повседневной жизни.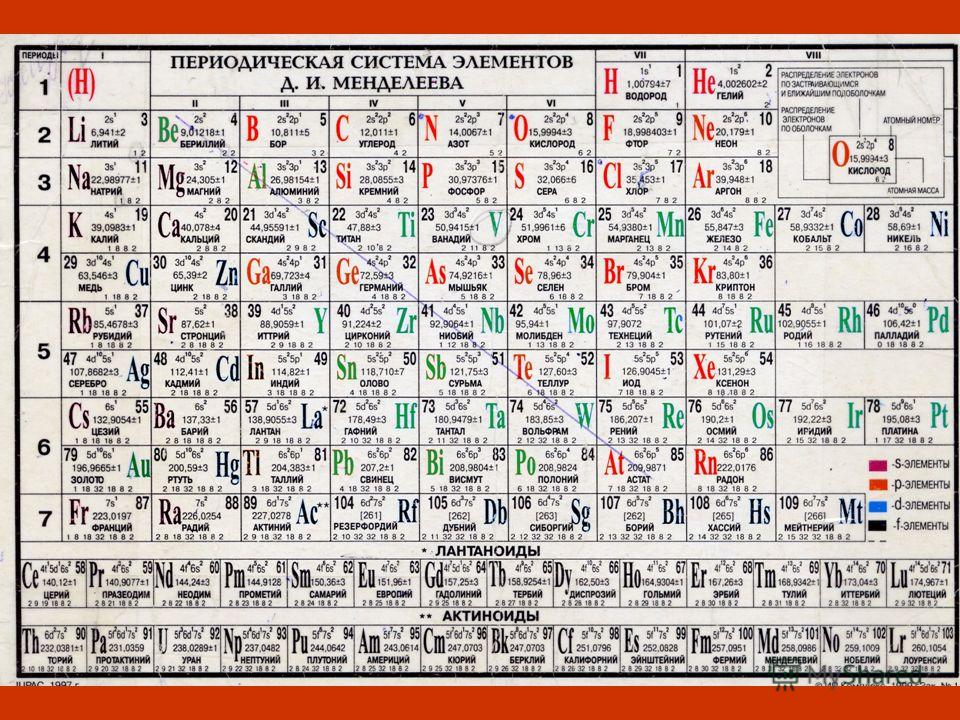 Если вы еще не знаете, изучите 15 способов поздороваться и поприветствовать других на чешском языке. Почему 15? Чем больше вариаций вы знаете, тем больше вы можете говорить и тем более свободно вы становитесь!
Если вы еще не знаете, изучите 15 способов поздороваться и поприветствовать других на чешском языке. Почему 15? Чем больше вариаций вы знаете, тем больше вы можете говорить и тем более свободно вы становитесь!
Научитесь здороваться
Можете ли вы представиться на чешском языке? Не волнуйся! Ознакомьтесь с 10 чешскими линиями, которые вам нужны, чтобы представиться, с помощью этого бесплатного обзорного листа. От «Меня зовут…» и «Я живу в…» до «Мои увлечения…» Просто просмотрите 10 строк. Это займет у вас всего 2 минуты. Затем представьтесь в разделе комментариев ниже!
Проверьте это
Узнайте все, что вам нужно знать о чешском алфавите. В CzechClass101 мы знакомим вас с чешским письмом простыми и понятными шагами, и вы можете попросить совета или помощи в любом месте. Важно с самого начала полностью овладеть чешским алфавитом.
Выучить чешский алфавит
Кто-нибудь благодарил вас сегодня? Мы будем.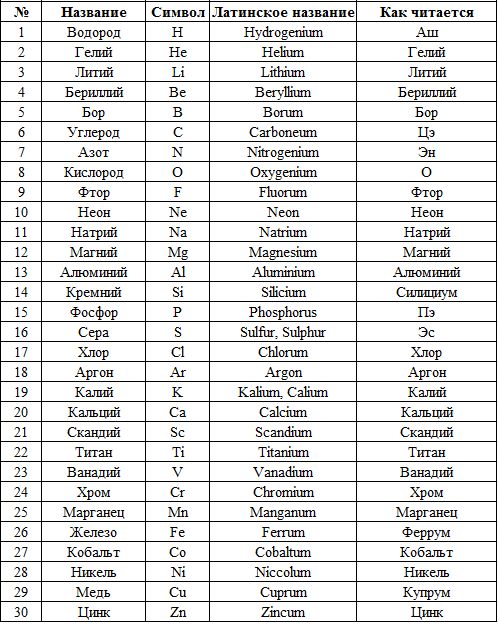 Спасибо, что читаете эту статью и учитесь вместе с нами! На самом деле, сегодня вы узнаете много разных способов сказать «Спасибо» по-чешски. Это одна из самых важных чешских фраз. Проверьте это и посмотрите видео, чтобы попрактиковаться в произношении.
Спасибо, что читаете эту статью и учитесь вместе с нами! На самом деле, сегодня вы узнаете много разных способов сказать «Спасибо» по-чешски. Это одна из самых важных чешских фраз. Проверьте это и посмотрите видео, чтобы попрактиковаться в произношении.
Check Out the Post
Средство проверки произношения в App Store
Описание
Проверьте свое произношение, аудирование, чтение и правописание с помощью nunci, вашего личного тренера по произношению. Эффективно изучайте языки с помощью наших интеллектуальных карточек.
nunci — это интеллектуальная тетрадь для изучения языка, помощник и тренер, который помогает вам записывать то, что вы изучаете, и эффективно изучать то, что вы записываете, чтобы вы могли экономить время, учиться эффективно и сосредоточиться на самом важном. Подобно вашему личному учителю, nunci автоматически создаст для вас уроки на основе созданных вами заметок.
• Создавайте мультимедийные заметки из своей жизни и окружающего мира
• Изучайте свои заметки с помощью наших автоматически создаваемых карточек с интеллектуальным расписанием
• Практикуйте свое произношение с конкретными отзывами о своих ошибках
• Практикуйтесь в прослушивании с естественным звучанием HD-голосов
• Отслеживайте свои успехи с помощью нашей надежной статистики
• Персонализированные напоминания, которые помогут вам придерживаться своих целей
Узнайте больше: https:/ /nunci. app/blog/
app/blog/
Условия использования: https://nunci.app/terms/
Политика конфиденциальности: https://nunci.app/privacypolicy/
Версия 2.16.3
Я люблю вносить изменения и улучшения в нунци. Присылайте отзывы в любое время, чтобы я мог продолжать совершенствоваться.
Что нового:
– улучшения производительности
– общие исправления ошибок
Рейтинги и обзоры
22 Оценки
Превосходно!
Надежный и красивый инструмент для изучения языка. Раньше просто использовал приложение для заметок, чтобы сохранять новые слова и фразы, которые я выучил, но никогда не возвращался к ним.
Nunci значительно упрощает повторение и практику языка. Также очень приятный дизайн. Очень рекомендую!
Спасибо за теплый отзыв! Пожалуйста, поделитесь nunci, если вы думаете, что это поможет другим 🙏 Если мы можем что-то улучшить, пожалуйста, не стесняйтесь, присылайте нам отзывы 🙂
Очень обидно.
Я использовал это приложение время от времени в течение нескольких недель, и, поскольку я не могу найти контактную информацию, чтобы сообщить об этом напрямую разработчику, я помещу информацию здесь: при использовании французской языковой части приложения, Я обнаружил, что даже носитель французского языка может идеально произнести слово, и приложение распознает его только на 20% правильно. Это бесполезно для тех, кто пытается научиться произносить по-французски, потому что, когда они делают это правильно, они получают неправильную обратную связь.
Пока это не исправлено. Приложение бесполезно и ненадежно, когда дело доходит до произношения.
Спасибо, что попробовали nunci. Приносим извинения за проблему с произношением, с которой вы столкнулись. В редких случаях одно или несколько слов вызывают проблемы. Если вы дадите мне больше информации, я могу диагностировать вашу проблему. Вы можете отправить мне отзыв прямо в настройках приложения или отправив электронное письмо по адресу [email protected]. С нетерпением жду Вашего ответа.
Использование ИИ для персонализации обучения
Я использовал несколько приложений для изучения языков. Это первый, который позволяет мне создавать свои собственные персонализированные уроки. Результаты в режиме реального времени позволяют мне узнать, в каких областях требуется дополнительная практика; читать, писать, говорить или слушать.
Я носитель английского языка, изучаю испанский.
г.Спасибо за теплый отзыв! Пожалуйста, поделитесь nunci, если вы думаете, что это поможет другим 🙏 Если мы можем что-то улучшить, пожалуйста, не стесняйтесь, присылайте нам отзывы 🙂
Разработчик, Nifty Apps, LLC, указал, что политика конфиденциальности приложения может включать обработку данных, как описано ниже. Для получения дополнительной информации см. политику конфиденциальности разработчика.
Данные, используемые для отслеживания вас
Следующие данные могут использоваться для отслеживания вас в приложениях и на веб-сайтах, принадлежащих другим компаниям:
- Расположение
- Идентификаторы
- Данные об использовании
- Диагностика
Данные, связанные с вами
Следующие данные могут быть собраны и связаны с вашей личностью:
- Расположение
- Идентификаторы
- Данные об использовании
- Диагностика
Данные, не связанные с вами
Могут быть собраны следующие данные, но они не связаны с вашей личностью:
- Расположение
- Пользовательский контент
- Диагностика
Методы обеспечения конфиденциальности могут различаться, например, в зависимости от используемых вами функций или вашего возраста.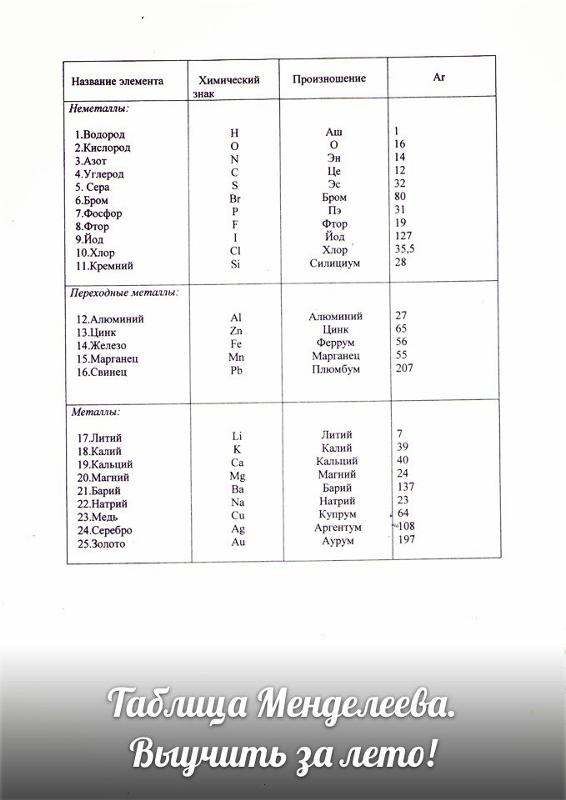

 Потому что произносится оно как [kjuː]. Наши преподаватели часто шутят, что можно отбросить четыре из пяти букв слова и все равно прочитать его правильно.
Потому что произносится оно как [kjuː]. Наши преподаватели часто шутят, что можно отбросить четыре из пяти букв слова и все равно прочитать его правильно. 


 Nunci значительно упрощает повторение и практику языка. Также очень приятный дизайн. Очень рекомендую!
Nunci значительно упрощает повторение и практику языка. Также очень приятный дизайн. Очень рекомендую!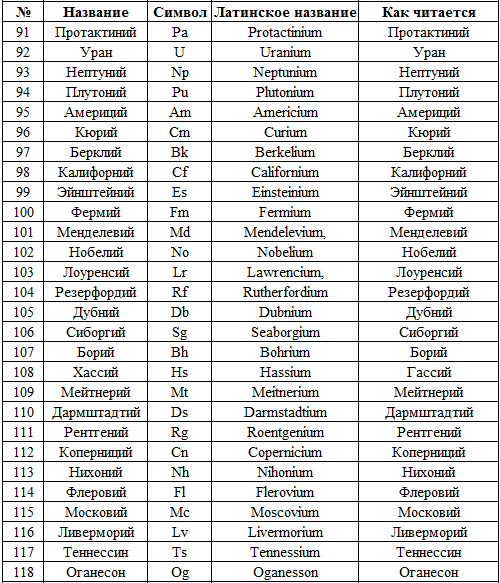 Пока это не исправлено. Приложение бесполезно и ненадежно, когда дело доходит до произношения.
Пока это не исправлено. Приложение бесполезно и ненадежно, когда дело доходит до произношения.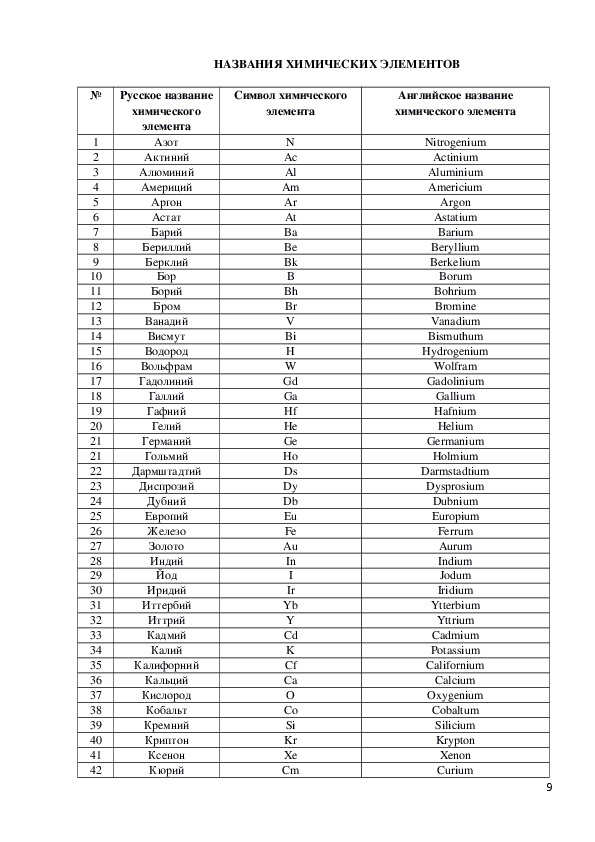 Я носитель английского языка, изучаю испанский.
Я носитель английского языка, изучаю испанский.