Символы химических элементов. Структура Периодической системы Д.И. Менделеева
Цель: познакомить учащихся с символами химических элементов, их названиями и произношениями; познакомить с этимологическими началами их названий, познакомить со структурой Периодической системы Д.И.Менделеева.
Задачи: Обучающие. Ввести понятие о знаках химических элементов и познакомить с этимологическими началами их названий, познакомить учащихся со структурой Периодической таблицы.

Планируемые результаты обучения. Знать структуру периодической системы Д.И.Менделеева, уметь описывать положение элемента в периодической системе, знать символы химических элементов, их произношения и понимать их происхождение.
Оборудование: компьютер, видеопроектор, электронное мультимедийное приложение к УМК “Химия. 8 класс” изд “Дрофа”; шаро–стержневые модели атомов и молекул, рабочие и информационные листы,
Подготовка к уроку: на столы выдаются для каждого ученика рабочие и информационные листы. Заранее на обратной стороне доски записывается тема и план урока, на другой доске с обратной стороны делается запись: “Две молекулы воды, под действием электрического ток разлагаются с образованием одной молекулы кислорода и двух молекул водорода”.
Приложение 1
Ход урока
1.
 Организационный момент
Организационный момент Проверка готовности к уроку.
2. Проверка домашнего задания. Актуализация знаний
Ученикам сообщают, что проверка домашнего задания проходит в виде “Аукциона знаний”, за правильные ответы учащиеся получают “жетоны знаний”, по количеству которых учитель оценивает активность учащихся на уроке.
Учитель: Вы начали изучать тему “Свойства веществ. Химические знаки и формулы” Я предлагаю вам вспомнить основные понятия прошлого урока. Что называется химическим элементом?
Ученик: химический элемент – это определённый вид атомов.
Учитель: – Что называется веществом?
Ученик: Вещество – это то, из чего состоят тела.
Учитель: Давайте подумаем, чем отличаются эти два понятия: “химический элемент” и “вещество”?
Ученики: химический элемент входит в состав
простых и сложных веществ, у него нет физических
и химических свойств; а вещество обладает
физическими и химическими свойствами. Например:
простое вещество кислород – газ, поддерживает
горение, входит в состав воздуха и необходим нам
для дыхания. Молекула простого вещества
кислорода образована двумя атомами
химического элемента кислорода.
Например:
простое вещество кислород – газ, поддерживает
горение, входит в состав воздуха и необходим нам
для дыхания. Молекула простого вещества
кислорода образована двумя атомами
химического элемента кислорода.
Учитель: – Из чего состоят вещества?
Ученик: вещества состоят из молекул, а молекулы состоят из атомов.
Учитель: На какие две группы делятся все вещества?
Ученик: вещества бывают простыми и сложными.
Учитель: – Какие вещества мы называем простыми веществами? (Демонстрирует шаро-стержневые модели молекул простых веществ – кислорода, озона, водорода, азота)
Ученик: простые вещества – это вещества, образованные атомами одного и того же химического элемента.
Учитель: – какие вещества мы называем сложными? (Демонстрирует шаро-стержневые модели молекул сложных веществ – воды, углекислого газа и серной кислоты)
Ученик: сложные вещества – это

Учитель: Итак, все вещества образованы атомами либо разными, либо одинаковыми!
– Сколько примерно этих видов атомов может быть? (Демонстрация во время вопроса– учитель разбирает несколько молекул веществ и выкладывает по одному шарику – “атому” разного цвета (вида) на демонстрационном столе)
Ученик: столько, сколько разных химических элементов в периодической системе, примерно 110.
Учитель: Молекула воды – сложное вещество
Предположения ученика: из сложных веществ можно получить простые вещества -кислород и водород.
Учитель: Верно. Давайте с вами проведём
пример реакции разложения на примере
шаростержневых молекул. Я приглашаю к доске двух
желающих, которые смогут провести это
превращение: из двух молекул воды получить
молекулы простых веществ.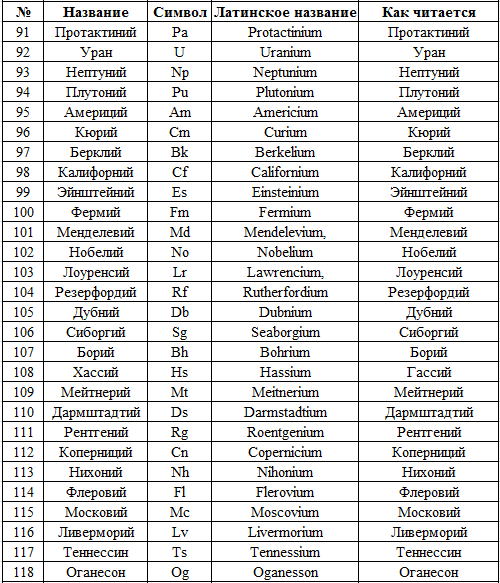
Каждому из двух учащихся выдаётся по две
шаростержневые модели молекул воды, перестроив
которые получают две молекулы водорода и одну
молекулу кислорода.
– Молекулы каких веществ вы получили? (Ответ: получили молекулы кислорода и водорода)
– Сколько получилось молекул каждого вещества из двух молекул воды? (Ответ: из двух молекул воды получилось две молекулы водорода и одна молекула кислорода)
– Почему для реакции мы взяли две молекулы воды? (Ответ: т.к. молекула кислорода состоит из двух атомов, а в состав молекулы воды входит один атом кислорода).
– Как вы думаете – реакция разложения воды –
это химическое явление или физическое? – Что
доказывает правильность вашего ответа? (Ответ:
химическое явление, т. к. в результате реакции
образуются новые вещества – кислород и водород).
к. в результате реакции
образуются новые вещества – кислород и водород).
Далее учитель обращает внимание, что при химической реакции, все связи, которые были между атомами в двух молекулах воды все израсходовались для образования молекул новых веществ.
Объяснение новой темы:
Учитель: Мы с вами грамотные люди и умеем писать. Я записала на доске реакцию разложения воды.
Демонстрация записи сделанной до урока на обратной стороне доски: “Две молекулы воды под действием электрического тока разлагаются на две молекулы водорода и одну молекулу кислорода”
– А кто является авторами славянской письменности – алфавита?
Ученик: болгарские просветитель Кирилл и Мефодий.
Учитель: мы знаем буквы алфавита, из них мы складываем слова, а из слов – пишем предложения.
Подобно русской письменности в химии есть тоже
буквы – химические символы.
На доске напротив записи сделанной заранее учитель пишет в ряд символы некоторых химических элементов и демонстрирует на примере шаростержневых молекул отдельные атомы.
Учитель: Атом кислорода обозначается
символом “О”, атом водорода обозначается
символом “Н”. С помощью химических символов мы
будем учиться писать слова – формулы
химических веществ. Например: молекулу воды
мы запишем “Н2О”, молекулу кислорода – “О2”,
молекулу водорода – “Н2”. А дальше из них
мы будем составлять уравнения химических
реакций.
Полное оформление демонстрационной записи на доске выглядит так:
|
Учитель: Итак, сегодня на уроке мы знакомимся
с “буквами” химического алфавита – символами
химических элементов.
Запишите тему сегодняшнего урока в своих тетрадях:
“СИМВОЛЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ”.
При изучении темы урока мы будем придерживаться следующего плана:
- Автор химической письменности.
- Принцип обозначения химических элементов.
- Периодическая система химических элементов Д.И.Менделеева.
- Этимологические начала названий химических элементов.
(Тема урока и план урока пишутся заранее, перед уроком, на обратной стороне доски.)
На протяжении всего урока во время беседы с учителем ученики, правильно отвечая на вопросы, получают такие жетоны:
Учитель: на первый и второй вопрос нашего плана я знаю, что уже некоторые учащиеся смогут ответить.
– Кто является автором химического алфавита? Как вы это узнали?
Учащийся: автором химического алфавита
является Йенс Якоб Берцелиус. Я эту информацию
нашёл в жетоне знаний.
Я эту информацию
нашёл в жетоне знаний.
Учитель: – Как Й.Я.Берцелиус предложил обозначать химические элементы?
Учитель: Шведский учёный Й.Я.Берцелиус предложил в качестве символов химических элементов использовать первую или первую и одну из последующих букв латинского названия элемента. Сейчас откройте учебник на странице 92, посмотрите на 4ю и 2ю колонки таблицы. В 4й колонке даны латинские названия некоторых химических элементов, а во второй – их химические символы
Пример:
Hidrogenium – Н – водород
Ferrum – Fe – железо
Magnium – Mg – магний
Mangants – Mn – марганец
Для чтения химических формул будем
использовать произношения химических
элементов. Возьмите информационный
лист №1 Там у вас есть такая же таблица, но
дополненная и с большим числом химических
элементов.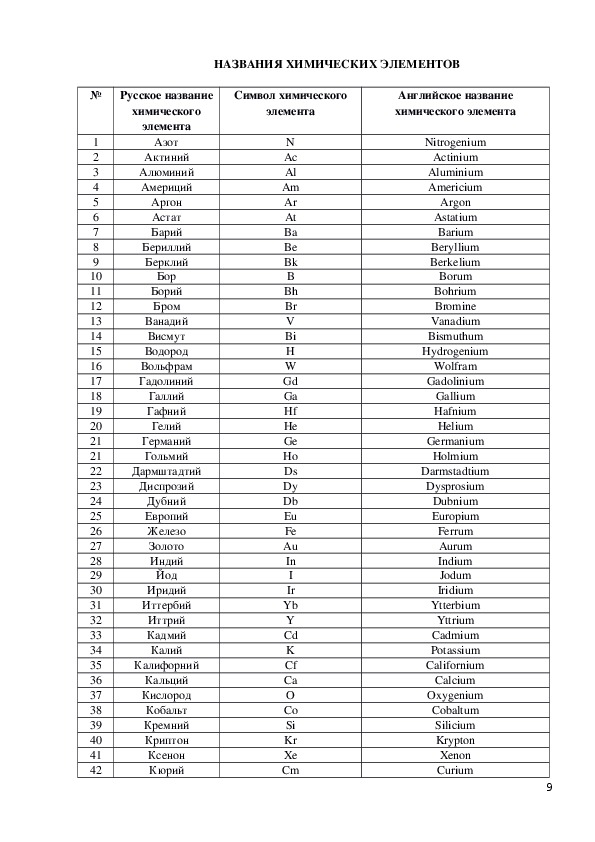 Она вам пригодится в дальнейшем.
Рассмотрим её. В 3ей колонке, обратите
внимание, на произношения химических элементов:
некоторые из них произносятся произношением
букв латинского алфавита, некоторые имеют такое
же произношение как и их русское название, а
некоторые произносятся латинским названием
элемента. В этом информационном листе 4я
и 5я колонки для вас интересная
информация об этимологии названия химических
элементов и названы учёные, открывшие данные
химические элементы.
Она вам пригодится в дальнейшем.
Рассмотрим её. В 3ей колонке, обратите
внимание, на произношения химических элементов:
некоторые из них произносятся произношением
букв латинского алфавита, некоторые имеют такое
же произношение как и их русское название, а
некоторые произносятся латинским названием
элемента. В этом информационном листе 4я
и 5я колонки для вас интересная
информация об этимологии названия химических
элементов и названы учёные, открывшие данные
химические элементы.
Таблицу, которая у вас в учебнике надо выучить
наизусть первые три колонки. К следующему уроку
выучите названия, символы и произношения первых
10 химических элементов (половина таблицы). Она
начинается на странице 83, вы учите элементы до
меди включительно, отметьте карандашом в
таблице. И сразу отметьте карандашом на странице
86 до слов “Обозначение состава вещества…. ”
второй абзац снизу – вы дома учите параграф 13 до
этих слов.
”
второй абзац снизу – вы дома учите параграф 13 до
этих слов.
Учитель: В таблице учебника вместилось всего 20 химических элементов.
– Сколько всего химических элементов? Откуда мы возьмём эти сведения?
Ученик: все известные химические элементы расположены в периодической таблице Д.И.Менделеева, их известно около 110 элементов.
Учитель: Правильно. Все известные химические
элементы расположены в периодической таблице
химических элементов Д.И.Менделеева.
Д.И.Менделеев – великий химик, русский учёный,
создатель периодической системы. На тот момент,
когда он составил таблицу было известно 63
химических элемента. Дмитрий Иванович хорошо
знал свойства каждого химического элемента и
расположил их так, что выделил группы элементов
сходных по химическим свойствам, и даже оставил
места в таблице ещё не изученным химическим
элементам. Дмитрий Иванович предугадал свойства
некоторых ещё не открытых элементов и указал
пути открытия этих элементов. О гениальности
этого учёного и его открытиях можно много
говорить, и для этого мы посвятим не один, а
несколько уроков. Сегодня мы должны
познакомиться со структурой периодической
системы химических элементов Д.И.Менделеева.
Дмитрий Иванович предугадал свойства
некоторых ещё не открытых элементов и указал
пути открытия этих элементов. О гениальности
этого учёного и его открытиях можно много
говорить, и для этого мы посвятим не один, а
несколько уроков. Сегодня мы должны
познакомиться со структурой периодической
системы химических элементов Д.И.Менделеева.
Учитель демонстрирует несколько вариантов периодической системы с разными цветовыми изображениями (демонстрационную, на форзаце учебника, на обложке дневников, …) и отмечает:
В любой периодической таблице изображены одни
и те же химические элементы, в одинаковой
последовательности. Гениальность этого творения
заключается в том, что она таит в себе очень много
информации о химических элементах, о
закономерностях их расположения, о строении
атомов химических элементов,… Поэтому изображая
периодические системы стараются выделить цветом
разные смысловые категории элементов. Каждая из
них удобна на разных этапах изучения химии.
Каждая из них находит в своё время удобное
применение.
Каждая из
них удобна на разных этапах изучения химии.
Каждая из них находит в своё время удобное
применение.
В нашей таблице (на форзаце учебника) цветом выделены красным цветом выделения элементы–неметаллы, а черным и зелёным – элементы-металлы.
– Приведите примеры элементов-неметаллов.
– Приведите примеры элементов-металлов.
По горизонтали эта таблица состоит из периодов.
Периоды – это горизонтальные ряды в периодической таблице химических элементов.
Периоды делятся на малые и большие, малые периоды имеют только 1 ряд элементов, а большие периоды – по 2 ряда элементов.
Сейчас внимательно посмотрите один видеосюжет, и после него вам надо будет ответить на вопросы.
Демонстрация видеосюжета мультимедийного
приложения к УМК “Химия. 8 класс” издание второе.
Изд “Дрофа” , 2006г Раздел “Введение. Предмет
химии”, урок 4 “Символы химических элементов. Периодическая система химических элементов
Д.И,Менделеева”, видеосюжет №12 “структурные
части Периодической системы Д.И.Менделева:
период”
Периодическая система химических элементов
Д.И,Менделеева”, видеосюжет №12 “структурные
части Периодической системы Д.И.Менделева:
период”
Учитель: Сейчас закрепим изученное понятие. В рабочих листах №1 самостоятельно допишите предложения 2,3,4. Через 2-3 минуты мы проверим ваши ответы.
Учитель спрашивает одного человека, проверяя правильность самостоятельного ответа, а учащиеся проверяют правильность своих записей.
Учитель: По вертикали периодическая система состоит из 8 групп. Группа – это вертикальный ряд элементов в Периодической системе Д. И. Менделеева.
Каждая группа, в свою очередь, подразделяется на две подгруппы: главную и побочную. Элементы главной подгруппы располагаются в малых и больших периодах, а элементы побочной подгруппы находятся только в больших периодах.
Сейчас внимательно посмотрите ещё один
видеосюжет, и после него опять выполним
следующие задания в рабочем листе №1.
Демонстрация видеосюжета мультимедийного приложения к УМК “Химия. 8 класс” издание второе. Изд “Дрофа” , 2006г Раздел “Введение. Предмет химии”, урок 4 “Символы химических элементов. Периодическая система химических элементов Д.И,Менделеева”, видеосюжет №13 “структурные части Периодической системы Д.И.Менделева: группы и подгруппы”
Учитель: допишите предложения 1,5,6,7 в рабочих листа №1. Через три минуты мы проверим правильность ваших ответов.
Учитель спрашивает одного человека, проверяя правильность самостоятельного ответа, а учащиеся проверяют правильность своих записей.
Учитель: А теперь, поучимся работать с периодической таблицей, ведь она не только великое творение Д.И.Менделеева, но и самая законная шпаргалка на любой контрольной, экзамене и даже ЕГЭ. Поэтому стоит научиться ей пользоваться!
– Выполните задание №1 в рабочем листе №1.
Учитель вместе с классом выполняет задание 1а, а следующие задания 1б и 1в учащиеся выполняют сами, затем учитель и класс проверяют.
– Выполните самостоятельно задание №2а и №2б. Это задания противоположные первому.
Учитель через 2 мин проверяет правильность выполнения задания.
Учитель: Мы научились называть адрес химических элементов в Периодической системе. Переходим к последнему вопросу нашего урока. Открытие каждого химического элемента воспринималось в науке как событие огромной важности. Названия, которые давались при открытии химическому элементу, никогда не были случайными.
– Каким правилам придерживались учёные, давая названия химическим элементам.
Я предлагаю вам вместе узнать этимологические
начала названий химических элементов. Поэтому
предлагаю работу в группах. Каждые две парты
учащихся работают вместе изучая свой рабочий
материал и выбирают одного отвечающего с
сообщением.. На работу выделяю 4-5 минут.
Поэтому
предлагаю работу в группах. Каждые две парты
учащихся работают вместе изучая свой рабочий
материал и выбирают одного отвечающего с
сообщением.. На работу выделяю 4-5 минут.
Учащимся выдаётся один на парту рабочий лист с заданием. Каждые две парты учащихся выполняет свои варианты заданий: Информационный лист №2, информационный лист №3, информационный лист №4, информационный лист №5 и информационный лист №6.
Приложение_2, Приложение_3, Приложение_4
Затем учащиеся выступают со своим сообщением.
Закрепление. Обобщение. Обратная связь.
Учитель: задаёт ряд вопросов по изучаемой теме.
– Какую тему мы изучали сегодня на уроке.
– Какие понятия вы запомнили на этом уроке.
– Что вам особенно запомнилось сегодня на уроке.
– Выполните задания № 2в , № 2г
и задание №3 в рабочем листе №1.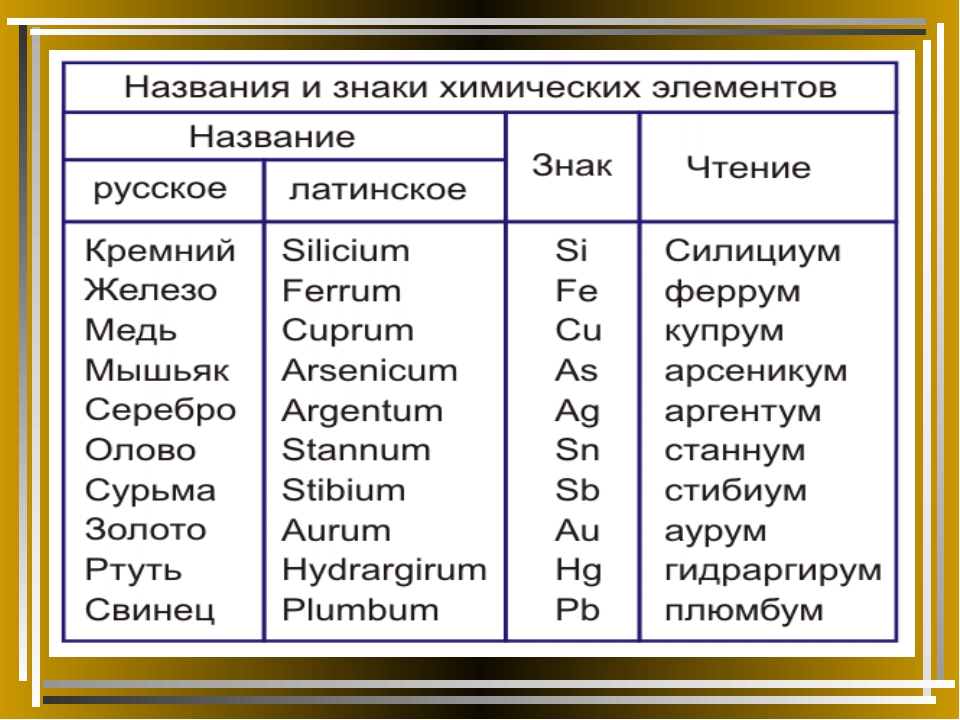
– Как вы считаете, по данной теме возникнут в дальнейшем у вас какие-нибудь сложности в изучении химии.
Я тоже думаю, что вы прекрасно справились с изучением данной темы урока. И выучив, домашний параграф и таблицу с химическими элементами, вы будете прекрасно пользоваться этими понятиями при дальнейшем изучении химии.
Домашнее задание
В дневник записываем §13 до слов “Обозначение состава вещества…” и задания на рабочем листе №2.
Как произносится гелий в таблице менделеева. Алфавитный список химических элементов. Смотреть что такое “ртуть” в других словарях
2.1. Химический язык и его части
Человечество использует много разных языков.
Кроме естественных языков (японского,
английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки ,
например, эсперанто. Среди искусственных языков
выделяются языки различных наук . Так, в
химии используется свой, химический язык .
Так, в
химии используется свой, химический язык .
Химический язык – система условных
обозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи
химической информации.
Сообщение, написанное на большинстве
естественных языков, делится на предложения,
предложения – на слова, а слова – на буквы. Если
предложения, слова и буквы мы назовем частями
языка, то тогда мы сможем выделить аналогичные
части и в химическом языке (таблица 2).
Таблица 2. Части химического языка
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые ” буквы” , научитесь понимать смысл ” слов” и” предложений” . В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
ХИМИЧЕСКИЙ ЯЗЫК.
1.Какие искусственные языки вы знаете (кроме
названных в тексте учебника)?
2.Чем естественные языки отличаются от
искусственных?
3.Как вы думаете, можно ли при описании химических
явлений обходиться без использования
химического языка? Если нет, то почему? Если да, то
в чем будут заключаться преимущества, а в чем
недостатки такого описания?
2.2. Символы химических элементов
Символ химического элемента обозначает сам
элемент или один атом этого элемента.
Каждый такой символ представляет собой
сокращенное латинское название химического
элемента, состоящее из одной или двух букв
латинского алфавита (латинский алфавит см. в
приложении 1). Символ пишется с прописной буквы.
Символы, а также русские и латинские названия
некоторых элементов, приведены в таблице 3. Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
” чтение” символа, то есть, как этот символ
читается в химической формуле.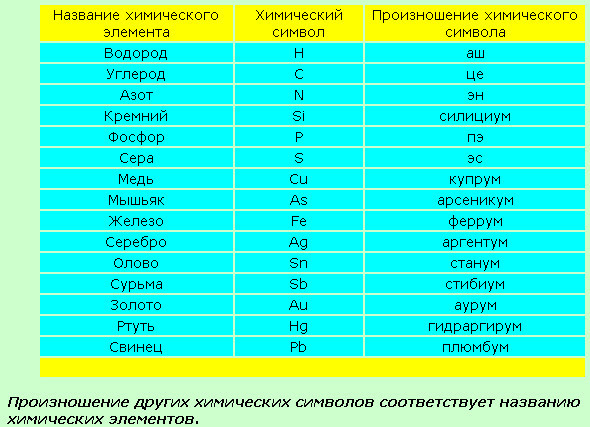
Заменять символом название элемента в устной
речи нельзя, а в рукописных или печатных текстах
это допускается, но не рекомендуется.В настоящее
время известно 110 химических элементов, у 109 из
них есть названия и символы, утвержденные
Международным союзом теоретической и прикладной
химии (ИЮПАК).
В таблице 3 приведена информация только о 33
элементах. Это те элементы, которые при изучении
химии вам встретятся в первую очередь. Русские
названия (в алфавитном порядке) и символы всех
элементов приведены в приложении 2.
Таблица 3. Названия и символы некоторых химических элементов
Название | ||||
Латинское | Написание | |||
| – | Написание | Происхождение | – | – |
| Азот | N itrogenium | От греч. ” рождающий селитру” ” рождающий селитру” | ” эн” | |
| Алюминий | Al uminium | От лат. ” квасцы” | ” алюминий” | |
| Аргон | Ar gon | От греч. ” недеятельный” | ” аргон” | |
| Барий | Ba rium | От греч. ” тяжелый” | ” барий” | |
| Бор | B orum | От арабск. ” белый минерал” | ” бор” | |
| Бром | Br omum | От греч. ” зловонный” | ” бром” | |
| Водород | H ydrogenium | От греч. ” рождающий воду” ” рождающий воду” | ” аш” | |
| Гелий | He lium | От греч. ” Солнце” | ” гелий” | |
| Железо | Fe rrum | От лат. ” меч” | ” феррум” | |
| Золото | Au rum | От лат. ” горящий” | ” аурум” | |
| Йод | I odum | От греч. ” фиолетовый” | ” йод” | |
| Калий | K alium | От арабск. ” щёлочь” | ” калий” | |
| Кальций | Ca lcium | От лат. ” известняк” ” известняк” | ” кальций” | |
| Кислород | O xygenium | От греч. ” рождающий кислоты” | ” о” | |
| Кремний | Si licium | От лат. ” кремень” | ” силициум” | |
| Криптон | Kr ypton | От греч. ” скрытый” | ” криптон” | |
| Магний | M ag nesium | От назв. полуострова Магнезия | ” магний” | |
| Марганец | M an ganum | От греч. ” очищающий” ” очищающий” | ” марганец” | |
| Медь | Cu prum | От греч. назв. о. Кипр | ” купрум” | |
| Натрий | Na trium | От арабск, ” моющее средство” | ” натрий” | |
| Неон | Ne on | От греч. ” новый” | ” неон” | |
| Никель | Ni ccolum | От нем. ” медь святого Николая” | ” никель” | |
| Ртуть | H ydrarg yrum | Лат. ” жидкое серебро” | ” гидраргирум” | |
| Свинец | P lumb um | От лат.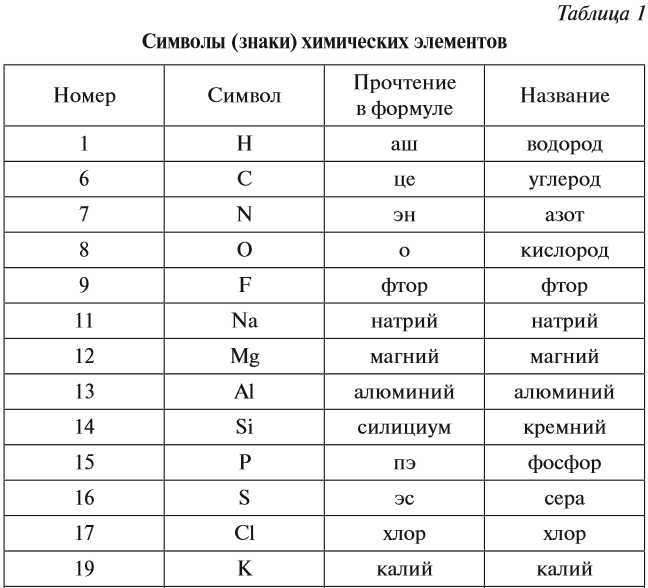 названия сплава свинца с
оловом. названия сплава свинца с
оловом. | ” плюмбум” | |
| Сера | S ulfur | От санскриттского ” горючий порошок” | ” эс” | |
| Серебро | A rg entum | От греч. ” светлый” | ” аргентум” | |
| Углерод | C arboneum | От лат. ” уголь” | ” цэ” | |
| Фосфор | P hosphorus | От греч. ” несущий свет” | ” пэ” | |
| Фтор | F luorum | От лат. глагола ” течь” | ” фтор” | |
| Хлор | Cl orum | От греч. ” зеленоватый” ” зеленоватый” | ” хлор” | |
| Хром | C hr omium | От греч. ” краска” | ” хром” | |
| Цезий | C aes ium | От лат. ” небесно-голубой” | ” цезий” | |
| Цинк | Z in cum | От нем. ” олово” | ” цинк” | |
2.3. Химические формулы
Для обозначения химических веществ используют химические формулы .
Для молекулярных веществ химическая формула
может обозначать и одну молекулу этого вещества.
Информация о веществе может быть разной, поэтому
существуют разные типы химических формул .
В зависимости от полноты информации химические
формулы делятся на четыре основных типа: простейшие , молекулярные , структурные и пространственные .
Подстрочные индексы в простейшейформуле не
имеют общего делителя.
Индекс ” 1″ в формулах не ставится.
Примеры простейших формул: вода – Н 2 О,
кислород – О, сера – S, оксид фосфора – P 2 O 5 ,
бутан – C 2 H 5 , фосфорная кислота – H 3 PO 4 ,
хлорид натрия (поваренная соль) – NaCl.
Простейшая формула воды (Н 2 О) показывает,
что в состав воды входит элемент водород (Н) и
элемент кислород (О), причем в любой порции
(порция – часть чего-либо, что может быть
разделено без утраты своих свойств.) воды число
атомов водорода в два раза больше числа атомов
кислорода.
Число частиц , в том числе и число атомов ,
обозначается латинской буквой N . Обозначив
число атомов водорода – N H , а число
атомов кислорода – N O , мы можем
записать, что
Или N H: N O = 2:
1.
Простейшая формула фосфорной кислоты (Н 3 РО 4) показывает, что в состав фосфорной кислоты входят атомы водорода , атомы фосфора и атомы кислорода , причем отношение чисел атомов этих элементов в любой порции фосфорной кислоты равно 3:1:4, то есть
N H: N P: N O = 3: 1: 4.
Простейшая формула может быть составлена для любого индивидуального химического вещества, а для молекулярного вещества, кроме того, может быть составлена молекулярная формула .
Примеры молекулярных формул: вода – H 2 O, кислород – O 2 , сера – S 8 , оксид фосфора – P 4 O 10 , бутан – C 4 H 10 , фосфорная кислота – H 3 PO 4 .
У немолекулярных веществ молекулярных формул нет.
Последовательность записи символов элементов
в простейших и молекулярных формулах
определяется правилами химического языка, с
которыми вы познакомитесь по мере изучения
химии. На информацию, передаваемую этими
формулами, последовательность символов влияния
не оказывает.
Из знаков, отражающих строение веществ, мы будем использовать пока только валентный штрих (” черточку”). Этот знак показывает наличие между атомами так называемой ковалентной связи (что это за тип связи и каковы его особенности, вы скоро узнаете).
В молекуле воды атом кислорода связан простыми (одинарными) связями с двумя атомами водорода, а атомы водорода между собой не связаны. Именно это наглядно показывает структурная формула воды.
Другой пример: молекула серы S 8 . В этой молекуле 8 атомов серы образуют восьмичленный цикл, в котором каждый атом серы связан с двумя другими атомами простыми связями. Сравните структурную формулу серы с объемной моделью ее молекулы, показанной на рис. 3. Обратите внимание на то, что структурная формула серы не передает форму ее молекулы, а показывает только последовательность соединения атомов ковалентными связями.
Структурная формула фосфорной кислоты
показывает, что в молекуле этого вещества один из
четырех атомов кислорода связан только с атомом
фосфора двойной связью, а атом фосфора, в свою
очередь, связан еще с тремя атомами кислорода
простыми связями. Каждый из этих трех атомов
кислорода, кроме того, связан простой связью с
одним из трех имеющихся в молекуле атомов
водорода./p>
Каждый из этих трех атомов
кислорода, кроме того, связан простой связью с
одним из трех имеющихся в молекуле атомов
водорода./p>
Сравните приведенную ниже объемную модель молекулы метана с его пространственной, структурной и молекулярной формулой:
В пространственной формуле метана клиновидныевалентные штрихи как бы в перспективе показывают, какой из атомов водорода находится ” ближе к нам” , а какой ” дальше от нас” .
Иногда в пространственной формуле указывают длины связей и значения углов между связями в молекуле, как это показано на примере молекулы воды.
Немолекулярные вещества не содержат молекул. Для удобства проведения химических расчетов в немолекулярном веществе выделяют так называемую формульную единицу .
Примеры состава формульных единиц некоторых
веществ: 1) диоксид кремния (кварцевый песок,
кварц) SiO 2 – формульная единица состоит из
одного атома кремния и двух атомов кислорода;
2) хлорид натрия (поваренная соль) NaCl –
формульная единица состоит из одного атома
натрия и одного атома хлора; 3) железо Fe –
формульная единица состоит из одного атома
железа. Как и молекула, формульная единица –
наименьшая порция вещества, сохраняющая его
химические свойства.
Как и молекула, формульная единица –
наименьшая порция вещества, сохраняющая его
химические свойства.
Таблица 4
Информация, передаваемая формулами разных типов
Тип формулы | Информация, передаваемая формулой. | |
| Простейшая Молекулярная Структурная Пространственная |
| |
Рассмотрим теперь на примерах, какую
информацию дают нам формулы разных типов.
1. Вещество: уксусная кислота . Простейшая формула – СН 2 О, молекулярная формула – C 2 H 4 O 2 , структурная формула
Простейшая формула говорит нам, что
1) в состав уксусной кислоты входит углерод,
водород и кислород;
2) в этом веществе число атомов углерода
относится к числу атомов водорода и к числу
атомов кислорода, как 1:2:1, то есть N H: N C:N O = 1:2:1.
Молекулярная формула добавляет, что
3) в молекуле уксусной кислоты – 2 атома углерода,
4 атома водорода и 2 атома кислорода.
Структурная формула добавляет, что
4, 5) в молекуле два атома углерода связаны между
собой простой связью; один из них, кроме этого,
связан с тремя атомами водорода, с каждым простой
связью, а другой – с двумя атомами кислорода, с
одним – двойной связью, а с другим – простой;
последний атом кислорода связан еще простой
связью с четвертым атомом водорода.
2. Вещество: хлорид натрия . Простейшая формула – NaCl.
Простейшая формула – NaCl.
1) В состав хлорида натрия входит натрий и хлор.
2) В этом веществе число атомов натрия равно числу
атомов хлора.
3. Вещество: железо . Простейшая
формула – Fe.
1) В состав этого вещества входит только железо,
то есть это простое вещество.
4. Вещество: триметафосфорная кислота . Простейшая формула – HPO 3 , молекулярная формула – H 3 P 3 O 9 , структурная формула
1) В состав триметафосфорной кислоты входит
водород, фосфор и кислород.
2) N H: N P:N O = 1:1:3.
3) Молекула состоит из трех атомов водорода, трех
атомов фосфора и девяти атомов кислорода.
4, 5) Три атома фосфора и три атома кислорода,
чередуясь, образуют шестичленный цикл. Все связи
в цикле простые. Каждый атом фосфора, кроме того,
связан еще с двумя атомами кислорода, причем с
одним – двойной связью, а с другим – простой.
Каждый из трех атомов кислорода, связанных
простыми связямис атомами фосфора, связан еще
простой связью с атомом водорода.
| Фосфорная кислота – H 3 PO 4 (другое название – ортофосфорная кислота) – прозрачное бесцветное кристаллическое вещество молекулярного строения, плавящееся при 42 o С. Это вещество очень хорошо растворяется в воде и даже поглощает пары воды из воздуха (гигроскопично). Фосфорную кислоту производят в больших количествах и используют прежде всего в производстве фосфорных удобрений, а также в химической промышленности, при производстве спичек и даже в строительстве. Кроме того, фосфорная кислота применяется при изготовлении цемента в зубоврачебной технике, входит в состав многих лекарственных средств. Эта кислота достаточно дешева, поэтому в некоторых странах, например в США, очень чистая сильно разбавленная водой фосфорная кислота добавляется в освежающие напитки для замены дорогой лимонной кислоты. |
Метан – CH 4 . Если у вас
дома есть газовая плита, то с этим веществом вы
сталкиваетесь ежедневно: природный газ, который
горит в конфорках вашей плиты, на 95 % состоит из
метана. Метан – газ без цвета и запаха с
температурой кипения –161 o С. В смеси с
воздухом он взрывоопасен, этим и объясняются
происходящие иногда в угольных шахтах взрывы и
пожары (другое название метана – рудничный газ).
Третье название метана – болотный газ – связано
с тем, что пузырьки именно этого газа поднимаются
со дна болот, где он образуется в результате
деятельности некоторых бактерий. В
промышленности метан используется как топливо и
сырье для производства других веществ.Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. Метан – газ без цвета и запаха с
температурой кипения –161 o С. В смеси с
воздухом он взрывоопасен, этим и объясняются
происходящие иногда в угольных шахтах взрывы и
пожары (другое название метана – рудничный газ).
Третье название метана – болотный газ – связано
с тем, что пузырьки именно этого газа поднимаются
со дна болот, где он образуется в результате
деятельности некоторых бактерий. В
промышленности метан используется как топливо и
сырье для производства других веществ.Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. |
Таблица 5 . Примеры формул разных типов для некоторых веществ –
Откуда происходят названия и символы химических эле-ментов ? Уже в Древнем Египте для обозначения некоторых веществ использовали символические изображения, которые выражали целые слова или понятия (рис. 5.7).
5.7).
В средние века количество алхимических символов до-стигло нескольких тысяч. А для одного и того же вещества существовали десятки разных знаков.
Символ химического элемента — его условное обозна-чение.
Во второй половине XVIII в. ученые делали напрасные по-пытки упорядочить химические знаки. Обозначить каждое вещество отдельным символом не удавалось из-за открытия многих новых веществ. Поэтому со временем старинную алхи-мическую символику заменили химическими знаками, пред-ложенными английским химиком Дж. Дальтоном. В символи-ке Дальтона атом каждого элемента изображен кружком. На поле изображения обозначены либо черточки и точки, либо на-чальные буквы английских названий элементов. Буквенная система химических знаков является удоб-ным способом записи, хранения и передачи химической информации.
Знаки Дальтона, хотя и имели определенное распростра-нение, но были неудобны для печатания. Поэтому в 1814 г. шведский ученый Й.Я. Берцелиус предложил только буквенную систему знаков. Знаки элементов составлялись или из первой буквы их латинских названий, или из первой и од-ной из последующих букв. Так Берцелиус добился максимально возможного сближения символа химического элемента с его названием.
Знаки элементов составлялись или из первой буквы их латинских названий, или из первой и од-ной из последующих букв. Так Берцелиус добился максимально возможного сближения символа химического элемента с его названием.
Латинское на-звание химического элемента | Символ | ||
алхимичес-кий | по Дж. Дальтону | по Й. Я. Берцелиусу | |
H ydrarg yrum | |||
P lumb um | |||
Таблица.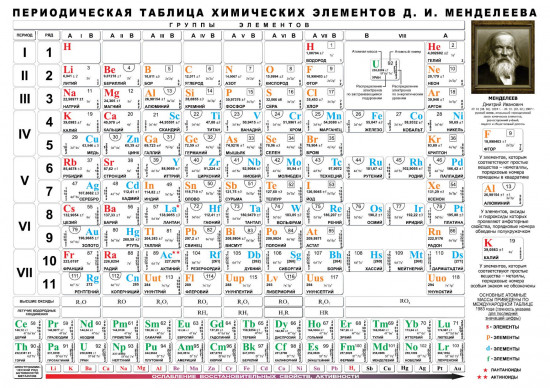 Названия и символы некоторых химических элементов
Названия и символы некоторых химических элементов
Символ | Произноше-ние | Латинское название | Современное название | |
русское | украинское | |||
H ydrogenium | Гідроген | |||
C arboneum | ||||
N itrogenium | Нітроген | |||
O xygenium | кислород | |||
M ag nesium | ||||
Алюминий | Al uminium | алюминий | Алюміній | |
Si licium | ||||
P hoshorus | ||||
Z in kum | ||||
Аргентум | A rg entum | Аргентум Материал с сайта | ||
S tan num | ||||
P lumb um | ||||
Гидраргирум | H ydrarg yrum | Меркурій | ||
Проанализируй данные, приведенные в таблице. Сравни современные русские и украинские назва-ния химических элементов. Определи, какие из них непо-средственно происходят от латинских названий.
Сравни современные русские и украинские назва-ния химических элементов. Определи, какие из них непо-средственно происходят от латинских названий.
Запомни, что русские названия химических элементов — нарицательные, их пишут со строчной буквы. Современные украинские названия химических элементов являются собственными, поэтому их пишут с прописной буквы. И в том и в другом случае нельзя в устной речи заменять назва-ние химического элемента произношением его символа. Не следует также заменять название элемента его символом в рукописях или печатных текстах.
На этой странице материал по темам:
Химические элименты которые поменяли обозначение в течении времени
Таблица сложных веществ их названия произношения
Нефть произношение химического знака
Названия химических веществ на латинском
Химические вещества и их произношение
Вопросы по этому материалу:
Инструкция
Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество квартир.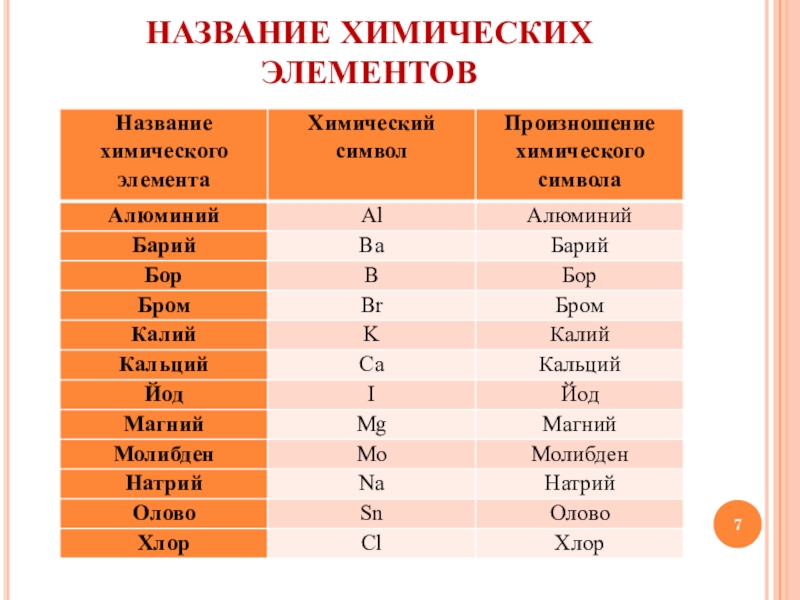 Каждый «жилец» или в своей собственной квартире под определенным номером, который является постоянным. Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот. Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Каждый «жилец» или в своей собственной квартире под определенным номером, который является постоянным. Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот. Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя . В зависимости от того, с какой стороны их больше, та называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер. Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, алюминий находится в 3 периоде, следовательно, у него будет 3 уровня.
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, магний, кальций и т.д.) будут иметь валентность равную 2.
Также по таблице можно проанализировать свойства элементов. Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием.
перевод, произношение, транскрипция, примеры использования
Химический элемент серебро является металлом.
Все инвестиции содержат в себе элемент риска.
Существенной частью её успеха является честность.
В этом унылом городишке ей было совсем не по себе.
Самая душа его строилась из одной лишь скорби.
периодическая система химических элементов (Д.И.Менделеева)
В его словах была какая-то доля (т.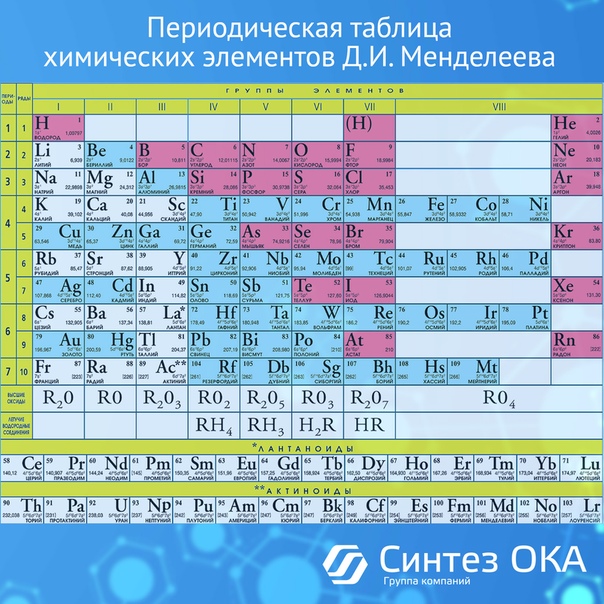 е. небольшое количество) истины.
е. небольшое количество) истины.
There is an element of truth in your argument.
В ваших доводах есть доля правды.
A free press is an essential element of a democracy.
Свободная пресса является необходимым элементом демократии.
Often there is an element of luck in getting the right answer.
Часто в получении правильного ответа присутствует элемент удачи.
An element of surprise is important to any attack.
Для любой атаки важен элемент неожиданности.
We must include this chemical element in the group.
Мы должны включить в данную группу этот химический элемент.
Graham was in his element, building a fire and cooking the steaks.
Грэм был в своей стихии: развести костёр и приготовить стейки — это по его части.
Some fishes can live a long time after removal from their element.
Некоторые рыбы способны прожить довольно долгое время после изъятия их из родной стихии.
There’s an element of risk in any kind of investment.
В любого рода инвестициях существует элемент риска.
The alchemists believed that there were four elements.
Алхимики считали, что существует четыре стихии.
Water is composed of the elements hydrogen and oxygen.
Вода состоит из элементов — водорода и кислорода.
Each element is mathematically coupled to its neighbours.
Каждый элемент математически связан с соседними.
There was an element of ambiguity in the president’s reply.
В ответе президента присутствовал элемент неопределённости.
There’s always an element of risk in this kind of investment.
В подобного рода вложениях всегда есть доля риска.
The word ‘element’ contains five different types of character.
Слово “element” (элемент) содержит пять различных типов печатных символов.
They have started showing a strong soul element in their sound.
В их звучании стали заметно проглядывать элементы стиля соул.
There is an element of doubt as to whether the deaths were accidental.
В том, что эти смерти были случайными, присутствует доля сомнения.
Besides ability, the other essential element in political success is luck.
Помимо таланта, другой важной составляющей политического успеха является удача.
There is an element of ‘jam tomorrow’ about some of the government’s policies.
В некоторых действиях правительства присутствует доля пустых обещаний “светлого будущего”.
Our knowledge of his tragic end adds an element of pathos to the story of his early success.
То, что мы знаем о его трагической кончине, добавляет элемент пафоса в историю его раннего успеха.
Her performance contains a strong element of self-parody (=when someone makes fun of their own style).
В её игре присутствует сильный элемент самопародии (когда кто-то высмеивает свой собственный стиль).
Знаки химических элементов. Периодическая система химических элементов Д.И.Менделеева.
Изучение нового материала.Дмитрий Иванович Менделеев – гениальный русский ученый, которому удалось создать строго научную классификацию хим. элементов, которой является Периодическая система. В ней расположены все известные науке химические элементы, все многообразие окружающего мира построено из элементов, находящиеся в этой таблице элементы принято обозначать химическими знаками или символами. Для того, чтобы пользоваться таблицей необходимо знать «химический язык» или «химический алфавит». В русском алфавите существуют 33 буквы, а в химическом алфавите – 109.
В этом сообщении вы познакомитесь с тем как же, грамотно обозначать химические элементы.
Знаки химических элементов.
Итак, по вашему мнению, легче всего написать химическое явление знаками, но какими?
Такая же точно проблема встала
и перед химиками средневековья.
В то время ученые, их называли, как вы помните, алхимиками, знали 10 химических элементов – семь металлов (золото, серебро, медь, железо, олово, свинец и ртуть) и три неметалла (серу, углерод и сурьму).
Алхимики считали, что химические элементы связаны со звездами и планетами, и присваивали им астрологические символы.
Золото называлось Солнцем, а обозначалось кружком с точкой. Медь – Венерой, символом этого металла служило «венерино зеркальце». Алхимики очень долго обходились без химических формул. В употреблении были странные значки, причем почти каждый химик пользовался своей собственной системой обозначений веществ. Это было очень неудобно. Существовала настоящая неразбериха: одни и те же химические реакции записывали разными знаками. Необходимо было ввести единую систему обозначений.
В XVIII веке укоренилась система обозначений
элементов (которых в то время стало известно уже три десятка) в виде
геометрических фигур – кружков, полуокружностей, треугольников, квадратов.
Этот способ изображения символов элементов придумал английский ученый, физик и химик, Джон Дальтон.
Символы химических элементов, используемые в настоящее время, были введены шведским ученым-химиком Йенс Якобом Берцелиусом.
Каждый элемент имеет свой символ, понятный ученым любой страны. Первая, прописная, буква символа – это всегда первая буква полного латинского названия элемента. Если с такой буквы начинаются названия нескольких элементов, то к первой букве прибавляется еще одна.
Например: Кислород – Oxуgenium – O
Углерод – Сarboneum – C
Кальций – Сalcium – Ca
Произносятся символы соответственно букве латинского алфавита.
Например: кислород – О – «о»
азот – N – « эн»
Другие, так и читаются по-русски.
Например: кальций – Са – «кальций»
Натрий – Na – «натрий»
Все элементы запоминать не надо. Но для дальнейшей
нашей работы ряд элементов надо выучить.
Все они записаны в учебнике на странице 35. Все элементы условно можно разделить на металлы и неметаллы.
Этимология названий химических элементов:
Рассмотрим этимологию названий химических элементов, т.е. происхождения их названий.
В названии отражено важнейшее свойство простого вещества, образованного данным элементом: водород – «рождающий воду», фосфор – «несущий свет»
Мифы древних греков: прометий – прометей, тантал – тантал
Географические названия: государства – галлий, германий, полоний, рутений; города – лютеций (Париж), гафний (Копенгаген).
Астрономия: селен – луна, теллур – земля, уран, нептуний
Имена великих ученых: фермий, кюрий, эйнштейний, менделевий
Структура Периодической системы химических элементов Д.И.Менделеева
Теперь мы рассмотрим с вами, пожалуй, самый главный
документ, «подсказку» для любого химика. Откройте форзац вашего учебника, а
также воспользуйтесь таблицами, которые лежат на ваших столах. Перед вами
находится таблица «Периодическая система Дмитрия Ивановича Менделеева». Как вы
видите, они несколько отличаются, но незначительно. Периодическая система –
Большой дом химических элементов, который был построен в 1869 году Д. И.
Менделеевым.
Перед вами
находится таблица «Периодическая система Дмитрия Ивановича Менделеева». Как вы
видите, они несколько отличаются, но незначительно. Периодическая система –
Большой дом химических элементов, который был построен в 1869 году Д. И.
Менделеевым.
Чем же нас удивляет таблица Менделеева?
Прежде всего, тем, что ее периоды, ее этажи, спланированы очень неравномерно.
В первом этаже, первом периоде таблицы, всего две квартиры. Во втором и третьем – по восемь. Четвертый и пятый устроены по гостиничному типу: восемнадцать комнат на каждом. На шестом и седьмом комнатушек и того больше – по 32.
- Периоды – горизонтальные ряды, или «этажи», бывают малыми (1,2,3), большими (4,5) и сверхбольшими (7,8).
- Кроме того, в Большом доме есть 8 «подъездов» –ГРУППЫ, каждая из которых состоит из главной (элементы слева) и побочной (элементы справа) подгруппы. У каждого элемента есть своя отдельная «квартира» с порядковым номером.
Некоторые «подъезды» – группы, имеют общие название,
отражающие их общие свойства: щелочные металлы, галогены, благородные или
инертные газы.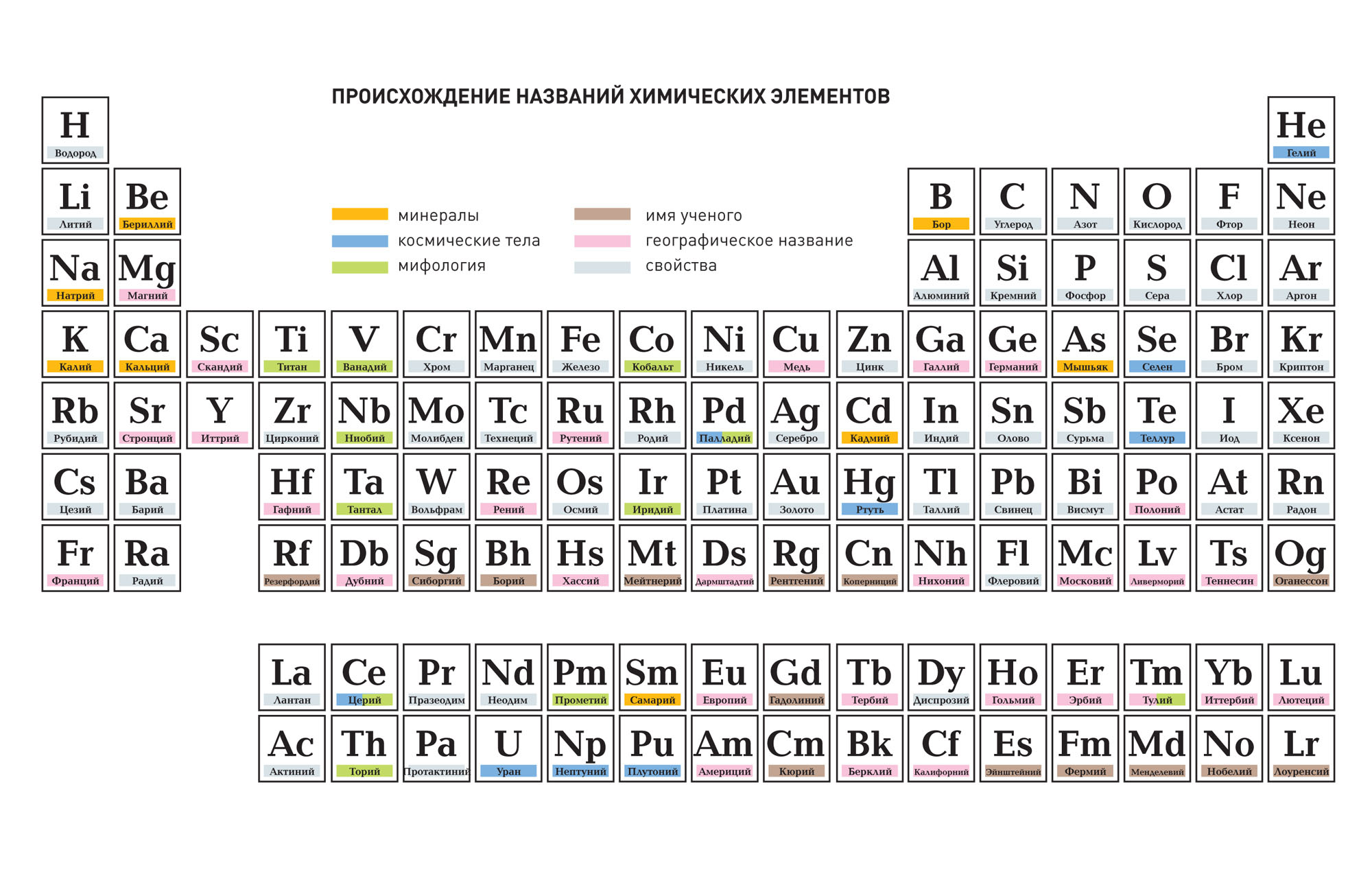
Кроме того отдельно внизу, в «подвале» располагаются лантаноиды и актиноиды, которые очень похожи на лантан, а другие на актиний.
В таблице отражена и принадлежность элемента к определенной группе: металл, неметалл или переходный элемент.
Произношение химических элементов таблицы менделеева полная. Обозначение, произношение, названия и символы химических элементов. Нефть произношение химического знака
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицыКак видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами.
 Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами).
 Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.

- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия.
 К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия.
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
Помните о том, что атомный номер соответствует числу протонов в атоме.
 Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны – отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.

Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными.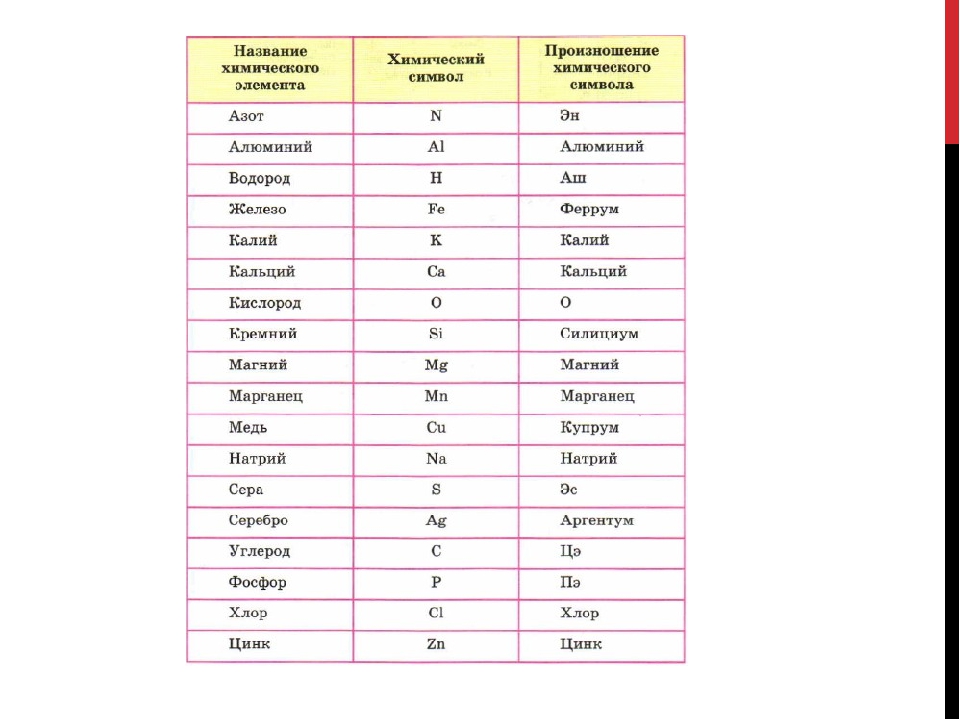 Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
Инструкция
Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество квартир. Каждый «жилец» или в своей собственной квартире под определенным номером, который является постоянным. Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот. Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя . В зависимости от того, с какой стороны их больше, та называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер. Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, алюминий находится в 3 периоде, следовательно, у него будет 3 уровня.
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, магний, кальций и т.д.) будут иметь валентность равную 2.
Также по таблице можно проанализировать свойства элементов. Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием.
Откуда происходят названия и символы химических эле-ментов ? Уже в Древнем Египте для обозначения некоторых веществ использовали символические изображения, которые выражали целые слова или понятия (рис. 5.7).
5.7).
В средние века количество алхимических символов до-стигло нескольких тысяч. А для одного и того же вещества существовали десятки разных знаков.
Символ химического элемента — его условное обозна-чение.
Во второй половине XVIII в. ученые делали напрасные по-пытки упорядочить химические знаки. Обозначить каждое вещество отдельным символом не удавалось из-за открытия многих новых веществ. Поэтому со временем старинную алхи-мическую символику заменили химическими знаками, пред-ложенными английским химиком Дж. Дальтоном. В символи-ке Дальтона атом каждого элемента изображен кружком. На поле изображения обозначены либо черточки и точки, либо на-чальные буквы английских названий элементов. Буквенная система химических знаков является удоб-ным способом записи, хранения и передачи химической информации.
Знаки Дальтона, хотя и имели определенное распростра-нение, но были неудобны для печатания. Поэтому в 1814 г. шведский ученый Й.Я. Берцелиус предложил только буквенную систему знаков. Знаки элементов составлялись или из первой буквы их латинских названий, или из первой и од-ной из последующих букв. Так Берцелиус добился максимально возможного сближения символа химического элемента с его названием.
Знаки элементов составлялись или из первой буквы их латинских названий, или из первой и од-ной из последующих букв. Так Берцелиус добился максимально возможного сближения символа химического элемента с его названием.
Латинское на-звание химического элемента | Символ | ||
алхимичес-кий | по Дж. Дальтону | по Й. Я. Берцелиусу | |
H ydrarg yrum | |||
P lumb um | |||
Таблица. Названия и символы некоторых химических элементов
Названия и символы некоторых химических элементов
Символ | Произноше-ние | Латинское название | Современное название | |
русское | украинское | |||
H ydrogenium | Гідроген | |||
C arboneum | ||||
N itrogenium | Нітроген | |||
O xygenium | кислород | |||
M ag nesium | ||||
Алюминий | Al uminium | алюминий | Алюміній | |
Si licium | ||||
P hoshorus | ||||
Z in kum | ||||
Аргентум | A rg entum | Аргентум Материал с сайта | ||
S tan num | ||||
P lumb um | ||||
Гидраргирум | H ydrarg yrum | Меркурій | ||
Проанализируй данные, приведенные в таблице. Сравни современные русские и украинские назва-ния химических элементов. Определи, какие из них непо-средственно происходят от латинских названий.
Сравни современные русские и украинские назва-ния химических элементов. Определи, какие из них непо-средственно происходят от латинских названий.
Запомни, что русские названия химических элементов — нарицательные, их пишут со строчной буквы. Современные украинские названия химических элементов являются собственными, поэтому их пишут с прописной буквы. И в том и в другом случае нельзя в устной речи заменять назва-ние химического элемента произношением его символа. Не следует также заменять название элемента его символом в рукописях или печатных текстах.
На этой странице материал по темам:
Химические элименты которые поменяли обозначение в течении времени
Таблица сложных веществ их названия произношения
Нефть произношение химического знака
Названия химических веществ на латинском
Химические вещества и их произношение
Вопросы по этому материалу:
2.1. Химический язык и его части
Человечество использует много разных языков. Кроме естественных языков (японского,
английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки ,
например, эсперанто. Среди искусственных языков
выделяются языки различных наук . Так, в
химии используется свой, химический язык .
Кроме естественных языков (японского,
английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки ,
например, эсперанто. Среди искусственных языков
выделяются языки различных наук . Так, в
химии используется свой, химический язык .
Химический язык – система условных
обозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи
химической информации.
Сообщение, написанное на большинстве
естественных языков, делится на предложения,
предложения – на слова, а слова – на буквы. Если
предложения, слова и буквы мы назовем частями
языка, то тогда мы сможем выделить аналогичные
части и в химическом языке (таблица 2).
Таблица 2. Части химического языка
Любым языком овладеть сразу невозможно, это
относится и к химическому языку. Поэтому пока вы
познакомитесь только с основами этого языка:
выучите некоторые ” буквы” , научитесь
понимать смысл ” слов” и” предложений” . В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью
химического языка. По мере изучения химии ваше
знание химического языка будет расширяться и
углубляться.
В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью
химического языка. По мере изучения химии ваше
знание химического языка будет расширяться и
углубляться.
ХИМИЧЕСКИЙ ЯЗЫК.
1.Какие искусственные языки вы знаете (кроме
названных в тексте учебника)?
2.Чем естественные языки отличаются от
искусственных?
3.Как вы думаете, можно ли при описании химических
явлений обходиться без использования
химического языка? Если нет, то почему? Если да, то
в чем будут заключаться преимущества, а в чем
недостатки такого описания?
2.2. Символы химических элементов
Символ химического элемента обозначает сам
элемент или один атом этого элемента.
Каждый такой символ представляет собой
сокращенное латинское название химического
элемента, состоящее из одной или двух букв
латинского алфавита (латинский алфавит см. в
приложении 1). Символ пишется с прописной буквы.
Символы, а также русские и латинские названия
некоторых элементов, приведены в таблице 3. Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
” чтение” символа, то есть, как этот символ
читается в химической формуле.
Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
” чтение” символа, то есть, как этот символ
читается в химической формуле.
Заменять символом название элемента в устной
речи нельзя, а в рукописных или печатных текстах
это допускается, но не рекомендуется.В настоящее
время известно 110 химических элементов, у 109 из
них есть названия и символы, утвержденные
Международным союзом теоретической и прикладной
химии (ИЮПАК).
В таблице 3 приведена информация только о 33
элементах. Это те элементы, которые при изучении
химии вам встретятся в первую очередь. Русские
названия (в алфавитном порядке) и символы всех
элементов приведены в приложении 2.
Таблица 3. Названия и символы некоторых химических элементов
Название | ||||
Латинское | Написание | |||
| – | Написание | Происхождение | – | – |
| Азот | N itrogenium | От греч.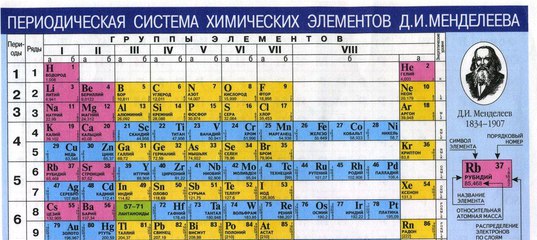 ” рождающий селитру” ” рождающий селитру” | ” эн” | |
| Алюминий | Al uminium | От лат. ” квасцы” | ” алюминий” | |
| Аргон | Ar gon | От греч. ” недеятельный” | ” аргон” | |
| Барий | Ba rium | От греч. ” тяжелый” | ” барий” | |
| Бор | B orum | От арабск. ” белый минерал” | ” бор” | |
| Бром | Br omum | От греч. ” зловонный” | ” бром” | |
| Водород | H ydrogenium | От греч. ” рождающий воду” ” рождающий воду” | ” аш” | |
| Гелий | He lium | От греч. ” Солнце” | ” гелий” | |
| Железо | Fe rrum | От лат. ” меч” | ” феррум” | |
| Золото | Au rum | От лат. ” горящий” | ” аурум” | |
| Йод | I odum | От греч. ” фиолетовый” | ” йод” | |
| Калий | K alium | От арабск. ” щёлочь” | ” калий” | |
| Кальций | Ca lcium | От лат. ” известняк” ” известняк” | ” кальций” | |
| Кислород | O xygenium | От греч. ” рождающий кислоты” | ” о” | |
| Кремний | Si licium | От лат. ” кремень” | ” силициум” | |
| Криптон | Kr ypton | От греч. ” скрытый” | ” криптон” | |
| Магний | M ag nesium | От назв. полуострова Магнезия | ” магний” | |
| Марганец | M an ganum | От греч. ” очищающий” ” очищающий” | ” марганец” | |
| Медь | Cu prum | От греч. назв. о. Кипр | ” купрум” | |
| Натрий | Na trium | От арабск, ” моющее средство” | ” натрий” | |
| Неон | Ne on | От греч. ” новый” | ” неон” | |
| Никель | Ni ccolum | От нем. ” медь святого Николая” | ” никель” | |
| Ртуть | H ydrarg yrum | Лат. ” жидкое серебро” | ” гидраргирум” | |
| Свинец | P lumb um | От лат. названия сплава свинца с
оловом. названия сплава свинца с
оловом. | ” плюмбум” | |
| Сера | S ulfur | От санскриттского ” горючий порошок” | ” эс” | |
| Серебро | A rg entum | От греч. ” светлый” | ” аргентум” | |
| Углерод | C arboneum | От лат. ” уголь” | ” цэ” | |
| Фосфор | P hosphorus | От греч. ” несущий свет” | ” пэ” | |
| Фтор | F luorum | От лат. глагола ” течь” | ” фтор” | |
| Хлор | Cl orum | От греч. ” зеленоватый” ” зеленоватый” | ” хлор” | |
| Хром | C hr omium | От греч. ” краска” | ” хром” | |
| Цезий | C aes ium | От лат. ” небесно-голубой” | ” цезий” | |
| Цинк | Z in cum | От нем. ” олово” | ” цинк” | |
2.3. Химические формулы
Для обозначения химических веществ используют химические формулы .
Для молекулярных веществ химическая формула
может обозначать и одну молекулу этого вещества.
Информация о веществе может быть разной, поэтому
существуют разные типы химических формул .
В зависимости от полноты информации химические
формулы делятся на четыре основных типа: простейшие , молекулярные , структурные и пространственные .
Подстрочные индексы в простейшейформуле не
имеют общего делителя.
Индекс ” 1″ в формулах не ставится.
Примеры простейших формул: вода – Н 2 О,
кислород – О, сера – S, оксид фосфора – P 2 O 5 ,
бутан – C 2 H 5 , фосфорная кислота – H 3 PO 4 ,
хлорид натрия (поваренная соль) – NaCl.
Простейшая формула воды (Н 2 О) показывает,
что в состав воды входит элемент водород (Н) и
элемент кислород (О), причем в любой порции
(порция – часть чего-либо, что может быть
разделено без утраты своих свойств.) воды число
атомов водорода в два раза больше числа атомов
кислорода.
Число частиц , в том числе и число атомов ,
обозначается латинской буквой N . Обозначив
число атомов водорода – N H , а число
атомов кислорода – N O , мы можем
записать, что
Или N H: N O = 2:
1.
Простейшая формула фосфорной кислоты (Н 3 РО 4) показывает, что в состав фосфорной кислоты входят атомы водорода , атомы фосфора и атомы кислорода , причем отношение чисел атомов этих элементов в любой порции фосфорной кислоты равно 3:1:4, то есть
N H: N P: N O = 3: 1: 4.
Простейшая формула может быть составлена для любого индивидуального химического вещества, а для молекулярного вещества, кроме того, может быть составлена молекулярная формула .
Примеры молекулярных формул: вода – H 2 O, кислород – O 2 , сера – S 8 , оксид фосфора – P 4 O 10 , бутан – C 4 H 10 , фосфорная кислота – H 3 PO 4 .
У немолекулярных веществ молекулярных формул нет.
Последовательность записи символов элементов
в простейших и молекулярных формулах
определяется правилами химического языка, с
которыми вы познакомитесь по мере изучения
химии. На информацию, передаваемую этими
формулами, последовательность символов влияния
не оказывает.
Из знаков, отражающих строение веществ, мы будем использовать пока только валентный штрих (” черточку”). Этот знак показывает наличие между атомами так называемой ковалентной связи (что это за тип связи и каковы его особенности, вы скоро узнаете).
В молекуле воды атом кислорода связан простыми (одинарными) связями с двумя атомами водорода, а атомы водорода между собой не связаны. Именно это наглядно показывает структурная формула воды.
Другой пример: молекула серы S 8 . В этой молекуле 8 атомов серы образуют восьмичленный цикл, в котором каждый атом серы связан с двумя другими атомами простыми связями. Сравните структурную формулу серы с объемной моделью ее молекулы, показанной на рис. 3. Обратите внимание на то, что структурная формула серы не передает форму ее молекулы, а показывает только последовательность соединения атомов ковалентными связями.
Структурная формула фосфорной кислоты
показывает, что в молекуле этого вещества один из
четырех атомов кислорода связан только с атомом
фосфора двойной связью, а атом фосфора, в свою
очередь, связан еще с тремя атомами кислорода
простыми связями. Каждый из этих трех атомов
кислорода, кроме того, связан простой связью с
одним из трех имеющихся в молекуле атомов
водорода./p>
Каждый из этих трех атомов
кислорода, кроме того, связан простой связью с
одним из трех имеющихся в молекуле атомов
водорода./p>
Сравните приведенную ниже объемную модель молекулы метана с его пространственной, структурной и молекулярной формулой:
В пространственной формуле метана клиновидныевалентные штрихи как бы в перспективе показывают, какой из атомов водорода находится ” ближе к нам” , а какой ” дальше от нас” .
Иногда в пространственной формуле указывают длины связей и значения углов между связями в молекуле, как это показано на примере молекулы воды.
Немолекулярные вещества не содержат молекул. Для удобства проведения химических расчетов в немолекулярном веществе выделяют так называемую формульную единицу .
Примеры состава формульных единиц некоторых
веществ: 1) диоксид кремния (кварцевый песок,
кварц) SiO 2 – формульная единица состоит из
одного атома кремния и двух атомов кислорода;
2) хлорид натрия (поваренная соль) NaCl –
формульная единица состоит из одного атома
натрия и одного атома хлора; 3) железо Fe –
формульная единица состоит из одного атома
железа. Как и молекула, формульная единица –
наименьшая порция вещества, сохраняющая его
химические свойства.
Как и молекула, формульная единица –
наименьшая порция вещества, сохраняющая его
химические свойства.
Таблица 4
Информация, передаваемая формулами разных типов
Тип формулы | Информация, передаваемая формулой. | |
| Простейшая Молекулярная Структурная Пространственная |
| |
Рассмотрим теперь на примерах, какую
информацию дают нам формулы разных типов.
1. Вещество: уксусная кислота . Простейшая формула – СН 2 О, молекулярная формула – C 2 H 4 O 2 , структурная формула
Простейшая формула говорит нам, что
1) в состав уксусной кислоты входит углерод,
водород и кислород;
2) в этом веществе число атомов углерода
относится к числу атомов водорода и к числу
атомов кислорода, как 1:2:1, то есть N H: N C:N O = 1:2:1.
Молекулярная формула добавляет, что
3) в молекуле уксусной кислоты – 2 атома углерода,
4 атома водорода и 2 атома кислорода.
Структурная формула добавляет, что
4, 5) в молекуле два атома углерода связаны между
собой простой связью; один из них, кроме этого,
связан с тремя атомами водорода, с каждым простой
связью, а другой – с двумя атомами кислорода, с
одним – двойной связью, а с другим – простой;
последний атом кислорода связан еще простой
связью с четвертым атомом водорода.
2. Вещество: хлорид натрия . Простейшая формула – NaCl.
Простейшая формула – NaCl.
1) В состав хлорида натрия входит натрий и хлор.
2) В этом веществе число атомов натрия равно числу
атомов хлора.
3. Вещество: железо . Простейшая
формула – Fe.
1) В состав этого вещества входит только железо,
то есть это простое вещество.
4. Вещество: триметафосфорная кислота . Простейшая формула – HPO 3 , молекулярная формула – H 3 P 3 O 9 , структурная формула
1) В состав триметафосфорной кислоты входит
водород, фосфор и кислород.
2) N H: N P:N O = 1:1:3.
3) Молекула состоит из трех атомов водорода, трех
атомов фосфора и девяти атомов кислорода.
4, 5) Три атома фосфора и три атома кислорода,
чередуясь, образуют шестичленный цикл. Все связи
в цикле простые. Каждый атом фосфора, кроме того,
связан еще с двумя атомами кислорода, причем с
одним – двойной связью, а с другим – простой.
Каждый из трех атомов кислорода, связанных
простыми связямис атомами фосфора, связан еще
простой связью с атомом водорода.
| Фосфорная кислота – H 3 PO 4 (другое название – ортофосфорная кислота) – прозрачное бесцветное кристаллическое вещество молекулярного строения, плавящееся при 42 o С. Это вещество очень хорошо растворяется в воде и даже поглощает пары воды из воздуха (гигроскопично). Фосфорную кислоту производят в больших количествах и используют прежде всего в производстве фосфорных удобрений, а также в химической промышленности, при производстве спичек и даже в строительстве. Кроме того, фосфорная кислота применяется при изготовлении цемента в зубоврачебной технике, входит в состав многих лекарственных средств. Эта кислота достаточно дешева, поэтому в некоторых странах, например в США, очень чистая сильно разбавленная водой фосфорная кислота добавляется в освежающие напитки для замены дорогой лимонной кислоты. |
Метан – CH 4 . Если у вас
дома есть газовая плита, то с этим веществом вы
сталкиваетесь ежедневно: природный газ, который
горит в конфорках вашей плиты, на 95 % состоит из
метана. Метан – газ без цвета и запаха с
температурой кипения –161 o С. В смеси с
воздухом он взрывоопасен, этим и объясняются
происходящие иногда в угольных шахтах взрывы и
пожары (другое название метана – рудничный газ).
Третье название метана – болотный газ – связано
с тем, что пузырьки именно этого газа поднимаются
со дна болот, где он образуется в результате
деятельности некоторых бактерий. В
промышленности метан используется как топливо и
сырье для производства других веществ.Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. Метан – газ без цвета и запаха с
температурой кипения –161 o С. В смеси с
воздухом он взрывоопасен, этим и объясняются
происходящие иногда в угольных шахтах взрывы и
пожары (другое название метана – рудничный газ).
Третье название метана – болотный газ – связано
с тем, что пузырьки именно этого газа поднимаются
со дна болот, где он образуется в результате
деятельности некоторых бактерий. В
промышленности метан используется как топливо и
сырье для производства других веществ.Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. |
Таблица 5 . Примеры формул разных типов для некоторых веществ –
ГДЗ по химии 8 класс Минченков Е.Е Задание: 6 Знаки химических элементов Периодической таблицы Д И Менделеева
Изображения обложек учебников приведены на страницах данного сайта исключительно в качестве иллюстративного материала (ст.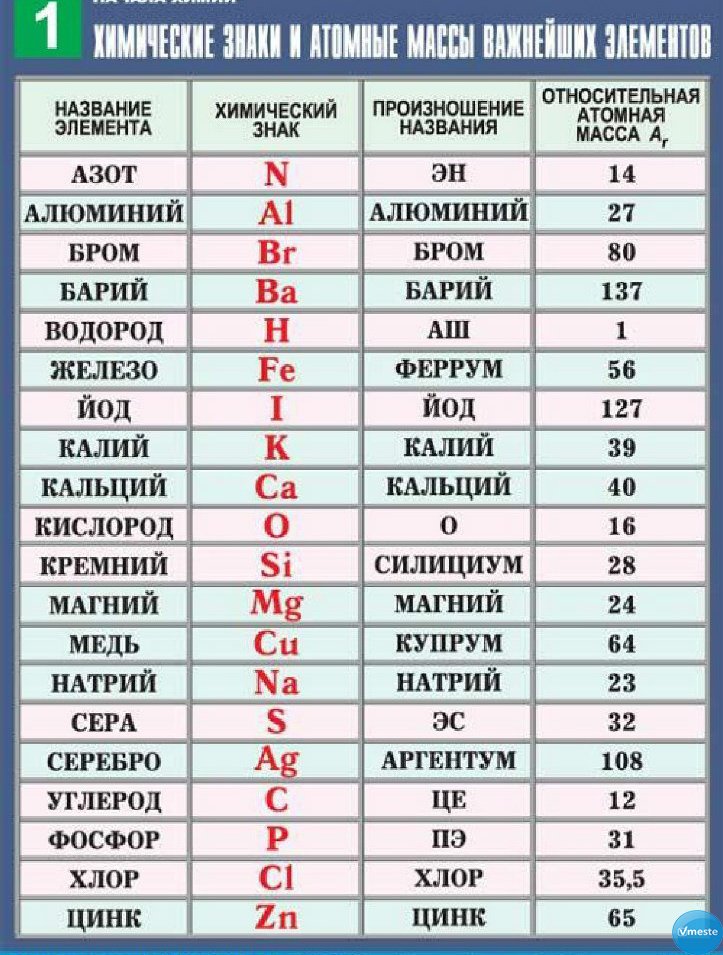 1274 п. 1 части четвертой Гражданского кодекса Российской Федерации)
1274 п. 1 части четвертой Гражданского кодекса Российской Федерации)
Авторы: Минченков Е.Е.
На данной странице представлено детальное решение задания 6 Знаки химических элементов Периодической таблицы Д. И. Менделеева по химии для учеников 8 классa автор(ы) Минченков Е.Е.
6 Знаки химических элементов Периодической таблицы Д. И. Менделеева
Информация, которую несет химический знак (символ):
Обозначает конкретный химический элемент;
Обозначает один атом химического элемента;
Относительную атомную массу.
По горизонтали таблица Д. И. Менделеева делится на периоды. В короткопериодном варианте таблицы выделяют 1-3 периоды – малые периоды, 4-7 периоды – большие периоды.
По вертикали таблица Д. И. Менделеева делится на группы. В короткопериодном варианте таблицы 8 групп, каждая состоит из двух подгрупп: главные или А-группы и побочные или Б-группы.

C – углерод (цэ) – происхождение названия от слова «уголь»
Cr – хром – элемент получил от греч. слова – цвет, краска — из-за разнообразия окраски своих соединений.
Cu – медь (купрум) – латинское название меди произошло от названия острова Кипр, где было богатое месторождение.
Сo – кобальт – Название «кобальт» происходит от нем. Kobold — домовой, гном.
Cd – кадмий – Штромейер назвал кадмий по греческому названию руды, из которой в Германии добывали цинк, — καδμεία. В свою очередь, руда получила своё название в честь Кадма, героя древнегреческой мифологии.
Химические элементы делятся на металлы и неметаллы, так как обладают похожими свойствами:
металлы имеют металлический блеск, хорошо проводят тепло и электрический ток, имеют высокую температуру кипения, твердое агрегатное состояние.
Неметаллы имеют разное агрегатное состояние, большинство плохо проводит электрический ток, обладают летучестью.

Металлы
| Железо | Fe | Феррум |
| Калий | K | Калий |
| Кальций | Ca | Кальций |
| Литий | Li | Литий |
| Медь | Cu | Купрум |
| Серебро | Ag | Аргентум |
Неметаллы
| Азот | N | Эн |
| Водород | H | Аш |
| Кислород | O | О |
| Cера | S | Эс |
| Углерод | C | Цэ |
Ru – рутений – в честь России
Sm – самарий – в честь русского горного инженера, полковника В. Е. Самарского-Быховца
Md – менделевий – в честь Дмитрия Ивановича Менделеева
Db – дубний – в честь российского центра по исследованиям в области ядерной физики, наукограда Дубны
Fl – флеровий – в честь Лаборатории ядерных реакций им. Г. Н. Флёрова
Г. Н. Флёрова
Mc – московий – в честь Московской области
Og – оганесон – в честь академика Юрия Цолаковича Оганесяна
Коротко- и длиннопериодные таблицы имеют по 7 периодов, где 1-3 периоды являются малыми, а 4-7 периоды – большими периодами.
В короткопериодном имеется 8 групп, которые делятся на главные (А) и побочные (Б) группы – пронумерованы римскими цифрами от I до VIII.
В длиннопериодном варианте имеется 18 групп, которые обозначают или арабскими цифрами.
Атомная единица массы: 1 а. е. м. = 1,66·10−27 кг = 1,66·10−23 г
m(Fe) = Ar(Fe) · 1 а. е. м. = 56 · = 1,66·10−23 г = 92.96·1,66·10−23 г
Для сообщения о других формах периодической таблицы Д. И. Менделеева используйте следующую информацию:
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая», «длинная», «сверхдлинная».

Нильсом Бором разработана лестничная (пирамидальная) форма периодической системы.
Существует несколько сотен вариантов, редко или вовсе не используемых, но весьма оригинальных, способов графического или табличного отображения Периодического закона, при этом учёные предлагают всё новые варианты.
Источник информации: https://www.sstu.ru/nauka/iypt/formy-periodicheskoy-tablitsy/
Рис. 1. ГДЗ по химии 8 класс Минченков Е.Е Задание: 6 Знаки химических элементов Периодической таблицы Д И Менделеева
Add
Новыe решебники
Химические знаки (символы) элементов – Справочник химика 21
Символ (химический знак) элемента Обозначение элемента одной или двумя латинскими буквами, принятое в химии [c.547] Каждый изотоп характеризуется двумя величинами массовым числом (проставляется вверху слева от химического знака) и порядковым номером (проставляется внизу слева от химического знака) и обозначается символом соответствующего элемента. Например, изотоп углерода с массовым числом 12 записывается так или или словами углерод-12 . Эта форма записи распространена и на элементарные частицы электрон 2е, нейтрон п, протон 1р или ЦН, нейтрино Sv. Изотопы известны для всех химических элементов. Так, кислород имеет изотопы с массовыми числами 16, 17, 18 Ю, 0, 0. Изотопы аргона Аг, Аг, 1 Аг. Изотопы калия Г К, 1гК. [c.42]
Например, изотоп углерода с массовым числом 12 записывается так или или словами углерод-12 . Эта форма записи распространена и на элементарные частицы электрон 2е, нейтрон п, протон 1р или ЦН, нейтрино Sv. Изотопы известны для всех химических элементов. Так, кислород имеет изотопы с массовыми числами 16, 17, 18 Ю, 0, 0. Изотопы аргона Аг, Аг, 1 Аг. Изотопы калия Г К, 1гК. [c.42]
Каждый элемент имеет свое название и свой символ (химический знак). Символы элементов состоят из одной или двух букв латинского названия элементов и являются интернациональными. Названия элементов в каждом языке различны. [c.9]
Наличие химической азбуки — знаков (символов) химических элементов — позволило ввести для всех химических индивидов химические формулы, отражающие их состав. При существовании химического индивида в атомной или молекулярной форме его химическая формула обозначается химическим знаком элемента с индексом, указывающим число атомов в атомной совокупности (единичный индекс не указывается), например благородные газы — Не, Ке, Аг, Кг, галогены — Га, С12, Вг,, Ха, белый фосфор — Р4. Если же химический индивид входит в состав атомного ассоциата или агрегата, ему приписывают химическую формулу с единичным индексом. [c.11]
Если же химический индивид входит в состав атомного ассоциата или агрегата, ему приписывают химическую формулу с единичным индексом. [c.11]
Чтобы можно было представить на бумаге элементы и соединения, был разработан международный язык. Буквами этОго языка являются химические знаки — символы элементов. Каждому элементу присваивается химический символ из одной или двух букв. Заглавной пишется только первая буква. Например, С – символ углерода, а Са – символ кальция. Символы некоторых наиболее привычных элементов приведены в табл. 1.3. Каждое из слов , или химических формул, этого химического языка представляет определенное химическое соединение. В химических формулах каждый символ обозначает один из химических элементов, присутствующих в данном соединении. [c.41]
В настоящее время известно 107 химических элементов. Каждый из них обозначается особым знаком (символом), представляющим собой первую или же первую и одну из последующих букв латинского названия элемента.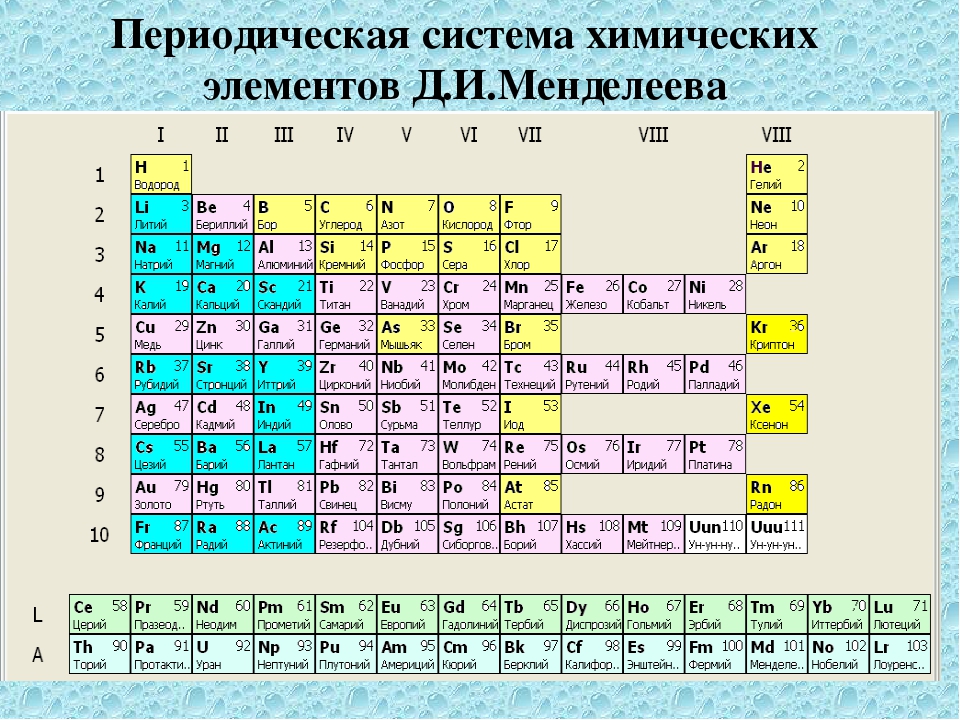 [c.7]
[c.7]
ХИМИЧЕСКИЕ ЗНАКИ (СИМВОЛЫ) ЭЛЕМЕНТОВ [c.31]
Химические знаки (символы) важнейших элементов и их атомные веса [c.25]
ХИМИЧЕСКИЕ ЗНАКИ—см. Символы химических элементов. [c.274]
Каждый химический знак выражал массу одного атома элемента. Для обозначения соединений из двух или трех атомов их символы помещали рядом, например вода ш, аммиак [c.140]
Внесены изменения в названия и символы некоторых элементов астат А1 (вместо астатин), иод 1 (вместо йод J), менделеевий Мс( (вместо менделевий Му), эйнштейний — химический знак Ез (вместо Е), лоуренсий — химический знак Ьг (вместо Ь у). [c.173]
В теме Первоначальные химические понятия формирует ся навык пользования химическими знаками. Необходимо добиваться прочного знания учащимися знаков некоторых химических элементов, но нельзя чрезмерно увлекаться one- рированием химическими символами в ущерб содержатель- ной их стороне. Каждый символ должен быть наполнен дл учащихся химическим смыслом, чтобы изучение химической символики не снижало их интереса к химии. I [c.218]
Каждый символ должен быть наполнен дл учащихся химическим смыслом, чтобы изучение химической символики не снижало их интереса к химии. I [c.218]
Химическая формула — это изображение качественного и количественного состава вещества при помощи символов химических элементов, а также числовых, буквенных и других знаков. Так же, как и символы элементов, химические формулы имеют интернациональные изображения. [c.26]
В воде неорганические соединения диссоциируют на электрически заряженные атомы и радикалы, называемые ионами. Распад веществ на составляющие их ионы называется ионизацией. Ион выражается химическим символом элемента или радикала со знаками плюс или минус вверху, указывающими число единичных зарядов иона. [c.11]
Каждому химическому элементу соответствует определенный знак (или символ), который обозначает какой это химический элемент один атом этого элемента его атомный вес. Например, химический знак серы S показывает, что это элемент сера, что это один атом серы и что атомный вес его 32. [c.7]
Например, химический знак серы S показывает, что это элемент сера, что это один атом серы и что атомный вес его 32. [c.7]
Условное буквенное обозначение химического элемента называют химическим знаком, или символом, элемента. [c.21]
Обозначение атомов элементов с помощью букв называется химическим знаком или символом элемента. [c.18]
Методика изображения схемы для вещества с ковалентной связью следующая сначала между химическими символами ставят столько пар общих точек, сколько непарных электронов у элемента, затем дописывают вокруг химического символа столько точек, сколько не хватает до номера группы, в которых стоят элементы. Например, в схеме СОг, так как у кислорода 2 непарных электрона, то между химическими знаками СиО пишут по [c.52]
Если массовое число радиоактивного изотопа не достоверно, то оно заключено в круглые скобки если не достоверно обнаружение самого изотопа, то символ изотопа помещен в скобках. Когда массовое число неизвестно, приводится химический символ элемента с гипотетическим (со знаком вопроса) массовым числом. Изомеры обозначаются буквой м . В случае двух изомеров метастабильные состояния обозначаются м и м2 . [c.637]
Когда массовое число неизвестно, приводится химический символ элемента с гипотетическим (со знаком вопроса) массовым числом. Изомеры обозначаются буквой м . В случае двух изомеров метастабильные состояния обозначаются м и м2 . [c.637]
Вещества и активированные комплексы представляют собой тогда 0-мерные элементы, которые можно обозначить первые — буквами А, В. .. или химическими знаками Нг, H I и т. д., вторые-символами Ri, R2 Траектории представляют собой 1-мерные, или линейные, элементы, в которых для нас здесь самое [c.283]
Все элементы обозначают особыми знаками (символами), состоящими из одной или двух латинских букв. Этими знаками пользуются при написании химических реакций. Например, водород обозначают буквой Н (аш), углерод буквой С (це), натрий буквами Ь а (на) и т. д. [c.44]
Химические знаки (символы) элементов были введены шведским химиком Берцелиусом в 1813 г. Они представляют собой начальные буквы латинских названий элементов. Например, азот (Nitrogenium) обозначается буквой N, фосфор (Phospholrus) буквой Р, калий (Kalium) — буквой К. Латинские названия некоторых элементов начинаются с одной и той ше буквы. В этих случаях к первой букве символа добавляется одна из последующих. Например [c.24]
Например, азот (Nitrogenium) обозначается буквой N, фосфор (Phospholrus) буквой Р, калий (Kalium) — буквой К. Латинские названия некоторых элементов начинаются с одной и той ше буквы. В этих случаях к первой букве символа добавляется одна из последующих. Например [c.24]
Химический знак (символ химического элемента) применяется как сокращение для названия элемента. В качестве знака обычно берут одну или две буквы от латинского названия элементов. Си — медь uprum). Au — золото (Aurum) и т. п. Система химических знаков была предложена в 1811 г. шведским ученым Я. Берцелиусом. [c.14]
Русское нааванле элемента Латинское название элемента Химический знак (символ) Произношение химического знака Атомный вес (округлен-лын) [c.31]
Из табл. 58. где элементы расположены по периодам системы Менделеева (причем у химического знака каждого элемента указан символ его нормального терма), ясно видно изменение четности и нечетности термов при продвижении вдоль каждой строки и сходство термов атомов, стоящих в одинаковых столбцах периодической системы.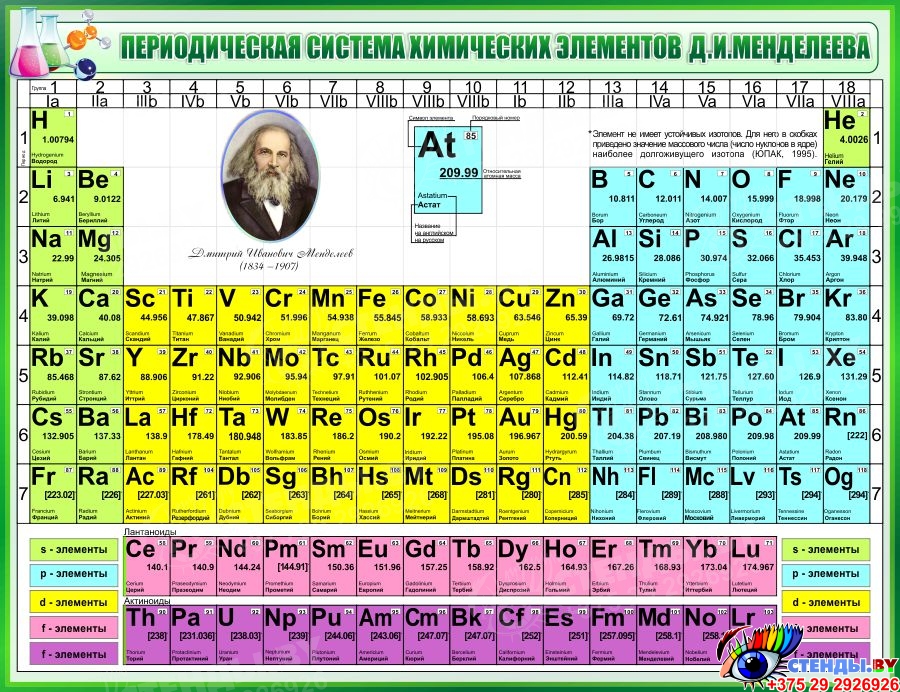 [c.315]
[c.315]
Изображение электронов в виде символов (точек, крестиков и т. п.), поставленных у химического знака элемента. Для удобства электроны, принадлежащие разным атомам, иногда изображают разными символами. В случае полярной связи указывают направление смещения электронной плотности. Описанные выше процессы образоЕиния молекул водорода и хлороводорода отобразятся схемами [c.64]
Для хороших условий видимости достаточно I = 3, для удовлетворительных / = 1J, для вспомогательной информации (осевые линии, штриховые и т. д.) допускается / = 1. Рисунок, так же как и текст, может занимать любую площадь в зависимости от задач кадра. Однако при максимальном заполнении кадра высота буквы не может быть меньше /зо—высоты листа основы, высота химического знака Vis— /26- Учитывая, что символ элемента состоит в большинстве случаен н лвух знаков, размеры их определяются более жестко, чем размеры букв. Размер изображения химических связей такой же, как и букв или химических знаков. В некоторых химических формулах необходимо проставлять индексы. В этом случае рекомендуется уменьшать его размер не более чем в 2,5 раза по сравнению с высотой знака химического элемента. Соблюдение этих требований обеспечивает читаемость всех химических формул в кадре. [c.122]
В некоторых химических формулах необходимо проставлять индексы. В этом случае рекомендуется уменьшать его размер не более чем в 2,5 раза по сравнению с высотой знака химического элемента. Соблюдение этих требований обеспечивает читаемость всех химических формул в кадре. [c.122]
Расположенный под снмврлом химического элемента знак J (рис. 1.3) указывает, что а этом элементе завершается застройка орбиталей определенного типа. Например, под символом элемента Сс находится знак означающий, [c.34]
Более употребительна краткая запись ядерных реакций. Вначале записывают химический знак исходного ядра, затем (в скобках) кратко обозначают частицу, вызвавшую реакцию, и частицу, образовавшуюся в результате реакции, после чего ставят химический знак конечного ядра. При этом у символов исходного и конечного ядер обычно проставляются только массовые числа, так как заряды ядер легко определять по периодической системе элементов Д.
 И. Менделеева. Сокращенная запись рассмотренных ранее ядерных реакций следующая 2 А1(а, ppSi N(a, рРО (-, ар2 п, [c.43]
И. Менделеева. Сокращенная запись рассмотренных ранее ядерных реакций следующая 2 А1(а, ppSi N(a, рРО (-, ар2 п, [c.43]Каждый изотоп характери уетя д[.умя величинами массовым числом (проставляется вверху сгг.зв i от. химического знака) и порядковым номером (проставляется пни зу слева от хими, ( Ского зна са) и обозначается символом соответствук)щего элемента. Ьапример, изотоп углерода с массовым числом М зшисывается так или или [c.48]
Для изображения связей, образованных электронными парами, постз гают так. Символом данного элемента обозначают ядро его атома и все энергетические уровни, кроме внешнего. Число электронов на наружном энергетическом уровне обозначают соответствующим числом точек около химического знака элемента, например, [c.56]
Каждый изотоп характеризуется двумя величинами массовым числом (проставляется вверху слева от химического знака) и порядковым номером эле.мента (проставляется внизу слева от химического знака) и обозначается символом соответствующего элемента. Например, изотоп углерода с. массовым числом 12 записывается так ЧС, или С, ilth словами углерод-12 . Эта форма записи распространена и на элементарные частицы электрон °е, нейтрон , протон [р или Н, нейтрино oV. [c.30]
Например, изотоп углерода с. массовым числом 12 записывается так ЧС, или С, ilth словами углерод-12 . Эта форма записи распространена и на элементарные частицы электрон °е, нейтрон , протон [р или Н, нейтрино oV. [c.30]
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ – Заклинание панды
Аудио запись в блоге доктора Айзекса. Нажмите, чтобы слушать и читать вместе!Список химических элементов в таблице Менделеева является вечным фаворитом как специалистов по правописанию, так и экспертов по словообразованию. Этот список легко составить, и он полон слов, которые варьируются от очень простых до почти непостижимых. Фактически, когда Paideia впервые заменили первую итерацию Words of the Champions в 1995 году, список элементов был одним из первых, появившихся на его страницах.Вот несколько рекомендаций, о которых следует помнить, когда вы начинаете изучать список химических элементов.
- Большинство химических элементов заканчиваются суффиксом – ium .
 (Исключения очевидны, например, олово, медь, мышьяк, золото … и тому подобное.) Если вы получаете слово элемента, которое звучит как \ēəm\ в конце, вы можете быть на 100% уверены, что оно будет написано только как – иум . Действительно? Действительно.
(Исключения очевидны, например, олово, медь, мышьяк, золото … и тому подобное.) Если вы получаете слово элемента, которое звучит как \ēəm\ в конце, вы можете быть на 100% уверены, что оно будет написано только как – иум . Действительно? Действительно. - Некоторые элементы на самом деле основаны на географических названиях с добавленным в конце суффиксом – ium .Германия, Франция, Америка и даже европейский континент заслужили свое место в этом списке.
- Другие элементы основаны на мифологических фигурах… включая некоторые из самых известных радиоактивных элементов атомного века. К этой категории относятся элементы, названные в честь Нептуна, Урана, Прометея, Тора и Титана.
- Другие элементы названы в честь ученых, чей огромный вклад в химию и физику принес им эту честь. Здесь вы увидите таких, как Альберт Эйнштейн, Мария Кюри и Дмитрий Менделеев.
Необычные названия элементов
Мы знаем некоторые химические элементы по их латинским, греческим или немецким названиям, а также по их более распространенным английским названиям. Эти слова могут быть не такими распространенными, но они достаточно распространены, чтобы появляться в словаре — и время от времени в пчелах. Именно эти менее распространенные имена вносят свой вклад в сокращения, которые мы видим в периодической таблице.
Эти слова могут быть не такими распространенными, но они достаточно распространены, чтобы появляться в словаре — и время от времени в пчелах. Именно эти менее распространенные имена вносят свой вклад в сокращения, которые мы видим в периодической таблице.
- Argentum (Ag) = серебро
- Aurum (Au) = золото
- Cuprum (Cu) = медь
- Ferrum (Fe) = железо
- Hydrargyrum (Hg) = ртуть
- Kalium (K) = фосфор
- Натрий (Na) = натрий
- Plumbum (Pb) = свинец
- Stannum (Sn) = олово
- Stibium (Sb) = сурьма
- Wolfram (W) = вольфрам
9005 Химические элементы
Фото предоставлено Кристин Л.Миллер
5 лучших приложений для периодической таблицы
1. Периодическая таблица (iOS, Android)
Каждый элемент представлен в таблице Менделеева вместе с множеством полезной информации, изображений, видео и подкастов. Просматривайте тенденции и шаблоны, из которых состоит таблица, и быстро сравнивайте элементы друг с другом. Королевское химическое общество перевело свой веб-сайт Периодической таблицы в версию приложения, доступную как для мобильных устройств, так и для планшетов.Огромный объем информации доступен для каждого отдельного элемента и представлен в логичной и привлекательной форме. Вы можете щелкнуть каждый элемент, чтобы прочитать подробную информацию, и вкладки вверху, чтобы изучить каждый раздел. Элементы можно мгновенно отсортировать в порядке от высшего к низшему, нажав на соответствующий заголовок.
Просматривайте тенденции и шаблоны, из которых состоит таблица, и быстро сравнивайте элементы друг с другом. Королевское химическое общество перевело свой веб-сайт Периодической таблицы в версию приложения, доступную как для мобильных устройств, так и для планшетов.Огромный объем информации доступен для каждого отдельного элемента и представлен в логичной и привлекательной форме. Вы можете щелкнуть каждый элемент, чтобы прочитать подробную информацию, и вкладки вверху, чтобы изучить каждый раздел. Элементы можно мгновенно отсортировать в порядке от высшего к низшему, нажав на соответствующий заголовок.
Если вы хотите узнать название и символы всех 118 химических элементов, это приложение поможет вам в этом. Он имеет несколько методов обучения. Вы можете выбрать тот, который подходит вам больше всего.
Попробуйте базовую викторину по химическим элементам, чтобы вспомнить базовые знания. Продвинутый уровень поможет вам узнать больше элементов с молекулярной массой, ядерным зарядом, протонами, нейтронами и электронами. Если вы прошли базовый и продвинутый уровень, попробуйте пройти викторину по всем химическим элементам.
Если вы прошли базовый и продвинутый уровень, попробуйте пройти викторину по всем химическим элементам.
Приложение Periodic Table от Socratica, вероятно, является одним из лучших и наиболее часто используемых приложений для изучения и проверки ваших знаний об элементах периодической таблицы. Он предоставляет более 30 полезных фактов для каждого элемента, аудиоклипы для произношения, пояснительные видео и мини-викторины.Идеальный инструмент для повторения химии и учебное пособие для использования в классе!
Это приложение покажет вам совершенно новый подход к изучению таблицы Менделеева. Вы легко запомните все химические элементы и познакомитесь с их физическими формами. Вам нужно нажать на изображение химического элемента, чтобы узнать о нем больше.
Вы увидите подробную информацию о каждом химическом элементе. Названия химических элементов переведены на десятки языков.Вы можете изучить все варианты.
5. Периодическая таблица 2020 (iOS, Android)
Это приложение имеет современный дизайн с темной темой. Вам понравится использовать его для учебы или работы. Он содержит информацию обо всех изучаемых элементах. Нажмите на нужный химический элемент, и приложение откроет окно химического элемента. Вы можете прочитать характеристики химического элемента. Вы узнаете латинские и английские названия, когда и кем был открыт этот химический элемент.Приложение сохраняет историю поиска химических элементов. Он также предоставит вам ссылки на другие источники для каждого химического элемента.
Вам понравится использовать его для учебы или работы. Он содержит информацию обо всех изучаемых элементах. Нажмите на нужный химический элемент, и приложение откроет окно химического элемента. Вы можете прочитать характеристики химического элемента. Вы узнаете латинские и английские названия, когда и кем был открыт этот химический элемент.Приложение сохраняет историю поиска химических элементов. Он также предоставит вам ссылки на другие источники для каждого химического элемента.
Хотите больше практической науки? Попробуйте лучшие приложения по химии.
Кроме того, лучшие научные приложения
Стенограмма: Химия в ее стихии: нобелий(Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Мира Сентилингам На этой неделе “О, как назвать элемент?” Особенно, когда несколько групп заявляют о его открытии. А раз назвали, как это сказать? Нет звонок ium? Нет пчелы лиум? Чтобы уточнить, вот Брайан Клегг. Брайан Клегг Можно подумать, что решить, как называется элемент, довольно просто. Но у элемента 102 было больше, чем его справедливая доля недоразумений и аргументов.Начнем с вопроса о том, как произносится его нынешнее название: ни колокол, ни ium (потому что оно происходит от того же корня, что и Нобелевская премия), ни bee, ни lium, созданный по образцу того, как мы говорим гелий. Даже представители Королевского химического общества устроили бурную дискуссию по этому поводу, когда я спросил их, прежде чем перейти к нобелию. И это только произношение — само название потребовало изрядной переборки. Элемент 102 является одним из наиболее стабильных короткоживущих искусственных трансфермиевых элементов с периодом полураспада 58 минут для нобелия 259. Нобелий можно рассматривать как один из них.Некоторые утверждают, что Альфред Нобель был известным ученым. Это правда, что технически он был химиком, но я призываю любого сделать научное открытие, которым славится Нобель. Родившийся в Стокгольме в 1833 году, Нобель был сыном инженера. Он работал в Париже с изобретателем нитроглицерина, взрывоопасного, но очень нестабильного вещества, и посвятил несколько лет поиску способа сделать его пригодным для использования, наконец, в 1867 году запатентовав вещество, которое принесло ему состояние, – динамит. Нобель был ответственен за изобретение ряда взрывчатых веществ и других химических продуктов, но был во многом промышленным химиком, а не тем человеком, в честь которого назван элемент. Название, как вы можете себе представить, вместо этого происходит от Нобелевской премии, учрежденной по завещанию Нобеля, где он объявил (к некоторому удивлению своей семьи), что его состояние будет потрачено на фонд для предоставления премий по физике, химии, физиологии или Медицина, литература и мир. Но думать, что нобелий получил свое название от Нобелевской премии, также было бы неверно. По правде говоря, ему никогда не следовало давать такое имя. Впервые этот элемент был получен в 1956 году в Объединенном институте ядерных исследований в Дубне, затем в СССР. Первооткрыватели назвали его joliotium в честь Ирэн Жолио-Кюри, дочери Пьера и Марии Кюри. В то время они, похоже, полностью игнорировались международным сообществом. Только в 1997 году Международный союз теоретической и прикладной химии, орган, контролирующий наименования элементов, признал, что российская лаборатория впервые создала элемент 102. Всего через два года после создания иолиотия в Дубне на линейном ускорителе тяжелых ионов в Беркли, штат Калифорния, был получен нобелий путем бомбардировки кюрия ионами углерода. Этот эксперимент был проведен группой, в которую входили Альберт Гиорсо и Гленн Т. Сиборг, ответственные за изоляцию стольких элементов в Беркли. Однако они не дали элементу его имени. Его уже год называют нобелием. Это потому, что команда Нобелевского института физики в Стокгольме объявила об открытии нового элемента за год до этого, в 1957 году.Используя циклотрон для проведения аналогичной реакции, они думали , что произвели изотоп элемента 102 с периодом полураспада десять минут. Не случайно они хотели назвать этот элемент нобелием. Но их эксперимент не удалось проверить — существование такого изотопа никогда не было доказано. Таким образом, нобелий — это единственный случай, подходящий где-то между третьей и четвертой группами. Это элемент, названный в честь места, где он был , думал, что был впервые выделен, но на самом деле это не так. Как и большинство короткоживущих искусственных элементов, мы мало что знаем о нобелии, хотя он производится в десяти различных изотопах. Судя по его положению в таблице, это будет серый или серебристый металл, но для проверки этого сделано недостаточно. Мы немного знаем о его химии. В отличие от большинства актинидов, плавающей полосы элементов, которые должны быть зажаты между актинием и лоуренсием, которые, как правило, имеют стабильные ионы с валентностью 3, то есть с положительным зарядом на три электрона, самые стабильные ионы нобелия имеют валентность 3. валентность 2. Как и все искусственные трансфермиевые элементы, нобелий не используется и не украшает. Его производство было достижением, но оно не имеет практической ценности и вряд ли когда-либо получит ее. Хотя изначально были сомнения по поводу названия нобелия, возможно, правильно, что название, которое в конце концов прижилось, связано с Нобелевской премией. Было высказано предположение, что Альфред Нобель под влиянием своей подруги, борца за мир Берты фон Зутнер, учредил Нобелевскую премию в качестве извинения за вред, причиненный взрывчатыми веществами. Мира Сентилингем Итак, в конце концов, победа была со всех сторон. Это был Брайан Клегг с невзрывоопасной химией нобелия. Теперь, на следующей неделе, элемент, который кажется неправильно понятым. Квентин Купер История ошибочной идентичности, его первооткрыватель, вводящий в заблуждение и часто неправильно написанный, — все это добавляет ауре комедии и путаницы вокруг молибдена… корень жизни – не только человеческая жизнь, но почти вся жизнь на планете: да, вы найдете крошечные количества его во всем, от нитей электронагревателей до ракет и защитных покрытий в котлах, и его высокая производительность при высоких температурах. температуры означают, что он имеет ряд коммерческих применений. Мира Сентилингем Что это за приложения, спросите вы? Что ж, чтобы узнать, присоединяйтесь к Квентину Куперу на Химию на следующей неделе в своей стихии. А пока я Мира Сентилингем, и спасибо, что выслушали. (Акция) (Конец акции) |
Таблицы произношения | Adrian Underhill’s Pronunciation Site
В 1869 году русский химик Дмитрий Менделеев разработал первую версию теперь очень знакомой таблицы химических элементов.Это показало все элементы, которые были известны в то время, и некоторые из них, которые были обнаружены позже. Элементы показаны в порядке возрастания количества протонов в ядре, начиная с водорода (H), который имеет один протон. Строки и столбцы также организованы так, чтобы выделять семейства элементов со схожими химическими свойствами, включая, например, их склонность взаимодействовать или нет с другими элементами.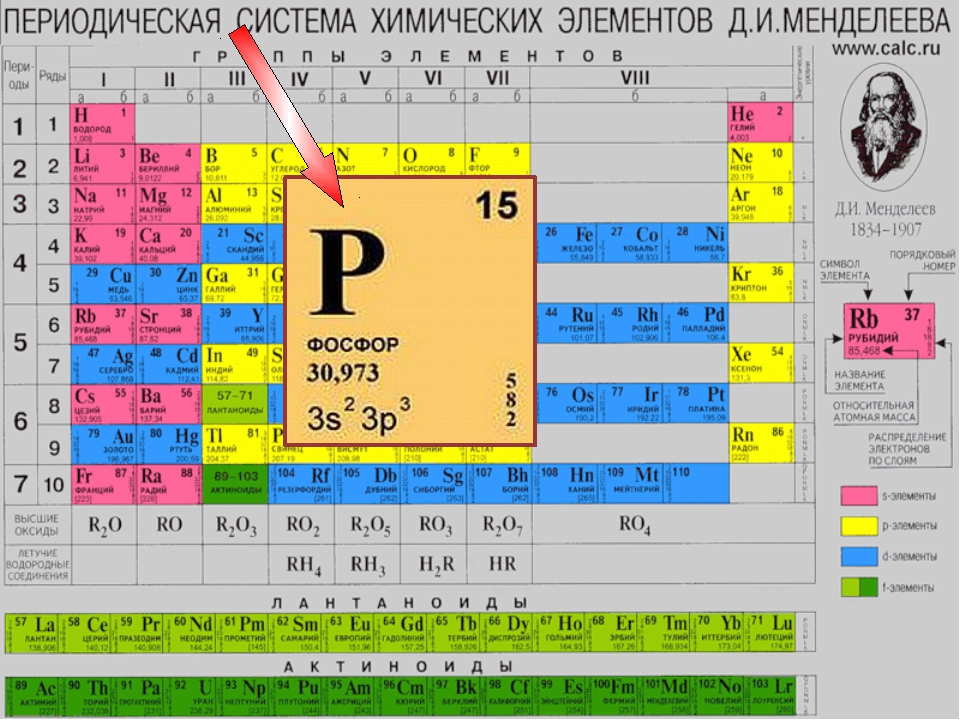
Эти химические свойства повторяются по мере того, как повторяются сходства в структурах электронов и протонов, отсюда и прилагательное «периодический».Таким образом, положение элемента в периодической таблице многое говорит вам о том, как этот элемент сделан и как он себя ведет.
То же самое относится и к таблице Sound Foundations. Я не хочу преувеличивать сходство, но есть некоторые сходства, которые могут помочь нам продуктивно подумать об этом. Например, строки и столбцы на диаграмме Sound Foundations многое говорят вам о:
.- Семейства звуков с общими качествами (гласные, дифтонги, согласные, полугласные и т. д.)
- Как произносится звук (округление губ, плавное скольжение, фрикативные, смычные, носовые, плавные, голос, длина и т. д.)
- Из каких частей рта и артикуляционного аппарата он состоит (язык, зубы, губы, голос, нос и т. д.)
- Где производится (губы, зубы, небо, передняя, задняя, верхняя, нижняя и т. д.)
И точно так же, как химические элементы иногда существуют сами по себе, хотя обычно в множественных комбинациях в виде молекул и соединений, так и (элементарные) звуки/фонемы иногда используются сами по себе (я, о, мм, ах или, э-э). , шшш и т. д.), но в основном в сочетаниях кластеров, слогов, слов и связанных высказываний.
, шшш и т. д.), но в основном в сочетаниях кластеров, слогов, слов и связанных высказываний.
Периодическая таблица элементов стремится показать все возможные элементы. То же самое во всех странах и, вероятно, на Марсе. Возможно, Периодическая таблица звуков могла бы показать все звуки разных языков или все звуки, включенные в Международный фонетический алфавит (IPA). Однако полезнее для изучающих и преподающих тот или иной язык иметь таблицу только звуков этого языка, да и то нужны не все звуки (аллофоны), а только те звуки, которые приводят к различию значения. (фонемы).Таким образом, можно составить таблицу Sound Foundations для отдельных языков и разновидностей этого языка.
Справа на этой странице вы найдете диаграммы Sound Foundations для британского и американского английского. И см. книгу Sound Foundations (Macmillan ELT) для дополнительных французских и немецких чартов.
Наконец, периодическая таблица элементов красива, она просто хорошо выглядит и вызывает любопытство, что, я думаю, можно сказать и о таблице Sound Foundations.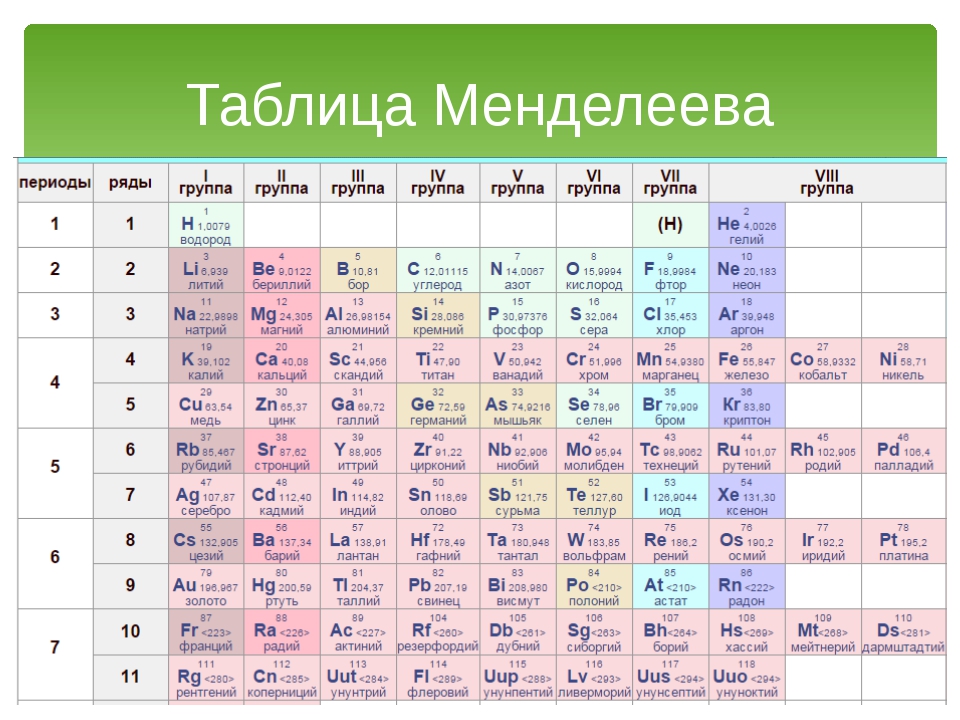
Для просмотра других поразительно отличающихся и красивых презентаций Периодической таблицы элементов щелкните здесь: http://en.wikipedia.org/wiki/Alternative_periodic_tables. А для получения дополнительной информации о самой периодической таблице щелкните здесь: http://en.wikipedia.org/wiki/Periodic_table
Chem4Kids.com: Atoms: Compound Naming
Процесс названий соединений — это всего лишь набор правил. Мы собираемся показать вам некоторые основы. Есть несколько продвинутых способов именования вещей, которые мы сейчас пропустим.
Когда у вас есть два разных элемента, в составном имени обычно есть только два слова. Первое слово — это имя первого элемента. Второе слово сообщает вам второй элемент и количество атомов в соединении. Второе слово обычно заканчивается на IDE . Это суффикс. Когда вы работаете с неметаллами, такими как кислород (O) и хлор (Cl), префикс (раздел в начале слова) второго элемента изменяется в зависимости от количества атомов в соединении. Это вот так…
Это вот так…
Вы что-нибудь заметили на доске? Вы можете видеть, что префиксы очень похожи на префиксы геометрических фигур. Вы знаете, что такое треугольник . Правильно? Приставка три- означает три. Итак, если у вас есть три атома хлора, вы бы назвали его трихлоридом .
Посмотрите и другие имена. Вы можете знать о пятиугольнике, шестиугольнике или восьмиугольнике. Система именования в химии работает точно так же!
Давайте объединим эти идеи! Помните, мы говорим только о простых соединениях без металлических элементов.В названии большинства простых соединений всего два слова. Начнем с угарного газа (СО). Это имя говорит вам, что у вас есть один атом углерода (C) и один атом кислорода (O) (вы также можете использовать префикс MONO , чтобы сказать один атом). Помните, что второе слово заканчивается на -ide. Итак…
(1) Углерод + (1) Кислород = Окись углерода (CO)
Теперь мы будем опираться на этот пример.
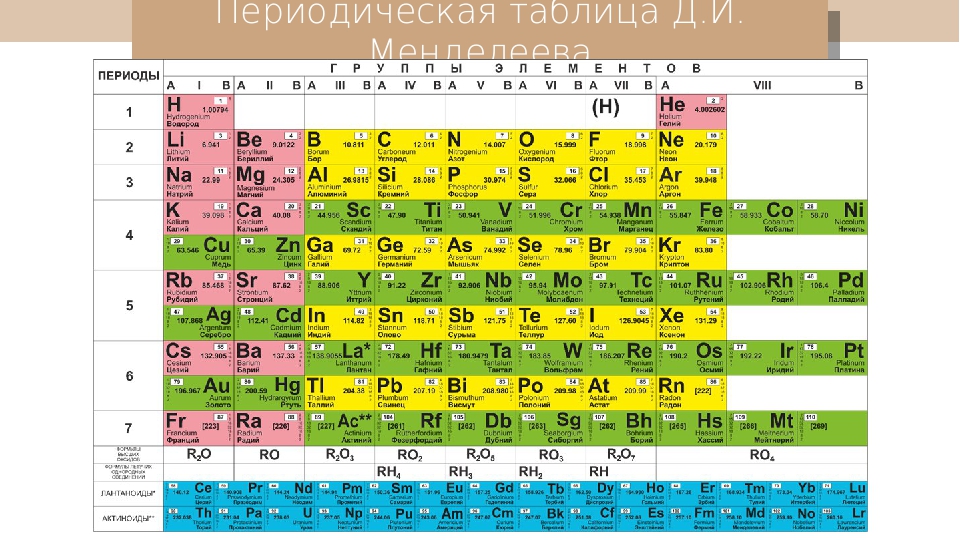 Что, если у вас есть один атом углерода (C) и два атома кислорода (O)?
Что, если у вас есть один атом углерода (C) и два атома кислорода (O)?(1) Углерод + (2) Кислород = Двуокись углерода (CO 2 )
Последний пример, и мы на этом закончим.Теперь у вас есть один атом углерода (C) и четыре атома хлора (Cl).
(1) Углерод + (4) Хлор = Четыреххлористый углерод (CCl 4 )
Вы должны получить идею сейчас. Название соединения может сказать вам, сколько атомов находится внутри. Взгляните на некоторые примеры и посмотрите, понимаете ли вы, что происходит в названии.
Curiosity собирает образцы (видео НАСА/Лаборатории реактивного движения)
Химия: термины, используемые в химии Списки слов
Кислота любое вещество, которое диссоциирует в воде с образованием кислого едкого раствора, содержащего ионы водорода, имеющего рН менее 7 и превращающего лакмусовый красный спирт в бесцветную легковоспламеняющуюся жидкость, активное начало опьяняющих напитков, производится путем ферментации сахаров, особенно глюкозы, и используется в качестве растворителя и в производстве органических химикатов. Формула: C2H5OH растворимое в щелочи основание или раствор щелочного металла любого из одновалентных металлов лития, натрия, калия, рубидия, цезия и франция, принадлежащих к группе 1А периодической таблицы. Все они являются очень реакционноспособными и электроположительными щелочноземельными металлами, любыми из двухвалентных электроположительных металлов бериллием, магнием, кальцием, стронцием, барием и радием, принадлежащих к группе 2А периодической таблицы. или более физических форм, в которых элемент может существовать сплав металлического материала, такого как сталь, латунь или бронза, состоящий из смеси двух или более металлов или металлических элементов с неметаллическими элементами.Сплавы часто имеют физические свойства, заметно отличающиеся от свойств чистых металлов, аминокислот любой группы органических соединений, содержащих одну или несколько аминогрупп, -Nh3, и одну или несколько карбоксильных групп, -COOH. Альфа-аминокислоты RCH(Nh3)COOH (где R — либо водород, либо органическая группа) входят в состав молекул белков; некоторые могут быть синтезированы в организме (заменимые аминокислоты), а другие не могут быть и поэтому являются важными компонентами рациона (незаменимые аминокислоты) анализ разложение вещества на его элементы, радикалы или другие составляющие для определения видов составляющих присутствующий (качественный анализ) или количество каждого составляющего (количественный анализ) аниона отрицательно заряженного иона; ион, который притягивается к аноду при электролизе анодположительный электрод в электролизере атомнаименьшее количество элемента, которое может принять участие в химической реакции атомная массамасса изотопа элемента в атомных единицах массы атомный номерколичество протонов в ядро атома элементной базы основной компонент смеси точка кипения температура кипения жидкости при данном давлении, обычно атмосферном давлении на уровне моря; температура, при которой давление паров жидкости равно внешнему давлению, связывать что-то, что связывает, скрепляет или удерживает вместе, например, цепь или веревку Броуновское движениеслучайное движение микроскопических частиц, взвешенных в жидкости, вызванное бомбардировкой частиц жидкость.
Формула: C2H5OH растворимое в щелочи основание или раствор щелочного металла любого из одновалентных металлов лития, натрия, калия, рубидия, цезия и франция, принадлежащих к группе 1А периодической таблицы. Все они являются очень реакционноспособными и электроположительными щелочноземельными металлами, любыми из двухвалентных электроположительных металлов бериллием, магнием, кальцием, стронцием, барием и радием, принадлежащих к группе 2А периодической таблицы. или более физических форм, в которых элемент может существовать сплав металлического материала, такого как сталь, латунь или бронза, состоящий из смеси двух или более металлов или металлических элементов с неметаллическими элементами.Сплавы часто имеют физические свойства, заметно отличающиеся от свойств чистых металлов, аминокислот любой группы органических соединений, содержащих одну или несколько аминогрупп, -Nh3, и одну или несколько карбоксильных групп, -COOH. Альфа-аминокислоты RCH(Nh3)COOH (где R — либо водород, либо органическая группа) входят в состав молекул белков; некоторые могут быть синтезированы в организме (заменимые аминокислоты), а другие не могут быть и поэтому являются важными компонентами рациона (незаменимые аминокислоты) анализ разложение вещества на его элементы, радикалы или другие составляющие для определения видов составляющих присутствующий (качественный анализ) или количество каждого составляющего (количественный анализ) аниона отрицательно заряженного иона; ион, который притягивается к аноду при электролизе анодположительный электрод в электролизере атомнаименьшее количество элемента, которое может принять участие в химической реакции атомная массамасса изотопа элемента в атомных единицах массы атомный номерколичество протонов в ядро атома элементной базы основной компонент смеси точка кипения температура кипения жидкости при данном давлении, обычно атмосферном давлении на уровне моря; температура, при которой давление паров жидкости равно внешнему давлению, связывать что-то, что связывает, скрепляет или удерживает вместе, например, цепь или веревку Броуновское движениеслучайное движение микроскопических частиц, взвешенных в жидкости, вызванное бомбардировкой частиц жидкость. Впервые обнаруженный в 1827 г., он предоставил убедительные доказательства в поддержку кинетической теории молекул углеводов большой группы органических соединений, включая сахара, такие как сахароза, и полисахариды, такие как целлюлоза, гликоген и крахмал, которые содержат углерод, водород. , и кислород с общей формулой Cm(h3O)n: важный источник пищи и энергии для животных катализатор вещество, которое увеличивает скорость химической реакции, не претерпевая при этом никаких постоянных химических изменений катод отрицательный электрод в электролитической ячейке; электрод, по которому электроны поступают в устройство из внешней цепи катиона положительно заряженного иона; ион, который притягивается к катоду во время цепи электролизадва или более атома или группы связаны вместе так, что конфигурация образовавшейся молекулы, иона или радикала напоминает цепное химическое уравнениепредставление химической реакции с использованием символов элементов для обозначения количества вещества, обычно в молях, каждого реагента и продукта цепной реакциипроцесс, при котором нейтрон, сталкивающийся с атомным ядром, вызывает деление и выбрасывание одного или нескольких других нейтронов, которые побуждают другие ядра расщеплять хроматографиюметод разделения и анализа компонентов смеси жидкостей или газов путем селективной адсорбции, например, в колонке с порошком (колоночная хроматография) или на полоске бумаги (бумажная хроматография) сжигание—химический процесс, при котором два соединения, например натрий и хлор, реагируют вместе, образуя производить теплоту и свет соединениевещество, содержащее атомы двух или более химических элементов, удерживаемых вместе химическими все облигации сконцентрированы
после удаления воды для увеличения концентрации конденсациятип реакции, при которой две органические молекулы объединяются, образуя более крупную молекулу, а также простые молекулы, такие как вода, метанол и т.
Впервые обнаруженный в 1827 г., он предоставил убедительные доказательства в поддержку кинетической теории молекул углеводов большой группы органических соединений, включая сахара, такие как сахароза, и полисахариды, такие как целлюлоза, гликоген и крахмал, которые содержат углерод, водород. , и кислород с общей формулой Cm(h3O)n: важный источник пищи и энергии для животных катализатор вещество, которое увеличивает скорость химической реакции, не претерпевая при этом никаких постоянных химических изменений катод отрицательный электрод в электролитической ячейке; электрод, по которому электроны поступают в устройство из внешней цепи катиона положительно заряженного иона; ион, который притягивается к катоду во время цепи электролизадва или более атома или группы связаны вместе так, что конфигурация образовавшейся молекулы, иона или радикала напоминает цепное химическое уравнениепредставление химической реакции с использованием символов элементов для обозначения количества вещества, обычно в молях, каждого реагента и продукта цепной реакциипроцесс, при котором нейтрон, сталкивающийся с атомным ядром, вызывает деление и выбрасывание одного или нескольких других нейтронов, которые побуждают другие ядра расщеплять хроматографиюметод разделения и анализа компонентов смеси жидкостей или газов путем селективной адсорбции, например, в колонке с порошком (колоночная хроматография) или на полоске бумаги (бумажная хроматография) сжигание—химический процесс, при котором два соединения, например натрий и хлор, реагируют вместе, образуя производить теплоту и свет соединениевещество, содержащее атомы двух или более химических элементов, удерживаемых вместе химическими все облигации сконцентрированы
после удаления воды для увеличения концентрации конденсациятип реакции, при которой две органические молекулы объединяются, образуя более крупную молекулу, а также простые молекулы, такие как вода, метанол и т. д. коррозияпроцесс, при котором твердое вещество, особенно металл, разъедается и изменяется под действием химического воздействия, как при окислении железа в присутствии воды электролитическим процессом ковалентная связь тип химической связи, предполагающий совместное использование электронов между атомами в молекуле, особенно совместное использование пары электронов двумя соседними атомами кристалл кусок твердого вещества, такого как кварц, правильной формы, в котором плоские грани пересекаются под определенными углами благодаря правильному внутреннему строению его атомов, ионов или молекул кристаллизацияпроцесс, при котором кристаллы образуются либо из чего-то, что было расплавленный или из раствора диффузиябеспорядочное тепловое движение атомов, молекул, скоплений атомов и т. д. в газах, жидкостях и некоторых твердых телах разбавленных (раствора, с суспензия, смесь и т. д.), имеющая низкую концентрацию или концентрацию, которая была снижена за счет примеси; (о веществе) присутствующем в растворе, особенно в слабом растворе при дистилляции водыпроцесс испарения или кипения жидкости и конденсации ее паров электродный элемент в полупроводниковом устройстве, которое излучает, собирает или контролирует движение электронов или дырок электролизэлектропроводность в растворе или расплаве, особенно в использовании этого процесса для индуцирования химических изменений электронная стабильная элементарная частица, присутствующая во всех атомах, обращающаяся вокруг ядра в количествах, равных атомному номеру элемента в нейтральном атоме; лептон с отрицательным зарядом 1.
д. коррозияпроцесс, при котором твердое вещество, особенно металл, разъедается и изменяется под действием химического воздействия, как при окислении железа в присутствии воды электролитическим процессом ковалентная связь тип химической связи, предполагающий совместное использование электронов между атомами в молекуле, особенно совместное использование пары электронов двумя соседними атомами кристалл кусок твердого вещества, такого как кварц, правильной формы, в котором плоские грани пересекаются под определенными углами благодаря правильному внутреннему строению его атомов, ионов или молекул кристаллизацияпроцесс, при котором кристаллы образуются либо из чего-то, что было расплавленный или из раствора диффузиябеспорядочное тепловое движение атомов, молекул, скоплений атомов и т. д. в газах, жидкостях и некоторых твердых телах разбавленных (раствора, с суспензия, смесь и т. д.), имеющая низкую концентрацию или концентрацию, которая была снижена за счет примеси; (о веществе) присутствующем в растворе, особенно в слабом растворе при дистилляции водыпроцесс испарения или кипения жидкости и конденсации ее паров электродный элемент в полупроводниковом устройстве, которое излучает, собирает или контролирует движение электронов или дырок электролизэлектропроводность в растворе или расплаве, особенно в использовании этого процесса для индуцирования химических изменений электронная стабильная элементарная частица, присутствующая во всех атомах, обращающаяся вокруг ядра в количествах, равных атомному номеру элемента в нейтральном атоме; лептон с отрицательным зарядом 1.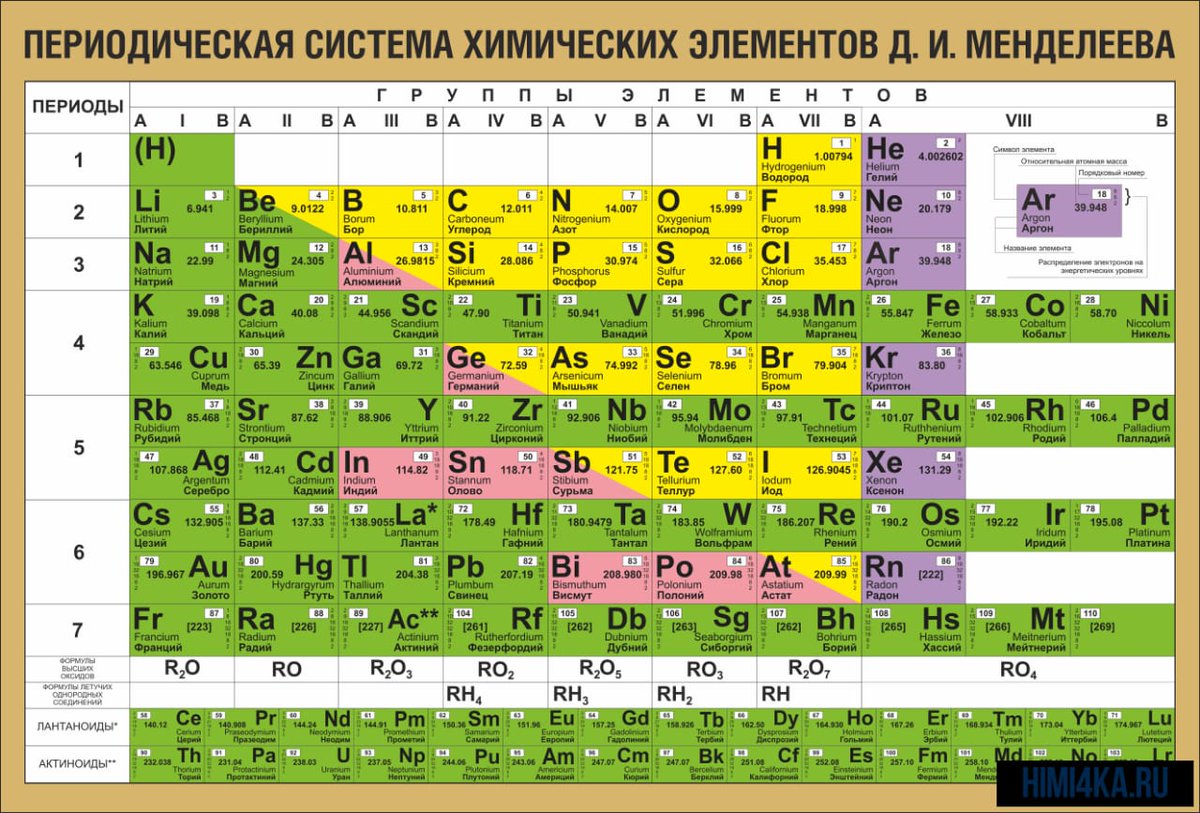 602 176 462 × 10 –19 кулонов, масса покоя 9,109 381 88 × 10–31 кг, радиус 2,817 940 285 × 10–15 метров, спин электровалентности – валентность вещества при образовании ионов, равная число электронов, полученных или потерянных элементом, любым из 118 известных веществ (93 из которых встречаются в природе), которые состоят из атомов с таким же числом протонов в ядрах, эмульсия, светочувствительное покрытие на основе, например бумаге или пленке, состоящей из тонких крупинки бромида серебра, суспендированные в желатиновом эфире, относятся к классу соединений, образующихся в результате реакции между кислотами и спиртами с удалением воды.Сложные эфиры с низкой молекулярной массой, такие как этилацетат, обычно представляют собой летучие ароматные жидкости; жиры – твердые эфиры эфира бесцветная летучая легковоспламеняющаяся жидкость с характерным сладковатым запахом, получаемая реакцией серной кислоты с этанолом: применяется как растворитель и обезболивающее средство. Формула: C2H5OC2H5 Испарение, когда жидкость превращается в пар, вызванное повышением температуры и/или снижением давления.
602 176 462 × 10 –19 кулонов, масса покоя 9,109 381 88 × 10–31 кг, радиус 2,817 940 285 × 10–15 метров, спин электровалентности – валентность вещества при образовании ионов, равная число электронов, полученных или потерянных элементом, любым из 118 известных веществ (93 из которых встречаются в природе), которые состоят из атомов с таким же числом протонов в ядрах, эмульсия, светочувствительное покрытие на основе, например бумаге или пленке, состоящей из тонких крупинки бромида серебра, суспендированные в желатиновом эфире, относятся к классу соединений, образующихся в результате реакции между кислотами и спиртами с удалением воды.Сложные эфиры с низкой молекулярной массой, такие как этилацетат, обычно представляют собой летучие ароматные жидкости; жиры – твердые эфиры эфира бесцветная летучая легковоспламеняющаяся жидкость с характерным сладковатым запахом, получаемая реакцией серной кислоты с этанолом: применяется как растворитель и обезболивающее средство. Формула: C2H5OC2H5 Испарение, когда жидкость превращается в пар, вызванное повышением температуры и/или снижением давления. Это класс природных мягких маслянистых твердых веществ, представляющих собой сложные эфиры глицерина и некоторых жирных кислот.Они присутствуют в некоторых растениях и в жировой ткани животных, образуя резервный источник энергии, и используются в производстве мыла и красок и в пищевой промышленности жирных кислот любого класса алифатических карбоновых кислот, таких как пальмитиновая кислота, стеариновая кислота и олеиновая кислота, составляющие часть липидной молекулы ферментацияхимическая реакция, в которой фермент вызывает расщепление органической молекулы на более простые вещества, особенно анаэробное превращение сахара в этиловый спирт при расщеплении дрожжейакт или процесс расщепления или разделения на части пенамасса маленьких пузырьков газа, образующихся на поверхности жидкости, например пена, образующаяся при взбалтывании раствора мыла или моющего средства в воде формулапредставление молекул, радикалов, ионов и т. д., выраженное символами атомов их составные элементы топливолюбое вещество, сжигаемое в качестве источника тепла или энергии, такое как уголь или нефтяной газвещество в физическом состоянии, в котором оно не сопротивляется изменению формы и pand до бесконечности, чтобы заполнить любой контейнер.
Это класс природных мягких маслянистых твердых веществ, представляющих собой сложные эфиры глицерина и некоторых жирных кислот.Они присутствуют в некоторых растениях и в жировой ткани животных, образуя резервный источник энергии, и используются в производстве мыла и красок и в пищевой промышленности жирных кислот любого класса алифатических карбоновых кислот, таких как пальмитиновая кислота, стеариновая кислота и олеиновая кислота, составляющие часть липидной молекулы ферментацияхимическая реакция, в которой фермент вызывает расщепление органической молекулы на более простые вещества, особенно анаэробное превращение сахара в этиловый спирт при расщеплении дрожжейакт или процесс расщепления или разделения на части пенамасса маленьких пузырьков газа, образующихся на поверхности жидкости, например пена, образующаяся при взбалтывании раствора мыла или моющего средства в воде формулапредставление молекул, радикалов, ионов и т. д., выраженное символами атомов их составные элементы топливолюбое вещество, сжигаемое в качестве источника тепла или энергии, такое как уголь или нефтяной газвещество в физическом состоянии, в котором оно не сопротивляется изменению формы и pand до бесконечности, чтобы заполнить любой контейнер. Если приложить очень высокое давление, газ может стать жидким или твердым, в противном случае его плотность стремится к плотности конденсированной фазы галогена любого химического элемента фтора, хлора, брома, йода и астата. Все они являются одновалентными и легко образуют отрицательные ионы, углеводороды, любые органические соединения, содержащие только углерод и водород, такие как гидролиз алканов, алкенов, алкинов, терпенов и аренов. реагировать химически; нереакционноспособный неорганический
относящийся к химическим соединениям или обозначающий их, которые не содержат нерастворимый углерод, неспособный к растворению; неспособный образовывать раствор, например в воде ионэлектрически заряженный атом или группа атомов, образованные в результате потери или приобретения одного или нескольких электронов ионная связьхимическая связь между двумя противоположно заряженными ионами, образующаяся, когда один атом передает электроны другому атому, как в образование хлорида натрия; ионизация электровалентной связиобразование ионов в результате химической реакции, воздействия высокой температуры, электрического разряда, столкновения частиц или излучения изомерное соединение, проявляющее изомерию с одним или несколькими другими соединениями изотоп один из двух или более атомов с одинаковым атомным номером, которые содержат разные число нейтронов лантанид или редкоземельный элементлюбой элемент из ряда лантанидов жидкостьвещество в физическом состоянии, при котором оно не сопротивляется изменению формы, но сопротивляется изменению размера лакмусовая бумажка для определения кислотности или щелочности смеси точка плавлениятемпература при котором твердое тело превращается в жидкость.
Если приложить очень высокое давление, газ может стать жидким или твердым, в противном случае его плотность стремится к плотности конденсированной фазы галогена любого химического элемента фтора, хлора, брома, йода и астата. Все они являются одновалентными и легко образуют отрицательные ионы, углеводороды, любые органические соединения, содержащие только углерод и водород, такие как гидролиз алканов, алкенов, алкинов, терпенов и аренов. реагировать химически; нереакционноспособный неорганический
относящийся к химическим соединениям или обозначающий их, которые не содержат нерастворимый углерод, неспособный к растворению; неспособный образовывать раствор, например в воде ионэлектрически заряженный атом или группа атомов, образованные в результате потери или приобретения одного или нескольких электронов ионная связьхимическая связь между двумя противоположно заряженными ионами, образующаяся, когда один атом передает электроны другому атому, как в образование хлорида натрия; ионизация электровалентной связиобразование ионов в результате химической реакции, воздействия высокой температуры, электрического разряда, столкновения частиц или излучения изомерное соединение, проявляющее изомерию с одним или несколькими другими соединениями изотоп один из двух или более атомов с одинаковым атомным номером, которые содержат разные число нейтронов лантанид или редкоземельный элементлюбой элемент из ряда лантанидов жидкостьвещество в физическом состоянии, при котором оно не сопротивляется изменению формы, но сопротивляется изменению размера лакмусовая бумажка для определения кислотности или щелочности смеси точка плавлениятемпература при котором твердое тело превращается в жидкость. Она равна температуре замерзания металла ряда химических элементов, таких как железо или медь, которые часто представляют собой блестящие пластичные твердые вещества, имеют основные оксиды, образуют положительные ионы и являются хорошими проводниками тепла и электричества. мышьяк или кремний, обладающий некоторыми свойствами металлического минералалюбое из класса встречающихся в природе твердых неорганических веществ с характерной кристаллической формой и однородным химическим составом смесьвещество, состоящее из двух или более веществ, смешанных вместе без какой-либо химической связи между ними молярностьдругое название (не в техническом обиходе) концентрации моль – основная единица СИ количества вещества; количество, которое содержит столько элементарных объектов, сколько атомов в 0.012 кг углерода-12. Сущность должна быть указана и может быть атомом, молекулой, ионом, радикалом, электроном, фотоном и т. д. соединение, молекулы которого могут соединяться вместе, образуя полимерную нейтральную ни кислотную, ни щелочную нейтронно-нейтральную элементарную частицу с массой покоя 1,674 92716 × 10–27 кг и спином; классифицируется как барион.
Она равна температуре замерзания металла ряда химических элементов, таких как железо или медь, которые часто представляют собой блестящие пластичные твердые вещества, имеют основные оксиды, образуют положительные ионы и являются хорошими проводниками тепла и электричества. мышьяк или кремний, обладающий некоторыми свойствами металлического минералалюбое из класса встречающихся в природе твердых неорганических веществ с характерной кристаллической формой и однородным химическим составом смесьвещество, состоящее из двух или более веществ, смешанных вместе без какой-либо химической связи между ними молярностьдругое название (не в техническом обиходе) концентрации моль – основная единица СИ количества вещества; количество, которое содержит столько элементарных объектов, сколько атомов в 0.012 кг углерода-12. Сущность должна быть указана и может быть атомом, молекулой, ионом, радикалом, электроном, фотоном и т. д. соединение, молекулы которого могут соединяться вместе, образуя полимерную нейтральную ни кислотную, ни щелочную нейтронно-нейтральную элементарную частицу с массой покоя 1,674 92716 × 10–27 кг и спином; классифицируется как барион. В ядре атома он стабилен, но в свободном состоянии распадается благородный газ или инертный газ, любой из нереакционноспособных газообразных элементов, гелий, неон, аргон, криптон, ксенон, радон, неметалл, любой из ряда химических элементов, образующих отрицательные ионы, имеют кислотные оксиды и, как правило, являются плохими проводниками тепла и электричества. Ядро – основная группа атомов в молекуле, служащая базовой структурой для родственных соединений и остающаяся неизменной во время большинства химических реакций.Обычно они горючи, нерастворимы в воде, растворимы в органических растворителях, получают из растений и животных, из месторождений полезных ископаемых и путем синтеза. Они используются в качестве смазочных материалов, топлива, парфюмерии, пищевых продуктов и сырья для химикатов или любого природного минерала или совокупности минералов, из которых могут быть извлечены экономически важные компоненты, особенно металлы, органические, относящиеся к классу химических соединений или относящиеся к ним.
В ядре атома он стабилен, но в свободном состоянии распадается благородный газ или инертный газ, любой из нереакционноспособных газообразных элементов, гелий, неон, аргон, криптон, ксенон, радон, неметалл, любой из ряда химических элементов, образующих отрицательные ионы, имеют кислотные оксиды и, как правило, являются плохими проводниками тепла и электричества. Ядро – основная группа атомов в молекуле, служащая базовой структурой для родственных соединений и остающаяся неизменной во время большинства химических реакций.Обычно они горючи, нерастворимы в воде, растворимы в органических растворителях, получают из растений и животных, из месторождений полезных ископаемых и путем синтеза. Они используются в качестве смазочных материалов, топлива, парфюмерии, пищевых продуктов и сырья для химикатов или любого природного минерала или совокупности минералов, из которых могут быть извлечены экономически важные компоненты, особенно металлы, органические, относящиеся к классу химических соединений или относящиеся к ним. которые образуются в результате окисления углеродалюбой процесс, при котором кислород соединяется с элементом или веществом либо медленно, как при ржавлении железа, либо быстро, как при горении дерева из которых одна реакция представляет собой окисление, а обратная реакция представляет собой периодическую таблицу восстановления. Таблица элементов, расположенная в порядке возрастания атомного номера, основана на периодическом законе.Элементы, имеющие сходные химические свойства и электронное строение, появляются в вертикальных столбцах (группах) рН-потенциала водорода; мера кислотности или щелочности раствора, равная десятичному логарифму обратной величины концентрации ионов водорода в молях на кубический дециметр раствора. Чистая вода имеет рН 7, кислые растворы имеют рН менее 7, а щелочные растворы имеют рН более 7. , особенно такой материал в готовом состоянии, содержащий пластификатор, стабилизатор, наполнитель, пигменты и т.п.Пластмассы классифицируются как термореактивные (такие как бакелит) или термопластичные (такие как ПВХ) и используются в производстве многих изделий и в покрытиях, искусственных волокнах и т.
которые образуются в результате окисления углеродалюбой процесс, при котором кислород соединяется с элементом или веществом либо медленно, как при ржавлении железа, либо быстро, как при горении дерева из которых одна реакция представляет собой окисление, а обратная реакция представляет собой периодическую таблицу восстановления. Таблица элементов, расположенная в порядке возрастания атомного номера, основана на периодическом законе.Элементы, имеющие сходные химические свойства и электронное строение, появляются в вертикальных столбцах (группах) рН-потенциала водорода; мера кислотности или щелочности раствора, равная десятичному логарифму обратной величины концентрации ионов водорода в молях на кубический дециметр раствора. Чистая вода имеет рН 7, кислые растворы имеют рН менее 7, а щелочные растворы имеют рН более 7. , особенно такой материал в готовом состоянии, содержащий пластификатор, стабилизатор, наполнитель, пигменты и т.п.Пластмассы классифицируются как термореактивные (такие как бакелит) или термопластичные (такие как ПВХ) и используются в производстве многих изделий и в покрытиях, искусственных волокнах и т. д. Натуральные или синтетические полимеры, такие как крахмал или плексиглас, имеют большую Молекулы, состоящие из множества относительно простых повторяющихся звеньев, осаждают осажденное твердое вещество в его взвешенном виде или после отстаивания или фильтрации протона устойчивые, положительно заряженные элементарные частицы, находящиеся в атомных ядрах в количестве, равном атомному номеру элемента.Это барион с зарядом 1,602176462 × 10–19 Кл, массой покоя 1,672 62159 × 10–27 кг и спиновой радиоактивностью — спонтанным излучением атомных ядер. Излучение может состоять из реакции альфа-, бета- и гамма-излучения. Процесс, который включает изменения в структуре и энергосодержании атомов, молекул или ионов, но не их ядер. Реагент. Вещество для использования в химической реакции, особенно для использования в химическом синтезе и анализ восстановления для проведения или проведения химической реакции с водородом или образования гидрида; терять или вызывать потерю атомов кислорода; претерпевать или вызывать увеличение числа электронов.
д. Натуральные или синтетические полимеры, такие как крахмал или плексиглас, имеют большую Молекулы, состоящие из множества относительно простых повторяющихся звеньев, осаждают осажденное твердое вещество в его взвешенном виде или после отстаивания или фильтрации протона устойчивые, положительно заряженные элементарные частицы, находящиеся в атомных ядрах в количестве, равном атомному номеру элемента.Это барион с зарядом 1,602176462 × 10–19 Кл, массой покоя 1,672 62159 × 10–27 кг и спиновой радиоактивностью — спонтанным излучением атомных ядер. Излучение может состоять из реакции альфа-, бета- и гамма-излучения. Процесс, который включает изменения в структуре и энергосодержании атомов, молекул или ионов, но не их ядер. Реагент. Вещество для использования в химической реакции, особенно для использования в химическом синтезе и анализ восстановления для проведения или проведения химической реакции с водородом или образования гидрида; терять или вызывать потерю атомов кислорода; претерпевать или вызывать увеличение числа электронов. соль белого цвета в виде порошка или бесцветного кристаллического твердого вещества, состоящего в основном из хлорида натрия и используемого для приправы и консервирования пищевых продуктов; конкретный, этот процесс, осуществляемый с использованием жиров (сложных глицериновых эфиров) для получения мыла, насыщенного (раствором или растворителем), содержащего максимальное количество растворенного вещества, которое обычно может быть растворено при данной температуре и давлении, мыла, чистящего или эмульгирующего агента, полученного путем реакции животных или растительные жиры или масла с гидроксидом калия или натрия.Мыла часто содержат красящие вещества и отдушки и действуют путем эмульгирования жира и снижения поверхностного натяжения воды, так что она легче проникает в открытые материалы, такие как твердые ткани, связанные или являющиеся веществом в физическом состоянии, в котором оно сопротивляется изменениям в размер и форма растворимы
(о веществе), способное растворяться, особенно легко растворяющееся в каком-либо растворителе, обычно в водном растворе, однородная смесь двух или более веществ, в которой молекулы или атомы веществ полностью диспергированы.
соль белого цвета в виде порошка или бесцветного кристаллического твердого вещества, состоящего в основном из хлорида натрия и используемого для приправы и консервирования пищевых продуктов; конкретный, этот процесс, осуществляемый с использованием жиров (сложных глицериновых эфиров) для получения мыла, насыщенного (раствором или растворителем), содержащего максимальное количество растворенного вещества, которое обычно может быть растворено при данной температуре и давлении, мыла, чистящего или эмульгирующего агента, полученного путем реакции животных или растительные жиры или масла с гидроксидом калия или натрия.Мыла часто содержат красящие вещества и отдушки и действуют путем эмульгирования жира и снижения поверхностного натяжения воды, так что она легче проникает в открытые материалы, такие как твердые ткани, связанные или являющиеся веществом в физическом состоянии, в котором оно сопротивляется изменениям в размер и форма растворимы
(о веществе), способное растворяться, особенно легко растворяющееся в каком-либо растворителе, обычно в водном растворе, однородная смесь двух или более веществ, в которой молекулы или атомы веществ полностью диспергированы.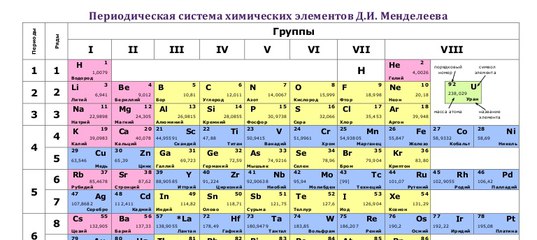 Компонентами могут быть твердые вещества, жидкости или газы растворительжидкость, способная растворять другое вещество сублимация процесс или пример или сублимация реакция замещения сахар белый кристаллический сладкий углевод, дисахарид, обнаруженный во многих растениях и извлеченный из сахарного тростника и сахарной свеклы: он используется особенно как подсластитель в еде и напитках. Формула: C12h32O11 суспензиядисперсия мелких твердых или жидких частиц в жидкости, при этом частицы поддерживаются плавучим синтезомпроцесс получения соединения путем химической реакции или ряда реакций, обычно из более простых или общедоступных исходных материалов переходный металллюбой элемент, принадлежащий к одному из трех рядов элементов с атомными номерами от 21 до 30, от 39 до 48 и от 57 до 80.Они имеют незавершенную предпоследнюю электронную оболочку и имеют тенденцию проявлять более одной валентности и образовывать ненасыщенные комплексы (химического соединения, особенно органического соединения), содержащие одну или несколько двойных или тройных связей и, таким образом, способные вступать в реакции присоединения валентность свойство атомов или группы, равное числу атомов водорода, с которыми атом или группа могут соединиться или сместиться, образуя соединения.
Компонентами могут быть твердые вещества, жидкости или газы растворительжидкость, способная растворять другое вещество сублимация процесс или пример или сублимация реакция замещения сахар белый кристаллический сладкий углевод, дисахарид, обнаруженный во многих растениях и извлеченный из сахарного тростника и сахарной свеклы: он используется особенно как подсластитель в еде и напитках. Формула: C12h32O11 суспензиядисперсия мелких твердых или жидких частиц в жидкости, при этом частицы поддерживаются плавучим синтезомпроцесс получения соединения путем химической реакции или ряда реакций, обычно из более простых или общедоступных исходных материалов переходный металллюбой элемент, принадлежащий к одному из трех рядов элементов с атомными номерами от 21 до 30, от 39 до 48 и от 57 до 80.Они имеют незавершенную предпоследнюю электронную оболочку и имеют тенденцию проявлять более одной валентности и образовывать ненасыщенные комплексы (химического соединения, особенно органического соединения), содержащие одну или несколько двойных или тройных связей и, таким образом, способные вступать в реакции присоединения валентность свойство атомов или группы, равное числу атомов водорода, с которыми атом или группа могут соединиться или сместиться, образуя соединения.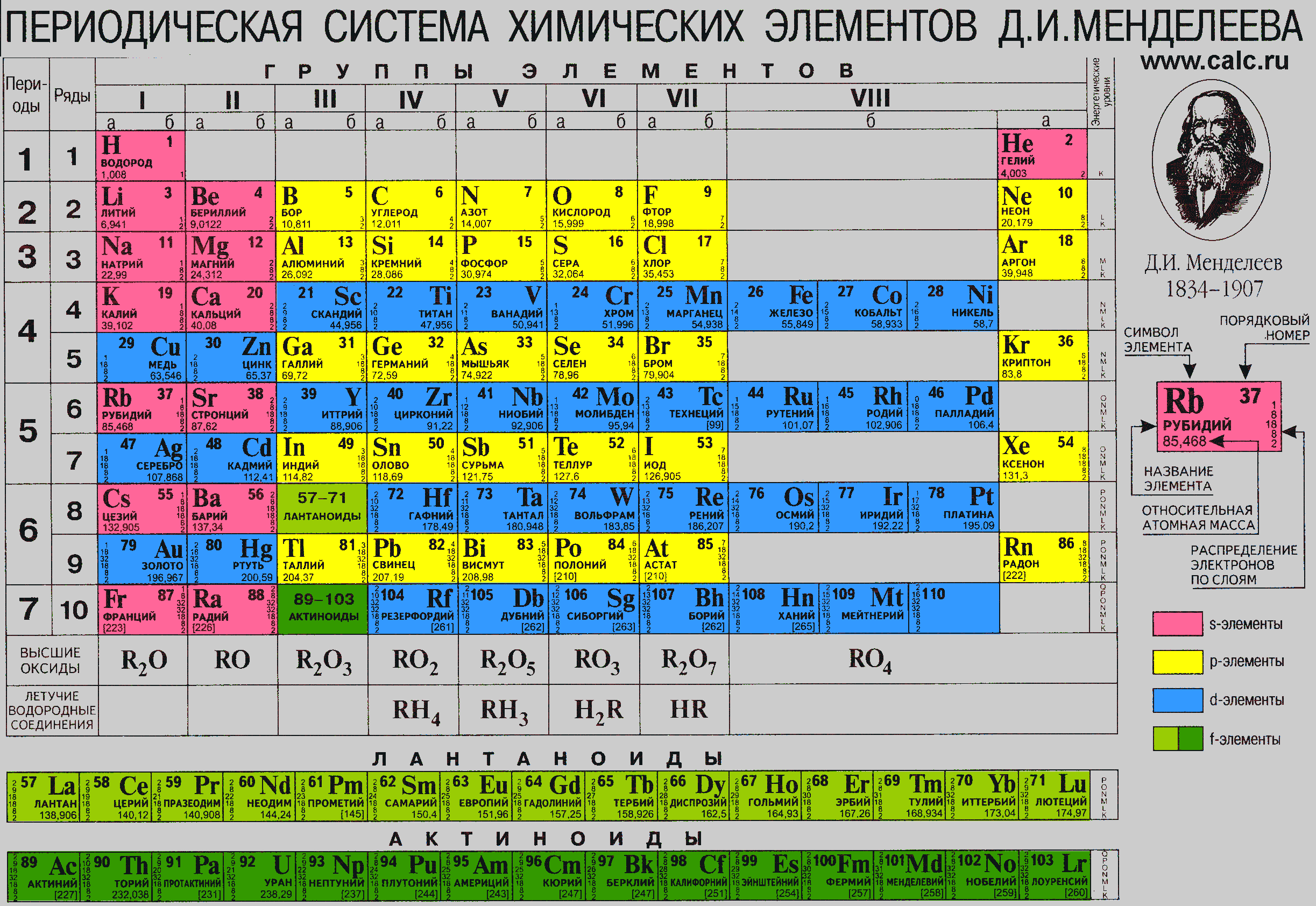 См. химию
См. химиюCopyright © 2016 HarperCollins Publishers.Все права защищены.
Арсол Да, хотите верьте, хотите нет, но на самом деле есть молекула под названием Arsole … и это кольцо! Это мышьяковый эквивалент пиррола, и, хотя он редко встречается в чистом виде, иногда он рассматривается как боковая группа в форме органических 90–105 арсолилов 90–106 . Для получения дополнительной информации см. статью с, вероятно, лучшим названием из всех научных статей, с которыми я когда-либо сталкивался: «Исследования по химии арсолей», Г.Маркл и Х. Гауптманн, J. Organomet. Chem ., 248 (1983) 269. Хотя класс молекул с такой общей структурой называется «арсолы», конкретная молекула, показанная справа, на самом деле называется «арсенол» (не путать с лондонским футбольным клубом). , Арсенал). Вопреки распространенному мнению, новое исследование (см. ссылку ниже) показывает, что арсолы обладают лишь умеренной ароматикой. Спасибо Нилу Бруксу, Николасу Уэлхэму, Энди Шипуэю, Ллойду Эвансу, Питеру Симсу, Джону Перкинсу, Бобу Бантроку и Бену Миллсу за некоторую информацию и подробности об этих молекулах. Эта статья вдохновила Микаэля Йоханссона из Хельсинкского университета на проведение научного исследования ароматичности арсолей, которое было опубликовано: Letts. Орг. хим. 2 (2005) 469. Еще одна интригующая ссылка, предоставленная Патриком Уоллесом: G. Märkl and H. |

 Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке. Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.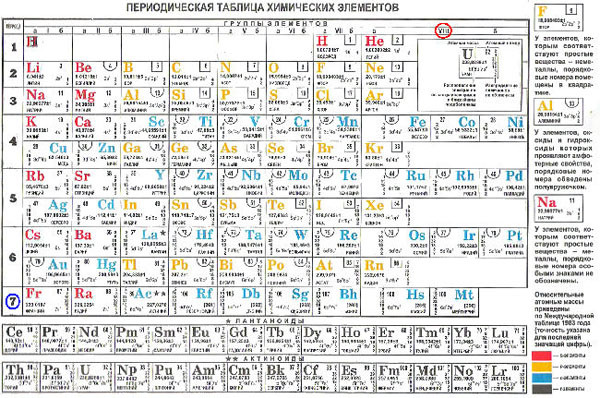
 К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.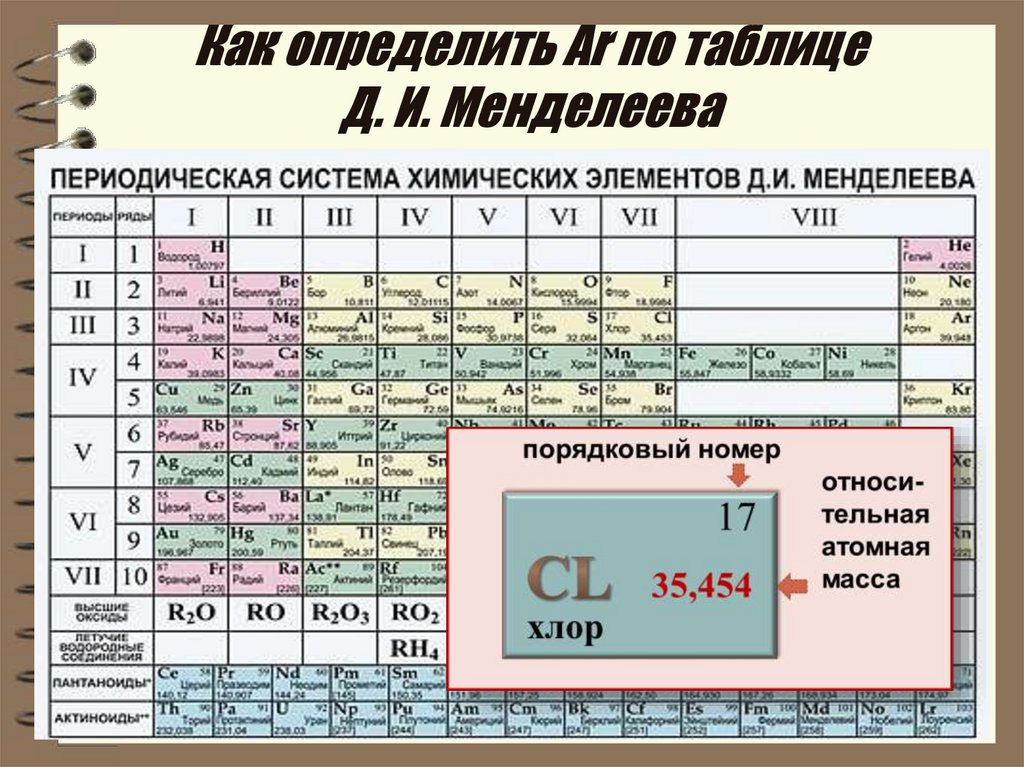 Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!


 (Исключения очевидны, например, олово, медь, мышьяк, золото … и тому подобное.) Если вы получаете слово элемента, которое звучит как \ēəm\ в конце, вы можете быть на 100% уверены, что оно будет написано только как – иум . Действительно? Действительно.
(Исключения очевидны, например, олово, медь, мышьяк, золото … и тому подобное.) Если вы получаете слово элемента, которое звучит как \ēəm\ в конце, вы можете быть на 100% уверены, что оно будет написано только как – иум . Действительно? Действительно.
 Но как он получил это имя? Имена элементов следуют четырем грубым шаблонам. Некоторые из них, например, золото, получили свои названия еще до того, как мы узнали, что такое элемент. Другие, такие как эйнштейний, были названы в честь известного ученого, сыгравшего значительную роль в нашем понимании атомов, а третьи группы названы в честь места, где они были обнаружены — возьмем, например, калифорний. Наконец, есть шансы и дерьмо. Элементы, которые больше нигде не подходят.
Но как он получил это имя? Имена элементов следуют четырем грубым шаблонам. Некоторые из них, например, золото, получили свои названия еще до того, как мы узнали, что такое элемент. Другие, такие как эйнштейний, были названы в честь известного ученого, сыгравшего значительную роль в нашем понимании атомов, а третьи группы названы в честь места, где они были обнаружены — возьмем, например, калифорний. Наконец, есть шансы и дерьмо. Элементы, которые больше нигде не подходят.
 Но к тому времени было уже слишком поздно.
Но к тому времени было уже слишком поздно.
 Из отрицательного возникло нечто очень положительное. Точно так же дубненская лаборатория, возможно, упустила первоначальную славу, но теперь они признаны первооткрывателями и навсегда связаны с именем, которое имеет гораздо большее влияние, чем джолиотиум когда-либо мог бы иметь.
Из отрицательного возникло нечто очень положительное. Точно так же дубненская лаборатория, возможно, упустила первоначальную славу, но теперь они признаны первооткрывателями и навсегда связаны с именем, которое имеет гораздо большее влияние, чем джолиотиум когда-либо мог бы иметь.
 .. Между прочим, номер патента США 3 412 119, выданный Dow Chemical Company, озаглавлен «Замещенные станнолы, фосфоли, арсолы и стиболы». не знал, что есть замена арсоле…
.. Между прочим, номер патента США 3 412 119, выданный Dow Chemical Company, озаглавлен «Замещенные станнолы, фосфоли, арсолы и стиболы». не знал, что есть замена арсоле…  д.), то можно получить ArSe-SeX. Я оставлю это как вызов химикам-синтетикам, которые сначала попытаются получить это соединение, а затем попытаются включить его название в заголовок статьи!
д.), то можно получить ArSe-SeX. Я оставлю это как вызов химикам-синтетикам, которые сначала попытаются получить это соединение, а затем попытаются включить его название в заголовок статьи! 