Как расположены элементы в таблице менделеева
Нестандартное домашнее задание по химии. Составляем Таблицу Менделеева из нарисованных карточек.
Тема домашнего задания: нарисовать карточку отдельного химического элемента, присутствующего в живых организмах (биоген) с иллюстрацией его действия на живые организмы.
Класс – 8– 10 класс; сложность – высокая, межпредметная; время выполнения – 30-40 минут.
Тип задания – индивидуальное, а затем – в группе; способ проверки – сбор иллюстраций отдельных химических элементов формата А4, и составление из них общей таблицы Менделеева.
Учебники:
1) учебник химии 10 класс — О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарев, углубленный уровень (ГЛАВА 7. Биологически активные соединения, стр.300).
2) учебник химии 8 класс – О.С. Габриелян, (§ 5. Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов, стр. 29).
29).
3) учебник экологии 10 (11) класс – Е. А. Криксунов, В.В.Пасечник, (Глава 6. Окружающая среда и здоровье человека, 6.1. Химические загрязнения среды и здоровье человека, стр. 217).
4) учебник биологии 10-11 класс – Общая биология. Базовый уровень. Под ред. Беляева Д.К., Дымшица Г.М. (Глава 1. Химический состав клетки. § 1. Неорганические соединения, § 2. Биополимеры.).
Цели: освоениезнаний о биохимических процессах в живой клетке, геохимических процессах в природе, полученные школьниками самостоятельно и осмысленно, закреплённые рисунком, творческое рисование. Создание уникальных наглядных пособий для других учеников. Составление авторской уникальной «Таблицы Менделеева».
Пояснительная записка.
Суть домашнего задания в том, что ученики рисуют участие каждого химического элемента в геохимических процессах. А затем все рисунки объединяются в сводную “Таблицу Менделеева”, которую можно вывесить на стене в классе. Образуется некий наглядный продукт совместного творчества: “Экология в картинках”. В разных классах получаются разные “Таблицы Менделеева”, главное сохранить табличную форму и проследить, чтобы все рисунки были на листе формата А4. А также, чтобы в углу листа был проставлен химический знак того элемента, о котором нарисован сюжет. Вначале каждый ученик выбирает конкретный химический элемент для изучения. Затем самостоятельно, или с помощью учителя ищет информацию, выбирает нужную, придумывает сюжет рисунка, рисует и размещает свой рисунок на стене в ячейку умозрительной таблицы Менделеева для соответствующего химического элемента. Можно упростить/усложнить задачу, из всех химических элементов выбрав только наиболее распространенные на земле, или, наоборот – наименее распространенные. Можно выбрать только биогены (химические элементы, входящие в состав живых организмов) и рисовать
учебные карточки с сюжетами о них. Можно выбрать макроэлементы живых клеток, а можно – только микроэлементы и т.д. В экологических справочниках сейчас можно найти много различной информации на эту тему.
В разных классах получаются разные “Таблицы Менделеева”, главное сохранить табличную форму и проследить, чтобы все рисунки были на листе формата А4. А также, чтобы в углу листа был проставлен химический знак того элемента, о котором нарисован сюжет. Вначале каждый ученик выбирает конкретный химический элемент для изучения. Затем самостоятельно, или с помощью учителя ищет информацию, выбирает нужную, придумывает сюжет рисунка, рисует и размещает свой рисунок на стене в ячейку умозрительной таблицы Менделеева для соответствующего химического элемента. Можно упростить/усложнить задачу, из всех химических элементов выбрав только наиболее распространенные на земле, или, наоборот – наименее распространенные. Можно выбрать только биогены (химические элементы, входящие в состав живых организмов) и рисовать
учебные карточки с сюжетами о них. Можно выбрать макроэлементы живых клеток, а можно – только микроэлементы и т.д. В экологических справочниках сейчас можно найти много различной информации на эту тему.
Справочный материал: Биогенными называют химические элементы, постоянно присутствующие в живых организмах и играющие какую-либо биологическую роль: O, C, H, Ca, N, K, P, Mg, S, Cl, Na, Fe, I , Cu .
Виртуальная «Таблица Менделеева». Вместо бумажной таблицы на стене в классе, можно организовать виртуальную таблицу и общую работу в ней учеников. Для этого учитель готовит макет таблицы в Google -документах и открывает доступ ученикам. Рисовать ученики могут с помощью компьютерных программ, а могут загружать рисунки, выполненные карандашами и красками. Вот первоначальный макет такой таблицы, частично заполненный учениками.
Отдельные учебные карточки , с ученическими скетчами на тему воздействия конкретных химических элементов на живые организмы (формат А4 каждой карточки).
ПРИЛОЖЕНИЕ. Таблица химических элементов-биогенов, как справочный материал для рисования сюжетов учебных карточек.
Пороговые концентрации химических элементов в почвах (мг/кг) и возможные реакции организмов (по Ковальскому) | |||
Химический элемент | Недостаток – нижняя пороговая концентрация | Норма | Избыток – верхняя пороговая концентрация |
Кобальт | Меньше 2-7. | 7-30 | Более 30. Угнетение синтеза витамина В. |
Медь | Меньше 6-13. Анемия, заболевания костной системы. Невызревание злаков, суховершинность плодовых деревьев. | 13-60 | Более 60. Поражение печени, анемия, желтуха. |
Марганец | До 400. Заболевание костей, увеличение зоба. | 400-3000 | Более 3000. Заболевания костной системы. |
Цинк | До 30. Карликовый рост растений и животных. | 30-70 | Более 70. Угнетение окислительных процессов, анемия |
Молибден | До 1,5. Заболевания растений. | 1,5-4 | Более 4. Подагра у человека, молибденовый токсикоз у животных. |
Бор | Меньше 3-6. Отмирание точек роста стеблей и корней растений. | 6-30 | Более 30. Боровые поносы (энтериты) у животных. |
Стронций | Более 600. Уровская болезнь, рахит, ломкость костей. | ||
Йод | Менее 2-5. Эндемический зоб у людей | 5-40 | Более 40. Ослабление синтеза йодистых соединений щитовидной железы. |
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицы
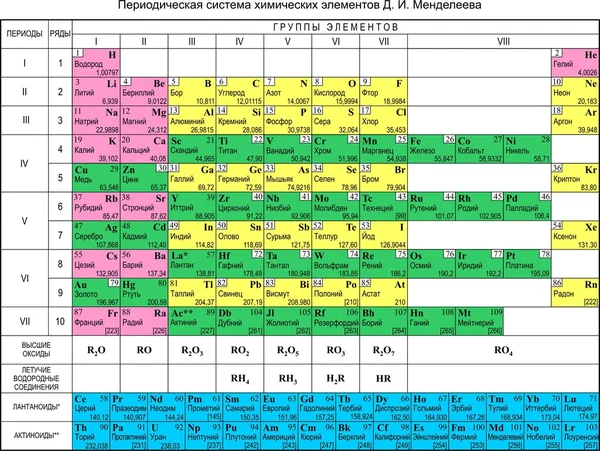
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2.

- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2.
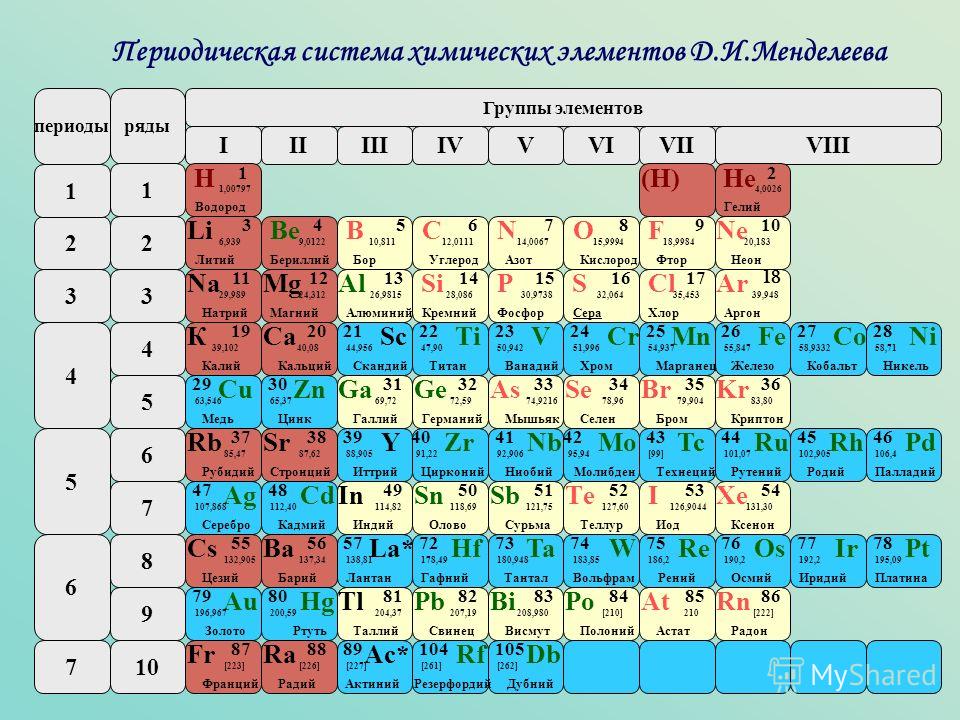
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
Узнайте, почему в таблице присутствуют пустые ячейки.
 Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.

- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.

- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента.
 Элементы имеют атомные номера от 1 до 118.
Элементы имеют атомные номера от 1 до 118.- Атомный номер всегда является целым числом.
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны – отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс».
 Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус». - Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс».
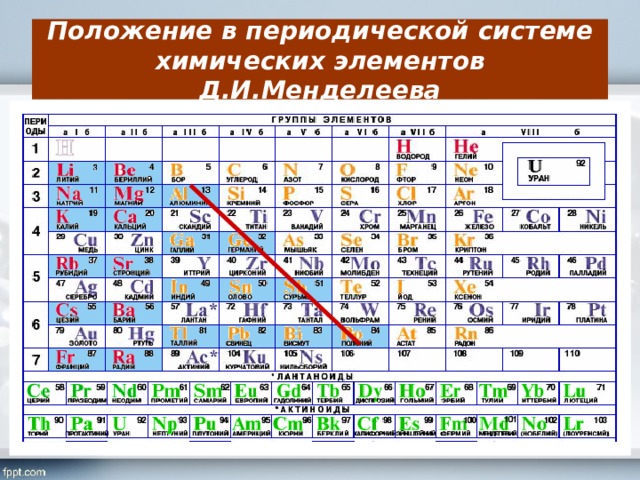
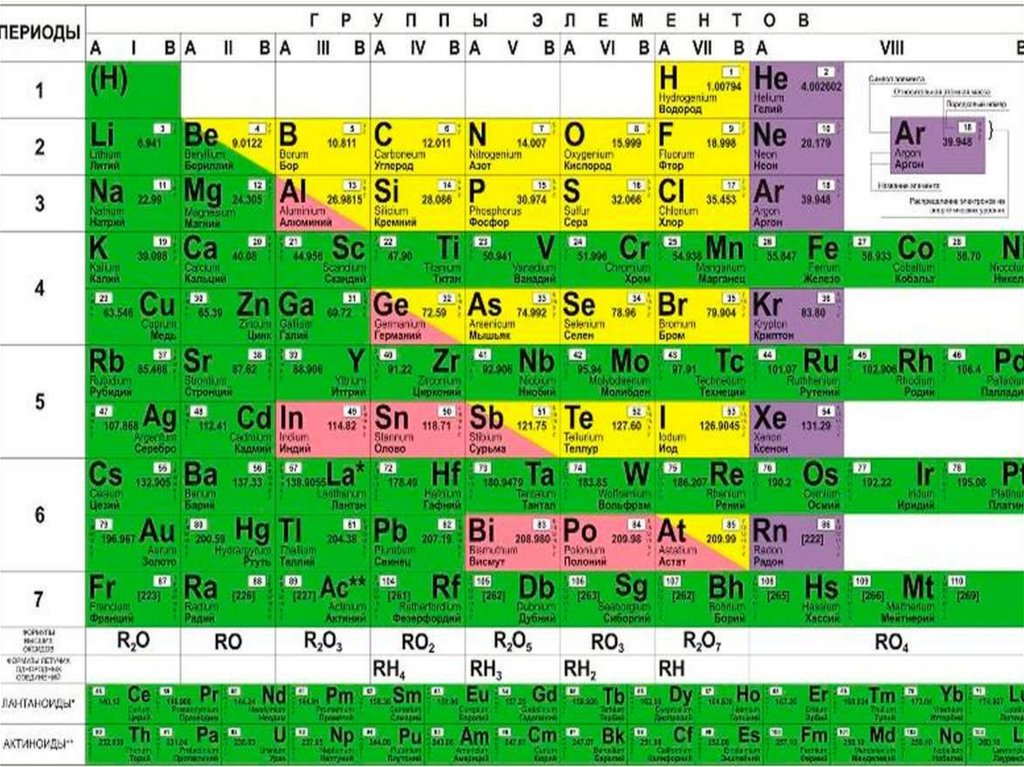
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Таблица Менделеева является одним из величайших открытий человечества, позволившим упорядочить знания об окружающем мире и открыть новые химические элементы . Она является необходимой для школьников, а так же для всех, кто интересуется химией. Кроме того, данная схема является незаменимой и в других областях науки.
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера . Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
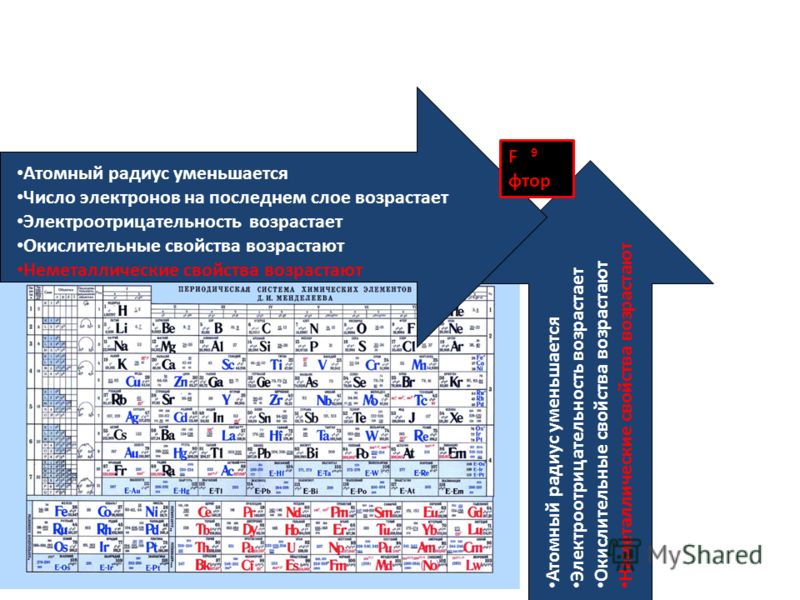
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной . В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон. Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина.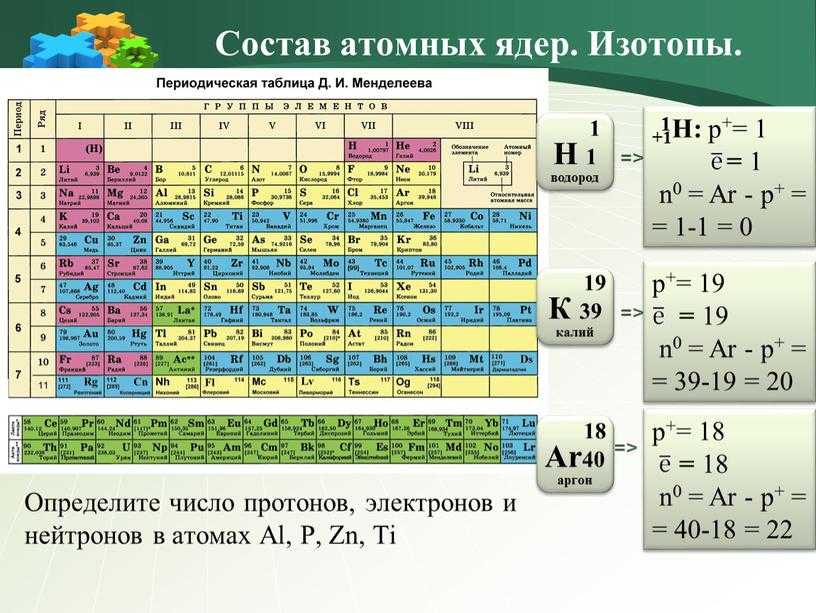 Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы , обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах . Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы . А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии , необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы , чтобы на экзамене не столкнуться с некоторыми трудностями.
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом. Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы , отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
1 марта 1869 года Менделеев закончил свою работу “Опыт системы элементов, основанной на их атомном весе и химическом сходстве”. Этот день считается днём открытия периодического закона элементов Д.М. Менделеева. “Открытие Д.И. Менделеева относится к фундаментальным законам мироздания, таким как закон всемирного тяготения Ньютона или теория относительности Эйнштейна, а Д. М. Менделеев стоит в одном ряду с именами этих великих физиков”. Академик А.И. Русанов.
М. Менделеев стоит в одном ряду с именами этих великих физиков”. Академик А.И. Русанов.
“Периодическая система как была, так и осталась в самых новейших решениях проблемы о веществе главной путеводной звездой”. Проф. А. Н. Реформатский.
“Когда подходишь к оценке личностей, подобных Д. И. Менделееву, к анализу их научного творчества, невольно является желание отыскать в этом творчестве элементы, всего более отмеченные печатью гения. Из всех признаков, отличающих гениальность и ее проявление, два, кажется, являются наиболее показательными: это, во-первых, способность охватывать и объединять широкие области знания и, во-вторых, способность к резким скачкам мысли, к неожиданному сближению фактов и понятий, которые для обыкновенного смертного кажутся далеко стоящими друг от друга и ничем не связанными, по крайнем мере до того момента, когда такая связь будет обнаружена и доказана”. Л. А. Чугаев, профессор химии.
Да и сам Менделеев понимал огромное значение открытого им закона для науки. И верил в его дальнейшее развитие. “По видимому, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает”. Д.И. Менделеев.
И верил в его дальнейшее развитие. “По видимому, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает”. Д.И. Менделеев.
Первоначальный вид таблицы, написанный рукой Д.И. Менделеева.
Если бы все научные знания мира пропали бы, из-за какого либо катаклизма, то для возрождения цивилизации одним из главных законов стал бы периодический закон Д.И. Менделеева. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону. В свою очередь, они расширили и углубили сущность закона Менделеева.
Периодический закон сыграл огромную роль в развитии химии и других естественных наук. Была открыта взаимная связь между всеми элементами, их физическими и химическими свойствами. Это поставило перед естествознанием научно-философскую проблемы огромной важности: эта взаимная связь должно получить объяснение.
Открытию периодического закона предшествовало 15 лет напряженной работы.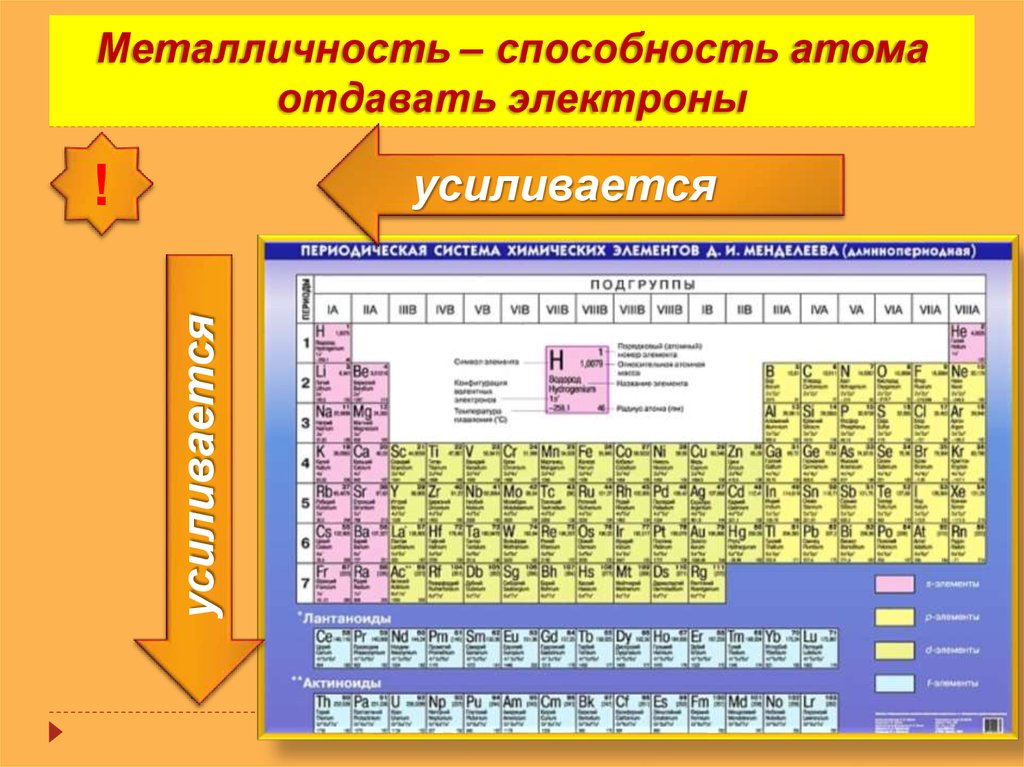 Ко времени открытия периодического закона было известно 63 химических элемента, существовало около 50 различных классификаций. Большинство ученых сравнивали между собой только сходные по свойствам элементы, поэтому не смогли открыть закон. Менделеев же сравнивал между собой все, в том числе и несходные элементы. Менделеев выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях, расположил их в порядке возрастания их относительных атомных масс и всесторонне проанализировал всю эту совокупность, пытаясь найти в ней определенные закономерности. В результате напряженного творческого труда он обнаружил в этой цепочке отрезки, в которых свойства химических элементов и образованных ими веществ изменялись сходным образом – периодически – периоды. С развитием учения о строении электронной оболочки атомов стало ясно, почему свойства атомов показывают периодичность с возрастанием атомной массы. Атомы с одинаковой внешней сферой составляют одну группу.
Ко времени открытия периодического закона было известно 63 химических элемента, существовало около 50 различных классификаций. Большинство ученых сравнивали между собой только сходные по свойствам элементы, поэтому не смогли открыть закон. Менделеев же сравнивал между собой все, в том числе и несходные элементы. Менделеев выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях, расположил их в порядке возрастания их относительных атомных масс и всесторонне проанализировал всю эту совокупность, пытаясь найти в ней определенные закономерности. В результате напряженного творческого труда он обнаружил в этой цепочке отрезки, в которых свойства химических элементов и образованных ими веществ изменялись сходным образом – периодически – периоды. С развитием учения о строении электронной оболочки атомов стало ясно, почему свойства атомов показывают периодичность с возрастанием атомной массы. Атомы с одинаковой внешней сферой составляют одну группу. Атомы с одинаковым числом внешних сфер – составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
Атомы с одинаковым числом внешних сфер – составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
Сама таблица Менделеева много раз трансформировалась, отображая разную информацию о свойствах атомов. Встречаются и курьёзные таблицы.
Так называемая короткопериодная или короткая форма ТМ
Длиннопериодная или длинная форма ТМ
Сверхдлинная.
Флаги государств, обозначающие страну, где впервые открыли данный элемент.
Названия элементов, которые были отменены или оказались ошибочными, как например, история с дидимом Di – оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима.
Здесь синим цветом обозначены элементы, образованные во время Большого Взрыва, голубым – синтезированные во время первичного нуклеосинтеза, жёлтые и зелёные цвета обозначают элементы, синтезированные соответственно в недрах “малых” и “больших” звёзд. Розовым цветом – вещества (ядра), синтезируемые во время вспышек сверхновых звёзд. Кстати, золото (Au) ещё синтезируется во время столкновений нейтронных звёзд. Фиолетовые – созданные в лабораториях искусственно. Но это ещё не вся история…
Розовым цветом – вещества (ядра), синтезируемые во время вспышек сверхновых звёзд. Кстати, золото (Au) ещё синтезируется во время столкновений нейтронных звёзд. Фиолетовые – созданные в лабораториях искусственно. Но это ещё не вся история…
Здесь разными цветами обозначены органические, неорганические и незаменимые элементы, необходимые для построения тел живых существ, в том числе и нас.
Таблица-башня
Предложена в 2006-ом Виталием Циммерманом на основе идей Чарльза Джанета. Он изучал орбитальное заполнение атомов – то, как располагаются электроны относительно ядра. И на основе этого разделил все элементы в четыре группы, рассортировав их по конфигурациям положения электронов. Таблица предельно проста и функциональна.
Таблица – спираль.
В 1964-ом Теодор Бенфей предложил поставить в центр таблицы водород (H), а прочие элементы разместить вокруг него по спирали, которая раскручивается по часовой стрелке. Уже на втором витке спираль вытягивается в петли, который соответствуют переходным металлам и лантаноидам с актиноидами, предусмотрено место для неизвестных пока суперактинидов. Это придает таблице вид экстравагантного дизайнерского решения.
Уже на втором витке спираль вытягивается в петли, который соответствуют переходным металлам и лантаноидам с актиноидами, предусмотрено место для неизвестных пока суперактинидов. Это придает таблице вид экстравагантного дизайнерского решения.
Таблица – радужная спираль.
Изобретена в 1975 химиком Джеймсом Хайдом. Он увлекался кремнийорганическими соединениями, поэтому в основание таблицы попал именно кремень, так как у него большое число связей с другими элементами. Различные категории элементов так же объединены по секторам и отмечены нужным цветом. Таблица красивее аналогов, но из-за криволинейной формы пользоваться ею непросто.
Эти таблицы отображают последовательность заполнения электронных оболочек. Во всяком случае некоторые из них. Все эти таблицы выглядят весьма экзотично.
Таблица изотопов. Здесь отображено время “жизни” различных изотопов, их стабильность в зависимости от массы ядра. Впрочем, это уже не таблица Менделеева, это совсем другая (ядерная физика) история. ..
..
Периодический закон Менделеева и система химических элементов — история открытия — 01.03.2023 — Статьи на РЕН ТВ
Фото: © РИА Новости/Ф. БлумбахЧитать ren.tv в
Великому русскому ученому Дмитрию Ивановичу Менделееву было всего 35 лет, когда в 1869 году он сформулировал периодический закон и создал Периодическую систему химических элементов.
Прообраз таблицы появился в первом издании учебника “Основы химии”, который разрабатывал Менделеев. По мнению историков, именно работа над учебником и заставила его задуматься над природой и взаимосвязью химических элементов и попытаться поместить их в понятную систему.
Об истории создания таблицы Менделеева и о том, почему она, как и закон, называется периодической – в материале РЕН ТВ.
Предыстория появления системы химических элементов
В далеком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем был опубликован научный труд, в котором было развенчано немало мифов об алхимии, и в котором он рассуждал о необходимости поиска неразложимых химических элементов.
Ученый также привел их список, состоящий всего из 15 элементов, но допускал мысль о том, что этот список неполный. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учеными по всему миру.
К середине XIX века было открыто 63 химических элемента и ученые всего мира не раз предпринимали попытки объединить все существовавшие вещества в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию представил химик и музыкант Джон Александр Ньюлендс, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа английского ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.
Фото: © РИА Новости
Как появились периодический закон и таблица химических элементов
Знаменитый русский ученый-энциклопедист Дмитрий Иванович Менделеев впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление.
В результате размышлений Менделеева 1 марта 1869 года был завершен самый первый вариант Периодической системы химических элементов, который получил тогда название “Опыт системы элементов, основанной на их атомном весе и химическом сходстве”.
Как выглядела первая таблица Менделеева
В этом варианте элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов).
1 марта 1869 года знаменует собой открытие Менделеевым периодического закона, но более верным будет считать эту дату началом открытия, поскольку еще требовалось его осмысление и затем – достижение формулировки.
“Опыт системы элементов” был напечатан с химическим обоснованием в программной статье ученого “Соотношение свойств с атомным весом элементов” в “Журнале Русского физико-химического общества”. А уже в апреле 1869 года состоялась первая публикация таблицы Менделеева в международной печати – она вышла в свет в лейпцигском Journal für Practische Chemie (“Журнале практической химии”) и стала достоянием мировой науки.
В том же году эта статья из “Журнала Русского химического общества” была переведена в Zeitschrift für Chemie, а в 1872 году в журнале Annalen der Chemie und Pharmacie была опубликована развернутая статья Менделеева, посвященная его открытию, – Die periodische Gesetzmässigkeit der Elemente (“Периодическая закономерность химических элементов”).
В этой работе, датированной августом 1871 года, Дмитрий Менделеев приводит формулировку периодического закона, которая затем оставалась в силе на протяжении более сорока лет: “Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса”.
Фото: © РИА Новости/Ю. Астафьев
Почему таблица называется периодической
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов свойства начинают повторяться. Так, калий похож на натрий, фтор – на хлор, а золото схоже с серебром и медью.
Появление новых элементов в таблице Менделеева
Пользуясь периодической системой, Менделеев также предсказал открытие нескольких новых химических элементов и описал их химические и физические свойства. В дальнейшем расчеты ученого полностью подтвердились: галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году) поразительно точно соответствовали тем свойствам, которые описал Менделеев.
Затем прогнозы гениального химика продолжили реализовываться и были открыты еще восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942–1943 годы).
Кстати, в 1900 году Дмитрий Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
На сегодняшний день в Периодической системе химических элементов – 118 элементов. Последний, самый тяжелый из известных, — оганесон (Og), названный так в честь своего первооткрывателя Юрия Цолаковича Оганесяна. Научный руководитель лаборатории ядерных реакций имени Г.Н. Флерова Объединенного института ядерных исследований в Дубне стал четвертым в истории ученым, при жизни которого его именем был назван химический элемент.
Фото: © Фотохроника ТАСС
Организация Периодической системы химических элементов
Химические элементы в таблице Д.И. Менделеева расположены по рядам в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства.
Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий, с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце.
А элементы левого столбца (калий, натрий, литий и т.п.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер.
Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому.
Все элементы вплоть до № 92 встречаются в природе, а с № 93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своем первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему все должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Фото: © РИА Новости/Александр Лобов
Самые старые экземпляры таблицы Менделеева
В 2019 году в Сент-Эндрюсском университете Великобритании был обнаружен один из старейших образцов таблицы. Это произошло, когда доктор Алан Айткен наводил порядок в кладовке химического факультета. Факультет переехал в новое помещение в 1968 году, и с тех пор оборудование, реактивы и бумаги пылились в подсобном помещении.
Факультет переехал в новое помещение в 1968 году, и с тех пор оборудование, реактивы и бумаги пылились в подсобном помещении.
Таблица лежала в кладовке среди кучи разных лабораторных принадлежностей. В какой-то момент Айткен обнаружил свернутые в трубку лекционные материалы по химии, а в них – копию Периодической таблицы химических элементов, возраст которой оценивался в 133–140 лет.
Найденная таблица аннотирована на немецком языке, слева внизу идет надпись Verlag v. Lenoir & Forster, Wien, указывающая на владельца типографии, работавшего в Вене с 1875 по 1888 год. Другая надпись – Lith. von Ant. Hartinger & Sohn, Wien – определяет литографа диаграммы, который умер в 1890 году.
Выяснить, в каком году была напечатана таблица, помогли поиски в университетском архиве. Нашлись данные о покупке таблицы профессором Томасом Пурди – пособие было куплено в октябре 1888 года. Тогда оно стоило 3 немецкие марки.
Восстановление плаката заняло немало времени: поверхность пришлось очистить от грязи и мусора, отделить таблицу от подкладки, на которой та была закреплена, обработать специальными растворами для выравнивания кислотно-щелочного баланса и устранить разрывы с помощью специальной бумаги из бруссонетии бумажной и пасты из пшеничного крахмала.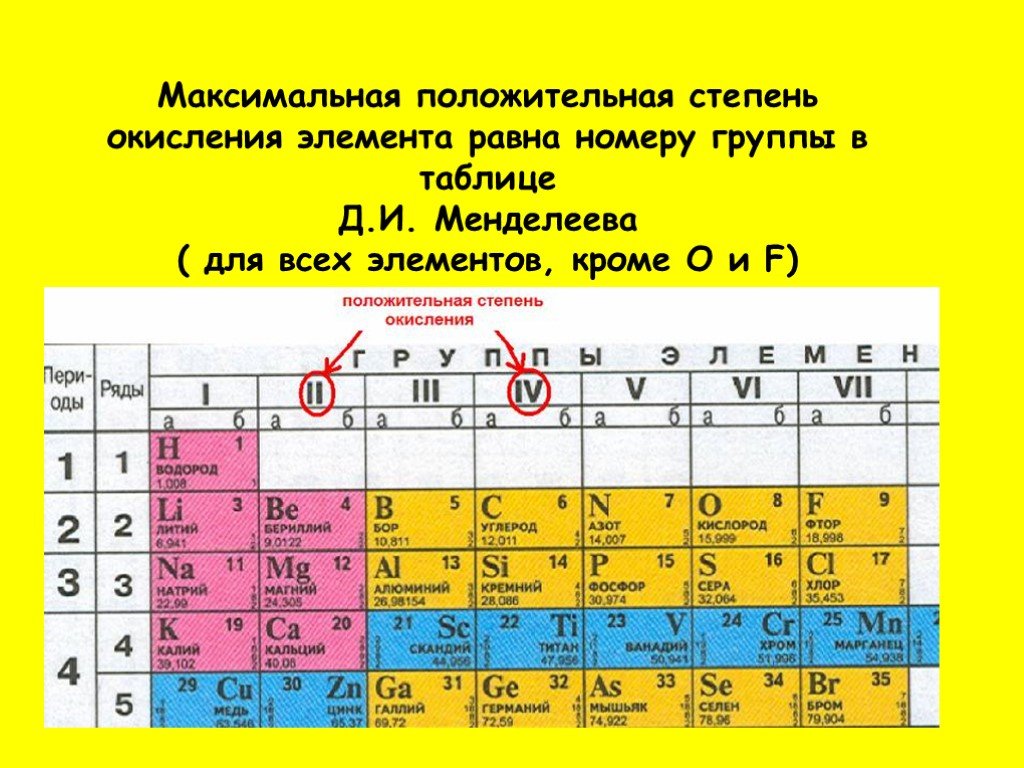
Теперь таблица находится в специальном хранилище университета, где для нее созданы подходящие условия. На самом же факультете осталась ее полномасштабная копия.
Чуть позже, но в том же 2019 году, сотрудники Санкт-Петербургского университета сообщили о своей сенсационной находке – обнаруженная ими в Большой химической аудитории таблица оказалась на 12 лет старше.
В университете рассказали, что таблица представляет собой демонстрационный вариант, изготовленный в 1876 году. Она отличается от современных вариантов. Например, в ней нет VIII группы, в которую входят инертные (благородные) газы: на момент публикации они еще не были открыты.
Фото: © wikipedia
Как появилась легенда о том, что Менделеев увидел таблицу во сне
Об известном ученом и его открытиях ходило немало баек и легенд. Одна из самых известных гласит, что Менделеев увидел свою таблицу во сне.
Сам Дмитрий Иванович об открытии периодического закона писал так:
“Заподозрив о существовании взаимосвязи между элементами еще в студенческие годы, я не уставал обдумывать эту проблему со всех сторон, собирал материалы, сравнивал и сопоставлял цифры. Наконец настало время, когда проблема созрела, когда решение, казалось, вот-вот готово было сложиться в голове. Как это всегда бывало в моей жизни, предчувствие близкого разрешения мучившего меня вопроса привело меня в возбужденное состояние. В течение нескольких недель я спал урывками, пытаясь найти тот магический принцип, который сразу привел бы в порядок всю груду накопленного за 15 лет материала.
Наконец настало время, когда проблема созрела, когда решение, казалось, вот-вот готово было сложиться в голове. Как это всегда бывало в моей жизни, предчувствие близкого разрешения мучившего меня вопроса привело меня в возбужденное состояние. В течение нескольких недель я спал урывками, пытаясь найти тот магический принцип, который сразу привел бы в порядок всю груду накопленного за 15 лет материала.
И вот в одно прекрасное утро, проведя бессонную ночь и отчаявшись найти решение, я, не раздеваясь, прилег на диван в кабинете и заснул. И во сне мне совершенно явственно представилась таблица.
Я тут же проснулся и набросал увиденную во сне таблицу на первом же подвернувшемся под руку клочке бумаги”.
Эта история позже и легла в основу легенды о том, что таблица Менделееву приснилась. Самому ученому такая интерпретация не нравилась.
“Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово”, – говорил он.
Научные открытия, сделанные во сне
Впрочем, история знает и другие примеры, когда ученые мужи не только не отрицали, а даже подчеркивали, что сделали свои открытия во сне.
- Так, немецкому химику Фридриху Августу Кекуле приснилась формула бензольного кольца.
- Датчанин Нильс Бор во сне очутился на Солнце, а вокруг него на огромной скорости вращались планеты. Под впечатлением от этого сновидения Бор создал планетарную модель строения атомов, за которую ему позже вручили Нобелевскую премию.
- А в середине XX века американский ученый Джеймс Уотсон увидел во сне двух переплетающихся змей. Это сновидение помогло ему первым в мире изобразить форму и структуру ДНК.
5.1 Расположение элементов | Периодическая таблица
Предыдущий Упражнения в конце главы | Следующий 5.2 Химические свойства групп |
5.
 1 Расположение элементов (ESABM)
1 Расположение элементов (ESABM)Периодическая таблица элементов представляет собой метод отображения химических элементов в таблице с элементы расположены в порядке возрастания атомного номера. Большая часть работы была проделана для достижения Периодическую таблицу, которую мы знаем, можно отнести к русскому химику по имени Дмитрию Менделееву . Менделеев разработал таблицу в 1869 году таким образом, чтобы повторяющиеся («периодические») тенденции или закономерности в могут быть показаны свойства элементов. Используя тенденции, которые он наблюдал, он оставил пробелы для тех элементов, которые он мысли «пропали». Он также предсказал свойства, которые, по его мнению, будут недостающими элементами. есть, когда они были обнаружены. Многие из этих элементов действительно были открыты, и предсказания Менделеева оправдались. оказалось правильным.
Чтобы показать повторяющиеся свойства, которые он наблюдал, Менделеев начал новые строки в своей таблице так, чтобы элементы
с аналогичными свойствами находились в тех же вертикальных столбцах, называемых группами . Каждая строка была отнесена
как период . На рис. 5.1 показано
упрощенная версия периодической таблицы. Полная таблица Менделеева воспроизведена в начале этой книги. Ты
можно просмотреть онлайн периодическую таблицу в таблице Менделеева.
Каждая строка была отнесена
как период . На рис. 5.1 показано
упрощенная версия периодической таблицы. Полная таблица Менделеева воспроизведена в начале этой книги. Ты
можно просмотреть онлайн периодическую таблицу в таблице Менделеева.
Рисунок 5.1: Упрощенная диаграмма, показывающая часть таблицы Менделеева. Металлы выделены серым цветом, металлоиды – голубой и неметаллы в бирюзовом.
Определения и важные понятия (ESABN)
Прежде чем мы сможем говорить о тенденциях в периодической таблице, нам сначала нужно определить некоторые термины, которые используются:
Атомный радиус
Атомный радиус — это мера размера атома.
Энергия ионизации
Первая энергия ионизации – это энергия, необходимая для отрыва одного электрона от атома в газовой фазе.
 энергия ионизации различна для каждого элемента. Мы также можем определить вторую, третью, четвертую и т. д. ионизацию.
энергии. Это энергии, необходимые для удаления второго, третьего или четвертого электрона соответственно.
энергия ионизации различна для каждого элемента. Мы также можем определить вторую, третью, четвертую и т. д. ионизацию.
энергии. Это энергии, необходимые для удаления второго, третьего или четвертого электрона соответственно.Сродство к электрону
Сродство к электрону можно рассматривать как то, насколько элемент хочет электронов.
Электроотрицательность
Электроотрицательность — это склонность атомов притягивать электроны. Электроотрицательность элементов начинается примерно с 0,7 (франций (Fr)) и доходит до 4 (фтор (F))
Группа представляет собой вертикальный столбец периодической таблицы и считается наиболее важный способ классификации элементов. Если вы посмотрите на периодическую таблицу, вы увидите группы, пронумерованные вверху каждого столбца.
 Группы нумеруются слева направо, начиная с 1 и заканчивая 18.
Это соглашение, которое мы будем использовать в этой книге. В некоторых периодических таблицах вы можете увидеть, что группы
нумеруются слева направо следующим образом: 1, 2, затем открытое пространство, содержащее переход
элементы , за которыми следуют группы с 3 по 8. Другой способ обозначить группы — использовать римские цифры.
Группы нумеруются слева направо, начиная с 1 и заканчивая 18.
Это соглашение, которое мы будем использовать в этой книге. В некоторых периодических таблицах вы можете увидеть, что группы
нумеруются слева направо следующим образом: 1, 2, затем открытое пространство, содержащее переход
элементы , за которыми следуют группы с 3 по 8. Другой способ обозначить группы — использовать римские цифры.Период — это горизонтальная строка в периодической таблице элементов. Периоды маркируются сверху вниз, начиная с 1 и заканчивая 7.
Для каждого элемента в периодической таблице мы можем указать его номер периода и номер его группы. Например,
\(\text{B}\) находится в периоде 2 и группе 13. Мы также можем определить электронную структуру элемента по его
положение в периодической таблице. В главе 4
вы отработали электронную конфигурацию различных элементов. Используя периодическую таблицу, мы можем легко дать
электронные конфигурации любого элемента. Чтобы увидеть, как это работает, посмотрите на следующее: 9{3}\). (Фосфор находится в третьей группе p-блока, поэтому он должен иметь 3
электронов в p-оболочке.)
Используя периодическую таблицу, мы можем легко дать
электронные конфигурации любого элемента. Чтобы увидеть, как это работает, посмотрите на следующее: 9{3}\). (Фосфор находится в третьей группе p-блока, поэтому он должен иметь 3
электронов в p-оболочке.)
Периоды в периодической таблице (ESABO)
Следующая диаграмма иллюстрирует некоторые ключевые тенденции по периодам:
Рисунок 5.2: Тенденции в периодической таблице.
Таблица 5.1 обобщает закономерности или тенденции в свойства элементов периода 3. Аналогичные тенденции наблюдаются и в другие периоды таблицы Менделеева. Хлориды представляют собой соединения с хлором, а оксиды — с кислородом. 9{35}\text{Кл}\)
Хлориды
\(\text{NaCl}\)
\(\text{MgCl}_{2}\)
\(\text{AlCl}_{3}\)
\(\текст{SiCl}_{4}\)
\(\text{PCl}_{5}\) или \(\text{PCl}_{3}\)
\(\text{S}_{2}\text{Cl}_{2}\)
без хлоридов
Оксиды
\(\text{Na}_{2}\text{O}\)
\(\текст{MgO}\)
\(\текст{Ал}_{2}\текст{О}_{3}\)
\(\текст{SiO}_{2}\)
\(\text{P}_{4}\text{O}_{6}\) или \(\text{P}_{4}\text{O}_{10}\)
\(\text{SO}_{3}\) или \(\text{SO}_{4}\)
Атомный радиус
Уменьшается в течение периода.
Первая энергия ионизации
Общая тенденция – увеличение за период.
Электроотрицательность
Увеличивается за период.
Температура плавления и кипения
Увеличивается до кремния, а затем уменьшается до аргона.
Электропроводность
9{12}\текст{С}\)Хлориды
\(\текст{LiCl}\)
\(\text{BeCl}_{2}\)
\(\text{BCl}_{3}\)
\(\текст{ССl}_{4}\)
Оксиды
\(\текст{Ли}_{2}\текст{О}\)
\(\текст{BeO}\)
\(\текст{В}_{2}\текст{О}_{3}\)
9{2}\)Атомный радиус
Уменьшается в течение периода.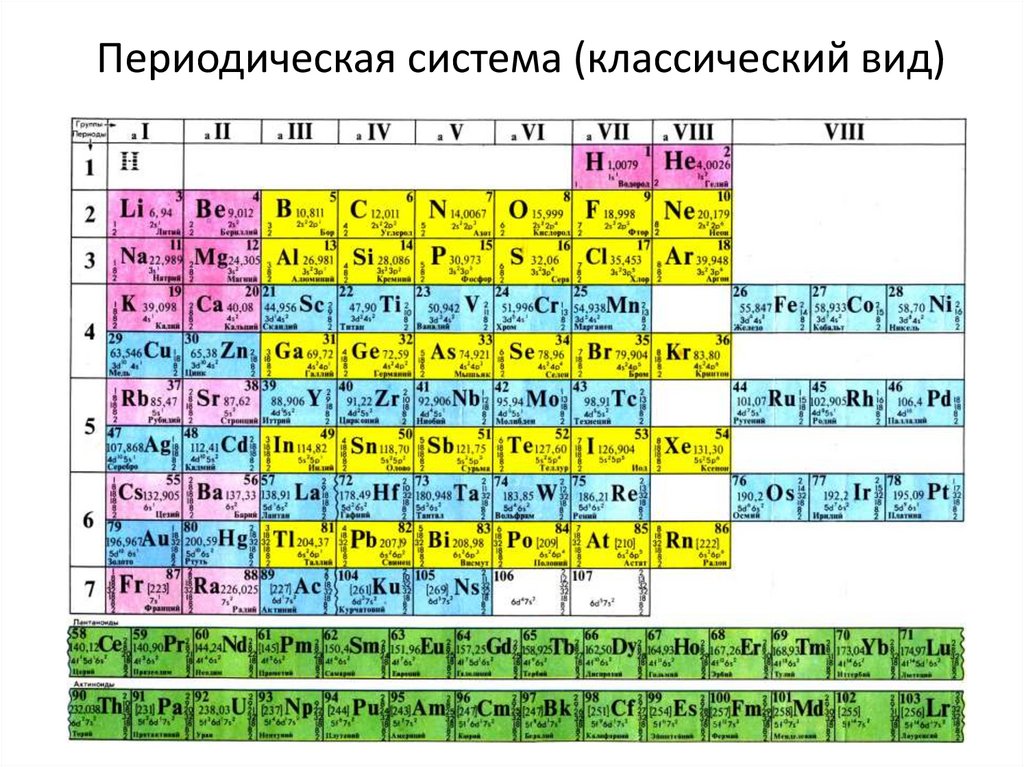
Первая энергия ионизации
Увеличивается за период.
Электроотрицательность
Увеличивается за период.
Температура плавления и кипения
Увеличивается до углерода, а затем уменьшается до неона.
Электропроводность
Увеличивается до бора, а затем уменьшается.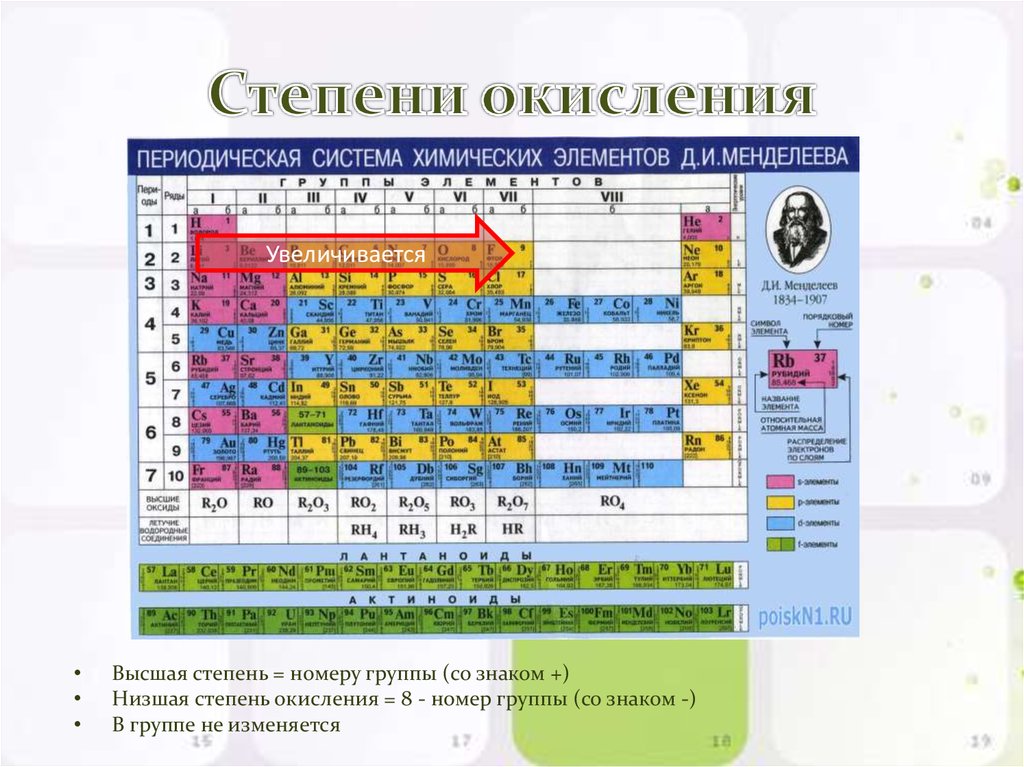 Бор является полупроводником. Литий и бериллий
проводники. Остальные изоляторы.
Бор является полупроводником. Литий и бериллий
проводники. Остальные изоляторы.
Элемент 9{20}\text{Не}\) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Хлориды | \(\text{NCl}_{3}\) | нет соединений, но кислород соединяется с хлором в соединениях, называемых оксидами хлора | без соединений | без соединений | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Оксиды | \(\text{НЕТ}_{2}\) или \(\текст{НЕТ}\) | Нет соединений. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Атомный радиус | Уменьшается в течение периода. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Первая энергия ионизации | Увеличивается за период. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Электроотрицательность | Увеличивается за период. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Температура плавления и кипения | Увеличивается до углерода, а затем уменьшается до неона.
Решение пока недоступно.
Расположение элементов: периодическая таблицаЗадание: Расстановка продуктов в продуктовом магазине. Изучите: что такое периодическая таблица и как она была разработана? Объясните 1. Что в коробке? Объясните 2. По периодам Объясните 3. Какова закономерность? Металлы, неметаллы и металлоидыОбъясните 4: Группы растут вверх!Уточните: Интерпретация периодической таблицыОцените: Периодическая таблица ПроверьтеПримечания для учителя Если бы вы зашли в продуктовый магазин, где бы вы нашли буханку хлеба или галлон молока? Как расположены товары в продуктовом магазине? Насколько вам удалось найти правильный проход? Продовольственные магазины организованы таким образом, чтобы покупатели могли легко находить нужные товары. Подумайте, как предметы расположены на полке. Легко двигаться вверх и вниз по проходу и заметить, как похожие товары сгруппированы вместе в продуктовом магазине. Систематизация информации полезна. Таблицы, диаграммы и графики используются для упорядочивания информации для удобства поиска. Ученые организовали элементы в таблицу на основе их свойств. Эта таблица называется периодической таблицей . Дмитрию Менделееву, русскому ученому, приписывают создание Периодической таблицы. Менделеев основывал свое расположение элементов как на увеличении атомной массы, так и на сходных свойствах. Нажмите на периодическую таблицу посмотреть видео о создании Периодической таблицы. Послушайте ответы на следующие вопросы:
*Примечание* Видео откроется в новом окне. Закройте окно, чтобы вернуться к этому ресурсу. Периодическая таблица кажется вам набором букв и цифр? Периодическая таблица может предоставить огромное количество информации, если ее правильно интерпретировать. Нажмите на видео ниже, чтобы понять и интерпретировать расположение элементов в периодической таблице. Обязательно нажмите на иконку «во весь экран». Запишите информацию в свой блокнот или в раздаточный материал Периодической таблицы. Найдите копию Периодической таблицы и раздаточный материал по Периодической таблице в разделе «Просмотр связанных элементов» ниже. В этом видео вы узнаете, как интерпретировать информацию, содержащуюся в отведенном для каждого элемента месте.
Из следующих видео вы узнаете, как
Запишите информацию в свой блокнот или в раздаточный материал Периодической таблицы. Найдите копию Периодической таблицы и раздаточный материал по Периодической таблице в разделе «Просмотр связанных элементов» ниже. В следующем видеоролике вы узнаете, как определить, является ли элемент металлом , неметаллом или металлоидом на основе его положения в периодической таблице. Запишите информацию о свойствах металлов, неметаллов и металлоидов в свой блокнот или в раздаточный материал Периодической таблицы. Найдите копию Периодической таблицы и раздаточный материал по Периодической таблице в разделе «Просмотр связанных элементов» ниже. Элементы периодической таблицы обычно подразделяются на групп или семейств . В следующих видеороликах вы узнаете, как
Выполните следующие задачи, используя полученную информацию. Используйте периодическую таблицу и информацию, которую вы узнали об интерпретации периодической таблицы, чтобы выполнить задания. Чтобы повторно пройти тест, перезагрузите страницу и выберите «Нет», когда появится диалоговое окно «Возобновить тест». Используйте свои знания и свою Периодическую таблицу, чтобы интерпретировать расположение Периодической таблицы. Чтобы повторно пройти тест, перезагрузите страницу и выберите «Нет», когда появится диалоговое окно «Возобновить тест». На этом уроке учащиеся будут интерпретировать расположение Периодической таблицы, включая группы и периоды, чтобы объяснить, как свойства используются для классификации элементов (TEKS 8.5A).
Краткое справочное руководство по видео
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Анемия, гипо- и авитоминоз В, эндемический зоб.
Анемия, гипо- и авитоминоз В, эндемический зоб.
 Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.

 Элементы имеют атомные номера от 1 до 118.
Элементы имеют атомные номера от 1 до 118. Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».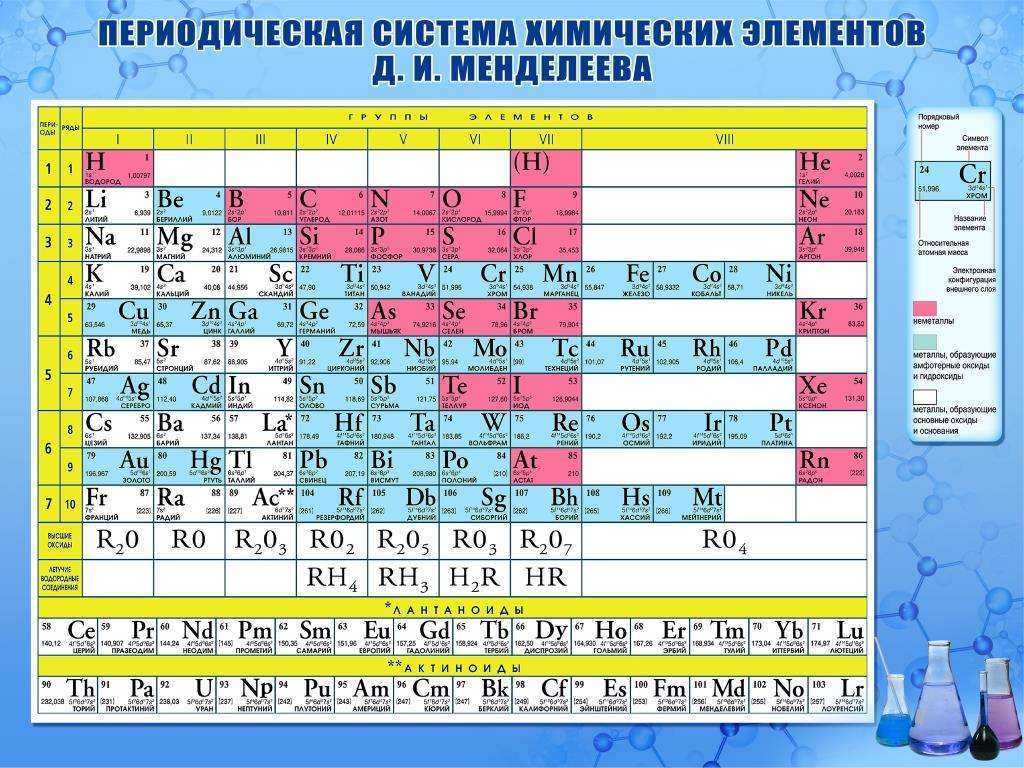 энергия ионизации различна для каждого элемента. Мы также можем определить вторую, третью, четвертую и т. д. ионизацию.
энергии. Это энергии, необходимые для удаления второго, третьего или четвертого электрона соответственно.
энергия ионизации различна для каждого элемента. Мы также можем определить вторую, третью, четвертую и т. д. ионизацию.
энергии. Это энергии, необходимые для удаления второго, третьего или четвертого электрона соответственно.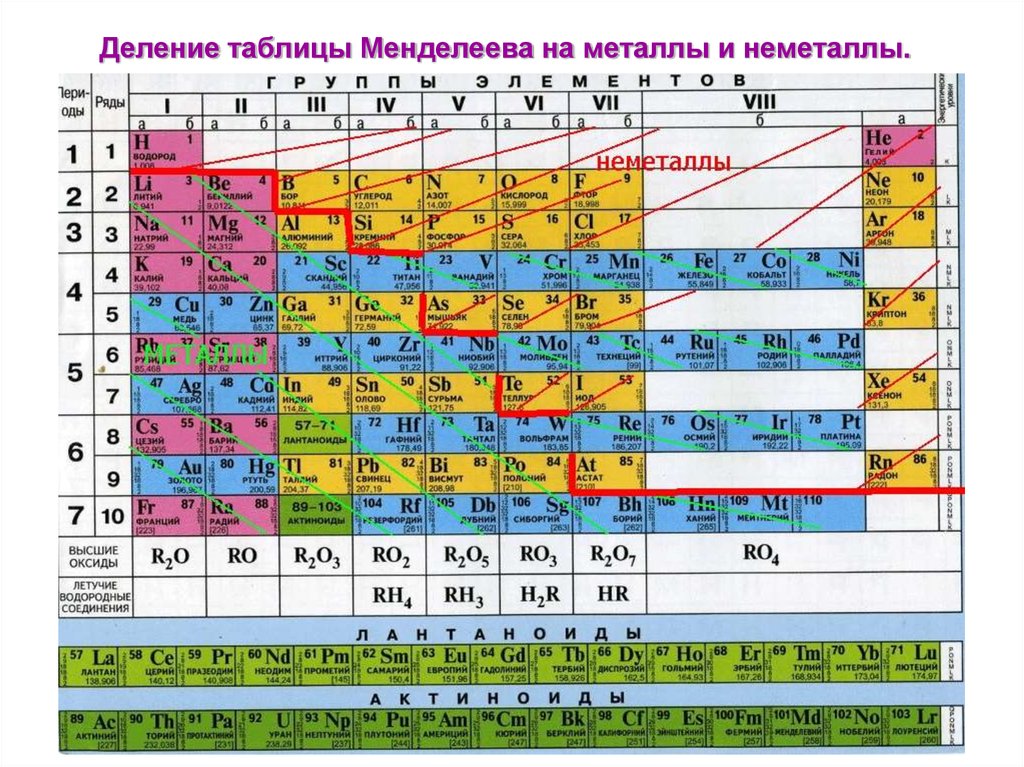 Группы нумеруются слева направо, начиная с 1 и заканчивая 18.
Это соглашение, которое мы будем использовать в этой книге. В некоторых периодических таблицах вы можете увидеть, что группы
нумеруются слева направо следующим образом: 1, 2, затем открытое пространство, содержащее переход
элементы , за которыми следуют группы с 3 по 8. Другой способ обозначить группы — использовать римские цифры.
Группы нумеруются слева направо, начиная с 1 и заканчивая 18.
Это соглашение, которое мы будем использовать в этой книге. В некоторых периодических таблицах вы можете увидеть, что группы
нумеруются слева направо следующим образом: 1, 2, затем открытое пространство, содержащее переход
элементы , за которыми следуют группы с 3 по 8. Другой способ обозначить группы — использовать римские цифры. Кислород соединяется сам с собой, образуя \(\text{O}_{2}\).
Кислород соединяется сам с собой, образуя \(\text{O}_{2}\).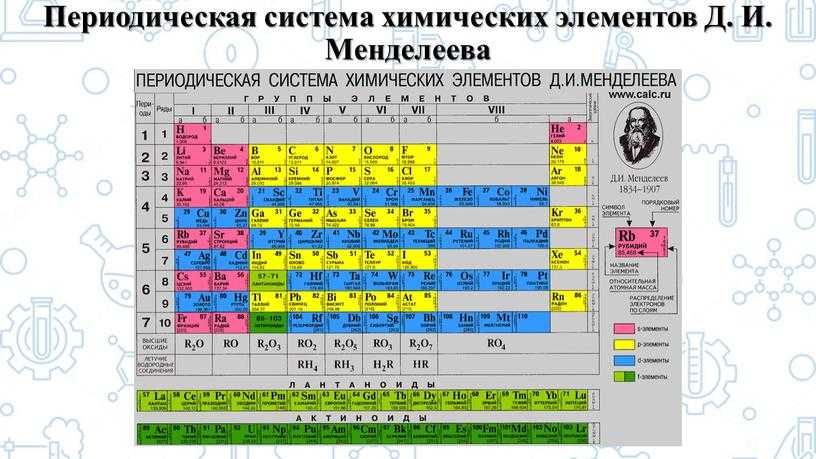

 2 Химические свойства групп
2 Химические свойства групп
 Сегодня мы продолжаем использовать периодическую таблицу в качестве справочника, помогающего определить физические и химические свойства элементов.
Сегодня мы продолжаем использовать периодическую таблицу в качестве справочника, помогающего определить физические и химические свойства элементов.

 Предполагается, что учащиеся знакомы с физическими и химическими свойствами и терминологией, такой как пластичность, пластичность и блеск.
Предполагается, что учащиеся знакомы с физическими и химическими свойствами и терминологией, такой как пластичность, пластичность и блеск.