Задачи по теме: «Количество вещества. Моль. Молярная масса. Молярный объём» 8 класс | Тренажёр по химии (8 класс):
Опубликовано 01.02.2021 – 22:50 – Кононова Севиндж Ровшан кызы
Задачи по теме: «Количество вещества. Моль. Молярная масса.
Молярный объём»
8 класс
Скачать:
Предварительный просмотр:
Задачи по теме: «Количество вещества. Моль. Молярная масса.
Молярный объём»
8 класс
|
|
|
|
|
|
|
|
|
|
|
|
По теме: методические разработки, презентации и конспекты
Открытый урок по химии в 8 классе по теме : Решение расчетных задач по теме “Количество вещества.
 Моль”.
Моль”.Решение расчетных задач по теме ” Количество вещества. Моль.”…
Тестовое задание по теме “Количество вещества.Моль.Молярная масса”
Представлен тест для учащихся 8 класса по теме “Количество вещества. Моль. Молярная масса” в виде презентации к уроку…
Решение задач «Моль, молярная масса, молярный объем»
Примеры задач по теме “Моль, молярная масса, молярный объем” с выбором ответа и самостоятельным решением основанным на уравнении реакций. можно использовать на уроках в восьмых классах и при повторени…
Контекстные задачи по теме “Количество вещества.Моль”.
Применение данного метода позволяет повысить интерес у обучающихся к решению расчётных задач….
Конспект урока в 8 классе “Количество вещества. Моль. Молярная масса”
Сложная в изложении и понимании тема для учащихся 8 класса. Сделана попытка так преподать мателиал, чтобы было и понятно, и логчно, чтобы ученики сами пришли к нужным выводам, практически закрепили но.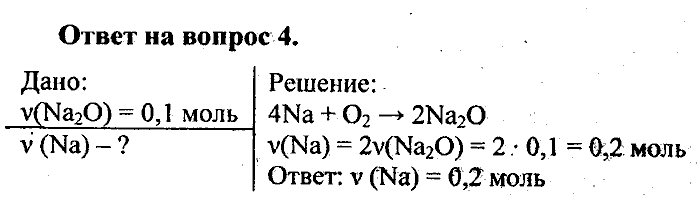 ..
..
Решение задач по теме: “Количество вещества. Молярный объем газов”
Данная работа предназначена для изучения нового материала, повторения и обобщения по теме: “Количество вещества. Молярный объем газов”….
Количество вещества. Моль. Молярная масса. Молярный объём газообразных веществ. Закон Авогадро.
Цель: Научить применять закон Авогадро при решении задач по формулам (исследование и рефлексия).Основное содержание темы: Количество вещества. Моль. Молярная масса. Молярный объём.Характеристика основ…
Поделиться:
Выход реакции. Задачи на выход
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр. , к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
, к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр. (NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н. у.) газа. Определите степень превращения углекислого газа, %.
у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н. у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Понравилось это:
Нравится Загрузка…
12.6: Массово-объемная стехиометрия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53794
Сколько азида необходимо для наполнения воздушной подушки?
В автомобилях и многих других транспортных средствах установлены подушки безопасности. В случае столкновения запускается реакция, при которой быстрое разложение азида натрия приводит к образованию газообразного азота, заполняющего подушку безопасности. Если использовать слишком мало азида натрия, подушка безопасности не наполнится полностью и не защитит человека в автомобиле. Слишком много азида натрия может вызвать образование большего количества газа, с которым мешок может безопасно справиться. Если мешок порвется из-за избыточного давления газа, вся защита будет потеряна.
В случае столкновения запускается реакция, при которой быстрое разложение азида натрия приводит к образованию газообразного азота, заполняющего подушку безопасности. Если использовать слишком мало азида натрия, подушка безопасности не наполнится полностью и не защитит человека в автомобиле. Слишком много азида натрия может вызвать образование большего количества газа, с которым мешок может безопасно справиться. Если мешок порвется из-за избыточного давления газа, вся защита будет потеряна.
Задачи массы к объему и объема к массе
В химических реакциях часто участвуют как твердые вещества, массу которых можно измерить, так и газы, для которых больше подходят измерения объема. Задачи стехиометрии такого типа называются либо задачами массы-объема, либо задачами объема-массы.
\[\text{масса данного} \rightarrow \text{моли данного} \rightarrow \text{моли неизвестного} \rightarrow \text{объем неизвестного}\nonumber \]
\[\text{объем заданного} \rightarrow \text{моль заданного} \rightarrow \text{моль неизвестного} \rightarrow \text{масса неизвестного}\nonumber \]
Поскольку оба типа задач включают преобразование молей газа в объем или наоборот, мы можем использовать молярный объем \(22,4 \: \text{л/моль}\), при условии, что условия для реакция по адресу STP .
Пример \(\PageIndex{1}\): Массово-объемная стехиометрия
Металлический алюминий быстро реагирует с водным раствором серной кислоты с образованием водного сульфата алюминия и газообразного водорода:
\[2 \: \text{Al} \left ( s \right) + 3 \ce{H_2SO_4} \left( aq \right) \rightarrow \ce{Al_2(SO_4)_3} \left( aq \right) + 3 \ce{H_2} \left( g \right )\номер \]
Определите объем газообразного водорода, образующегося на СТП при полной реакции \(2,00 \: \text{g}\) куска алюминия.
Решение:
Шаг 1: Перечислите известные количества и спланируйте задачу. Известно- Дано: \(2.00 \: \text{g} \: \ce{Al}\)
- Молярная масса \(\ce{Al} = 26,98 \: \text{г/моль}\)
- \(2 \: \text{моль} \: \ce{Al} = 3 \: \text{моль} \: \ce{H_2}\)
- объем H 2 = ?
Сначала граммы алюминия будут преобразованы в моли. Затем будет применяться мольное отношение для преобразования в моли газообразного водорода. Наконец, молярный объем газа будет использоваться для преобразования в литры водорода.
Затем будет применяться мольное отношение для преобразования в моли газообразного водорода. Наконец, молярный объем газа будет использоваться для преобразования в литры водорода.
\[\text{g} \: \ce{Al} \rightarrow \text{mol} \: \ce{Al} \rightarrow \text{mol} \: \ce{H_2} \rightarrow \text{L } \: \ce{H_2}\nonumber \]
Шаг 2: Решить.\[2.00 \: \text{g} \: \ce{Al} \times \frac{1 \: \text{mol} \: \ce{Al}}{26.98 \: \text{g} \: \ce{Al}} \times \frac{3 \: \text{mol} \: \ce{H_2}}{2 \: \text{mol} \: \ce{Al}} \times \frac {22,4 \: \text{L} \: \ce{H_2}}{1 \: \text{моль} \: \ce{H_2}} = 2,49 \: \text{L} \: \ce{H_2} \nonumber \]
Шаг 3: Подумайте о своем результате .
Объем в литрах. Для гораздо меньших количеств может быть удобно конвертировать в миллилитры. Ответ здесь состоит из трех значащих цифр. Поскольку молярный объем представляет собой измеренную величину \(22,4 \: \text{л/моль}\), три – это максимальное количество значащих цифр для этого типа задач. 93 \: \text{L} = \ce{SO_2}\)
93 \: \text{L} = \ce{SO_2}\)
- масса CaO = ? г
Объем \(\ce{SO_2}\) будет преобразован в моли, затем следует молярное отношение и, наконец, преобразование молей \(\ce{CaO}\) в граммы.
\[\text{L} \: \ce{SO_2} \rightarrow \text{моль} \: \ce{SO_2} \rightarrow \text{моль} \: \ce{CaO} \rightarrow \text{g } \: \ce{CaO}\номер\] 93 \: \text{g} \: \ce{CaO}\nonumber \]
Шаг 3: Подумайте о своем результате.Результирующая масса может быть представлена как \(3,5 \: \text{кг}\) с двумя значащими цифрами. Несмотря на то, что мольное соотношение 2:2 математически не влияет на проблему, оно все же необходимо для преобразования единиц измерения.
Резюме
- Описаны расчеты для определения количества газа, образующегося в результате реакции.

Обзор
- Каковы условия для всех газов в этих расчетах?
- Как узнать, правильно ли установлены все коэффициенты?
- Почему 2 моль CaO/2 моль SO 2 были включены во второй пример, если это не повлияло на окончательное число?
Эта страница под названием 12.6: Массово-объемная стехиометрия распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 через исходный контент, отредактированный в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
5.6: Массово-объемная и объемно-массовая стехиометрия
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 270471
Сколько азида необходимо для заполнения подушки безопасности?
В автомобилях и многих других транспортных средствах установлены подушки безопасности. В случае столкновения запускается реакция, при которой быстрое разложение азида натрия приводит к образованию газообразного азота, заполняющего подушку безопасности. Если использовать слишком мало азида натрия, подушка безопасности не наполнится полностью и не защитит человека в автомобиле. Слишком много азида натрия может вызвать образование большего количества газа, с которым мешок может безопасно справиться. Если мешок порвется из-за избыточного давления газа, вся защита будет потеряна.
В случае столкновения запускается реакция, при которой быстрое разложение азида натрия приводит к образованию газообразного азота, заполняющего подушку безопасности. Если использовать слишком мало азида натрия, подушка безопасности не наполнится полностью и не защитит человека в автомобиле. Слишком много азида натрия может вызвать образование большего количества газа, с которым мешок может безопасно справиться. Если мешок порвется из-за избыточного давления газа, вся защита будет потеряна.
Задачи массы на объем и объема на массу
В химических реакциях часто участвуют как твердые вещества, массу которых можно измерить, так и газы, для которых больше подходят измерения объема. Задачи стехиометрии такого типа называются либо задачами массы-объема, либо задачами объема-массы.
\[\text{масса данного} \rightarrow \text{моли данного} \rightarrow \text{моли неизвестного} \rightarrow \text{объем неизвестного}\nonumber \]
\[\text{объем заданного} \rightarrow \text{моль заданного} \rightarrow \text{моль неизвестного} \rightarrow \text{масса неизвестного}\nonumber \]
Поскольку оба типа задач включают преобразование молей газа в объем или наоборот, мы можем использовать молярный объем \(22,4 \: \text{л/моль}\), при условии, что условия для реакция по адресу STP .
Пример \(\PageIndex{1}\): Массово-объемная стехиометрия
Металлический алюминий быстро реагирует с водным раствором серной кислоты с образованием водного сульфата алюминия и газообразного водорода:
\[2 \: \text{Al} \left ( s \right) + 3 \ce{H_2SO_4} \left( aq \right) \rightarrow \ce{Al_2(SO_4)_3} \left( aq \right) + 3 \ce{H_2} \left( g \right )\номер \]
Определите объем газообразного водорода, образующегося на СТП при полной реакции \(2,00 \: \text{g}\) куска алюминия.
Решение:
Шаг 1: Перечислите известные количества и спланируйте задачу. Известно- Дано: \(2.00 \: \text{g} \: \ce{Al}\)
- Молярная масса \(\ce{Al} = 26,98 \: \text{г/моль}\)
- \(2 \: \text{моль} \: \ce{Al} = 3 \: \text{моль} \: \ce{H_2}\)
- объем H 2 = ?
Сначала граммы алюминия будут преобразованы в моли.
\[\text{g} \: \ce{Al} \rightarrow \text{mol} \: \ce{Al} \rightarrow \text{mol} \: \ce{H_2} \rightarrow \text{L } \: \ce{H_2}\nonumber \]
Шаг 2: Решить.\[2.00 \: \text{g} \: \ce{Al} \times \frac{1 \: \text{mol} \: \ce{Al}}{26.98 \: \text{g} \: \ce{Al}} \times \frac{3 \: \text{mol} \: \ce{H_2}}{2 \: \text{mol} \: \ce{Al}} \times \frac {22,4 \: \text{L} \: \ce{H_2}}{1 \: \text{моль} \: \ce{H_2}} = 2,49 \: \text{L} \: \ce{H_2} \nonumber \]
Объем в литрах. Для гораздо меньших количеств может быть удобно конвертировать в миллилитры. Ответ здесь состоит из трех значащих цифр. Поскольку молярный объем представляет собой измеренную величину \(22,4 \: \text{л/моль}\), три – это максимальное количество значащих цифр для этого типа задач. 93 \: \text{L} = \ce{SO_2}\)
93 \: \text{L} = \ce{SO_2}\)
- масса CaO = ? г
Объем \(\ce{SO_2}\) будет преобразован в моли, затем следует молярное отношение и, наконец, преобразование молей \(\ce{CaO}\) в граммы.
\[\text{L} \: \ce{SO_2} \rightarrow \text{моль} \: \ce{SO_2} \rightarrow \text{моль} \: \ce{CaO} \rightarrow \text{g } \: \ce{CaO}\номер\] 93 \: \text{g} \: \ce{CaO}\nonumber \]
Шаг 3: Подумайте о своем результате.Результирующая масса может быть представлена как \(3,5 \: \text{кг}\) с двумя значащими цифрами. Несмотря на то, что мольное соотношение 2:2 математически не влияет на проблему, оно все же необходимо для преобразования единиц измерения.
Резюме
- Описаны расчеты для определения количества газа, образующегося в результате реакции.

- Описаны расчеты для определения количества материала, необходимого для реакции с газом.
Обзор
- Каковы условия для всех газов в этих расчетах?
- Как узнать, правильно ли установлены все коэффициенты?
- Почему 2 моль CaO/2 моль SO 2 были включены во второй пример, если это не повлияло на окончательное число?
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC
- Показать страницу TOC
- № на стр.


