как решать с процентным содержанием
Смесь, состоящая из частиц растворителя, растворяемого вещества и продуктов их взаимодействия, называется раствором. Это гомогенные структуры однородной консистенции, состоящие из двух либо нескольких компонентов. Решение задач на растворы – определение их концентрации, степени растворимости веществ, условий протекания растворообразующих процессов.
Задачи на растворы по химии
Чистое вещество либо смесь нескольких компонентов, попадая в растворитель, могут проявлять свойства:
- хорошей растворимости;
- малой растворимости;
- быть нерастворимыми.
При растворении в воде образуются многочисленные атомно-молекулярные связи. Их количество зависит от коэффициента растворимости – химической величины, которая рассчитывается путем деления массы растворяемого вещества на массу растворителя.
Кроме этого, в задачах могут присутствовать массовая доля вещества, растворенного в соответствующем растворителе.
Как решать задачи с процентными растворами
Растворы с выраженной концентрацией активного (растворенного) вещества носят название процентных. В задачах по химии ставятся цели определить содержание массы растворенного вещества, массы образовавшегося либо первоначального раствора, процентного содержания вещества до или после растворения.
Растворы, о которых идет речь в задачах по химии, обладают общими свойствами:
- они однородны;
- смешивание компонентов происходит за малый отрезок времени, как и изменение их концентрации;
- в результате смешивания двух (или более) растворов с различной концентрацией, происходит не только увеличение общей массы и объема раствора, но и усреднение процентного содержания растворенного вещества.
Поэтому существуют общие принципы их решения. Так, увеличение концентрации происходит в результате упаривания (испарения растворителя), а уменьшение – разбавления. В результате смешения может наблюдаться как увеличение, так и уменьшение, в зависимости от конкретных условий задачи.
В результате смешения может наблюдаться как увеличение, так и уменьшение, в зависимости от конкретных условий задачи.
В любом случае характеристики начального и конечного продуктов будут различаться, поэтому важно, данные в условии сведения не перепутать. Для этого применяется их нумерация.
Чтобы грамотно составить алгоритм решения, часто бывает полезно использовать уравнение химической реакции относительно активного вещества либо кислоты.
Концентрация растворов и способы ее выражения
Источник: thepresentation.ruНа бытовом уровне понятие концентрации раствора выражается в отношении массы растворенного вещества к массе раствора, выраженном в процентах. Однако правомерно более широкое определение, охватывающее различные способы выражения концентрации.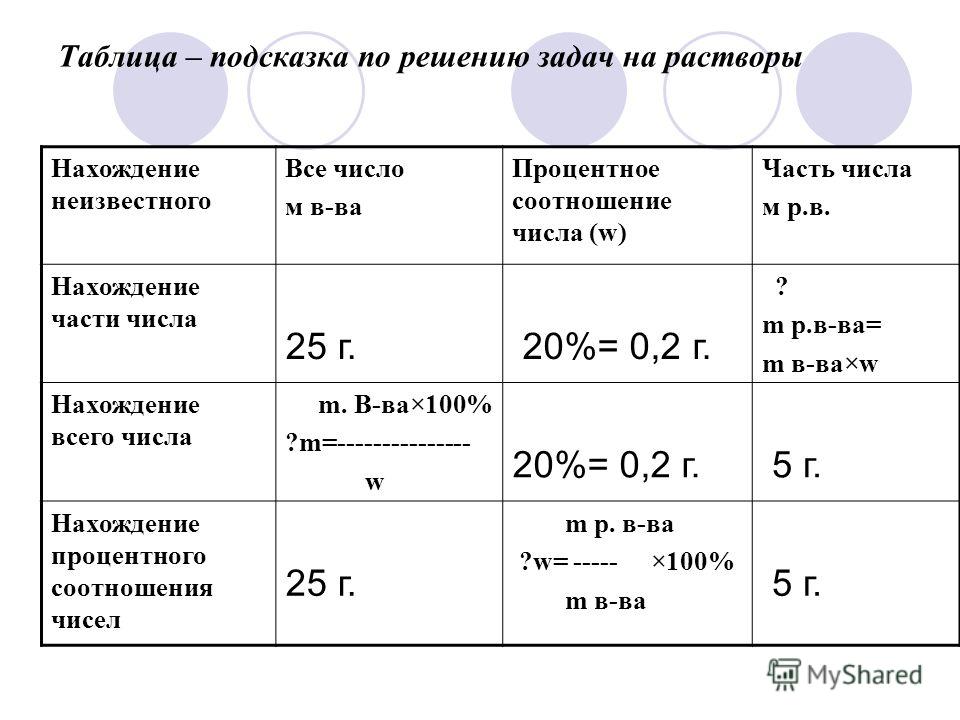
Концентрация раствора – количественный показатель состава активного вещества в растворе, выраженное в определенных единицах и заключенное в единице массы или объема. Выражается в долях, процентах, массовых долях, молярности, мольных долях, титрах. Из них чаще применяются молярность и мольная доля.
1. О массовой доле (\(\omega\)) идет речь в задачах, когда можно составить соотношение масс растворенного компонента и всего раствора. Для ее выражения существует формула:
\(\omega=M_{в-ва}\div M_{р-ра}\)
Выражается она в процентах либо долевых частях единицы.
2. Молярность (по-другому – молярная концентрация) или \(С\) показывает сколько молей растворяемого компонента содержится в литре раствора. Ее формула имеет вид:
\(С=n\div V\)
где \(n\) – это растворенное вещество в молях. Исходя из его значения, раствор может быть одномолярным (содержит 1 моль в 1 литре), децимолярным (0,1 моля в 1 л), сантимолярным (0,01 моль) и т.д.
3. Концентрация моляльная (обозначается \(С_х\)) – моляльность – показатель количества (n) молей растворенного компонента в 1 кг растворителя (\(M_{р-ля}\)).
Концентрация моляльная (обозначается \(С_х\)) – моляльность – показатель количества (n) молей растворенного компонента в 1 кг растворителя (\(M_{р-ля}\)).
\(C_x=n\div M_{р-ля}\)
4. Для определения содержания (в граммах) вещества в 1 л раствора применяется понятие «титр» (\(Т\)).
\(T=M_{в-ва}\div V_{р-ра}\)
5. Под растворимостью (\(S\)) понимают максимальную массу растворяемого вещества, способного раствориться в 100 г растворителя:
\(S=(M_{в-ва}\div M_{р-ля})\times100 {}\)
6. Коэффициент растворимости (\(K_s\)) – показатель, который определяется отношением массы вещества к массе растворителя при условии получения насыщенного раствора при обозначенной температуре:
\(K_s=M_{в-ва}\div M_{р-ля}\)
Решение задач на упаривание растворов
Выпаривание раствора происходит в результате испарения воды, что ведет за собой уменьшение общего объема и массы. В то же время масса растворенного вещества остается без изменений.
Пример. Водный раствор аммиака
Рассмотрим пример решения задачи на упаривание.
Условие: В наличии 800 г раствора с 15%-ной концентрацией определенного вещества. Нужно увеличить его массовую долю на 5%. Сколько г воды должно испариться?
Этапы решения:
- Какова масса вещества в первичном растворе?
\(M_в=\omega_в\times M_р=0,15×800=120\)г, где \(M_в\) – масса вещества, \(M_р\) – масса раствора
Найденное значение останется постоянным, поскольку при выпаривании изменения массы растворенного вещества не происходит. Значит M’=120г
2. \(M_р=M_в\div\omega_в= 120÷0.2=600\)г
3. Теперь можно найти массу испаренной воды:
\(M{исп\;в}=M_р-M’=800-600=200\)г
Решение задач на разбавление растворов
В результате процесса разбавления масса того вещества, которое растворено, не меняется в отличие от массы всего раствора и растворителя.
Масса имеющегося раствора NaCl 200г, его концентрация – 15%. К раствору добавлено 40г воды. Определить массовую долю NaCl в конце реакции.
Решение
1. Определение массы раствора в конце процесса:
\(M’=M_{р-ра}+M_{добh3O}=240\)г
2. Определение массы NaCl в начале процесса:
\(M_{NaCl}=(\omega_{NaCl}\times M_р)\div100\%=15\%\times200г\div100\%=30 {}\)г
В конечном растворе \(M’_ {NaCl}=M_{NaCl}\)
3. Определение массовой доли NaCl в конце процесса:
\(\omega’_{NaCl}=M_{NaCl}\div M’_р\times100\%=12,5\%\)
Решение задач на концентрирование растворов
Повышение концентрации происходит при добавлении вещества в раствор. При этом конечная масса растворенного вещества равна сумме первоначального содержимого и того, который добавлен.
Задача. Имеется 180 г раствора с 8%-ной концентрацией соли (формула NaCl). В этот раствор всыпали еще 20 г поваренной соли. Какая массовая доля NaCl получилась в конце реакции?
Какая массовая доля NaCl получилась в конце реакции?
Решение
1. Определение окончательной массы раствора:
\(M’_р=M_р+M_{доб}=200\)г
2. Определение конечной массы NaCl:
M’=M+Mдоб
Следовательно, нужно найти \(M\) – массу в начале процесса.
Тогда \(M’=14,4г+20г=34,4\)г
3. Определение массовой доли NaCl в конечном продукте:
\(\omega’=M’_{NaCl}\div M’_р\times100\%=17,2%\)
Решение задач на смешение растворов
Источник: image.slidesharecdn.comСмешение растворов с различной концентрацией растворенного вещества происходит с соблюдением «конверта Пирсона». Это – диагональная модель, при которой нельзя складывать массовые доли, а можно – лишь массы растворенных компонентов и растворов.
Задача
Дано два раствора с массами \(M\) и \(M_1\). Массовые доли растворенного вещества обозначим соответственно \(ω\) и \(ω_1\).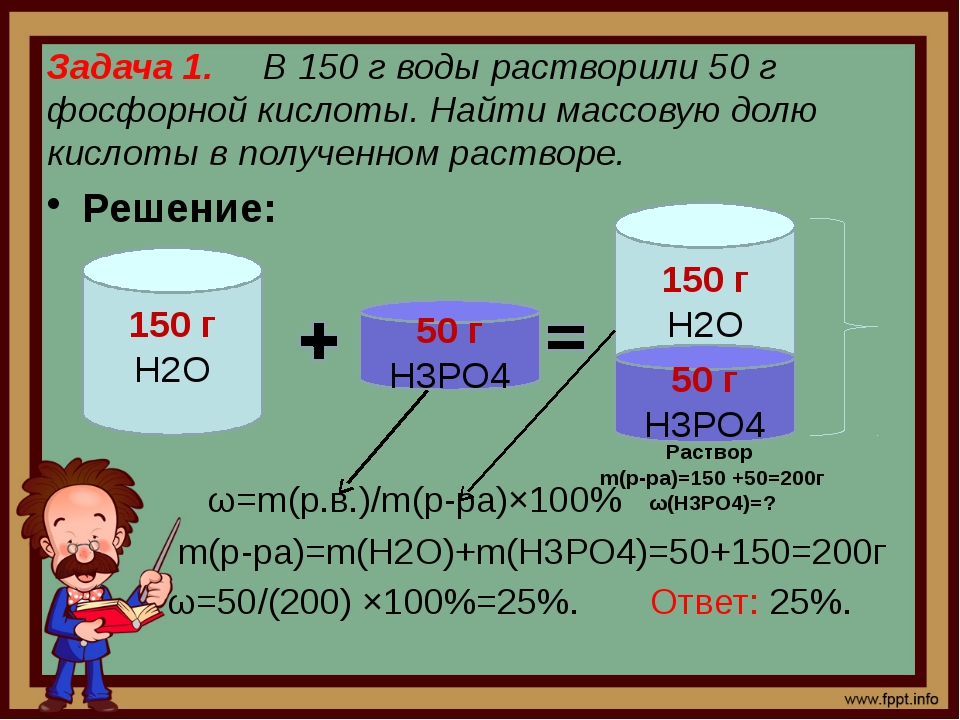
Решение
1. Определение общей массы растворенного вещества:
\(M_1\omega_1+M_2\omega_2=\omega_3(M_1+M_2)\)
2. Математические действия:
\(M_1(\omega_1-\omega_3)=M_2=(\omega_3-\omega_2)\)
\(M_1\div M_2=(\omega_3-\omega_2)\div(\omega_1-\omega_3)\)
Следовательно, согласно этому математическому выражению, и нужно взять соотношение растворов.
Задачи на определение процентной концентрации раствора
Источник: lh4.googleusercontent.comКакая процентная концентрация раствора \(KNO_3\), если нормальная равна \(0,2\) моль/л. Плотность равна \(1\) г/мл.
Решение:
1. Определение массы раствора объемом \(1000\) мл:
\(M=\rho\times V=1\times1000=1000\)г
2. Составление и решение следующей пропорции:
\(20,0\)г \(KNO_3\) – \(1000\) г раствора
\(Х_г\) – \(100\) г раствора
\(Х=2,02\) г или \(ω=2,02%\)
Задача 2
Нужно приготовить \(300\) г 25%-ного раствора соли, имея 60%-ный и 10%-ный. Сколько нужно взять таких компонентов (m1 и m2)?
Сколько нужно взять таких компонентов (m1 и m2)?
Для решения применим правило Креста:
Источник: him.1sept.ru1. Определение веса одной из 50-ти частей образуемого раствора:
\(300\div5=6\)
2. Определение массы каждой части \(m_1\) и \(m_2\):
\(m_1=6\times15=90\)
\(m_2=6\times35=210\)
Задача 3
Используя 250г 45%-ного раствора соли, нужно понизить его концентрацию до 10%. Сколько воды необходимо использовать?
Концентрация соли в воде, используемой в качестве добавки, равна 0.
По методу креста образуется 45 частей раствора:
Источник: him.1sept.ruРешение
1. Масса одной части первичного раствора равна: \(250\div10=25\)г
2. Определение массы воды, что необходима: \(25\times35=875\)г
С целью проверки можно выполнить следующие действия:
1. Определение массы конечного продукта-раствора:
\(875+25=1125г\)
2. Для исходного раствора действует пропорция:
Для исходного раствора действует пропорция:
В 250г 40%-ного р-ра содержится Хг соли
в 100 г – 45г
Отсюда Х=112,5 г соли
3. Определение конечной концентрации раствора:
1125 г раствора – 112,5 соли
100г – Х
Х=10г или 10%
Следовательно, нужно взять 875 г воды.
Решать задачи на растворы – интересное занятие! Знание основных закономерностей будет полезно с теоретической и практической точек зрения. Однако бывают случаи, когда нужно быстро сдать контрольную либо перепроверить собственные решения. Тогда можно обратиться на сайт ФениксХелп.
объяснение и примеры для сдачи ЕГЭ
В реальной жизни вам вряд ли пригодится решение задач по химии «методом креста», например. Это больше подходит тем, кто претендует на участие в олимпиадах или занятия научной деятельностью. Но такие люди и без нас знают, как правильно решать задачи по химии по теме растворы.
Если же вам просто нужно сдать какой-то экзамен и забыть про этот совершенно непонятный и крайне сложный предмет раз и навсегда, мы предлагаем вам полезную информацию, которая поможет освоить хотя бы базовое решение задач на смешивание растворов по химии.
Правило смешивания или «Конверт Пирсона»
Довольно часто учащиеся сталкиваются с задачами по приготовлению растворов с определенной массовой долей вещества, растворенного в этом растворе, или же на смешение растворов различной концентрации. И диагональная модель «конверта Пирсона» в этом случае станет идеальным методом решения задач на концентрацию растворов по химии.
На заметку!
Конверт Пирсона имеет другое более распространенное название – правило креста.
Общая химия предлагает множество способов решения задач по растворам. вот самые применяемые
Итак, возьмем в качестве примера задачу на растворы по химии с решением.
Допустим, необходимо сделать раствор с определенной концентрацией. При этом у нас в распоряжении 2 раствора с разной степенью концентрацией, нам не подходящей (то есть у одного концентрация выше, у второго – ниже).
При этом у нас в распоряжении 2 раствора с разной степенью концентрацией, нам не подходящей (то есть у одного концентрация выше, у второго – ниже).
Массу первого раствора обозначим m1, а второго – m2. При смешивании обоих растворов их общая масса будет рассчитываться путем суммы обеих масс.
В этом примере очевидно, что отношение массы первого раствора к массе второго – это и будет отношение разности массовых долей растворенного в них вещества и во втором растворе к разности соответствующих величин в первом растворе и в смеси в целом.
Есть и другое название у этой формулы – диагональная схема правила смешения.
Делается это так: одна массовая доля пишется над другой. Правее между ними записывается массовая доля вещества в растворе, который необходимо приготовить по условию. Затем идет процесс вычитания по диагонали – из большего значения вычитывается меньшее. Итог вычитаний покажет массовую долю для обоих растворов, которые нужны для приготовления раствора концентрации, нам необходимой.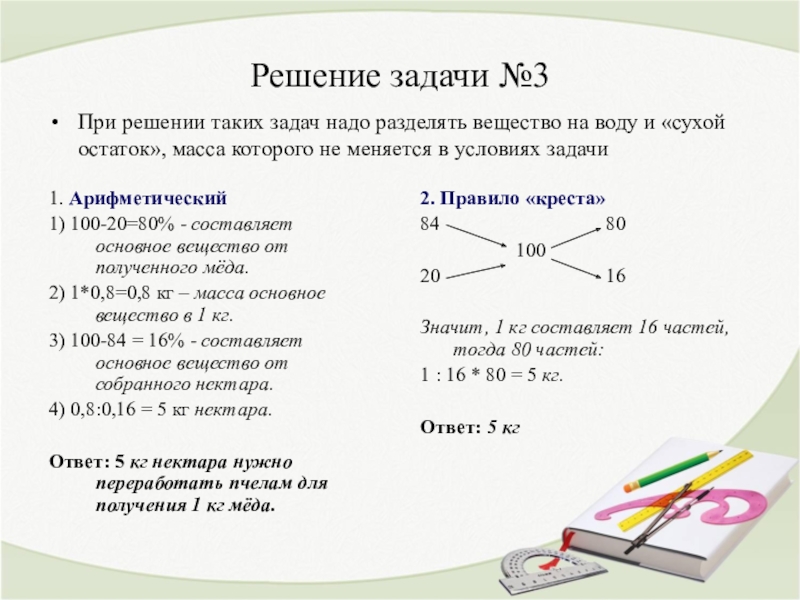
И если применить это диагональное правило (или правило креста) на практике, давайте приведем вам такой пример:
Пожалуй, на этом закончим рассматривать самые основные способы решения задач по химии на растворы. Если хорошенько вдуматься, то ничего сложного в этом нет. Если это все же вызывает у вас недоумение, не расстраивайтесь – наши авторы готовы в любое время дня и ночи не только решить для вас задачи по химии любой сложности, но и при необходимости сдать экзамен по этому невероятно сложному предмету! Например, заказать речь на защиту диплома вы можете по ссылке. Вам останется только наслаждаться жизнью!
Автор: Наталья
Наталья – контент-маркетолог и блогер, но все это не мешает ей оставаться адекватным человеком. Верит во все цвета радуги и не верит в теорию всемирного заговора. Увлекается «нейрохиромантией» и тайно мечтает воссоздать дома Александрийскую библиотеку.
Верит во все цвета радуги и не верит в теорию всемирного заговора. Увлекается «нейрохиромантией» и тайно мечтает воссоздать дома Александрийскую библиотеку.
Урок «Растворы. Решение задач на растворы» (11 класс)
Технологическая карта урока
Предмет: химия
Класс: 11
Тема: «Растворы. Решение задач на растворы».
Цель урока: воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости грамотного отношения к своему здоровью и окружающей среде.
Задачи:
1. Подвести обучающихся к пониманию необходимости знаний о растворах.
2.Познакомить с новым способом решения задач. Способствовать развитию умения мыслить логически и владеть химическим языком,
Способствовать развитию умения мыслить логически и владеть химическим языком,
3. Развивать навыки наблюдения, экспериментальные навыки, решения задач, умения выделять главное и делать выводы.
4. Воспитывать умение работать самостоятельно. Показать связь изученной темы с жизнью. Развивать смекалку учащихся.
5. Создать на уроке условия для сохранения здоровья.
Тип урока: комбинированный.
Необходимое оборудование: химические реактивы (растворы HCl, H2SO4, BaCl2, Na2CO3, Mg), химическая посуда, презентация на тему «Растворы», компьютер, экран, проектор.
Формируемые универсальные учебные действия:
Личностные УУД: умение ориентироваться в социальных ролях и межличностных отношениях.
Познавательные УУД: умение анализировать и синтезировать причинно-следственные связи, доказывать свои суждения, сформулировать проблему и найти способы ее решения, умение исследовать, обобщать.
Регулятивные УУД: умение действовать по плану, контролировать, корректировать, оценивать процесс и результаты своей деятельности.
Коммуникативные УУД: умение сотрудничать, вступать в дискуссию, управлять поведением партнера, уметь с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации.
Структура и ход урока
№
Этапы урока
Деятельность учителя
Деятельность обучающихся
1
2
3
4
1
Ориентировочно-мотивационный этап
Учитель начитает урок словами Н. Заболоцкого.
Приложение 1.
Сообщает тему урока, затем в целях актуализации знаний проводит фронтальную беседу по вопросам
Слайды 3-11
Слушают учителя, фиксируют проблему, Высказывают предположение о важности растворов в повседневной жизни.
2.
Исполнительский этап
Учитель предлагает провести химический эксперимент. Проводит инструктаж по ТБ.
Приложение 2.
Учащиеся проводят эксперимент. Общаются в парах и делают вывод
Слайд 12
3.
Первичное усвоение новых знаний
Предлагает новый способ решения задач на смешение растворов. Приложение 3.
Приводит учащимся эвристические рекомендации к решению задач из книги известного американского математика Д. Пойа. (Автора книги «Как решить задачу»)
Слайд 14.
Приложение 4.
Слушают учителя, строят высказывания.
Анализируют услышанное, аргументируют свою точку зрения.
4.
Первичная проверка понимания
Предлагает решить задачи с использованием правила смещения
Приложение 5.
Решают задачи.
Осуществляют взаимоконтроль
Записывают решение на доске.
5.
Пауза для здоровья
Предлагает сделать профилактические упражнения для глаз.
Приложение 6.
Выполняют профилактические упражнения для глаз.
6.
Первичное закрепление
Учитель предлагает провести химический эксперимент. Проводит инструктаж по ТБ.
Приложение 7.
Учащиеся проводят эксперимент. Общаются в парах и делают вывод
Приложение 7.
7.
Контроль усвоения.
Предлагает решить задачи по выбору.
Решают задачи.
Осуществляют взаимоконтроль
Приложение 8
8.
Постановка и решение проблемной задачи
Предлагает поговорить о составе табачного дыма, и напоминает о Федеральном законе «Об охране здоровья граждан от воздействия окружающего табачного дыма и последствий потребления табака»
Предлагает решить задачу.
Приложение 9.
Изучая данные таблицы и решая задачу, учащиеся, отвечают на вопросы о вреде курения и влиянии сигаретного дыма на природу, а также делают вывод для себя, стоит ли курить или стоит отказаться от этого порока.
9.
Информация о домашнем задании, инструктаж по его выполнению
Приложение 10.
Получают карточки с домашним заданием
10.
Рефлексия
Учитель заканчивает урок словами великого химика XX столетия Л. К. Полинга: «Я думаю, что химики – это те, кто на самом деле понимает мир. Этот огромный мир – удел химиков»
К. Полинга: «Я думаю, что химики – это те, кто на самом деле понимает мир. Этот огромный мир – удел химиков»
И предлагает старшеклассникам выразить свое отношение к уроку.
Поднимают вверх смайлики.
Приложение 11.
Приложение 1.
Два мира есть у человека:
Один, который нас творит,
Другой, который мы от века
Творим по мере наших сил…
1) Что происходит с веществами при растворении их в воде?
2) Что такое растворы?
3) Какую роль играют растворы в жизни человека?
4) Какие способы выражения концентрации растворов вы знаете?
Приложение 2.
Опыт 1. К 1 мл 10 %-ного раствора хлорида натрия прилейте 1 мл. 5 %-ного раствора хлорида натрия. Что наблюдаете? Как меняется концентрация вещества в растворе при сливании двух этих растворов? Как изменится концентрация соли, если в раствор соли добавить 10 г хлорида натрия? А если добавить 50 мл воды?
При смешивании исходного раствора с более разбавленным раствором того же вещества, либо при разбавлении водой происходит понижение концентрации исходного раствора. Напротив, добавление к исходному раствору концентрированного раствора того же вещества или добавление дополнительного количества растворённого вещества концентрация исходного раствора увеличивается
Напротив, добавление к исходному раствору концентрированного раствора того же вещества или добавление дополнительного количества растворённого вещества концентрация исходного раствора увеличивается
Приложение 3.
Учитель предлагает новый способ решения таких задач.
Для решения подобных задач удобнее пользоваться правилом смещения (правило креста или квадрат Пирсона), согласно которому количества смешиваемых растворов обратно пропорциональны разностям концентраций смешиваемых растворов; массовые концентрации исходных растворов помещают друг под другом в углу квадрата с левой стороны; задаваемая концентрация растворённого вещества помещается в центре квадрата, а разности между ней и концентрациями исходных растворов (из большего вычитается меньшее) размещаются на концах диагоналей по правым углам квадрата. Следует помнить, что концентрация воды равна 0%, концентрация твёрдого безводного вещества – 100%.
ω1 ω 3 – ω 2 m1
ω 3
ω 2 ω 1 – ω 3 m2
Приложение 4.
Общие рекомендации к решению задач.
«Обдумай цель раньше, чем начать…» – люди начинают вносить предложения, обсуждать и даже бороться за дело, не поняв, какой цели они добиваются.
«С началом считается глупец, о конце думает мудрец» – если вы не уяснили конечной цели, не трудно при решении задачи сбиться с пути, а затем и вовсе забросить её.
«Мудрый меняет свои решения, а дурак никогда» – если мы терпим неудачу, приходится пробовать другие средства и другие пути.
«Подмечай главную возможность» – преимущество «знатока» в том, что он всегда начеку и лучше ориентируется в ситуации.
«Желаемое мы охотно принимаем за действительное» – наш план даёт лишь один общий контур решения. Надо убедиться, что детали соответствуют ему, поэтому мы должны внимательно рассмотреть каждую из них одну за другой.
Приложение 5.
Пример 1. Определить массы исходных растворов с массовыми долями серной кислоты 7,5 % и 60 %, если при их смешивании образовался раствор массой 350 г с массовой долей кислоты 15 %.
Решение
60 7,5 m1
15
7,5 45 m2 = 350 – m1
m1 = 50 г и m2 = 300 г
Ответ: 50 г 60% раствора и 300 г 7,5% раствора.
Задачи для закрепления
В каких массовых соотношениях надо смешать 20% и 5% -ные растворы одного вещества, чтобы получить 10% раствор?
Решение.
20 (10 -5) = 5 вес.ч.(г.)
10
5 (20 -10) = 10 вес.ч.(г.)
Числа 5 и 10 показывают, в каком массовом отношении надо взять растворы. Следовательно, для приготовления 10% раствора нужно смешать 5 г 20% раствора с 10 г 5% раствора в соотношении 1:2. Это соотношение сохранится для данных растворов независимо от того, какое весовое количество 10 % – го раствора нужно приготовить.
2. Какой объём воды надо прибавить к раствору серной кислоты объёмом 100 мл с массовой долей 20 % и плотностью 1,14 г/мл, чтобы получить 5 % раствор?
Решение.
Найдём массу исходного раствора кислоты
m (раствора H2SO4) = ρV = 1,14 г/мл · 100 мл = 114 г
В соответствии с правилом смещения
20 5 114
5
0 15 m(H2O) -?
Для приготовления 5 % -го раствора необходимо к 5 г 20 % -ной кислоты прибавить 15 г воды, т. е в соотношении 1:3.
е в соотношении 1:3.
m (H2O) = г
V (H2O) = m (H2O) / ρ (H2O) = 342 г/ 1 г/мл = 342 мл.
Ответ: 342 мл.
3. Определите массу раствора 9%-ого столового уксуса, который получают из 90 г 80 % уксусной кислоты?
Решение:
80 9 90 г
9
0 71 m(H2O) -?
m (Н2О) = 710 г.
Масса образовавшегося столового уксуса: 710 + 90 = 800 г.
Приложение 6.
1. Посмотреть влево, затем вправо, вверх и вниз, не поворачивая головы (4 раза).
2. Посмотреть вправо вниз, влево вверх, влево вниз, вправо вверх (4 раза).
3. Сделать круговые движения глазным яблоком слева направо, и затем справа налево (каждое движение по 4 раза). Те же самые движения проделать при закрытых глазах.
4. Широко открыть глаза и посмотреть вверх, сосчитать до 10 и опустить их. При выполнении упражнения следует обратить внимание на то, чтобы не морщить лоб. Это можно контролировать, положив на лоб руку. Упражнение следует повторить 8 раз.
Широко открыть глаза и посмотреть вверх, сосчитать до 10 и опустить их. При выполнении упражнения следует обратить внимание на то, чтобы не морщить лоб. Это можно контролировать, положив на лоб руку. Упражнение следует повторить 8 раз.
5. Открыть глаза и посмотреть вверх и влево, сосчитать до 10, затем опустить веки. То же самое проделать, смотря вверх и вправо. Упражнения повторить по 5 раз в каждую сторону
Приложение 7.
Опыт 1. Возьмите пробирку и поместите в неё магниевую стружку и прилейте 1 мл. соляной кислоты. Что наблюдаете? Напишите уравнение реакции.
Опыт 2. В две пробирки налейте 2 мл. раствора карбоната натрия. Затем в одну пробирку прилейте раствор соляной кислоты, а в другую – хлорида магния. Что наблюдаете? Напишите уравнение реакции.
Опыт 3. Возьмите пробирку и налейте в неё 1мл. «купоросной водки», затем добавьте 1-2 мл. раствора хлорида бария. Что наблюдаете? Напишите уравнение реакции.
«купоросной водки», затем добавьте 1-2 мл. раствора хлорида бария. Что наблюдаете? Напишите уравнение реакции.
«Купоросная водка» – серная кислота (М.В. Ломоносов)
Учитель: Как найти массу раствора в этих случаях после реакции?
Учащиеся делают вывод:
mр-ра полученного = mреагента + mр-ра 1– mосадок (газ)
mр-ра полученного = mр-ра1 + mр-ра 2– mосадок (газ)
Приложение 8.
Задачи для закрепления (карточки с заданиями)
1**) Какую массу AgNO3 необходимо добавить к 100 г 5,5 М раствора HCl (ρ = 1,1 г/мл), чтобы получить раствор, в котором массовая доля соляной кислоты равна 10 %? (Ответ: 34 г AgNO3)
2*) Рассчитайте массовые доли веществ в растворе, образовавшемся при действии 25 мл 20%-ной соляной кислоты (плотность 1,1 г/мл) на 4г сульфида железа (II). (Ответ: 19,3 % FeCl2, 7,3 % HCl.)
(Ответ: 19,3 % FeCl2, 7,3 % HCl.)
Приложение 9.
Определить % содержание ядовитых веществ: табачного дегтя, синильной кислоты и оксида углерода, если никотин составляет 2% от всего табачного дыма, а синильная кислота 1\2 часть никотина, а табачного дегтя в 7, 5 раз больше чем никотина. Оксид углерода составляет 3\5 от табачного дегтя». Для решения задачи предлагаю воспользоваться таблицей, в которой указано содержание веществ в дыме 1 сигареты.
Состав дыма сигареты:
Табачный дым – аэрозоль из газов, жидкостей и твердых веществ.
Вещества
Количество
Никотин
3 * 10-3 г
Фенол
120 * 10-6 г
Цианистый водород
400 * 10-6 г
Оксид углерода
10 * 10-3 г
Формальдегид
100 * 10-6 г
Бензол
40 * 10-6 г
Приложение 10.
Задание на дом. 1) Какой объём воды надо добавить к 100 г 70 %-ного раствора уксусной кислоты, чтобы получить 9 %-ный раствор? (678 мл)
2) Какую массу хлорида натрия следует добавить к 200 г 10 %-ного раствора хлорида натрия, чтобы получить 25 %- ный раствор? (40 г)
Приложение 11.
На уроке было комфортно и все понятно
На уроке немного затруднялся не все понятно
На уроке было трудно, ничего не понял.
Подготовка школьников к ЕГЭ и ОГЭ (Справочник по математике – Алгебра
Концентрация (процентное содержание) вещества
Рассмотрим смесь (сплав, раствор) из нескольких веществ.
Определение 1. Концентрацией (процентной концентрацией, процентным содержанием) вещества A в смеси (сплаве, растворе) называют число процентов pA , выраженное формулой
Концентрацией (процентной концентрацией, процентным содержанием) вещества A в смеси (сплаве, растворе) называют число процентов pA , выраженное формулой
| (1) |
где MA – масса вещества A в смеси (сплаве, растворе), а M – масса всей смеси (сплава, раствора).
Часто в задачах на растворы указаны не массы входящих в них веществ, а их объёмы. В этом случае вместо формулы (1) для концентрации (процентной концентрации, процентного содержания) вещества A в растворе используется формула
| (2) |
где VA , – объём вещества А в растворе, а V – объем всего раствора.
Определение 2. Формулу (1) называют формулой для массовой концентрации вещества A в смеси (сплаве, растворе), а формулу (2) – формулой для объёмной концентрации вещества A в растворе.
При решении задач считается, что при слиянии нескольких растворов (сплавов) масса и объем полученной смеси равны сумме масс и объемов смешиваемых компонентов соответственно.
Приёмы, используемые при решении задач на массовые концентрации смесей (сплавов, растворов), а также при решении задач на объёмные концентрации растворов, являются общими, что мы и увидим при решении следующих типовых задач
Примеры решения задач на смеси, сплавы и растворы
Задача 1. Смешали 16 литров 30% раствора кислоты в воде с 9 литрами 80% раствора кислоты в воде. Найти концентрацию полученного раствора кислоты в воде.
Решение. В 16 литрах 30% раствора кислоты в воде содержится
литров кислоты. В 9 литрах 80% раствора кислоты в воде содержится
В 9 литрах 80% раствора кислоты в воде содержится
литров кислоты. Поэтому в смеси этих растворов содержится
4,8 + 7,2 = 12
литров кислоты. Поскольку полученный в результате смешивания раствор имеет объем
16 + 9 = 25
литров, то концентрация кислоты в этом растворе равна
Ответ. 48% .
Задача 2. Имеется 27 килограммов смеси цемента с песком с 40% содержанием цемента. Сколько килограммов песка нужно добавить в эту смесь, чтобы процентное содержание цемента в ней стало 30% ?
Решение. Обозначим буквой x количество килограммов песка, которые нужно добавить в смесь. Поскольку в 27 килограммах смеси с 40% содержанием цемента содержится
килограммов цемента, а после добавления x килограммов песка масса смеси станет равной
27 + x
килограммов, то после добавления песка процентное содержание цемента в получившейся смеси будет составлять
По условию задачи
Следовательно,
Ответ. 9 килограммов.
9 килограммов.
Задача 3. Смешав 8% и 13% растворы соли и добавив 200 миллилитров 5% раствора соли, получили 7% раствор соли. Если бы вместо 200 миллилитров 5% раствора соли добавили 300 миллилитров 17% раствора соли, то получили бы 15% раствор соли. Сколько миллилитров 8% и 13% растворов соли использовали для получения раствора?
Решение. Обозначив буквой x массу 8% раствора соли, а буквой y – массу 13% раствора соли, рассмотрим рисунки 1 и 2.
| x мл | |
| + | y мл |
| + | 200 мл |
| = | (x + y + 200) мл |
Рис. 1
1
На рисунке 1 изображена структура раствора, полученного при смешении x миллилитров 8% раствора соли, y миллилитров 13% раствора соли и 200 миллилитров 9% раствора соли. Объем этого раствора равен (x + y + 200) миллилитров.
| x мл | |
| + | y мл |
| + | 300 мл |
| = | (x + y + 300) мл |
Рис.2
На рисунке 2 изображена структура раствора, полученного при смешении x миллилитров 8% раствора соли, y миллилитров 13% раствора соли и 300 миллилитров 17% раствора соли. Объем этого раствора равен (x + y + 300) миллилитров.
Объем этого раствора равен (x + y + 300) миллилитров.
Записывая баланс соли в растворе, структура которого изображена на рисунке 1, а также баланс соли в растворе, структура которого изображена на рисунке 2, получим систему из двух уравнений с двумя неизвестными x и y :
Раскрывая скобки и приводя подобные члены, получаем
Ответ. Смешали 70 мл 8% раствора и 55 мл 13% раствора.
Задача 4. Имеются два сплава меди с цинком. Если сплавить 1 килограмм первого сплава с 2 килограммами второго сплава, то получится сплав с 50% содержанием меди. Если же сплавить 4 килограмма первого сплава с 1 килограммом второго сплава, то получится сплав с 36% содержанием меди. Найти процентное содержание меди в первом и во втором сплавах.
Решение. Обозначим x % и y % – процентные содержания меди в первом и во втором сплавах соответственно и рассмотрим рисунки 3 и 4.
| 1 кг | 2 кг | |||||||||
| Медь x % | Цинк | + | Медь y % | Цинк | ||||||
| ||||||||||
Рис. 3
На рисунке 3 изображена структура сплава, состоящего из 1 килограмма первого сплава и 2 килограммов второго сплава. Масса этого сплава – 3 килограмма.
| 4 кг | 1 кг | |||||||||
| Медь x % | Цинк | + | Медь y % | Цинк | ||||||
| ||||||||||
Рис. 4
4
На рисунке 4 изображена структура сплава, состоящего из 4 килограммов первого сплава и 1 килограмма второго сплава. Масса этого сплава – 5 килограммов.
Записывая баланс меди в сплаве, структура которого изображена на рисунке 3, а также баланс меди в сплаве, структура которого изображена на рисунке 4, получим систему из двух уравнений с двумя неизвестными x и y :
Далее получаем
Ответ. В первом сплаве содержание меди 30% , во втором сплаве содержание меди 60% .
Желающие ознакомиться с примерами решения различных задач по теме «Проценты» и применением процентов в экономике и финансовой математике могут посмотреть раздел нашего справочника «Проценты. Решение задач на проценты», «Простые и сложные проценты. Предоставление кредитов на основе процентной ставки», а также наши учебные пособия «Задачи на проценты» и «Финансовая математика».
Приемы, используемые для решения задач на выполнение работ, представлены в разделе нашего справочника «Задачи на выполнение работ».
С примерами решения задач на движение можно ознакомиться в разделе нашего справочника «Задачи на движение».
С методами решения систем уравнений можно ознакомиться в разделах нашего справочника «Системы линейных уравнений», «Системы с нелинейными уравнениями» и в нашем учебном пособии «Системы уравнений».
На нашем сайте можно также ознакомиться нашими учебными материалами для подготовки к ЕГЭ и ОГЭ по математике.
С демонстрационными вариантами ЕГЭ и ОГЭ, опубликованными на официальном информационном портале Единого Государственного Экзамена, можно ознакомиться на специальной страничке нашего сайта.
Методика решения задач по химии на изменение концентрации раствора
В задачах, связанных с добавлением к раствору определенного количества растворителя или растворенного вещества, необходимо сначала рассчитать массу растворенного вещества в исходном растворе, а затем использовать ее для дальнейших вычислений. Условие каждой задачи для большей наглядности лучше изобразить в виде рисунка.
Условие каждой задачи для большей наглядности лучше изобразить в виде рисунка.
Задача 1.
К 180,0 г 8% -ного раствора хлорида натрия добавили 20 г NaС1. Массовая доля хлорида натрия в образовавшемся растворе равна ….% (запишите число с точностью до десятых).
Дано:
масса исходного раствора: mисх.р-ра = 180 г;
массовая доля NaС1 в исходном растворе: (NaС1)в исх р-ре = 8%;
масса добавленной соли NaС1: m(NaСl)добавл = 20 г.
Найти:
массовую долю соли в конечном растворе: (NaС1)в кон/ р-ре
Решение:
Условие задачи удобно отобразить в виде рисунка:
1. Находим массу NaСl в исходном растворе:
2. Масса NaС1 в конечном растворе представляет собой сумму:
m(NаС1)в кон.р.ре = m(NаС1)в исх. р.ре + m(NаС1)добавл. = 14,4+ 20 = 34,4 г.
3. Массу добавленной соли учитываем и в массе конечного раствора:
Массу добавленной соли учитываем и в массе конечного раствора:
mкон. р-ра = mисх. р-ра + m(NаС1)добавл. = 180 + 20 = 200 г.
4. Полученные данные позволяют определить массовую долю в конечном растворе:
Ответ: (NaС1)в исх р-ре = 17,2%.
Задача, в которой добавляется некоторое количество воды к порции раствора известной концентрации, решается по тому же алгоритму.
В задаче на смешение двух растворов требуется проводить немного большее количество расчетов. В этом случае необходимо вычислить массу растворенного вещества в каждом из
исходных растворов.
Задача 2.
Смешали 200 г 20%-ного раствора NаОН с 218 мл 10%-ного раствора того же вещества (p = 1,11 г/мл). Массовая доля щелочи в полученном растворе. …% (Запишите число с точностью до десятых).
Дано:
масса первого раствора NаОН: m1 исх р-ра = 200 г;
массовая доля NаОН в первом р-ре: со(МаОН) в 1 исх р-ре = 20% ;
объем второго раствора NаОН: V2исх. р-ра = 218 мл;
р-ра = 218 мл;
массовая доля NаОН во втором р-ре: (NаОН) во 2 исх. р-ре = 10% ;
плотность второго исходного раствора: р2 исх. р.р=1,11 г/мл.
Найти: массовую долю NаОН в конечном р-ре: (NаОН)в кон р-ре
Решение:
Условие задачи удобно отобразить в виде рисунка:
При решении данной задачи необходимо определить массу NаОН в каждом из исходных растворов. Далее найти суммарную массу конечного раствора и массу NаОН в нем. После этого вычисляем искомую величину.
Схематично алгоритм решения можно отразить так:
1. Находим массу NаОН в первом исходном растворе:
2. Находим массу второго исходного раствора:
m2 исх. р-ра = V2 исх. р-ра. p 2 исх. р-ра = 218 . 1,11 = 242 г.
3. Находим массу NаОН во втором исходном растворе:
m(NaOH)в кон. р-ре = m(NaOH)в 1 исх. р-ре + m(NaOH)во 2 исх. р-ре = 40 + 24,2 = 64,2 г.
р-ре + m(NaOH)во 2 исх. р-ре = 40 + 24,2 = 64,2 г.
5. Находим массу конечного раствора:
mкон. р-ра = m1 исх. р-ра + m2 исх. р-ра = 200 + 242 = 442 г.
6. Находим массовую долю NаОН в конечном растворе:
Округляем полученное значение до десятых.
Ответ: (NaOH)в кон.р-ре = 14,5%.
В задаче на выпаривание масса раствора уменьшается обычно за счет удаления растворителя. При этом масса растворенного вещества остается прежней, что приводит к увеличению концентрации.
Задача 3.
Определите массу воды, которую необходимо выпарить из 2 л 10% раствора NаОН (р = 1,11 г/мл) для повышения массовой доли NаОН в нем до 15% . Ответ: … г (запишите число с точностью до целых).
Дано:
объем исходного раствора: Vисх. р-ра = 2 л;
плотность исходного раствора: рисх р-ра =1,11 г/мл;
массовая доля NаОН в исходном р-ре: (NаОН)в исх р.ре = 10% ;
массовая доля NаОН в конечном р-ре:(NаОН)в кон р-ре = 15%
Найти: массу испарившейся воды: m(Н2О)испарили = ?
Решение:
При выпаривании водного раствора NаОН улетучиваться будет только вода. Масса NаОН будет одинаковой как в исходном, так и в конечном растворе.
Схематично алгоритм решения можно представить следующим образом:
1. Найдем массу исходного раствора:
m исх. р-ра = V исх. р-ра. рисх. р-ра
V исх. р-ра = 2 л = 2000 мл
mисх. р-ра = 2000 . 1,11 = 2220 г.
2. Найдем массу NаОН в исходном растворе:
3. Определим массу конечного раствора:
4. Уменьшение массы раствора произошло только из-за испарения воды, следовательно, по разнице масс исходного и конечного растворов можно найти массу улетучившейся воды:
m(Н2О)испарилось = mисх р-ра – mкон. р-ра = 2220 – 1480 = 740 г.
Ответ: m(Н2О)испарилось = 740 г.
В условиях некоторых задач предполагается выведение из раствора в виде газа легколетучего растворенного вещества (например МН3; НС1; Н2S или растворенного в воде органического вещества). Для решения таких задач необходимо считать неизменной массу растворителя (воды).
Задача 4.
При нагревании 200 г 25%-ного раствора аммиака 20 г этого вещества улетучилось. Массовая доля аммиака в растворе после нагревания равна… % (запишите число с точностью до десятых).
Дано:
масса исходного раствора: mисх р-ра = 200 г;
массовая доля NН3 в исходном растворе: (NН3)в исх. р-ре = 25% ;
масса улетучившегося аммиака: m(NН3)улетучилось = 20 г.
Найти: массовую долю NH3 в конечном р-ре: (NН3)в кон. р ре =?
Решение:
Схематично алгоритм решения можно представить следующим образом:
1. Находим массу NН3 в исходном растворе:
2. Находим массу NН3 в конечном растворе:
m(NH3) в кон. р-ре = m(NH3) в исх. р-ре – m(NН3)улетело = 50 – 20 = 30 г.
Находим массу конечного раствора1:
mкон р-ра = mисх р-ра – m(NН3)улетучилось = 200 – 20 = 180 г.
4. Находим массовую долю аммиака в конечном растворе:
Округляем значение, согласно требованию условия, и получаем: (NН3)в кон. р-ре = 16,7% .
Ответ: (NН3)в кон. р-ре = 16,7% .
Комментарии:
1При решении данной задачи учащиеся часто забывают найти массу
конечного раствора. После определения массы оставшегося аммиака они для нахождения массовой доли NH3 в конечном растворе ошибочно делят массу оставшегося NH3 на массу исходного раствора.
Избежать этой распространенной ошибки помогают комментарии каждой записанной величины. Например, следует записывать mкон. р-ра, а не mр-ра ; m(NH3)в кон. р-ре, а не m(NH3).
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
Задачи по химии, решение задач по химии
На практике мы иногда сталкиваемся с задачами, связанными с определением количественной оценкой веществ, вступающих в химические реакции, оценкой количества получаемых в этой реакции продуктов, интересующих нас веществ. Хозяйкам наверняка часто приходится определять процентное содержание того или иного вещества в растворе и сколько того или другого вещества при этом надо взять. Как правильно рассчитать количество вещества, которое бы нейтрализовало или обезвредило другое вещество? Сколько газа выделится, если к раствору лимонной кислоты добавить соду? Как приготовить, например, 5%-й раствор марганцовки, а также много других задач, встречаемых в бытовой практике.
Цель статьи Решение задач по химии – показать, как можно легко решать подобные задачи, не прибегая к сложным химическим расчётам, а применяя лишь общие знания из курса математики и немного общих знаний из химии.
Что нужно знать для решения задач по химии
Кстати, что Вам необходимо знать для решения простых задач по химии:
M – молярная масса (молекулярная масса вещества) – эту величину для простых веществ берут из таблицы Менделеева (число, записанное в правом нижнем углу каждого элемента, например, у углерода M(C)=12,01115 г/моль, при этом дробную часть обычно отбрасывают). Если это газ (например, водород), то M(H2) =1 x 2 =2 г/моль), и так для всех элементов – газов.
В основном мы имеем дело со сложными веществами, молярная масса которых равна сумме молярных масс входящих в него простых элементов, например, углекислый газ (CO2): M(CO2) = 12+16×2 = 44 г/моль.
W – концентрация вещества – это сколько вещества по массе содержится в 100 г раствора, например 5% раствор содержит 5 г сухого вещества и 95 г растворителя.
Ну что ж, рассмотрим наиболее широко распространённую задачку о том, как определить процентное содержание вещества в растворе и сколько нужно взять при этом вещества и самого раствора.
Задача по химии 1Имеется 200 мл 25% раствора уксусной кислоты (CH3 -COOH). Сколько нужно взять воды, чтобы из этого раствора приготовить раствор 5% уксусной кислоты?
Решение:
(М раствора) = (М растворенного вещества) + (М растворителя)1) По формуле W1 = (M вещества) / (М раствора) определим массу растворенного вещества:
(M вещества) = W1 x (М раствора), т.е. 0,25 x 200 = 50 г.
2) Чтобы получить раствор меньшей концентрации, нужно его разбавить водой, при этом масса растворенного в нём вещества не изменется. Поэтому запишем такую же формулу для нового раствора:
W2 = (M вещества) / ( М растворенного вещества + М растворителя ). Подставив числа, получим:
0,05 = 50 / (М растворителя + 50), откуда находим, что М растворителя = 950 г.
3) Итак, масса нового раствора будет равна (М растворенного вещества) + (М растворителя) = 50 + 950 = 1000 г (1л). Зная массу имевшегося раствора (200 г) и массу нового раствора (1000 г) определяем, что выду нужно добавить 800 г. Ответ: 800 г.
Иногда требуется решить обратную задачу:
Имеется раствор 250 г с концентрацией 5%. Требуется определить, сколько необходимо взять растворимого вещества, чтобы повысить концентрацию раствора до 25%?Решение:
1) Воспользуемся формулой W1 = (M вещества) / (М раствора) и определим массу рстворимого вещества в имеющемся 5% растворе и массу воды в этом растворе:
(M вещества) = 0,05 x 250 = 12,5 г., значит масса (М растворителя) = (М раствора) – (M вещества) = 250 – 12,5 = 237,5 г.
2) Запишем формулу для нового раствора:
W2 = (M нового вещества) / ( М нового вещества + М растворителя ). Подставив числа, получим:
0,25 = (M нового вещества) / ( М нового вещества + 237,5 ), откуда М нового вещества = 79,16 г.
3) Итак, в ранее имевшемся 5% рстворе содержалось 12,5 г растворенного вещества, а в новом растворе его содержится 79,16 г., значит для получения нового раствора нужно добавить 79,16- 12,5 г = 66,66 г вещества. Ответ: 66,66 г.
Здесь вы можете рассчитать свои растворы, их концентрации для своих практических целей, проверить себя!
Задача по химии 2
Задача на определение количества продуктов реакции или реагентов.
Допустим такое условие. Нам нужно обезвредить кислую среду. Вы случайно разлили 200 мл соляной кислоты (HCl), а под руками оказалась стиральная сода (Na2CO3) (или второе её название – кальцинированная сода). Так вот: сколько нужно взять стиральной соды, чтобы обезвредить 200 мл соляной кислоты!?
Решение:
Запишем уравнение химической реакции соляной кислоты со стиральной содой:
2HCl + Na2CO3 => 2NaCl + H2O + CO2.
Из начального курса химии мы знаем, что при реакции кислоты с солью образуется другая кислота (более слабая) и другая соль. В нашем случае образуется угольная кислота, которая сразу же распадается на воду и углекислый газ, и раствор поваренной соли.
Теперь по таблице Менделеева нужно определить молекулярные массы веществ соляной кислоты (2 х HCl) и стиральной соды (Na2CO3). Молекулярная масса с ложного вещества считается как сумма масс входящих в него веществ с учётом количества атомов в молекуле и числа молекул!
Например молекулярная масса 2-x молекул HCl: Mr (HCl) = 2 x (1+ 35,5)= 73 г/моль;
молекулярная масса 1 молекула Na2CO3: Mr (Na2CO3) = 2 х 23 + 12 + 16 х 3)= 106 г/моль
Теперь осталось составить пропорцию:
73 мл (HCl) вступают в реакцию с 106 г Na2CO3
200 мл (HCl) вступают в реакцию с X г Na2CO3, откуда находим, что X = 200 х 106 / 73 = 290 г.
Так вот, чтобы обезвредить 73 мл разлитой кислоты (концентрированной) нужно её смешать с 290 г стиральной соды. Всё!
Такая химическая задачка может немного усложниться, если учитывать концентрацию кислоты. В этом случае, мы должны посчитать, сколько чистого вещества находится в растворе (как в предыдущей задаче 1), а затем составить пропорцию с найденным количеством соляной кислоты. Но в любом случае если даже кислота будет иметь меньшую концентрацию, то наше решение с избытком удовлетворит решение, так как, в таком случае сода будет взята в избытке!
Задача по химии 3Нужно рассчитать, сколько % каждого простого вещества находится в сложном веществе – CaSO4 – гипс.
Решение:
Берём таблицу Менделеева и находим общую относительную молекулярную массу CaSO4: (помним, что общая молекулярная сложного вещества равна сумме молекулярных масс входящих в него простых веществ – выбираем из таблицы)
M (CaSO4) = 40 + 32 +16×4 = 136 г/моль
Теперь рассчитываем долю каждого элемента в отдельности:
40:136 =0,29 (29%)
32:136 = 0,24 (24%)
Процентное содержание кислорода находим как оставшуюся часть задачи: (100%-29%-24% = 47%). Вот и всё.
Доводилось ли Вам читать на упаковках продуктов срок годности продуктов! Наверняка! Там стоит дата изготовления и срок хранения при определённой температуре. Но не всегда удаётся хранить продукты при рекомендуемой температуре. Так вот! Можно определить срок хранения продукта, зная условия его рекомендуемого хранения. Итак, задача по химии:
Имеется торт с кремом, срок хранения которого 4 дня при температуре +50C. Вопрос: как долго этот торт можно хранить при температуре +250C?
Решение:
Прежде всего, при решении таких задач (задача по химии на скорость химической реакции) существует правило:
при повышении температуры на каждые 10 0C скорость химической реакции увеличивается в 2…4 раза
откуда следует формула
Vt1 – скорость реакции (рекомендуемая)
Vt2 – скорость реакции при новых условиях
Y – коэффициент равный 2, 3 или 4 (пр решении задач обычно принимается 3)
t1 – температура хранения (рекомендуемая, указанная на упаковке)
t2 – температура хранения при новых условиях
Итак, в нашем случае: t1 = +50C
; t2 = +250C; коэффициент Y = 3
тогда Vt2 / Vt1 = Y(25 – 5) / 10C = 31,5C = 32 = 9 раз.
Итак, если хранить торт при температуре +250C, вместо +50C, то он может храниться по времени в 9 раз меньше, а именно: 4 суток = 96 часов, тогда 96 / 9 = 1,5 часа. Вот так!
Задачи по химии | Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Задачи по химии и их видео-объяснения
Предлагаем вашему вниманию задачи по химии по всем раздел школьного курса с подробными видео-объяснениями к каждой задаче. Задачи разделены по темам и уровню сложности. Листайте вниз, чтобы выбрать подходящий раздел. Если же вы только начали учиться, как решать задачи по химии, то рекомендуем начинать решать все задачи в том порядке, как они расположены ниже! Пригодится всем, кто учится в школе, а также планирует сдавать ЕГЭ или ЦТ по химии.
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
Задачи по химии базового уровня
1. Простейшие химические расчёты
2. Расчёты по химическим уравнениям
3. Закон постоянства состава
4. Вывод формул
5. Использование системы уравнений
6. Выход продукта реакции. Примеси. Потери
7. Стехиометрические цепочки
8. Избыток реагирующих веществ
9. Растворы
10. Образование кислых и средних солей
11. Разница масс и объёмов (задачи на пластинку и др.)
12. Электролиз
13. Скорость реакции
14. Равновесие. Тепловой эффект
15. Молярная масса смеси газов
Задачи по химии высокого и повышенного уровня
16. Задачи на «атомистику» (соотношение атомов, ионов и др. частиц, массовая доля элемента в смеси и т.п.)
17. Задачи с использованием нескольких приёмов решения, включая использование математических уравнений
- Hа газовые смеси
- На нахождение молярной массы неизвестного органического или неорганического вещества, вывод формул. Часть 1
- На нахождение молярной массы неизвестного органического или неорганического вещества, вывод формул. Часть 2
- На смеси веществ
- На растворы, электролитическую диссоциацию, растворимость, кристаллогидраты. Часть 1
- На растворы, электролитическую диссоциацию, растворимость, кристаллогидраты. Часть 2
- На термохимические уравнения и тепловой эффект
- На скорость реакции
- Комплексные задачи по органической химии
- Комплексные задачи по неорганической химии
- На разницу масс, объёмов (дельта m, пластинки и т.д.)
18. Задачи ЕГЭ по химии всех лет
19. Задачи и тесты в виде задач из всех этапов ЦТ, РТ и ДРТ
20. Задачи без видео-объяснения (с ответами):
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Химические решения практических задач | Carolina.com
1. Молярные растворы
а. Опишите, как вы приготовили бы 1 л из 1 M раствор натрия хлорида. Вес хлорида натрия в граммах формулы составляет 58,44. г / моль.
Ответ: Сделать 1 М раствор натрия хлорида, растворите 58,44 г хлорида натрия в 500 мл воды в 1000 мл мерная колба. Когда все твердое вещество растворено и раствор находится при комнатной температуре. температуры, доведите до отметки и несколько раз переверните колбу для перемешивания.
г. Опишите, как вы приготовили бы 1 л из 2 M раствор уксусной кислоты. Граммовая формула веса уксусной кислоты составляет 60,05 г / моль, плотность 1.049 г / мл.
Ответ: Чтобы приготовить 2 М раствор уксусной кислоты, растворите 120,1 г уксусной кислоты в 500 мл дистиллированной или деионизированной воды в емкости объемом 1000 мл. мерная колба. Поскольку уксусная кислота является жидкостью, ее также можно измерить объем. Разделите массу кислоты на ее плотность (1,049 г / мл), чтобы определить объем (114 мл).Для приготовления раствора используйте 120,1 г или 114 мл уксусной кислоты. Осторожно покрутите колбу, чтобы перемешать раствор. Как только раствор будет в комнате температуры, доведите до отметки и несколько раз переверните колбу для перемешивания.
2. Процентные решения
а. Опишите, как бы вы приготовили 100 г 0,5% раствора. фенолфталеин по массе.
Ответ: Поскольку растворенное вещество (фенолфталеин) является твердое вещество, раствор в процентах по массе. Массовый процент означает количество граммов растворенного вещества на 100 г раствора.
массовый процент = (масса растворенного вещества / масса раствора) × 100%
масса растворенного вещества = массовый процент × масса раствора / 100%
= 0,5% x 100 г / 100%
= 0,5 г
Так как общая масса раствора равна 100 г, оставшиеся 99,5 г раствор – вода. Для приготовления раствора растворите 0,5 г фенолфталеина. в 99,5 г дистиллированной или деионизированной воды.
г. Опишите, как вы приготовили бы 100 мл раствор, содержащий 22% уксусную кислоту по объему.
Ответ: Объемный процент означает количество миллилитров растворенного вещества на 100 мл раствора. Разбавьте 22 мл уксусной кислоты дистиллированная или деионизированная вода для приготовления 100 мл раствора.
3. Разведения
а. Опишите, как приготовить 1,0 л 0,10 М раствора серной кислоты. кислота из 3,0 М раствора серной кислоты.
Ответ: Рассчитайте объем 3,0 М серной кислоты. кислота, необходимая для приготовления разведения.
M реагент × V реагент = M разбавление × V разбавление
3.0 M × V реагент = 0,10 M × 1,0 л
V реактив = 0,033 л = 33 мл
Медленно добавьте 33 мл 3,0 М серной кислоты в мерную колбу на 1000 мл. наполовину заполните дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать. Один раз раствор комнатной температуры, разбавить водой до метки и перевернуть колбу несколько раз перемешать.
б. Опишите, как бы вы приготовили 500 мл 0,25 М раствор гидроксида натрия из 5.0 М раствор гидроксида натрия.
Ответ: Рассчитать объем 5,0 М гидроксида натрия, необходимого для приготовления разведения.
M реагент × V реагент = M разбавление × V разбавление
5,0 M × V реактив = 0,25 M × 0,500 л
V реагент = 0.025 л = 25 мл
Медленно добавьте 25 мл 5,0 М гидроксида натрия в мерную колбу на 500 мл. наполовину заполните дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать. Один раз раствор комнатной температуры, разбавить водой до метки и перевернуть колбу несколько раз перемешать.
4. Особые случаи
а. Опишите, как приготовить 500 мл 1,0 М раствора калия. хлорид с чистотой 93,0%. Вес хлорида калия в граммах формулы 74.56 г / моль.
Ответ: Рассчитайте массу нечистого хлорида калия. нужный.
масса нечистого хлорида калия = M чистый × V чистый × грамм формулы вес / процент чистота
= 1,0 M × 0,500 L × 74,56 г / моль
0,930= 40 г
Медленно добавьте 40 г 93% хлорида калия в мерную емкость 500 мл. колбу наполовину заполните дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать.Когда все твердое вещество растворится и раствор достигнет комнатной температуры, разбавьте до отметки и несколько раз переверните колбу для перемешивания.
г. Опишите, как бы вы готовились 500 мл 1,0 М раствора фосфорной кислоты из 85,0% фосфорной кислоты, т.е. чистый. Вес фосфорной кислоты по формуле в граммах составляет 98,00 г / моль, а плотность 85,0% фосфорной кислоты составляет 1,685 г / мл.
Ответ: Рассчитать объем 85.Требуется 0% фосфорная кислота.
объем нечистой фосфорной кислоты = M чистый × V чистый × грамм формулы вес / (проценты чистота x плотность) = (1,0 M × 0,500 L x 98,00 г / моль) ÷ 1,685 г / мл
0,850= 34 мл
Медленно добавьте 34 мл 85,0% фосфорной кислоты в мерную емкость 500 мл. колбу наполовину заполните дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать. Как только раствор достигнет комнатной температуры, разбавьте водой до отметки и переверните колбу несколько раз, чтобы перемешать.
5. Нормальные решения
Опишите, как приготовить 1000 мл 1,0 н. Раствора магния. гидроксид. Граммовая формула веса гидроксида магния составляет 58,33 г / моль.
Ответ: Гидроксид магния. содержит две гидроксильные группы. Половина моля гидроксида магния, следовательно, принимает один моль протонов. Чтобы приготовить 1,0 н раствор гидроксида магния, медленно добавьте 29 г гидроксида магния в 500-миллилитровую мерную колбу, заполненную наполовину. с дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать.Когда все твердое вещество растворяется и раствор при комнатной температуре доводится до метки. и несколько раз переверните колбу для перемешивания.
6.1.1: Практические задачи – концентрация решения
ПРОБЛЕМА \ (\ PageIndex {1} \)
Объясните, что меняется и что остается прежним, когда 1,00 л раствора NaCl разбавляется до 1,80 л.
- Ответ
Количество молей всегда остается неизменным в разбавлении.
Концентрация и объемы изменяются при разбавлении.
ПРОБЛЕМА \ (\ PageIndex {2} \)
Что это значит, когда мы говорим, что образец объемом 200 мл и образец раствора соли объемом 400 мл имеют одинаковую молярность? В чем идентичность двух образцов? Чем отличаются эти два образца?
- Ответ
Два образца содержат одинаковое соотношение молей соли к литрам раствора, но имеют разное фактическое количество молей.
ПРОБЛЕМА \ (\ PageIndex {3} \)
Определите молярность для каждого из следующих растворов:
- 0,444 моль CoCl 2 в 0,654 л раствора
- 98,0 г фосфорной кислоты, H 3 PO 4 , в 1,00 л раствора
- 0,2074 г гидроксида кальция, Ca (OH) 2 , в 40,00 мл раствора
- 10,5 кг Na 2 SO 4 · 10H 2 O в 18.60 л раствора
- 7,0 × 10 −3 моль I 2 в 100,0 мл раствора
- 1,8 × 10 4 мг HCl в 0,075 л раствора
- Ответьте на
0,679 М
- Ответ б
1,00 м
- Ответ c
0,06998 М
- Ответ d
1.75 М
- Ответ e
0,070 М
- Ответ на
6,6 М
- Щелкните здесь, чтобы просмотреть видео решения
ПРОБЛЕМА \ (\ PageIndex {4} \)
Определите молярность каждого из следующих растворов:
- 1.457 моль KCl в 1.500 л раствора
- 0,515 г H 2 SO 4 в 1,00 л раствора
- 20,54 г Al (NO 3 ) 3 в 1575 мл раствора
- 2,76 кг CuSO 4 · 5H 2 O в 1,45 л раствора
- 0,005653 моль Br 2 в 10,00 мл раствора
- 0,000889 г глицина, C 2 H 5 NO 2 , в 1,05 мл раствора
- Ответьте на
0.9713 M
- Ответ б
5,25 × 10 -3 M
- Ответ c
6,122 × 10 -2 M
- Ответ d
7,62 м
- Ответ e
0,5653 М
- Ответ на
1.13 × 10 -2 М
ПРОБЛЕМА \ (\ PageIndex {5} \)
Рассчитайте количество молей и массу растворенного вещества в каждом из следующих растворов:
(а) 2,00 л 18,5 M H 2 SO 4 , концентрированная серная кислота
(б) 100,0 мл 3,8 × 10 −5 M NaCN, минимальная летальная концентрация цианида натрия в сыворотка крови
(c) 5,50 л 13,3 M H 2 CO, формальдегид, используемый для «фиксации» образцов ткани
(d) 325 мл 1.8 × 10 −6 M FeSO 4 , минимальная концентрация сульфата железа, определяемая по вкусу в питьевой воде
- Ответьте на
37,0 моль H 2 SO 4
3,63 × 10 3 г H 2 SO 4
- Ответ б
3.8 × 10 −6 моль NaCN
1,9 × 10 −4 г NaCN
- Ответ c
73.2 моль H 2 CO
2,20 кг H 2 CO
- Ответ d
5.9 × 10 −7 моль FeSO 4
8,9 × 10 −5 г FeSO 4
- Щелкните здесь, чтобы просмотреть видео решения
ПРОБЛЕМА \ (\ PageIndex {6} \)
Рассчитайте молярность каждого из следующих растворов:
(а) 0.195 г холестерина, C 27 H 46 O, в 0,100 л сыворотки, средняя концентрация холестерина в сыворотке крови человека
(b) 4,25 г NH 3 в 0,500 л раствора, концентрация NH 3 в бытовом аммиаке
(c) 1,49 кг изопропилового спирта, C 3 H 7 OH, в 2,50 л раствора, концентрация изопропилового спирта в медицинском спирте
(d) 0,029 г I 2 в 0,100 л раствора, растворимость I 2 в воде при 20 ° C
- Ответьте на
5.04 × 10 −3 M
- Ответ б
0,499 м
- Ответ c
9.92 М
- Ответ d
1,1 × 10 −3 M
ПРОБЛЕМА \ (\ PageIndex {7} \)
В 1 г кальция содержится около 1,0 г кальция в виде Ca 2+ .0 л молока. Какова молярность Ca 2+ в молоке?
- Ответ
0,025 М
- Щелкните здесь, чтобы просмотреть видео решения
ПРОБЛЕМА \ (\ PageIndex {8} \)
Какой объем раствора 1,00- M Fe (NO 3 ) 3 можно разбавить, чтобы приготовить 1,00 л раствора с концентрацией 0.250 М ?
- Ответ
0,250 л
ПРОБЛЕМА \ (\ PageIndex {9} \)
Если 0,1718 л раствора 0,3556- M C 3 H 7 OH разбавить до концентрации 0,1222 M , каков объем полученного раствора?
- Ответ
0,5000 л
- Щелкните здесь, чтобы просмотреть видео решения
ПРОБЛЕМА \ (\ PageIndex {10} \)
Какой объем 0.33- M C 12 H 22 O 11 раствор можно разбавить для приготовления 25 мл раствора с концентрацией 0,025 M ?
- Ответ
1,9 мл
ПРОБЛЕМА \ (\ PageIndex {11} \)
Какова концентрация раствора NaCl, которая получается, когда 0,150 л раствора 0,556- M дают испариться до тех пор, пока объем не уменьшится до 0,105 л?
- Ответ
0.794 кв.м
- Щелкните здесь, чтобы просмотреть видео решения
ПРОБЛЕМА \ (\ PageIndex {12} \)
Какова молярность разбавленного раствора, когда каждый из следующих растворов разбавляется до заданного конечного объема?
- 1,00 л 0,250- М раствора Fe (NO 3 ) 3 разбавляют до конечного объема 2,00 л
- 0,5000 л раствора 0,1222- M C 3 H 7 OH разбавляют до конечного объема 1.250 л
- 2,35 л 0,350- M раствора H 3 PO 4 разбавляют до конечного объема 4,00 л
- 22,50 мл 0,025- M раствора C 12 H 22 O 11 разбавляют до 100,0 мл
- Ответьте на
0,125 М
- Ответ б
0,04888 М
- Ответ c
0.206 М
- Ответ d
0,0056 М
ПРОБЛЕМА \ (\ PageIndex {13} \)
Какова конечная концентрация полученного раствора, когда 225,5 мл 0,09988- M раствора Na 2 CO 3 дают испариться до тех пор, пока объем раствора не уменьшится до 45,00 мл?
- Ответ
0.5005 M
- Щелкните здесь, чтобы просмотреть видео решения
ПРОБЛЕМА \ (\ PageIndex {14} \)
Для лаборатории общей химии закуплен флакон объемом 2,00 л с раствором концентрированной HCl. Раствор содержал 868,8 г HCl. Какая молярность раствора?
- Ответ
11.9 М
ПРОБЛЕМА \ (\ PageIndex {15} \)
Эксперимент в лаборатории общей химии требует 2.00- M раствор HCl. Сколько мл 11,9 M HCl потребуется для получения 250 мл 2,00 M HCl?
- Ответ
42,0 мл
- Щелкните здесь, чтобы просмотреть видео решения
ПРОБЛЕМА \ (\ PageIndex {16} \)
Какой объем раствора 0,20- M K 2 SO 4 содержит 57 г K 2 SO 4 ?
- Ответ
1.6 л
ПРОБЛЕМА \ (\ PageIndex {17} \)
Агентство по охране окружающей среды США (EPA) устанавливает ограничения на количество токсичных веществ, которые могут сбрасываться в канализационную систему. Пределы были установлены для различных веществ, включая шестивалентный хром, который ограничен до 0,50 мг / л. Если промышленность выбрасывает шестивалентный хром в виде дихромата калия (K 2 Cr 2 O 7 ), какова максимально допустимая молярность этого вещества?
- Ответ
4.8 × 10 −6 M
- Щелкните здесь, чтобы просмотреть видео решения
| 1. | Водный раствор объемом 0,750 л содержит 90,0 г этанола, C 2 H 5 OH. Рассчитайте молярную концентрацию раствора в моль · л -1 . | ||||||||||||||||||||||||||||||
Решение:
Соберите эту информацию вместе, чтобы решить проблему, упорядочив информацию так, чтобы получить желаемую единицу:
| |||||||||||||||||||||||||||||||
| 2. | Какая масса NaCl растворяется в 152 мл раствора, если концентрация раствора составляет 0,364 М? | ||||||||||||||||||||||||||||||
Решение:
| |||||||||||||||||||||||||||||||
| 3. | Какая масса декстрозы, C 6 H 12 O 6 растворена в 325 мл 0,258 М раствора? | ||||||||||||||||||||||||||||||
Решение:
Соберите эту информацию вместе, чтобы решить проблему, упорядочив информацию так, чтобы получить желаемую единицу:
| |||||||||||||||||||||||||||||||
| 4. | 98 г серной кислоты H 2 SO 4 растворяют в воде для приготовления 0,500 М раствора. Какой объем раствора? | ||||||||||||||||||||||||||||||
Решение:
Соберите эту информацию вместе, чтобы решить проблему, упорядочив информацию так, чтобы получить желаемую единицу:
| |||||||||||||||||||||||||||||||
| 5. | Раствор карбоната натрия Na 2 CO 3 , содержит 53.0 г растворенного вещества в 215 мл раствора. Какова его молярность? | ||||||||||||||||||||||||||||||
Решение:
Соберите эту информацию вместе, чтобы решить проблему, упорядочив информацию так, чтобы получить желаемую единицу:
| |||||||||||||||||||||||||||||||
| 6. | Какова молярность раствора HNO 3 , который содержит 12,6 г растворенного вещества в 5,00 л раствора? | ||||||||||||||||||||||||||||||
Решение:
Соберите эту информацию вместе, чтобы решить проблему, упорядочив информацию так, чтобы получить желаемую единицу:
| |||||||||||||||||||||||||||||||
| 7. | Какая масса нитрата меди (II), Cu (NO 3 ) 2 , присутствует в 50,00 мл водного раствора 4,55 × 10 -3 M? | ||||||||||||||||||||||||||||||
Решение:
Соберите эту информацию вместе, чтобы решить проблему, упорядочив информацию так, чтобы получить желаемую единицу:
Окончательный ответ: 4.27 × 10 -2 г нитрата меди (II). | |||||||||||||||||||||||||||||||
Глава 7 – Растворы – Химия
Глава 7: Растворы A -й стехиометрия раствора 7.1 Введение 7.2 Типы решений 7.3 Растворимость 7.4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7.6 твердых гидратов 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Количество частей в решениях 7,8 Разведения 7,9 Концентрации ионов в растворе 7.10 Резюме 7.11 Ссылки7.1 Введение:
Напомним из главы 1, что растворы , , , определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один компонент не может наблюдаться независимо от другого.Решения повсюду вокруг нас. Например, воздух – это решение. Если вы живете рядом с озером, рекой или океаном, этот водоем не является чистым H 2 O, но, скорее всего, это решение. Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения – большая часть повседневной жизни. Большая часть химии, происходящей вокруг нас, происходит в растворе. Фактически, большая часть химии, происходящей в нашем собственном организме, происходит в растворах, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения.В нашем понимании химии нам нужно немного разбираться в растворах. В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Навыки для развития
- Определите следующие термины: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы решений.
- Различают ненасыщенные, насыщенные и пересыщенные растворы.
Главный компонент раствора называется растворителем , а второстепенный компонент (ы) называется растворенным веществом . Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом. Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью. Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле – все это решения. Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).
По теме решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы в зависимости от состояния раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, процент и доли), расчеты стехиометрии реакции с использованием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или обменные реакции: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение проблем стехиометрии раствора требует концепций, представленных в стехиометрии в главе 6, которая также обеспечивает основу для обсуждения реакций.
(Вернуться к началу)7.2 Типы решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно рассматривать как единое вещество, хотя это не так. С другой стороны, гетерогенные смеси неоднородны и имеют участки смеси, которые отличаются от других участков смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид – это смесь, содержащая частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав во всем, но являются мутными или непрозрачными. Молоко – хороший пример коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (от 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы . Для количественной обработки такого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого вещества или жидкости диспергированы и смешаны с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами . Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где вода является растворителем.
- Многие сплавы, керамика и полимерные смеси – это твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью.Серебро, золото и медь образуют множество различных сплавов, уникальных по цвету и внешнему виду. Сплавы и другие твердые растворы важны в мире химии материалов.
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором . Это означает, что к растворителю все еще может быть добавлено больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы – это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна полезная классификация материалов – полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют самую высокую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 7.1 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разницей электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 , являются неполярными соединениями , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 Более высокая разность электроотрицательностей полярных соединений .Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Нравится Растворяется Нравится.Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже отделены от составляющих частиц, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рисунке 7.2. Когда растворителем является вода, вместо сольватации используется слово гидратация .
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода представляет собой высокополярный растворитель, способный растворять многие ионные соли. На рис. 7.2 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере растворения и взаимодействия с молекулами воды. В случае ионных соединений, не растворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разрушены частичными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения называются электролитами . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия – пример сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl – . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Аналогичным образом решения могут быть получены путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией – растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, они считаются смешиваемыми . С другой стороны, жидкости, которые не обладают схожими характеристиками и не могут смешиваться вместе, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также учитывать эти другие факторы.
(Вернуться к началу)7.4 Температура и растворимость
При рассмотрении растворимости твердых веществ соотношение температуры и растворимости не является простым или предсказуемым. На рис. 7.3 показаны графики растворимости некоторых органических и неорганических соединений в воде в зависимости от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) мало изменяются, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3. Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться с температурой; величина этой температурной зависимости широко варьируется между соединениями.
Изменение растворимости в зависимости от температуры было измерено для широкого диапазона соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси путем фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C. а затем медленно охлаждают раствор до 0 ° C.Согласно температурным кривым на рисунке 7.3 оба соединения растворяются в воде при 80 ° C, и все 50 г KBr остаются в растворе при 0 ° C. Однако только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г – 36 г) CH 3 CO 2 Na при охлаждении. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистой форме всего за одну стадию.
Фракционная кристаллизация – это распространенный метод очистки таких разнообразных соединений, как показано на рис. 7.3, и от антибиотиков до ферментов. Чтобы методика работала должным образом, интересующее соединение должно быть более растворимым при высокой температуре, чем при низкой, чтобы понижение температуры заставляло его кристаллизоваться из раствора. Кроме того, примеси должны быть на больше, чем на растворимыми, чем представляющее интерес соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рисунке 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, потому что молекулы находятся так далеко друг от друга, когда находятся в газовой форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Когда формируются эти новые силы притяжения, выделяется тепло. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4 Зависимость растворимости нескольких обычных газов в воде от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрочайнике, знает, что внутри накапливается белый или серый налет, который в конечном итоге необходимо удалить.То же явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных применений, где это называется «котельная накипь», – нагар, который может серьезно снизить пропускную способность труб горячего водоснабжения ( Рисунок 7.5). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химический состав этих отложений умеренно сложен, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 – (бикарбонат). Бикарбонат кальция [Ca (HCO 3 ) 2 ] довольно растворим в воде, но карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием диоксида углерода, карбонат-иона и воды:
2HCO 3 – (водн.) → CO 2 2- (водн.) + H 2 O (л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который уходит в газовую фазу над раствором.В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента накипи в котле.
Рисунок 7.5 Вес котла в водопроводе. Отложения карбоната кальция (CaCO 3 ) в трубах горячего водоснабжения могут значительно снизить пропускную способность труб. Эти отложения, называемые котловыми отложениями, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
При термическом загрязнении вода из озера или реки, которая используется для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, когда она попадала в растение. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания будет слишком низкой. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать на поверхности более холодной, плотной и более богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды. Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любые неблагоприятные воздействия на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды составляет от 12,8 до 17,8 ° ° C (55-65 ° ° F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищничеству и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите Focus Publication штата Вашингтон.
Аналогичный эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого является глобальное потепление. На каждые 1,5 ° C, которые нагревает вода в заливе, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, переместили свои популяции дальше на север.В 2005 году угорь, который является важным местом обитания рыб и моллюсков, исчез на большей части залива после рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других питателей, что затем уменьшило светопропускание, что позволило угрям расти. Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
(Вернуться к началу)7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых тел. Напротив, растворимость газов увеличивается с увеличением парциального давления газа над раствором. Эта точка проиллюстрирована на рисунке 7.6, где показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с увеличением давления, концентрация молекул растворенного газа в растворе в состоянии равновесия также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается при увеличении парциального давления при постоянной температуре. (a) Когда газ вступает в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как скорость, с которой они растворяются, было установлено динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере того, как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Взаимосвязь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кПа
, где C – концентрация растворенного газа в состоянии равновесия, P – парциальное давление газа, а k – постоянная закона Генри , которая должна определяться экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице 7.2
Видеоурок по закону Генри Академии Кана
Все материалы Khan Academy доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 демонстрируют, что концентрация растворенного газа в воде при заданном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ дисперсионные силы Лондона возрастают с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He до Ne и до Ar. Из таблицы также видно, что O 2 почти вдвое растворимее, чем N 2 . Хотя силы лондонской дисперсии слишком слабы, чтобы объяснить такую большую разницу, O 2 является парамагнитным веществом и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитно , оно очень слабо притягивается полюсами магнита, но не сохраняет никакого постоянного магнетизма).
Таблица 7.2 Константы закона Генри для выбранных газов в воде при 20 ° CПарциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C / k. Это важно во многих аспектах жизни, включая медицину, где обычно измеряются газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать, используя следующее уравнение:
Где C 1 и P 1 – соответственно концентрация и парциальное давление газа в исходном состоянии, а C 2 и P 2 – концентрация и парциальное давление, соответственно, газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм? Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. На этом этапе проще всего будет изменить приведенное выше уравнение, чтобы найти C 2 . Далее нам нужно определить начальные условия: C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и решить для C 2 : Газы, которые химически реагируют с водой, такие как HCl и другие галогениды водорода, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водный) и Cl – (водный), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом газы, вступающие в реакцию с водой, не подчиняются закону Генри.
Закон Генри имеет важные приложения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит под CO 2 при давлении более 1 атм.При открытии бутылки давление CO 2 над раствором быстро падает, и часть растворенного газа улетучивается из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоком давлении под водой во внутренних жидкостях дайвера растворяется больше N 2 из воздуха. Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование мелких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и даже в некоторых случаях оказываясь фатальной.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низкие для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Чтобы увеличить концентрацию O 2 во внутренних жидкостях, организмы синтезируют хорошо растворимые молекулы-носители, которые обратимо связывают O 2 . Например, красные кровяные тельца человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи с целью получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови, эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
(Вернуться к началу)7,6 Твердые гидраты:
Некоторые ионные твердые вещества принимают небольшое количество молекул воды в свою кристаллическую решетку и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат молекулы воды, объединенные в определенном соотношении в качестве неотъемлемой части кристалла, которые либо связаны с металлическим центром, либо кристаллизовались с комплексом металла. Сообщается также, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Ярким примером является хлорид кобальта (II), который при гидратации меняет цвет с синего на красный и поэтому может использоваться в качестве индикатора воды.
Рис. 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллическая решетка (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлорида.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Обозначение, используемое для представления твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n – количество молекул воды на формульную единицу соли. n обычно является низким целым числом, хотя возможны дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.В примере на рис. 7.7 гидратированный хлорид кобальта будет обозначен: «хлорид кобальта (II) 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Hemi – 1/2
- моно – 1
- Sesqui – 1½
- Ди – 2
- Три – 3
- Тетра – 4
- Пента – 5
- Hexa – 6
- Hepta – 7
- Окта – 8
- Нона – 9
- Дека – 10
- Undeca – 11
- Додека – 12
Гидрат, потерявший воду, называется ангидридом ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании.Вещество, не содержащее воды, обозначается как безводное . Некоторые безводные соединения настолько легко гидратируются, что вытягивают воду из атмосферы и становятся гидратированными. Эти вещества гигроскопичны, и могут использоваться как осушители или осушители .
(Вернуться к началу)7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный и высококонцентрированный напиток, тогда как слишком мало приводит к разбавленному раствору, который может быть трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество разных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
Наиболее распространенной единицей концентрации является молярность , которая также является наиболее полезной для расчетов, включающих стехиометрию реакций в растворе. Молярность (M) раствора – это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, который содержит 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при расчете задач всегда записывайте единицы молярности как моль / л, а не М. Это позволит вам отменить единицы при выполнении расчета.)
Запрошено: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Решение:
(1) Измените приведенное выше уравнение, чтобы найти количество молей.
(2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Следовательно, никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.В приведенном выше примере:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рисунке 7.8 показана процедура приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя на меньше, чем на желаемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна
моль / литр.2. Чтобы вычислить молярность, нам нужно выразить:
- масса в виде молей
- объем в литрах
- Подставьте оба в уравнение выше и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
7.7.2 Количество частей в решенияхВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или в обоих (т. Е. масса растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, используются сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (м / м), тогда как в клинической химии обычно используется (м / об) с массой , выраженной в граммах, и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » – это префикс латинского происхождения, относящийся к числу 100
(L. centum ), например, Centum или столетие . Он также обозначает 1/100 (от L. centesimus ) как сантиметр и денежная единица цент . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженном на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор представляет собой сумму как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:В качестве примера, раствор этанола в воде с концентрацией 7,0% об. / Об. Должен содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл – 7 мл = 93 мл H 2 O
Пример 2Какое (м / об)% раствора, если 24.0 г сахарозы растворяют в общем растворе 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 частей на миллион) и части на миллиард (10 9 ; частей на миллиард). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Одинаковые процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения ppm и ppb приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей обычно очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (b) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
Концентрации ионных растворенных веществ иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также равно 1 экв / л, потому что натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) – например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении эквивалент – это количество вещества, необходимое для выполнения одного из следующих действий:
- реагирует или поставляет один моль ионов водорода (H + ) в кислотно-основной реакции
- реагирует или поставляет один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент – это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(Вернуться к началу)7,8 Разведения
Раствор желаемой концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 7.10. Это требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества.Помните, что разбавление данного количества исходного раствора растворителем не приводит к изменению , а не количества присутствующего растворенного вещества, изменяется только объем раствора. Соотношение между объемом и концентрацией основного раствора и объемом и концентрацией желаемого разбавленного раствора может быть математически выражено как:
где M s – концентрация основного раствора, V s – объем основного раствора, M d – концентрация разбавленного раствора, а V d – объем разбавленного раствора. .
Рисунок 7.10 Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряют из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в данном случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание: если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем – объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл – 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе) .
7,9 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один Cr 2 O 7 2− ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2- ионов.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2- ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, получается 3 моля ионов (1 моль Cr 2 O 7 2- анионов и 2 моль NH 4 + катионов) в растворе (рисунок 7.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквивалентов .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 7.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль анионов Cr 2 O 7 2- анионов и 2 моль катионов NH 4 + . (Молекулы воды для ясности не показаны с молекулярной точки зрения.)
Когда мы проводим химическую реакцию с использованием раствора соли, например дихромата аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2- также должна быть 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2-. Однако на формульную единицу приходится два NH 4 + ионов, поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует трех ионов при растворении в воде (2NH 4 + + 1Cr 2 O 7 2-), общая концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 может быть затем рассчитано путем деления 1,43 M на 4,29 M, что дает 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M In (NO 3 ) 3
Дано: молярность
Запрошено: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или как неэлектролит.
B Если соединение неэлектролит, его концентрация такая же, как молярность раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия – это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH – , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH – ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты – это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 м
3. 0,032 M дюйм (NO 3 ) 3
A Нитрат индия – это ионное соединение, которое содержит ионы In 3+ и ионы NO 3 –, поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 –, поэтому 0,032 M In (NO 3 ) 3 Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 – , то есть [In 3+ ] = 0,032 M и [NO 3 – ] = 0,096 M
(Вернуться к началу)7.10 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор представляет собой гомогенную смесь. Основным компонентом является растворитель , а второстепенным компонентом – растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор. Растворенные вещества – это растворимые или нерастворимые , что означает, что они растворяются или не растворяются в конкретном растворителе. Термины смешивающийся и несмешивающийся вместо «растворимый» и «нерастворимый» используются для жидких растворенных веществ и растворителей.Утверждение « подобно растворяется как » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит путем сольватации , процесса, в котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора. Для водных растворов используется слово гидратация . Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество.Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества.Таких решений насыщенных . Растворы с количеством меньше максимального – ненасыщенные . Большинство растворов являются ненасыщенными, и их концентрацию можно указать разными способами. Массовый / массовый процент , объемный / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда на ионах. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора. Растворы известной концентрации могут быть приготовлены либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Ключевые вынос
- Концентрации раствора обычно выражаются в виде молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- HF
- Канал 3 Канал 2 Канал 2 Канал
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Можно ли ожидать, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора – моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 M раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
a) Nh4 – слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF – слабая кислота, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 – это растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего напоминающие химический стакан № 1.
Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl –), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl –) для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 Мбайн 2
- 1,135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Родинки Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат иодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 с использованием основного раствора.
Гипохлорит кальция [Ca (OCl) 2 ] – эффективное дезинфицирующее средство для одежды и постельного белья. Если в растворе концентрация Ca (OCl) 2 равна 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответы
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
а. 0.174 М, г. 0.297 М, c. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1,08 М, h4PO4 = 0,816 М, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
1,74 × 10 −3 M кофеин
Ссылки
- Chung (Peter) Chieh (2016) Неорганическая химия. Либретекстов . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
- Болл, Д. У., Хилл, Дж. У.и Скотт Р.Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл Б.А., Элдридж П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Лоуэр, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.html
ChemTeam: проблемы с разбавлением # 1-10
ChemTeam: проблемы с разбавлением # 1-10Проблемы с разбавлением
# 1-10
Проблема № 1: Если вы разбавите 175 мл 1.6 М раствор LiCl на 1,0 л, определяют новую концентрацию раствора.
Решение:
M 1 V 1 = M 2 V 2(1,6 моль / л) (175 мл) = (x) (1000 мл)
x = 0,28 М
Обратите внимание, что использовалось 1000 мл, а не 1,0 л. Не забудьте сохранить единообразие единиц объема.
Задача № 2: Вам необходимо произвести 10,0 л 1,2 M KNO 3 . Какая молярность должна быть у раствора нитрата калия, если вы используете только 2.5 л?
Решение:
M 1 V 1 = M 2 V 2(x) (2,5 л) = (1,2 моль / л) (10,0 л)
x = 4,8 М
Обратите внимание, как я использую в расчетах молярную единицу, моль / л, а не символ молярности M.
Проблема № 3: Сколько миллилитров 5,0 М раствора сульфата меди (II) необходимо добавить к 160 мл воды, чтобы получить 0,30 М раствор сульфата меди (II)?
Решение:
M 1 V 1 = M 2 V 2(5.00 моль / л) (x) = (0,3 моль / л) (160 + x)
5х = 48 + 0,3х
4,7x = 48
x = 10. мл (на два сиговых инжира)
Решение этой проблемы предполагает, что объемы складываются. Это «160 + x», то есть V 2 .
Задача № 4: Какой объем 4,50 М HCl можно получить, смешав 5,65 М HCl с 250,0 мл 3,55 М HCl?
Решение:
Вот первый способ решить эту проблему:
M 1 V 1 + M 2 V 2 = M 3 V 3(3.55) (0,250) + (5,65) (х) = (4,50) (0,250 + х)
Где x – объем добавляемой 5,65 М HCl
(0,250 + x) – общий результирующий объем0,8875 + 5,65x = 1,125 + 4,50 x
1,15x = 0,2375
x = 0,2065 лОбщее количество 4,50 М HCl тогда (0,250 + 0,2065) = 0,4565 л.
Общий объем = 456,5 мл
Вот второй способ решить эту проблему:
Поскольку добавленная сумма 5,65 млн не запрашивается, нет необходимости решать ее.M 1 V 1 + M 2 V 2 = M 3 V 3
(3,55) (250) + (5,65) (x – 250) = (4,50) (x )
Таким образом, x – это тот ответ, который вам нужен, конечный объем раствора, а не x – количество добавляемого 5,65 M раствора.
Проблема № 5: Объем 40,0 мл 1,80 M Fe (NO 3 ) 3 смешивают с 21,5 мл раствора 0,808 M Fe (NO 3 ) 3 .Рассчитайте молярную концентрацию конечного раствора.
Решение:
Давайте воспользуемся немного другим способом написания индексов:
M 1 V 1 + M 2 V 2 = M 3 V 3
Стандартного способа записи индексов в задачах такого типа не существует.
Замена:
(1,80) (40,0) + (0,808) (21,5) = (M 3 ) (40,0 + 21,5)М 3 = 1.45 м
Проблема № 6: К 2,00 л 0,445 M HCl вы добавляете 3,88 л второго раствора HCl неизвестной концентрации. Полученный раствор составляет 0,974 М. Предполагая, что объемы складываются, рассчитайте молярность второго раствора HCl.
Решение № 1:
M 1 V 1 + M 2 V 2 = M 3 V 3(0,445) (2,00) + (x) (3,88) = (0,974) (2,00 + 3,88 )
0.890 + 3,88x = 5,72712
3,88x = 4,83712
x = 1,25 M (до трех сигнатур)
Решение № 2:
1) Рассчитайте моль HCl в 0,445 М растворе:
(0,445 моль / л) (2,00 л) = 0,890 моль
2) Установите выражение для молей HCl во втором растворе:
(x) (3,88 л) = моль HCl в неизвестном растворе
3) Рассчитайте количество молей HCl в конечном растворе:
(0,974 моль / л) (5,88 л) = 5,73 моль
4) Моль HCl в двух смешанных растворах = моль HCl в конечном растворе:
0.890 моль + [(x) (3,88 л)] = 5,73 мольx = 1,25 M (для трех сигнатур)
Проблема № 7: До какого объема следует разбавить 133 мл 7,90 M раствора CuCl 2 , чтобы 51,5 мл разбавленного раствора содержал 4,49 г CuCl 2 ?
Решение:
1) Найдите родинки:
(4,49 г CuCl 2 ) (1 моль CuCl 2 / 134,45 г) = 0,033395 моль CuCl 2
2) Найдите молярность числа 51.5 мл разбавленного раствора, содержащего 4,49 г CuCl 2 :
(0,033395 моль CuCl 2 ) / (0,0515 литра) = 0,648 M
3) Используйте формулу разбавления:
M 1 V 1 = M 2 V 2(7,90 M) (133 мл) = (0,648 M) (V 2 )
V 2 = 1620 мл
Следует разбавить 133 мл 7,90 M раствора CuCl 2 до 1620 мл.
Проблема № 8: Если объемы складываются и 95.0 мл 0,55 М KBr смешивают с 165,0 мл раствора BaBr 2 , чтобы получить новый раствор, в котором [Br ¯] составляет 0,65 М. Какая концентрация BaBr 2 используется для приготовления нового раствора?
Решение:
моль Br¯ из KBr: (0,55 моль / л) (0,095 л) = 0,05225 мольмоль Br ¯ в конечном растворе: (0,65 моль / л) (0,260 л) = 0,169 моль.
моль Br¯, обеспечиваемого раствором BaBr 2 : 0,169 – 0,05225 = 0,11675 моль
BaBr 2 обеспечивает два Br ¯ на формульную единицу, поэтому (0.11675 делить на 2) моль BaBr 2 требуется для 0,11675 моль Br ¯ в растворе.
молярность раствора BaBr 2 : 0,058375 моль / 0,165 L = 0,35 M
Задача № 9: 1,00 л раствора получают растворением в нем 125,6 г NaF. Если я взял 180 мл этого раствора и разбавил его до 500 мл, определите молярность полученного раствора.
Решение:
1) Рассчитайте количество молей NaF:
125.6 г / 41,9 г / моль = 3,00 моль
2) Рассчитайте количество молей в 180 мл полученного раствора:
3,00 моль в 1000 мл, поэтому 3 x (180/1000) = 0,54 моль в 180 мл
3) Рассчитайте молярность разбавленного раствора:
0,54 моль / 0,50 л = 1,08 моль / л = 1,08 M
Задача № 10: Какова молярная концентрация хлорид-ионов в растворе, приготовленном путем смешивания 100,0 мл 2,0 М KCl с 50,0 мл 1,50 М раствора CaCl 2 ?
(Предупреждение: есть сложность в решении.Это связано с CaCl 2 .)
Решение № 1:
1) Получите общее количество молей хлорида:
KCl ⇒ (2,00 моль / л) (0,100 л) = 0,200 моль хлорид-ионаCaCl 2 ⇒ (1,50 моль / л) (0,0500 л) (2 иона / 1 формульная единица) = 0,150 моль хлорид-иона.
«2 иона / 1 формула» – проблемный ребенок. Раствор представляет собой 1,50 М хлорида кальция, но 3,00 М только хлорид-ион.
Всегомолей = 0,200 моль + 0.150 моль = 0,350 моль
2) Получите молярность хлорида:
0,350 моль / 0,150 L = 2,33 M
Решение № 2:
Предположим, вы действительно хотите использовать это уравнение:
M 1 V 1 + M 2 V 2 = M 3 V 3
Настройте это так:
(2,00 моль / л) (0,100 л) + (3,00 моль / л) (0,0500 л) = (M 3 ) (0,150 л)Обратите внимание, что молярность CaCl 2 равна 3.00, потому что это молярность раствора с точки зрения хлорид-иона.
Дополнительная задача: Какой объем 30% (мас. / Об.) Раствора перекиси водорода требуется для приготовления 425 мл 6.0% (мас. / Об.) Раствора?
Решение:
1) 6,0% (мас. / Об.) Означает 6 г на 100 мл раствора:
6 г х ––––––– = ––––––– 100 мл 425 мл x = 25.5 г
Мы должны использовать 30% (мас. / Об.) Раствор, достаточный для получения 25,5 г H 2 O 2 .
2) 30% (вес / объем) означает 30 г растворенного вещества на 100 мл раствора:
30 г 25,5 г ––––––– = ––––––– 100 мл х x = 85 мл
3) Этот вопрос можно записать так, чтобы задать массу 30.% (мас. / об.) требуется. Для этого мы выполняем описанные выше шаги, а затем это:
(85 мл) (1,10 г / мл) = 93,5 млТребуется плотность решения, что требует поиска в Интернете. Вот пример сайта, на котором указано значение плотности.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Проблема химической реакции в водном растворе
Этот пример отработанного химического примера демонстрирует, как определить количество реагентов, необходимых для завершения реакции в водном растворе.
Проблема
Для реакции:
- Zn (s) + 2H + (водный) → Zn 2+ (водный) + H 2 (g)
- Определите количество молей H + , необходимое для образования 1.22 моль H 2 .
- Определите массу Zn в граммах, которая требуется для образования 0,621 моль H 2
- Определите количество молей H + , необходимое для образования 1.22 моль H 2 .
Решение
Часть A : Возможно, вы захотите просмотреть типы реакций, которые происходят в воде, и правила, применимые к уравнениям баланса водных растворов. После того, как вы их настроили, сбалансированные уравнения для реакций в водных растворах работают точно так же, как и другие сбалансированные уравнения. Коэффициенты означают относительное количество молей веществ, участвующих в реакции.
Из сбалансированного уравнения видно, что 2 моль H + используется на каждый 1 моль H 2 .
Если использовать это как коэффициент пересчета, то для 1,22 моль H 2 :
- моль H + = 1,22 моль H 2 x 2 моль H + /1 моль H 2
- моль H + = 2,44 моль H +
Часть B : Аналогично, 1 моль Zn требуется для 1 моль H 2 .
Чтобы решить эту задачу, вам нужно знать, сколько граммов содержится в 1 моль Zn. Найдите атомную массу цинка в Периодической таблице. Атомная масса цинка 65,38, так что в 1 моль Zn 65,38 г.
Подключение этих значений дает нам:
- масса Zn = 0,621 моль H 2 x 1 моль Zn / 1 моль H 2 x 65,38 г Zn / 1 моль Zn
- масса Zn = 40,6 г Zn
Ответ
- 2,44 моль H + требуется для образования 1.22 моль H 2 .
- Для образования 0,621 моль H требуется 40,6 г Zn 2
