СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
22.01.2023
А в общежитии свой Новый год!
Традиционная «Зимняя сказка» прошла в общежитии.
19.01.2023
Этот старый добрый Новый год…
Группа лицеистов отметила праздник на турбазе.
29.12.2022
Успех во Всероссийском конкурсе учебных судов
Команда СУНЦ УрФУ впервые в истории Свердловской области приняла участие в финальном этапе XVI Всероссийского конкурса учебных судов.
24.12.2022
Победа в первом региональном турнире учебных судов
Команда СУНЦ УрФУ одержала победу в первом в истории Свердловской области региональном турнире XVI Всероссийского конкурса учебных судов.
23.12.2022
Долгожданная награда
Награду из рук губернатора Свердловской области получил победитель Всероссийской олимпиады по искусственному интеллекту.
23. 12.2022
12.2022
Волейбол. Итоги
Команды СУНЦ успешно выступили на первенстве Кировского района Екатеринбурга.
Больше новостей
Видеогалерея:
Новогодние поздравления (декабрь 2022)
СУНЦ.АРТ (ноябрь 2022)
«Горнозаводской Урал» (октябрь 2022)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями.
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9, 10 и 11 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 19, 32 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.

Решение задач по теме «Растворы»
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Решение задач по теме «Растворы»
Вычисление массовой доли веществав растворе, полученном при растворении
вещества в растворителе
m(в-ва)
m(р -ра) =m(в-ва) +m(растворителя)
m
раствора
(растворителя)
W вещества
m
Следствие из формулы:
1. Растворение вещества в воде
Задача 1а.
Растворили 50 г. поваренной соли в 200 г.
воды. Вычислите массовую долю соли в
растворе.
Дано:
m (NаCl)=50г
m (в-ва)
m (р-ра)
m (h3O)
m (h3O)=200г
w (NаCl)=?
m (NаCl)
50г
= 0,2 или 20%
w (NаCl)
=
m (NаCl)+m(h3O) 50г +200г
=
4.
 Решение задачСколько грамм соли и воды нужно взять для
Решение задачСколько грамм соли и воды нужно взять дляприготовления 150 г 15% раствора?
Дано:
m (раствора)=150г
w (NаCl)= 15 %
m (h3O) – ?
m (NаCl) – ?
m(h3O) = m (раствора) – m(NаCl)
5. Решите самостоятельно
Сколько грамм воды и сахара нужновзять для приготовления 300 г 15%
раствора?
Дано:
m (раствора)=300г
w (сахара)= 15 %
m (h3O) – ?
m (сахара) – ?
m(h3O) = m (раствора) – m(NаCl)
6. Проверяем домашнее задание
Составить и решить на отдельном листике двеСВОИ задачи
Задача 1.
В ________ г воды растворили ______ г
поваренной соли. Рассчитайте массовую долю
соли в полученном растворе.
Задача 2.
Требуется приготовить __________ г раствора с
массовой долей _________ %. Рассчитайте массу
требуемых сахара и воды.
7. Тестовые задания
Отметьте, какие из следующих четырех утвержденийотносительно массовой доли растворенного вещества
правильные, а какие — неправильные.

А. Массовая доля — это доля молекул растворенного
вещества в растворе.
Б. Массовая доля — это отношение массы растворенного
вещества к массе раствора, выраженное в процентах.
В. Массовая доля — это отношение массы молекулы
растворенного вещества к массе молекулы воды.
Г. Массовая доля — это отношение количества молекул
растворенного вещества к количеству молекул
растворителя.
8. Тестовые задания
10 г хлорида натрия смешали с 90 г воды.Отметьте, какие из следующих четырех
утверждений относительно образовавшегося
раствора правильные, а какие —
неправильные.
А. Хлорид натрия полностью не растворится в
воде.
Б. Масса образовавшегося раствора равна 80 г.
В. Массовая доля хлорида натрия в растворе
равна 11,1%.
Г. При повышении температуры раствора
массовая доля хлорида натрия увеличится.
9. Тестовые задания
В 250 г раствора сульфата меди (II)содержится 50 г этой соли. Отметьте, какие из
следующих четырех утверждений
относительно этого раствора правильные, а
какие — неправильные.

А. Раствор сульфата меди имеет красную
окраску.
Б. Масса воды в этом растворе равна 300 г.
В. Массовая доля сульфата меди в этом растворе
равна 17%.
Г. При понижении температуры из этого
раствора начнут выделяться пузырьки газа.
10. Домашнее задание
Решить задачу №5 (стр. 59 – учебник) по образцу наследующем слайде
Готовиться к СР по задачам (выберу из
составленных Вами)
Пусть вас не пугают [МЛ] в
задаче
Вспомните (или узнайте в
инете) плотность воды и как
относятся друг к другу
Добавление воды к раствору
Задача.
К 150 г. 10% раствора соли прилили 100 г.
воды. Вычислите массовую долю соли в
новом растворе.
Дано:
m (р-ра)1=150 г
w (соли)1 =10%
m (h3O)доб
0,1
m (h3O)доб =100 г
w (соли)2 =?
m (соли)1
w(соли)2=
m (р-ра)1+m(h3O)доб
m (в-ва)
m (р-ра)
m (h3O)
0,1 .150 г
= 150 г + 100 г = 0,06
или 6%
English Русский Правила
Глава 12.
 1: Подготовка растворов — Химия LibreTexts
1: Подготовка растворов — Химия LibreTexts- Последнее обновление
- Идентификатор страницы
- 19928
Цель обучения
- Количественно описать концентрации растворов.
В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе.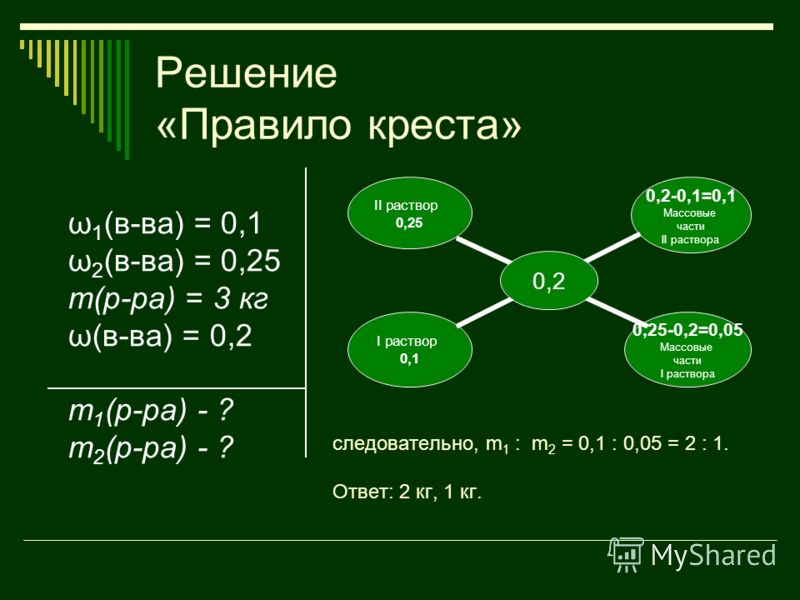
Приготовление растворов
Для приготовления раствора, содержащего указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\( Молярность раствора = dfrac{моли\: of\: solute}{Объем раствора} \tag{12.1.1}\)
На рис. 12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок 12.1.1 Приготовление раствора известной концентрации с использованием твердого растворенного вещества 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей CoCl 5 2 2 900 разделить массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль. Следовательно,
Следовательно,
\( молей\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165 ,87\: \cancel{g} /mol} \right) = 0,0603 \: моль \)
Объем раствора в литрах равен
\( объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \справа) = 0,500\: л \)
Молярность – это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1,43 M
количество молей растворенного вещества в требуемом объеме раствора с использованием соотношения, показанного в уравнении 12. 1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \справа) = 27,9 \: г \: глюкоза \)
Упражнение
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации можно также приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9. 0024
0024
\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора. Рис. 12.1.3 Приготовление раствора известной концентрации путем разбавления маточного раствора0053 s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример 12.1.3
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере 4?
Дано: объем и молярность разбавленного раствора
Запрошено: объем основного раствора
Стратегия:
A Рассчитайте количество молей разбавленного раствора глюкозы, содержащееся в нем.
B Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Раствор:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \)
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего это количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема исходного раствора нам нужно было разделить желаемое количество молей глюкозы на концентрацию исходного раствора для получения соответствующих единиц.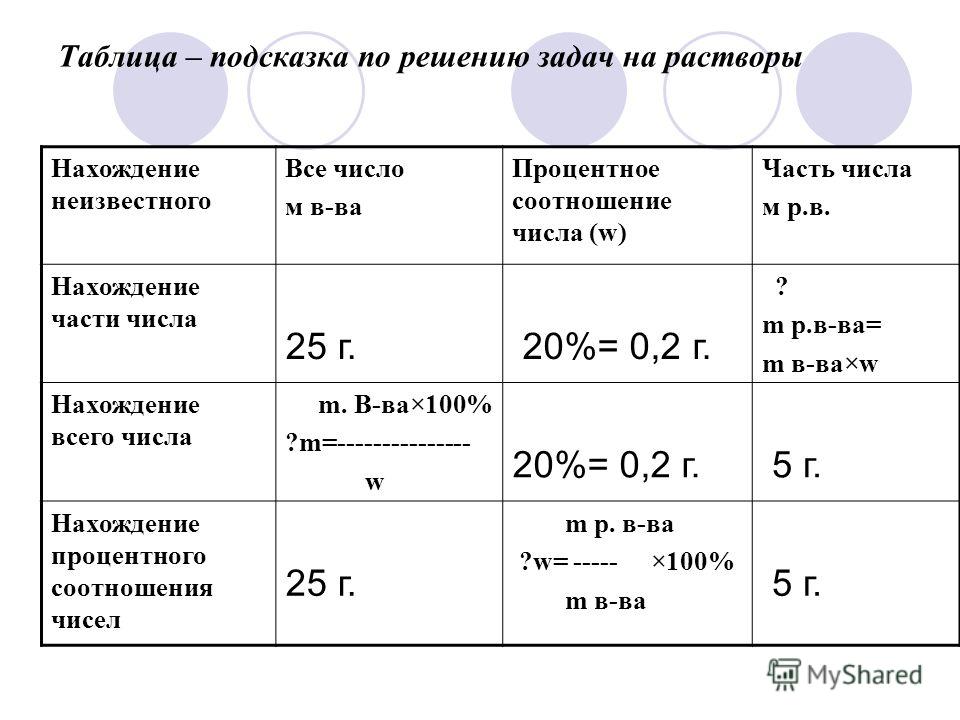 Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя
Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для V s и подставив соответствующие значения:
\( V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \cancel{M}} = 0,258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9. 3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + (см. рис. 12.1.4).
Рис. 12.1.4 Растворение 1 моля ионного соединения В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 дает раствор, содержащий 1 05 O 1 моль Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов. (Для ясности молекулы воды опущены в молекулярном представлении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. . Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
Пример 12.1.4
полученные из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH – , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН – ] = 0,21 М.
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3,7 M. – (водн.) \)
– (водн.) \)
B One formula unit of In(NO 3 ) 3 produces one In 3 + ion and three NO
Упражнение
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [ОН – ] = 0,0024 М
- [Na + ] = 0,34 М; [ТАК 4 2− ] = 0,17 М
- [(СН 3 ) 2 СО] = 0,50 М Уравнение 12.
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- НХ 3
- ВЧ
- СН 3 СН 2 СН 2 ОН
Нет 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет 3 Заказ на поставку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m . Моляльность определяется как число молей растворенного вещества в 1 кг растворителя .
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.Каковы преимущества использования растворов для количественных расчетов?
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.

- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3,62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.

- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента потребовалось 200,0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ) растворяют в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетках некоторых лекарств указаны инструкции по добавлению 10,0 мл стерильной воды, в которых указано, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
0,48 М ClO −
1,74 × 10 −3 М кофеин
- Анонимно
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Встроить Hypothes.
 is?
is? - да
- Лицензия
- CC BY-NC-SA
- Показать страницу TOC
- да на странице
- Этап
- Финал
- Теги
 1.2:
1.2:Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражаются как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Key Takeaway
Концептуальные проблемы
Ответить
Численные задачи
Ответы
Авторы
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
Как решить задачи по химии?
Часто ли у вас возникают трудности при решении задач по химии или концентрации, например, при переходе от одной концентрации, выраженной в массовых процентах, к другой, выраженной в молях на литр раствора? Вы видите, как молярность дыма в глазах? Без страха.
Следуй за мной, и, проявив немного терпения, ты увидишь, что найти дорогу не так уж и сложно. Я буду предлагать задачи, разделенные по типам; с соответствующей методологией, предложенной для решения.
Случай 1: Переход от концентрированного молярного раствора к разбавленному, то есть «разведение».
Пример:
Берут 35 мл 2,0 М раствора серной кислоты и помещают в мерную колбу вместимостью 500 мл. Рассчитайте молярность полученного раствора.
Чтобы решить этот тип упражнения, вы должны понять важную концепцию: количество взятых молей растворенного вещества равно количеству молей растворенного вещества, присутствующего в новом растворе. Что меняется после операции, так это концентрация, которая становится меньше (если она выражена в той же единице измерения).
Вспоминая, что молярная концентрация получается путем деления числа молей растворенного вещества на объем раствора (Важно! выражается в литрах или лучше в дм 3 ):
М = n / V
Имеем, что n = M × V
В первом растворе, описываемом задачей, 2-молярном, число молей кислоты будет:
n начальных = начальное M × начальное V
В разбавленном растворе будет :
n окончательный = M окончательный × V окончательный
Однако мы поняли, что родинки не меняются, поэтому мы будем иметь это:
n начальное = n конечное
Таким образом, мы можем написать:
M начальное × V начальное = M конечное × V конечное
By изучив данные задачи, мы видим, что наша неизвестная и есть конечная молярность. Поэтому решение задачи будет даваться выражением:
Поэтому решение задачи будет даваться выражением:
Конечная М = исходная М × исходная V / конечная V
Обратите внимание на два важных момента.
Первый пункт: Вышеприведенное выражение является выражением, а не пропорцией:
Второй момент: объем перед проведением расчетов необходимо перевести в литры или кубические дециметры.
Теперь математически. по массе до разбавленного, выраженного в молях на литр
Пример:
Из раствора HCl 37% масс./м, плотностью 1,19 г/мл берут 50 мл, помещают в мерную колбу и доводят до конечный объем 250 мл. Рассчитайте молярность полученного раствора.
Это немного сложнее, чем предыдущее, но не волнуйтесь.
Что данные говорят нам о проблеме? «Давайте прочитаем их» внимательно. Плотность представляет собой массу единицы объема и рассчитывается:
d = m/V
Плотность относится объем взятого раствора к его массе. Сказать, что плотность составляет 1,19 г/мл, это все равно, что сказать, что один миллилитр этого раствора имеет массу 1,19 грамма.
Поскольку мы взяли 50 мл, произведение плотности на объем даст соответствующую массу:
m = d × V = 1,19 г × мл -1 × 50 мл = 59,5 г
Эта масса представляет собой массу образца, т. е. раствора (растворенное вещество + растворитель): поэтому следует помнить, что раствор гомогенная смесь, то есть она не состоит из чистой жидкости. Данные задачи говорят нам о том, что только 37 % массы этого раствора представлено соляной кислотой, то есть:
Масса кислоты = 59,5 г × 37/100 = 22 г
Поскольку задача требует от нас выразить конечную концентрацию в молях, переводим количество кислоты в моли:
n HCl = m HCl / молярная масса HCl = 22 г / 36,46 г × моль -1 = 0,60 моль
Последнее усилие: конечный объем раствора дан нам в миллилитрах; поэтому мы должны перевести его в литры:
250 мл = 0,250 л
Молярность конечного раствора будет:
М = n / V = 0,60 моль / 0,250 л = 2,4 М
Случай 3: Рассчитать молярность раствора, концентрация которого выражается в массовых/массовых процентах.
Пример
Рассчитайте молярность 22,38% раствора азотной кислоты, имеющего плотность 1,130 г/мл.
Это несложно: поскольку нам предстоит вычислить молярность, объем которой выражается в литрах или кубических дециметрах, для удобства мы принимаем в расчет в качестве произвольного объема один литр.
Один литр раствора будет иметь массу 1130 граммов, т.е. 1,130 г/мл × 1000 мл (т.е. 1 л).
Теперь, как и в типе 2, вычисляем массу растворенного вещества, которая составляет 22,38% от общей массы раствора:
м HNO3 = 1130 г × 22,38 / 100 = 252,9 г
Чтобы узнать молярную концентрацию, достаточно перевести 252,9 г азотной кислоты в моли азотной кислоты, помня, что это количество вещества содержится в литре раствора.
М = 252,9 г × л -1 / 63,01 г × моль -1 = 4,01 М
Надеюсь, вы узнали что-то новое сегодня, прочитав эту статью. Пожалуйста, укажите ниже свой уровень обучения после прочтения этой статьи. Оставляйте комментарии под своими вопросами и предложениями, относящимися к химии.
