Задачи с участием примесей неактивных веществ | Задача 1.1
Задача 1.1
Образец известняка, содержащий 12% примеси песка (SO2), залили избытком раствора соляной кислоты (НС1). Определите объем выделившегося газа (н.у.), если масса исходного образца была 70 г.
Дано:
масса исходного образца известняка: mисх. обр. = 70 г;
массовая доля примеси песка: SiO2 = 12%.
Найти:
объем выделившегося газа: V(СО2) = ?
Решение:
В данной задаче образец известняка представляет собой смесь: СаСО3 + SiO2. С соляной кислотой взаимодействует только один из ее компонентов — карбонат кальция. Второй же компонент (песок SiO2) представляет собой неактивную примесь. Поэтому мы записываем химическую реакцию взаимодействия с соляной кислотой только для СаСО3.
СаСО3 + 2НС1 = СаС12 + СО2↑ + Н2
Но в условии задачи указана масса всего образца вместе с примесью. Поэтому на начальном этапе решения необходимо выявить количество (в данном случае массу) активного компонента в образце. Алгоритм решения будет иметь вид:
Поэтому на начальном этапе решения необходимо выявить количество (в данном случае массу) активного компонента в образце. Алгоритм решения будет иметь вид:
1. Определим массу примеси (SiO2) в исходном образце.
2. Определим массу карбоната кальция в образце.
m(СаСО3) = mисх. обр. – mприм. = 70 – 8,4 = 61,6 г.
3. По уравнению реакции определяем объем (н.у.) выделившегося газа.
Составляем пропорцию:
из 61 ,6 г СаСО3 выделяется х л СО2 (по данным условия)
из 100 г СаСО3 выделяется 22,4 л СО
Ответ: Объем СО2 равен 13,8 л (н.у.).
Задача 1.2
Образец углерода, содержащий некоторое количество негорючей примеси, сожгли в избытке кислорода. В результате реакции получили 67,2 л углекислого газа (н.у.). Определите содержание (массовую долю) примеси в образце, если его масса составляла 40 г.
Дано:
масса исходного образца: mисх. обр. = 40 г;
объем (н.у.) выделившегося углекислого газа: V(СО2) = 67,2 л.
Найти:
массовую долю примеси: оприм. = ?
В условии сказано, что примесь является негорючей, следовательно, углекислый газ образуется только в результате сгорания углерода:
С + О2 = СО2
Алгоритм решения можно представить следующим образом:
V(СO2) → m(С) → (С)в исх. обр. → прим.
1. По уравнению реакции определим массу чистого углерода.
Составим пропорцию:
x г углерода дают 67,2л СО2 (по данным условия)
12 г углерода дают 22,4л СО2 (по уравнению реакции)
2. Определяем массовую долю углерода в образце.
3. Определяем массовую долю примеси в образце.
прим. = 100% – (С) = 100% – 90% -=10% .
Ответ: массовая доля негорючих примесей составляет 10%.
Задачи по химии. Выход продукта реакции. Примеси. Потери
3 Сен
Posted on Author admin 1
Чтобы поделиться, нажимайте
Задачи на тему Выход продукта реакции. Примеси. Потери.
Предлагаем вашему вниманию задачи по теме Выход продукта реакции. Примеси. Потери с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
При восстановлении водородом оксида меди (II) массой 64 кг была получена медь массой 43,52 кг. Укажите выход (%) продукта реакции.
а) В избытке кислорода сожгли углерод массой 240 г. Укажите массу (г) оксида углерода (IV), который был получен, если потери в производстве (реакции) составляют 10%.
б) В избытке кислорода сожгли углерод массой 240 г. Укажите массу (г) оксида углерода (IV), который был получен, если практический выход реакции равен 90%.
в) В избытке кислорода сожгли углерод массой 240 г. Укажите массу (г) оксида углерода (IV), который был получен, если исходное вещество содержит 10% примесей по массе.
Необходимо получить сернистый газ объёмом 112 дм
3. Какую массу серы надо взять, если:
Какую массу серы надо взять, если:
а) потери в производстве 7%;
б) выход оксида равен 93%;
в) сера содержит 7% примесей.
Из поваренной соли массой 325 г, содержащей 10% примесей, в лаборатории получили соляную кислоту объёмом 730 мл с массовой долей 20% и плотностью 1,15 г/мл. Сколько (%) это составит от теоретически возможного выхода?
При взаимодействии технического карбида кальция массой 93 г с избытком воды выделилось 28 дм
3 газа (н. у.). Найдите массовую долю (%) примесей в карбиде.
у.). Найдите массовую долю (%) примесей в карбиде.
При нагревании при 1200С гидрида бария массой 41,7 г получили два простых вещества, объём водорода составил при этой температуре и нормальном давлении 32,633 л. Вычислите выход (%) реакции разложения.
Руда содержит 91% гематита. Какая массу (т) руды требуется для получения железа массой 4000 т, если железо извлекается из руды на 80%?
Над нагретой серой массой 20,48 г пропустили водород. Образовавшийся сероводород пропустили через избыток раствора гидроксида калия. Определите массу (г) образовавшегося сульфида, если выход продукта реакции на первой стадии равен 90%, на второй – 85%.
При дегидратации насыщенного одноатомного спирта массой 9,2 г с выходом 75% образовался алкен массой 4,2 г. Укажите суммарное число атомов в одной молекуле исходного спирта.

Кусочек мела массой 2,5 г, массовая доля карбоната кальция в котором равна 95%, опустили в раствор массой 10 г с массовой долей серной кислоты 33,33%. В результате реакции выделился газ объёмом (н.у.) 500 см
3. Определите выход (%) продукта реакции.
Ответы:
- 85
- 792
- 172
- 92
- 14
- 90
- 8416
- 54
- 9
- 94
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk. com/id30891697 или на электронную почту [email protected]
com/id30891697 или на электронную почту [email protected]
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Посмотреть видео-объяснения решений всех типов задач по химии
- Просмотреть все тесты по органической химии с видео-объяснениями
- Просмотреть все тесты по неорганической химии с видео-объяснениями
- Посмотреть пробные варианты ЦТ вы можете здесь,
- Посмотреть пробные и реальные варианты ЕГЭ
- Посмотреть все видео-уроки по различным разделам школьного курса
- Больше заданий РТ с видео-объяснениями
- Больше заданий ЦТ с видео-объяснениями
- Больше заданий ЕГЭ с ответами и видео-объяснениями
- Все видео-объяснения вы можете найти на YouTube канале
 При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
 Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Статья 36. Свободное использование произведений в образовательных и исследовательских целяхПункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
3.6F: Устранение неполадок — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 254927
- Лиза Николс
- Колледж Бьютт
Кристаллизация слишком быстрая
Быстрая кристаллизация не рекомендуется, поскольку примеси имеют тенденцию внедряться в кристалл, что противоречит цели этого метода очистки.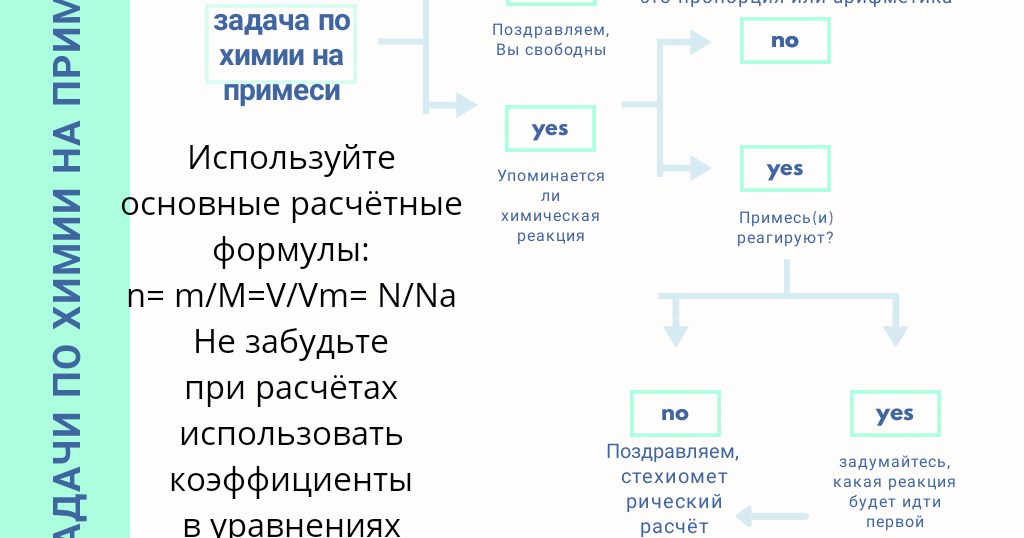 Для кристаллизации может быть приемлемо начинать
Для кристаллизации может быть приемлемо начинать
При идеальной кристаллизации некоторое количество кристаллов образуется примерно за 5 минут, а рост продолжается в течение 20 минут. Ниже приведены методы, которые можно использовать для замедления роста кристаллов:
- Поместите твердое вещество обратно на источник тепла и добавьте дополнительное количество растворителя (возможно, \(1\)-\(2 \: \text{мл}\) для \(100 \: \text{мг}\) твердого вещества ), так что вы превысили минимальное количество горячего растворителя, необходимое для растворения твердого вещества. Хотя большее количество соединения будет растворяться в маточном растворе, соединение будет оставаться растворимым дольше после того, как оно будет оставлено для охлаждения.
Например, при кристаллизации транс--коричной кислоты со смешанным растворителем из метанола и воды использование минимального количества горячего растворителя для растворения твердого вещества (рис.
 3.60а) приводило к немедленному выпадению твердого вещества из раствора при раствор был снят с источника тепла (рис. 3.60б). Чтобы устранить эту проблему, твердое вещество снова помещали на паровую баню, добавляли дополнительное количество метанола (растворимый растворитель), доводили до кипения для растворения твердого вещества и затем охлаждали. Затем твердое вещество начало кристаллизоваться намного медленнее (рис. 3.60c), для полной кристаллизации потребовалось 15 минут.
3.60а) приводило к немедленному выпадению твердого вещества из раствора при раствор был снят с источника тепла (рис. 3.60б). Чтобы устранить эту проблему, твердое вещество снова помещали на паровую баню, добавляли дополнительное количество метанола (растворимый растворитель), доводили до кипения для растворения твердого вещества и затем охлаждали. Затем твердое вещество начало кристаллизоваться намного медленнее (рис. 3.60c), для полной кристаллизации потребовалось 15 минут.
- Если минимальное количество горячего растворителя, необходимое для растворения твердого вещества, достигает высоты менее \(1 \: \text{см}\) в колбе, возможно, колба слишком велика для кристаллизации.
 Неглубокий бассейн с растворителем имеет большую площадь поверхности, что приводит к быстрому охлаждению. Перенесите раствор в колбу меньшего размера (используя некоторое количество растворителя для ополаскивания колбы, а затем выкипятите такое же количество растворителя, которое использовалось для ополаскивания) и повторите кристаллизацию.
Неглубокий бассейн с растворителем имеет большую площадь поверхности, что приводит к быстрому охлаждению. Перенесите раствор в колбу меньшего размера (используя некоторое количество растворителя для ополаскивания колбы, а затем выкипятите такое же количество растворителя, которое использовалось для ополаскивания) и повторите кристаллизацию. - Обязательно используйте часовое стекло поверх колбы Эрленмейера, чтобы удерживать тепло, и поставьте колбу на какой-либо материал, чтобы изолировать дно (несколько бумажных полотенец, деревянный брусок или пробковое кольцо). Можно также попробовать использовать перевернутый химический стакан для создания изолирующей атмосферы вокруг охлаждающей колбы.
Кристаллизация не происходит
Оставить растворенный раствор для охлаждения и полного отсутствия кристаллов может быть довольно неприятно. Методы инициирования кристаллизации подробно обсуждались ранее. Подводя итог, вот методы, которые можно попробовать (в иерархическом порядке) для формирования кристаллов в зависимости от внешнего вида раствора:
- Если раствор мутный, поскребите колбу стеклянной палочкой.

- Если раствор прозрачный,
- Сначала попробуйте поцарапать колбу стеклянной палочкой.
- Добавьте затравочный кристалл (небольшое пятнышко неочищенного твердого вещества, оставшееся до начала кристаллизации, или немного чистого твердого вещества из сосуда с реагентом).
- Окуните в раствор стеклянную палочку для перемешивания, выньте ее и дайте растворителю испариться, чтобы на палочке образовался тонкий остаток кристаллов (рис. 3.61). Затем коснитесь стержнем поверхности раствора или перемешайте раствор стержнем, чтобы удалить мелкие затравочные кристаллы.
- Верните раствор к источнику тепла, выпарите часть растворителя (возможно, половину), затем снова охладите.
- Понизьте температуру охлаждающей ванны.
- Если видно очень мало кристаллов, вероятно, слишком много растворителя. Верните раствор к источнику тепла и выпарите часть растворителя, затем снова охладите.

- Если ничего не помогает, растворитель всегда можно удалить с помощью роторного испарителя, чтобы восстановить неочищенное твердое вещество. Можно попытаться провести еще одну кристаллизацию, возможно, с другой системой растворителей.
Низкий выход
Кристаллизация может привести к очень низкому выходу (например, менее \(20\%\)). Это может произойти по нескольким причинам:
- Возможно, во время кристаллизации было использовано слишком много растворителя, и поэтому большое количество соединения было потеряно с маточным раствором. Если маточный раствор (фильтрат после вакуумной фильтрации) не удаляли, это можно проверить, погрузив стеклянную палочку для перемешивания в маточный раствор и дав ему высохнуть. Если растворитель испаряется, оставляя на стержне большой осадок, в растворе остается много соединения. Дополнительное соединение может быть извлечено путем выпаривания части растворителя и повторения кристаллизации (это называется «кристаллизацией второй порции») или путем удаления всего растворителя путем ротационного испарения и повторения кристаллизации с другим растворителем.

- Возможно, было использовано слишком много растворителя при попытке растворить полунерастворимые примеси. Если бы это было так, то можно было бы попытаться удалить примеси с помощью горячей фильтрации. (Твердое вещество должно быть сначала извлечено из маточного раствора с помощью роторного выпаривания, чтобы попытаться снова провести кристаллизацию.)
- Возможно, для обесцвечивания раствора было использовано слишком много древесного угля (черный как смоль раствор содержит слишком много древесного угля). Слишком большое количество древесного угля снижает выход, поскольку древесный уголь может адсорбировать желаемое соединение вместе с примесями. Невозможно восстановить продукт после его адсорбции древесным углем.
- Если использовалась стадия горячей фильтрации, соединение могло быть потеряно в фильтровальной бумаге и/или на ножке воронки. Кроме того, возможно, было использовано слишком много растворителя при добавлении порции, чтобы разогреть систему перед фильтрацией.
 Дополнительный растворитель перед фильтрацией добавляется к «минимальному количеству горячего растворителя» и, если его значительный избыток, может вызвать потерю соединения с маточным раствором.
Дополнительный растворитель перед фильтрацией добавляется к «минимальному количеству горячего растворителя» и, если его значительный избыток, может вызвать потерю соединения с маточным раствором. - Если нечистое твердое вещество было продуктом химической реакции, возможно, эта реакция не удалась. Это можно было бы оценить, если бы была получена сырая масса: если сырая масса изначально была очень низкой, то низкий выход кристаллизованного продукта был вызван проблемами с реакцией, а не с кристаллизацией.
Если неочищенная масса не была получена, можно использовать оценку приблизительных объемов твердого вещества до и после кристаллизации. Если бы объемы были одинаковыми, потеря выхода могла бы быть не из-за проблем с кристаллизацией. Обратите внимание, что кристаллизованные твердые вещества, как правило, намного «пушистее», чем неочищенные твердые вещества (рис. 3.62), поэтому «на глазок» твердые объемы являются лишь очень грубой оценкой количества.
 3.62: Две \(6,5 \: \text{мг}\) пробы бензила: (слева) из банки с реагентом, (справа) кристаллизованная проба.
3.62: Две \(6,5 \: \text{мг}\) пробы бензила: (слева) из банки с реагентом, (справа) кристаллизованная проба.Форма капель жидкости (твердое «масло выходит»)
При охлаждении соединение может выйти из раствора в виде жидкости, а не твердого вещества (рис. 3.63). Этот процесс называется «промасливанием» и происходит, когда температура плавления твердого вещества ниже температуры раствора. Это проблема кристаллизации, потому что, когда соединения сначала разжижаются, они редко образуют чистые кристаллы. Это связано с тем, что примеси часто лучше растворяются в каплях жидкости, чем в растворителе. На рис. 3.63c показан образец сырого ацетанилида, который промаслен (капли представляют собой неочищенный жидкий ацетанилид), и образец загрязнен примесью метилового красного (который кажется красным при низком pH раствора, артефакт того, как сырой синтезировано твердое вещество). Маслянистые капли ацетанилида кажутся более окрашенными, чем раствор, что указывает на большее количество растворенной примеси метилового красного. Если промасленная жидкость в конечном итоге затвердевает, она часто образует нечистое стеклоподобное некристаллическое твердое вещество.
Если промасленная жидкость в конечном итоге затвердевает, она часто образует нечистое стеклоподобное некристаллическое твердое вещество.
Причин вымачивания несколько, и это может произойти при растворении твердого вещества и во время кристаллизации. Может случиться так, что температура плавления твердого вещества естественно низкая. Также может случиться так, что твердое вещество настолько загрязнено, что его температура плавления резко снижается (поскольку примеси снижают температуру плавления).
Есть несколько способов исправить замасленный раствор:
- Верните образец к источнику тепла и добавьте еще немного растворителя, затем снова охладите раствор. (При использовании смешанной системы растворителей добавьте больше «растворимого растворителя»). Твердое вещество могло выходить из раствора слишком быстро (и, следовательно, при температуре выше его точки плавления), поэтому оно может оставаться растворимым дольше, если растворителя больше.

- Добавьте шаг древесного угля, если он еще не был частью кристаллизации. Твердое вещество может плавиться из-за большого количества примесей, которые можно удалить с помощью древесного угля. Это особенно может сработать, если в горячем растворе заметен цветной оттенок.
Если какой-либо из этих методов не работает, извлеките неочищенное твердое вещество с помощью роторного выпаривания и повторите попытку кристаллизации. Если в неудачной попытке использовался смешанный растворитель, попробуйте, если возможно, один растворитель. Или выбрать другой растворитель с аналогичными свойствами растворимости, но с более низкой температурой кипения. Например, если в качестве растворителя в первый раз использовали этанол, повторите кристаллизацию с использованием метанола. Метанол обладает такими же свойствами растворимости, как и этанол, но его более низкая температура кипения может позволить твердому веществу выйти из раствора выше его температуры плавления.
Эта страница под названием 3. 6F: Устранение неполадок распространяется под лицензией CC BY-NC-ND и была создана, изменена и/или курирована Лизой Николс с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
6F: Устранение неполадок распространяется под лицензией CC BY-NC-ND и была создана, изменена и/или курирована Лизой Николс с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Лиза Николс
- Лицензия
- CC BY-NC-ND
- Показать страницу TOC
- № на стр.
- Включено
- да
- Теги
- источник@https://organiclabtechniques.
 weebly.com/
weebly.com/ - источник[1]-chem-95771
- источник@https://organiclabtechniques.
Как быстро идентифицировать и контролировать примеси в лекарствах с помощью целостного подхода
Выделение и идентификация примесей в активных фармацевтических ингредиентах (АФИ) и фармацевтических лекарственных продуктах (ЛП) является критическим аспектом процесса разработки.
Наиболее очевидной причиной может быть необходимость соблюдения рекомендаций по качеству, изложенных ICH (Международная конференция по гармонизации) и принятых регулирующими органами во всем мире. Но сильный и ранний контроль примесей также имеет смысл для бизнеса.
Почему?
Поскольку примеси могут иметь серьезные негативные последствия для вашего продукта во время разработки лекарств и в дальнейшем.
- Они могут усложнить рецептуру, увеличить сроки разработки и повлиять на срок годности из-за роста продуктов разложения.
- Неквалифицированные примеси, даже на очень низком уровне, могут представлять неизвестный риск для здоровья пациентов, которые используют ваш готовый фармацевтический продукт.

Было бы дорого отказаться от партий в процессе разработки. Но когда обнаруживаются ранее необнаруженные примеси после утверждения , это может привести к массовому отзыву продукта и потенциальной опасности для пациентов. Например, недавние случаи обнаружения примесей нитрозаминов в API блокаторов рецепторов ангиотензина II [ARB] привели к массовым отзывам продукции по всему миру. Гораздо лучше обнаруживать, идентифицировать и контролировать примеси как можно раньше.
Предпримите активные шаги для контроля за примесямиНеобходимо понимать образование примесей и затем контролировать его во время разработки и последующих масштабов. Выявление образования примесей на ранней стадии развития может избежать осложнений на более поздних и более дорогостоящих стадиях. Конкретные этапы включают:
- оценку чистоты исходного материала.
- минимизирует уровень примесей в процессах синтеза и производства.
- , идентифицирующие примесные структуры.

- выделение и синтез примесей для квалификации в исследованиях токсичности.
- мониторинг стабильности API и DP для обнаружения продуктов деградации.
Самый быстрый и недорогой способ определить потенциальные примеси — тесно сотрудничать с вашей контрактной организацией по разработке и производству (CDMO). У них есть опыт изоляции и идентификации примесей, а также знания процессов для быстрого решения любых возникающих проблем. У них также есть обширные знания в области химии и разведки маршрутов, а также доступ к промежуточным продуктам, маточным растворам, фильтратам и другим ресурсам, которые могут понадобиться для поиска подходящего решения.
Мы обнаружили, что этапы проекта, основанные на целостном подходе к идентификации примесей, обеспечивают самые быстрые и экономически эффективные результаты. В Regis, например, это достигается за счет тесного сотрудничества между нашими группами аналитической химии и технологической химии.
Мы также используем программное обеспечение Luminata — среду корпоративного уровня, разработанную специально для управления данными о примесях, — чтобы отслеживать судьбу примесей и исследования очистки, а также отслеживать историю партий и проектов.
Целостный подход, основанный на фазах проекта, состоит из различных действий, которые происходят на разных стадиях проекта. На ранней стадии разработки лекарств наши специалисты-аналитики и технологи начинают с изучения химического процесса и сообщают о возможных примесях. Это может быть вызвано использованием определенных растворителей или реагентов или последовательностью выбранного синтетического пути.
Поскольку пути синтеза обычно не фиксируются на ранних стадиях разработки, оптимизация условий реакции для сведения к минимуму примесей, особенно потенциальных генотоксичных примесей (PGI), обеспечивает наибольшую выгоду для проекта. На этом этапе оцениваются контроль профиля примесей и понимание взаимосвязи между условиями синтетической реакции и изменениями в профиле примесей.
На более поздних стадиях разработки лекарств необходимо устранить все примеси как в АФИ, так и в ДП, которые превышают уровни идентификации и квалификации. Нормативные рекомендации определяют приемлемый уровень примеси на основе токсикологических исследований на животных, оценки in-silico , потенциальной токсичности и максимальной суточной дозы API для человека.
Нормативные рекомендации определяют приемлемый уровень примеси на основе токсикологических исследований на животных, оценки in-silico , потенциальной токсичности и максимальной суточной дозы API для человека.
Первым шагом контроля примесей является получение точного и надежного профиля примесей API или DP. Необходим хороший метод ВЭЖХ, показывающий стабильность. Метод должен быть специфическим, чтобы все примеси были хорошо отделены друг от друга и не скрывались за основным пиком АФИ.
Идентификация примесей Профили примесей для каждого этапа синтетического маршрута должны отслеживаться и управляться инструментами управления данными, такими как программное обеспечение Luminata. При необходимости группы модифицируют аналитический метод в соответствии со спецификой любых примесей. Например, жидкостная хроматография/масс-спектрометрия (ЖХ/МС) может дополнять ВЭЖХ (высокоэффективную жидкостную хроматографию) для получения масс-спектра каждой интересующей примеси. Эксперимент с жидкостной хроматографией и масс-спектрометрией высокого разрешения может быстро получить информацию о каждой примеси.
Эксперимент с жидкостной хроматографией и масс-спектрометрией высокого разрешения может быстро получить информацию о каждой примеси.
Затем химики-аналитики и химики-технологи работают вместе, чтобы проверить соответствие программного обеспечения масс-спектрометрии высокого разрешения (HRMS), чтобы сузить количество значимых структур, связанных с реакцией. Этот быстрый и гибкий подход обычно значительно сокращает количество подозрительных структур. Для дальнейшего подтверждения структуры примеси будет проведено выделение примеси с помощью препаративной ВЭЖХ или SFC, чтобы получить достаточное количество примеси для ЯМР-анализа.
Эти результаты и предлагаемые структуры примесей часто перепроверяются путем синтеза потенциальной примеси с использованием подтверждения ортогональной структуры. Это повышает достоверность предлагаемой структуры примесей и часто требуется как часть подачи NDA (заявки на новое лекарство). Затем может происходить синтез каждой примеси в граммовом масштабе — если это необходимо — для квалификации токсичности в соответствии с Надлежащей лабораторной практикой (GLP).
Хранение и анализ стабильности являются очень важными частями общей стратегии контроля примесей. Примеси возникают не только в процессе синтеза АФИ, но также могут увеличиваться при хранении АФИ и ДП. Новые продукты деградации могут быть обнаружены на более поздних стадиях разработки лекарств. Это может вызвать серьезные осложнения с DP из-за взаимодействия API с вспомогательной матрицей или материалами для укупорки контейнера – даже при очень низких уровнях.
Выявление потенциальных проблем со стабильностью API или DP должно происходить как можно раньше во время разработки. Как правило, хорошо спланированные эксперименты по принудительной деградации используются для получения примесей, известных как продукты деградации. Как только пути образования продуктов разложения обнаружены и поняты, команда разработчиков может скорректировать рецептуру, упаковку или условия хранения DP, чтобы свести к минимуму их воздействие.
После выявления примесей мы гарантируем, что у аналитической группы есть обратная связь с группой технологической химии. Точные шаги варьируются в зависимости от конкретных задач проекта.
Например, общение между группами может повлиять на химический процесс или поставку исходного материала. Но независимо от конкретного процесса сотрудничество является ключом к разработке воспроизводимого решения.
В такой среде совместной работы аналитическая группа имеет немедленный доступ к промежуточным продуктам, фильтратам и решениям после кристаллизации. Кроме того, наша группа по синтезу может генерировать большинство примесей в граммовом масштабе, если это необходимо для аналитической работы в качестве эталонных добавок для разработки аналитических методов. Точное отслеживание профиля примесей обеспечивают качественные аналитические разработки и отделы контроля качества.
Хотя идентификация примесей может выполняться исключительно химиками-аналитиками без сотрудничества с химиками технологического процесса, наша аналитическая группа считает, что все проходит гораздо более гладко, когда они могут работать напрямую с группой химиков технологического процесса.
В Regis функции аналитической химии и технологической химии сосуществуют в одном месте. Это оказывает огромное положительное влияние на управление примесями в API и DP. В этих автономных проектах идентификации примесей обычно требуется больше времени для получения необходимой синтетической информации о процессе от клиентов. В этих случаях некоторые промежуточные продукты процесса и маточные растворы, необходимые для всестороннего анализа, могут отсутствовать. Наш опыт показывает, что более совместный подход, описанный выше, быстрее, точнее и менее затратен как в краткосрочной, так и в долгосрочной перспективе.
Оптимизация процессаСнова и снова комплексный подход, который мы описали выше, доказывает, что он является самым быстрым и наименее затратным способом выявления примесей и управления ими , сводя к минимуму препятствия на протяжении всего цикла разработки лекарств.
Мы также еще больше упростили этот процесс, применив междисциплинарный подход — объединив наши химические производственные и аналитические группы на одном предприятии и поощряя сотрудничество между командами.

 Какую массу серы надо взять, если:
Какую массу серы надо взять, если: у.). Найдите массовую долю (%) примесей в карбиде.
у.). Найдите массовую долю (%) примесей в карбиде.
 3.60а) приводило к немедленному выпадению твердого вещества из раствора при раствор был снят с источника тепла (рис. 3.60б). Чтобы устранить эту проблему, твердое вещество снова помещали на паровую баню, добавляли дополнительное количество метанола (растворимый растворитель), доводили до кипения для растворения твердого вещества и затем охлаждали. Затем твердое вещество начало кристаллизоваться намного медленнее (рис. 3.60c), для полной кристаллизации потребовалось 15 минут.
3.60а) приводило к немедленному выпадению твердого вещества из раствора при раствор был снят с источника тепла (рис. 3.60б). Чтобы устранить эту проблему, твердое вещество снова помещали на паровую баню, добавляли дополнительное количество метанола (растворимый растворитель), доводили до кипения для растворения твердого вещества и затем охлаждали. Затем твердое вещество начало кристаллизоваться намного медленнее (рис. 3.60c), для полной кристаллизации потребовалось 15 минут. Неглубокий бассейн с растворителем имеет большую площадь поверхности, что приводит к быстрому охлаждению. Перенесите раствор в колбу меньшего размера (используя некоторое количество растворителя для ополаскивания колбы, а затем выкипятите такое же количество растворителя, которое использовалось для ополаскивания) и повторите кристаллизацию.
Неглубокий бассейн с растворителем имеет большую площадь поверхности, что приводит к быстрому охлаждению. Перенесите раствор в колбу меньшего размера (используя некоторое количество растворителя для ополаскивания колбы, а затем выкипятите такое же количество растворителя, которое использовалось для ополаскивания) и повторите кристаллизацию.


 Дополнительный растворитель перед фильтрацией добавляется к «минимальному количеству горячего растворителя» и, если его значительный избыток, может вызвать потерю соединения с маточным раствором.
Дополнительный растворитель перед фильтрацией добавляется к «минимальному количеству горячего растворителя» и, если его значительный избыток, может вызвать потерю соединения с маточным раствором.
 weebly.com/
weebly.com/
