В России появятся генетические паспорта. Кому их выдадут и что внутри
https://ria.ru/20190425/1553009840.html
В России появятся генетические паспорта. Кому их выдадут и что внутри
В России появятся генетические паспорта. Кому их выдадут и что внутри
В марте Владимир Путин подписал указ № 97 о генетической паспортизации и составлении генетического профиля населения. Это повысит химическую и биологическую… РИА Новости, 27.11.2019
2019-04-25T08:00
2019-04-25T08:00
2019-11-27T12:36
муковисцидоз
днк
санкт-петербург
наука
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn22.img.ria.ru/images/155297/43/1552974353_0:116:1152:764_1920x0_80_0_0_254c039d0ccefb9337b690784b42e3c6.jpg
МОСКВА, 25 апр — РИА Новости, Татьяна Пичугина. В марте Владимир Путин подписал указ № 97 о генетической паспортизации и составлении генетического профиля населения. Это повысит химическую и биологическую безопасность государства. В Международный день ДНК РИА Новости вместе с экспертами рассказывает, что такое генетический паспорт и какая информация в нем записана. Чем различаются ДНК людейДНК — это длинная молекула дезоксирибонуклеиновой кислоты, которая содержится в ядре каждой клетки организма. Она состоит из цепочки оснований, или нуклеотидов, четырех видов, их обозначают буквами: А (аденин), Т (тимин), Г (гуанин), Ц (цитозин). Химический состав молекулы жизни одинаков у всех существ, а вот длина и строение различаются. Какие-то части — общие всему живому на Земле, какие-то — родам, видам, отдельным популяциям. У людей ДНК примерно на 99,9 процента одинакова. Различия заметны, если анализировать маленькие цепочки нуклеотидов. Выясняется, что у одних разная длина, у других — последовательности букв, расположение, число повторов на хромосоме. По этим нюансам можно безошибочно отличить людей (и вообще любых особей), даже если они прямые родственники. Полностью одинаковый генетический текст только у гомозиготных близнецов, да и то в момент рождения, поскольку они — результат деления одной оплодотворенной яйцеклетки. По мере взросления у близнецов возникают мутации в группах клеток, по которым можно идентифицировать личность. Для анализа достаточно крошечного образца слюны, крови и любой биологически жидкости, где содержится пара десятков молекул ДНК. Их выделяют, размножают с помощью полимеразной цепной реакции и расшифровывают несколько участков в определенных хромосомах, которые у людей мутируют чаще всего. Результат представляет собой набор букв и цифр. Информацию об особенностях ДНК человека называют генетическим паспортом. Это может быть генетический “отпечаток пальца”, то есть набор уникальных маркеров, информация о мутациях, указывающая на этническое происхождение, точнее на регион, откуда происходят предки, в редких случаях — информация об особенностях внешнего вида. Туда же включают сведения о предрасположенности к наследственным заболеваниям. Как рассказала РИА Новости Светлана Боринская, заведующая лабораторией анализа генома Института общей генетики имени Н. И. Вавилова РАН, ДНК-идентификацию применяют в криминалистике с 1990 годов, сейчас — повсеместно. “С 2008 года действует федеральный закон “О государственной геномной регистрации в Российской Федерации”, в котором определен круг лиц, обязательно подлежащих этой процедуре. В первую очередь это осужденные за тяжкие преступления, изнасилования. Их генетический профиль поступает в базу данных и там сравнивается с ДНК неопознанных образцов с места преступлений. Это помогло раскрыть очень давние преступления, совершенные десятки лет назад”, — говорит эксперт. По ее словам, аналогичный закон в ряде стран применяют в отношении служащих, чья профессия связана с повышенным риском для жизни, например, военных, сотрудников спецслужб, пожарных. Это позволяет в случае гибели быстро идентифицировать останки. Еще одно направление — идентификация жертв стихийных бедствий, терактов.
Полностью одинаковый генетический текст только у гомозиготных близнецов, да и то в момент рождения, поскольку они — результат деления одной оплодотворенной яйцеклетки. По мере взросления у близнецов возникают мутации в группах клеток, по которым можно идентифицировать личность. Для анализа достаточно крошечного образца слюны, крови и любой биологически жидкости, где содержится пара десятков молекул ДНК. Их выделяют, размножают с помощью полимеразной цепной реакции и расшифровывают несколько участков в определенных хромосомах, которые у людей мутируют чаще всего. Результат представляет собой набор букв и цифр. Информацию об особенностях ДНК человека называют генетическим паспортом. Это может быть генетический “отпечаток пальца”, то есть набор уникальных маркеров, информация о мутациях, указывающая на этническое происхождение, точнее на регион, откуда происходят предки, в редких случаях — информация об особенностях внешнего вида. Туда же включают сведения о предрасположенности к наследственным заболеваниям. Как рассказала РИА Новости Светлана Боринская, заведующая лабораторией анализа генома Института общей генетики имени Н. И. Вавилова РАН, ДНК-идентификацию применяют в криминалистике с 1990 годов, сейчас — повсеместно. “С 2008 года действует федеральный закон “О государственной геномной регистрации в Российской Федерации”, в котором определен круг лиц, обязательно подлежащих этой процедуре. В первую очередь это осужденные за тяжкие преступления, изнасилования. Их генетический профиль поступает в базу данных и там сравнивается с ДНК неопознанных образцов с места преступлений. Это помогло раскрыть очень давние преступления, совершенные десятки лет назад”, — говорит эксперт. По ее словам, аналогичный закон в ряде стран применяют в отношении служащих, чья профессия связана с повышенным риском для жизни, например, военных, сотрудников спецслужб, пожарных. Это позволяет в случае гибели быстро идентифицировать останки. Еще одно направление — идентификация жертв стихийных бедствий, терактов. Погибших опознают, сравнивая их образцы с ДНК близких родственников. Пионеры персонализированной медициныПонятие “генетический паспорт” ввели в научный оборот в 2000 году ученые из лаборатории пренатальной диагностики наследственных и врожденных заболеваний НИИ акушерства, гинекологии и репродуктологии имени Д. О. Отта (Санкт-Петербург) в книге о предиктивной, то есть предсказательной медицине. Ее первое издание теперь библиографическая редкость. “Сейчас генетический паспорт предлагают составить коммерческие фирмы как платную услугу”, — комментирует РИА Новости генетик Владислав Баранов, член-корреспондент РАН, профессор, один из авторов той книги. Вообще-то, он и его коллеги под генетическим паспортом понимали информацию из ДНК, которая поможет сохранить здоровье данному человеку и его потомкам. Это сведения о мутациях, приводящих к опасным заболеваниям, результаты медико-генетического консультирования, кариотип, то есть полный хромосомный набор, серия тестов, направленных на то, чтобы гарантировать рождение здорового ребенка. Ученые предлагали тестирование примерно на десять опасных наследственных заболеваний. Причем человек может быть носителем мутаций, вызывающих болезнь, и не знать, что он в группе риска. “Сюда же относятся мутации, связанные с наследственными опухолями. Очень важно тестировать на них при рождении, чтобы человек был в курсе такой предрасположенности и получал соответствующую профилактику. Еще одна группа мутаций проявляется, только если у супруга или супруги есть нарушения в том же гене. Тогда вероятность тяжелого заболевания у потомства, нередко смертельного, вырастает до 25 процентов. Но мы можем это предотвратить”, — поясняет ученый. По его словам, генетическая паспортизация очень полезна. Это общемировой тренд. Можно сравнить с диспансеризацией, которую проходят раз в два года, или, к примеру, с необходимостью знать группу крови, резус-принадлежность. Учитывая огромное число уже известных наследственных болезней и болезней с выраженной наследственной предрасположенностью (онкологические заболевания, диабет, ожирение и многие другие) правильнее говорить об электронной генетической карте здоровья, уточняет профессор Баранов.
Погибших опознают, сравнивая их образцы с ДНК близких родственников. Пионеры персонализированной медициныПонятие “генетический паспорт” ввели в научный оборот в 2000 году ученые из лаборатории пренатальной диагностики наследственных и врожденных заболеваний НИИ акушерства, гинекологии и репродуктологии имени Д. О. Отта (Санкт-Петербург) в книге о предиктивной, то есть предсказательной медицине. Ее первое издание теперь библиографическая редкость. “Сейчас генетический паспорт предлагают составить коммерческие фирмы как платную услугу”, — комментирует РИА Новости генетик Владислав Баранов, член-корреспондент РАН, профессор, один из авторов той книги. Вообще-то, он и его коллеги под генетическим паспортом понимали информацию из ДНК, которая поможет сохранить здоровье данному человеку и его потомкам. Это сведения о мутациях, приводящих к опасным заболеваниям, результаты медико-генетического консультирования, кариотип, то есть полный хромосомный набор, серия тестов, направленных на то, чтобы гарантировать рождение здорового ребенка. Ученые предлагали тестирование примерно на десять опасных наследственных заболеваний. Причем человек может быть носителем мутаций, вызывающих болезнь, и не знать, что он в группе риска. “Сюда же относятся мутации, связанные с наследственными опухолями. Очень важно тестировать на них при рождении, чтобы человек был в курсе такой предрасположенности и получал соответствующую профилактику. Еще одна группа мутаций проявляется, только если у супруга или супруги есть нарушения в том же гене. Тогда вероятность тяжелого заболевания у потомства, нередко смертельного, вырастает до 25 процентов. Но мы можем это предотвратить”, — поясняет ученый. По его словам, генетическая паспортизация очень полезна. Это общемировой тренд. Можно сравнить с диспансеризацией, которую проходят раз в два года, или, к примеру, с необходимостью знать группу крови, резус-принадлежность. Учитывая огромное число уже известных наследственных болезней и болезней с выраженной наследственной предрасположенностью (онкологические заболевания, диабет, ожирение и многие другие) правильнее говорить об электронной генетической карте здоровья, уточняет профессор Баранов. Не исключено, что медицинское содержание отчасти вкладывается и в понятие генетического профиля населения, которое фигурирует в президентском указе № 97. “Думаю, это определение, в конечном счете, относится к группе риска по тем болезням, к которым каждый из нас, увы, предрасположен уже при рождении. Достаточно вспомнить, какие хронические заболевания имеют или имели родители, чтобы понять, к какой группе риска вы скорее всего относитесь. А уточнить генетический профиль семьи или собственную предрасположенность к различным частым болезням можно с помошью генетического анализа. Благодаря ему каждая семья, каждый человек может узнать об уникальных особенностях своего генома, получить свой электронный генетический паспорт здоровья, который принципиально важен не только для самого человека, но его детей”, — предполагает генетик. Гены расскажут о здоровье”По сути, сейчас нечто вроде паспорта делают каждому новорожденному, просто не раздают. Во всех наших роддомах детям проводят скрининг на пять наследственных заболеваний, встречающихся у одного на несколько тысяч человек (это не так уж редко). Если начать лечение загодя, ребенок вырастет здоровым”, — говорит Светлана Боринская. ДНК новорожденных исследуют на адреногенитальный синдром, галактоземию, врожденный гипотиреоз, муковисцидоз, фенилкетонурию. Список планируют расширить до 23 скринируемых болезней.Известно более пяти тысяч наследственных заболеваний. Большинство очень редкие, и проводить скрининг на все не нужно. Для нескольких сотен из них разработаны методы диагностики и имеется эффективное . “Не все эти мутации однозначно вызывают заболевание. Важно знать, с какой вероятностью это произойдет. Например, мать и тетя американской актрисы Анджелины Джоли умерли от рака груди. Она сделала анализ ДНК, и у нее нашли мутацию, которая в восьмидесяти процентах случаев ведет к этой болезни. Джоли решилась на профилактическую операцию, удалила грудь. Иначе пришлось бы раз в три месяца проверяться, поскольку непонятно, когда болезнь возникнет.
Не исключено, что медицинское содержание отчасти вкладывается и в понятие генетического профиля населения, которое фигурирует в президентском указе № 97. “Думаю, это определение, в конечном счете, относится к группе риска по тем болезням, к которым каждый из нас, увы, предрасположен уже при рождении. Достаточно вспомнить, какие хронические заболевания имеют или имели родители, чтобы понять, к какой группе риска вы скорее всего относитесь. А уточнить генетический профиль семьи или собственную предрасположенность к различным частым болезням можно с помошью генетического анализа. Благодаря ему каждая семья, каждый человек может узнать об уникальных особенностях своего генома, получить свой электронный генетический паспорт здоровья, который принципиально важен не только для самого человека, но его детей”, — предполагает генетик. Гены расскажут о здоровье”По сути, сейчас нечто вроде паспорта делают каждому новорожденному, просто не раздают. Во всех наших роддомах детям проводят скрининг на пять наследственных заболеваний, встречающихся у одного на несколько тысяч человек (это не так уж редко). Если начать лечение загодя, ребенок вырастет здоровым”, — говорит Светлана Боринская. ДНК новорожденных исследуют на адреногенитальный синдром, галактоземию, врожденный гипотиреоз, муковисцидоз, фенилкетонурию. Список планируют расширить до 23 скринируемых болезней.Известно более пяти тысяч наследственных заболеваний. Большинство очень редкие, и проводить скрининг на все не нужно. Для нескольких сотен из них разработаны методы диагностики и имеется эффективное . “Не все эти мутации однозначно вызывают заболевание. Важно знать, с какой вероятностью это произойдет. Например, мать и тетя американской актрисы Анджелины Джоли умерли от рака груди. Она сделала анализ ДНК, и у нее нашли мутацию, которая в восьмидесяти процентах случаев ведет к этой болезни. Джоли решилась на профилактическую операцию, удалила грудь. Иначе пришлось бы раз в три месяца проверяться, поскольку непонятно, когда болезнь возникнет. А потом сразу начать лечение. И еще неизвестно, насколько удачным оно будет. Все эти риски снимает профилактическая операция”, — приводит Боринская пример того, как можно использовать информацию о генетической предрасположенности к смертельным заболеваниям. Что касается болезней, риск которых сильно зависит от одной мутации, здесь все более-менее ясно. В большинстве же случаев вклад генов незначителен, порядка 15-20 процентов. “Для большинства болезней врачи дают сходные рекомендации: не ешьте острого, соленого, жирного, поддерживайте высокую физическую активность, не злоупотребляйте спиртным, не курите, не подвергайтесь сильным стрессам. Но при наличии определенных вариантов генов требуется более жестко соблюдать эти условия”, — добавляет исследователь. Например, в 2005 году ВОЗ рекомендовала обследовать группы риска на предмет мутации в гене F5 (FV) — важного фактора возникновения венозного тромбоза. Под защитой законаНужна ли обязательная генетическая паспортизация? Ученые предлагают гибко подходить к этому вопросу, поскольку уже сейчас достаточно много людей не хотят знать о генетических рисках для своего здоровья. “На мой взгляд, следует значительно расширить консультации с врачами-генетиками, которые могут определить наиболее рациональную форму составления генетического паспорта, целесообразность его, оценить круг тех, для кого он обязателен. Надо решать много привходящих вопросов: кто получит доступ к этой информации, как ее использовать в практическом здравоохранении для пользы каждого человека. Многое еще неясно”, — заключает Владислав Баранов. “Индивидуальную генетическую паспортизацию необходимо развивать, это не вызывает сомнений. Для этого потребуется усовершенствовать методику, а также законодательство, обсудить этические вопросы. Генетическая информация должна быть столь же тайной, как любые медицинские сведения о человеке, на которые распространяется закон о защите персональных данных. Недаром на профильных международных конференциях обязательно устраивают секцию по этическим, юридическим и социальным аспектам геномных исследований”, — подчеркивает Боринская.
А потом сразу начать лечение. И еще неизвестно, насколько удачным оно будет. Все эти риски снимает профилактическая операция”, — приводит Боринская пример того, как можно использовать информацию о генетической предрасположенности к смертельным заболеваниям. Что касается болезней, риск которых сильно зависит от одной мутации, здесь все более-менее ясно. В большинстве же случаев вклад генов незначителен, порядка 15-20 процентов. “Для большинства болезней врачи дают сходные рекомендации: не ешьте острого, соленого, жирного, поддерживайте высокую физическую активность, не злоупотребляйте спиртным, не курите, не подвергайтесь сильным стрессам. Но при наличии определенных вариантов генов требуется более жестко соблюдать эти условия”, — добавляет исследователь. Например, в 2005 году ВОЗ рекомендовала обследовать группы риска на предмет мутации в гене F5 (FV) — важного фактора возникновения венозного тромбоза. Под защитой законаНужна ли обязательная генетическая паспортизация? Ученые предлагают гибко подходить к этому вопросу, поскольку уже сейчас достаточно много людей не хотят знать о генетических рисках для своего здоровья. “На мой взгляд, следует значительно расширить консультации с врачами-генетиками, которые могут определить наиболее рациональную форму составления генетического паспорта, целесообразность его, оценить круг тех, для кого он обязателен. Надо решать много привходящих вопросов: кто получит доступ к этой информации, как ее использовать в практическом здравоохранении для пользы каждого человека. Многое еще неясно”, — заключает Владислав Баранов. “Индивидуальную генетическую паспортизацию необходимо развивать, это не вызывает сомнений. Для этого потребуется усовершенствовать методику, а также законодательство, обсудить этические вопросы. Генетическая информация должна быть столь же тайной, как любые медицинские сведения о человеке, на которые распространяется закон о защите персональных данных. Недаром на профильных международных конференциях обязательно устраивают секцию по этическим, юридическим и социальным аспектам геномных исследований”, — подчеркивает Боринская. По ее сведениям, в России в прошлом году поддержано около сорока проектов РФФИ по анализу правового регулирования геномных исследований. Предстоит прояснить, кто обязан сдавать образцы для генетического профиля, кто может отказаться, в каких ситуациях нужна геномная регистрация, как соблюдается конфиденциальность.
По ее сведениям, в России в прошлом году поддержано около сорока проектов РФФИ по анализу правового регулирования геномных исследований. Предстоит прояснить, кто обязан сдавать образцы для генетического профиля, кто может отказаться, в каких ситуациях нужна геномная регистрация, как соблюдается конфиденциальность.
https://ria.ru/20190308/1551632924.html
https://ria.ru/20190220/1551093098.html
https://ria.ru/20190207/1550431030.html
санкт-петербург
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn22.img.ria.ru/images/155297/43/1552974353_0:8:1152:872_1920x0_80_0_0_cd2e4d73721d311745511a9ed80c62a1.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
муковисцидоз, днк, санкт-петербург
МОСКВА, 25 апр — РИА Новости, Татьяна Пичугина. В марте Владимир Путин подписал указ № 97 о генетической паспортизации и составлении генетического профиля населения. Это повысит химическую и биологическую безопасность государства. В Международный день ДНК РИА Новости вместе с экспертами рассказывает, что такое генетический паспорт и какая информация в нем записана.
Чем различаются ДНК людей
ДНК — это длинная молекула дезоксирибонуклеиновой кислоты, которая содержится в ядре каждой клетки организма. Она состоит из цепочки оснований, или нуклеотидов, четырех видов, их обозначают буквами: А (аденин), Т (тимин), Г (гуанин), Ц (цитозин).
Она состоит из цепочки оснований, или нуклеотидов, четырех видов, их обозначают буквами: А (аденин), Т (тимин), Г (гуанин), Ц (цитозин).
Химический состав молекулы жизни одинаков у всех существ, а вот длина и строение различаются.
Какие-то части — общие всему живому на Земле, какие-то — родам, видам, отдельным популяциям. У людей ДНК примерно на 99,9 процента одинакова. Различия заметны, если анализировать маленькие цепочки нуклеотидов. Выясняется, что у одних разная длина, у других — последовательности букв, расположение, число повторов на хромосоме. По этим нюансам можно безошибочно отличить людей (и вообще любых особей), даже если они прямые родственники.
Полностью одинаковый генетический текст только у гомозиготных близнецов, да и то в момент рождения, поскольку они — результат деления одной оплодотворенной яйцеклетки. По мере взросления у близнецов возникают мутации в группах клеток, по которым можно идентифицировать личность.
Для анализа достаточно крошечного образца слюны, крови и любой биологически жидкости, где содержится пара десятков молекул ДНК. Их выделяют, размножают с помощью полимеразной цепной реакции и расшифровывают несколько участков в определенных хромосомах, которые у людей мутируют чаще всего. Результат представляет собой набор букв и цифр.
Информацию об особенностях ДНК человека называют генетическим паспортом.
Это может быть генетический “отпечаток пальца”, то есть набор уникальных маркеров, информация о мутациях, указывающая на этническое происхождение, точнее на регион, откуда происходят предки, в редких случаях — информация об особенностях внешнего вида. Туда же включают сведения о предрасположенности к наследственным заболеваниям.
Как рассказала РИА Новости Светлана Боринская, заведующая лабораторией анализа генома Института общей генетики имени Н. И. Вавилова РАН, ДНК-идентификацию применяют в криминалистике с 1990 годов, сейчас — повсеместно.
“С 2008 года действует федеральный закон “О государственной геномной регистрации в Российской Федерации”, в котором определен круг лиц, обязательно подлежащих этой процедуре. В первую очередь это осужденные за тяжкие преступления, изнасилования. Их генетический профиль поступает в базу данных и там сравнивается с ДНК неопознанных образцов с места преступлений. Это помогло раскрыть очень давние преступления, совершенные десятки лет назад”, — говорит эксперт.
В первую очередь это осужденные за тяжкие преступления, изнасилования. Их генетический профиль поступает в базу данных и там сравнивается с ДНК неопознанных образцов с места преступлений. Это помогло раскрыть очень давние преступления, совершенные десятки лет назад”, — говорит эксперт.
По ее словам, аналогичный закон в ряде стран применяют в отношении служащих, чья профессия связана с повышенным риском для жизни, например, военных, сотрудников спецслужб, пожарных. Это позволяет в случае гибели быстро идентифицировать останки.
Еще одно направление — идентификация жертв стихийных бедствий, терактов. Погибших опознают, сравнивая их образцы с ДНК близких родственников.
Пионеры персонализированной медицины
Понятие “генетический паспорт” ввели в научный оборот в 2000 году ученые из лаборатории пренатальной диагностики наследственных и врожденных заболеваний НИИ акушерства, гинекологии и репродуктологии имени Д. О. Отта (Санкт-Петербург) в книге о предиктивной, то есть предсказательной медицине. Ее первое издание теперь библиографическая редкость.“Сейчас генетический паспорт предлагают составить коммерческие фирмы как платную услугу”, — комментирует РИА Новости генетик Владислав Баранов, член-корреспондент РАН, профессор, один из авторов той книги.
Вообще-то, он и его коллеги под генетическим паспортом понимали информацию из ДНК, которая поможет сохранить здоровье данному человеку и его потомкам. Это сведения о мутациях, приводящих к опасным заболеваниям, результаты медико-генетического консультирования, кариотип, то есть полный хромосомный набор, серия тестов, направленных на то, чтобы гарантировать рождение здорового ребенка.
Ученые предлагали тестирование примерно на десять опасных наследственных заболеваний. Причем человек может быть носителем мутаций, вызывающих болезнь, и не знать, что он в группе риска.
“Сюда же относятся мутации, связанные с наследственными опухолями. Очень важно тестировать на них при рождении, чтобы человек был в курсе такой предрасположенности и получал соответствующую профилактику. Еще одна группа мутаций проявляется, только если у супруга или супруги есть нарушения в том же гене. Тогда вероятность тяжелого заболевания у потомства, нередко смертельного, вырастает до 25 процентов. Но мы можем это предотвратить”, — поясняет ученый.
Еще одна группа мутаций проявляется, только если у супруга или супруги есть нарушения в том же гене. Тогда вероятность тяжелого заболевания у потомства, нередко смертельного, вырастает до 25 процентов. Но мы можем это предотвратить”, — поясняет ученый.
По его словам, генетическая паспортизация очень полезна. Это общемировой тренд. Можно сравнить с диспансеризацией, которую проходят раз в два года, или, к примеру, с необходимостью знать группу крови, резус-принадлежность. Учитывая огромное число уже известных наследственных болезней и болезней с выраженной наследственной предрасположенностью (онкологические заболевания, диабет, ожирение и многие другие) правильнее говорить об электронной генетической карте здоровья, уточняет профессор Баранов.
Не исключено, что медицинское содержание отчасти вкладывается и в понятие генетического профиля населения, которое фигурирует в президентском указе № 97.
“Думаю, это определение, в конечном счете, относится к группе риска по тем болезням, к которым каждый из нас, увы, предрасположен уже при рождении. Достаточно вспомнить, какие хронические заболевания имеют или имели родители, чтобы понять, к какой группе риска вы скорее всего относитесь. А уточнить генетический профиль семьи или собственную предрасположенность к различным частым болезням можно с помошью генетического анализа. Благодаря ему каждая семья, каждый человек может узнать об уникальных особенностях своего генома, получить свой электронный генетический паспорт здоровья, который принципиально важен не только для самого человека, но его детей”, — предполагает генетик.
8 марта 2019, 08:00НаукаРоссийские генетики совершили прорыв в лечении муковисцидозаГены расскажут о здоровье
“По сути, сейчас нечто вроде паспорта делают каждому новорожденному, просто не раздают. Во всех наших роддомах детям проводят скрининг на пять наследственных заболеваний, встречающихся у одного на несколько тысяч человек (это не так уж редко). Если начать лечение загодя, ребенок вырастет здоровым”, — говорит Светлана Боринская.
ДНК новорожденных исследуют на адреногенитальный синдром, галактоземию, врожденный гипотиреоз, муковисцидоз, фенилкетонурию. Список планируют расширить до 23 скринируемых болезней.
Известно более пяти тысяч наследственных заболеваний. Большинство очень редкие, и проводить скрининг на все не нужно. Для нескольких сотен из них разработаны методы диагностики и имеется эффективное .
“Не все эти мутации однозначно вызывают заболевание. Важно знать, с какой вероятностью это произойдет. Например, мать и тетя американской актрисы Анджелины Джоли умерли от рака груди. Она сделала анализ ДНК, и у нее нашли мутацию, которая в восьмидесяти процентах случаев ведет к этой болезни. Джоли решилась на профилактическую операцию, удалила грудь. Иначе пришлось бы раз в три месяца проверяться, поскольку непонятно, когда болезнь возникнет. А потом сразу начать лечение. И еще неизвестно, насколько удачным оно будет. Все эти риски снимает профилактическая операция”, — приводит Боринская пример того, как можно использовать информацию о генетической предрасположенности к смертельным заболеваниям.
Что касается болезней, риск которых сильно зависит от одной мутации, здесь все более-менее ясно. В большинстве же случаев вклад генов незначителен, порядка 15-20 процентов.
“Для большинства болезней врачи дают сходные рекомендации: не ешьте острого, соленого, жирного, поддерживайте высокую физическую активность, не злоупотребляйте спиртным, не курите, не подвергайтесь сильным стрессам. Но при наличии определенных вариантов генов требуется более жестко соблюдать эти условия”, — добавляет исследователь.
Например, в 2005 году ВОЗ рекомендовала обследовать группы риска на предмет мутации в гене F5 (FV) — важного фактора возникновения венозного тромбоза. 20 февраля 2019, 08:00НаукаСколько мужей растят не своих детей? Ответ дает тест ДНК на отцовствоПод защитой закона
Нужна ли обязательная генетическая паспортизация? Ученые предлагают гибко подходить к этому вопросу, поскольку уже сейчас достаточно много людей не хотят знать о генетических рисках для своего здоровья.
“На мой взгляд, следует значительно расширить консультации с врачами-генетиками, которые могут определить наиболее рациональную форму составления генетического паспорта, целесообразность его, оценить круг тех, для кого он обязателен. Надо решать много привходящих вопросов: кто получит доступ к этой информации, как ее использовать в практическом здравоохранении для пользы каждого человека. Многое еще неясно”, — заключает Владислав Баранов.
“Индивидуальную генетическую паспортизацию необходимо развивать, это не вызывает сомнений. Для этого потребуется усовершенствовать методику, а также законодательство, обсудить этические вопросы. Генетическая информация должна быть столь же тайной, как любые медицинские сведения о человеке, на которые распространяется закон о защите персональных данных. Недаром на профильных международных конференциях обязательно устраивают секцию по этическим, юридическим и социальным аспектам геномных исследований”, — подчеркивает Боринская.
По ее сведениям, в России в прошлом году поддержано около сорока проектов РФФИ по анализу правового регулирования геномных исследований. Предстоит прояснить, кто обязан сдавать образцы для генетического профиля, кто может отказаться, в каких ситуациях нужна геномная регистрация, как соблюдается конфиденциальность.
7 февраля 2019, 08:00НаукаДНК в опасности. Почему раскрытие серийных убийств расстроило американцевИнвитро. Генетические предрасположенности, узнать цены на анализы и сдать в Москве
Врожденная гиперплазия надпочечников, ген CYP21A2, ч.м.Генетическое исследование на наличие частых мутаций в гене CYP21OHB направлено на диагностику адреногенитального синдрома – заболевания, обусловленного генетическим дефектом ферментативных систем, которые участвуют в синтезе кортикостероидов, и сопровождаемое аномалиями полового и соматического развития, гиперандрогенией.
Возникновение изолированных пороков развития у плодаВыявление индивидуальных особенностей в основных генах ферментов фолатного цикла для оценки вероятности формирования дефицита фолиевой кислоты при беременности (рекомендовано оценивать в комплексе с иммунохимическим тестом на определение уровня гомоцистеина).
Выявление индивидуальных особенностей по трем локусам генов HLA II класса для оценки предрасположенности к развитию некоторых аутоиммунных заболеваний, в том числе во время беременности.
Тест включает в себя исследование гена RHD – гена резус-фактора с определением гетерозиготного или гомозиготного носительства по резус-фактору. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Определение резус-фактораТест выполняют при плановой подготовке к беременности, для профилактики резус-конфликта и гемолитической болезни новорожденных.
Тромбозы: расширенная панельВыявление индивидуальных особенностей в 6 генах системы гемостаза для оценки наличия факторов риска развития тромбоза и повышения уровня гомоцистеина (гены протромбина, фактора Лейдена и ферментов реакций фолатного цикла).
Анализ направлен на исследование полиморфизмов в гене β-полипептида фибриногена FGB, которые могут обуславливать увеличение риска развития тромбофилических состояний. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
ГипергомоцистеинемияВыявление изменений в основных генах ферментов фолатного цикла для оценки наличия склонности к гипергомоцистеинемии (рекомендовано оценивать в комплексе с иммунохимическим тестом на определение уровня гомоцистеина).
Исследование полиморфизмов в генах интегрина альфа-2 и тромбоцитарного гликопротеина 1b проводят для выявления генетической предрасположенности к раннему развитию инфаркта миокарда, ишемического инсульта, тромбоэмболии, а также для оценки риска развития тромбозов. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Определение полиморфизмов в гене тромбоцитарного рецептора фибриногена (β3-интегрина) выполняют для выявления наследственной предрасположенности к тромбофилическим состояниям. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
В процессе исследования выявляют генетические факторы риска развития артериальной гипертензии, атеросклероза, ишемической болезни сердца, инфаркта миокарда, ишемического инсульта.
Артериальная гипертензия (полная панель)Анализ полиморфизмов в генах ACE, AGT, NOS3 дает возможность обнаружить наследственные факторы риска развития артериальной гипертензии. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Артериальная гипертензия, связанная с нарушениями в ренин-ангиотензиновой системеИсследование дает возможность выявить наследственные факторы риска развития тромбозов, артериальной гипертензии и атеросклероза путем анализа полиморфизмов в генах ACE, AGT, ApoE, NOS3, ITGB3, ITGA2. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Тест используют при диагностике болезни Крона, для определения прогноза тяжести течения заболевания и риска развития осложнений. Также исследование применяют для дифференциальной диагностики болезни Крона с язвенным колитом и в качестве прогностического теста у родственников пациентов с болезнью Крона.
Поражения печени, гены ATP7B, PNPLA3, SERPINA1, ч.м.Исследование используется для дифференциальной диагностики генетических причин патологии печени – дефицита альфа-1-антитрипсина, болезни Вильсона-Коновалова, классического гемохроматоза и злокачественной формы неалкогольной жировой болезни печени
Исследование показано для диагностики, определения прогноза течения заболевания, подбора адекватной терапии и мониторинга минимальной остаточной болезни пациентов с множественной миеломой.
Синдром множественной эндокринной неоплазии 2B типаСиндром множественной эндокринной неоплазии 2В типа относится к группе семейных опухолевых синдромов, ассоциированных со специфическими мутациями протоонкогена RET, которые выявляют в процессе исследования.
Генетическая диагностика синдрома Жильбера – неконъюгированной доброкачественной гипербилирубинемии – основана на исследовании возможных мутаций в промоторной области гена UGT1A1.
Остеопороз: полная панельИсследование проводят при наличии нарушений минерального обмена, а также при отягощенном семейном анамнезе по заболеваниям костной системы.
Остеопороз: сокращённая панельИсследование проводят при наличии нарушений минерального обмена, а также при отягощенном семейном анамнезе по заболеваниям костной системы.
Исследование генетических факторов риска развития остеопороза проводят при отягощенном семейном анамнезе по заболеваниям костного аппарата, а также при наличии нарушений минерального обмена. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Обмен фолиевой кислотыВыявление индивидуальных особенностей в основных генах ферментов фолатного цикла для оценки наличия склонности к гипергомоцистеинемии (рекомендовано оценивать в комплексе с иммунохимическим тестом на определение уровня гомоцистеина).
Выявление 2 наиболее часто встречаемых мутаций в гене HFE для оценки риска развития гемохроматоза 1-го типа. Рекомендовано при выявлении повышения концентрации ферритина и % насыщения трансферрина железом в сыворотке крови.
Описание результатов генетического теста 2 категории сложности (№№ 118ГП/БЗ, 121ГП/БЗ, 123ГП/БЗ, 131ГП/БЗ, 141ГП/БЗ, 149ГП/БЗ, 150ГП/БЗ, 115ГП/БЗ, 152ГП/БЗ, 124ГП/БЗ, 154ГП/БЗ)Исследование включает описание врачом-генетиком результатов генетических анализов, которые относятся ко второй категории сложности.
Описание результатов генетического теста 3 категории сложности (№№ 122ГП/БЗ, 129ГП/БЗ, 120ГП/БЗ, 137ГП/БЗ, 138ГП/БЗ, 153ГП/БЗ, 151ГП/БЗ, 110ГП/БЗ, 114ГП/БЗ, 140ГП/БЗ, 7661БЗ, 7258БЗ, 134ГП/БЗ, 135ГП/БЗ, 136ГП/БЗ)Тест включает проведение анализа полиморфизмов в гене NAT-2, который указывает на наличие наследственных факторов повышенного риска развития волчаночноподобного синдрома и гепатотоксичности при приеме кардиотропных препаратов.
ИзониазидТест включает проведение анализа полиморфизмов в гене NAT-2, который указывает на наличие наследственных факторов повышенного риска развития полиневритов при приеме изониазида, связанных с нарушением его метаболизма.
Анализ полиморфизмов в гене ACE необходим для прогнозирования нефропротективного эффекта ингибиторов ангиотензин-превращающего фермента (АПФ) – физиологического регулятора артериального давления и водно-солевого обмена при недиабетических заболеваниях. Посредством исследования можно определить генетические маркеры эффективности атенолола при артериальной гипертензии с гипертрофией левого желудочка или флувастатина при ишемической болезни сердца.
Лозартан/ирбесартанВ процессе исследования проводится анализ полиморфизмов в гене CYP2C9, который выступает генетическим маркером риска нарушений метаболизма блокаторов рецепторов ангиотензина II.
МетотрексатВыявление изменений в основных генах ферментов фолатного цикла для оценки вероятности развития побочных реакций при приеме метотрексата.
Нестероидные противовоспалительные препаратыАнализ полиморфизмов в гене CYP2C9 выполняют с целью выявления наследственных факторов развития побочных реакций по типу желудочных кровотечений при приеме нестероидных противовоспалительных препаратов (НПВП).
ПеницилламинПеницилламин представляет собой лекарственный препарат из группы детоксицирующих средств. Некоторые варианты полиморфизмов в генах системы детоксикации ксенобиотиков и канцерогенов ассоциированы с усилением клинической эффективности этого препарата. Исследование направлено на выявление генетических маркеров, потенцирующих клиническую эффективность при применении пеницилламина.
Сульфаниламиды (сульфасалазин)Тест включает проведение анализа полиморфизмов в гене NAT-2, который указывает на наличие наследственных факторов повышенного риска развития побочных реакций в форме диспепсий и желудочных кровотечений при приеме сульфасалазина, связанных с нарушением его метаболизма.
Бета-адреноблокаторы. Ген CYP2D6. Фармакогенетика.
Цитохром CYP2D6 участвует в метаболизме лекарственных препаратов (β-адреноблокаторов, антиаритмиков, аналептиков, антидепрессантов и наркотических анальгетиков), применяемых при лечении ряда сердечно-сосудистых заболеваний и психических расстройств. Исследование полиморфизмов в гене CYP2D6 позволяет выявить людей со сниженной активностью CYP2D6, поскольку таким пациентам необходимо индивидуально подбирать более низкие дозы препаратов.
ГлутатионтрансферазыВыявление генетических факторов нарушения системы детоксикации (2-я фаза биотрансформации).
N-ацетилтрансфераза 2Анализ полиморфизмов в гене NAT-2 позволяет обнаружить наследственные факторы нарушения системы детоксикации. От активности фермента N-ацетилтрансферазы зависит эффективность выведения из организма токсинов, лекарственных препаратов и канцерогенов, что определяет больший или меньший риск различных заболеваний.
Цитохром СYP2D6: ген СYP2D6Тест целесообразно проводить перед плановым назначением антигипертензивных, антиаритмических, психотропных препаратов, а также при длительном их приеме.
Цитохром CYP2C9Анализ наличия полиморфизмов в гене цитохрома Р450 проводят для выявления наследственных факторов нарушения детоксикации. CYP2C9 участвует в метаболизме лекарственных средств. При снижении активности цитохрома CYP2C9 метаболизм препаратов замедляется, в результате чего происходит увеличение их концентрации в крови, что может быть причиной развития нежелательных реакций.
Неинвазивный генетический тест -цена, сделать генетический тест в клинике «Мать и дитя» в Москве
Преимущества неинвазивного генетического теста
Данный метод исследования на сегодняшний день является точным и безопасным способом диагностировать нарушение числа хромосом у плода (анеуплоидии).
В отличие от различных инвазивных методов, таких как кордоцентез, амниоцентез и аспирация ворсин хориона, этот тест делается по крови матери и является абсолютно безопасным как для ее здоровья, так и для здоровья будущего ребенка.
При этом точность неинвазивного теста гораздо выше, чем у биохимического скрининга беременных, так как на его результат не оказывают влияния особенности течения беременности, принимаемые препараты и соматические заболевания женщины. Немаловажным плюсом является тот факт, что делать неинвазивный генетический тест можно на ранних сроках беременности, начиная уже с 10 недели.
Что показывает этот тест?
Суть данного исследования заключается в выделении из крови женщины ДНК плода, некоторое количество которого свободно циркулирует в ее организме во время беременности. На основании анализа фетальной ДНК можно получить информацию о нарушении числа хромосом, с которым связаны наиболее распространенные заболевания.
Таким образом, неинвазивный генетический тест позволяет с точностью 99% определить такие заболевания, как синдром Дауна, синдром Патау, синдром Эвардса, синдром Тернера и с 98% точностью диагностировать синдром Клайнфельтера.
Кому показан тест?
Поскольку неинвазивный генетический тест является абсолютно безопасным методом диагностики, сделать его может любая беременная женщина, желающая получить наиболее полную информацию о здоровье своего будущего ребенка и, возможно, развеять некоторые сомнения и страхи.
Пройти этот тест может любая женщина, желающая получить максимальную информацию о здоровье ребенка безопасным способом. Однако при наличии следующих ситуаций неинвазивный тест обязателен:
- высокий риск патологии плода по результатам биохимического скрининга;
- возраст беременной более 35 лет;
- имеется угроза прерывания беременности или привычное невынашивание.
Противопоказания для неинвазивного генетического теста
Не смотря на то, что этот метод, как и, собственно, скрининг беременных, является полностью безопасным, он тоже имеет свои противопоказания. Неинвазивный пренатальный тест нельзя делать в случаях, если:
- носительство хромосомных перестроек одним из родителей
- в анамнезе имеется пересадка костного мозга или стволовых клеток;
- обнаружены УЗ-маркеры хромосомной патологии (неимунная водянка, расширение толщины воротникового пространства) или пороки развития, это показание для инвазивной пренатальной диагностики
Что нужно для данного исследования?
Неинвазивный генетический тест не требует никакой предварительной подготовки. При отсутствии противопоказаний к его прохождению, необходимо просто сдать кровь в одной из клиник «Мать и Дитя» не натощак. Результаты исследования будут готовы через 14 дней после сдачи крови на анализ.
При отсутствии противопоказаний к его прохождению, необходимо просто сдать кровь в одной из клиник «Мать и Дитя» не натощак. Результаты исследования будут готовы через 14 дней после сдачи крови на анализ.
Здесь же при необходимости вы можете получить и консультацию генетика. Высококвалифицированные специалисты клиник «Мать и Дитя» с радостью ответят на все интересующие вас вопросы.
Где сделать генетический анализ в Москве?
Где сделать генетический анализ в Москве? Этот вопрос задают себе те, кто заботится о своем здоровье и желает избежать проявления наследственных болезней. Исследование также будет полезно пройти супружеским парам, планирующим зачать ребенка.
Генодиагностика развивается стремительными темпами. Сегодня изучение генов дает возможность определить:
- склонность к наследственным заболеваниям, в том числе онкологическим,
- особенности обмена веществ в организме,
- риск развития патологий у будущего ребенка и др.
Сделать генетический анализ в Москве предлагают многие клиники. Выбирая, где пройти обследование, обратите внимание на техническое оснащение медицинского учреждения и квалификацию персонала. Сеть лабораторий «Литех» оказывает услуги по лабораторной диагностике на самом высоком уровне. У нас работают опытные специалисты — кандидаты и доктора медицинских наук.
Генодиагностика в “Литех”
Одно из ведущих направлений нашей деятельности — генетическая диагностика. Предлагаем сдать анализы по разным профилям.
- Риск развития заболеваний сердечно-сосудистой системы — включает тесты на склонность к артериальной гипертензии, ИБС, инсульту и инфаркту миокарда. Специалисты выполнят оценку липидного обмена, системы свертывания крови.
- Переносимость лекарств, болезни разных органов и систем — оценка вероятности возникновения язвы, гастрита, остеопороза, сахарного диабета, онкологии, непереносимости глютена, лактозы и пр.

- Женское здоровье — предрасположенность к невынашиванию беременности, поликистозу яичников, РМЖ, раку шейки матки и яичников, пролапсу половых органов при менопаузе.
- Мужское здоровье — генетические аспекты бесплодия, злокачественных опухолей предстательной железы.
- Моногенные заболевания, передающиеся по наследству — тесты ДНК на риск галактоземии, фенилкетонурии, муковисцидоза, нейросенсорной тугоухости, гемохроматоза, синдрома Жильбера и т.д.
- Спортивная генетика — определение склонности к занятиям разными видами спорта, создание программ по наращиванию мышечной массы и коррекции фигуры.
Приглашаем всех желающих сделать генетический анализ в Москве в лаборатории «Литех». При заказе объединенных профилей по нескольким заболеваниям предоставляется скидка. Исследование включает:
- анализ крови с выделением ДНК,
- изучение полиморфизмов,
- составление заключения врачом-генетиком.
Результаты предоставляются в удобном формате — на бумажном или электронном носителе. Для получения максимальной генетической информации оформляйте паспорта здоровья — мужской или женский.
Чтобы уточнить, где и как сделать генетический анализ, обращайтесь по телефонам наших офисов в Москве. Быстрая запись — через интернет-регистратуру.
Все статьи
Сделать генетический анализ крови в СПб: цены в клинике Даная
Генетический анализ крови – это методика, направленная на выявление передающихся по наследству признаков. Исследование помогает выявить имеющиеся наследственные болезни и предрасположенность к ним. Если вы ищете клинику, где можно сделать генетический анализ, то обратитесь в наш медицинский центр «Даная». Наши опытные специалисты грамотно проведут обследование, что обеспечит высокую точность результатов.
Цена генетического анализа крови
| Определение онкомаркера СА 125 (маркер рака яичников и матки) | 450 |
| Определение онкомаркера СА 15-3 (маркер рака молочной железы) | 320 |
Смотреть все цены
Запись к врачу
Показания к проведению
ДНК-идентификация, как часто называют данное исследование, позволяет определить степень риска развития определённого заболевания. С помощью процедуры можно выявить около 500 возможных патологий и повысить вероятность их излечения.
С помощью процедуры можно выявить около 500 возможных патологий и повысить вероятность их излечения.
Нередко метод используется для выявления переносимости определённых лекарственных препаратов и эффективности проводимой терапии.
Процедуру чаще всего рекомендуют проходить женщинам, планирующим ребёнка, и пациенткам во время беременности. Однако стоит отметить, что исследование ДНК проводится у мужчин и даже у детей – оно позволяет выявить отклонения в работе различных систем организма.
Основанием для исследования могут стать следующие факторы:
- Наличии у женщины выкидышей.
- Возраст старше 35 лет.
- Рождение ребёнка с врождёнными пороками развития.
- Тяжёлые перенесённые заболевания во время беременности (токсоплазмоз, ОРВИ, краснуха и т.д.).
- Употребление наркотиков или алкоголя при зачатии ребёнка.
- Наличие наследственных болезней в семье.
Ещё одной причиной для проведения анализа на генетику является установление отцовства и родственных связей.
Разновидности генетического анализа
В нашей клинике используются разные методики для получения данных о генетических особенностях человека.
Чаще всего проводится прямой ДНК-анализ. В этом случае рассматривается количество и последовательность аминокислот, генов в хромосомах и другие особенности ДНК. Для проведения такой процедуры используются лейкоциты крови. Методика подходит для обнаружения большинства наследственных заболеваний и установления отцовства.
Также возможно проведение косвенного исследования. Чаще всего такая процедура используется во время планирования беременности. Методика позволяет оценить риск развития наследственных патологий у ребёнка и, соответственно, предотвратить их развитие.
Помните, если вы располагаете информацией о возможных заболеваниях, вы получаете шанс избежать их в будущем!
Как проходит процедура?
Для того чтобы сдать анализ крови на генетические заболевания, не потребуется специальная подготовка. Чаще всего кровь для анализа берется из вены. Для определения патологий используются так называемые генетические маркеры. Они представляют собой искусственно разработанные вещества, которые способны выявить наличие тех или иных инфекций и отклонений в ДНК. Существуют маркеры на хромосомные болезни, наследственные формы рака, заболевания сосудов, лёгких и многое другое.
Чаще всего кровь для анализа берется из вены. Для определения патологий используются так называемые генетические маркеры. Они представляют собой искусственно разработанные вещества, которые способны выявить наличие тех или иных инфекций и отклонений в ДНК. Существуют маркеры на хромосомные болезни, наследственные формы рака, заболевания сосудов, лёгких и многое другое.
В результате у пациента можно выявить такие заболевания, как инфаркт, ишемическую болезнь сердца, онкологию, патологии щитовидной железы, болезни ЖКТ, диабет, атеросклероз. Также методика помогает определить предрасположенность к болезни Крона, синдром Жильбера, мутацию Лейдена и риск развития гипертонии.
Почему стоит обратиться к нам?
Сегодня многие медицинские центры предлагают ДНК-анализы крови, однако не везде качество услуг является достаточно высоким. Если вы хотите пройти максимально полное и информативное обследование, обратитесь в нашу клинику «Даная».
Наш центр имеет множество преимуществ:
- У нас вы сможете пройти исследование в любое удобное время. Клиника работает даже в субботу и воскресенье.
- Все результаты являются максимально точными. Достоверность составляет свыше 95%.
- В нашем центре используется новейшее оборудование. Это позволяет исключить любые неточности при обследовании биологического материала.
- Вы сможете получить результаты в максимально короткие сроки. Генетические исследования в среднем занимают от 5 до 14 дней.
Как записаться на процедуру?
Если вы хотите пройти генетический анализ крови в Санкт-Петербурге по доступной цене, то запишитесь в клинику «Даная». Для этого можно воспользоваться специальной формой на сайте или позвонить нам по указанным номерам. Также по телефону вы сможете узнать все подробности исследования, его стоимость и сроки выполнения.
Задайте ваш вопрос
Что такое ДНК-тест, сколько стоит генетический тест и где его можно сделать
В 2019 году я сдала ДНК-тест. Это обошлось мне в 99 $ (6475 Р).
Это обошлось мне в 99 $ (6475 Р).
Виктория Зорина
любит тесты
Расскажу, что такое ДНК-тест, как сдать его, находясь в России, сколько это может стоить и что можно узнать о своем здоровье и происхождении.
Что такое ДНК-тест
В генах человека содержится огромный объем информации. Из ДНК-теста можно узнать, например, к каким этносам принадлежали ваши предки, есть ли у вас генетические заболевания, склонны ли вы к занятиям футболом, как вы переносите лактозу и эффективно ли в вашем случае работает аспирин. Самое известное практическое применение генетического теста — установление отцовства. Но в статье речь пойдет не об этом.
Сайт «Популярно о генетике»
ДНК-тестирование проходит так. Клиент сдает в лабораторию свой биоматериал: как правило, слюну или клетки с внутренней поверхности щеки. Из материала выделяют участки ДНК и расшифровывают снипы. Слово «снип» образовано от английской аббревиатуры SNP — single-nucleotide polymorphism. Означает оно отличия в последовательностях нуклеотидов. Эти отличия возникают из-за точечных мутаций в процессе эволюции. Затем снипы сравнивают с другими, уже имеющимися в базе, — и таким образом получают информацию об этническом происхождении клиента, предрасположенности к заболеваниям, личных особенностях и реакциях на медицинские препараты.
Что такое снип — статья в Википедии
В итоге получается массив исходных сырых данных — его так и называют: raw data. Клиенту его передают в виде заархивированного файла весом 5—6 Мб. Затем эти данные прогоняют через компьютерные алгоритмы — и получаются отчеты, понятные покупателю теста. Если расшифровать свой raw data в другой лаборатории, можно узнать о себе новые подробности.
С ДНК-тестом на руках можно даже знакомиться с потенциальными половинками — для этого есть специальный сайт DNA Romance
Расшифровка ДНК за деньги — не новая услуга. В США ее с 2006 года предоставляет компания 23AndMe, которую создала Анна Войжицки, жена сооснователя Гугла Сергея Брина. 23AndMe — пионер в проведении генетических тестов для всех желающих, но сейчас на рынке существует множество других компаний — как в США, так и в России и других странах.
23AndMe — пионер в проведении генетических тестов для всех желающих, но сейчас на рынке существует множество других компаний — как в США, так и в России и других странах.
ДНК-тест стоит от 50 $ (3079 Р). На мой взгляд, это доступная цена для генетического анализа, с помощью которого можно узнать о себе много нового.
Сколько стоят ДНК-тесты
Выбор компании для проведения ДНК-тестов не ограничивается вышеупомянутой 23AndMe. Есть несколько альтернатив, в том числе российских.
Российские тесты удобно выбирать, если вы не хотите долго ждать доставку, а потом еще и заморачиваться с пересылкой биоматериалов за границу. Но сэкономить с ними не получится: стоят они дороже американских.
Цены на ДНК-тесты
| Название компании | Страна | Тест только на происхождение | Тест на здоровье и генетические болезни | Другие данные |
|---|---|---|---|---|
| MyHeritage | США | 79 $ (5167 Р) | 199 $ (13 026 Р) | — |
| FamilyTreeDNA | США | От 79 $ (5167 Р) | — | — |
| Ancestry | США | 99 $ (6476 Р) | 149 $ (9753 Р) | Характерные черты (traits) — 20 $ (1309 Р) |
| 23AndMe | США | 99 $ (6476 Р) | 199 $ (13 026 Р) | Характерные черты (traits) — включено в стоимость |
| «Генотек» | Россия | 9995 Р | 2500 Р | Эффективность лекарств, подходящая диета и фитнес, таланты и спорт, планирование детей — по 2500 Р за каждый анализ |
| TellmeGen | США | 199 $ (13 026 Р) | Бесплатно | Характерные черты, эффективность лекарств — включено в стоимость |
| «Атлас» | Россия | 30 000 Р | Бесплатно | Характерные черты, питание, спорт — включено в стоимость |
Тест только на происхождение
79 $ (5167 Р)
Тест на здоровье и генетические болезни
199 $ (13 026 Р)
Другие данные
—
Тест только на происхождение
От 79 $ (5167 Р)
Тест на здоровье и генетические болезни
—
Другие данные
—
Тест только на происхождение
99 $ (6476 Р)
Тест на здоровье и генетические болезни
149 $ (9753 Р)
Другие данные
Характерные черты (traits) — 20 $ (1309 Р)
Тест только на происхождение
99 $ (6476 Р)
Тест на здоровье и генетические болезни
199 $ (13 026 Р)
Другие данные
Характерные черты (traits) — включено в стоимость
Страна
Россия
Тест только на происхождение
9995 Р
Тест на здоровье и генетические болезни
2500 Р
Другие данные
Эффективность лекарств, подходящая диета и фитнес, таланты и спорт, планирование детей — по 2500 Р за каждый анализ
Тест только на происхождение
199 $ (13 026 Р)
Тест на здоровье и генетические болезни
Бесплатно
Другие данные
Характерные черты, эффективность лекарств — включено в стоимость
Страна
Россия
Тест только на происхождение
30 000 Р
Тест на здоровье и генетические болезни
Бесплатно
Другие данные
Характерные черты, питание, спорт — включено в стоимость
Все указанные в таблице компании предоставляют информацию о происхождении и почти все — о здоровье. Но вот сами по себе их отчеты сильно различаются. В одной лаборатории — например, Ancestry или TellmeGen — тест покажет только самую общую картину происхождения. А в другой лаборатории — например, 23AndMe — тест сможет определить даже области проживания ваших родственников. Впрочем,такая высокая точность не гарантирована: все зависит от того, сдавали ли эти родственники генетические тесты, чтобы попасть в общую базу.
Но вот сами по себе их отчеты сильно различаются. В одной лаборатории — например, Ancestry или TellmeGen — тест покажет только самую общую картину происхождения. А в другой лаборатории — например, 23AndMe — тест сможет определить даже области проживания ваших родственников. Впрочем,такая высокая точность не гарантирована: все зависит от того, сдавали ли эти родственники генетические тесты, чтобы попасть в общую базу.
Тесты с оценкой здоровья определяют предрасположенность к болезням — от пары десятков до нескольких сотен, — а также наличие дефектных генов. Эта информация будет полезна тем, кто собирается завести ребенка.
Пункт traits — «характерные черты» — включает в себя много данных, которые разнятся в зависимости от лаборатории. Так, 23AndMe расскажет о внешности: определит ваш предполагаемый цвет глаз, размер ушей, наличие ямочек на щеках, текстуру и толщину волос, склонность к появлению веснушек и мозолей. Она же проанализирует, насколько хорошо вы переносите кофеин и лактозу, насколько чувствительны к запахам и вкусам и склонны ли бояться высоты. Мужчины смогут узнать, ждет ли их облысение.
Тесты из лабораторий Ancestry и TellmeGen тоже оценивают внешность клиента с генетической точки зрения. Еще они определяют усвояемость некоторых витаминов и чувствительность к запахам. Российские тесты в компаниях «Атлас» и «Генотек» предлагают оценить генетическую предрасположенность к разным видам спорта, найдя общие с именитыми спортсменами гены.
Кроме указанных выше компаний, которые проводят подобные тесты, на рынке есть и другие: например, MyGenetics, Pharmazam, Living DNA. Я не включила их в таблицу, потому что какие-то из них слишком дорогие, а в других надо доплачивать за каждый нюанс и итоговая цена теста непонятна.
Я заказывала тест в лаборатории MyHeritage и дальше в статье буду рассказывать о нем.
Как лечиться экономно
Или не платить за лечение вообще. Расскажем в нашей рассылке вместе с другими материалами о деньгах
Как заказать тест
Цена теста на сайте указана в у. е. — условных единицах. Валюта меняется в зависимости от страны, где вы заказываете тест. Даже если на сайте цена указана в долларах, уже потом на странице оплаты пользователям с европейским IP-адресом сайт покажет цены в евро, а пользователям с российским IP-адресом будет показывать то в евро, то в долларах, причем сумма будет указана одна и та же — 99 $ или 99 €. Очевидно, что в долларах платить выгоднее.
е. — условных единицах. Валюта меняется в зависимости от страны, где вы заказываете тест. Даже если на сайте цена указана в долларах, уже потом на странице оплаты пользователям с европейским IP-адресом сайт покажет цены в евро, а пользователям с российским IP-адресом будет показывать то в евро, то в долларах, причем сумма будет указана одна и та же — 99 $ или 99 €. Очевидно, что в долларах платить выгоднее.
Деньги с карточки банк снимет по текущему курсу. Можно воспользоваться валютной картой, тогда тест обойдется вам еще немного дешевле.
Страница покупки теста на сайте MyHeritage. Суммы в условных единицах одинаковые — вот только в рублях они будут значительно различатьсяДоставка теста в Москву стоит 15 $ (923 Р). На ней можно сэкономить двумя способами. Если зарегистрироваться на сайте, положить выбранный тест в корзину, но не оплачивать его сразу, в течение суток вы наверняка получите на электронную почту промокод на бесплатную доставку. Я провела такой эксперимент трижды и промокод мне прислали во всех трех случаях.
15 $стоит доставка теста MyHeritage в Москву
Другой способ — заказать два или больше тестов, тогда доставка сразу будет бесплатной. Второй комплект можно продать или подарить.
Если положить тест в корзину на сайте и не оплачивать сразу, то вам в ближайшее время пришлют промокод на бесплатную доставкуЗа заказ я заплатила 99 $ (6098 Р). Доставка благодаря промокоду мне ничего не стоила. Но даже с бесплатной доставкой покупка оказалась неоптимальной по цене.
Дело в том, что я заказала расширенный тест с информацией о происхождении и здоровье. А как выяснилось позже, данные о здоровье MyHeritage вам предоставит в любом случае и поместит их в файл с общими данными. Чтобы убедиться в этом, я провела эксперимент с файлом сырых данных моей подруги. Она оплатила тест только на происхождение, но в других лабораториях ей рассказали о здоровье в таком же объеме, как и мне. Полученный файл с сырыми данными можно расшифровать на других платформах, причем бесплатно или существенно дешевле, чем на родном сайте.
Получается, в MyHeritage достаточно оплатить только тест на происхождение — Ancestry. Его цена варьируется от 49 $ (3018 Р) до 79 $ (4866 Р) в зависимости от акций на сайте.
Заказать тесты в других лабораториях в США — 23AndMe, TellmeGen, FamilyTreeDNA — немного сложнее, но тоже возможно. Для этого понадобится посредник с адресом в США, о них в Т—Ж есть отдельная большая статья. Посылка с тестом поступит сначала на склад посредника, а за дополнительную плату ее перешлют в Россию. Доставка обойдется в 20—30 $ (1231 —1846.5 Р) в зависимости от расценок посредника.
Пересылать тесты через посредников не запрещено ни их собственными правилами, ни законодательством, и желающие вовсю этим пользуются. Большинство тестов можно купить не только на официальном сайте, но и на «Амазоне» — и там на тесты могут быть скидки.
Правда, во всех случаях могут быть проблемы с пересылкой материалов обратно в американскую лабораторию. Об этом расскажу дальше в статье.
Как собрать материал
Моя посылка с тестом из Америки пришла за две недели. В белой картонной коробке была инструкция по сбору анализа, две маленькие пробирки с жидкостью, две палочки с ватками и коробочка с адресом для отправки теста обратно в Хьюстон, штат Техас.
Коробка с тестом Содержимое коробки: две палочки с ватками для проб, пробирки с жидкостью — в нее погружаются пробы, — пакетик для упаковки пробирок с салфеткой от возможной протечки, конверт для отправки материала за свой счетГенетический материал для теста в лаборатории MyHeritage надо собирать с внутренней поверхности щек. Через полчаса после еды надо взять палочку из набора и 45 секунд поводить ею по поверхности щеки изнутри. После — отломить участок с ваткой по указанной линии, положить в пробирку и закрыть. А потом повторить всю процедуру со второй щекой.
В сборе материала нет ничего сложного. Один тест я сдала по всем правилам, на вторую палочку сильно нажала, и она сломалась по линии раньше, чем нужно.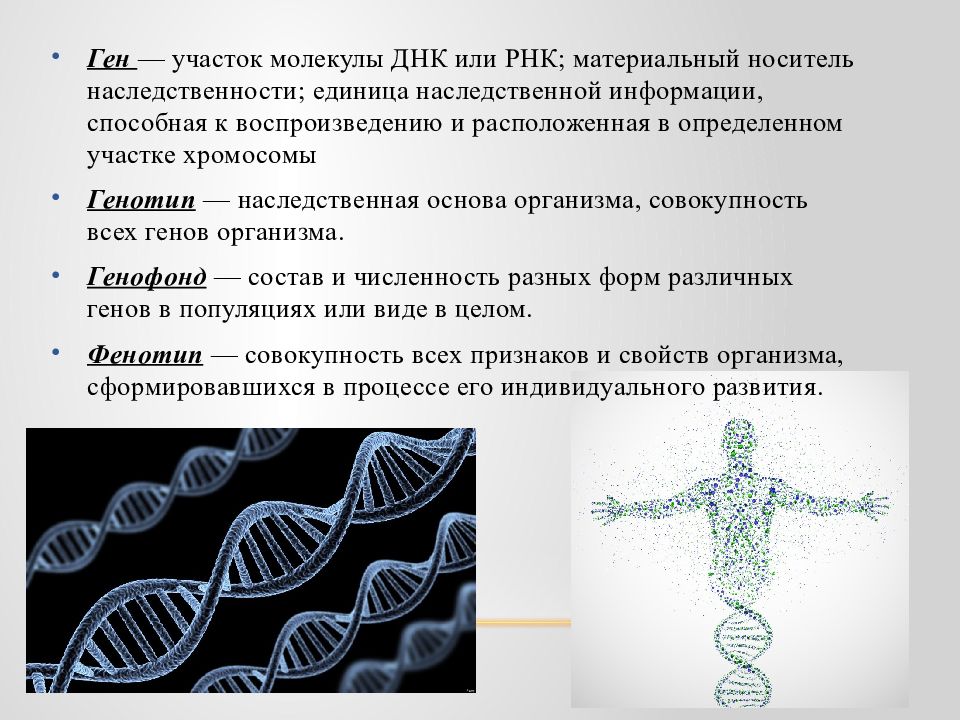 Но и это не доставило проблем: я аккуратно поместила сломанную палочку в пробирку и закрыла ее.
Но и это не доставило проблем: я аккуратно поместила сломанную палочку в пробирку и закрыла ее.
В других лабораториях генетический материал нужно собирать иными способами. Например, для проведения тестов в лабораториях 23AndMe и «Атлас» предлагают собрать в пробирку 2,5—3 мл своей слюны.
Как отправить материал в США
Пересылать запрещено «образцы биологических материалов человека» — в том числе и образцы клеток, тканей, биологических жидкостей человека, мазков, соскобов, смывов. Наказание — штраф от 1000 до 2500 Р и конфискация предметов административного правонарушения.
ст. 16.3 КоАП РФ
Я решила рискнуть. Вложила пробирки с ватными палочками в конверт из набора MyHeritage. Этот конверт положила в еще один — непромокаемый, который мне выдали на почте. Потом заполнила таможенную декларацию. В ней не стоит писать слов «биоматериал» и «генетический тест», чтобы не смущать сотрудников почты и таможни.
Я выбрала категорию «подарок» и написала «two plastic tubes»: мало ли кому в США я отправляю в подарок две пластиковые пробирки. Никаких вопросов не возникло.
360 Ря заплатила за отправку материалов в США
За отправку я заплатила 360 Р.
Результаты теста
Мой образец ДНК доставили из Москвы в Хьюстон за три недели. Пока он был в пути, на сайте MyHeritage мне предложили заполнить несколько анкет о здоровье — моем и ближайших родственников, но это было необязательно. Я заполнять не стала.
Через 10 дней после доставки теста в лабораторию мне пришло уведомление, что результаты готовы. С замиранием сердца я открыла результаты — и увидела, что я на 55,6% уроженка Восточной Европы и на 44,4% — прибалтка. В принципе, я и не ожидала никаких открытий, поскольку неплохо знакома со своим генеалогическим древом. Но все же мне показалось, что отчет был не очень-то информативным.
В базе данных компании MyHeritage прибалты — это одновременно и прибалты, и славяне
Интереснее оказались генетические совпадения с другими людьми. Система нашла нескольких моих четверо- и пятиюродных братьев и сестер, которых я знала и раньше, а также сотни совпадений с низкой достоверностью — их я проверять не стала. В каждом случае сайт предлагает связаться с человеком — и известно немало историй, когда люди таким образом находили реальных новых родственников. Но я не из их числа: не вижу смысла бросаться на шею возможной семиюродной сестре из США.
Система нашла нескольких моих четверо- и пятиюродных братьев и сестер, которых я знала и раньше, а также сотни совпадений с низкой достоверностью — их я проверять не стала. В каждом случае сайт предлагает связаться с человеком — и известно немало историй, когда люди таким образом находили реальных новых родственников. Но я не из их числа: не вижу смысла бросаться на шею возможной семиюродной сестре из США.
Важный момент: поскольку у женщин отсутствует Y-хромосома, генетический тест покажет им предков только по женской линии. Поэтому интереснее протестировать мужчину, чем его сестру, если вам важно узнать именно о происхождении по линии отца. В других отчетах разница минимальна: например, мужчинам тест может показать вероятность облысения, а женщинам — раннюю или позднюю менопаузу.
Результаты генетического теста не были для меня неожиданными Система показала, что больше всего совпадений ДНК у меня с еще 373 американцами. Скорее всего, просто потому, что этот тест в США сдали больше людей, чем в остальных странах. И это не значит, что все эти 373 человека — мои прямые родственники Мои предполагаемые дальние родственники в РоссииЗакрываю страницу с анализом моего происхождения и перехожу к здоровью. Лаборатория проверила мою ДНК на 18 болезней, в том числе на болезнь Альцгеймера и рак молочной железы.
У меня обнаружился повышенный риск целиакии — это непереносимость глютена — и сердечно-сосудистых заболеваний. Остальные риски были в пределах или ниже нормы, что порадовало. К каждому пункту прилагалось довольно подробное описание на русском языке о дефектном гене и профилактике заболевания, если она возможна. Также мне сообщили, что я не носитель 18 генетических заболеваний, в том числе муковисцидоза и серповидноклеточной анемии, и это тоже было приятно.
Несмотря на все это, я по-прежнему считала, что мне предоставили слишком мало информации. Я скачала с сайта MyHeritage raw data — исходные данные о моей ДНК — и отправилась с ними на другие сайты, которые могут выдать дополнительную информацию для расшифровки генетических тестов.
Где еще можно расшифровать результаты теста
Многие генетические лаборатории рады новым данным, даже если не взяли с пользователя свою сотню долларов. Немало информации они предоставляют бесплатно или за совсем небольшую цену. Например, так делают сайты MyTrueAncestry, FamilyTreeDNA и GEDmatch.
Перед загрузкой сырых данных все сайты просят зарегистрироваться. Ничего особенного не спрашивают: имя, фамилия, электронная почта. Лучше не придумывать псевдоним, потому что на некоторых сайтах можно найти новых родственников — будет удобнее фигурировать под реальным именем. Большинство сайтов англоязычные.
У меня есть хорошая новость для тех, кто боится, что их бесценный генетический материал будут использовать во вред: например, для создания биологического оружия — я действительно видела в интернете такие страшилки. Сайты, где расшифровываются сырые данные после проведения анализов ДНК, обязуются не передавать данные на сторону, а также дают возможность удалить профиль и его содержимое в любой момент.
Сайт GEDmatch позволяет удалить профиль пользователя со всеми даннымиПроисхождение и родственники
MyTrueAncestry. Для желающих получить красивые картинки, рассказывающие о вашем происхождении бесплатно, есть сайт MyTrueAncestry. Строго говоря, без оплаты там дают только часть информации о предках, зато самую интересную.
Так, там есть наглядные карты, которые показывают, как ваши предки заселяли территорию начиная с эпохи неолита. Можно проверить, не приходитесь ли вы родственником венценосным особам, и узнать, к каким народам вы ближе всего по происхождению.
Можно проверить, не приходитесь ли вы родственником венценосным особам, и узнать, к каким народам вы ближе всего по происхождению.
Полный доступ к информации стоит от 150 $ (9239 Р), более дешевые тарифные планы открывают не все данные. Но, на мой взгляд, платить нет смысла: открытой информации вполне достаточно.
В этих областях жили мои предки — балты и скифы. Дело происходило в железном веке, это 905—590 годы до нашей эры А вот здесь жили мои предки — викинги, народы Киевской Руси и ранние славяне около 1100 года нашей эры, на рубеже 11—12 веков Я не родственница французским монархам, а жаль Ближайшие к моему происхождению этносы: литовцы, эстонцы и белорусыFamilyTreeDNA. Загрузка моего файла с сырыми исходными данными на сайт FamilyTreeDNA заняла считаные минуты, а вот отчета мне пришлось ждать несколько часов. В результате у меня нашлось немало совпадений в базе данных с ДНК: некоторые записи перекликались с результатами у MyHeritage, некоторые были новыми. Родственников можно сравнить друг с другом и узнать, совпадают у них участки ДНК или эти люди совсем разных кровей.
Сайт предложил мне узнать больше о происхождении, заказав отчет Family Finder за 19 $ (1170 Р). Без него можно обойтись: подробностей в нем немного, а то, как предки расселялись по Европе, я уже рассмотрела в деталях на предыдущем сайте.
Список родственников пересекается с аналогичным списком на сайте MyHeritage Можно сравнить предполагаемых родственников между собой и узнать, много ли у них общего Сайт FamilyTreeDNA подтвердил, что мои предки из Восточной Европы. В левом нижнем углу экрана — опять предполагаемые родственники Пишут, что я наполовину потомок охотников-собирателей, на 35% — земледельцев, на 14% — степных кочевников Здесь показано, где и когда жили мои предполагаемые предки. На сайте карта интерактивнаяВ целом мне показалось, что данные с разных сайтов о происхождении совпадают. На сайте MyHeritage Прибалтика отделена от Восточной Европы, а на сайте FamilyTreeDNA это считается единым регионом. Африканских или американских корней у меня не нашлось.
Африканских или американских корней у меня не нашлось.
GEDmatch. Еще один полезный и при этом совершенно бесплатный сайт — GEDmatch. Выглядит он архаично, зато не только находит дальних родственников, но и позволяет узнать своих генетических предков, показывая результаты на диаграмме. В зависимости от выбранной географической области и периода результаты, конечно, различаются.
На сайте GEDmatch у меня тоже нашлись родственники Один из калькуляторов происхождения показал, что я на 66,59% потомок северо-восточных европейских племен, на 18,57% — средиземноморских племен времен неолита, на 4,13% — южноазиатских племенЗдоровье и не только
«Генотек». Здоровье в ДНК-тесте меня интересовало больше происхождения. Я загрузила данные на сайт «Генотека», чтобы поддержать отечественных исследователей.
Через несколько минут я получила бесплатную демоверсию отчета о моем здоровье. В нем были рекомендации по диете: предпочтительное пищевое поведение, витамины, информация о непереносимости продуктов. Еще мне рассказали о моем спортивном состоянии: насколько я вынослива и предрасположена к разным видам спорта. Также в отчете были данные об эффективности лекарств: по одной-две позиции в каждом тесте для примера.
О генеалогии и планировании детей лаборатория готова рассказать только за деньги, но стоить это будет существенно дешевле, чем если обратиться за полным набором тестов. Такой набор включает следующие тесты:
- Генеалогия.
- Здоровье.
- Планирование детей.
- Диета и фитнес.
- Таланты и спорт.
- Эффективность лекарств.
Стоимость полного набора тестов в «Генотеке» — 22 500 Р. Первый тест из этого перечня стоит 10 000 Р, остальные — по 2500 Р. А если загрузить в систему свои готовые исходные данные, то каждый из шести перечисленных тестов будет стоить по 2500 Р, причем при заказе в первые сутки после получения демоверсии отчета действует скидка 20%.
«Генотек» обещает проверить биоматериал на предрасположенность к почти 150 заболеваниям. Я заплатила 2000 Р и быстро получила подробный отчет. На сайте есть демоверсия такого отчета, и можно понять, какой объем информации предоставляет лаборатория.
2000 Ря заплатила, чтобы получить отчет о предрасположенностях к заболеваниям
«Генотек» подтвердил, что у меня есть риск развития целиакии и проблем с сердцем, а также обнаружил непереносимость лактозы. Честно говоря, я не особенно люблю молочные продукты, но и проблем с ними не замечала. Помня, что это отчет о генетических рисках, а не подтвержденный анализ крови на аллергию с высокими титрами, я поняла, что исключать лактозу из рациона не нужно. А вот наблюдать за самочувствием стоит.
Любопытно, что в моих генах нашли повышенный риск псориаза — 9% при 3% в среднем по популяции. Еще обнаружили риск витилиго — 2% при среднем риске по популяции менее 1%. Одна из этих болезней есть у моего отца, вторая — у матери. Генетических болезней у меня по-прежнему не обнаружено.
Самые высокие генетические риски указаны в начале отчета Лаборатория дает подробные пояснения по каждому пункту и даже информацию для врача В отдельный список вынесены самые серьезные заболевания Генетические риски можно просчитать даже для сахарного диабета, некоторых видов рака и болезни Альцгеймера. Разумеется, это не заменяет других методов диагностики Как и в случае с MyHeritage, генетических заболеваний у меня не нашли — а отношение организма к лактозе в американской лаборатории не проверяли Наглядная сравнительная таблица рисковGenomelink. На сайте Genomelink можно получить данные о переносимости разных продуктов, физических и личных качествах, спортивной форме. Бесплатно доступны сведения для 25 характеристик, полный пакет из 125 позиций стоит 14 $ (862 Р) в месяц, но первый месяц дается в подарок, если привязать карту. Можно ничего не платить, только потом нужно не забыть отписаться.
В отчетах с этого сайта довольно много подробностей. Показывают даже конкретные цепочки генов, которые отвечают за ту или иную особенность организма. Разумеется, «склонность к курению» не означает, что вы непременно закурите, если никогда не пробовали. А «открытость» не обязательно свидетельствует о том, что вы душа компании. Но какая-то информация все равно может быть полезна.
На сайте можно получить оценку, насколько хорошо я усваиваю витамины, переношу кофеин и насколько я склонна к курению Каждую позицию можно внимательно изучить. Указаны даже гены, отвечающие за конкретную особенность Определение личных качеств, на мой взгляд, вполне достоверно. Можно сделать выводы для работы над собой Размер ушей и склонность к дневному сну можно отнести к смешным результатам тестаSequencing. Еще некоторые факты о здоровье можно узнать, загрузив свои данные на сайт Sequencing. По моему файлу с данными он подтвердил наличие сложностей с лактозой и риска проблем с сердцем, а также дал рекомендации лекарств от сердечно-сосудистых заболеваний.
Спортивную подготовку сайт оценил как среднюю, а способность играть в футбол оценить не смог: было недостаточно данных. Большинство отчетов платные, но постоянно проводятся акции с бесплатным доступом к некоторым из них.
Небольшой риск сердечно-сосудистых заболеваний — совпадение с отчетом MyHeritageЧто надо знать про ДНК-тест
- ДНК-тест можно сдать как в России, так и за границей.
- В некоторые тесты данные о здоровье включены по умолчанию, даже если их расшифровка не оплачена.
- На происхождение лучше тестировать брата, чем сестру: из-за отсутствия у женщин Y-хромосомы вам найдут предков только по женской линии.
- Результаты ДНК тестов — не повод немедленно лечиться от каких-либо заболеваний. Тесты показывают только вероятность.
- Полученные исходные данные можно загружать на другие сайты, чтобы получить больше информации. Почти всегда можно обойтись без дополнительных платежей.

Медицинский генетический паспорт – стоимость, сделать генетический паспорт в СПб
Современные возможности медицины позволяют определить предрасположенности к некоторым заболеваниям до их реального проявления. Подобные данные закодированы на носителе нашей генетической информации – ДНК.
Значение данной информации трудно переоценить, так как она дает как пациенту, так и врачу, мощное оружие против развития возможной болезни. Совокупные данные о факторах предрасположенности к развитию заболеваний называют медицинским генетическим паспортом. В настоящее время наиболее востребованным элементом генетического паспорта является анализ одиночных нуклеотидных полиморфизмов (SNP, single nucleotide polymorphism).
Именно совокупность данных о наличии патологических аллелей SNP позволяет сделать современную доказательную медицину медициной четырех «П»:
- Предсказательной.
- Персонализированной.
- Превентивной (предшествующей началу заболевания).
- Подразумевающей активное участие пациента (следование рекомендациям врача).
Медицинский генетический паспорт не следует путать с криминалистическим генетическим паспортом, используемым для идентификации личности и установления биологического родства.
В медицине наиболее значимой является генетическая информация о рисках развития следующих заболеваний:
- муковисцидоза,
- рака груди и яичников,
- фенилкетонурии,
- остеопороза,
- воспалительных заболеваний кишечника,
- болезни Крона и неспецифического язвенного колита,
- артериальных и венозных тромбозов,
- инфаркта миокарда,
- инсультов,
- миелопролиферативных заболеваний,
- нарушений женской репродуктивной системы,
- мужского и женского бесплодия,
- синдрома Жильбера,
- исследование SNP также необходимо при назначении ряда лекарственных препаратов, например, варфарина, некоторых химиотерапевтических агентов.

Часто именно анализ SNP указывает на истинные причины мультифакторных заболеваний, долгое время не поддававшихся диагностике классическими средствами. В первую очередь это относится к различным нарушениям сердечно-сосудистой системы и женской репродуктивной системы.
Исследования SNP желательно проводить пакетами, так как наиболее полную информацию можно получить лишь при наличии данных о нескольких SNP из одной генной сети. Достоинством генетических исследований является то, что изучение одного полиморфизма достаточно провести один раз в жизни, в дальнейшем расширяя генетический паспорт за счет исследования новых SNP. Генетический паспорт рекомендуется иметь при любом посещении врача – это значительно увеличивает вероятность назначения правильной терапии и скорейшего выздоровления.
Understanding Genetics
-Ученик средней школы из Калифорнии 19 июня 2008 г. Да, определенно возможно создать ген, созданный в лаборатории. Фактически, ученые занимаются этим годами! Первый лабораторный ген был создан тридцать пять лет назад в 1973 году. Ученые сначала начали создавать синтетические гены, вырезая и склеивая части разных генов вместе. Этот «простой» метод за эти годы практически не изменился. Это по-прежнему самый распространенный способ создания гена, созданного в лаборатории.Но со временем технологии улучшились. Таким образом, ученые также могут создавать гены полностью с нуля. Вы можете спросить себя, почему ученые тратят время на создание дизайнерских генов. Оказывается, это совсем не пустая трата времени! Гены, созданные в лаборатории, используются не только учеными для изучения биологии. Они также используются для изготовления таких жизненно важных лекарств, как инсулин. Совсем недавно их также использовали для создания генов, используемых в генной терапии и генетически модифицированных продуктах питания. Давайте узнаем больше о том, как создаются гены, созданные в лаборатории, и почему. Но прежде чем мы сможем говорить о создании гена, мы должны понять, что такое ген и для чего он нужен. Создание генов в лаборатории Ген – это фрагмент ДНК, у которого есть инструкции по созданию белка. В этих инструкциях также указано, когда и сколько нужно производить белка. Белки – это молекулы, которые участвуют практически во всем, что делает клетка. Причина, по которой ученые конструируют новый ген, обычно заключается в том, что они хотят что-то изменить в старом гене. Они хотят изменить то, что делает белок, где он находится или сколько из него вырабатывается.Они также могут повлиять на то, вырабатывается ли белок в человеке, бактерии, мыши и т. Д. Когда ученый меняет ген, это называется рекомбинантной технологией. Все это на самом деле означает новое сочетание ДНК. Как я сказал ранее, у ученых есть два основных способа создания рекомбинантной ДНК. Самый распространенный – вырезание и склеивание генов или частей генов. Второй – создание синтетического гена прямо из ДНК. Например, представьте, что ген – это слова, в которых буквы – это ДНК.Чтобы составить слово «баскетбол», вы можете вырезать и вставить слова « корзина » и « мяч oon» вместе. Или вы можете использовать буквы b, a, s, k, e, t и l, чтобы составить слово с нуля. В обоих этих примерах мы рекомбинируем буквы, чтобы образовать новое слово. Один метод использует уже существующие слова для создания нового слова. Другой составляет слово из отдельных букв. Это то же самое, что рекомбинация ДНК для создания нового гена. Итак, как именно можно рекомбинировать ДНК для создания гена? Давайте быстро рассмотрим структуру ДНК, чтобы понять, как это делается.ДНК – это двухцепочечная молекула. Каждая из двух цепей состоит из цепочки нуклеотидов, сокращенно A, G, T и C. В порядке расположения этих букв указаны инструкции о том, как, когда, где и сколько нужно сделать белка. Один из способов создания синтетического гена – это рекомбинировать эти инструкции. Смешивание и согласование Например, предположим, что мы хотим произвести инсулин в бактериях.
Но прежде чем мы сможем говорить о создании гена, мы должны понять, что такое ген и для чего он нужен. Создание генов в лаборатории Ген – это фрагмент ДНК, у которого есть инструкции по созданию белка. В этих инструкциях также указано, когда и сколько нужно производить белка. Белки – это молекулы, которые участвуют практически во всем, что делает клетка. Причина, по которой ученые конструируют новый ген, обычно заключается в том, что они хотят что-то изменить в старом гене. Они хотят изменить то, что делает белок, где он находится или сколько из него вырабатывается.Они также могут повлиять на то, вырабатывается ли белок в человеке, бактерии, мыши и т. Д. Когда ученый меняет ген, это называется рекомбинантной технологией. Все это на самом деле означает новое сочетание ДНК. Как я сказал ранее, у ученых есть два основных способа создания рекомбинантной ДНК. Самый распространенный – вырезание и склеивание генов или частей генов. Второй – создание синтетического гена прямо из ДНК. Например, представьте, что ген – это слова, в которых буквы – это ДНК.Чтобы составить слово «баскетбол», вы можете вырезать и вставить слова « корзина » и « мяч oon» вместе. Или вы можете использовать буквы b, a, s, k, e, t и l, чтобы составить слово с нуля. В обоих этих примерах мы рекомбинируем буквы, чтобы образовать новое слово. Один метод использует уже существующие слова для создания нового слова. Другой составляет слово из отдельных букв. Это то же самое, что рекомбинация ДНК для создания нового гена. Итак, как именно можно рекомбинировать ДНК для создания гена? Давайте быстро рассмотрим структуру ДНК, чтобы понять, как это делается.ДНК – это двухцепочечная молекула. Каждая из двух цепей состоит из цепочки нуклеотидов, сокращенно A, G, T и C. В порядке расположения этих букв указаны инструкции о том, как, когда, где и сколько нужно сделать белка. Один из способов создания синтетического гена – это рекомбинировать эти инструкции. Смешивание и согласование Например, предположим, что мы хотим произвести инсулин в бактериях. Для этого нам нужно объединить человеческие инструкции о том, как производить белок, с бактериальными инструкциями о том, где и сколько нужно производить.
Для этого нам нужно объединить человеческие инструкции о том, как производить белок, с бактериальными инструкциями о том, где и сколько нужно производить.| Создание нового гена из ранее существовавших генов с использованием метода вырезания и вставки. Щелкните изображение для получения дополнительных сведений. |
| Создание нового гена с нуля с использованием нуклеотидов ДНК. Щелкните изображение для получения дополнительных сведений.  |
| Использование светящихся белков медузы , чтобы увидеть белки в клетке человека . Щелкните изображение, чтобы увидеть более деталей. |
 Поэтому им нужно каждый день вводить себе инсулин, чтобы оставаться здоровыми. Ученые взяли копию гена инсулина у человека и поместили ее в бактерии. Бактерии теперь производят много белка инсулина из ДНК.Так что бактерии превращаются в фабрику по производству инсулина! И инсулин – не единственный препарат, производимый таким образом. Другие примеры включают такие лекарства, как EPO или гормон роста. Ученые также используют рекомбинантную ДНК для создания лекарств из бактерий, которые могут бороться с малярией или пытаться вылечить аллергию на арахис. И есть еще много примеров. В будущем возможности рекомбинантной ДНК безграничны. Только в прошлом году ученые смогли полностью с нуля создать ДНК определенного типа бактерий.Несмотря на то, что у этой бактерии довольно маленький геном, его длина составляет 582970 нуклеотидов! Знание того, как воссоздать ДНК из бактерий, означает, что теперь ученые могут создавать организмы-конструкторы, а не только гены-конструкторы. И это только начало. Рекомбинантная ДНК будет продолжать улучшать наши посевы, производить лучшие лекарства и делать то, о чем мы еще даже не думали. Джеки Бенджамин
Поэтому им нужно каждый день вводить себе инсулин, чтобы оставаться здоровыми. Ученые взяли копию гена инсулина у человека и поместили ее в бактерии. Бактерии теперь производят много белка инсулина из ДНК.Так что бактерии превращаются в фабрику по производству инсулина! И инсулин – не единственный препарат, производимый таким образом. Другие примеры включают такие лекарства, как EPO или гормон роста. Ученые также используют рекомбинантную ДНК для создания лекарств из бактерий, которые могут бороться с малярией или пытаться вылечить аллергию на арахис. И есть еще много примеров. В будущем возможности рекомбинантной ДНК безграничны. Только в прошлом году ученые смогли полностью с нуля создать ДНК определенного типа бактерий.Несмотря на то, что у этой бактерии довольно маленький геном, его длина составляет 582970 нуклеотидов! Знание того, как воссоздать ДНК из бактерий, означает, что теперь ученые могут создавать организмы-конструкторы, а не только гены-конструкторы. И это только начало. Рекомбинантная ДНК будет продолжать улучшать наши посевы, производить лучшие лекарства и делать то, о чем мы еще даже не думали. Джеки Бенджамин Дополнительная информация
* 1) Для методов рекомбинантной ДНК: щелкните Manipulation (на верхней панели инструментов), затем щелкните модуль Techniques .* 2) Для производства искусственного инсулина: щелкните Manipulation (на верхней панели инструментов), затем щелкните модуль Production .Как сделать ГМО
Челси Пауэлл
Фигурки Анны Маурер
Резюме: Генетически модифицированные организмы (ГМО) – это организмы, которые были изменены с помощью методов генной инженерии. Хотя генная инженерия является распространенной и важной практикой в биотехнологии, ее конкретное использование в сельскохозяйственных культурах вызывает споры.Ключевыми этапами генной инженерии являются определение интересующего признака, выделение этого признака, вставка этого признака в желаемый организм и затем размножение этого организма. За последнее столетие методы генетической манипуляции быстро улучшились: от простого селекционного разведения до вставки генов из одного организма в другой и до более современных методов прямого редактирования генома.
За последнее столетие методы генетической манипуляции быстро улучшились: от простого селекционного разведения до вставки генов из одного организма в другой и до более современных методов прямого редактирования генома.
–
Что считается ГМО?
Распространенное заблуждение состоит в том, что любое животное или растение, находящееся за пределами нашей терминологии «натуральное», является ГМО.На ум приходят изображения аномально больших коров и помидоров. Однако научное сообщество и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) используют более строгое определение ГМО: животное или растение, созданное с помощью генной инженерии [1]. Генная инженерия – это термин, используемый для описания биотехнологических методов, используемых учеными для непосредственного управления геномом организма. В соответствии с этим определением ГМО не включают растения или животных, полученных путем селекции, или животных, модифицированных путем введения гормональных добавок или антибиотиков.Фактически, в настоящее время мы не едим мясные продукты, которые считаются ГМО, хотя сельскохозяйственных животных можно кормить генетически модифицированными культурами [2].
Основная цель большинства методов генной инженерии, выполняемых в отношении пищевых продуктов, состоит в повышении урожайности сельскохозяйственных культур и / или улучшении питательной ценности кормов для животных. Никакие генно-инженерные культуры на рынке США не были модифицированы до необычно больших размеров (Таблица 1). Изображения чрезвычайно крупных овощей, используемые для поддержки имиджа ГМО «Franken-food», вероятно, вовсе не являются ГМО; необычно большой овощ, скорее всего, будет создан менее спорными методами селекции или добавками питательных веществ, а не генной инженерией.
Процесс генной инженерии
Генная инженерия широко используется в биологических исследованиях. Мышиные модели созданы для биомедицинских исследований, бактерии созданы для производства лекарств, таких как инсулин, а сельскохозяйственные культуры созданы для сельского хозяйства. Все эти продукты генной инженерии были созданы с использованием одних и тех же основных шагов: определение интересующего признака, выделение этого генетического признака, вставка этого признака в геном желаемого организма, а затем выращивание сконструированного организма (рис. 1).Эти шаги подробно объясняются ниже с использованием примеров от Monsanto, поскольку подробности их технологий общедоступны. Другие крупные компании, такие как Syngenta, BASF, Dow, Bayer и Du Pont, используют аналогичные методы, как вкратце изложено на их соответствующих веб-сайтах [3, 4, 5, 6, 7].
Все эти продукты генной инженерии были созданы с использованием одних и тех же основных шагов: определение интересующего признака, выделение этого генетического признака, вставка этого признака в геном желаемого организма, а затем выращивание сконструированного организма (рис. 1).Эти шаги подробно объясняются ниже с использованием примеров от Monsanto, поскольку подробности их технологий общедоступны. Другие крупные компании, такие как Syngenta, BASF, Dow, Bayer и Du Pont, используют аналогичные методы, как вкратце изложено на их соответствующих веб-сайтах [3, 4, 5, 6, 7].
Шаг 1: Определите интересующую черту
Чтобы определить новую желательную черту, ученые чаще всего обращаются к природе. Успешное открытие интересующего нас нового генетического признака часто является комбинацией критического мышления и удачи.Например, если исследователи ищут признак, который позволил бы урожаю выжить в конкретной среде, они будут искать организмы, которые естественным образом способны выжить в этой конкретной среде. Или, если исследователи стремятся улучшить питательную ценность сельскохозяйственных культур, они будут проверять список растений, которые, по их гипотезе, производят интересующее питательное вещество.
Примером свойства, которое в настоящее время является ГМО, которое было выявлено благодаря этой комбинации удачи и критического мышления, является толерантность к гербициду Roundup (см. Эту статью).Компания Monsanto создала растения «Roundup Ready» после обнаружения бактерий, растущих рядом с фабрикой Roundup, которые содержали ген, позволяющий им выживать в присутствии гербицида [8]. Хотя Syngenta разработала золотой рис с повышенным количеством провитамина А, который человеческий организм может превратить в витамин А, несмотря на то, что его нет на рынке в Соединенных Штатах, Syngenta разработала. Исследователи Syngenta определили последовательность гена, производящего провитамин А, и составили список растений для скрининга с этой последовательностью [9]. Если повезет, в природе было растение, кукуруза, которая содержала ген, который заставлял золотой рис вырабатывать провитамин А на уровне, который мог удовлетворить потребности в питании сообществ, испытывающих дефицит витамина А.
Если повезет, в природе было растение, кукуруза, которая содержала ген, который заставлял золотой рис вырабатывать провитамин А на уровне, который мог удовлетворить потребности в питании сообществ, испытывающих дефицит витамина А.
Шаг 2: Выделить интересующий генетический признак
Сравнительный анализ используется для расшифровки того, какая часть генетического состава организма содержит интересующий признак. Геномы растений с признаком сравниваются с геномами того же вида без признака с целью идентификации генов, присутствующих только в первом [8].Геномы разных видов с одним и тем же признаком также можно сравнивать, чтобы идентифицировать ген, как это было при разработке золотого риса [9]. Если нет базы данных генетической информации для сравнения, ученые намеренно удаляют или «выбивают» части интересующего генома до тех пор, пока желаемый признак не будет потерян, тем самым идентифицируя гены, которые приводят к этому признаку.
Чтобы ускорить этот процесс, Monsanto разработала и запатентовала метод, известный как измельчение семян [8].С помощью этого метода Monsanto обрезает части семян для высокопроизводительного генетического секвенирования, оставляя остальные семена пригодными для посева. Это создает генетическую базу данных для растений еще до того, как они будут выращены, где система штрих-кода используется для сопоставления растений с их генотипами. Затем исследователи могут использовать эту базу данных для выявления новых представляющих интерес признаков, а также для оптимизации желаемых признаков в культуре путем отбора лучших генотипов на основе фенотипов растений.
Шаг 3: Вставьте желаемый генетический признак в новый геном
Изменить геном семян растений сложно из-за их жесткой структуры.Многие биотехнологические компании используют «генные пушки», которые стреляют металлическими частицами, покрытыми ДНК, в ткани растений с зарядом 0,22-го калибра [8]. Monsanto больше не использует генные пушки, а вместо этого использует бактерии, называемые Agrobacterium tumefaciens, , которые естественным образом проникают в семена и изменяют растения, вставляя фрагменты своей собственной ДНК в геном растения.
В биотехнологических исследованиях принято генетически создавать бактерии для производства желаемого белка. Это делается с помощью ферментов для вырезания и вставки интересующей цепи ДНК в плазмиду, которая представляет собой небольшую кольцевую молекулу ДНК [10].Затем бактерии подвергаются шоку с помощью тепла или электричества, так что клетки принимают сконструированную плазмиду. Изменяя A. tumefaciens, , который легче модифицировать, чем сами семена растений, исследователи могут использовать естественное инвазивное поведение бактерий в качестве троянского коня для внесения желаемых признаков в геном растения.
Этап 4: Выращивание ГМО
После того, как генетический признак был успешно вставлен в геном организма, модифицированный организм должен иметь возможность расти и воспроизводиться с его недавно созданным геномом.Во-первых, необходимо проверить генотип организмов, чтобы исследователи могли размножать только те организмы, геном которых был изменен правильно.
Биотехнологические компании инвестируют большие суммы в поддержание жизни этих растений и их воспроизводство после того, как они были успешно созданы. Компании используют специальные камеры для выращивания с контролируемым климатом, и биологи часто проверяют растения вручную, чтобы убедиться, что они растут, как ожидалось [8].
В ходе этого процесса биотехнологические компании будут использовать автоматизированные машины, такие как сеялки Monsanto GenV, для отслеживания растений и расчета оптимальных условий посева и роста для получения максимально возможных урожаев.ГМО-семена часто поставляются с инструкциями по интервалам и питанию, которые являются результатом этих исследований.
Будущие направления создания ГМО
Способность человека изменять сельскохозяйственные культуры для повышения урожайности и повышения питательных веществ в данной среде является краеугольным камнем сельского хозяйства. Технологический прогресс от селекции до генной инженерии открыл множество возможностей для будущего нашей пищи. По мере того, как методы генной инженерии, такие как новые технологии на основе РНК- и нуклеаз, которые позволяют напрямую модифицировать геном (см. Эту статью и эту статью), неуклонно совершенствуются, наша способность создавать новые ГМО также будет расти [11].По мере расширения наших научных возможностей важно, чтобы мы обсуждали этику и идеалы, связанные с ГМО, чтобы мы могли эффективно и безопасно использовать эту технологию так, чтобы это было приемлемо для общественности.
По мере того, как методы генной инженерии, такие как новые технологии на основе РНК- и нуклеаз, которые позволяют напрямую модифицировать геном (см. Эту статью и эту статью), неуклонно совершенствуются, наша способность создавать новые ГМО также будет расти [11].По мере расширения наших научных возможностей важно, чтобы мы обсуждали этику и идеалы, связанные с ГМО, чтобы мы могли эффективно и безопасно использовать эту технологию так, чтобы это было приемлемо для общественности.
Таблица 1. Краткое изложение перечня завершенных консультаций по биотехнологии по генетически модифицированным продуктам FDA по состоянию на 30 июня 2015 года. Культуры перечислены в порядке относительного количества консультаций по генетически модифицированным культурам (по кукурузе больше всего консультаций).Эта информация общедоступна:
http://www.accessdata.fda.gov/scripts/fdcc/index.cfm?set=Biocon
Челси Пауэлл – аспирант программы химической биологии Гарвардского университета.
Эта статья является частью специального выпуска за август 2015 г., «Генетически модифицированные организмы и наша пища».
Список литературы
1. «Вопросы и ответы о продуктах питания из генетически модифицированных растений». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. U.С. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, 22 июня 2015 г. http://www.fda.gov/Food/FoodScienceResearch/Biotechnology/ucm346030.htm
2. Cossins, Daniel. «Будем ли мы когда-нибудь есть генетически модифицированное мясо?» BBC. BBC, 9 марта 2015 г. http://www.bbc.com/future/story/20150309-will-we-ever-eat-gm-meat
3. http://www.syngenta.com/global/corporate /en/products-and-innovation/research-development/rdapproach/Pages/research-areas.aspx
4. https://www.basf.com/en/company/research/our-focus/plant-biotechnology.html
5.http://www.dowagro.com/innovation/
6. http://www.cropscience.bayer.com/en/Products-and-Innovation/Research-and-Innovation.aspx
http://www.cropscience.bayer.com/en/Products-and-Innovation/Research-and-Innovation.aspx
7. http: // www .dupont.com / Industries / farm.html
8. Бойл, Ребекка. «Как генетически модифицировать семя, шаг за шагом». Популярная наука. Popular Science, 24 января 2011 г. http://www.popsci.com/science/article/2011-01/life-cycle-genetically-modified-seed
9. Пейн, Жаклин А., Кэтрин А. Шиптон, Сунанда Чаггар, Риан М. Хауэллс, Майк Дж. Кеннеди, Гарет Вернон, Сьюзан Ю.Райт, Эдвард Хинчлифф, Джессика Л. Адамс, Арон Л. Сильверстоун и Рэйчел Дрейк. «Повышение пищевой ценности золотого риса за счет увеличения содержания провитамина А.» Nature Biotechnology 23.4 (2005): 482-87. http://www.ncbi.nlm.nih.gov/pubmed/15793573
10. «Генная инженерия». BBC. BBC, 2015. Интернет. http://www.bbc.co.uk/education/guides/zg2bkqt/revision/2
11. Сюй, Патрик Д., Эрик С. Ландер и Фэн Чжан. «Разработка и применение CRISPR-Cas9 для геномной инженерии». Ячейка 157.6 (2014): 1262-278.
http://www.sciencedirect.com/science/article/pii/S00414006047
12. «Консультации по биотехнологии по пищевым продуктам из сортов растений GE». Консультации по биотехнологии продуктов питания из сортов растений GE. FDA, 30 июня 2015 г. http://www.accessdata.fda.gov/scripts/fdcc/index.cfm?set=Biocon
Если вы хотите создать ген с нуля
Согласно New York Times, синтетическая биология создает ДНК из воздуха. В недавней статье о синтетической биологии и потребительских товарах синтез ДНК описывается как процесс, при котором «ДНК создается на компьютере и вводится в организмы.«Компьютеры – это круто, и они действительно полезны в лабораториях синтетической биологии, но чтобы превратить текстовый файл, полный Т и С, в ДНК, нужно гораздо больше, чем компьютер.
Я не хочу просто придираться к научным журналистам здесь , потому что чрезмерно распространенные аналогии с компьютерами и другими «футуристическими» устройствами широко распространены в синтетической биологии, скрывая реалии инженерной биологии за языком битов и схем. В 2010 году Крейг Вентер объявил, что его исследовательская группа секвенировала и повторно синтезировала геном небольшая бактерия, создавшая то, что он назвал «первым самовоспроизводящимся видом на планете, родителем которого является компьютер.Позже Вентер объявил, что синтез ДНК был похож на организмы «3D-печати», и что они работали над «факсом», чтобы скопировать жизнь на Марсе.
В 2010 году Крейг Вентер объявил, что его исследовательская группа секвенировала и повторно синтезировала геном небольшая бактерия, создавшая то, что он назвал «первым самовоспроизводящимся видом на планете, родителем которого является компьютер.Позже Вентер объявил, что синтез ДНК был похож на организмы «3D-печати», и что они работали над «факсом», чтобы скопировать жизнь на Марсе.
Эти аналогии делают переключение между живым организмом и файлами последовательностей ДНК столь же простым, как нажатие кнопки «печать». Иногда это действительно так и описывают – в Grist Натанаэль Джонсон говорит, что синтетическая биология – это создание генов с нуля: «вы вводите нужную ДНК, распечатываете ее и превращаете в дрожжи». Действительно, для среднестатистического сотрудника лаборатории заказ нестандартных последовательностей ДНК в компании по синтезу стал рутинной задачей: мы вводим последовательности в онлайн-форму и через несколько дней получаем ДНК по почте.Но как нам понять, какую ДНК набирать и что происходит между нажатием кнопки «Заказать сейчас» и получением ДНК по почте? Откуда взялась ДНК?
Сделано создание клавиатуры моей мечты. Теперь обновим мои привязки Emacs! pic.twitter.com/IdubFDLCN9
– Патрик Бойл (@p_maverick_b) 1 апреля 2014 г. Если вы хотите создать последовательность ДНК «с нуля», вам, вероятно, не удастся заставить свой белок сворачиваться. Очень немногие исследователи, подпадающие под действие синтетической биологии, на самом деле работают над созданием генов полностью «с нуля» или, как сказали бы ученые, «de novo», а не на основе каких-либо существующих генов, обнаруженных у других организмов.Для пептида из 100 аминокислот существует больше возможных последовательностей, чем атомов в наблюдаемой вселенной. Из этих возможных последовательностей только крошечная фракция сможет свернуться в трехмерную форму белка, и из них очень крошечная часть будет иметь биологическую функцию. За последние два десятилетия в этой области было идентифицировано «несколько» последовательностей de novo с использованием комбинации вычислительных методов для прогнозирования мелкомасштабного сворачивания белка и комбинаторной химии для отбора пептидов с любой функцией вообще.
Большинство синтетических биологов не конструируют таким образом последовательности генов; эта область была основана на идее, что не должны строить новые проекты генной инженерии с нуля. Вместо этого синтетические биологи хотят построить новые связи между генами из библиотеки существующих генов, которые были секвенированы и охарактеризованы другими биологами и инженерами. Синтетические биологи смешивают и сопоставляют гены от разных организмов или изменяют части генов, чтобы изменить то, как белки экспрессируются или как они функционируют в живой клетке.Это сочетание и совпадение последовательностей ДНК может быть создано с использованием «традиционных» инструментов генной инженерии для вырезания и вставки ДНК с использованием ферментов или передано на аутсорсинг компании по синтезу, которая будет использовать химию для создания молекулы ДНК.
Если вы хотите создать молекулу ДНК с нуля, вы должны сначала создать несколько атомов. ДНК – это органическая химическая молекула, состоящая из атомов углерода, водорода, азота, кислорода и фосфора. Как и многие другие органические молекулы, которые образуются внутри живых клеток, ДНК также можно синтезировать в пробирках с использованием инструментов органической химии.В большинстве описаний технологии синтеза ДНК мы слышим, что последовательности ДНК можно создать, просто сложив вместе буквы Т, С и G – «основания», образующие ступеньки скрученной лестницы ДНК. Но откуда эти базы? Какова цепочка поставок для производства ДНК?
Автоматический химический синтез ДНК начинается с оснований ДНК, которые были химически модифицированы для защиты высокореактивных частей молекулы от связывания друг с другом и образования нежелательных побочных продуктов.Каждое из этих оснований и их защитные группы состоит из комбинации других молекул, каждая из которых имеет свою серию химических реакций, исходное сырье и экономику цепочки поставок. Например, «основная» часть аденина («А») и гуанина («G») представляет собой пуриновое кольцо, которое химически синтезируется путем нагревания формамида при 160-200 градусах Цельсия. Формамид образуется в результате реакции окиси углерода и аммиака. Аммиак получают, нагревая азот из воздуха до высоких температур под высоким давлением и смешивая его с водородом, который получается при сжигании природного газа, который извлекается из подземных запасов путем крекинга горных пород жидкостями под высоким давлением.
Формамид образуется в результате реакции окиси углерода и аммиака. Аммиак получают, нагревая азот из воздуха до высоких температур под высоким давлением и смешивая его с водородом, который получается при сжигании природного газа, который извлекается из подземных запасов путем крекинга горных пород жидкостями под высоким давлением.
В синтетической биологии физическая реальность ДНК как химического вещества аналогична транзисторам, из которых состоят компьютерные микросхемы, ее исходная последовательность оснований является «кодом сборки». Это слои, о которых большинству программистов не нужно думать при разработке программного обеспечения, точно так же, как большинство синтетических биологов не обязательно думают о том, как создается ДНК, когда они проектируют метаболические пути. Но эта абстракция в инженерной иерархии не означает, что нижние уровни не важны или возникают как-то сами по себе, и уж точно не «с нуля».”
Дебаты о растущей индустрии синтетической биологии, разыгрывающиеся на страницах New York Times и Grist, связаны с тем, что мы знаем, откуда берутся химические вещества в наших потребительских товарах, кто их производит и как. Эти статьи начинают освещать для широкой общественности, как процессы синтетической биологии становятся частью чрезвычайно сложной глобальной цепочки поставок химикатов. Пока мы раскрываем растущую роль синтетической биологии в промышленности, давайте не будем определять эту область с помощью языка, который скрывает, как сама синтетическая биология сделан.
Что такое генная инженерия? | Факты
Генная инженерия относится к прямым манипуляциям с ДНК для изменения характеристик (фенотипа) организма определенным образом.
Что такое генная инженерия?
- Генная инженерия, иногда называемая генетической модификацией, – это процесс изменения ДНК в геноме организма.
- Это может означать изменение одной пары оснований (A-T или C-G), удаление всей области ДНК или введение дополнительной копии гена.

- Это также может означать извлечение ДНК из генома другого организма и объединение ее с ДНК этого человека.
- Генная инженерия используется учеными для улучшения или изменения характеристик отдельного организма.
- Генную инженерию можно применить к любому организму, от вируса до овцы.
- Например, генная инженерия может использоваться для получения растений, которые имеют более высокую питательную ценность или могут выдерживать воздействие гербицидов.
Как работает генная инженерия?
Чтобы объяснить процесс генной инженерии, мы взяли в качестве примера инсулин, белок, который помогает регулировать уровень сахара в нашей крови.
- Обычно инсулин вырабатывается в поджелудочной железе, но у людей с диабетом 1 типа возникает проблема с производством инсулина.
- Люди с диабетом должны вводить инсулин, чтобы контролировать уровень сахара в крови.
- С помощью генной инженерии из дрожжей и бактерий, таких как E.coli .
- Этот генетически модифицированный инсулин, «Хумулин», был лицензирован для использования человеком в 1982 году.
Процесс генной инженерии
- Небольшой фрагмент кольцевой ДНК, называемый плазмидой, извлекается из бактерий или дрожжевых клеток.
- Затем из кольцевой плазмиды вырезают небольшой участок рестрикционными ферментами, «молекулярными ножницами».
- Ген человеческого инсулина вставлен в разрыв плазмиды. Эта плазмида теперь генетически модифицирована.
- Генетически модифицированная плазмида вводится в новую бактериальную или дрожжевую клетку.
- Затем эта клетка быстро делится и начинает вырабатывать инсулин.
- Для создания большого количества клеток генетически модифицированные бактерии или дрожжи выращивают в больших сосудах для ферментации, которые содержат все необходимые им питательные вещества. Чем больше делятся клетки, тем больше вырабатывается инсулина.

- По окончании ферментации смесь фильтруют, чтобы высвободить инсулин.
- Затем инсулин очищается и расфасовывается во флаконы и инсулиновые ручки для распределения среди пациентов с диабетом.
Иллюстрация, показывающая, как генетическая модификация используется для производства инсулина в бактериях.
Изображение предоставлено: Genome Research Limited
Для чего еще используется генная инженерия?
- Первым генетически модифицированным организмом, который был создан в 1973 году, была бактерия.
- В 1974 году те же методы были применены к мышам.
- В 1994 году появились первые генетически модифицированные продукты питания.
- Генная инженерия имеет ряд полезных приложений, включая научные исследования, сельское хозяйство и технологии.
- В растениях генная инженерия применялась для повышения устойчивости, питательной ценности и скорости роста таких сельскохозяйственных культур, как картофель, томаты и рис.
- У животных он был использован для выращивания овец, которые вырабатывают в своем молоке терапевтический белок, который можно использовать для лечения муковисцидоза или червей, светящихся в темноте, чтобы ученые могли больше узнать о таких заболеваниях, как болезнь Альцгеймера.
Болезнь Альцгеймера и червь
- Червь нематода, C.elegans , имеет всего около 300 клеток во всей нервной системе, что делает его очень простой моделью для изучения болезни Альцгеймера.
- Кроме того, поскольку червь почти прозрачен, когда его нервные клетки помечены зеленым флуоресцентным белком (GFP), можно наблюдать за расположением и активностью различных структур и белков под микроскопом.
- Генетический материал C. elegans можно легко генетически модифицировать, чтобы заставить червя производить специфические белки, которые исследователи хотят изучить.
- У человека ген APP кодирует белок, связанный с амилоидными бляшками, характерными для людей с болезнью Альцгеймера.

- Итак, чтобы изучить болезнь Альцгеймера, исследователи генетически сконструировали нервные клетки червя, содержащие ген APP , что фактически привело к болезни Альцгеймера.
- Помечая белок APP, продуцируемый червем, зеленым флуоресцентным белком, можно было увидеть, что все клетки, которые контактировали с APP, погибли по мере старения червя.
- Затем исследователи смогли отслеживать прогрессирование болезни Альцгеймера у червя и применить свои результаты для понимания роли APP у людей с болезнью Альцгеймера.
Эта страница последний раз обновлялась 17.02.2017.
Что такое редактирование генов и как с его помощью можно переписать код жизни? | Генетика
Так что же такое редактирование генов?
Ученые сравнивают его с функцией поиска и замены, используемой для исправления орфографических ошибок в документах, написанных на компьютере.Вместо исправления слов редактирование генов переписывает ДНК, биологический код, составляющий инструкции по эксплуатации живых организмов. С помощью редактирования генов исследователи могут отключать гены-мишени, исправлять вредные мутации и изменять активность определенных генов у растений и животных, включая человека.
В чем смысл?
Большая часть ажиотажа вокруг редактирования генов вызвана его способностью лечить или предотвращать болезни человека. Существуют тысячи генетических заболеваний, которые могут передаваться от одного поколения к другому; многие из них серьезны и изнурительны.Они не редкость: каждый 25-й ребенок рождается с генетическим заболеванием. Среди наиболее распространенных – муковисцидоз, серповидно-клеточная анемия и мышечная дистрофия. Редактирование генов обещает лечить эти расстройства путем переписывания поврежденной ДНК в клетках пациентов. Но он может сделать гораздо больше, чем исправить неисправные гены. Редактирование генов уже использовалось для модификации иммунных клеток людей для борьбы с раком или обеспечения устойчивости к ВИЧ-инфекции. Его также можно использовать для исправления дефектных генов в человеческих эмбрионах и предотвращения наследования серьезных заболеваний младенцами.Это является спорным, так как генетические изменения будут влиять на их сперму или яйцеклетки, то есть генетические изменения и любые отрицательные побочные эффекты могут быть переданы будущим поколениям.
Его также можно использовать для исправления дефектных генов в человеческих эмбрионах и предотвращения наследования серьезных заболеваний младенцами.Это является спорным, так как генетические изменения будут влиять на их сперму или яйцеклетки, то есть генетические изменения и любые отрицательные побочные эффекты могут быть переданы будущим поколениям.
Чем еще он хорош?
Сельскохозяйственная отрасль сделала рывок к редактированию генов по целому ряду причин. Эта процедура быстрее, дешевле и точнее, чем обычная генетическая модификация, но она также имеет то преимущество, что позволяет производителям улучшать урожай без добавления генов других организмов – что вызвало негативную реакцию против ГМ-культур в некоторых регионах.С помощью редактирования генов исследователи получили помидоры без косточек, пшеницу без глютена и грибы, которые не становятся коричневыми при старении. Другие отрасли медицины также воспользовались его потенциалом. Компании, работающие над антибиотиками следующего поколения, разработали безвредные вирусы, которые находят и атакуют определенные штаммы бактерий, вызывающих опасные инфекции. Между тем, исследователи используют редактирование генов, чтобы сделать органы свиньи безопасными для трансплантации человеку. Редактирование генов также изменило фундаментальные исследования, позволив ученым точно понять, как действуют определенные гены.
Так как это работает?
Есть много способов редактировать гены, но самым большим достижением последних лет является молекулярный инструмент под названием Crispr-Cas9. Он использует направляющую молекулу (бит Crispr) для поиска определенной области в генетическом коде организма – например, мутированного гена – который затем разрезается ферментом (Cas9). Когда клетка пытается исправить повреждение, она часто делает из него хэш и фактически отключает ген. Это само по себе полезно для отключения вредных генов.Но возможны и другие виды ремонта. Например, чтобы исправить неисправный ген, ученые могут разрезать мутировавшую ДНК и заменить ее здоровой цепью, которая вводится вместе с молекулами Crispr-Cas9. Вместо Cas9 можно использовать другие ферменты, такие как Cpf1, которые могут помочь более эффективно редактировать ДНК.
Вместо Cas9 можно использовать другие ферменты, такие как Cpf1, которые могут помочь более эффективно редактировать ДНК.
Напомните снова, что такое гены?
Гены – это биологические шаблоны, которые организм использует для создания структурных белков и ферментов, необходимых для создания и поддержания тканей и органов.Они состоят из цепочек генетического кода, обозначаемых буквами G, C, T и A. У людей около 20 000 генов, связанных в 23 пары хромосом, все свернутые в ядре почти каждой клетки тела. Только около 1,5% нашего генетического кода или генома состоит из генов. Еще 10% регулируют их, обеспечивая, например, включение и выключение генов в нужных клетках в нужное время. Остальная часть нашей ДНК явно бесполезна. «Большая часть нашего генома ничего не делает», – говорит Гертон Лантер, генетик из Оксфордского университета.«Это просто эволюционный мусор».
Что это за G, C, Ts и As?
Буквы генетического кода относятся к молекулам гуанина (G), цитозина (C), тимина (T) и аденина (A). В ДНК эти молекулы объединяются в пары: G с C и T с A. Эти «пары оснований» становятся ступеньками знакомой двойной спирали ДНК. Чтобы создать ген, их нужно много. Ген, поврежденный при муковисцидозе, содержит около 300000 пар оснований, в то время как тот, который мутировал при мышечной дистрофии, имеет около 2.5 миллионов пар оснований, что делает его крупнейшим геном в организме человека. Каждый из нас наследует около 60 новых мутаций от родителей, большинство из которых происходит от отца.
Но как добраться до нужных ячеек?
Это большая проблема. Большинство лекарств представляют собой небольшие молекулы, которые могут перемещаться по телу в кровотоке и по пути доставляться к органам и тканям. По сравнению с ними молекулы для редактирования генов огромны, и им трудно попасть в клетки. Но это может быть сделано. Один из способов – упаковать молекулы, редактирующие ген, в безвредные вирусы, которые заражают определенные типы клеток. Затем миллионы из них вводятся в кровоток или непосредственно в пораженные ткани. Попадая в организм, вирусы проникают в клетки-мишени и высвобождают молекулы, редактирующие ген, для выполнения своей работы. В 2017 году ученые из Техаса использовали этот подход для лечения мышечной дистрофии Дюшенна у мышей. Следующим шагом будет клиническое испытание на людях. Однако вирусы – не единственный способ сделать это. Исследователи использовали жирные наночастицы для переноса молекул Crispr-Cas9 в печень и крошечные разряды электричества, чтобы открыть поры в эмбрионах, через которые могут проникать молекулы, редактирующие гены.
Затем миллионы из них вводятся в кровоток или непосредственно в пораженные ткани. Попадая в организм, вирусы проникают в клетки-мишени и высвобождают молекулы, редактирующие ген, для выполнения своей работы. В 2017 году ученые из Техаса использовали этот подход для лечения мышечной дистрофии Дюшенна у мышей. Следующим шагом будет клиническое испытание на людях. Однако вирусы – не единственный способ сделать это. Исследователи использовали жирные наночастицы для переноса молекул Crispr-Cas9 в печень и крошечные разряды электричества, чтобы открыть поры в эмбрионах, через которые могут проникать молекулы, редактирующие гены.
Обязательно в кузове делать?
No. В некоторых из первых испытаний по редактированию генов ученые собирали клетки из крови пациентов, вносили необходимые генетические изменения, а затем вливали модифицированные клетки обратно в пациентов. Этот подход выглядит многообещающим для лечения людей с ВИЧ. Когда вирус попадает в организм, он поражает и убивает иммунные клетки. Но для того, чтобы заразить клетки в первую очередь, ВИЧ должен сначала закрепиться за специфическими белками на поверхности иммунных клеток.Ученые собрали иммунные клетки из крови пациентов и использовали редактирование генов, чтобы вырезать ДНК, которая нужна клеткам для образования этих поверхностных белков. Без белков вирус ВИЧ больше не может проникать в клетки. Аналогичный подход можно использовать для борьбы с определенными типами рака: иммунные клетки собирают из крови пациентов и редактируют, чтобы они производили поверхностные белки, которые связываются с раковыми клетками и убивают их. Отредактировав клетки, чтобы сделать их убийцами рака, ученые выращивают их в огромных количествах в лаборатории и снова вливают в пациента.Прелесть модификации клеток вне тела заключается в том, что их можно проверить перед тем, как вернуть обратно, чтобы убедиться, что процесс редактирования не пошел наперекосяк.
Что может пойти не так?
Современное редактирование генов достаточно точное, но не идеальное. Процедура может быть неудачной, достигнув одних ячеек, но не других. Даже когда Crispr попадает туда, где это необходимо, правки могут отличаться от ячейки к ячейке, например, исправление двух копий мутировавшего гена в одной ячейке и только одной копии в другой.Для некоторых генетических заболеваний это может не иметь значения, но это может иметь значение, если нарушение вызывает единственный мутировавший ген. Другая распространенная проблема возникает, когда правки вносятся не в том месте генома. Могут быть сотни таких «нецелевых» правок, которые могут быть опасными, если нарушают здоровые гены или важную регуляторную ДНК.
Процедура может быть неудачной, достигнув одних ячеек, но не других. Даже когда Crispr попадает туда, где это необходимо, правки могут отличаться от ячейки к ячейке, например, исправление двух копий мутировавшего гена в одной ячейке и только одной копии в другой.Для некоторых генетических заболеваний это может не иметь значения, но это может иметь значение, если нарушение вызывает единственный мутировавший ген. Другая распространенная проблема возникает, когда правки вносятся не в том месте генома. Могут быть сотни таких «нецелевых» правок, которые могут быть опасными, если нарушают здоровые гены или важную регуляторную ДНК.
Приведет ли он к дизайнерским младенцам?
Огромные усилия медицины направлены на исправление дефектных генов у детей и взрослых. Но несколько исследований показали, что опасные мутации у эмбрионов тоже можно исправить.В 2017 году ученые, созванные Национальной академией наук США и Национальной академией медицины, осторожно одобрили редактирование генов в человеческих эмбрионах для предотвращения самых серьезных заболеваний, но только однажды было доказано, что это безопасно. Любые изменения, внесенные в эмбрионы, повлияют на все клетки человека и будут переданы его детям, поэтому крайне важно избегать вредных ошибок и побочных эффектов. Конструирование человеческих эмбрионов также поднимает непростую перспективу создания детей-дизайнеров, у которых эмбрионы изменяются по социальным, а не медицинским причинам; например, чтобы сделать человека выше или умнее.Подобные черты могут включать тысячи генов, большинство из которых неизвестны. Так что пока что дизайнерские младенцы – далекая перспектива.
Как скоро он будет готов для пациентов?
Гонка за применением в клинике методов лечения генного редактирования. Около дюжины испытаний Crispr-Cas9 находятся в стадии реализации или планируются, большинство из которых проводится китайскими исследователями по борьбе с различными формами рака. Один из первых был запущен в 2016 году, когда врачи в провинции Сычуань передали отредактированные иммунные клетки пациенту с запущенным раком легких.В ближайшие несколько лет ожидается больше испытаний в США и Европе.
Один из первых был запущен в 2016 году, когда врачи в провинции Сычуань передали отредактированные иммунные клетки пациенту с запущенным раком легких.В ближайшие несколько лет ожидается больше испытаний в США и Европе.
Базовое редактирование
Более мягкая форма редактирования гена, которая не разрезает ДНК на части, а вместо этого использует химические реакции для изменения букв генетического кода. Пока все выглядит хорошо. В 2017 году китайские исследователи использовали базовое редактирование для исправления мутаций, вызывающих у человеческих эмбрионов серьезное заболевание крови, называемое бета-талассемией.
Генные двигатели
Спроектированные генные двигатели обладают способностью проталкивать определенные гены через всю популяцию организмов.Например, их можно использовать, чтобы сделать комаров бесплодием и, таким образом, уменьшить бремя болезней, которые они распространяют. Но технология вызывает большие споры, потому что может иметь огромные непредвиденные экологические последствия.
Редактирование эпигенома
Иногда вы не хотите полностью удалить или заменить ген, а просто уменьшить или увеличить его активность. Ученые сейчас работают над инструментами Crispr, чтобы сделать это, давая им больше контроля, чем когда-либо прежде.
Трещина в творчестве: Редактирование генов и немыслимая сила для управления эволюцией Дженнифер Дудна и Сэмюэл Х.Штернберг
Ген: интимная история Сиддхартха Мукерджи
Эпигенетическая революция: Как современная биология переписывает наше понимание генетики, болезней и наследственности Несса Кэри Современный Прометей: редактирование генома человека с помощью Crispr-Cas9 Джим Козубек
5.
 ПРОЦЕСС ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ 5.ПРОЦЕСС ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ
ПРОЦЕСС ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ 5.ПРОЦЕСС ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИПроизводство ГМО – многоступенчатый процесс, который может быть резюмируется следующим образом:
1. идентификация интересующего гена;
2. выделение интересующего гена;
3. усиление гена для получения множества копий;
4. связывание гена с подходящим промотором и поли Последовательность и вставка в плазмиды;
5.размножение плазмиды в бактериях и восстановление клонированная конструкция для инъекций;
6. перенос конструкции в ткань реципиента, обычно оплодотворенные яйца;
7. интеграция гена в геном реципиента;
8. экспрессия гена в геноме реципиента; и
9. Наследование гена через поколения.
5.1 Выбор цели гены
Как показано в Таблице 2, наиболее популярный ген, используемый в водных является гормоном роста (GH) по очевидным причинам.GH широко используется у наземных видов и потому, что последовательность гена является высококонсервативной; в продукт легко используется вне границ видов. Также можно отметить что, по крайней мере в некоторых случаях, усиленный рост связан с более эффективным утилизация пищи.
Температура холодной воды часто является серьезной проблемой в
аквакультура в умеренном климате, когда необычно холодная зима может
наносят ущерб как производственным, так и племенным рыбным запасам рыбы.Некоторые морские костистые
высокий уровень сывороточных белков антифриза (AFP) или гликопротеинов (AFGP), которые
снизить температуру замерзания, предотвратив рост кристаллов льда. Флетчер, Хью
и Davies (2001) показали, что существует один класс AFGP и четыре класса
AFP. Большинство из них экспрессируются в первую очередь в печени, а некоторые демонстрируют явные сезонные проявления.
изменения (Меламед и др. ., 2002). Работа была особенно сосредоточена на
производство AFP из озимой камбалы ( Pleuronectes americanus ), и
ген успешно внедрен в геном атлантического лосося,
интегрированы в зародышевую линию и переданы потомству F3, где и были
выражается в печени. Однако ряд Ala, Pro-специфичных эндопептидаз
необходимы для производства зрелых белков, которых нет в
Атлантический лосось. Кроме того, ген AFP у озимой камбалы и, возможно,
другие арктические виды, существуют во многих экземплярах (см. раздел 7). Таким образом, гораздо дальше
требуется работа, чтобы развить эффективную антифризную активность в Атлантике.
лосось (Hew et al ., 1999). Работа над AFP также велась в
золотая рыбка (Ван и др. ., 1995) и молочной рыбы (Wu et al .,
1998).
Однако ряд Ala, Pro-специфичных эндопептидаз
необходимы для производства зрелых белков, которых нет в
Атлантический лосось. Кроме того, ген AFP у озимой камбалы и, возможно,
другие арктические виды, существуют во многих экземплярах (см. раздел 7). Таким образом, гораздо дальше
требуется работа, чтобы развить эффективную антифризную активность в Атлантике.
лосось (Hew et al ., 1999). Работа над AFP также велась в
золотая рыбка (Ван и др. ., 1995) и молочной рыбы (Wu et al .,
1998).
Генетические манипуляции также были предприняты для повысить устойчивость рыб к болезнетворным микроорганизмам. В настоящее время этот вопрос решается с помощью ДНК-вакцин (кодирующих часть генома патогена) и противомикробные агенты, такие как лизоцим (Demers and Bayne 1997). Примером может служить инъекция атлантического лосося с последовательностью ДНК, кодирующей инфекционный гликопротеин гематопоэтического некровируса (IHNV) под контролем промотор цитомегаловируса (pCMV).Проблема с вирусом восемь недель спустя показали, что достигнута значительная степень сопротивления. Рыба были по-прежнему устойчивы и, как было показано, вырабатывали антитела через три месяца позже (Traxler et al ., 1999). Подобные исследования были предприняты для другие болезни рыб, например. Вирус геморрагической септицемии (VHS) (Lorenzen, Olesen и Кох, 1999), и работы такого рода, по-видимому, имеют большую потенциальную ценность для рыбные хозяйства (Меламед и др. ., 2002). Также обращаем внимание на работают с использованием гена цекропина B от моли Hyaloplova cecropin. Когда канального сома, трансгенного по этому гену, заражали Flavobacterium columnare и Edwardsiella ictaluri выживаемость у трансгенных животных была лучше, чем у контрольных (Dunham et al ., 2002)
Таблица 2. Результаты индукции ГМО в водных разновидность.
Виды | Целевой ген | Внутр. | Опыт | Транс | Номер ссылки |
At. Лосось | GH | + | + | + | Hew & Fletcher, 2001 |
At.Лосось | AFP | + | + | + | Hew & Fletcher, 2001 |
Кижуч | GH | + | + | Nd | Стивенс Девлин, 2000 г. |
Тилапия | ТИГХ | + | + | + | Martinez et al., 1999 |
Тилапия | Рыба GH | + | + | Nd | Рахман и Маклин, 1999 г. |
Карп | GH | + | + | Nd | Hinits & Moav, 1999 г. |
Лосось | Переносчик глюкозы и гексокиназа | + | + | + | Питканен и др. ., 1999 |
Тилапия | GH | + | + | Nd | Рахман и др. ., 1998 |
At. лосось | GH | + | + | + | Saunders, Fletcher & Hew, 1998 |
Карп | HGH | + | + | + | Fu et al. |
At. лосось | GH | + | + | + | Стивенс, Саттерлин и Кук, 1998 г. |
Тилапия | ТИГХ | + | + | + | de la Fuente et al., 1998 |
Тилапия | ИНТ-ТИГХ | + | + | + | de la Fuente et al ., 1998 |
Тилапия | CSGH | + | + | + | Рахман и Маклин, 1998 г. |
Тилапия | ИНТ-ТИГХ | + | + | + | Эрнандес и др. |
Тилапия | г.р.GH | + | + | Nd | Chen et al ., 1997 |
Морское ушко | GH | + | + | Nd | Пауэрс, Кирби и Гомес-Кьярри, 1996 |
Медака | CAT | + | + | + | Киношита и др. ., 1996 |
Тилапия | GH | + | + | + | de la Fuente et al ., 1996 |
At. лосось | GH AFP | + | + | + | Чой и др. |
Тилапия | ТИГХ | + | + | + | Мартинес и др. ., 1996 |
Тилапия | Лак Z | + | + | + | Alam et al., 1996 |
Тилапия | ТИГХ | + | Nd | Nd | Мартинес и др. ., 1996 |
Кижуч | GH | + | + | + | Девлин и др. ., 1995a |
Тихоокеанский лосось | CSGH | + | + | + | Девлин и др. |
Карп обыкновенный | RTGH | + | + | Nd | Chatakondi и др. ., 1995 |
Карп обыкновенный | CSGH | + | + | + | Моав и др. ., 1995 |
Медака | Лак Z | + | + | Nd | Цай, Цзэн и Ляо, 1995 |
Рассольные креветки | Репортерный ген люциферазы | + | Nd | Nd | Gendreau и др. ., 1995 |
Карп обыкновенный | RTGH | + | + | Nd | Chatakondi et al . |
Карп обыкновенный | CSGH | + | + | + | Моав и др. ., 1995 |
Тихоокеанский лосось | CSGH | + | + | + | Девлин и др. ., 1995b |
Радужная форель | CSGH | + | + | + | Девлин и др. ., 1995a |
Форель-головорез | CSGH | + | + | + | Девлин и др. ., 1995b |
Чавычи | CSGH | + | + | + | Девлин и др. ., 1995b |
Вьюн | CSGH | + | + | Nd | Цай, Цзэн и Ляо, 1995 |
Лосось | GH | + | + | Nd | Девлин и др. ., 1994 |
Чавычи | | + | Nd | Nd | Sin и др. ., 1994 |
Ламинария японская | Плазмида BI221 | + | + | Nd | Цинь и др. ., 1994 |
Undaria pinnatifida | Плазмида BI221 | + | + | Nd | Цинь и др. ., 1994 |
Нигоробуна | E. coli бета-галактозидаза | + | + | Nd | Уэно и др. ., 1994 |
Лещ тупой | HGH | + | + | + | Wu et al ., 1994 |
Карп обыкновенный | HGH | + | + | + | Wu и др. ., 1994 |
Oreochromis niloticus | Бактериальный лак | + | + | + | Маклин, 1994 |
Данио | | + | Nd | Nd | Hackett и др. ., 1994 |
Африканский сом | AFP GH | + | + | Nd | Эрдели и др. ., 1994 |
Карп обыкновенный | AFP GH | + | + | Nd | Эрдели и др. ., 1994 |
Морское ушко | GH | + | + | Nd | Пауэрс и др. ., 1994 |
Тихоокеанский лосось | GH нерка | + | + | Nd | Девлин и др. ., 1994 |
Данио | Люцифераза светлячка | + | + | – | Патил, Вонг и Кху, 1994 |
Данио | CSGH | + | + | + | Чжао, Чжан и Вонг, 1993 |
Карп обыкновенный | RTGH | + | + | + | Чен и др. ., 1993 |
Данио | люцифераза | + | – | – | Kavumpurath et al ., 1993 |
Карп обыкновенный | HGH | + | + | + | Cui и др. ., 1993 |
Тилапия | RGH | + | Nd | Nd | Рахман и Маклин, 1991 |
Рыба-зебра | CAT | + | Nd | Nd | Khoo и др. ., 1992 |
Тилапия | HGH | Nd | Nd | Nd | Бер и др. ., 1992 |
Данио | CAT | + | + | Nd | Шарпс и др. ., 1992 |
Золотая рыбка | Устойчивость к неомицину CAT | + | + | Nd | Guise, Hackett & Faras, 1992 |
Северная щука | BGH | + | + | Nd | Guise, Hackett & Faras, 1992 |
Атлантический лосось | Камбала зимняя AFP | + | + | + | Fletcher, Davies & Hew, 1992 |
At.лосось | Бактериальная кошка Чавычь-лосось GH | + | Nd | Nd | Джун Ду и др. ., 1992 |
Карп обыкновенный | RTGH | + | + | + | Чен и др. ., 1992 |
Канальный сом | RTGH | + | + | + | Чен и др. ., 1992 |
Северная щука | Бактериальные CAT BGH и CGH | + | Nd | Nd | Моав и др. ., 1992 |
Судак | Бактериальные CAT BGH и CGH | + | Nd | Nd | Моав и др. ., 1992 |
Данио | Бактериальные CAT BGH и CGH | + | Nd | Nd | Моав и др. ., 1992 |
Карп | Белый амур GH | + | Nd | Nd | Чжу, 1992 |
Данио | | + | – | Nd | Khoo и др. ., 1992 |
Щука северная | BGH CSGH | + | + | Nd | Гросс и др. ., 1992 |
Канальный сом | Лосось GH | + | + | Nd | Данэм и др. ., 1992 |
At. лосось | CSGH | + | + | Nd | Джун Ду и др. ., 1992 |
Морской лещ Gilthead | BGH и HGH | + | – | Nd | Кавари и др. ., 1993 |
Радужная форель | Карп альфа-глобин | + | + | + | Йошизаки и др. ., 1991 |
Радужная форель | BGH | + | + | Nd | Чандлер и др. ., 1990 |
Тилапия | HGH | + | Nd | Nd | Brem и др. ., 1988 |
Сокращения, использованные в таблице 2 выше:
В: | Атлантический лосось |
GH: | Гормон роста |
AFP: | Антифриз протеин |
Nd: | Не определено |
HGH: | Гормон роста человека |
BGH: | Гормон роста крупного рогатого скота |
CS: | Гормон роста лосося кижуча |
YP: | Гормон роста желтоперого порги |
CAT: | Хлорамфениколацетилтрансфераза |
TiGH: | Гормон роста тилапии |
RTGH: | Гормон роста радужной форели |
RGH: | Гормон роста крысы |
Инт: | Интеграция |
Опыт: | Выражение |
Транс: | Трансмиссия |
Похоже, что нет опубликованных доказательств интеграции ДНК вакцины в геном реципиента.Тем не менее, стойкость ДНК часто оказывается относительно длинным, что предполагает некоторую репликацию (не обычно ожидается с нехромосомными участками ДНК). Кажется желательным для момент, чтобы рассматривать таких обработанных животных как «временные» ГМО, а чем полные ГМО.
5.2 Выделение гена процент
Обычно интересующий ген уже будет доступен как элемент «библиотеки» коротких участков общего генома донорский штамм или вид.В этом случае следует выполнить следующую процедуру: размножить ген с помощью реакции ПЦР. Если, однако, следует взять ген из генома, ранее не исследованного, потребуется более сложная процедура следовать. Использование метода полимеразной цепной реакции (ПЦР) позволяет в обоих случаях, указанных выше, размножить ген до уровня несколько миллионов копий, необходимых для создания конструкции (см. раздел 5.3).
5.3 Клонирование гена процент
Когда было сгенерировано много копий целевого гена, ген помещается в «конструкцию» (см. раздел 5.4). Когда-то ген интерес был ферментативно лигирован в конструкцию, весь этот комплекс лигируется в бактериальные плазмиды (см. рис. 3), которые действуют как «продуцирующие векторы »и позволяют многократно реплицировать ген в пределах бактериальные клетки. Затем бактерии высевают. Можно сказать из репортерные гены (см. ниже), был ли вектор поглощен бактериальным клетки.Обычно это связано с некоторым изменением цвета колоний, содержащих вставленная ДНК. Затем многократно амплифицированная конструкция ДНК ферментативно разрезается. из плазмид (после того, как они были удалены из бактериальных клеток) и он готов к использованию для вставки в яйца вида-хозяина.
Более подробное описание технических деталей процессы, описанные в разделах 5.2 и 5.3, можно найти в Maclean. (1998).
5.4 Конструкция
Конструкция представляет собой фрагмент ДНК, который функционирует как носитель или вектор, несущий целевой ген в организм-реципиент.В нем есть несколько различные области, как показано на рисунке 2. Существует область промотора, которая контролирует активность целевого гена, области, в которой находится целевая ДНК. вставлен, как правило, какой-либо тип репортерного гена, чтобы можно было установить, цель успешно сочетается с конструкцией и прекращением последовательность.
Рис. 2. Схема ДНК. последовательность основной плазмиды и встроенной конструкции.
Источники этих нескольких последовательностей ДНК могут быть разными. видов, хотя в идеале гены промотора и мишени должны происходить от того же вида
Как показано в таблице 3, конструкции были зарегистрированы из 92 исследования.Количество различных конструкций больше, чем количество целевых гены, используемые в аквакультуре, и в эта зона. С начала 1990-х годов исследования были сосредоточены на разработке «всех fish », а не с использованием промоторов млекопитающих.
Использование исключительно рыбных конструкций оказывает драматическое влияние на экспрессия трансгенов, например Девлин и и . (1994), разработали вся конструкция гена лосося, которая ускоряет рост трансгенных лососевых. более чем в 11 раз.В случае тилапии Maclean (1994) обнаружил, что использование бета-актина карпа вместо промотора бета-актина крысы привело к десятикратному увеличению продукции гормон у трансгенных животных.
Таблица 3 . Краткое изложение основных исследований по стимулированию ГМО в водных видах.
Виды | Целевой ген | Типовая конструкция | Типовой индукционный метод | Количество исследований |
Лосось spp. | GH AFP | Ocean pout AFP линеаризованная ДНК | Микроинъекция | 17/92 |
Радужная форель | GH | Надуватель океана AFP | Микроинъекция | 14/92 |
Tilapia spp. | GH | Цитомегаловирус (CMV) | Микроинъекция | 12/92 |
Карп | GH | Длинный тандемный повтор вируса саркомы Рауса | Микроинъекция | 17/92 |
Данио | Люцифераза | плазмида pMTL | Микроинъекция | 16/92 |
Медака | CAT | AFP | Микроинъекция | 11/92 |
Другая важная работа подсказала, что оптимальный этап, на котором вводимый трансген может варьироваться в зависимости от клетки и вида, например.Гарсия дель Barco et al. (1994) с использованием рыбок данио показал, что существуют различия в нормативные требования к клеткам и эмбрионам, и поэтому предположили, что конструкции следует анализировать как на клетках, так и на эмбрионах.
Другая работа показывает, насколько важна природа генной конструкции является. Девлин и др. (1995a) показал, что использование гена opAFPGHc в икре кижуча дала начало некоторым алевинам, которые имели типичные коричневого цвета, в то время как остальные имели отчетливую зеленую окраску.Результаты предполагают, что зеленый фенотип возник из-за присутствия конструкция opAFPGHc и, следовательно, может указывать на наличие трансгена поглощение / передача. Все потомки были протестированы с помощью ПЦР на наличие трансген и 182 из 184 алевинов были правильно отнесены на этой основе. Тем не мение, было обнаружено, что позже в процессе развития все рыбы стали зелеными (нормальный цвет позже в развитии), и поэтому трансгенные рыбы показали ускоренное рост. Позже было обнаружено, что большинство трансгенных рыб появились признаки черепной аномалии, вероятно, из-за ускоренного роста (см. Раздел 9.3). Хотя конструкция была полезной в том, что поглощение трансгена могло быть под наблюдением, потребовалась дальнейшая работа, чтобы гарантировать, что здоровая рыба может быть произведено.
5.5 Методы индукции transgenics
Трансгенная рыба в основном была получена микроинъекция в оплодотворенные яйца или ранние эмбрионы (см. Таблицу 2). Электропорация сперматозоидов оказалась успешной у некоторых видов, например. Рыба данио (Khoo et al., 1992) Чавычья лосось (Sin et al ., 1994) и вьюн (Цай, Цзэн и Ляо, 1995). Липосомы также использовались в качестве векторы (Khoo 1995). Были применены баллистические методы с использованием микрочастиц. исследованы в Artemia с целью их использования в создании трансгенных ракообразных (Gendreau et al ., 1995), а также у видов морских водорослей (Qin et al. al ., 1994). «Баэконизация», тип электрического плоского поля. электропорацию использовали для переноса ДНК в эмбрионы рыбок данио (Zhao, Zhang and Wong, 1993), этот метод оказался успешным, но не был принят так же, как и другие формы электропорации и микроинъекций методы.
Совсем недавно использование эмбриональных стволовых клеток (ЭСК) в качестве метод индукции трансгенеза. Эти клетки недифференцированы и остаются тотипотентными, поэтому ими можно манипулировать in vitro и впоследствии повторно внедряются в ранние эмбрионы, где они могут способствовать развитию зародышевая линия хозяина. Таким образом можно было стабильно вводить или удалять гены. (Меламед и др. , 2002). Несмотря на ранний успех технологии ESC в мышей, освоение технологии рыбной ловли идет медленно, хотя клетки-предшественники (Mes 1) были культивированы из Медаки и показывают многие из те же функции, что и ESC мыши.Исследования Хонга, Винклера и Шартла (1996, 1998) и Hong, Chen и Schartl (2000) показали, что 90 процентов бластул хозяйских клеток пересаженные клетки Mes 1 превратились в мозаичных мальков, и эти клетки стали интегрированы в органы, полученные из всех трех зародышевых листков, и дифференцированы в различные типы функциональных клеток.
Еще один пример новых и, возможно, более эффективных способов Перенос генов – это использование пантропных ретровирусных векторов. Они способны заражают широкий спектр клеток-хозяев и использовались для заражения недавно оплодотворенных Яйца медака с репортерным геном, который, по-видимому, интегрировался в вся зародышевая линия некоторых самок P1 (Lu, Burns and Chen, 1997).В При сравнении ретровирусной инфекции и микроинъекции у рыбок данио эти два методы были одинаково эффективны при передаче трансгена в яйца, но более широкая вариабельность степени экспрессии репортерного гена среди этих основателей которые были введены с помощью микроинъекций (Linney et al ., 1999). Однако использование retroviruses не без проблем (см. Раздел 9.1).
Метод микроинъекции подходит для относительно небольших количество организмов, которыми манипулируют, тогда как электропорация, сперма / липосома Методы медиации и бомбардировки больше подходят для массовых процедур.В самый популярный метод внедрения трансгенов в аквакультуре – микроинъекция; в 92 исследованиях, рассмотренных с 1985 г. по настоящее время, в 68 использовались микроинъекции, в одиннадцати использовали методы, опосредованные спермой, шесть использовали электропорацию и пять использовали обе сперматозоиды посредничество и электропорация. Однако проблема мозаичного выражения transgenes является обычным явлением, и это приводит к различным пропорциям трансгенных генотипы в потомстве.
Полезный обзор технических деталей методик упомянутое можно найти в Sin (1997).
5.6 Сайты интеграции
Факторы, определяющие сайты интеграции, по-прежнему слабы понятно, хотя исследования в этом направлении расширяются. Это особенно важно для достижения большей точности в контролируемом месте интеграции из-за непредсказуемые эффекты неконтролируемой интеграции на резидентные гены. Caldovic и Hackett (1995) проверили способность специальных последовательностей, называемых переносимые граничные элементы от других видов для предоставления независимого от положения экспрессия трансгенов или усиление интеграции трансгенных конструкций в хромосомы рыб.Ранние результаты показывают, что такие элементы у некоторых видов действительно не действуют как усилители и не улучшают частоты интеграции. Однако оба Было обнаружено, что пограничные элементы птиц и насекомых не зависят от положения экспрессию, как оценивали по экспрессии генов CAT у рыб F 1 . Hackett et , al., (1994) показали, что совместный перенос ретровирусной интегразы белок с трансгенной ДНК может ускорить и повысить скорость интеграции. Необходимы дополнительные исследования этого типа, чтобы повысить успешность и контролируемость. позиционирование интеграции трансгенов в будущее.
5.7 Экспрессия гена
Поглощение и интеграция трансгена не гарантирует что ген проявит себя в новой генетической среде. Тесты должны быть выполняется, чтобы определить, есть ли выражение, и если есть выражение, на каком уровне это происходит. Понятно, что в коммерческой аквакультуре только те трансгены, экспрессирующие целевой ген на достаточно высоком уровне, будут интерес.
5.8 Наследование гена
Рыба, экспрессирующая целевой ген на приемлемом уровне может быть не в состоянии передать ген потомству. Это потому, что многие трансгенные особи являются мозаичными индивидуумами, и если гонады не включены в ткани, содержащие трансген, трансгенные животные не будут воспроизводить истинное потомство. Следовательно, необходимо провести соответствующие селекционные испытания.
Высокая доля мозаичных особей – одна из причин, по которой пропорции потомков разных генотипов от родителей, которые предположительно гемизиготны для трансгена, не обязательно соответствуют менделевские ожидания.Еще одна причина – интеграция двух и более копий. трансгена на разных участках генома реципиента. Дальнейшее разведение потребуются тесты для создания чистой линии разведения трансгенных рыбы.
Что такое генетическая модификация? – Любопытный
Как вы относитесь к генетически модифицированным продуктам питания?
Это вопрос, который может вызвать очень страстные ответы и множество споров: некоторые утверждают, что он может положить конец голоду в мире; другие думают, что риски слишком велики.
Это мощная технология. Ученые могут использовать ряд современных молекулярных технологий, чтобы сделать урожай более продуктивным, более питательным и улучшить здоровье кишечника. Фермеры могут выращивать культуры, которые лучше переносят суровые условия окружающей среды, такие как засуха или соленые (засоленные) почвы, или сократить использование пестицидов и гербицидов.
И все же, несмотря на потенциально огромные преимущества, некоторые люди категорически против любых генетических модификаций, утверждая, что они могут быть вредными для здоровья человека или окружающей среды, или указывая на этические проблемы.Десятилетия научных исследований предоставили множество доказательств в ответ на эти опасения.
Но прежде чем мы сможем полностью углубиться в некоторые разговоры о генетической модификации, нам нужно понять фундаментальную науку, лежащую в основе того, что за этим стоит.
Что такое генетическая модификация?
Вообще говоря, в генетической модификации нет ничего нового. Люди изменяли гены растений, животных и микробов на протяжении тысячелетий – даже до того, как узнали, что такое «ген».Первоначальные селекционеры растений и животных выбирали отдельные организмы с желаемыми характеристиками и использовали такие методы, как селективное разведение, для достижения желаемого результата: более крупных и сладких плодов, возможно, или собак, которые были верны и легко обучались.
Используя методы селекции, культурные растения и домашний скот были выведены для получения желаемых качеств задолго до того, как люди узнали что-либо о генетике. Изображение адаптировано из: Австралийская академия наукПо мере того, как мы узнали больше о науке о генах, мы смогли разработать технологии, которые могут изменять эти гены гораздо более точными и направленными способами по сравнению с традиционными методами селекции.Термин «генетическая модификация» в настоящее время обычно понимается многими людьми как относящийся конкретно к этим современным технологиям и их роли в разработке генетически модифицированных организмов (ГМО) и продуктов.
Это все еще очень широкий термин, поскольку используется множество различных методов и технологий, каждая из которых имеет свои преимущества и недостатки. Однако все они включают добавление, удаление, включение или выключение определенных функций генов для достижения более желаемых характеристик в организме.
Как можно изменить гены?
Гены – это участки ДНК, которые предоставляют инструкции по созданию белков, которые затем могут создавать структуры или выполнять функции в живых существах. У всех организмов есть гены, обладающие схожими свойствами. Чтобы изменить генетический состав организма, ученые могут идентифицировать конкретный ген, который обеспечивает определенную функцию или черту в одном организме, например устойчивость к насекомым-вредителям, а затем скопировать и изолировать этот ген, чтобы перенести его в другой организм.В случае успеха этот ген будет производить эту функцию или свойство у измененного животного, растения или микроба.
Теперь у нас есть возможность манипулировать действиями гена или копировать ген из одного организма и перемещать его в другой. Изображение адаптировано из: Австралийская академия наукПри использовании традиционных методов селекции потомство получает смесь генов от обоих родителей. Эти гены могут включать в себя те, которые отвечают за создание желаемого признака, но они также могут нести с собой множество других нежелательных генов, которые вызывают нежелательные признаки.Или заводчик может получить много потомства, у которого вообще не будет нужного гена. Это медленный процесс, который может быть случайным.
Нацеливаясь на определенные гены, вместо того, чтобы полагаться на случайное смешивание, генная технология может ускорить процесс и обеспечить очень точный перенос генов без лишнего ненужного багажа.
Растения, полученные традиционными методами селекции, получают смесь генов от обоих родителей – генетическая модификация позволяет выбрать конкретные гены, а не смесь. Изображение адаптировано из: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США; CC0Это «натуральное»?
Современные методы генетической модификации могут быть восприняты некоторыми людьми как неестественные и, следовательно, нездоровые или ненадежные.




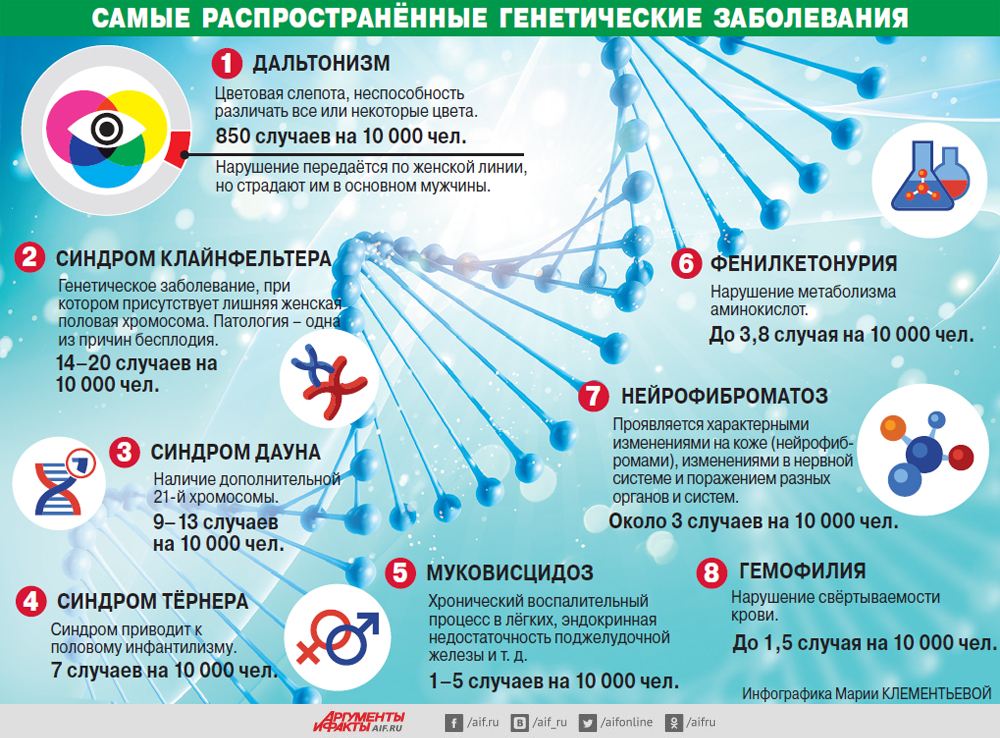


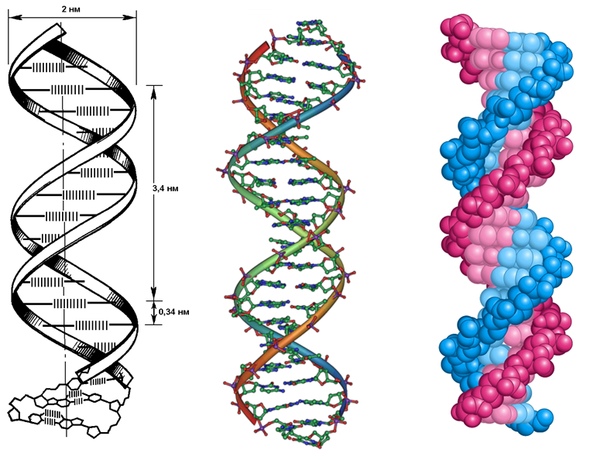

 , 1998
, 1998 ., 1997
., 1997 ., 1996
., 1996 ., 1995b
., 1995b , 1995
, 1995