Урок 11. Химические уравнения – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 11 «Химические уравнения» из курса «Химия для чайников» мы узнаем кем и когда был открыт закон сохранения массы веществ; познакомимся с химическими уравнениями и научимся правильно расставлять в них коэффициенты.
До сих пор при рассмотрении химических реакций мы обращали внимание на их качественную сторону, т. е. на то, как и при каких условиях исходные вещества превращаются в продукты реакций. Но в химических явлениях существует и другая сторона — количественная.
Закон сохранения массы веществ
Изменяется ли масса веществ, вступивших в химическую реакцию? В поиске ответа на этот вопрос английский ученый Р. Бойль еще в XVII в. провел множество опытов по прокаливанию свинца в запаянных сосудах. После окончания опытов он вскрывал сосуды и взвешивал продукты реакции. В результате Бойль пришел к выводу, что масса вещества после реакции больше массы исходного металла. Он объяснил это присоединением к металлу некой «огненной материи».
Он объяснил это присоединением к металлу некой «огненной материи».
Опыты Р. Бойля по прокаливанию металлов повторил русский ученый М. В. Ломоносов в 1748 г. Прокаливание железа он проводил в специальной колбе (реторте) (рис. 56), которая была герметически запаяна. В отличие от Бойля после реакции он оставлял реторту запаянной. Взвешивание реторты после реакции показало, что ее масса не изменилась. Это свидетельствовало о том, что, хотя между металлом и веществом, содержащемся в воздухе, произошла химическая реакция, сумма масс исходных веществ равна массе продукта реакции.
М. В. Ломоносов сделал вывод: «Все перемены, в натуре случающиеся, суть такого состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому, так ежели где убудет несколько материи, то умножится в другом месте».
В 1789 г. французский химик А. Лавуазье доказал, что прокаливание металлов — это процесс их взаимодействия с одной из составных частей воздуха — кислородом. На основе работ М. В. Ломоносова и А. Лавуазье был сформулирован закон сохранения массы веществ в химических реакциях.
На основе работ М. В. Ломоносова и А. Лавуазье был сформулирован закон сохранения массы веществ в химических реакциях.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
При химических реакциях атомы не исчезают бесследно и не возникают из ничего. Их число остается неизменным. А так как они имеют постоянную массу, то и масса образованных ими веществ также остается постоянной.
Закон сохранения массы веществ можно проверить экспериментально. Для этого используют прибор, показанный на рисунке 57, а, б. Главная его часть — двухколенная пробирка. В одно колено нальем известковую воду, во второе — раствор медного купороса. Уравновесим прибор на весах, а затем смешаем оба раствора в одном колене. При этом мы увидим, что выпадает голубой осадок нового вещества. Образование осадка подтверждает, что произошла химическая реакция. Масса прибора при этом остается прежней. Это означает, что в результате химической реакции масса веществ не изменяется.
Закон важен для правильного понимания всего совершающегося в природе: ничто не может исчезнуть бесследно и возникнуть из ничего.
Химические уравнения
Химические реакции можно изобразить, используя химический язык формул. Химические элементы обозначают химическими символами, состав веществ записывают при помощи химических формул, химические реакции выражают при помощи химических уравнений, т. е. так же, как из букв составляются слова, из слов — предложения.
Уравнение химической реакции (химическое уравнение) — это условная запись реакции при помощи химических формул и знаков «+» и «=».
Закон сохранения массы веществ в химических реакциях должен соблюдаться и при составлении уравнений химических реакций. Как и в математических уравнениях, в уравнениях химических реакций имеется левая часть (где записываются формулы исходных веществ) и правая часть (где записываются формулы продуктов реакции). Например (рис. 58):
Например (рис. 58):
При написании уравнений химических реакций знак «+» (плюс) соединяет формулы веществ в левой и правой частях уравнения. Так как масса веществ до реакции равна массе образовавшихся веществ, используется знак «=» (равно), который связывает левую и правую части уравнения. Для уравнивания числа атомов в левой и правой частях уравнения используются числа перед формулами веществ. Эти числа называются коэффициентами химических уравнений и показывают число молекул или формульных единиц. Поскольку 1 моль любого вещества состоит из одинакового числа структурных единиц (6,02*1023), то коэффициенты показывают и химические количества каждого из веществ:
При написании химических уравнений применяют также и специальные знаки, например знак «↓», обозначающий, что вещество образует осадок:
знак «↑», обозначающий, что вещество выделяется в виде газа (рис. 59):
Часто в уравнениях химических реакций над знаком «=» указывают условия их протекания: нагревание (t), облучение светом (hν), электрический ток (↯) и др.
Краткие выводы урока:
- В химических реакциях соблюдается закон сохранения массы веществ: масса исходных веществ равна массе продуктов реакции.
- Сущность химической реакции состоит в перегруппировке атомов, из которых состояли исходные вещества, с образованием новых веществ.
- Число атомов каждого химического элемента до реакции должно быть равно их числу после реакции.
- Химическое уравнение — условная запись реакции при помощи химических формул и специальных знаков.
Надеюсь урок 11 «Химические уравнения» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 12. Составление уравнений химических реакций →
← Урок 10. Признаки химических реакций
ОглавлениеПРЕДИСЛОВИЕ К ЧЕТВЕРТОМУ ИЗДАНИЮВВЕДЕНИЕ Ионы. Свободные радикалы. Энергия активации. Часть I. РЕАКЦИИ ОБМЕНА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ I. РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ 2. Реакции, протекающие с образованием осадков 3. Реакции, протекающие с образованием слабых электролитов Реакции получения слабых электролитов. Амфотерные электролиты. 4. Реакции, протекающие с образованием комплексных ионов Строение комплексных соединений. 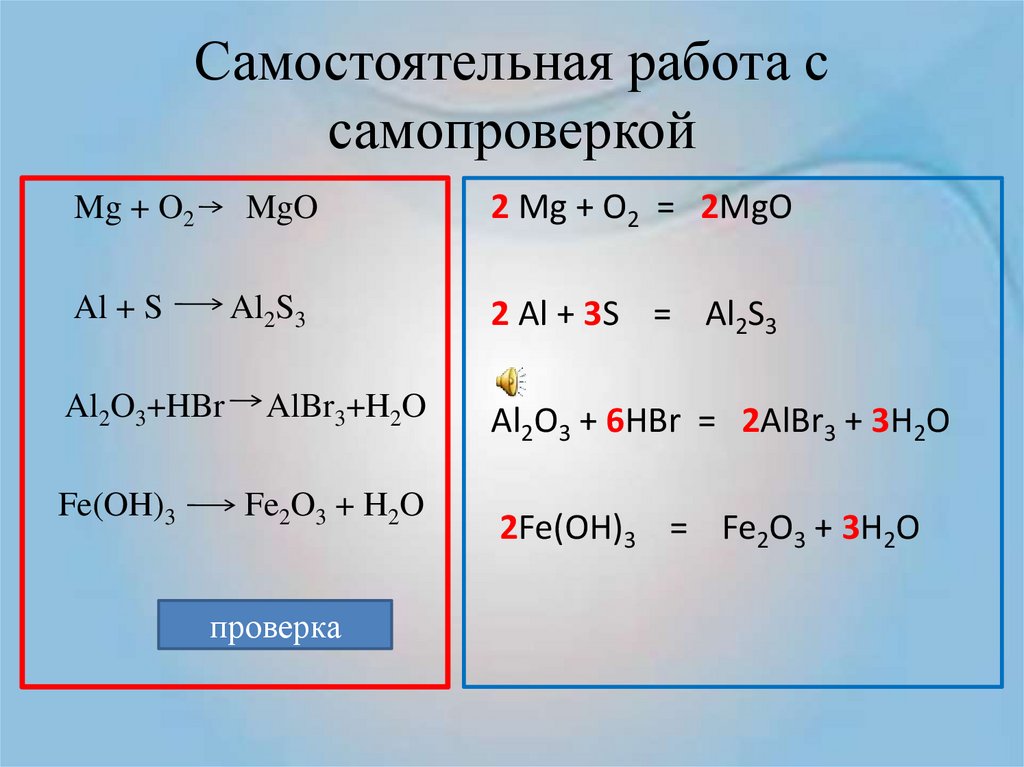 О природе сил, обусловливающих комплексообразование. Устойчивость комплексов. Классификация комплексных соединений. Некоторые особенности комплексных соединений. Номенклатура комплексных соединений. II. СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ, ПРОТЕКАЮЩИХ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ Упражнения Часть II. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ I. КАЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Переход нейтральных атомов в ионное состояние. Энергия ионизации и сродство к электрону. Валентность и степень окисления. Степень окисления. Восстановители и окислители Восстановители, имеющие большое значение в технике и лабораторной практике. Группа окислителей. Окислители, имеющие большое значение в технике и лабораторной практике. Классификация реакций окисления — восстановления II. СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ Составление уравнений сложных реакций Реакции в кислой среде.  Реакции в щелочной среде. Реакции в нейтральной среде. Особые случаи составления уравнений окислительно-восстановительных реакций. Составление уравнений реакций диспропорционирования Составление уравнений реакций внутримолекулярного окисления — восстановления Составление уравнений реакций с участием воды Составление уравнений реакций окисления металлов Окислительно-восстановительные эквиваленты. III. КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Электродные потенциалы — мера окислительно-восстановительной способности веществ Окислительно-восстановительные потенциалы Константа равновесия. Пользование таблицей окислительно-восстановительных потенциалов и выводы из нее Термодинамическое определение направления химических реакций Упражнения Часть III. ЯДЕРНЫЕ РЕАКЦИИ Строение атома Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Спиновая теория валентности. s-Элементы р-Элементы d-Элементы f-Элементы СТРОЕНИЕ ЯДРА Ядерные силы.  Ядерные реакции. Написание уравнений ядерных реакций. Трансурановые элементы. Упражнения ЧАСТЬ IV. УПРАЖНЕНИЯ ПО СОСТАВЛЕНИЮ ХИМИЧЕСКИХ УРАВНЕНИЙ Водород, кислород, перекись водорода Щелочные металлы Медь, серебро, золото Бериллий, магний и щелочноземельные металлы Цинк, кадмий, ртуть Бор, алюминий и элементы подгруппы скандия Углерод, кремний, олово, свинец и элементы подгруппы титана Азот, фосфор, мышьяк, сурьма, висмут и элементы подгруппы ванадия Сера, селен, теллур, полоний Хром, молибден, вольфрам Галогены Марганец Железо, кобальт, никель и платиновые металлы Лантаноиды Актиноиды Дополнительные (смешанные) упражнения Реакции с образованием газов Реакции с образованием и растворением осадков Растворение осадков. Реакции с образованием слабых электролитов Реакции с образованием комплексных ионов II. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Качественная характеристика окислительно-восстановительных реакций Количественная характеристика окислительно-восстановительных реакций III.  УПРАЖНЕНИЯ ПО СОСТАВЛЕНИЮ ХИМИЧЕСКИХ УРАВНЕНИЙ УПРАЖНЕНИЯ ПО СОСТАВЛЕНИЮ ХИМИЧЕСКИХ УРАВНЕНИЙВодород, кислород, перекись водорода Щелочные металлы Сера, селен, теллур, полоний Железо, кобальт, никель и платиновые металлы ПРИЛОЖЕНИЯ I. Номенклатура неорганических соединений II. Технические и обыденные названия некоторых веществ III. Растворимость солей IV. Растворимость и произведение растворимости малорастворимых веществ V. Потенциалы ионизации элементов (эв) VI. Нормальные (стандартные) окислительно-восстановительные потенциалы VII. Характеристика некоторых элементарных частиц |
11.3: Уравнения баланса — Химия LibreTexts
- Последнее обновление
- Идентификатор страницы
- 53781
 wikimedia.org/wiki/File:John_Dalton.jpeg(открывается в новом окне); Лицензия: общественное достояние)
wikimedia.org/wiki/File:John_Dalton.jpeg(открывается в новом окне); Лицензия: общественное достояние)Есть остатки?
Когда вы готовите еду, довольно часто остаются остатки, потому что вы приготовили больше, чем люди съели бы за один присест. Иногда, когда вы ремонтируете часть оборудования, у вас остаются так называемые «карманные детали» — маленькие детали, которые вы кладете в карман, потому что не знаете, где им быть. Химия старается избегать остатков и карманных деталей. В обычных химических процессах мы не можем создавать или разрушать материю (закон сохранения массы). Если мы начнем с десяти атомов углерода, нам нужно закончить с десятью атомами углерода. В атомной теории Джона Дальтона говорится, что химические реакции в основном включают перегруппировку атомов. Химические уравнения должны следовать этим принципам, чтобы быть правильными.
Уравновешивание химических уравнений
Сбалансированное уравнение — это химическое уравнение, в котором масса сохраняется, а число атомов каждого элемента в обеих частях уравнения одинаково.
\[\begin{array}{ccccc} \ce{C} \left( s \right) & + & \ce{H_2} \left( g \right) & \rightarrow & \ce{CH_4} \left( g \right) \\ 2 \: \ce{C} \: \text{атомы} & & 2 \: \ce{H} \: \text{атомы} & & 1 \: \ce{C} \: \text{атом,} \: 4 \: \ce{H} \: \text{атомы} \end{массив}\номер\]
Чтобы написать правильное уравнение, вы должны сначала написать правильное скелетное уравнение с правильными химическими формулами. Напомним, что водород представляет собой двухатомную молекулу, поэтому его записывают как \(\ce{H_2}\).
Когда мы посчитаем количество атомов обоих элементов, показанных под уравнением, мы увидим, что уравнение не сбалансировано. На стороне реагента в уравнении всего 2 атома водорода, а на стороне продукта — 4 атома водорода. Мы можем сбалансировать приведенное выше уравнение, добавив коэффициент 2 перед формулой для водорода.
\[\ce{C} \left( s \right) + 2 \ce{H_2} \left( g \right) \rightarrow \ce{CH_4} \left( g \right)\nonumber \]
Коэффициент — это небольшое целое число, которое ставится перед формулой в уравнении, чтобы сбалансировать ее. Цифра 2 перед \(\ce{H_2}\) означает, что в качестве реагентов используется всего \(2 \times 2 = 4\) атомов водорода. Визуально реакция выглядит так, как показано на рисунке ниже.
Цифра 2 перед \(\ce{H_2}\) означает, что в качестве реагентов используется всего \(2 \times 2 = 4\) атомов водорода. Визуально реакция выглядит так, как показано на рисунке ниже.
В сбалансированном уравнении по одному атому углерода и четырем атомам водорода по обе стороны от стрелки. Ниже приведены рекомендации по написанию и балансировке химических уравнений.
- Определите правильные химические формулы для каждого реагента и продукта.
- Напишите уравнение скелета.
- Подсчитайте количество атомов каждого элемента, который появляется как реагент и как продукт. Если многоатомный ион не меняется в обеих частях уравнения, считайте его за единицу.

- Балансируйте каждый элемент по одному, помещая коэффициенты перед формулами.
- Лучше всего начать с балансировки элементов, которые встречаются только в одной химической формуле с каждой стороны уравнения.
- Для 1 коэффициент не указан.
- НИКОГДА не меняйте нижние индексы в химической формуле — вы можете сбалансировать уравнения только с помощью коэффициентов.
- Проверьте каждый атом или многоатомный ион, чтобы убедиться, что они равны в обеих частях уравнения.
- Убедитесь, что все коэффициенты находятся в наименьшем возможном соотношении. При необходимости уменьшите соотношение до минимального.
Пример \(\PageIndex{1}\): Балансировка химических уравнений
Водные растворы нитрата свинца (II) и хлорида натрия смешивают. Продуктами реакции являются водный раствор нитрата натрия и твердый осадок хлорида свинца (II). Напишите сбалансированное химическое уравнение этой реакции.
Раствор
Шаг 1: Спланируйте проблему.Следуйте инструкциям по составлению и балансировке химического уравнения, приведенным в тексте.
Шаг 2: Решить.Напишите скелетное уравнение с правильными формулами.
\[\ce{Pb(NO_3)_2} \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce {PbCl_2} \left( s \right)\nonumber \]
Подсчитайте количество атомов или многоатомных ионов в обеих частях уравнения. 9-} \: \text{ионы} \\ 1 \: \ce{Na} \: \text{атом} & 1 \: \ce{Na} \: \text{атом} \\ 1 \: \ce{ Cl} \: \text{atom} & 2 \: \ce{Cl} \: \text{atoms} \end{array}\nonumber \]
Ионы нитрата и атомы хлора не сбалансированы. Начните с размещения 2 перед \(\ce{NaCl}\). Это увеличивает количество реагентов до 2 атомов \(\ce{Na}\) и 2 атомов \(\ce{Cl}\). Затем поместите 2 перед \(\ce{NaNO_3}\). Результат:
\[\ce{Pb(NO_3)_2} \left( aq \right) + 2 \ce{NaCl} \left( aq \right) \rightarrow 2 \ce{NaNO_3} \left( aq \right) + \ce{PbCl_2} \left( s \right)\nonumber \] 9-} \: \text{ионы} \\ 2 \: \ce{Na} \: \text{атом} & 2 \: \ce{Na} \: \text{атом} \\ 2 \: \ce{ Cl} \: \text{atom} & 2 \: \ce{Cl} \: \text{atom} \end{array}\nonumber \]
Шаг 3: Подумайте о своем результате.
Уравнение теперь сбалансировано, поскольку в обеих частях уравнения имеется одинаковое количество атомов каждого элемента.
Моделирование
Потренируйтесь составлять химические уравнения с помощью этого моделирования:
Можете ли вы сбалансировать химическое уравнение?
Резюме
- Описан процесс балансировки химических уравнений.
Обзор
- Что такое закон сохранения массы?
- Как Дальтон описал процесс химической реакции?
- Почему бы нам не изменить нижние индексы, чтобы сбалансировать уравнение?
Эта страница под названием 11.3: Балансирующие уравнения распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- источник@https://flexbooks.
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник@https://flexbooks.
Balance Chemical Equation – Online Balancer
Balance Chemical Equation – Online BalancerПожалуйста, включите JavaScript, чтобы использовать этот веб-сайт.
Распечатано с https://www.webqc.org
| Введите химическое уравнение для баланса: |
| Инструкции по балансировке химических уравнений:
|

 4-е издание, перераб. и доп., 1968 – 359 с.
4-е издание, перераб. и доп., 1968 – 359 с.
