Химия в солнечном свете
Ровно 150 лет назад, 18 августа 1868 года, двум ученым — Пьеру Жансену и Норману Локьеру — независимо друг от друга удалось обнаружить в спектре солнечных протуберанцев линию, которая не принадлежала ни одному из известных на тот момент химических элементов. Таким образом впервые был открыт элемент, про существование которого на Земле ничего не было известно. Имя он получил соответствующее — гелий (от древнегреческого ἥλιος — Солнце). Дальнейшая история показала, что и на нашей планете этого газа достаточно, хотя получить его непросто даже сегодня, не говоря о технических возможностях XIX века. Тем не менее, свое изначальное солнечное название элемент сохранил. Давайте разберемся, как удалось найти новый элемент с помощью исключительно оптических измерений и на что подобные измерения способны в наше время.
Обнаружить новый элемент на Солнце, ничего не зная о его присутствии на Земле, ученым помогли спектроскопические методы, основанные на том, что каждый элемент из всего непрерывного светового спектра выбирает только определенные длины волн, которые либо избирательно поглощает, либо, наоборот, избирательно испускает.
Определение металлов по цвету пламени
Основы современной спектроскопии были заложены еще в начале XIX века немецким химиком Робертом Вильгельмом Бунзеном. Ученый заметил, что если небольшие образцы металлов или их солей поместить в пламя газовой горелки (изначально практически бесцветное), то у этого пламени появляется выраженная окраска, причем для разных металлов — разная. Так, если поместить в пламя натрий, то оно станет желтым, если литий — то красным, а если калий — фиолетовым.
Именно для определения щелочных и щелочно-земельных металлов анализ цвета пламени оказался наиболее полезным. Известны все эти металлы были и ранее, но многие из них очень трудно отличить друг от друга только с помощью химических реакций. Например, ионы калия и натрия в водных растворах ведут себя практически одинаково, но вот если каплю этих растворов поместить в пламя горелки, то их сразу можно отличить друг от друга.
Тем не менее, несмотря на наглядность этого подхода и его очевидную пользу для быстрого качественного анализа, такой метод оказался весьма грубым. Во-первых, таким образом невозможно определить наличие небольших примесей. Кроме того, оказалось, что человеческий глаз не способен отличить друг от друга цвета пламени многих элементов. Например, и литий, и стронций дают один и тот же цвет — красный, и понять, чем красный цвет лития отличается от красного цвета стронция, без дополнительных приборов невозможно.
Во-первых, таким образом невозможно определить наличие небольших примесей. Кроме того, оказалось, что человеческий глаз не способен отличить друг от друга цвета пламени многих элементов. Например, и литий, и стронций дают один и тот же цвет — красный, и понять, чем красный цвет лития отличается от красного цвета стронция, без дополнительных приборов невозможно.
Спектроскоп Бунзена — Кирхгофа
Поэтому, чтобы сделать метод химического анализа, основанный на анализе цвета пламени, более точным, Бунзен вместе с физиком Густавом Робертом Кирхгофом разработал специальный прибор, который мог преобразовать свет, исходящий от окрашенного пламени, сразу в целый спектр — подобно тому, как стеклянная призма превращает белый свет в радугу. С помощью целой системы таких призм и увеличительных стекол ученым удалось разложить видимый свет от пламени по длинам волн.
 Самая яркая из них по цвету совпадала с цветом пламени, но также на экране можно было найти еще несколько линий меньшей интенсивности.
Самая яркая из них по цвету совпадала с цветом пламени, но также на экране можно было найти еще несколько линий меньшей интенсивности.Оказалось, что набор линий в оптических спектрах однозначно характеризует каждый элемент. И если на глаз два языка пламени красного цвета отличить друг от друга невозможно, то полный набор из десятка линий в разных частях спектра даст однозначную картину элементного состава изучаемого образца. При этом анализировать таким образом можно и сложные соединения, и смеси веществ — спектроскопия точно показывает, какие элементы входят в состав минерала, раствора или смеси порошков.
С помощью своего прибора ученые могли получать спектры двух типов — на них были либо яркие линии, светящиеся на фоне более тусклого спектра (их цвет при этом соответствует положению на радуге), либо, наоборот, это были спектры, на которых определенный цвет как будто бы вырезали. Первые из них — спектры испускания (или эмиссионные спектры) — образуются за счет излучения образцом света под действием определенного внешнего возбуждения.
Сейчас, после развития квантовой физики (толчком к которому послужили в том числе и спектроскопические данные), мы знаем, что эти линии в спектрах соответствуют энергетическим переходам в электронных оболочках атомов. Если электрон переходит с более низкого по энергии уровня на более высокий, то ему требуется дополнительная энергия. Эту энергию электрон поглощает из видимого света, которым его облучают, и таким образом приводит к появлению «вырезанных» линий в спектре поглощения. Если же в результате внешнего воздействия освобождается какой-то из низких энергетических уровней, то на него сразу же перескакивает электрон с более высокой энергией, испуская при этом энергетический избыток в виде кванта света. Этот квант оказывается в спектре в виде дополнительной яркой линии в эмиссионных спектрах.
Разница энергий ΔE электронных уровней однозначно определяет длину волны испускаемого или поглощаемого света λ согласно уравнению ΔE=hc/λ, где h — постоянная Планка, а c — скорость света. При этом поскольку спектры
поглощения и испускания образуются в результате переходов между одними и теми же энергетическими уровнями, то и положение линий в спектрах двух типов будет совпадать.
При этом поскольку спектры
поглощения и испускания образуются в результате переходов между одними и теми же энергетическими уровнями, то и положение линий в спектрах двух типов будет совпадать.
Энергетических уровней у электронов в атомах (особенно сложных) — много, поэтому и линий в их спектрах возникает тоже множество — по одной на каждую пару уровней. Вероятность перехода между ними будет влиять на яркость той или иной линии в спектре, а суммарный набор всех спектральных полос становится однозначной характеристикой каждого отдельного элемента.
Бунзен во время своих экспериментов всего этого еще не знал, однако понял, что спектроскопические данные — то есть положение полос на радуге видимого света — однозначно определяют элемент. В результате химику и его последователям удалось составить полную таблицу спектрометрических данных для всех известных на тот момент элементов. А изучив оптические спектры некоторых минералов, ученым удалось обнаружить в них новые линии, по которым были описаны и неизвестные к тому времени элементы.
Открытие гелия
Теперь вернемся к гелию. Поскольку выяснилось, что обнаруживать новые элементы можно, основываясь только на их свечении, а достаточно точные спектроскопы к середине 60-х годов XIX века уже стали занимать довольно мало места, к 1868 году у ученых появилась идея исследовать таким образом химический состав Солнца. При этом возникла она одновременно и независимо сразу как минимум у двух ученых — Пьера Жансена и Нормана Локьера. Делать это они решили 18 августа 1868 года — в день полного солнечного затмения.
В тот момент, когда солнечный диск полностью закрывается лунным, снаружи можно видеть выступающие изменчивые образования — протуберанцы, и именно их спектр ученые решили изучить. Потом, правда, выяснилось, что если правильно настроить спектрометр, то спектр Солнца можно спокойно изучать и в другие дни, а не только во время затмения.
В результате этих экспериментов ученые описали целую серию спектральных линий, характерных для солнечного света. Впервые все эти полосы, названные Фраунгоферовыми линиями, были обнаружены еще в начале XIX столетия, однако связать положение каждой из них с химическим составом звезды удалось лишь более полувека спустя. Изначально были описаны 570 линий, сейчас их выделяют больше тысячи.
Впервые все эти полосы, названные Фраунгоферовыми линиями, были обнаружены еще в начале XIX столетия, однако связать положение каждой из них с химическим составом звезды удалось лишь более полувека спустя. Изначально были описаны 570 линий, сейчас их выделяют больше тысячи.
Стоит отметить, что, в отличие от тех спектров, которые Бунзен и Кирхгоф получали в лабораторных условиях, солнечный спектр представлял собой спектр поглощения — некоторых длин волн в сплошном спектре не хватало за счет того, что часть света поглощали элементы во внешних слоях атмосферы Солнца, однако линии в нем занимали те же положения, что и в спектрах испускания различных элементов, полученных ранее на Земле.
Благодаря данным, собранным за предыдущие годы, ученым без труда удалось определить, какие именно элементы привели к образованию полученного спектра. Подавляющее большинство линий свидетельствовали о наличии на Солнце водорода, также удалось обнаружить и другие элементы — в частности, железо, натрий, кальций и хром. Однако одна из ярких спектральных линий в желтой части спектра осталась неопознанной. Сначала ее приняли за двойную линию натрия, но при ближайшем рассмотрении оказалось, что эта полоса смещена относительно известных позиций натриевых линий, поэтому она была приписана новому элементу, который ученые и назвали гелием.
Однако одна из ярких спектральных линий в желтой части спектра осталась неопознанной. Сначала ее приняли за двойную линию натрия, но при ближайшем рассмотрении оказалось, что эта полоса смещена относительно известных позиций натриевых линий, поэтому она была приписана новому элементу, который ученые и назвали гелием.
Обнаружить гелий на Земле удалось намного позже — только спустя 27 лет. Сначала этот инертный газ нашли в минералах, содержащих радиоактивные элементы и производящих гелий в результате их распада, а затем благодаря усовершенствованию методов газового фракционирования смогли получить его и из воздуха.
Гелий активно используется, например, для проведения экспериментов в условиях низких температур, поэтому поиск естественных месторождений гелия и сегодня остается актуальной задачей. Так, недавно химики из Оксфордского и Даремского университетов специально разработали метод направленного поиска месторождений гелия, с помощью которого нашли крупнейшее из известных на данный момент месторождений в Восточно-Африканской рифтовой долине с емкостью около полутора миллиарда кубометров.
Более детальное изучение спектров
Изначально вся информация, которую ученые предлагали получать из спектроскопических данных, основывалась на единственном параметре — положении спектральных линий (сначала на проецируемой на экран радуге, образованной в результате дисперсии из видимого света, а затем — и по длине волны). Но оказалось, что в этих спектрах содержится значительно больше информации. Во-первых, все линии отличаются друг от друга по яркости свечения, поэтому любой спектр можно представить в виде зависимости интенсивности от длины волны. В таком виде спектр представляет из себя набор пиков с разными положением, шириной и высотой.
Если интенсивность каждого пика определяется изначальной электронной структурой атома, то по уширению спектральных линий можно делать выводы о каких-то дополнительных свойствах исследуемого объекта: например, химики могут таким образом определить параметры взаимодействия конкретного атома с кристаллической решеткой, а астрономы — измерить температуру звезды.
Кроме того, положения пиков на спектрах все-таки не совсем постоянные, они могут смещаться. Движение спектральных линий по спектру происходит из-за случившегося по какой-то причине изменения энергии волны. Такой причиной может быть и непосредственно смещение энергетических электронных уровней, и изменение параметров волны после испускания. Так, в кристаллических материалах изначальные электронные уровни могут расщепляться под влиянием соседних атомов — например, магнитное поле от соседей по кристаллической решетке может приводить к тому, что за счет эффекта Зеемана один уровень расщепляется на несколько. Таким образом в спектре пик не только смещается, но еще и множится.
Другая возможная причина изменения положения спектральных линий — эффект Доплера. Так, если волну испускает объект, движущийся с большой скоростью, например звезда, то частота излучения смещается в область более длинных волн (то есть в сторону красного цвета) при движении от наблюдателя или в область более коротких длин волн (в сторону фиолетового цвета) при движении к наблюдателю.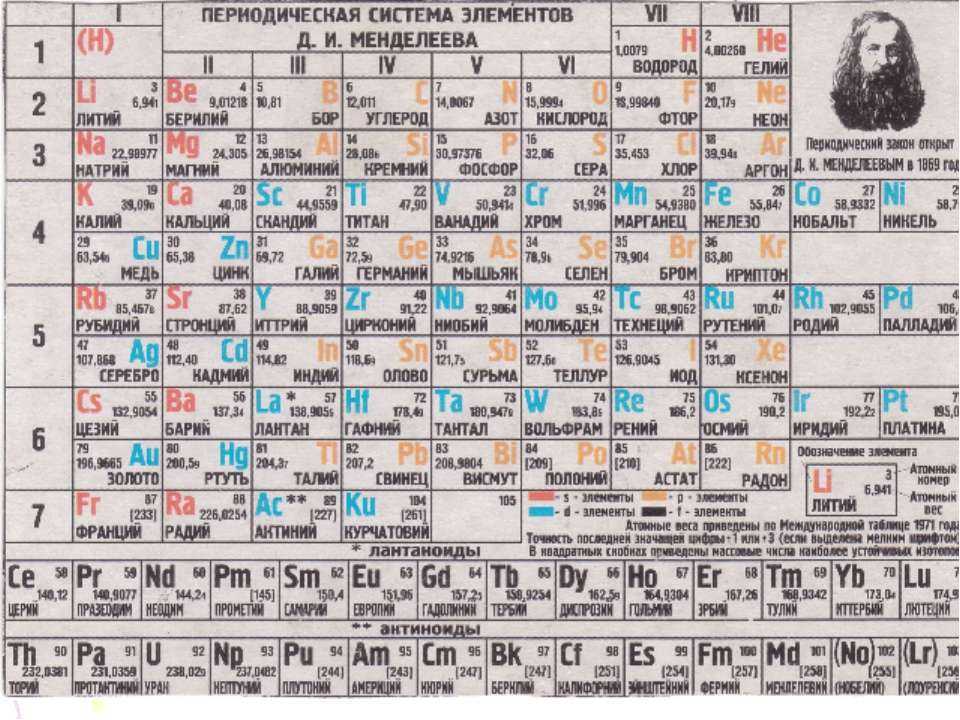 Поскольку «правильное» положение линий (которое было бы, будь звезда неподвижной) известно, то по их смещению можно определить скорость движения нашей звезды (или галактики, или туманности).
Поскольку «правильное» положение линий (которое было бы, будь звезда неподвижной) известно, то по их смещению можно определить скорость движения нашей звезды (или галактики, или туманности).
Эффект Доплера, кстати, может приводить не только к смещению, но и к уширению пиков, если излучающих объектов одновременно много и двигаются они все случайным образом в разные стороны.
Спектроскопические методы в химическом анализе
Сейчас спектроскопические методы — один из самых распространенных методов анализа как в «земной» химии, так и при изучении различных астрономических объектов. Так, окрашивание пламени до сих пор используется для быстрого качественного определения щелочных и щелочно-земельных металлов. Более сложные спектроскопы продолжают использовать для проведения количественного химического анализа и в физических экспериментах. Количество спектроскопических методов за полтора века значительно увеличилось, и они уже давно не ограничиваются только видимой частью спектра.
Однако именно видимый диапазон и примыкающие к нему инфракрасная и ультрафиолетовые области оказались наиболее удобными для элементного анализа и анализа молекулярного строения. Объясняется это довольно простым соображением: точно такие же электронные переходы используются светочувствительными рецепторами в сетчатке глаза человека при улавливании солнечного света. Мы их воспринимаем как цвет, а прибор аналогичные сигналы преобразует в пики на спектре.
Сейчас спектроскопия в видимой и ультрафиолетовой областях чаще используется не для элементного анализа, а для исследования электронных переходов в органических молекулах. Это позволяет изучить строение комплексных соединений в растворах, определить их люминесцентные свойства. Нередко этот же тип спектроскопических измерений используют для исследования свойств полупроводников, у которых ширина запрещенной зоны как раз соответствует излучению в видимой и ультрафиолетовой частях электромагнитного спектра.
При этом энергия электронных переходов оказывается не единственной, которую можно использовать для электромагнитной спектроскопии.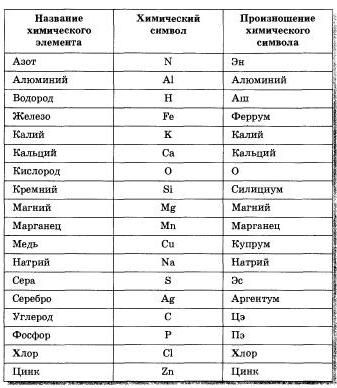
Спектроскопические методы используют электромагнитное излучение и других длин волн — в микроволновом, терагерцовом и рентгеновском диапазонах. Это излучение взаимодействует с электронами и ядрами атомов, приводя не только к поглощению или испускания света, но также, например, к отражению, дифракции или выбиванию из вещества электронов. Так, с помощью микроволновой спектроскопии ученые могут исследовать переходы между вращательными состояниями молекул, с помощью рентгеновской дифракции — строение кристаллов, а излучение в мегагерцовом диапазоне приводит к изменению магнитного момента ядра.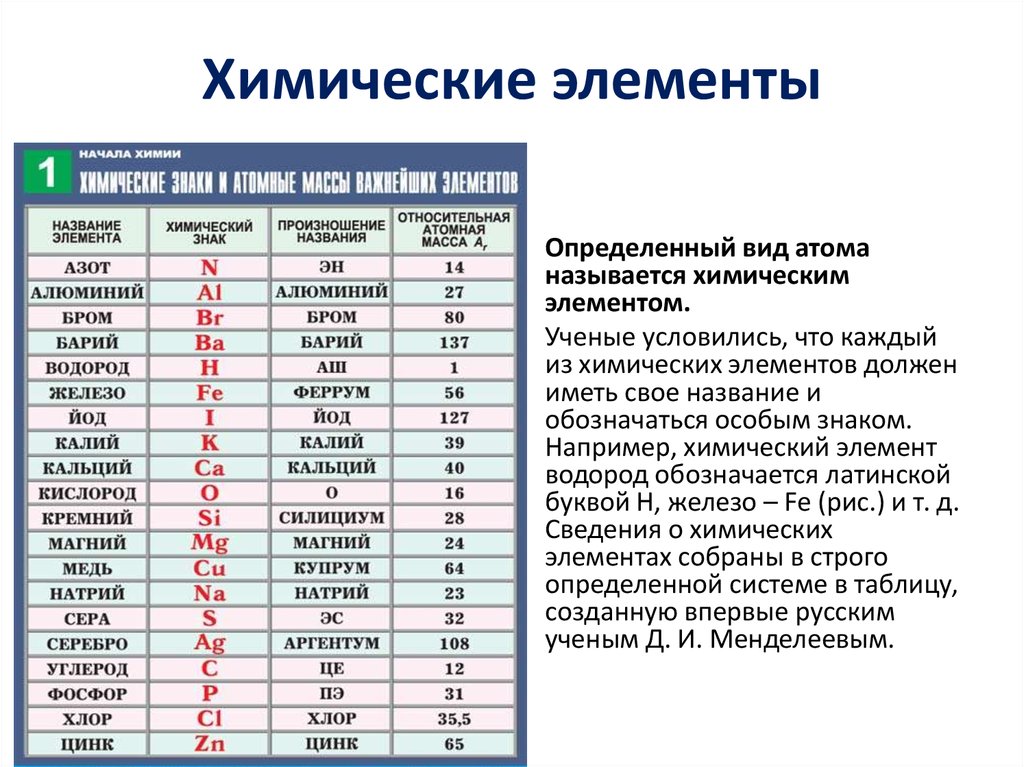
Спектроскопические методы в астрономии
Пример гелия показал, что спектроскопия — один из самых эффективных инструментов для исследования астрономических объектов. Поскольку поместить звезду или галактику в измерительный прибор невозможно, то за ними остается только наблюдать, исследуя спектры тех электромагнитных сигналов, которых до нас долетают. В первую очередь, с помощью спектроскопии можно изучать именно химический состав астрономических объектов.
Основным источником данных остаются спектры в видимой, ультрафиолетовой и инфракрасной частях спектра. Именно по ним легче всего определить элементный состав звезд (который показывает, в основном, наличие самых легких элементов, водорода и гелия — их в космосе 98 процентов) или облаков межзвездного газа. Другой важной для астрономической спектроскопии частью электромагнитного спектра оказался радиодиапазон: именно там находятся энергетические переходы между вращательными состояниями молекул.
Также для исследований используется электромагнитное излучение в гамма-диапазоне — в частности, с помощью него ученые пытаются исследовать источники космических лучей. Как и полтора века назад, основной информацией, которую астрономам удается получать с помощью спектроскопических исследований космоса, все еще остается химический состав небесных тел. Однако теперь с помощью них также можно измерять, например, температуру, светимость и скорость небесных тел или плотность их оболочек. При этом количество объектов, исследуемых с помощью спектроскопии, точность методов, количество определяемых веществ и исследуемых параметров за эти 150 лет увеличились не на один порядок.
Александр Дубов
Как быстро выучить химические элементы? Тест на химические элементы от Skills4u
Зарегистрируйся и получи 7 дней бесплатного доступа к тренажерам и персональный план прокачки знаний до 100%!
Вопросов в тесте: 24
Среднее время прохождения: ~10:00
Зарегистрируйся и получи персональный план прокачки знаний до 100%!
Как работает платформа Skills4u
Тестирование по предмету за класс
Платформа определит, какие темы сформированы слабо и составит индивидуальный план обучения
Персональный план обучения
План обучения и повторений поможет ученику в закреплении всех необходимых тем по предмету
Закрепление темы на 100%
Платформа напомнит и проконтролирует все повторения для закрепления каждой темы на 100%
Проработка слабых тем с предыдущих классов
Чтобы идеально овладеть предметом, рекомендуем закрепить пробелы, начиная с самых простых тем
Почему нужно пройти общее тестирование по химии за 8 класс, а не по отдельной теме «Названия химических элементов»
Пройдя тестирование за класс вы получите ПОЛНУЮ КАРТИНУ ЗНАНИЙ ПО ВСЕМ ТЕМАМ.
Такой подход позволит глубинно проанализировать знания, вывести успеваемость и понимание предмета на качественно новый уровень.
Пройдя тестирование по одной теме вы получите РЕЗУЛЬТАТ ЗНАНИЙ ТОЛЬКО ЭТОЙ ТЕМЫ, которая, возможно, плохо изучена. Такой метод не является комплексным и дает лишь точечное понимание знаний по предмету.
Зарегистрироваться и пройти тестирование
Представляем короткий, но эффективный тест на химические элементы для учеников 8 класса, который поможет вам запомнить общепринятые обозначения каждого из них. Тест состоит из 24 вопросов, на которые необходимо ответить в возможно более короткое время. Помните, что система, основанная на интеллектуальной образовательной платформе, учитывает не только правильность ответов, но и время, потраченное на прохождение теста.
Вам предстоит расшифровать названия химических элементов, представленные латинскими буквами. На выбор предлагается четыре варианта ответа, из которых только один является правильным.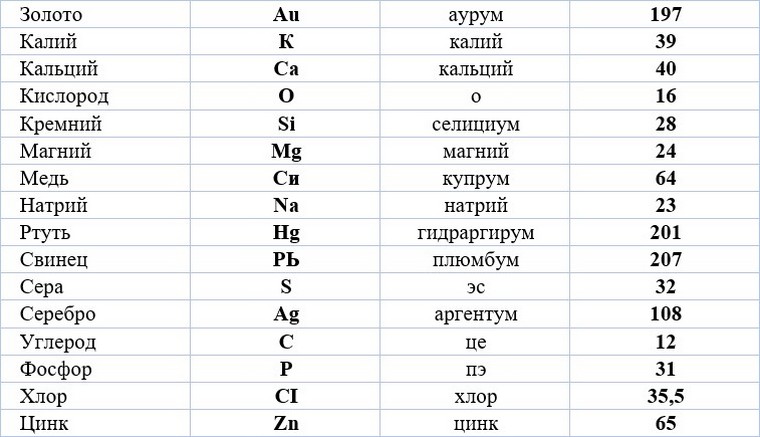 Необходимо указать ответ, который вы считаете верным. Если он указан ошибочно, загорится красный свет, но одновременно появится и правильный вариант ответа, подсвеченный зеленым. Это очень удобно, так как избавляет от необходимости обращаться к учебникам и справочникам.
Необходимо указать ответ, который вы считаете верным. Если он указан ошибочно, загорится красный свет, но одновременно появится и правильный вариант ответа, подсвеченный зеленым. Это очень удобно, так как избавляет от необходимости обращаться к учебникам и справочникам.
В среднем прохождение одного теста занимает не более 5-10 минут, а учебники и тетрадки не понадобятся совсем. Если вы будете заниматься ежедневно, вы узнаете, как быстро выучить химические элементы без особых усилий. Наш метод основан на формировании учебных навыков. Уже очень скоро вы будете безошибочно выбирать только правильные ответы.
Тем, кто затрудняется с ответом и не знает, как запомнить химические элементы, предлагаем пройти регистрацию и оформить доступ к образовательной платформе Skills4u на месяц, полгода или целый учебный год. Тогда вы сможете не просто проверить свой уровень знаний, но и получить возможность заниматься на тренажере в удобном для вас режиме.
Опытным путем мы установили алгоритм, который позволит быстро выучить химические элементы и довести учебный навык до автоматизма.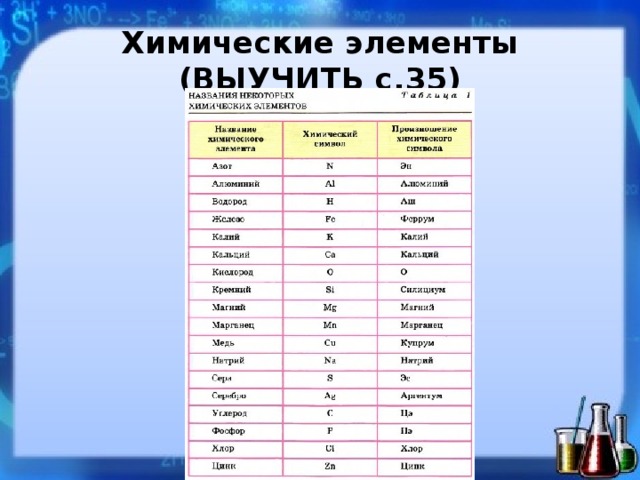 Для этого необходимо вернуться к выполнению задания через несколько часов, а затем продолжать заниматься в течение последующих 4-5 дней, пока не будет достигнут 100% результат. Как правило, этого временного отрезка бывает достаточно, чтобы сформировать устойчивый навык.
Для этого необходимо вернуться к выполнению задания через несколько часов, а затем продолжать заниматься в течение последующих 4-5 дней, пока не будет достигнут 100% результат. Как правило, этого временного отрезка бывает достаточно, чтобы сформировать устойчивый навык.
Как растут результаты учеников
после занятий на тренажерах Skills4u
Занятия
на Skills4u
Занятия
с учебником
Успеваемость
Мотивация
Внимательность
Скорость
Самостоятельность
Запоминание
Первичный Тест «Названия химических элементов» по химии за 8 класс онлайн и бесплатно предоставляется всем желающим.
Советуем пройти тестирование за весь 8 класс по химии, чтобы узнать пробелы в знаниях по всем темам и получить индивидуальный план обучения.
После регистрации вы получите 7 дней бесплатного доступа, чтобы увидеть первые результаты занятий и оценить эффективность тренажеров.
Зарегистрироваться и пройти тестирование
Мы рекомендуем использовать тренажер при подготовке к контрольным и итоговым экзаменам. Желаем успеха!
Желаем успеха!
А для комплексного результата пройдите общее тестирование за
класс! Узнайте пробелы в знаниях по всем темам
Ученик
Занимайся 20 минут в день и прокачай знания по школьной программе за месяц!
Родитель
Наслаждайтесь прогрессом вашего ребенка в школе и на платформе
Учитель/
репетитор
Задавайте и проверяйте домашние задания прямо на платформе
Зарегистрироваться и пройти тестирование
60655
учеников уже занимаются с нами
Поиск химической формулы
Пожалуйста, следуйте инструкциям ниже, чтобы провести поиск (Помощь):
- Введите желаемую химическую формулу (например, C4H*Cl):
- Выберите любые нужные параметры для поиска:
Точное соответствие указанным изотопам. (Справка)
(Справка)
Разрешить элементы, не указанные в формуле. (Справка)
Разрешить большее количество атомов элементов в формуле чем указано. (Справка)
Исключить из поиска ионы. (Справка) - Выберите нужные единицы для термодинамических данных:
SI калорийный - Выберите нужный тип данных:
Термодинамические данные Прочие данные Газовая фаза ИК спектр Конденсированная фаза ТГц ИК спектр Изменение фазы Масс-спектр реакция УФ/видимый спектр Ионная энергетика Газовая хроматография Ионный кластер Вибрационные и электронные энергетические уровни Константы двухатомных молекул Закон Генри - Нажмите здесь для поиска:
Правила для химических формул
(Вернуться к поиску)- Введите последовательность символов элемента, за которыми следуют числа
указать количество желаемых элементов (например, C6H6).

- Используйте правильный регистр символов элементов. Если правильный случай не используется, формула может быть неоднозначной и интерпретация выбранный не может быть желаемым.
- Элементы могут быть в любом порядке.
- Если требуется только один из заданных атомов, вы можете опустить номер после символа элемента.
- Круглые скобки могут использоваться для группировки атомов.
- Будет добавлено несколько спецификаций для атома. Это означает, что Ch4(Ch3)4Ch4 будет обрабатывается так же, как C6h24 .
- Чтобы указать один или несколько заданных атомов, используйте вопросительный знак (?) после символа элемента.
- Указать любое количество (в том числе нулевое) заданных элемент, используйте звездочку (*) после символа элемента.
- Чтобы явно указать ион, поместите заряд в
конец формулы. Если заряд превышает
один заряд должен быть включен после + или символ - (например, C60-2 ).

Примеры химических формул
(Вернуться к поиску)| Chemical Formula | Search Specification |
|---|---|
| C2h5 | Species with two C, and four H. |
| Ch3Ch3 | Species with two C, and four H. |
| Ch4CH | Species with два C и четыре H. |
| (Ch3)2 | Виды с двумя C и четырьмя H. |
| C2H*F? | Виды с двумя C, нулем или более H и одним или более F. |
Варианты поиска (шаг 2)
(Вернуться к поиску)- Точное соответствие указанным изотопам
- Если флажок установлен, этот параметр указывает, что поиск
должны соответствовать изотопам, указанным в формуле поиска.
Например, если эта опция не отмечена, поиск по h3 будет соответствовать видам, содержащим
атомы дейтерия и трития.
 Если этот параметр был отмечен,
дейтерий и тритий будут исключены из поиска.
Если этот параметр был отмечен,
дейтерий и тритий будут исключены из поиска. - Разрешить элементы, не указанные в формуле
- Если флажок установлен, этот параметр указывает, что виды содержащие элементы, не указанные в формуле также будет соответствовать. Например, поиск Te2 найдете все виды, которые содержат ровно два атома теллура и любое число другие атомы. Проверка только этой опции эквивалентна к «частичному поиску формулы», доступному ранее с этого сайта.
- Эта опция указывает, что виды содержат больше атомы, чем указано для данного элемента, будут сопоставлены. Например, поиск Te только с если этот флажок установлен, будут найдены все теллур, дителлур, трителлур и др.
- Исключить ионы из поиска
- Если этот параметр отмечен, поиск не будет соответствуют ионам, если заряд явно не указан в формула.
Правила для типов данных (шаг 4)
(Вернуться к поиску)- Если проверяется один или несколько типов данных,
поиск будет ограничен видами, которые
содержать хотя бы один из указанных типов данных.

- Если ни один из типов данных не проверен, не будет никаких ограничений на поиск.
Викторина по элементам и таблице Менделеева в App Store
Описание
На английском языке. Вы узнаете названия и символы всех 118 химических элементов.
С помощью этого приложения вы выучите названия и символы всех 118 химических элементов Периодической таблицы — от азота (N) и кислорода (O) до плутония (Pu) и америция (Am). Это одна из лучших игр на химию.
Выберите наиболее удобный для вас способ обучения:
1) Викторина по основным элементам (магний Mg, сера S).
2) Продвинутый опросник по элементам (ванадий = V, палладий = Pd).
3) Все элементы игры от водорода (H) до оганесона (Og).
+ Отдельный тест по атомным числам (например, 20 — кальций Ca).
Выберите режим игры:
* Орфографические викторины (простые и сложные).
* Вопросы с несколькими вариантами ответов (с 4 или 6 вариантами ответа). Важно помнить, что у вас всего 3 жизни.
Важно помнить, что у вас всего 3 жизни.
* Игра на время (дайте как можно больше ответов за 1 минуту) – вы должны дать более 25 правильных ответов, чтобы получить звезду.
Два учебных пособия:
* Флэш-карточки: просмотрите все карточки с важной информацией об атомном номере, химическом символе, атомной массе и названии элемента.
* Периодическая таблица.
Приложение переведено на 22 языка, включая английский, немецкий, испанский и многие другие. Так вы сможете узнать названия элементов в любой из них.
Рекламу можно удалить с помощью покупки в приложении.
Большое спасибо Дмитрию Менделееву, первооткрывателю Периодического закона! Элемент с атомным номером 101 назван в его честь Менделевием (Md).
Определите все элементы от щелочных металлов и лантаноидов (редкоземельных металлов) до переходных металлов и благородных газов. Я надеюсь, что это приложение поможет вам сделать важный шаг в изучении общей и неорганической химии.
000Z” aria-label=”May 21, 2021″> 21 мая 2021 г.
Версия 2.3.0
+ Новые режимы игры.
Рейтинги и обзоры
121 Рейтинг
Полезно с химией
Это меньше изучения каждого элемента и больше о символах и правописании, и есть несколько дополнений, но помимо этого качество хорошее, и если вы пытаетесь запомнить периодическую таблицу, то это приложение идеально подходит
Чрезвычайно полезно
Один из моих учителей порекомендовал мне это приложение, потому что у меня были небольшие проблемы с изучением периодической таблицы. Когда я впервые загрузил его, он показался мне немного простым, но, опробовав некоторые функции, я обнаружил, что он действительно помогает мне выучить элементы.
Он не только научит вас элементам с помощью викторин с несколькими вариантами ответов, но также научит вас писать как второстепенные, так и основные элементы. Одна из главных причин, почему я люблю это приложение, — отсутствие дополнений. Объявления появляются только время от времени, и ни одно из них не является добавлением видео, а это значит, что вы можете выйти из них почти сразу! ЛЮБЛЮ ЭТО ПРИЛОЖЕНИЕ!!!
Великий и Замечательный!
Это супер-пупер полезное приложение, я очень хотел выучить элементы периодической таблицы! И еще одна вещь, которую нужно сказать, это то, что у него не так много добавлений! Вы можете легче разобраться в вещах, вместо того, чтобы смотреть кучу объявлений. Я должен вычислить больше элементов в этом приложении, вместо того, чтобы смотреть, писать и угадывать! Это дало мне намного больше, чем раньше!
Хорошего дня!
Спасибо за отзыв!
Разработчик Андрей Соловьев указал, что политика конфиденциальности приложения может включать обработку данных, как описано ниже. Для получения дополнительной информации см. политику конфиденциальности разработчика.
Для получения дополнительной информации см. политику конфиденциальности разработчика.
Данные, используемые для отслеживания вас
Следующие данные могут использоваться для отслеживания вас в приложениях и на веб-сайтах, принадлежащих другим компаниям:
- Идентификаторы
- Данные об использовании
- Диагностика
Данные, не связанные с вами
Могут быть собраны следующие данные, но они не связаны с вашей личностью:
- Идентификаторы
- Данные об использовании
- Диагностика
Методы обеспечения конфиденциальности могут различаться, например, в зависимости от используемых вами функций или вашего возраста.

 (Справка)
(Справка) 

 Если этот параметр был отмечен,
дейтерий и тритий будут исключены из поиска.
Если этот параметр был отмечен,
дейтерий и тритий будут исключены из поиска.