Старейшая настенная таблица Менделеева • Аркадий Курамшин • Научная картинка дня на «Элементах» • Химия
Переда вами, вероятно, самая старая из сохранившихся настенных таблиц Менделеева, изданных типографским способом. Она была отпечатана в конце XIX века в Вене и вместе с другими таблицами из этого тиража использовалась в качестве демонстрационного материала для занятий со студентами. Таблица была обнаружена в 2014 году в Сент-Эндрюсском университете и отреставрирована, однако массовый интерес к находке возник только спустя пять лет, когда 2019 год был объявлен годом Периодической таблицы химических элементов.
История находки старейшей аудиторной Периодической системы напоминает сценарий фильма, про который хочется сказать: «Нет, так не бывает, сюжет притянут за уши». В 2014 году сотрудникам химического факультета Сент-Эндрюсского университета (это самый старый шотландский университет и третий в Великобритании) было поручено навести порядок на складе, расположенном под одной из крупных лекционных аудиторий.
Ближе к окончанию этой эпической уборки участников ждал приятный сюрприз: в глубине склада была найдена стопка наглядных учебных материалов — таблицы и картинки, которые, вероятно, перекочевали на склад из здания, где до 1968 года располагался химический факультет. Среди этих бумаг, некоторые из которых рассыпались от старости, и была обнаружена вышеупомянутая таблица Менделеева.
Возраст таблицы и плохие условия хранения сделали свое печальное дело: бумага, на которой были отпечатаны символы химических элементов, стала хрупкой и могла рассыпаться от малейшего прикосновения. Этому способствовала тяжелая основа таблицы из льняной ткани, а также то, что таблица была свернута в рулон. Сент-Эндрюсский университет получил на реставрацию таблицы грант от Британского фонда реставрации рукописей. Ее восстановлением занялся известный в Британии реставратор предметов живописи Ричард Хокс.
Этому способствовала тяжелая основа таблицы из льняной ткани, а также то, что таблица была свернута в рулон. Сент-Эндрюсский университет получил на реставрацию таблицы грант от Британского фонда реставрации рукописей. Ее восстановлением занялся известный в Британии реставратор предметов живописи Ричард Хокс.
Сначала реставраторы удалили с поверхности таблицы грязь и пыль, а также те участки бумаги, которые не подлежали восстановлению. Затем бумажный плакат отделили от льняной основы, промыли в деионизированной воде при нейтральных значениях pH. После промывки водой таблицу обработали раствором гидроксида кальция Ca(OH)2, удалив кислые загрязнения, а затем выдержали в растворе гидрокарбоната магния Mg(HCO3)2, бумага при этом адсорбировала ионы магния, нужные для увеличения ее прочности. На завершающем этапе реставрации утраченные участки бумаги были восстановлены с помощью японской бумаги васи (см. Бруссонетия бумажная и Paper mulberry) и крахмальной пасты.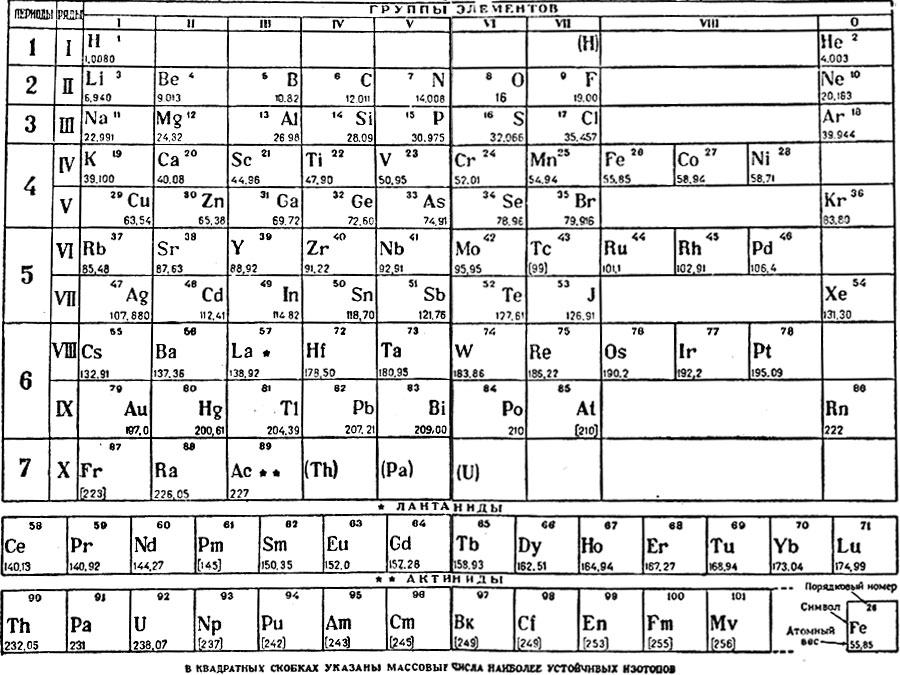
После реставрации таблица заняла почетное место среди раритетных экспонатов библиотеки университета, а ее копию выставили на всеобщее обозрение на химическом факультете Сент-Эндрюсского университета.
Таблица подписана по-немецки: если переводить дословно — «Периодическая зависимость элементов Менделеева». Она похожа на вторую версию Периодической системы, предложенную Дмитрием Ивановичем Менделеевым в 1871 году в книге «Основы химии», но не полностью ей идентична. В свою таблицу 1871 года Менделеев внес несколько еще не открытых химических элементов, предсказав их атомные массы и свойства, и в версии самого Дмитрия Ивановича на месте предсказанных элементов стояли только их атомные веса. В Сент-Эндрюсской таблице же два элемента — скандий (Sc) и галлий (Ga) уже отпечатаны как обнаруженные.
Наиболее известна тройка предсказанных и открытых при жизни Менделеева элементов — экабор (скандий, открыт в 1879 году), экаалюминий (галлий, открыт в 1875 году) и экакремний (германий, открыт в 1886 году). Именно после того, как эти элементы были открыты и их свойства практически совпали с менделеевскими предсказаниями, о Периодической системе перестали говорить как просто о способе систематизации химических элементов. Периодический закон был признан фундаментальным естественнонаучным законом. Исполнение предсказаний Менделеева привело к тому, что Дмитрий Иванович перестал быть просто одним из трех систематизаторов химических элементов и создателей таблицы наряду с Юлиусом Лотаром Мейером и Джоном Александром Ньюлендсом. Открытие галлия, скандия и германия превратило Менделеева в создателя основного закона химии и самого известного русского химика во мире.
Именно после того, как эти элементы были открыты и их свойства практически совпали с менделеевскими предсказаниями, о Периодической системе перестали говорить как просто о способе систематизации химических элементов. Периодический закон был признан фундаментальным естественнонаучным законом. Исполнение предсказаний Менделеева привело к тому, что Дмитрий Иванович перестал быть просто одним из трех систематизаторов химических элементов и создателей таблицы наряду с Юлиусом Лотаром Мейером и Джоном Александром Ньюлендсом. Открытие галлия, скандия и германия превратило Менделеева в создателя основного закона химии и самого известного русского химика во мире.
Таблица Менделеева, в которой были расставлены химические элементы, имела определенные черты, свойственные и для таблицы Ньюлендса, и для таблицы Мейера. Во всех трех таблицах элементы были расположены в порядке увеличения атомной массы, во всех трех таблицах оставались пустые ячейки, зарезервированные под элементы, которые еще не были открыты.
В 1882 году Лондонское королевское общество присудило Менделееву и главному его конкуренту в приоритете открытия периодической системы Лотару Мейеру свои высшие награды — золотые медали Дэви — «За открытие периодических соотношений атомных весов». Однако после открытия германия в 1886 году и Ньюлендс, и Мейер всё реже упоминаются в связи с созданием и периодического закона, и его графического отображения — Периодической системы.
В таблице, обнаруженной в Сент-Эндрюсском университете, скандий и галлий уже приведены как открытые, но германий (клетка без символа элемента, но с атомным весом 72, еще пуста).
Маленькое расследование позволило сотрудникам Сент-Эндрюсского университета с большой вероятностью предположить, что найденная таблица появилась в их университете в XIX веке благодаря профессору Томасу Перди (Thomas Purdie), работавшему там с 1884-го по 1908 годы. В архивах университета были найдены детали закупки профессором Перди таблицы у поставщика научных материалов в Бонне. Покупка таблицы вместе с почтовой доставкой обошлась университету не очень дорого — в три марки (эта сумма сегодня эквивалентна примерно 1500 рублям). Собственно говоря, ситуация вполне обычная: профессор, начинающий исследовательскую и преподавательскую работу на новом месте, старается обустроить его, приобретая самое новое для своего времени исследовательское оборудование и самые свежие учебно-методические материалы.
Собственно говоря, ситуация вполне обычная: профессор, начинающий исследовательскую и преподавательскую работу на новом месте, старается обустроить его, приобретая самое новое для своего времени исследовательское оборудование и самые свежие учебно-методические материалы.
С помощью раритетной таблицы Менделеева можно совершить путешествие во времени. Хотя основные ее очертания напоминают классическую короткопериодную версию Периодической системы, она заметно отличается от нее. Во-первых, некоторые атомные массы, приводимые в таблице, отличаются от привычных для нас значений (например, атомная масса 240 для урана, 125 — для теллура). Уточненные значения атомных масс, которые куда ближе к массам, опубликованным в современных таблицах (238,03 для урана и 127,6 для теллура), были получены немного позже — американским химиком Теодором Уильямом Ричардсом, которому присудили в 1914 году Нобелевскую премию по химии именно за «
 ..».
..».Во-вторых, в таблице полностью отсутствуют инертные газы, что, впрочем, и неудивительно. Сообщение об открытии первого инертного газа — аргона — было сделано в 1894 году, через восемь лет после открытия германия. Чуть позже были открыты и другие инертные газы, и из-за их инертности (нульвалентности) Менделеев предложил поместить их в нулевую группу Периодической системы, что и было сделано в последнем прижизненном издании «Основ химии». В привычной для нас восьмой группе инертные газы оказались уже после работ Генри Мозли и Нильса Бора, объяснивших причины периодичности свойств химических элементов повторяемостью электронной конфигурации. Отдельные семейства лантаноидов и актиноидов тоже появились уже в ХХ веке, а в обнаруженной таблице известные на то время лантаноиды и актиноиды (в таблице их два — уран и торий) распределены по группам.
Ну и, наконец, «пасхальное яйцо» для самых внимательных. В шестой группе, восьмом ряду Сент-Эндрюсской таблицы помещен символ Di с атомной массой 145. Это не устаревший символ диспрозия, как кто-то мог подумать, а «элемент» дидим (Didymium) — смесь трудноразделяемых элементов неодима и празеодима, которая с 1839-го по 1885 год считалась индивидуальным химическим элементом. То, что «дидим» представляет собой два элемента, австрийский химик Карл Ауэр фон Вельсбах показал только в 1885 году. Кстати, это обстоятельство позволяет сузить временной интервал, в который таблица была отпечатана, до периода 1879–1885 годов.
Это не устаревший символ диспрозия, как кто-то мог подумать, а «элемент» дидим (Didymium) — смесь трудноразделяемых элементов неодима и празеодима, которая с 1839-го по 1885 год считалась индивидуальным химическим элементом. То, что «дидим» представляет собой два элемента, австрийский химик Карл Ауэр фон Вельсбах показал только в 1885 году. Кстати, это обстоятельство позволяет сузить временной интервал, в который таблица была отпечатана, до периода 1879–1885 годов.
В заключение хотелось бы пожелать коллегам быть внимательнее и осторожнее, наводя порядок в помещениях, где долго копятся предметы, ставшие ненужными. Как показывает пример химиков Сент-Эндрюсского университета, во время такой уборки можно найти настоящий раритет.
Фото с сайта gsy.bailiwickexpress.com.
Аркадий Курамшин
Таблица Менделеева
Еще до Менделеева было несколько ученых, которые попробовали свои силы в организации 63 элементов, известных в то время. С тех пор было обнаружено в общей сложности 118 элементов, и предпринято много попыток перестроить их с помощью диаграмм, имеющих форму чего угодно, от странных улиток до объемных цветов.
С тех пор было обнаружено в общей сложности 118 элементов, и предпринято много попыток перестроить их с помощью диаграмм, имеющих форму чего угодно, от странных улиток до объемных цветов.
Offnfopt/Wikimedia/Public Domain
Классическая периодическая таблица, которая есть на развороте каждого учебника химии, основана на том, что свойства веществ меняется в зависимости от их атомной массы. Но это не единственный признак, по которому вещества пытались упорядочивать. Вот некоторые самые интересные из вариантов.
Башня
DePiep/Wikimedia/CC-BY-3.0
Эта таблица, разработанная в 2006 году Валерием Циммерманом, сильнее всех отличается от привычной нам формы. Вместо того, чтобы основываться на атомных номерах, эта периодическая таблица ADOMAH, систематизирована вокруг четырех квантовых чисел конфигурации электронов.
Спираль
DePiep/Wikimedia/CC-BY-3.0
Если последняя таблица была чисто функциональной, то основой этого варианта стал внешний вид и дизайн. Эта красота создана в 1964 году химиком Теодором Бенфеем. Она начинается в середине спирали водородом, закручивается наружу в порядке атомных номеров, а затем разветвляется на переходные металлы, лантаноиды, актиноиды и неизученные в настоящее время суперактиниды.
Эта красота создана в 1964 году химиком Теодором Бенфеем. Она начинается в середине спирали водородом, закручивается наружу в порядке атомных номеров, а затем разветвляется на переходные металлы, лантаноиды, актиноиды и неизученные в настоящее время суперактиниды.
3D цветок
Тимохова Ольга/Wikimedia/CC-BY-3.0
Чтобы разобраться в этом, надо приложить немного усилий. Здесь вообще нет водорода или гелия. Первая часть (или лепесток) бирюзового цвета содержит щелочные металлы спереди и щелочноземельные металлы сзади. А другие лепестки содержат прочие элементы, сгруппированные по их качествам.
Почему цветок точно сказать нельзя. Но это художник-химик, он так видит.
Радужная лента
Rezmason/Wikimedia/CC-BY-3.0
Она была создана Джеймсом Франклином Хайдом в 1975 году. Хайд был химиком по кремнийорганическим соединениям, поэтому он поставил кремний в центр (в бежевой секции в середине двух кругов), подчеркнув, как этот элемент связан со многими другими в таблице.
Перевод: Futurist
Таблица Менделеева – не единственная. Показываем все странные варианты | Futurist
19 апреля 2019, 13:40
Еще до Менделеева было несколько ученых, которые попробовали свои силы в организации 63 элементов, известных в то время. С тех пор было обнаружено в общей сложности 118 элементов, и предпринято много попыток перестроить их с помощью диаграмм, имеющих форму чего угодно, от странных улиток до объемных цветов.
Классическая периодическая таблица, которая есть на развороте каждого учебника химии, основана на том, что свойства веществ меняется в зависимости от их атомной массы. Но это не единственный признак, по которому вещества пытались упорядочивать. Вот некоторые самые интересные из вариантов.
Вот некоторые самые интересные из вариантов.
Башня
Эта таблица, разработанная в 2006 году Валерием Циммерманом, сильнее всех отличается от привычной нам формы. Вместо того, чтобы основываться на атомных номерах, эта периодическая таблица ADOMAH, систематизирована вокруг четырех квантовых чисел конфигурации электронов.
Спираль
Если последняя таблица была чисто функциональной, то основой этого варианта стал внешний вид и дизайн. Эта красота создана в 1964 году химиком Теодором Бенфеем. Она начинается в середине спирали водородом, закручивается наружу в порядке атомных номеров, а затем разветвляется на переходные металлы, лантаноиды, актиноиды и неизученные в настоящее время суперактиниды.
3D цветок
Чтобы разобраться в этом, надо приложить немного усилий. Здесь вообще нет водорода или гелия. Первая часть (или лепесток) бирюзового цвета содержит щелочные металлы спереди и щелочноземельные металлы сзади. А другие лепестки содержат прочие элементы, сгруппированные по их качествам.
А другие лепестки содержат прочие элементы, сгруппированные по их качествам.
Почему цветок точно сказать нельзя. Но это художник химик, он так видит.
Радужная лента
Она была создана Джеймсом Франклином Хайдом в 1975 году. Хайд был химиком по кремнийорганическим соединениям, поэтому он поставил кремний в центр (в бежевой секции в середине двух кругов), подчеркнув, как этот элемент связан со многими другими в таблице.
Читайте еще: Новая «таблица Менделеева». Только для технологий
Источник: Sciencealert.com
Понравилась статья?
Поделись с друзьями!
Поделиться 0 Поделиться 0 Твитнуть 0Подпишись на еженедельную рассылку
Разница между классической и современной формулировкой периодического закона Менделеева
Знаменитый русский ученый Дмитрий Иванович Менделеев еще в 19 веке сформулировал периодический закон, оказавший исключительно большое влияние на развитие физики, химии и науки в целом. Но с тех пор соответствующая концепция претерпела ряд изменений. В чем они заключаются?
Но с тех пор соответствующая концепция претерпела ряд изменений. В чем они заключаются?
Периодический закон Менделеева: первоначальная формулировка
В 1871 году Д. И. Менделеев предложил научному сообществу фундаментальную формулировку, по которой свойства простых тел, соединений элементов (равно как и их формы), как результат — и свойства тел, образуемых ими (простых и сложных), следует рассматривать как находящиеся в периодической зависимости от показателей их атомного веса.
Данная формулировка была опубликована в авторской статье Д. И. Менделеева «Периодическая законность химических элементов». Соответствующей публикации предшествовала большая работа ученого в области исследования физических и химических процессов. В 1869 году в российском научном сообществе появилась новость об открытии Д. И. Менделеевым Периодического закона химических элементов. Вскоре был издан учебник, в котором была обнародована одна из первых версий знаменитой Таблицы Менделеева.
С термином «периодический закон» Д. И. Менделеев первые ознакомил широкую публику в 1870 году, в одной из своих научных статей. В данном материале ученый указал на тот факт, что существуют еще не открытые химические элементы. Менделеев обосновывал это тем, что свойства каждого отдельного химического элемента промежуточны между характеристиками тех, что соседствуют с ним по периодической таблице. Причем как в группе, так и в периоде. То есть свойства элемента промежуточны между характеристиками элементов, располагающихся выше и ниже по таблице относительно него, а также находящихся правее и левее.
И. Менделеев первые ознакомил широкую публику в 1870 году, в одной из своих научных статей. В данном материале ученый указал на тот факт, что существуют еще не открытые химические элементы. Менделеев обосновывал это тем, что свойства каждого отдельного химического элемента промежуточны между характеристиками тех, что соседствуют с ним по периодической таблице. Причем как в группе, так и в периоде. То есть свойства элемента промежуточны между характеристиками элементов, располагающихся выше и ниже по таблице относительно него, а также находящихся правее и левее.
Таблица Менделеева стала уникальным результатом научных трудов. Кроме того, принципиальная новизна концепции Менделеева заключалась в том, что он, во-первых, разъяснил закономерности в соотношениях величин атомных масс химических элементов, а во-вторых, предложил сообществу исследователей рассматривать данные закономерности в качестве закона природы.
В течение нескольких лет после обнародования периодического закона Менделеева химические элементы, не известные на момент публикации соответствующей концепции, но предсказанные ученым, были открыты. В 1875 году был открыт галлий. В 1879-м — скандий, в 1886-м — германий. Периодический закон Менделеева стал неоспоримой теоретической основой химии.
В 1875 году был открыт галлий. В 1879-м — скандий, в 1886-м — германий. Периодический закон Менделеева стал неоспоримой теоретической основой химии.
Современная формулировка периодического закона
По мере развития химии и физики концепция Д. И. Менделеева развивалась. Так, в конце 19 — начале 20 века ученые смогли объяснить физический смысл того или иного атомного номера химического элемента. Позже исследователи разработали модель изменений электронной структуры атомов в корреляции с ростом зарядов ядер соответствующих атомов.
Сейчас формулировка периодического закона — с учетом вышеобозначенных и других открытий ученых — несколько отличается от предложенной Д. И. Менделеевым. В соответствии с ней свойства элементов, а также образуемых ими веществ (равно как и их формы) характеризуются периодической зависимостью от зарядов ядер атомов соответствующих элементов.
к содержанию ↑Сравнение
Главное отличие классической формулировки периодического закона Менделеева от современной заключается в том, что первоначальная трактовка соответствующего научного закона предполагает зависимость свойств элементов и образуемых ими соединений от показателей их атомного веса. Современная трактовка также предполагает наличие подобной зависимости — но предопределяемой зарядом ядер атомов химических элементов. Так или иначе, ко второй формулировке ученые пришли, в течение долгого времени развивая первую путем кропотливого труда.
Современная трактовка также предполагает наличие подобной зависимости — но предопределяемой зарядом ядер атомов химических элементов. Так или иначе, ко второй формулировке ученые пришли, в течение долгого времени развивая первую путем кропотливого труда.
Определив, в чем разница между классической и современной формулировкой периодического закона Менделеева, отразим выводы в таблице.
к содержанию ↑Таблица
| Формулировка периодического закона Менделеева | Современная формулировка периодического закона |
| Что общего между ними? | |
| Обе концепции предполагают периодическую зависимость свойств элементов и образуемых ими соединений от неких факторов | |
| В чем разница между ними? | |
| Д. И. Менделеев предложил формулировку, по которой свойства элементов имеют периодическую зависимость от показателей их атомного веса | Современные ученые применяют формулировку, по которой свойства элементов имеют периодическую зависимость от заряда ядер их атомов |
Читать онлайн «Естественная химия» – автор Владимир Кучин
Таблица Менделеева в графике КучинаВведение
Естественная (далее темпералогическая) химия — это философский раздел темпералогии — естественной философии Вселенной. Классическая химия изучает свойства веществ, их химические элементы, химические реакции и превращения без изменения т.н. атомарной структуры вещества. Предметом классической химии является задача ответить на вопросы: «что?», «как, каким образом?», «почему?». Химия за период своего развития образовала множество самостоятельных разделов: неорганическая химия, органическая химия, аналитическая химия, стереохимия, коллоидная химия, фотохимия, термохимия, физическая химия, биохимия, агрохимия, радиохимия, нефтехимия, квантовая химия. В смежных науках образовались свои «химии»: химия металлургии, минералогия и химия минералов, нефтехимия, химия полупроводников. В каждой новой науке образовывалась своя химия: радиационная химия, криогенная химия, химия плазмы, лазерная химия, генетическая химия (генная инженерия). Естественно будет создана или уже есть нанохимия. Химия превратилась в прикладную, и начинает терять свое фундаментальное значение.
Классическая химия изучает свойства веществ, их химические элементы, химические реакции и превращения без изменения т.н. атомарной структуры вещества. Предметом классической химии является задача ответить на вопросы: «что?», «как, каким образом?», «почему?». Химия за период своего развития образовала множество самостоятельных разделов: неорганическая химия, органическая химия, аналитическая химия, стереохимия, коллоидная химия, фотохимия, термохимия, физическая химия, биохимия, агрохимия, радиохимия, нефтехимия, квантовая химия. В смежных науках образовались свои «химии»: химия металлургии, минералогия и химия минералов, нефтехимия, химия полупроводников. В каждой новой науке образовывалась своя химия: радиационная химия, криогенная химия, химия плазмы, лазерная химия, генетическая химия (генная инженерия). Естественно будет создана или уже есть нанохимия. Химия превратилась в прикладную, и начинает терять свое фундаментальное значение.
Предлагаемые автором основы темпералогической химии служат целью вернуть химии ее основное значение и ответить на вопрос «зачем?». В частности вернуться к истокам в 1 марта 1869 года и ответить на вопрос: «зачем необходимо такое многообразие химических элементов и какие объединительные свойства питают это многообразие».
В частности вернуться к истокам в 1 марта 1869 года и ответить на вопрос: «зачем необходимо такое многообразие химических элементов и какие объединительные свойства питают это многообразие».
Задача автора в данной научно-популярной брошюре двойная, или бинарная:
— показать универсальность темпералогических методов в любой созданной науке, в данном случае в химии,
— показать величайшую роль и прозорливость Д. И. Менделеева, именно его первого варианта периодической системы химических элементов, который он называл «естественной системой», и предложить изображение таблицы в новой графике Кучина.
Для последующих выкладок нам необходимо вспомнить философские основы темпералогии. Этому отведена глава 1. Изложение материала начинается с главы 2.
Глава 1. Свойства вселенной, как базовые основы темпералогии
Осмысление свойств вселенной является для темпералогии базой для понимания всей системы взглядов этой философии.
Вселенная должна обладать, и обладает в представленной модели нижеследующими свойствами.
1.1. Транспарентность
Вселенная транспарентна — правила и свойства ее на всех важных уровнях и в группах влияния ее элементов близки, и не противоречат одно другому.
Осознав правила и законы на макроуровне можно их в большей степени распространять на близкие по влиянию уровни и микроуровни, а также мегауровни.
1.2. Стабильность
Вселенная на всех уровнях стабильна и имеет характеристики стабильной системы по Винеру.
Процессы, идущие во вселенной никогда не приводят к изменению свойств и характеристик вселенной.
Кажущиеся процессы деструкции имеют причину в обеспечении дальнейшей стабильности и имеют следствием эту стабильность.
Бывает, что осознать эту стабильность не так просто, или не хватает периода наблюдений, но это не может служить основанием в сомнениях в стабильности Вселенной как системы.
1.3. Преемственность
Элементы Вселенной преемственны, т.е. подчинены причинно-следственной связи и связи поколений элементов.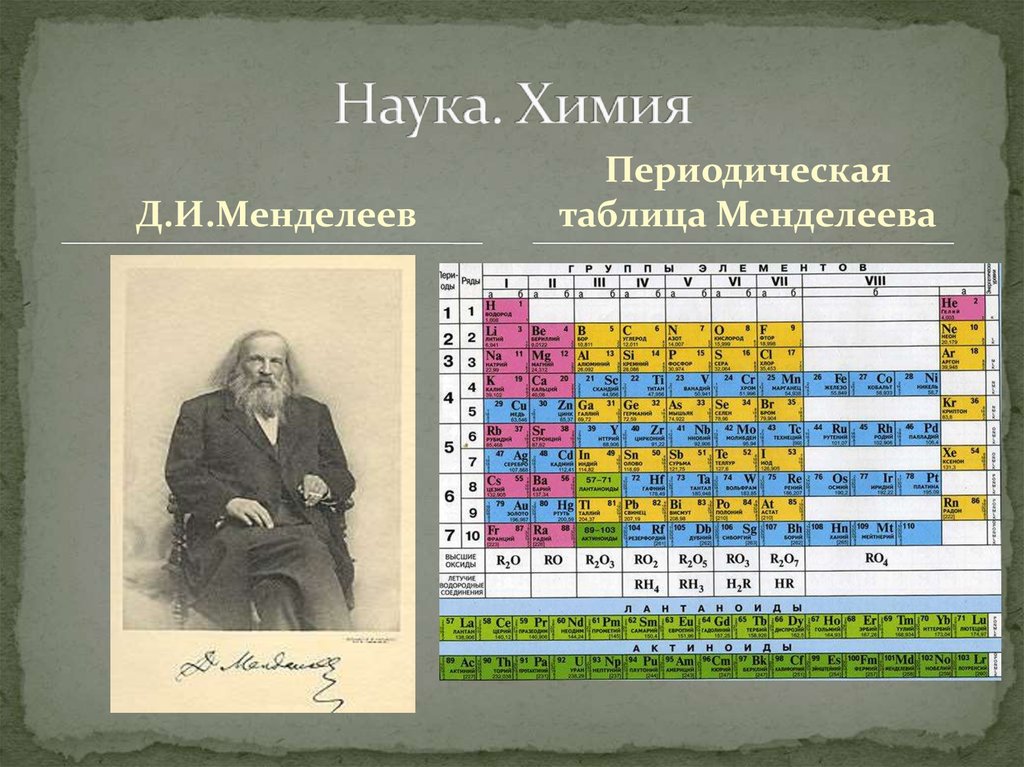
Процесс замены старых элементов новыми непрерывен и в той или иной степени разумен для поддержания свойств системы, в частности свойства стабильности.
Развитие в частности идет не от простого к сложному как считал Дарвин, а от менее стабильного к более стабильному.
1.4 Гармония
Вселенная гармонична, все ее элементы не противоречат одно другому, их взаимозависимость не искусственна, а естественна.
Свойства Вселенной дополняют одно другое и служат для выполнения функции Вселенной в целом.
1.5. Синхронность и бинарность
Вселенная, создаваемая полем S из потенции P и времени T синхронна во всех своих основных элементах.
Это означает цикличность процессов, и сохранение первичных возникших сдвигов фаз на протяжении всего времени существования данной Вселенной.
Бинарность, как самый простой вид синхронности, может быть присуща Вселенной наряду с синхронностью. Возможны наличия синхронности и бинарности одновременно.
1.6. Компактность и минимализм
Вселенная компактна — ее модель должна содержать все необходимые элементы в таком виде, который имеет минималистские свойства, не содержать лишних элементов, обеспечивать свойства гармонии и стабильности, встраиваться систему других вселенных, соблюдая свойства транспарентности и в системе других вселенных.
1.7. Центральность
Вселенная во всех своих проявлениях и уровнях должна поддерживать принцип центральности — выделения некоего центрального элемента, связи с ним других элементов, в данном случае периферийных, поддерживая при этом принцип компактности, минимализма, стабильности и транспарентности.
1.8. Темпералогические свойства
Пространство темпералогических явлений шестимерно, свойства явлений удовлетворяют сами себе и удобно использовать в работе их «карту» размещения
Карта темпералогических свойств.Глава 2. Темпералогические свойства периодической таблицы элементов
2.1. Классическая таблица
Как уже говорилось, автор твердо понимает, что 1 марта 1869 года Д.И.Менделеев обнародовал огромное достижение химии, а фактически темпералогической химии — таблицу элементов, «естественную таблицу элементов», «периодический закон химических элементов». Д. И. Менделеев менял названия и, наконец, мы знаем эту таблицу как «таблицу Менделеева».
Уже при жизни Менделеева его таблица подвергалась ревизии, многократно, да что там — сотни, раз доказывалась ее ошибочность, неточность, просто ложность и ненужность. Физики в квантовой модели строения атома ввели свои термины и законы: Бор, Паули, Дирак — часть этих терминов вписаны в клетки таблицы. Современная таблица многими авторами обзывается мнемонической схемой и лишается звания «система». Оспаривается исторический приоритет Менделеева, т.к. немец Л. Мейер в 1870 году опубликовал свою таблицу. Не смущает и то, что это было на год позже.
Что тут сказать?
Правильным и точным является вариант Д. И. Менделеева без всяких дописываний, раздвиганий в длинный и полудлинный вид, не нужны типы орбиталей, типы элементов d-элементы, f-элементы и т. д. Не нужен атомарный вес! Не нужна цветовая классификация (такая не нужна — правильная другая) на щелочные, щелочноземельные, переходные металлы, полуметаллы, легкие металлы, неметаллы, галогены, инертные газы.
Все это только закрывает главное: мы имеем восемь групп элементов и семь периодов элементов. Элементы расположены в группах по степени окисления, первая группа +1, восьмая группа +8. По мере роста номера элемента периодически повторяется смена степени окисления с +8 на +1 и образуется новый период. Всего насчитывается семь периодов.
Такая периодическая таблица элементов перед вами.
Классический вопрос недругов Менделеева: «а как же лантаноиды и актиноиды?».
Отвечаю, опережая события, — темпералогические свойства их периодов и группы таковы, что они образовали свои синхронные, компактные ряды.
Периодическая таблица элементов, стандартный вид
Элементарно! Вся таблица Менделеева у тебя дома
Это научно-детективная история, которая рассказывает как супер-научный детектив Шерлок Омс с помощниками Крысли и Шляпли, подозрительно похожими на крыс, ведут дело. Шерлок Омс предлагает читателю найти у себя дома и исследовать 118 подозреваемых, которые вписаны в таблицу Менделеева. Как вы догадались, это химические элементы.
Каждый элемент рассматривается в отдельности: перечисляются его свойства, особенности и список предметов, в которых присутствует это вещество. Большинство вещиц можно отыскать дома.
Для некоторых элементов есть примеры опытов. Не выходя из дома, ребенок сможет получить оксид алюминия, вскипятив кусочек фольги, замкнуть языком электрическую цепь из трех лимонных «батарей», поднять шнурком кубик льда из воды и очистить ржавую монету. Разумеется, под присмотром взрослых.
В книге вы найдете 10 страниц комиксов, посвященных открытию новых химических элементов и жизни великих химиков. Эти истории поданы с юмором, а потому отлично запоминаются.
В книге представлены последние научные сведения из области химии, в частности рассматриваются радиоактивные элементы до оганесона.
Фишки книги:
- книга раскрывает таблицу Менделеева, рассматривая отдельно каждый элемент;
- автор приводит примеры и показывает различные опыты;
- о жизни великих химиков в формате комикса;
- информация подана с юмором, что помогает ребенку легче усваивать материал;
- ваш ребенок удивит учителя химии своими знаниями.
Как читать эту книгу
— из книги узнаете, что такое химический элемент, вещество, смесь и соединение, как устроена Периодическая система, откуда взялись и из чего состоят элементы. Познакомитесь с каждым из них подробно;
— отдохнете, повеселитесь и узнаете интересные факты из истории химии, прочитав странички с комиксами;
— под присмотром и с разрешения родителей школьник может поставить тот или иной химический опыт, описанный в книге.
Для кого эта книга
Книга будет интересна детям в возрасте от 8 до 12 лет.
Фотогалерея
Об авторах
Майк Барфилд — писатель, поэт, карикатурист, аниматор, автор и исполнитель собственных песен с 25-летним стажем. Он работал на телевидении, радио, в книжных, газетных и журнальных издательствах, а также в школах, библиотеках, музеях, книжных магазинах и в саду позади дома Бернарда Шоу.
Периодическая система менделеева для егэ
Таблица Менделеева является фундаментом нашего современного знания о химии.
- Сколько элементов в таблице Менделеева?
- Классический вид периодической таблицы Менделеева
- Таблица Менделеева для ЕГЭ по химии
- Периодический закон Менделеева
Ответ: 118 или 126 элементов в зависимости от вида таблицы.
Почему такая разница?
В природе люди обнаружили 94 элемента. Другие 24 элемента были созданы в лабораториях. Всего получается 118 штук. Еще 8 элементов являются лишь гипотетическими вариантами.
Классический вид периодической таблицы Менделеева Таблица Менделеева для ЕГЭ по химииНиже приведена таблица, которую можно использовать на ЕГЭ по химии, входит в пакет разрешенных документов.
Периодический закон МенделееваСуществуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева:
«Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов».
Современная:
«Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)».
Таблица Менделеева является одним из величайших открытий человечества, позволившим упорядочить знания об окружающем мире и открыть новые химические элементы . Она является необходимой для школьников, а так же для всех, кто интересуется химией. Кроме того, данная схема является незаменимой и в других областях науки.
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера . Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной . В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон. Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы , обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах . Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы . А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии , необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы , чтобы на экзамене не столкнуться с некоторыми трудностями.
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом. Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы , отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Таблица растворимости солей, кислот и оснований – фундамент, без которого невозможно полноценное освоение химических знаний. Растворимость оснований и солей помогает в обучении не только школьникам, но и профессиональным людям. Создание многих продуктов жизнедеятельности не может обойтись без данных знаний.
Таблица растворимости кислот, солей и оснований в воде
Таблица растворимости солей и оснований в воде – это пособие, которое помогает в освоении химических основ. Разобраться с представленной ниже таблицей помогут следующие примечания.
- Р – указывает на растворимое вещество;
- Н – не растворимое вещество;
- М – вещество мало растворяется в водной среде;
- РК – вещество способно растворятся только при воздействии сильных органических кислот;
- Прочерк будет говорить о том, что такого существа не существует в природе;
- НК – не растворяется ни в кислотах, ни в воде;
- ? – вопросительный знак говорит о том, что на сегодняшний день нет точных сведений о растворении вещества.
Зачастую таблицу используют химики и школьники, студенты для проведения лабораторных исследований, в ходе которых необходимо установить условия протекания определённых реакций. По таблице получается обнаружить, как поведёт себя вещество в соляной или кислотной среде, возможно ли появление осадка. Осадок при проведении исследований и опытов говорит о необратимости реакции. Это существенный момент, который может повлиять на ходе всей лабораторной работы.
от классического дизайна для использования в массовой культуре
Периодическая таблица Менделеева – одно из тех классических изображений, которые можно найти во многих научных лабораториях и классах. Это изображение почти каждый видел когда-либо в своей жизни.
Вы также можете найти таблицу Менделеева на футболках, кружках, пляжных полотенцах, наволочках, пододеяльниках и многих других предметах. Он даже вдохновил меня на сборник рассказов.
Кто может забыть таблицу Менделеева, положенную на музыку американцем Томом Лерером, профессором математики из Гарварда, который также был певцом / автором песен и сатириком.Его песня The Elements включает в себя все элементы, которые были известны на момент написания в 1959 году.
С тех пор в периодическую таблицу Менделеева было добавлено несколько новых элементов, в том числе четыре, которые были официально одобрены в прошлом году Международным союзом чистой и прикладной химии (IUPAC).
Но что именно показывает таблица Менделеева?
Короче говоря, это попытка организовать совокупность элементов – всех известных чистых соединений, состоящих из одного типа атомов.
Есть два способа посмотреть, как устроена таблица Менделеева, основанная либо на наблюдаемых свойствах содержащихся в ней элементов, либо на субатомном строении атомов, образующих каждый элемент.
Основная современная таблица Менделеева. Shutterstock / duntaroЭлементы
Когда ученые начали собирать элементы в 1700-х и 1800-х годах, медленно выявляя новые в течение десятилетий исследований, они начали замечать закономерности и сходство в их физических свойствах.Некоторые были газами, некоторые – блестящими металлами, некоторые бурно реагировали с водой и так далее.
В то время, когда элементы были впервые открыты, структура атомов не была известна. Ученые начали искать способы систематизировать их, чтобы схожие свойства можно было сгруппировать вместе, точно так же, как кто-то, собирающий ракушки, может попытаться организовать их по форме или цвету.
Задача осложнялась тем, что не все элементы были известны. В результате оставались пробелы, из-за которых расшифровка шаблонов немного напоминала попытку собрать головоломку с недостающими частями.
Разные ученые придумали разные типы таблиц. Первую версию нынешней таблицы обычно приписывают русскому профессору химии Дмитрию Менделееву в 1869 году, а обновленная версия – в 1871 году.
Периодическая таблица Менделеева впервые опубликована за пределами России в Zeitschrift für Chemie (1869, страницы 405-6). Викимедиа / Дмитрий МенделеевВажно отметить, что Менделеев оставил пробелы в таблице, куда, по его мнению, следует поместить недостающие элементы.Со временем эти пробелы были заполнены, и появилась окончательная версия, которую мы знаем сегодня.
Атомы
Чтобы действительно понять окончательную структуру периодической таблицы, нам нужно немного понять об атомах и о том, как они устроены. У атомов есть центральное ядро (ядро), состоящее из более мелких частиц, называемых протонами и нейтронами.
Это число протонов, которое дает элементу его атомный номер – число, которое обычно находится в верхнем левом углу каждого прямоугольника в периодической таблице.
Свойства водорода указаны в периодической таблице. Shutterstock / duntaroТаблица Менделеева расположена в порядке возрастания атомных номеров (слева направо, сверху вниз). Он варьируется от элемента 1 (водород H) в верхнем левом углу до недавно утвержденного элемента 118 (oganesson Og) в правом нижнем углу.
Количество нейтронов в ядре может быть разным. Это дает начало различным изотопам для каждого элемента.
Например, вы, возможно, слышали о датировании по углероду-14 для определения возраста объектов.Этот изотоп представляет собой радиоактивную версию обычного углерода C (или углерода-12), который имеет два дополнительных нейтрона.
Но почему под основной таблицей находится отдельный блок элементов, и почему основная таблица имеет странную форму, с выступом наверху? Это сводится к тому, как устроен другой компонент атома – электроны.
Электроны
Мы склонны думать, что атомы устроены чем-то вроде луковицы, с семью слоями электронов, называемыми «оболочками», обозначенными K, L, M, N, O, P и Q, окружающими ядро ядра.
Представьте атом с центральным ядром, содержащим все протоны и нейтроны, окруженным серией оболочек, содержащих электроны. Разговор, CC BY-NDКаждая строка в периодической таблице как бы соответствует заполнению одной из этих оболочек электронами. У каждой оболочки есть подоболочки, и порядок, в котором они заполняются, зависит от требуемой энергии, хотя это сложный процесс. Мы вернемся к ним позже.
Проще говоря, первый элемент в каждой строке запускает новую оболочку, содержащую один электрон, в то время как последний элемент в каждой строке имеет две (или одну для первой строки) подоболочек во внешней оболочке, полностью занятых. Эти различия в электронах также объясняют некоторые сходства свойств между элементами.
С одной или двумя подоболочками во внешнем слое, заполненными электронами, последние элементы каждого ряда совершенно инертны, поскольку во внешней оболочке нет дыр или щелей для взаимодействия с другими атомами.
Вот почему элементы в последнем столбце, такие как гелий He, неон (Ne), аргон (Ar) и так далее, называются благородными газами (или инертными газами). Все они газы, и они «благородны», потому что редко связываются с другими элементами.
Напротив, элементы первого столбца, за исключением водорода (как и в грамматике английского языка, всегда есть исключения!), Называются щелочными металлами. Элементы первого столбца похожи на металл по своему характеру, но имея только один электрон во внешней оболочке, они очень реактивны, поскольку этот одинокий электрон очень легко задействовать в химической связи.При добавлении в воду они быстро реагируют с образованием щелочного (основного) раствора.
Каждая оболочка может вместить все большее количество электронов. Первая оболочка (K) подходит только для двух, поэтому в первой строке периодической таблицы всего два элемента: водород (H) с одним электроном и гелий (He) с двумя.
Вторая оболочка (L) вмещает восемь электронов. Таким образом, вторая строка периодической таблицы содержит восемь элементов с зазором между водородом и гелием для размещения дополнительных шести.
Третья оболочка (M) вмещает 18 электронов, но третий ряд по-прежнему содержит только восемь элементов. Это связано с тем, что дополнительные десять электронов не добавляются к этому слою до тех пор, пока первые два электрона не будут добавлены к четвертой оболочке (N) (почему мы узнаем позже).
Таким образом, зазор в четвертом ряду увеличен для размещения дополнительных десяти элементов, что приводит к «отрыву» от верхней части стола. Дополнительные десять соединений в средней части называются переходными металлами.
Четвертая оболочка содержит 32 электрона, но, опять же, дополнительные электроны не добавляются к этой оболочке до тех пор, пока некоторые из них также не будут добавлены к пятой (O) и шестой (P) оболочкам, что означает, что и четвертый, и пятый ряды содержат 18 элементов.
Для следующих двух строк (шестой и седьмой) вместо дальнейшего расширения таблицы в сторону для включения этих дополнительных 14 элементов, которые сделают ее слишком широкой, чтобы ее было легко читать, они были вставлены как блок из двух строк, называемый лантаноидами. (элементы с 57 по 71) и актиноиды (элементы с 89 по 103) под основной таблицей.
Таблица Менделеева выглядела бы иначе, если бы в нее были включены лантаноиды и актиноиды. Разговор, CC BYВы можете увидеть, где они могли бы поместиться, если бы периодическая таблица была расширена, если вы посмотрите на два нижних квадрата в третьем столбце таблицы выше.
По колоннам
Есть еще один усложняющий фактор, определяющий окончательную форму стола. Как упоминалось ранее, по мере того, как электроны добавляются к каждому слою, они переходят в разные подоболочки (или орбитали), которые описывают места вокруг ядра, где они с наибольшей вероятностью могут быть обнаружены.Они известны под буквами s, p, d и f.
Буквы, используемые для орбиталей, фактически получены из описаний излучения или поглощения света электронами, движущимися между орбиталями: s harp, p rincipal, d iffuse и f main.
Каждая оболочка имеет свою собственную конфигурацию подоболочек с именами от 1s до 7p, что дает общее количество электронов в каждой оболочке по мере продвижения по периодической таблице.
Разговор, CC BY-NDКак упоминалось ранее, порядок, в котором подоболочки заполняются электронами, не так прост. Вы можете увидеть порядок, в котором они заполняются, на изображении ниже, просто следуйте порядку, как вы читали бы слева направо.
Разговор, CC BY-SAСуществует интерактивная таблица Менделеева, которая также хорошо иллюстрирует последовательность заполнения, если вы щелкаете по атомам.
Элементы в столбце обычно имеют схожие свойства, но в некоторых местах элементы, расположенные рядом, также могут быть похожими. Например, в переходных металлах кластеры драгоценных металлов вокруг меди (Cu), серебра (Ag), золота (Au), палладия (Pd) и платины (Pt) очень похожи.
Большинство существующих элементов с высокими атомными номерами, включая четыре сверхтяжелых элемента, добавленные в прошлом году, очень нестабильны и никогда не были обнаружены в природе или изолированы от нее.
Вместо этого они создаются и анализируются в ничтожных количествах в сильно искусственных условиях. Теоретически могут быть и другие элементы, помимо известных сейчас 118 (есть дополнительные суборбитали g, h и i), но мы пока не знаем, будет ли какой-либо из них достаточно стабильным, чтобы быть изолированным.
Классический дизайн
Периодическая таблица Менделеева видела много красочных и информативных версий, созданных за эти годы.
Периодическая таблица украшает такси в Великобритании.Flickr / Отец Гаурав Шрофф, CC BY-NC-NDОдна из моих любимых – художественная версия с оригинальными произведениями искусства для каждого элемента, заказанная Королевским химическим институтом Австралии по случаю Международного года химии в 2011 году.
Другой фаворит – интерактивная версия с изображениями элементов. Создатели этого сайта также опубликовали журнальный столик под названием The Elements и приложение Apple с видеороликами о каждом элементе.
Интерактивные версиибыли также созданы Королевским химическим обществом (их также можно загрузить как приложение) и ChemEd DL среди других.
Классический дизайн таблицы Менделеева может быть использован в версии игры Морской бой.
Играем в боевые корабли с периодической таблицей на первом Всемирном научном фестивале в Брисбене в 2016 году. Разговор, CC BY-NC-NDСуществует также множество забавных версий, которые помогают упорядочить множество объектов, включая еду, пиво, смайлики, приложения для iPad и птиц.
Что касается The Elements Тома Лерера, песня еще не обновлена, чтобы включить все элементы, известные сегодня, но на протяжении многих лет на нее делали каверы.
Актер Дэниел Рэдклифф, известный как Гарри Поттер, исполнил версию во время выступления в качестве гостя на шоу Грэма Нортона BBC.
Существуют и другие музыкальные версии элементов, но они тоже еще не обновлены, чтобы включить все записи периодической таблицы.
Таким образом, периодическая таблица – это химическая систематика всех элементов. Его триумф в том, что он по-прежнему актуален для ученых, а также становится частью популярной культуры.
Почему некоторые элементы Периодической таблицы представлены буквами, которые не имеют четкой связи с их названиями?
Ответ
Некоторые элементы были известны в древности и поэтому имеют латинские названия.
Периодическая таблица. 2019. Фото Н. Ханачека. Национальный институт стандартов и технологий (NIST).
В периодической таблице одиннадцать элементов представлены буквами, не совпадающими с их названиями:
- Натрий (Na – Natrium)
- Калий (K – Kalium)
- Железо (Fe – Ferrum)
- Медь (Cu – Cuprum)
- Серебро (Ag – Argentum)
- Олово (Sn – Stannum)
- Сурьма (Sb – Stibium)
- Вольфрам (W – Wolfram)
- Золото (Au – Aurum)
- Ртуть (Hg – Hydragery )
- Свинец (Pb – Plumbum)
Почти все эти элементы были известны в древние времена и поэтому имеют латинские названия.Некоторые из названий также привели к другим словам, которые распространены в английском языке. Например, от слова «plumbum», что на латыни означает «свинец» (Pb), мы получили слова «сантехник» и «водопроводчик», потому что свинец веками использовался в водопроводных трубах.
Другие имена имеют разное происхождение. Например, гидраргирум, латинское название Меркурия (Hg), произошло от оригинального греческого слова гидраргирос, что означало «водное серебро». Также исторически известная как «ртуть», элементарная ртуть – это блестящий серебряный металл, который находится в жидком состоянии при комнатной температуре.
Таблица типов элементов и объяснение пластин, показывающих различные химические элементы и их атомный вес. Между 1808-1827 гг. В г. Новая система химической философии Джона Далтона. Отдел эстампов и фотографий, Библиотека Конгресса.Вольфрам получил символ W от немецкого названия Wolfram. Вольфрам происходит из вольфрамита, который был одной из руд, в которой чаще всего находили вольфрам. Само название Tungsten на самом деле шведское и переводится на английский как «тяжелый камень».
Слово «калий» происходит от английского «pot ash», которое использовалось для выделения солей калия. Мы получили K от названия калиум, данного немецким химиком Мартином Генрихом Клапротом, которое произошло от щелочи, происходящей от арабского al-qalyah, или «растительный пепел».
Этимология названий элементов может увести вас в фантастическое приключение, и вы можете быть удивлены тем, где вы оказались. В разделе для дальнейшего чтения можно найти книги по истории химических элементов.
Периодическая таблица элементов.PubChem, Национальная медицинская библиотека США (NLM), Национальный центр биотехнологической информации, Национальные институты здравоохранения.Опубликовано: 05.05.2020. Автор: Справочная секция по науке, Библиотека Конгресса
6.8: Блоки периодической таблицы
Многие любят музыку. Кому-то нравится классическая музыка, кому-то – джаз или кантри. Музыкальные стили меняются от одного периода к другому и от одного региона к другому. У каждого типа музыки есть свой язык, на котором он описывается.Классическая музыка имеет определенную структуру, стиль и содержание. Есть разные выражения классической музыки – симфония, концерт, соната. Джаз имеет иной набор характеристик, нежели классика и разные стили исполнения. Каждый тип музыки можно описать и сравнить с другими типами на основе определенных общих качеств, таких как ноты, аккорды и мелодические стили.
Элементы периодической таблицы можно считать подобными музыкальным жанрам. Каждый набор элементов имеет свой уникальный набор свойств, при этом разные наборы элементов имеют некоторые общие характеристики с точки зрения расположения электронов.Мы можем видеть образцы электронной структуры и реакционной способности в периодической таблице, которые позволяют нам лучше понять поведение отдельных элементов.
Периоды и блоки
В периодической таблице есть семь горизонтальных рядов, которые называются периодами и . Продолжительность каждого периода определяется количеством электронов, которые способны занимать подуровни , которые заполняются в течение этого периода, как показано в таблице ниже.
| Период | Количество элементов в периоде | Подуровни в порядке заполнения |
|---|---|---|
| 1 | 2 | \ (1с \) |
| 2 | 8 | \ (2с \) \ (2п \) |
| 3 | 8 | \ (3с \) \ (3п \) |
| 4 | 18 | \ (4s \) \ (3d \) \ (4p \) |
| 5 | 18 | \ (5s \) \ (4d \) \ (5p \) |
| 6 | 32 | \ (6s \) \ (4f \) \ (5d \) \ (6p \) |
| 7 | 32 | \ (7s \) \ (5f \) \ (6d \) \ (7s \) |
Напомним, что каждый из четырех разных подуровней состоит из разного количества орбиталей.Подуровень \ (s \) имеет одну орбиталь, подуровень \ (p \) имеет три орбитали, подуровень \ (d \) имеет пять орбиталей, а подуровень \ (f \) имеет семь орбиталей. В первом периоде заполняется только подуровень \ (1s \). Поскольку все орбитали могут содержать два электрона, весь первый период состоит всего из двух элементов. Во втором периоде заполняются подуровень \ (2s \) с двумя электронами и подуровень \ (2p \) с шестью электронами. Следовательно, второй период содержит восемь элементов. Третий период аналогичен второму, заполняя подуровни \ (3s \) и \ (3p \).Обратите внимание, что подуровень \ (3d \) фактически заполняется только после подуровня \ (4s \). Это приводит к четвертому периоду, содержащему 18 элементов из-за дополнительных 10 электронов, внесенных подуровнем \ (d \). Пятый период аналогичен четвертому. После заполнения подуровня \ (6s \) заполняется подуровень \ (4f \) с его 14 электронами. Далее следуют \ (5d \) и \ (6p \). Общее количество элементов в шестом периоде – 32. Более поздние элементы в седьмом периоде все еще создаются.2 \) часть конфигурации. Следовательно, никель можно найти в четвертом периоде таблицы Менделеева.
Основываясь на электронных конфигурациях, периодическая таблица может быть разделена на блоков , обозначающих, какой подуровень находится в процессе заполнения. Блоки \ (s \), \ (p \), \ (d \) и \ (f \) проиллюстрированы ниже.
Рисунок \ (\ PageIndex {1} \): Периодическая таблица, помеченная блоками подуровней.На рисунке также показано, как подуровень \ (d \) всегда на один главный уровень отстает от периода, в котором находится этот подуровень.Другими словами, в четвертый период заполняется подуровень \ (3d \). Подуровень \ (f \) всегда на два уровня позади. Подуровень \ (4f \) принадлежит шестому периоду.
Сводка
- Горизонтальные ряды таблицы Менделеева называются периодами.
- Длина периода зависит от того, сколько электронов необходимо, чтобы занять подуровни, заполняющие период.
- Блоки указывают, какой подуровень заполняется.
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
| GRAPHIC Скачать периодическую таблицу Менделеева Требуется СВЯЗАННЫЕ САЙТЫ НАИЛУЧШЕЕ ИЗОБРЕТЕНИЕ ЛУЧШАЯ ИСТОРИЯ СОДЕРЖАНИЕ Кредиты изображений | | Любовь одного мужчины к таблице Менделеева.
Когда я был мальчиком, говорили, что было 92 элемента, каждый со своими уникальными характеристиками.Эти элементы, которые могут сочетаться друг с другом, чтобы сформировать миллионы соединений были «строительными блоками вселенной». Кто-то знал или подозревал, что некоторые из них были родственниками. Например, олово и свинец – мягкие металлы, легко плавящиеся; медь, серебро и золото – металлы «чеканки» – все можно было превратить в фольгу настолько тонкую, что она пропускала зеленый или зеленый цвет. синий свет. Но я не уверен, что мне пришло в голову, что все элементы могут быть связаны друг с другом, пока я не пошел, в возрасте 12 лет, в Музей науки в Лондоне (недавно открывшийся после окончания Второй мировой войны) и там увидел огромный шкаф с надписью «Периодическая таблица» висит наверху лестницы. Просмотр стола с его реальными образцами элементов был одним из формирующих переживаний моего детства и показал мне с силой откровения красоту науки.Таблица Менделеева казалась такой простой и экономичной: все, вся 92-я степень, сведенная к двум осям, и все же вдоль каждой оси – упорядоченная последовательность различных свойств. Алхимические корни химии начались в 18 веке, отчасти с открытием новых элементов: между 1735 и 1826 годами не менее 40 были добавлены к 9 известным древним элементам (медь, серебро, золото, железо, ртуть и т. Д.). свинец, олово, сера и углерод) и немногие из них, открытые в средние века (мышьяк, сурьма и висмут).Открытие этих новых элементов заставило каждого химика задаться вопросом: сколько элементов там? Есть ли ограничение на их количество? Были ли они все как-то связаны? И если да, то как их можно классифицировать?
Некоторые признавали родство.Хлор, бром и йод – все цветные, летучие, очень активные – казались естественным семейством галогенов. Кальций, стронций и барий, щелочноземельные металлы, были другой семьей, потому что все они были легкими, мягкий, легко воспламеняется и сильно реагирует с водой. В 1817 году немецкий химик Иоганн Доберейнер заметил, что атомные веса щелочноземельных металлов образуют ряд, причем атомный вес стронция находится примерно посередине между атомными массами кальция и бария.Позже он обнаружил другие такие триады, как а также триады, в которых элементы имеют схожие свойства, но почти одинаковые атомные веса. Триады Доберейнера убедили многих химиков, что атомный вес должен представлять фундаментальную характеристику всех элементов. Но путаница в основах оставалась – о разнице между атомами и молекулами и об объединяющей способности, или валентность атомов.Как следствие, многие принятые атомные веса были неправильными. Сам Дальтон – создатель атомной гипотезы – предположил, например, что формулой воды является HO, а не h3O, давая ему атомную формулу. вес кислорода был только половиной правильного числа. В 1860 году первое международное собрание химиков было созвано в Карлсруэ, Германия, специально для того, чтобы прояснить эту путаницу.Здесь Станислао Канниццаро предложил надежный способ вычисления атомного веса по плотности пара, и его красиво аргументированная презентация продолжила день и привела к консенсусу: теперь, наконец, с исправленными атомными весами и ясным представлением о валентности, открылся путь для всеобъемлющей классификации элементов. Замечательным примером синхронности является то, что не менее шести таких классификаций, каждая из которых указывает на открытие периодичности, были независимо разработаны. в ближайшее десятилетие.Из них система Дмитрия Ивановича Менделеева была самой всеобъемлющей, а также самой смелой, поскольку она отваживалась делать подробные предсказания элементов, которые еще не были известны.
Менделеев (имя которого и дикое бородатое лицо были известны каждому школьнику моего времени) был фигурой героических размеров.Он был главным научным консультантом России и тесно сотрудничал с промышленностью и сельским хозяйством, от угля и масла до сыра и пиво. Он был автором самого восхитительного и яркого текста по химии, когда-либо опубликованного, «Принципы химии», и с 1854 года он размышлял о том, как можно классифицировать химические элементы. Со старыми атомными весами, существовавшими до Карлсруэ, можно было, как это сделал Доберейнер, получить представление о локальных триадах или группах.Но нелегко было увидеть численное соотношение между самими группами. Только когда Канниццаро показал, что надлежащие атомные веса для щелочноземельных металлов, кальция, стронция и бария были 40, 88 и 137, стало ясно, насколько они близки к атомным весам щелочных металлов, калия (39), рубидия (85) и цезия (133) . Это Именно эта близость и близость атомных весов галогенов – хлора, брома и йода – побудили Менделеева в 1868 году создать небольшую двумерную сетку, сопоставляющую три группы:
И именно в этот момент, видя, что расположение трех групп элементов в порядке атомного веса дает повторяющуюся структуру – галоген, за которым следует щелочной металл, за которым следует щелочноземельный металл – Менделеев почувствовал, что это должен быть фрагмент. из более крупной структуры и перескочил к идее периодичности, управляющей всеми элементами, периодическому закону. Первую небольшую таблицу Менделеева нужно было заполнить, а затем растянуть во всех направлениях, как будто заполняя кроссворд. Переходя от сознательного расчета к догадке, от интуиции к анализу, Менделеев за несколько недель пришел к табуляция 30 с лишним элементов в порядке возрастания атомного веса, таблица, которая предполагает, что для каждого восьмого элемента было повторение свойств. Говорят, что ночью 16 февраля 1869 года Менделееву приснился сон, в котором он увидел почти все 65 известных элементов, выстроенных на большом столе. На следующее утро он записал это на бумаге. Эта первая таблица должна была подвергнуться значительному пересмотру в течение следующих нескольких лет, но к 1871 году она приняла новую знакомую форму короткого прямоугольника с пересекающимися группами и точками. Именно этот стол я видел в Музее науки и на протяжении столетия можно было найти в каждом учебнике, лекционной аудитории и музее. Можно было читать таблицу вверх и вниз, переходя от одной группы к другой (каждая вертикальная группа представляла собой семейство элементов с аналогичная реакционная способность и валентность) – это то, что Доберейнер и химики до 1860 года сделали бы. Но можно было также читать его по горизонтали, чтобы прочувствовать каждый период, когда он проходил через восемь групп.Можно было увидеть способ, которым свойства элементов изменялись с каждым приращением атомного веса, пока внезапно период не подходил к концу, и мы оказывались в следующем периоде, где все элементы повторяли свойства тех выше. Именно это, прежде всего, давало почувствовать таинственную периодичность таблицы, реальность закрепленного в ней великого закона. у меня уже была небольшая лаборатория, в которой я провел много часов, и, должно быть, видел в книгах уменьшенные версии таблицы Менделеева.Но он видел огромное стол в музее, восхищенный, по-настоящему ассимилирующий его впервые, что перешло меня от случайного или энциклопедического подхода – сбора всех химических веществ, которые я мог, проведения всех экспериментов, которые я мог – к более систематическому один, исследуя тенденции элементов для себя.
В одном простом, очень драматичном (и немного опасном) эксперименте были помещены небольшие комочки щелочных металлов в воду и наблюдались, как их реакционная способность возрастает по мере увеличения их атомного веса.Пришлось делать это осторожно, щипцами, и снарядить себе и своим гостям в очках: литий будет плавно перемещаться по поверхности воды, реагируя с ней, выделяя водород, пока он не исчезнет; комок натрия будет двигаться по поверхности с гневным гудением, но не загорелся бы, если бы использовался небольшой кусок; калий, напротив, загорелся бы в тот момент, когда попал в воду, горел бледно-лиловым пламенем и разбрасывал повсюду свои глобулы; рубидий был еще более реактивным, Яростно вспыхивая красновато-фиолетовым пламенем, я обнаружил, что цезий взорвался при ударе о воду, разбив свой стеклянный сосуд.После этого никогда не забываешь о свойствах щелочных металлов. Таблица Менделеева на самом деле не сообщала о свойствах элементов, но, как семейное древо, она распределяла их по местам. Мне было интересно поработать в обратном направлении от этого, чтобы увидеть, как свойства элемента соответствуют его месту. Вольфрам, например, был фаворитом – ни один другой металл не имел такой высокой температуры плавления. Сначала я подумал, что это сделало его уникальным, но теперь я мог сравнить его с его соседями в периодической таблице и увидеть, что самые высокие температуры плавления металлов все были найдены в Группе VI и Периоде 6.Вольфрам в позиции VI: 6 лежал на пересечении двух горных хребтов, Эвереста среди других пиков, но это не аномалия. Я мог построить графики физических и химических свойств всех элементов в зависимости от их атомного веса и получить самые заманчивые графики. Если, например, построить график зависимости атомного объема от атомного веса, то получится кривая с множеством пиков с вершинами для легких металлов I группы – впадины для плотных металлов VIII группы.Казалось, что каждое свойство периодически менялось и было так или иначе связано с атомным весом. Но почему любой из элементов должен иметь те свойства, которые у них были, и почему такие свойства должны повторяться периодически с атомным весом, было для меня полной загадкой, как и для Менделеева. С 1869 по 1871 год Менделеев расширил таблицу, зайдя так далеко, что переставил элементы, которые не подходили, пересмотрел их принятые атомные веса, чтобы они подходили, что шокировало некоторых из его современников.Дальнейшие проблемы были представлены двумя группы элементов, переходные элементы (к ним относятся редкие металлы, такие как ванадий и платина, а также обычные, такие как железо и никель) и редкоземельные элементы. Ни то, ни другое, казалось, не вписывалось в аккуратные октавы более ранние периоды. Чтобы приспособить их, Менделеев и другие экспериментировали с новыми формами стола – спиралевидными, пирамидальными и т. Д., Что в некотором смысле придавало ему дополнительные размеры. Совершенно очевидно, что Менделеев зарезервировал несколько пустых мест в своей таблице для элементов, «пока неизвестных». Он утверждал, что экстраполяция свойств элементов выше и ниже (а также, в некоторой степени, из тех, в любую сторону), можно было бы сделать уверенный прогноз относительно того, на что будут похожи эти неизвестные элементы. Он сделал именно это, очень подробно предсказав новый элемент, который последует за алюминием в Группе III: это будет серебристый Металл, подумал он, с плотностью 6.0 и атомный вес 68. Четыре года спустя, в 1875 году, был обнаружен именно такой элемент: галлий. Он также с равной точностью предсказал существование скандия и германия, и эти тоже вскоре были обнаружены. Именно эта способность предсказывать элементы с такой детализацией ошеломила его коллег-химиков и убедила многих из них, что система Менделеева была не просто произвольным упорядочением элементов, но глубокое выражение реальности. Но Менделеев, как и все остальные, был удивлен открытием в 1890-х годах целого нового семейства элементов – инертных газов.Сначала он скептически относился к их существованию. (Сначала он думал, что аргон, обнаруженный первым, был просто более тяжелым форма азота.) Но с открытием гелия, неона, криптона, ксенона и, наконец, радона, стало ясно, что они образуют идеальную периодическую группу. Они были идентичны в своей неспособности образовывать соединения; у них была валентность, казалось, ноль. Итак, к восьми группам таблицы Менделеев добавил последнюю группу 0. При наличии инертных газов количество элементов в каждом периоде выделялось: 2 (водород и гелий) в первом периоде; По 8 во втором и третьем; 8 типовых плюс 10 переходных элементов, или по 18 каждого в четвертом и пятом периодах; 8 плюс 10 плюс 14 редкоземельных элементов, или 32, в шестом периоде.Это были магические числа – 2, 8, 8, 18, 18, 32. Но что они значили? А что, в более широком смысле, лежало в основе химических свойств? Менделеев постоянно возвращался к этим вопросам. Он жаждал новой «химической механики», сравнимой с классической механикой Ньютона. И все же возникает вопрос, что он мог подумать о реальной форме революции, которая произошла. после его смерти произошла революция, совершенно невообразимая с точки зрения классической механики. Новое понимание внутреннего строения атомов появилось в 1911 году, через четыре года после смерти Менделеева, когда Эрнест Резерфорд (бомбардировавший золотую фольгу альфа-частицами и обнаруживший, что очень редко одна из них отклоняется назад), сделал вывод, что атом должен иметь структуру, подобную миниатюрной солнечной системе, почти вся его масса сосредоточена в крошечном, очень плотном, положительно заряженном ядре, окруженном на больших расстояниях относительно невесомыми электронами.Но самой сутью атомов была их абсолютная стабильность. И такой атом, как атом Резерфорда, если бы он управлялся законами классической механики, не был бы стабильным; его электроны теряли бы энергию при движении по орбите, в конечном итоге погружаясь в ядро. Нильс Бор, работая с Резерфордом в 1912 году, хорошо осознавал это и необходимость радикально нового подхода. Это он обнаружил в квантовой теории, которая постулировала, что электромагнитная энергия – свет, излучение – не непрерывна, а излучается. или поглощается дискретными пакетами, или «квантами».”Бор поразительным скачком соединил эти концепции с моделью Резерфорда и с хорошо известной, но ранее необъяснимой природой оптических спектров – что эти были не только характерны для каждого элемента, но состояли из множества дискретных линий или частот. Все эти соображения сошлись воедино в атоме Бора, где предполагалось, что электроны занимают ряд орбит или «оболочек» с различными энергиями вокруг ядра.В отличие от классических орбит, которые распадаются, эти квантовые орбиты обладали устойчивостью это позволяло им сохранять себя потенциально вечно. (Но если атом был возбужден, некоторые из его электронов могли бы на некоторое время перейти на более высокие энергетические орбиты и, вернувшись в свое основное состояние, испустить квант энергии определенной частоты; именно это вызвало характерные линии в их спектрах.) Весной 1913 года Бор представил свою модель атома.Несколько месяцев спустя Генри Мозли обнаружил теснейшую взаимосвязь между порядком элементов и их рентгеновскими спектрами. Эти спектры можно сопоставить, подумал Мозли, с число положительных зарядов в ядре, и для этого использовался термин «атомный номер». В атомных числах не было пробелов, дробей или неправильностей, как в случае атомных весов. Это был атомный номер, а не атомный вес, который определил порядок элементов.И теперь Мозли мог с абсолютной уверенностью сказать, что между водородом и ураном было всего 92 элемента, в том числе полдюжины еще не открытых. (У трех из них был предсказан Менделеевым, хотя и смутно.) Модель Бора предполагала, что химические свойства каждого элемента, его положение в периодической таблице зависят от количества его электронов и того, как они организованы в последовательные оболочки.Валентность и химическая реакционная способность, определяющие Группы Менделеева коррелировали с числом валентных электронов во внешних оболочках: с максимумом в восемь электронов атом был химически инертен; при большем или меньшем, чем максимум, будет больше реактивный. Таким образом, галогены, у которых на внешних оболочках не хватает только одного электрона, стремились захватить восьмой электрон, в то время как щелочные металлы, имеющие только один электрон на своих внешних оболочках, стремились избавиться от него. стать стабильными по-своему. К этой базовой восьмерке в более поздние периоды были добавлены дополнительные оболочки: 10-электронные оболочки для переходных элементов и 14-электронные оболочки для редкоземельных элементов. Бор и Мозли предоставили впечатляющее подтверждение существования таблицы Менделеева, обосновав ее, как и надеялся Менделеев, в «невидимом мире химических атомов». Теперь стало ясно, что периодичность элементов проистекает из их электронной структуры.И таинственные числа, которые управляли периодической таблицей – 2, 8, 8, 18, 18, 32 – теперь можно было понимать как количество электронов, добавляемых за каждый период. Такая электронная таблица Менделеева в основном идентична таблице Менделеева, построенной почти полвека назад на чисто химических основаниях. Мозли и Бор работали изнутри, с невидимым миром химических атомов, а Менделеев и его современники работали извне, с видимыми и явными свойствами элементов – и все же они пришли к одной и той же точке.В этом и заключается прелесть таблицы Менделеева, в том, что она выглядит двояко, объединяя классическая химия и квантовая физика в магическом синтезе. Учитывая орбиты Бора с разными уровнями энергии, в принципе можно построить всю периодическую таблицу, добавляя электроны по одному, поднимаясь по ступеням атомной лестницы от гелия к урану. И именно благодаря такому наращиванию мы имеем смогли создать новые элементы, отсутствующие в природе, такие как 20 элементов (93-112), которые теперь следуют за ураном в периодической таблице, более тяжелые атомы, которые не отклоняются от закономерностей периодического закона.В принципе можно работать Из периодической таблицы до элемента 200 и выше и предсказать некоторые свойства таких элементов. (Эти прогнозы в основном теоретические, потому что высокорадиоактивные трансурановые элементы имеют тенденцию становиться все более и более нестабильными. За один раз можно создать только атом, и это может исчезнуть за несколько миллионных долей секунды.) * Но идея периодичности, похоже, не имеет видимых границ, и это, как и все подтверждения этот век, обрадовал бы Менделеева. Прошло более 50 лет с тех пор, как я впервые увидел таблицу Менделеева, и мой восторг от нее никогда не угасал. Это все еще икона химии, как это было уже 130 лет; он продолжает направлять химические исследования, предлагать новые синтезы, делать прогнозы свойств невиданных ранее материалов. Это чудесная карта всей географии стихий. Моя кухня оклеена периодическими таблицами любого размера и вида – продолговатыми, спиралевидными, пирамидальными, флюгерами – и на кухонном столе, очень любимым, – круглая таблица Менделеева из дерева, которую я могу вращать, как молитвенное колесо. .Ношу два крошечных периодические таблицы в моем кошельке – классическая менделеевская со старинными буквами и более современная, красивая цветная спираль, которая показывает элементы с их атомными номерами, как огромная туманность, кружащаяся над ураном. Кто знает, что такое бесконечность. |
С полувековой годовщиной, Таблица Менделеева! – Сеть блогов Scientific American
Научные теории с годами появляются и исчезают.Фактически, среди философов науки существует довольно пессимистический лозунг: «Все теории рождаются опровергнутыми», что означает, что рано или поздно все они заменяются. Поэтому может показаться неожиданностью, что периодическая таблица элементов, которой в 2019 году исполнилось 150 лет, просуществовала так долго. По общему признанию, технически это может не быть теорией как таковой, но периодическая таблица, тем не менее, служила научным организационным принципом огромной силы и влияния с тех пор, как она была впервые опубликована.
Таблица была составлена в 1869 году русским химиком Дмитрием Менделеевым, который понял, что свойства элементов, кажется, повторяются примерно после каждых восьми элементов, если они расположены в порядке возрастания их атомного веса. Литий, например, мягкий химически активный металл. То же самое и с натрием, который идет на восемь позиций позже в списке. И калий, еще восемь пятен спустя. Как и почти все научные открытия, другие ученые были близки к тому же открытию, но по тем или иным причинам они не получили большого признания.Самый первый намек на химическую периодичность был объявлен французским инженером Александром-Эмилем де Шанкуртуа, который также разработал трехмерную периодическую систему, которую он назвал теллурическим винтом.
Затем пришли два лондонских химика, Джон Ньюлендс и Уильям Одлинг, которые пришли к своим примитивным периодическим таблицам, работая совершенно независимо. В Соединенных Штатах датский эмигрант Густав Хинрихс также понял, что все элементы могут быть помещены в одну связную систему, как и немецкий химик Юлиус Лотар Мейер.Но ни один из этих ученых не был в состоянии сделать прогнозы относительно новых элементов, которые могут быть открыты, как это сделал Менделеев, или отстоять ценность периодической таблицы в той же степени, что и ему.
Портрет Дмитрия Ивановича Менделеева (1834 – 1907). Предоставлено: Getty Images. В 20-м веке физика, которая, по сути, объясняет всю химию, пережила крупную революцию. Ученые, включая Нильса Бора, Вольфганга Паули, Эрвина Шредингера и Вернера Гейзенберга, обнаружили, что в масштабе атома и составляющих его частиц законы обычной классической механики необходимо заменить новыми законами квантовой механики.Тем не менее, несмотря на то, что эта революционная теория стала основой для объяснения поведения атомов, составляющих различные элементы, таблица Менделеева оставалась неизменной.
Конечно, в таблице были некоторые изменения, хотя они были относительно незначительными и в некоторых случаях почти косметическими. Например, элементы больше не упорядочиваются в соответствии с атомным весом – суммой протонов и нейтронов в ядрах их атомов – а вместо этого в соответствии с возрастающими значениями атомного номера, который является суммой только протонов.Во-вторых, исходные таблицы с восемью столбцами в значительной степени уступили место более широким таблицам с 18 столбцами, которые более точно отражают взаимосвязь между элементами.
Одно из многих достоинств таблицы Менделеева состоит в том, что она способствует упрощению и согласованности мира химии и, более конкретно, элементов. Вместо того, чтобы изучать свойства 118 известных в настоящее время элементов, студент-химик или профессиональный химик может обойтись знанием типичных свойств всего лишь 10 из них.Химик должен знать свойства, которые типичны для элементов в группах 1 и 2, а также для групп с 13 по 18 включительно.
Кроме того, он / она должен ознакомиться с типичными свойствами элементов, которые попадают в центральный или d-блок периодической таблицы. Эти элементы состоят в основном из плотных металлов, которые способны образовывать различное количество связей в зависимости от конкретных соединений, в которых они находятся. Последний из 10 типичных элементов находится в странно выглядящем блоке, образующем сноску к основной части книги. таблица Менделеева.Эти элементы f-блока включают очень важные с коммерческой точки зрения редкоземельные элементы и обычно образуют три связи с другими элементами.
Один из первых успехов периодической таблицы Менделеева произошел вскоре после того, как она была впервые обнаружена. В дополнение к включению всех элементов, которые были известны в то время, Менделеев оставил несколько пустых мест в своей таблице, предсказывая, что будут обнаружены новые элементы, чтобы заполнить их, и изложив, какими будут их свойства. В частности, он предсказал существование четырех элементов.Примечательно, что три из этих элементов, впоследствии названные галлием, германием и скандием, были открыты в течение 15 лет после предсказаний Менделеева. Четвертый, ныне известный как технеций, был впервые синтезирован в 1937 году.
Эти предсказания сделали периодическую таблицу чрезвычайно полезным инструментом в дополнение к тому, что она могла объяснить свойства уже известных элементов. Прогнозирующая сила сохраняется по сей день и помогает объяснить непреходящую актуальность таблицы Менделеева.Например, в 1990-х годах было обнаружено, что соединение YBa 2 Cu 3 O 7 может вести себя как высокотемпературный сверхпроводник. Чтобы найти другие подобные материалы, ученым нужно было просто проконсультироваться с периодической таблицей, чтобы предсказать, что соединения, в которых иттрий заменен лантаном, также будут высокотемпературными сверхпроводниками. Это потому, что лантан находится на одно место ниже иттрия в периодической таблице. Вскоре было обнаружено, что аналогичные соединения, содержащие лантан, действительно являются сверхпроводниками и даже в большей степени, чем соединения, содержащие иттрий.
Химики также используют периодическую таблицу для предсказания существования еще неоткрытых элементов. Например, хотя элементы на самом высоком конце периодической таблицы очень нестабильны, исследователи давно подозревали, что может существовать так называемый «остров стабильности» с атомами еще большего числа. Эти прогнозы были сосредоточены на элементе 114, теперь известном как флеровий, созданном в российском реакторе в 1999 году, хотя его повышенная стабильность оказалась меньше, чем предполагалось вначале.Но поиски все еще продолжаются.
2019 год объявлен ЮНЕСКО Годом Периодической таблицы Менделеева. Непреходящая ценность этой чудесной научной иконы – хороший повод для всех нас поднять рюмку водки в честь человека, которого по праву считают ее первооткрывателем: Дмитрия Менделеева.
Блоки периодической таблицы
Цели обучения
- Определите блоки периодической таблицы.
- Определите блок, к которому принадлежит каждый элемент, по его электронной конфигурации.
Что делает эти музыкальные ноты уникальными?
Все мы любим какую-то музыку. Кому-то нравится классическая музыка, кому-то – джаз или кантри. Музыкальные стили меняются от одного периода к другому и от одного региона к другому. У каждого типа музыки есть свой язык, на котором он описывается. Классическая музыка имеет определенную структуру, стиль и содержание. Есть разные выражения классической музыки – симфония, концерт, соната. У нас есть балет и опера, а также хоровая музыка.Джаз имеет иной набор характеристик, нежели классика и разные стили исполнения. Каждый тип музыки можно описать и сравнить с другими типами на основе определенных общих качеств, таких как ноты, аккорды и мелодические стили.
Элементы периодической таблицы можно считать подобными музыкальным жанрам. Каждый набор элементов имеет свой уникальный набор свойств, при этом разные наборы элементов имеют некоторые общие характеристики с точки зрения расположения электронов.Мы можем видеть образцы электронной структуры и реакционной способности в периодической таблице, которые позволяют нам лучше понять поведение отдельных элементов.
Периоды и блоки
В периодической таблице есть семь горизонтальных рядов, которые называются периодами и . Продолжительность каждого периода определяется количеством электронов, которые способны занимать подуровни , которые заполняются в течение этого периода, как показано в таблице 1 .
| Период | Количество элементов за период | Подуровни в порядке заполнения |
| 1 | 2 | 1 с |
| 2 | 8 | 2 с 2 с |
| 3 | 8 | 3 с 3 с |
| 4 | 18 | 4 с 3 d 4 с |
| 5 | 18 | 5 с 4 d 5 с |
| 6 | 32 | 6 s 4 f 5 d 6 p |
| 7 | 32 | 7 с 5 с 6 с 7 с |
Напомним, что каждый из четырех разных подуровней состоит из разного количества орбиталей.Подуровень s имеет одну орбиталь, подуровень p имеет три орбитали, подуровень d имеет пять орбиталей, а подуровень f имеет семь орбиталей. В первом периоде заполняется только 1 подуровень s . Поскольку все орбитали могут содержать два электрона, весь первый период состоит всего из двух элементов. Во втором периоде заполняются подуровень 2 s с двумя электронами и подуровень 2 p с шестью электронами.Следовательно, второй период содержит восемь элементов. Третий период аналогичен второму, заполняя 3 подуровня s и 3 p . Обратите внимание, что подуровень 3 d фактически заполняется только после подуровня 4 s . Это приводит к четвертому периоду, содержащему 18 элементов из-за дополнительных 10 электронов, которые вносит подуровень d . Пятый период аналогичен четвертому. После заполнения подуровня 6 s заполняется подуровень 4 f с его 14 электронами.Далее следуют 5 d и 6 p . Общее количество элементов в шестом периоде – 32. Более поздние элементы в седьмом периоде все еще создаются. Таким образом, хотя в периоде может быть 32 элемента, текущее число немного меньше.
Период, которому принадлежит данный элемент, можно легко определить по его электронной конфигурации. Например, рассмотрим элемент никель (Ni). Его электронная конфигурация [Ar] 3 d 8 4 s 2 .Самый высокий занятый основной уровень энергии – четвертый, обозначенный цифрой 4 в части конфигурации 4 s 2 . Следовательно, никель можно найти в четвертом периоде таблицы Менделеева.
Основываясь на электронных конфигурациях, периодическая таблица может быть разделена на блоков , обозначающих, какой подуровень находится в процессе заполнения. Блоки s , p , d и f показаны ниже.
На рисунке также показано, как подуровень d всегда находится на один главный уровень позади периода, в котором находится этот подуровень. Другими словами, в четвертый период заполняется подуровень 3 d . Подуровень f всегда на два уровня позади. Подуровень 4 f относится к шестому периоду.
Сводка
- Горизонтальные ряды таблицы Менделеева называются периодами.
- Длина периода зависит от того, сколько электронов необходимо, чтобы занять подуровни, заполняющие период.
- Блоки указывают, какой подуровень заполняется.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://en.wikibooks.org/wiki/High_School_Chemistry/The_Periodic_Table_and_Electron_Configurations
- Сколько элементов во втором периоде? Четвертый? Шестой?
- Используйте периодическую таблицу, чтобы определить блок, в котором может быть найден каждый из этих элементов.
- рубидий
- гольмий
- палладий
- теллур
Обзор
- Как называются горизонтальные ряды периодической таблицы Менделеева?
- Какой подуровень заполняется в периоде 1?
- Какой подуровень заполняется в периоде 7?
- Как электронная конфигурация элемента дает информацию о периоде, в котором он находится?
- В каком блоке элементов заполняются подуровни d ?
Глоссарий
- b lock: Периодическая таблица Менделеева может быть разделена на блоки, обозначающие, какой подуровень находится в процессе заполнения.
- период: Каждая горизонтальная строка из семи строк периодической таблицы.
- подуровень: Электронные орбитали s, p, d или f.
Список литературы
- Пользователь: Szalax / Wikimedia Commons. Ноты .
- Кристофер Ауён и Джой Шэн. Таблица электронной конфигурации.
Что такое элемент? Что такое таблица Менделеева? И что квантовая механика вносит в этот вопрос?
Аллен, Л.К., Найт, Э. Т .: Проблема Лёвдина. Int. J. Quantum Chem. 90 , 80–88 (2000)
Артикул Google Scholar
Аткинс, П.В., Каес, Х .: Центральное место для водорода в периодической таблице. Chem. Int. 25 , 14 (2003)
Google Scholar
Бент, Х.А.: Новые идеи в химии из свежей энергии для периодического закона. AuthorHouse, Блумингтон, Индиана (2006)
Google Scholar
Бент, H.A., Weinhold, F.J .: Новости из периодической таблицы: Введение в символы периодичности, таблицы и модели для валентности более высокого порядка и донорно-акцепторного родства. Chem. Educ. 84 , 1145–1146 (2007)
Артикул Google Scholar
Чалмерс, А.Ф .: Бойль и истоки современной химии: Ньюман попробовал себя в огне. Stud. Hist. Филос. Sci. Часть А 41 , 1–10 (2010)
Статья Google Scholar
Чалмерс, А.F .: Понимание науки через ее историю: ответ Ньюману. Stud. Hist. Филос. Sci. 42 , 150–153 (2011)
Артикул Google Scholar
Кронин, М. У .: Подходящее место для водорода в периодической таблице. J. Chem. Educ. 80 , 947–951 (2003)
Артикул Google Scholar
Дэш, Х.Х .: Постоянные энергетические различия в атомной структуре.Природа 198 , 25–26 (1963)
Артикул Google Scholar
Дэш, Х.Х .: Положение водорода в периодической системе элементов. Природа 202 , 1001–1003 (1964)
Артикул Google Scholar
Эрли Дж .: Почему в море нет соли. Нашел. Chem. 7 , 85–102 (2005)
Артикул Google Scholar
Хендри Р.Ф .: Лавуазье и Менделеев о стихиях. Нашел. Chem. 7 , 31–48 (2005)
Статья Google Scholar
Хендри Р.Ф .: Существенная путаница. Stud. Hist. Филос. Sci. 37 , 322–336 (2006).
Хендри Р.Ф .: Онтологическая редукция и молекулярная структура. Stud. Hist. Филос. Мод. Phys. 41 , 183–191 (2010)
Статья Google Scholar
Дженсен, В.Б .: Положение лантана (актиний) и лютеция (лоуренсий) в периодической таблице. J. Chem. Educ. 59 , 634–636 (1982)
Артикул Google Scholar
Ньюман У.Р .: Как не интегрировать историю и философию науки: ответ Чалмерсу. Stud. Hist. Филос. Sci. Часть А 41 , 203–213 (2010)
Статья Google Scholar
Островки В.Н .: Как и что физика способствует пониманию периодической таблицы Менделеева? Нашел. Chem. 3 , 145–182 (2001)
Google Scholar
Панет Ф.А.: Эпистемологический статус химической концепции элемента. Брит. J. Philos. Sci. 13 , 1 и 144 (1962) [перепечатано в Found. Chem. 5 , 113 (2003)]
Панет, Ф.А.: Химические элементы и изначальное вещество: взгляд Менделеева и нынешнее положение.В: Дингл, Х., Мартин, Г. (ред.) Химия и не только, стр. 53–72. Уайли, Нью-Йорк (1965)
Google Scholar
Рестрепо Г., Пачон, Л .: Математические аспекты периодического закона. Нашел. Chem. 9 , 189–214 (2007)
Google Scholar
Рутенберг, К .: Панет, Кант и философия химии. Нашел. Chem. 11 , 79–91 (2009)
Google Scholar
Sacks, L.Дж .: Относительно положения водорода в периодической таблице. Нашел. Chem. 8 , 31–35 (2006)
Google Scholar
Скерри, Э.Р .: Как Ab initio является ab initio квантовой химией? Нашел. Chem. 6 , 93–116 (2004)
Google Scholar
Шерри, Э.Р .: Некоторые аспекты метафизики химии и природы элементов. Хайл 11 , 127–145 (2005)
Google Scholar
Scerri, E.Р .: Комментарий к ответу Allen & Kinght на вызов Лёвдина. Нашел. Chem. 8 , 285–292 (2006)
Google Scholar
Шерри, Э.Р .: Периодическая таблица Менделеева, ее история и ее значение. Oxford University Press, Нью-Йорк (2007)
Google Scholar
Шерри, Э.Р .: Сборник статей по философии химии. Imperial College Press, Лондон (2008)
Google Scholar
Scerri, E.Р .: Двойной смысл термина «элемент» – это попытка вывести правило Маделунга и оптимальную форму периодической таблицы, если таковая имеется. Int. J. Quantum Chem. 109 , 959–971 (2009)
Google Scholar
Scerri, E.R .: от редакции 37. Found Chem. 13 , 1–7 (2011)
Статья Google Scholar
Скерри, Э.Р .: Нисходящая причинно-следственная связь в отношении химического и физического взаимодействия.В: Д. Ноубл, Т. О’Коннор, Труды конференции фонда Темплтона по возникновению и нисходящей причинно-следственной связи (2012)
Шварц, W.H.E .: Полная история электронных конфигураций переходных элементов. J. Chem. Educ. 87 , 444–448 (2010)
Статья Google Scholar
Снит, P.H.A., Сокал, Р.Р .: Числовая таксономия, принципы и практика числовой классификации. W.H.Фриман, Сан-Франциско (1973)
Google Scholar
Снит, P.H.A .: Числовая классификация элементов и ее связь с периодической системой. Нашел. Chem. 2 , 237–263 (2000)
Артикул Google Scholar
Вихаллем, Р .: Химическая автономия: старые и новые проблемы. Нашел. Chem. 13 , 97–107 (2011)
Google Scholar
