Кобальт электронное строение – Справочник химика 21
В табл. 53 показано электронное строение атомов железа, кобальта и никеля. [c.473]Электронное строение атомов в основном состоянии 15 2з-2р 35 3р Зё А5 . Наиболее устойчивой является степень окисления +2, в некоторых соединениях, особенно в комплексных, кобальт проявляет степень окисления +3 п +4. [c.67]
Е.6. Электронное строение комплексов кобальта(1П) [c.291]
Электронное строение атомов (и ионов) элементов триады железа таково, что оно обусловливает ярко выраженные магнитные свойства как простых соединений (металлы), так и большинства сложных соединений. Действительно, число неспаренных электронов в невозбужденных атомах Ре, Со, N1 велико. Для железа оно равно четырем, для кобальта — трем, для никеля — двум. Недостроенный З -подуровень и неспаренные электроны у Ре, Со, N1 являются причиной и другого, [c.114]
Часто говорят, что у кобальта и никеля имеется по два валентных электрона.

Е.4. Электронное строение, спектры и магнитные свойства комплексов кобальта(И) [c.285]
Строение электронных уровней атомов этих элементов характеризуется почти полной достройкой -подуровня предпоследнего уровня шесть —у железа, семь — у кобальта и восемь — у никеля. Заполнение -подуровня у атомов этих элементов сказывается на уменьшении окислительного числа, поскольку на /-подуровне содержится меньшее число непарных электронов (см. Курс химии, ч. 1. Общетеоретическая, гл. 11, стр. 86). Поэтому если марганцу свойственно еще окислительное число +7. то атом железа может отдавать не более 6 электронов и, следовательно, его окислительное число не может быть больше +6. Окислительное число кобальта не можег быть больше +5, а никеля -1-4. Таким образом, у атомов этих элементов уже нельзя считать все электроны незаполненных уровней валентными. Одновременно с повышением устойчивости почти зг(полненного /-подуровня снижается склонность этих элементов к металлообразным соединениям с электронной проводимостью.
Электронное строение атома кобальта [od As ) в еще большей мере (чем у железа) способствует стабилизации степени окисления + 2 (см. табл. 1.16). Для пары Со (П)/Со (1П) величина о составляет —1,84 В, т. е. Со (П1) проявляет свойства сильного окислителя, поэтому его производные в обычных условиях (например, ионы Со + в водных растворах) неустойчивы. Более высокие степени окисления для кобальта совсем не характерны, хотя в жестких условиях отдельные соединения o(IV), например Мг СоРе, получены [5]. На неустойчивости более высоких, чем +3, степеней окисления сказывается большая завершенность З -подуровня, чем у железа.
Строение электронных уровней атомов железа, кобальта и никеля характеризуется почти полной достройкой -подуровня предпоследнего электронного уровня шесть электронов — у железа, семь—у кобальта и восемь — у никеля. Заполнение -подуровня у атомов этих элементов сказывается на уменьшении окислительного числа, поскольку на -подуровне содержится меньшее число непарных электронов.
Свойства никеля и его соединений. Никель — элемент VIII группы Периодической системы Д, И. Менделеева, входит наряду с железом и кобальтом в первую триаду элементов этой группы. Электронное строение атомов в основном состоянии — s 2s2p )s 3p 3d 4s-. Устойчивой является степень окисления +2, но в комплексных соединениях проявляется степень окисления +3 и +4,  76]
76]
Для электронного строения никеля (З Чх ) характерна близость к завершению З -подуровня, Это делает Зй-подуровень никеля (3 ) более стабильным, чем в случае кобальта (Зй ) н особенно железа (3 ), Поэтому, хотя переход Ni°/Ni + характеризуется величиной о= + 0,23 В, близкой к таковой для кобальта ( о=+0,277 В), величина Ео для перехода N +/N 3+ еще выше (—2,1 В), чем у кобальта (—1,84 В), Поэтому трехвалентное состояние иикеля маловероятно N1 (III) должен проявлять свойства сильнейшего окислителя и стабилизация его является трудной задачей. [c.144]
Никель имеет электронную конфигурацию dV и проявляет наиболее устойчивую валентность 2-Ь. В металлическом состоянии никель, судя по его термодинамическим характеристикам, близок к железу и кобальту, а следовательно, также двухкратно ионизирован (электронная концентрация 2 эл1атом). Два его внешних электрона переходят в электронный газ, а два d-электрона, по-видимому, возбуждаются на -уровень, что приводит к сферической симметрии внешней оболочки и к плотной кубической структуре, сохраняющейся вплоть до плавления.

Кроме железа — родоначальника триады — в нее входят кобальт и никель. Как уже указывалось (см. табл. 1.15), наружные электронные оболочки изолированных атомов Ре, Со, N1 имеют одинаковое строение (45 ), а размеры атомов в ряду Ре—Со—N1 несколько сокращаются по мере заполнения электронами З -подуровня. Это явление характерно для всех участников периодической системы, где возрастает заряд ядра, а главное и побочное квантовые числа валентных электронов не меняются. Так как внешняя электронная оболочка (4б-2) в ряду Ре—Со—N1 неизменна, находящиеся на ней электроны все в большей степени притягиваются к атомному ядру по мере роста ь нем числа протонов, что приводит к уменьшению радиуса атомов и ионов, несмотря на увеличение общего числа электронов.
Известны также карбонильные и цианидные комплексы кобальта, в которых он проявляет неустойчивые низкие степени окисления Со(СО)4 (степень окисления —1), K4[ o( N)4] (нулевая степень окисления). Говоря о химии кобальта, нельзя не упомянуть связанной с его электронным строением уникальной склонности к комплексообразованию. [c.136]
Говоря о химии кобальта, нельзя не упомянуть связанной с его электронным строением уникальной склонности к комплексообразованию. [c.136]
Следует отметить, что природа проводимости окислов р-типа (NiO, СоО и МпО) и п-типа (МпО) достаточно подробно рассмотрена Босманом и Ван-Даалом [195] (см. также гл. IV), а электронное строение определено рентгенографическим исследованием [196]. Окись магния обладает при повышенных температурах смешанной проводимостью [197] т. е, как ионной, так и электронной одновременно, тогда как закиси железа, кобальта, никеля и марганца — типичные полупроводники.
При рассмотрепии кобальта с порядковым числом 27 становится очевидным, что образование, подобное строению благородного газа, в этом случае маловероятно, так как трудно предположить, чтобы этот металл при соединении только лишь с окисыо углерода был насыщенным в своей внешней оболочке. Оп обязательно будет иметь слишком мало пли слишком много электронов.
Можно полагать, что все металлы подгрупп скандия, титана, ванадия, хрома, а также марганец, имеющие при высоких температурах ОЦК структуру и переходящие в жидкое состояние без изменения ближнего порядка и с увеличением объема, будут обнаруживать повышение температуры плавления с возрастанием давления. Экспериментально это подтверждено для железа, родия, никеля и платины до давлений 60 кбар (см. рис. 123). Отсутствие признаков изменения электронного строения и увеличение объема при плавлении кобальта, технеция, рения и металлов платиновой группы с плотными упаковками дают основание полагать, что при повышении давления их температура плавления также возрастает.
В этом плане в нашей лаборатории изучается связь между активностью и электронным строением катализаторов металлов и сплавов, осажденных и плавленых железных промоти-рованных контактов. Наблюдается параллелизм, определенная корреляция между активностью и количеством неспаренных электронов в -зоне и контактной разностью потенциалов железа, кобальта, никеля и их сплавов при протекании реакции разложения аммиака [47]. Изучается действие ионизирующего излучения на формирование активных катализаторов, а также на протекание каталитического синтеза аммиака.
Наблюдается параллелизм, определенная корреляция между активностью и количеством неспаренных электронов в -зоне и контактной разностью потенциалов железа, кобальта, никеля и их сплавов при протекании реакции разложения аммиака [47]. Изучается действие ионизирующего излучения на формирование активных катализаторов, а также на протекание каталитического синтеза аммиака.
Общая характеристика переходных элементов. Особенности переходных элементов определяются, прежде всего, электронным строением их атомов, во внешнем электронном слое которых содержатся, как правило, два 5-электрона (иногда — один -электрон ). Невысокие значения энергии ионизации этих атомов указывают на сравнительно слабую связь внешних электронов с ядром так, для ванадия, хрома, марганца, железа, кобальта энергии ионизации составляет соответственно 6,74 6,76 7,43 7,90 и 7,86 эВ. Именно поэтому переходные элементы в образуемых ими соединениях имеют положительную окисленность и выступают в качестве характерных металлов, проявляя тем самым сходство с металлами главных подгрупп. [c.646]
[c.646]
При образовании стабильных карбонилов металлов они приобретают электронную оболочку благородного газа, для чего требуется 12 электронов для металлов VI группы, 11 для металлов VII группы и 10 для металлов VIII группы. Поэтому карбонилы Ш и Мо взаимодействуют с 12 я-электронами шести групп СО и образуют октаэдрические молекулы [46]. Карбонил Ке присоединяет 5 групп СО (10 электронов) и образует двуядерный карбонил за счет связи Не—Ке. Молекулу этого карбонила можно построить из двух октаэдров, в каждом из которых в центральном положении находится один атом металла, пять вершин заняты группами СО, а шестая — вторым атомом металла. Молекула карбонила железа с пятью группами СО имеет строение тетрагональной пирамиды. Но известно, что пять эквивалентных гибриди-зованных связей не образуется, юэтому одна из связей Ре—С ослаблена, что подтверждается измерениями дипольного момента. В карбониле кобальта также одна из связей (Со—Со) отлична от других (Со—С). [c. 110]
110]
Строение молекулы октакарбонила можно объяснить следующим образом. В ней атомы Со образуют по шесть ст-связей. Четыре связи обязаны донорно-акцепторному взаимодействию электронных пар четырех молекул СО и свободных орбиталей Со. Пятая связь образуется при участии одной -электронной пары атома Со и свободной я-орбита-ли молекулы СО. Связь Со—Со образуется за счет непарных электронов двух атомов кобальта. Стабилизация молекулы достигается за счет я-связей, на образование которых используются Зс( -электроны атома кобальта. [c.635]
Относительно электронного строения тетракарбонилгидри-да кобальта справедливо все то, что сообщалось относитель- [c.122]
С точки зрения электрохимии полупроводников у окисных соединений, принадлежащих к полупроводникам р-типа, в частности закиси-окиси кобальта, СодО , можно ождать, при благоприятных условиятных,относительно высокую злектрокаталитическую активность в анодных процессах. Однако практическая реализации анодных реакций со значительными скоростями с участием основных носителей гока – дырок СодО – зависит от ряда факторов, а которым в первую очередь можно отнести электрофизические характеристики (электропроводность), степень и характер нарушения стехиометрии, электронное строение приповерхностного слоя электрода, его адсорбционную способность и т. д. [c.18]
д. [c.18]
Исходя из имеющихся литературных данных и накопленных экспериментальных материалов в области электроосаждения сплавов было предпринято исследование в целях разработки технологии гальванопластического получения изделий различной формы из никелькобальтовых сплавов. Электрохимические (равновесные) потенциалы никеля и кобальта достаточно близки, так же как и их электронное строение и физико-химические свойства. Так, по данным Глестона [2], при температуре 15° потенциал выделения кобальта равен минус 0,56 в, а потенциал выделения никеля — минус 0,57 в. Катодная поляризация кобальта несколько меньше катодной поляризации никеля. Это дает основание рассчитывать на возможность электроосаждения никелькобальтовых сплавов заданного состава путем изменения концентрации солей никеля и кобальта в электролите, [c.142]
Известно два соединения [(ЫНз)5Со02Со(К Нз)б](НОз)4 и [(NHз)5 o02 o(NHз)5](NOз)5, из которых первое неустойчиво, а второе стабильно, хотя в соответствии с формулой должно содержать кобальт в необычном для него состоянии окисления.
 Для объяснения устойчивости второго соединения было проведено измерение его магнитной восприимчивости. Оказалось, что осуществляется следующее строение электронных оболочек центральных ионов кобальта из девяти 1-, 8-, /)-ячеек каждого атома Со две заняты спаренными электронами Со, пять — акцепторными связями с МНз. У двух атомов Со остаются четыре ячейки с четырьмя электронами и группа О с тремя электронами, участвующими в образовании валентных связей (один неспаренный валентный электрон и пара электронов у отрицательно заряженного атома кислорода). Неспаренный электрон может дать одну ковалентную связь с одним из электронов кобальта, а электронная пара — донорную связь со свободной орбитой Со. В результате семь электронов двигаются в поле четырех центров, причем у двух из этих центров (у кобальта) имеются по две орбиты. [c.345]
Для объяснения устойчивости второго соединения было проведено измерение его магнитной восприимчивости. Оказалось, что осуществляется следующее строение электронных оболочек центральных ионов кобальта из девяти 1-, 8-, /)-ячеек каждого атома Со две заняты спаренными электронами Со, пять — акцепторными связями с МНз. У двух атомов Со остаются четыре ячейки с четырьмя электронами и группа О с тремя электронами, участвующими в образовании валентных связей (один неспаренный валентный электрон и пара электронов у отрицательно заряженного атома кислорода). Неспаренный электрон может дать одну ковалентную связь с одним из электронов кобальта, а электронная пара — донорную связь со свободной орбитой Со. В результате семь электронов двигаются в поле четырех центров, причем у двух из этих центров (у кобальта) имеются по две орбиты. [c.345] Однако двухвалентная медь (в виде ацетата), двухвалентная платина (в виде зтилендихлорида), а также кобальт с нулевой валентностью (в виде карбонила), несмотря на то, что они не обладают подобным строением внешней электронной оболочки, также являются эффективными гомогенными катализаторами активации водорода. Поэтому в настоящее время не представляется возможным ни дать простое обобщение электронных свойств [c.215]
Поэтому в настоящее время не представляется возможным ни дать простое обобщение электронных свойств [c.215]
Если считать критерием для размещения элемента в периодической системе величину его атомной массы (атомного веса но Менделееву), следует вместо последовательности Ре—Со—N1 принять другую Ре—N1—Со, т. е. никель должен предшествовать кобальту в периодической системе. Однако, несмотря на то, что Менделеев в качестве основного параметра, определяющего последовательность расположения элементов в периодической системе, принял величину атомной массы, он, будучи блестящим химиком, счел неиравильным подчинение формальному критерию и разместил Ре, Со, N1 так, как этого требовала последовательность изменения химических свойств соответствующих однотипных соединений в триаде железа. Таким образом, Менделеев фактически размещал элементы в периодической системе в соответствии с химическими свойствами их соединений, т. е. в конечном счете, как нам теперь понятно, 1в соответствии ео строением их электронных оболочек. В частности, у элементов триады железа Менделеев учитывал большую склонность Ре к переходу в трехвалентное состояние и все уменьшающуюся устойчивость соединений со степенью окисления + 3 к кобальту и затем к никелю. [c.114]
В частности, у элементов триады железа Менделеев учитывал большую склонность Ре к переходу в трехвалентное состояние и все уменьшающуюся устойчивость соединений со степенью окисления + 3 к кобальту и затем к никелю. [c.114]
Кобальт атом, электронное строение – Справочник химика 21
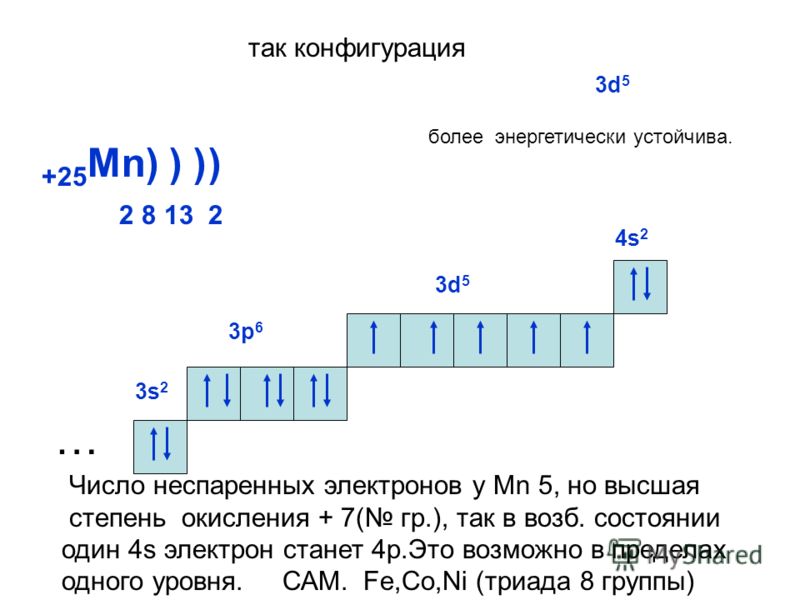
Строение электронных уровней атомов этих элементов характеризуется почти полной достройкой -подуровня предпоследнего уровня шесть —у железа, семь — у кобальта и восемь — у никеля. Заполнение -подуровня у атомов этих элементов сказывается на уменьшении окислительного числа, поскольку на /-подуровне содержится меньшее число непарных электронов (см. Курс химии, ч. 1. Общетеоретическая, гл. 11, стр. 86). Поэтому если марганцу свойственно еще окислительное число +7. то атом железа может отдавать не более 6 электронов и, следовательно, его окислительное число не может быть больше +6. Окислительное число кобальта не можег быть больше +5, а никеля -1-4. Таким образом, у атомов этих элементов уже нельзя считать все электроны незаполненных уровней валентными. Одновременно с повышением устойчивости почти зг(полненного /-подуровня снижается склонность этих элементов к металлообразным соединениям с электронной проводимостью. [c.126]
Одновременно с повышением устойчивости почти зг(полненного /-подуровня снижается склонность этих элементов к металлообразным соединениям с электронной проводимостью. [c.126]
Строение электронных уровней атомов железа, кобальта и никеля характеризуется почти полной достройкой -подуровня предпоследнего электронного уровня шесть электронов — у железа, семь—у кобальта и восемь — у никеля. Заполнение -подуровня у атомов этих элементов сказывается на уменьшении окислительного числа, поскольку на -подуровне содержится меньшее число непарных электронов. Поэтому если марганцу свойственна еще степень окисления 4-7, то атом железа может отдавать не более шести электронов и, следовательно, его степень окисления не может быть больше 4-6. Окислительное число кобальта не может быть больше 4-5, а никеля 4-4, Таким образом, у атомов этих элементов нельзя считать все электроны незаполненных уровней валентными. Одновременно с повышением устойчивости почти заполненного -подуровня снижается склонность этих элементов к образованию металлоподобных соединений с электронной проводимостью.
 Электрической проводимостью такого типа обладают только силиды этих металлов. [c.297]
Электрической проводимостью такого типа обладают только силиды этих металлов. [c.297]В атомах, следующих за скандием элементов, продолжается заполнение электронами Зг/-уровпей. К этим элементам относятся титан, у которого два Зй-электрона, ванадий, имеющий Зс -электрона, т. е. V(l) (2) (3s) (Зр) (3d) (4s) . Строение атома следующего элемента — хрома— имеет вид Сг(1) (2) (3s) (3p) (3ii) (4s) так как оказывается, что одному s-электрону выгоднее возвратиться на 3 -уровень. Атом марганца имеет также пять Зс/-электронов и два 4s. В атоме железа шесть 3d-электронов Fe(l) (2) (3s)2(3p) (3d) (4s)2, в атоме кобальта — семь З -электронов и в никеле — восемь. Общее количество электронов, которое может поместиться на -оболочке, равно 10 [2(2-2+1)]. Заполнение Зс -уровня или оболочки завершается в атоме меди (2=29) Си(1) [c.317]
При образовании стабильных карбонилов металлов они приобретают электронную оболочку благородного газа, для чего требуется 12 электронов для металлов VI группы, 11 для металлов VII группы и 10 для металлов VIII группы. Поэтому карбонилы Ш и Мо взаимодействуют с 12 я-электронами шести групп СО и образуют октаэдрические молекулы [46]. Карбонил Ке присоединяет 5 групп СО (10 электронов) и образует двуядерный карбонил за счет связи Не—Ке. Молекулу этого карбонила можно построить из двух октаэдров, в каждом из которых в центральном положении находится один атом металла, пять вершин заняты группами СО, а шестая — вторым атомом металла. Молекула карбонила железа с пятью группами СО имеет строение тетрагональной пирамиды. Но известно, что пять эквивалентных гибриди-зованных связей не образуется, юэтому одна из связей Ре—С ослаблена, что подтверждается измерениями дипольного момента. В карбониле кобальта также одна из связей (Со—Со) отлична от других (Со—С). [c.110]
Поэтому карбонилы Ш и Мо взаимодействуют с 12 я-электронами шести групп СО и образуют октаэдрические молекулы [46]. Карбонил Ке присоединяет 5 групп СО (10 электронов) и образует двуядерный карбонил за счет связи Не—Ке. Молекулу этого карбонила можно построить из двух октаэдров, в каждом из которых в центральном положении находится один атом металла, пять вершин заняты группами СО, а шестая — вторым атомом металла. Молекула карбонила железа с пятью группами СО имеет строение тетрагональной пирамиды. Но известно, что пять эквивалентных гибриди-зованных связей не образуется, юэтому одна из связей Ре—С ослаблена, что подтверждается измерениями дипольного момента. В карбониле кобальта также одна из связей (Со—Со) отлична от других (Со—С). [c.110]
В настоящее время наблюдается мощный интеллектуальный подъем в неорганической химии, который сильнее всего затронул те ее области, которые лежат на стыке с соседними дисциплинами химию металлоорганических и бионеорганических соединений, химию твердого тела, биогеохимию и др. Возрастает, в частности, уверенность ученых в том, что неорганические элементы играют важную роль в живых системах. Живые существа вовсе не являются чисто органическими. Они весьма чувствительны к ионам металлов почти всей Периодической системы Д.И. Менделеева. Некоторые ионы играют важнейшую роль в таких жизненно важных процессах, как связывание и транспорт кислорода (железо в гемоглобине), поглощение и конверсия солнечной энергии (магний в хлорофилле, марганец в фотосистеме II, железо в ферродоксине, медь во фта-лоцианине), передача электрических импульсов между клетками (кальций, калий в нервных клетках), мышечное сокращение (кальций), ферментативный катализ (кобальт в витамине В12). Это привело к взрыву творческой активности ученых в области неорганической химии биосистем. Мы начинаем изучать строение ближайшего и дальнего окружения атомов металлов в биосистемах и учимся понимать, как это окружение позволяет атому металла с такой высокой чувствительностью реагировать на изменение pH, давление кислорода, присутствие доноров или акцепторов электронов.
Возрастает, в частности, уверенность ученых в том, что неорганические элементы играют важную роль в живых системах. Живые существа вовсе не являются чисто органическими. Они весьма чувствительны к ионам металлов почти всей Периодической системы Д.И. Менделеева. Некоторые ионы играют важнейшую роль в таких жизненно важных процессах, как связывание и транспорт кислорода (железо в гемоглобине), поглощение и конверсия солнечной энергии (магний в хлорофилле, марганец в фотосистеме II, железо в ферродоксине, медь во фта-лоцианине), передача электрических импульсов между клетками (кальций, калий в нервных клетках), мышечное сокращение (кальций), ферментативный катализ (кобальт в витамине В12). Это привело к взрыву творческой активности ученых в области неорганической химии биосистем. Мы начинаем изучать строение ближайшего и дальнего окружения атомов металлов в биосистемах и учимся понимать, как это окружение позволяет атому металла с такой высокой чувствительностью реагировать на изменение pH, давление кислорода, присутствие доноров или акцепторов электронов. [c.158]
[c.158]
При рассмотрепии кобальта с порядковым числом 27 становится очевидным, что образование, подобное строению благородного газа, в этом случае маловероятно, так как трудно предположить, чтобы этот металл при соединении только лишь с окисыо углерода был насыщенным в своей внешней оболочке. Оп обязательно будет иметь слишком мало пли слишком много электронов. Поэтому молекула карбонила кобальта содержит не один атом металла, а представляет дикобальтоктокарбопил — С02 (СО)в, состоящий [c.700]
Структура карбонила кобальта и механизм оксореакции были предметом ряда исследований. Металлический кобальт обладает-27 электронами, которые распределены по электронным орбитам следующим образом Is 2s 2р 3s Зр Sd 4s . Дикобальтоктакарбонилу приписывается структура, согласно которой между двумя атомами кобальта существует одна простая связь и две. мостиковые связи через СО-группы к каждому из атомов кобальта прикреплено по 3 СО-группы. Таким 06pas0iM, при образовании ковалентных связей каждый атом кобальта получает-в совместное обладание 8 электронов от окружающих его молекул окиси углерода и еще один дополнительный электрон от-другого атома кобальта. Следовательно, электронная оболочка кобальта вместо 27 первоначальных электронов имеет 36 электронов, т. е. она приобретает электронную структуру благородного газа криптона. Согласно этому представлению, атом кобальта в карбониле кобальта будет обладать внещней электронной структурой следующего строения 3d ° 4s 4р . Было отмечено, что приобретение кобальтом структуры благородного газа возможно также в результате реакции между дикобальтоктакарбонилом и водородом с образованием гидрокарбонила кобальта [c.207]
Таким 06pas0iM, при образовании ковалентных связей каждый атом кобальта получает-в совместное обладание 8 электронов от окружающих его молекул окиси углерода и еще один дополнительный электрон от-другого атома кобальта. Следовательно, электронная оболочка кобальта вместо 27 первоначальных электронов имеет 36 электронов, т. е. она приобретает электронную структуру благородного газа криптона. Согласно этому представлению, атом кобальта в карбониле кобальта будет обладать внещней электронной структурой следующего строения 3d ° 4s 4р . Было отмечено, что приобретение кобальтом структуры благородного газа возможно также в результате реакции между дикобальтоктакарбонилом и водородом с образованием гидрокарбонила кобальта [c.207]
С точки зрения электронной теории соединение иона Со” с ЫНз происходит по той причине, что ион Со+ может образовать устойчивую внешнюю оболочку из 12 электронов. Агом Со (2, 8, 14, 3) превращается в ион Со+++, отдавая 3 электрона и получая, следовательно, строение (2, 8, 14). Приобретая 12 дополнительных электронов (по два от каждой молекулы ЫНз), ион кобальта в комплексе будет иметь строение (2, 8, 14, 12) сумма его электронов равна 36. Это же число электронов имеет атом инертного газа криптона. Рассматривая формулы некоторых комплексов, найдем, что сумма планетарных электронов центрального атом или та же, что и у ближайшего инертного газа, или приблизительно равна ей. Однако во многих случаях при одном и том же числе электронов расположение их различно. Так, в атоме криптона распределение электронов по оболочкам (2, 8, 18, 8), а ион Со+++ в кобальтиаммине имеет, вероятно, группировку электронов (2, 8, 14, 12). [c.33]
Приобретая 12 дополнительных электронов (по два от каждой молекулы ЫНз), ион кобальта в комплексе будет иметь строение (2, 8, 14, 12) сумма его электронов равна 36. Это же число электронов имеет атом инертного газа криптона. Рассматривая формулы некоторых комплексов, найдем, что сумма планетарных электронов центрального атом или та же, что и у ближайшего инертного газа, или приблизительно равна ей. Однако во многих случаях при одном и том же числе электронов расположение их различно. Так, в атоме криптона распределение электронов по оболочкам (2, 8, 18, 8), а ион Со+++ в кобальтиаммине имеет, вероятно, группировку электронов (2, 8, 14, 12). [c.33]
В литературе высказывалось мнение, что истинные карбонилы образуют лишь некоторые элементы (никель, железо, кобальт, рений, хром, молибден, вольфрам, часть платиновых металлов). При этом предполагалось наличие у карбонилов так называемых типич1ных карбонильных овойств. К их числу относили высокую летучесть, растворимость в индиферентных органичеоких растворителях, термическую диссоциацию на металл и окись углерода, комплексное строение. Ряд исследователей считает, что летучие карбонилы могут образовывать только элементы с 5-валентными электронами. Но карбонил углерода обладает всеми типичными карбонильными свойствами. Он летуч, разлагается на углерод и окись углерода, растворяется только в органических растворителях, имеет координационные связи (комплексное строение), и в то же время его центральный атом обладает -5- и р- валентными электронами. [c.12]
Ряд исследователей считает, что летучие карбонилы могут образовывать только элементы с 5-валентными электронами. Но карбонил углерода обладает всеми типичными карбонильными свойствами. Он летуч, разлагается на углерод и окись углерода, растворяется только в органических растворителях, имеет координационные связи (комплексное строение), и в то же время его центральный атом обладает -5- и р- валентными электронами. [c.12]
Многие карбонилы металлов и близкие им по строению вещества являются многоядерными. Типичным примером может служить дикобальт-гексакарбонилдифенилацетилен, структура которого, установленная методом дифракции рентгеновских лучей, показана на рис. 19.6. Тройная связь углерод — углерод заменена на одинарную углерод-углеродную связь и на четыре одинарные связи углерод — кобальт. Каждый атом кобальта образует одинарную связь с другим атомом кобальта, две одинарные связи с ацетиленовыми атомами углерода и двойную связь с каждой из присоединенных к нему карбонильных групп таким образом, для образования связей оказываются использованными все девять внешних электронов и девять внешних орбиталей. В некоторых многоядерных карбонильных комплексах имеются мостпковые карбонильные группы, в которых атом углерода карбонильной группы, помимо двойной связи с атомом кислорода, образует и одинарные связи с двумя атомами металла. [c.594]
В некоторых многоядерных карбонильных комплексах имеются мостпковые карбонильные группы, в которых атом углерода карбонильной группы, помимо двойной связи с атомом кислорода, образует и одинарные связи с двумя атомами металла. [c.594]
Известно, что при замещении у тетраэдрического углерода происходит количественное стереохимическое обращение независимо от деталей строения системы. Оказывается, замещение 5дг2 у октаэдрического кобальта менее стереоспецифично. Но мы находим, что в зависимости от ориентирующего эффекта уже присутствующих групп в больщой и часто преобладающей степени происходит перемещение по ребру . Ориентирующее влияние нитрогруппы весьма отличается от других групп, а несколько пониженные скорости указывают, что она оказывает не активирующее, а слабое избирательное замедляющее действие. По-вндимому, это можно понять [6с]. Так как нитрогрупна является уникальной среди перечисленных ориентирующих групп по способности ее структуры посредством сопряжения втягивать неспаренные электроны (а их в Зс(-оболочке кобальта имеется шесть), то кажется правдоподобным, что перемещение этой оболочки по направлению к нитрогруппе и частично внутрь ее избирательно подвергает другую сторону атома кобальта атаке анионным реагентом. Положительный заряд, наведснный таки.м образом на атом кобальта, будет препятствовать отделению уходящего хлорид-иона. Так как в механизме S v2, описанном нами для замещения анионами, отделение уходящего аниона является существенной частью процесса, определяющего скорость, то не удивительно, что комплексы с нитрогруппой реагируют несколько медленнее. [c.123]
Положительный заряд, наведснный таки.м образом на атом кобальта, будет препятствовать отделению уходящего хлорид-иона. Так как в механизме S v2, описанном нами для замещения анионами, отделение уходящего аниона является существенной частью процесса, определяющего скорость, то не удивительно, что комплексы с нитрогруппой реагируют несколько медленнее. [c.123]
ПЛОСКИЙ, атом металла подчиняется правилу 18 электронов. Однако аналогичное соединение кобальта 4.186 подчиняется этому правилу, толЬко если предположить существование связи металл — металл. Далее, молекула должна, быть парамагнитной, если бы не происходило спаривания спинов в результате образования связи металл — металл или по какому-либо другому механизму. Из структуры 4.816 видно, что длина связи Со—Со равна 2,56 А (0,256 нм) и молекула не имеет центра симметрии. Различия в строении диамагнитных соединений 4.18а и 4.186 говорят о том, что в последнем случае спаривание спинов происходит вследствие образования связи Со—Со возможно, эта связь изогнута, как показано на схеме [207а] [c.172]
Для изоэлектронной СоКО(СО)з молекулы гидрида тетракарбонил-кобальта НСо(СО)4 можно предполагать, что атом водорода координирован с атомом металла, дополняя его валентную конфигурацию до 18-электронной, однако электронографическим исследованием обнаружено [94] тетраэдрическое расположение лигандов вокруг атома Со. Это обстоятельство, как и укорочение одной из связей Со—С (1,75 0,08 А) по сравнению с тремя остальными (1,83 0,02 А) (длины связей С—О совпадают и имеют среднюю величину 1,15 0,05 А), позволило предположить [94], что атом водорода связан не с атомом металла, а с карбонильной группой, образуя лиганд СОН, который и располагается на более коротком расстоянии от атома кобальта, так как вкладывает в связь три электрона (по аналогии с NO-гpyп-пой). Однако последующее ИК-спектральное исследование Со(СО)4Н указало [7] на присутствие гидридного атома водорода и тригонально-бипирамидальное строение молекулы. [c.204]
2.1. Характеристика кобальта по положению в периодической системе. Электронная формула. характеристика кобальта
Похожие главы из других работ:
Водород и его свойства
Строение атома водорода в периодической системе
Первый элемент периодической системы (1-й период, порядковый номер 1). Не имеет полной аналогии с остальными химическими элементами и не принадлежит ни к какой группе, поэтому в таблицах условно помещается в IА группу и/или VIIA-группу…
Воздействие окружающей среды на металлы
I. Строение атомов металлов. Положение металлов в периодической системе. Группы металлов.
В настоящее время известно 105 химических элементов, большинство из них – металлы. Последние весьма распространены в природе и встречаются в виде различных соединений в недрах земли, водах рек, озер, морей, океанов, составе тел животных…
Качественное обнаружение вольфрама
Положение в периодической системе химических элементов
Вольфрам – элемент VI группы периодической системы химических элементов, его порядковый номер 74, атомная масса 183,85. Природный вольфрам состоит из смеси стабильных изотопов с массами: 180 (0,16%) 182 (26,35%) 183 (14,32%) 184 (30,68%) 186 (28…
Классы неорганических веществ. Растворы электролитов. Размеры атомов и водородная связь
2. Размеры атомов. Связь размера атома с положением в периодической системе элементов. Понятие об ионах
Атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных частиц_электронов, составляющих его электронную оболочку. Сумма зарядов электронов равна по модулю положительному заряду ядра…
Магний и его свойства
2. Характеристика по положению в периодической системе Д. И. Менделеева. Физические свойства
Что же представляет собой этот элемент? Магний — элемент II группы периодической системы Д. И. Менделеева; третьего периода, главной подгруппы, порядковый номер 12; атомная масса 24,312 у.е. Это легкий (плотность 1…
Масс-спектрометрический метод анализа
Электронная ионизация (EI)
Электронная ионизация – один из наиболее важных способов ионизации для повседневных анализов малых гидрофобных термически стабильных молекул и до сих пор широко используется. Так как EI обычно даёт большое число фрагментарных ионов…
Молибден
2. Местоположение в периодической системе
Элемент побочной подгруппы шестой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 42. Обозначается символом Mo (лат. Molybdaenum)…
Моносахариды. Глюкоза
3. Электронная структура глюкозы
Внутримолекулярное замыкание цикла в циклическую полуацетальную структуру связано с возникновением нового хирального центра, аномерного атома углерода…
Получение фосфорнокислого цинка
1.1.2 Положение цинка в периодической системе Д.И. Менделеева
Цинк – элемент побочной подгруппы второй группы, четвертого периода периодической системы химических элементов Д.И. Менделеев, с атомным номером 30. Атомная масса 65,39. Конфигурация внешних электронных оболочек атома 3d10 4s2. Степень окисления +2…
Развитие периодического закона. Зависимость свойства элементов от ядра его атома
Электронная оболочка атома
Строение электронной оболочки атома по Бору. Как уже указывалось, в своей теории Нильс Бор исходил из ядерной модели атома. Основываясь на положении квантовой теории света о прерывистой…
Структура и свойства покрытия из нержавеющей стали, напыленной на Сталь 3 и оплавленной электронным пучком
2.1.2 Растровая электронная микроскопия
Использование растровой электронной микроскопии дает возможность изучения морфологии поверхности и исследование внутренней структуры при рассмотрении косых шлифов [24]…
Сульфидные катализаторы гидроочистки
1.1 Электронная микроскопия
В электронном микроскопе электроны сначала ускоряются в электрическом поле между катодом и анодом, имеющим форму кольца. Длина волны ускоренных таким образом электронов может составлять несколько сотых долей ангстрема (т.е…
характеристика кобальта
2.3. Получение кобальта
Кобальт — относительно редкий металл, и богатые им месторождения в настоящее время практически исчерпаны. Поэтому кобальтсодержащее сырье (часто это никелевые руды, содержащие кобальт как примесь) сначала обогащают…
характеристика кобальта
2.4. Химические свойства кобальта
нормальный электродный потенциал реакции Со – 2е – Со2+ ц0 = – 0,27 В, а реакции Со – 3е – Со3+ ц0 = +0,4 В. Окислительно – восстановительный потенциал кобальта в кислых растворах для реакции Со2+ Со3+ + е равен 1,81 В, а реакции Со Со3+ + +3е 0…
Экстракция редкоземельных элементов
1.2 Электронная конфигурация РЗЭ
К группе редкоземельных элементов или лантаноидов относятся 14 элементов с порядковыми номерами от 58 (церия) до 71 (лютеция), расположенных в периодической системе за лантаном и сходных с ним по свойствам…
Тема 7 Электронное строение сложных атомов
%PDF-1.5 % 1 0 obj > /Metadata 2 0 R /Outlines 3 0 R /PageLayout /OneColumn /Pages 4 0 R /StructTreeRoot 5 0 R /Type /Catalog >> endobj 6 0 obj /Comments () /Company () /CreationDate (D:20151006103331+03’00’) /Creator /Keywords () /ModDate (D:20151006103338+03’00’) /Producer (Adobe PDF Library 10.0) /SourceModified (D:20151006073324) /Subject () /Title >> endobj 2 0 obj > stream 2015-10-06T10:33:38+03:002015-10-06T10:33:31+03:002015-10-06T10:33:38+03:00Acrobat PDFMaker 10.1 для Worduuid:4350221a-2d21-4d56-afcf-2257e9808a0auuid:e5e6745a-0d7f-431e-88eb-05d7f6b1170b
`vfǘܲKdwmcSǚ!k08lۺk@3,lΨn7?،tOX2?㖘 gɈB_A{wyIBFsWn;1[
НихромПродукция Описание Цены Стандарты Статьи Фото ФехральПродукция Описание Цены Стандарты Статьи Фото Нихром в изоляцииПродукция Цены Стандарты Статьи Фото ТитанПродукция Описание Цены Стандарты Статьи Фото ВольфрамПродукция Описание Цены Стандарты Статьи Фото МолибденПродукция Описание Цены Стандарты Статьи Фото КобальтПродукция Описание Цены Стандарты Статьи Фото Термопарная проволокаПродукция Описание Цены Стандарты Статьи Фото Провода термопарныеПродукция Цены Стандарты Статьи Фото НикельПродукция Описание Цены Стандарты Статьи Фото МонельПродукция Описание Цены Стандарты Статьи Фото КонстантанПродукция Описание Цены Стандарты Статьи Фото МельхиорПродукция Описание Цены Стандарты Статьи Фото Твердые сплавыПродукция Описание Цены Стандарты Статьи Фото Порошки металловПродукция Цены Стандарты Статьи Фото Нержавеющая стальПродукция Описание Цены Стандарты Статьи Фото Жаропрочные сплавыПродукция Описание Цены Стандарты Статьи Фото ФерросплавыПродукция Описание Цены Стандарты Статьи Фото ОловоПродукция Описание Цены Стандарты Статьи Фото ТанталПродукция Описание Цены Стандарты Статьи Фото НиобийПродукция Описание Цены Стандарты Статьи Фото ВанадийПродукция Описание Цены Стандарты Статьи Фото ХромПродукция Описание Цены Стандарты Статьи Фото РенийПродукция Описание Цены Стандарты Статьи Фото Прецизионные сплавыПродукция Описание Магнитомягкие Магнитотвердые С заданным ТКЛР С заданной упругостью С высоким эл. сопротивлением Сверхпроводники Термобиметаллы
Основные сведенияКобальт (Co) (Cobaltum) – химический элемент VIII группы в периодической системе химических элементов с атомным номером 27, твердый вязкий блестящий голубовато-серый металл, относится к тяжелым металлам. Плотность равна 8,9 г/см3, tпл.=1493 °C, tкип.=2957 °C. В земной коре содержание Co равно 4·10-3% по массе. Данный металл входит в состав более 30 минералов. К ним относятся каролит CuCo2S4, линнеит Co3S4, кобальтин CoAsS, сферокобальтит CoCO3, смальтит СоAs2 и другие. В морской воде приблизительно (1-7)·10-10% Co. История открытияНазвание металла “Кобальт” тесно связано с саксонскими рудниками, а точнее с подземным гномом Кобольдом, который там обитал по мнению саксонцев. Дело в том, что не всегда руда, принимаемая тогда за серебряную, давала при выплавке непосредственно драгоценный металл. Данное явление, как раз, и приписывали к злым деяниям маленького гнома Кобольда. Руда, которая не давала серебра, но была по внешним признакам очень похожа на серебряную, получила название “кобольд”. Скорее всего, это были содержащие мышьяк кобальтовые минералы — кобальтин CoAsS, или сульфиды кобальта скуттерудит, сафлорит или смальтин. В 1735 году шведский химик Георг Брандт выделил из данной руды серый со слабым розоватым оттенком неизвестный металл, который получил название “кобольд” или “Кобальт”. Брандт выяснил также, что соединения именно этого элемента окрашивают стекло в синий цвет. Свойства кобальтаФизические и механические свойства
Химические свойства
Марки кобальта и сплавовСовременная промышленность выпускает несколько марок данного металла.
Достоинства / недостатки
Применение кобальтаКобальт в виде порошка используют в основном в качестве добавки к сталям. При этом повышается жаропрочность стали, улучшаются ее механические свойства (твердость и износоустойчивость при повышенных температурах). Данный металл входит в состав твердых сплавов, из которых изготовляется быстрорежущий инструмент. Один из основных компонентов твердого сплава – карбид вольфрама или титана – спекается в смеси с порошком металлического кобальта. Именно Co улучшает вязкость сплава и уменьшает его чувствительность к толчкам и ударам. Так, например, резец из суперкобальтовой стали (18% Co) оказался самым износоустойчивым и с лучшими режущими свойствами по сравнению с резцами из ванадиевой стали (0% Co) и кобальтовой стали (6% Co). Также кобальтовый сплав может использоваться для защиты от износа поверхностей деталей, подверженных большим нагрузкам. Твердый сплав способен увеличить срок службы стальной детали в 4-8 раз.Также стоит отметить магнитные свойства кобальта. Данный металл способен сохранять эти свойства после однократного намагничивания. Магниты должны иметь высокое сопротивление к размагничиванию, быть устойчивыми по отношению к температуре и вибрациям, легко поддаваться механической обработке. Добавление кобальта в стали позволяет им сохранять магнитные свойства при высоких температурах и вибрациях, а также увеличивает сопротивление размагничиванию. Так, например, японская сталь, содержащая до 60% Co, имеет большую коэрцитивную силу (сопротивление размагничиванию) и всего лишь на 2-3,5% теряет магнитные свойства при вибрациях. Магнитные сплавы на основе кобальта применяют при производстве сердечников электромоторов, трансформаторов и в других электротехнических устройствах. Стоит отметить, что кобальт также нашел применение в авиационной и космической промышленности. Кобальтовые сплавы постепенно начинают конкурировать с никелевыми, которые хорошо зарекомендовали себя и давно используются в данной отрасли промышленности. Сплавы, содержащие Co, используются в двигателях, где достигается достаточно высокая температура, в конструкциях авиационных турбин. Никелевые сплавы при высоких температурах теряют свою прочность (при температурах от 1038°С) и тем самым проигрывают кобальтовым. В последнее время кобальт и его сплавы стали применяться при изготовлении ферритов, в производстве «печатных схем» в радиотехнической промышленности, при изготовлении квантовых генераторов и усилителей. Кобальтат лития применяется в качестве высокоэффективного положительного электрода для производства литиевых аккумуляторов. Силицид кобальта отличный термоэлектрический материал и позволяет производить термоэлектрогенераторы с высоким КПД. Соединения Co, введенные в стекла при их варке, обеспечивают красивый синий (кобальтовый) цвет стеклянных изделий. Продукция из кобальтаСовременная промышленность выпускает разнообразную продукцию из кобальта. Наиболее распространены кобальтовый порошок, слитки и пластины. Для специальных целей также производится кобальтовая проволока.Указанная продукция применяется в случаях, когда необходим материал, имеющий высокие показатели износостойкости и жаропрочности или высокое сопротивление размагничиванию. |
Схема электронного строения атома мышьяка – Telegraph
Схема электронного строения атома мышьяка
====================================
>> Перейти к скачиванию
====================================
Проверено, вирусов нет!
====================================
Схема строения атома мышьяка, рисунок 1. Задание, Сколько электронов находится на внешнем электронном уровне элемента с порядковым.
Электронное строение атома цезия в химии, Cs. Внешний. Задание, Атому элемента марганец отвечает сокращенная электронная формула. формула валентных подуровней 3d34s2 отвечает атому элемента: мышьяк, бром.
Электронные формулы атомов химических элементов. элемента, Электронная формула. 33, As, мышьяк, 1s 22s 22p 63s 23p64s 23d104p3.
Мышья́к (лат. Arsenicum, химический символ As) химический элемент 15-й группы (по. Свойства атома. Название. Электронная конфигурация.
Составьте электронные формулы мышьяка и представьте графически. электронов при возбуждении атомов с образованием валентных электронов в.
Фосфор, мышьяк или сурьма (имеющие электронное строение внешнего. На основании электронного строения атомов р-элементов IV и V групп.
Особенности электронного строения атомов хрома, меди и некоторых других. валентную электронную конфигурацию атомов титана и мышьяка.
Пять электронов находятся во внешнем электронном слое атома. 1) бора. 2) мышьяка. Схема строения электронных оболочек соответствует атому.
Но атом водорода может и восстановиться – принять электрон. с компьютерной моделью Электронная конфигурация атома. Валентные электроны атома мышьяка As – это электроны 4s и 4p-подуровней (всего их пять).
Электронная структура атома может быть изображена также в виде схем размещения. Составьте электронные и электронно-графические формулы атомов. и 3d-подуровнях атома кобальта; д) 3d- и 4s-подуровнях атома мышьяка?. Исходя из электронного строения атомов фтора и хлора объясните.
Такое кольцо из атомов, как правило, химически стабильно и обладает. В- третьих, каждый атом должен вносить вклад в образование общего электронного облака. Схема реакции получения дифосфатриазолата. проверить, насколько полны современные знания о строении молекул.
В этом видеоролике показан порядок составления схемы строения атома, электронной формулы и энергетической диаграммы.
Свойства атома. Атомная масса (молярная. Электронная конфигурация, [Ar ] 3d10 4s2 4p3. Химические свойства. Схема атома мышьяка. Название.
Общая характеристика и строение элементов VA группы Химия ( Элементы VA группы. семейство пниктидов, входят азот, фосфор, мышьяк, сурьма и висмут. V группы, имеют пять электронов на внешнем электронном уровне. конфигурацию внешнего энергетического уровня атома ns2np3 и могут.
Низшая степень окисления опреде- также в виде схем размещения. Для атома мышьяка написать электронную формулу; 62. нец, исходя из электронного строения? трона указать значения всех четырех квантовых чисел. 90.
Строение атома» из банка тестовых заданий, составленных авторами для тематического контроля в. Номер внешнего электронного слоя в атоме кальция. Валентность атома мышьяка в его водородном соединении равна.
В первом случае атомы мышьяка имеют скорее отрицательную степень окисления. Интересно строение минералов, в которых мышьяк присутствует.
Атом состоит из ядра и окружающего его электронного облака. б) В ядре атома углерода 6 протонов и 6 нейтронов, а в электронном облаке – 6. олово, ртуть, цинк, мышьяк, сурьма, висмут, платина, фосфор, кобальт, никель.
Вместо фосфора эти бактерии используют мышьяк. Ниже приведена схема, на которой эти бактерии и археи собраны в. Так выглядят бактерии под электронным микроскопом. C мышьячный вариант, E внутреннее строение этих клеток с вакуолями, D фосфорный аналог.
Электронные формулы атомов химических элементов (109). элемента, Электронная формула. 33, As, мышьяк, 1s 22s 22p 63s 23p64s 23d104p3.
Cobalt – Информация об элементе, свойства и использование
Расшифровка:
Химия в ее стихии: кобальт
(Promo)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет – красота, синее стекло, B12 и лучшие магниты, которые можно купить за деньги.Так почему же элемент этой недели назван в честь гоблина?
Сара Станиленд
Я всегда нахожу вопрос «какой твой любимый элемент» трудным. Есть несколько лидеров по самым разным причинам; однако главным соперником всегда должен быть кобальт, потому что он выделяется несколькими важными чертами характера: Кобальт обладает удивительной красотой и силой, а также прекрасным сотрудничеством. Все вместе очень полезный металл.
Прежде чем я даже подумал о химии цвета, я полюбил синее стекло, которое я коллекционирую и по сей день.Только после изучения химии переходных металлов я понял, что этот красивый синий цвет происходит от кобальта. Собственно хлорид кобальта.
Однако, что касается цветов, у кобальта больше струн на смычке, чем просто у этого чудесного синего цвета. Кобальт также может окрашивать стекло в зеленый цвет, а гидратированная форма хлорида кобальта имеет красивый темно-розовый цвет. Как вы можете себе представить, это изменение цвета из-за присутствия воды очень полезно, поскольку хлорид кобальта является идеальным индикатором влажности.
Множество красивых цветов, которые производит кобальт, никогда не было для меня более распространенным, чем когда я поехал в регион добычи кобальта под названием Copperbelt в Замбии. В этой области возвышаются огромные разноцветные месторождения минералов кобальта, берега плотин и ручьев окрашены в глубокую розу с серебристо-синими прожилками.
Кобальт не встречается в природе в чистом виде, но содержится в минералах серы и обычно ассоциируется с другими переходными металлами. Как вы, вероятно, можете догадаться из названия региона в Замбии – Коппербелт, кобальт добывается как вторичный продукт по сравнению с медью, которая доминирует в руде этого региона.По этой причине кобальт обычно извлекают из отходов первичного извлечения металлов.
Однако эти горячие точки добычи полезных ископаемых – не единственные места на Земле, где можно найти высокие концентрации кобальта. Огромный запас нескольких переходных металлов (включая кобальт) можно найти в странных конкрециях на дне глубочайших океанов. Конкреции представляют собой минералы марганца, на формирование которых уходят миллионы лет, и в этой форме присутствует много тонн кобальта.
Итак, вы можете видеть, что кобальт никогда не бывает сам по себе, он всегда накапливается в рудах других переходных металлов, в основном, меди и никеля.Фактически, металлический кобальт не был выделен и очищен до 1735 года шведским ученым Г. Брандтом.
Кобальт также иногда может быть найден в смешанных мышьяковистых рудах, и именно ассоциация кобальта с мышьяком дала ему свое название. Слово кобальт происходит от немецкого «кобольды», что означает гоблин или нарушитель спокойствия. Его так называли в этом регионе ранней добычи, потому что его было очень трудно плавить без окисления, а при плавке выделялись пары мышьяка, что приводило к довольно неприятным или даже смертельным условиям обработки для рабочего.В этом обвиняли кобольдов, и название прижилось.
За исключением горнодобывающего региона, кобальта не так много, лишь следовые количества присутствуют в земной коре (примерно в 2500 раз меньше, чем железа). Тем не менее, это металл, который необходим для жизни в следовых количествах. Кобальт – это металл в центре витамина B 12 , который помогает регулировать развитие клеток и, следовательно, производство ДНК и энергии в организме.
Кобальт был известен и использовался людьми благодаря его красивой окраске и свойствам пигмента еще в 2500 году до нашей эры.К этому времени относятся египетские кобальтовые синие краски и прусские ожерелья из оксида кобальта, а кобальтовое стекло было найдено в греческой вазе, датированной 100 годом до нашей эры. Кобальт также использовался для окрашивания стекла во времена китайской династии Тан с 618 года нашей эры. Фактически, вплоть до начала 20 – века люди действительно использовали кобальт только из-за его красивого цвета.
Однако кобальт – это не только красивое лицо. Кобальт – блестящий, очень твердый серебристый металл, принадлежащий к группе, называемой «переходными металлами».Это один из трех ферромагнитных переходных элементов, наряду с железом и никелем. Как металл, он очень механически твердый и вязкий, и он имеет очень высокую температуру плавления (отсюда проблемы плавления), а также остается магнитным до самой высокой температуры из всех магнитных элементов.
Когда кобальт сочетается с другими металлами, его прочность позволяет создавать ряд суперсплавов. В частности, очень высокая температура плавления и механическая прочность кобальта при высоких температурах широко используются в так называемых «суперсплавах».Это сплавы, сохраняющие механическую прочность при высоких температурах. Благодаря своим впечатляющим свойствам кобальт является важным компонентом износостойких и коррозионно-стойких сплавов. Кобальтовые сплавы и покрытия можно встретить повсюду, от сверл до пил, от авиационных турбин до протезов костей.
Тот факт, что кобальт является магнитным, также использовался в японском изобретении кобальтовой магнитной стали, где добавление кобальта к стали значительно увеличивает магнитную твердость.Всего через несколько лет после этого, в 1930-х годах, произошло решающее изобретение магнитов Alnico, которые, как следует из названия, состоят из алюминия, никеля и кобальта.
Тот факт, что кобальт сохраняет свой магнетизм до высоких температур, также является очень благоприятным признаком, когда добавление кобальта к магнитному материалу может улучшить его свойства при высоких температурах. Совсем недавно создание редкоземельных магнитов дало нам гораздо более сильные и твердые постоянные магниты, чем магниты Алнико. Один из таких магнитных материалов, самарий-кобальт, сохраняет свой магнетизм до 800 ° C.Поскольку он обладает магнитной и механической прочностью до очень высоких температур, он нашел применение в высокоскоростных двигателях и турбомашинах. В последнее время кобальт широко используется в новых батареях, магнитных частицах для записи и хранения информации на магнитных лентах и жестких дисках.
Так кобальт; доставляя радость в множестве красивых цветов, но в то же время сверхпрочных, твердых и притягательных. Кобальт никогда не бывает одиноким, он связан с различными металлами в их руде и обладает лучшими механическими свойствами, когда накапливается вместе с другими.
Крис Смит
Подчеркивая важность, конечно же, командной работы. Это была Сара Станиленд с историей Кобальта – она работает в Университете Лидса. На следующей неделе настанет черед того, что, помимо прочего, заставляет перья ручки Parker писать так красиво, но если вы не слышали об этом раньше, то вы, вероятно, в хорошей компании.
Джонатан Стид
Остановите пресловутого «обывателя» и спросите его, что такое рутений, и, скорее всего, он не сможет вам сказать.По сравнению с «более сексуальными элементами», которые стали нарицательными, такими как углерод и кислород, рутений, честно говоря, немного неясен. Фактически, даже если ваш обыватель был одет в лабораторный халат и шел по улице в непосредственной близости от химического факультета университета, он все равно мог немного не знать об этом загадочном металле. Однако так было не всегда.
Крис Смит
И вы можете услышать, как рутений стал известен благодаря Джонатану Стиду на следующей неделе в программе «Химия в ее элементе».Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
WebElements Periodic Table »Cobalt» Свойства свободных атомов
Атомы кобальта имеют 27 электронов, а структура оболочки – 2.8.15.2.
Электронная конфигурация основного состояния газообразного нейтрального кобальта в основном состоянии – это [ Ar ]. 3д 7 . 4s 2 , а символ термина – это 4 F 9/2 .
Схематическая электронная конфигурация кобальта. Оболочечная структура Косселя кобальта.Атомный спектр
Представление атомного спектра кобальта.
Энергии ионизации и сродство к электрону
Электронное сродство кобальта составляет 63,7 кДж / моль ‑1 . Энергии ионизации кобальта приведены ниже.
Энергии ионизации кобальта.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff . Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 26,3668 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 19,41 | 2п | 23.09 | ||||
| 3с | 14.32 | 3 пол | 13,43 | 3д | 11,86 | ||
| 4с | 5,58 | 4п | (нет данных) | 4д | (нет данных) | 4f | (нет данных) |
| 5s | (нет данных) | 5п | (нет данных) | 5д | (нет данных) | ||
| 6s | (нет данных) | 6п | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальный | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 7709 [1] |
| L I | 2s | 925.1 [3] |
| L II | 90 1/2 II 90p2 793,2 [3]||
| L III | 2p 3/2 | 778,1 [3] |
| M I | 3s | 101 [3] |
| 3 пол. 1/2 | 58.9 [3] | |
| M III | 3p 3/2 | 59,9 [3] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev.Мод. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, «Энергии связи на уровне ядра в металлах», J.Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
частиц кобальта | AMERICAN ELEMENTS ®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Название продукта: Cobalt Particles
Номер продукта: Все применимые коды продуктов American Elements, например CO-M-02-PTCS , CO-M-03-PTCS , CO-M-04-PTCS , CO-M-05-PTCS
Номер CAS: 7440-48-4
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Лос-Анджелес, Калифорния
Тел .: +1 310-208-0551
Факс: +1 310-208-0351
Телефон экстренной связи:
Внутренний номер, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТЕЙ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
GHS02 Flame
Flam. Sol. 1 х328 Легковоспламеняющееся твердое вещество.
GHS08 Опасность для здоровья
Респ. Sens. 1 h434 При вдыхании может вызывать симптомы аллергии, астмы или затруднение дыхания.
Carc. 2 ч451 Предположительно вызывает рак.
GHS07
Skin Sens. 1 h417 Может вызывать аллергическую кожную реакцию.
Классификация в соответствии с Директивой 67/548 / EEC или Директивой 1999/45 / EC
Xn; Сенсибилизирующий
R42 / 43: Может вызывать сенсибилизацию при вдыхании и контакте с кожей.
F; Легковоспламеняющийся
R11: Легковоспламеняющийся.
R53: Может вызывать длительные неблагоприятные изменения в водной среде.
Информация об особых опасностях для человека и окружающей среды:
Н / Д
Опасности, не классифицированные иным образом
Данные отсутствуют.
Элементы этикеток
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Продукт классифицируется и маркируется в соответствии с Регламентом CLP.
Пиктограммы, обозначающие опасности
GHS02 GHS08
Сигнальное слово: Опасно
Компоненты этикетки, указывающие на опасность:
Кобальт
Оксид кобальта (II, III)
Предупреждения об опасности
h328 Воспламеняющееся твердое вещество.
h434 При вдыхании может вызывать симптомы аллергии, астмы или затруднение дыхания.
h417 Может вызывать аллергическую кожную реакцию.
h451 Предположительно вызывает рак.
Меры предосторожности
P210 Беречь от тепла / искр / открытого огня / горячих поверхностей. Не курить.
P284 При недостаточной вентиляции использовать средства защиты органов дыхания.
P261 Избегать вдыхания пыли / дыма / газа / тумана / паров / аэрозолей.
P342 + P311 При появлении респираторных симптомов: обратиться в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР / к врачу / …
P405 Хранить под замком.
P501 Утилизировать содержимое / контейнер в соответствии с местными / региональными / национальными / международными правилами.
Классификация WHMIS
B4 – Воспламеняющееся твердое вещество
D2A – Очень токсичный материал, вызывающий другие токсические эффекты
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
1
3
1
Здоровье (острые эффекты) = 1
Воспламеняемость = 3
Физическая опасность = 1
Другие опасности
Результаты оценки PBT и vPvB:
PBT: N / A.
vPvB: н / д.
РАЗДЕЛ 3. СОСТАВ / ИНФОРМАЦИЯ ОБ ИНГРЕДИЕНТАХ
Химическая характеристика: Смеси
Опасные компоненты:
7440-48-4 Cobalt
Xn R42 / 43;
F R11
R53
Огн.Sol. 1, х328;
Респ. Sens. 1, h434;
Skin Sens. 1, h417
90,0%
1308-06-1 Оксид кобальта (II, III)
Xn R40;
Xi R43;
N R50 / 53
Carc. Кот. 3
Carc. 2, х451;
Skin Sens. 1, h417
10.0%
Дополнительная информация
Неизвестно.
РАЗДЕЛ 4. ПЕРВАЯ ПОМОЩЬ
Описание мер первой помощи
При вдыхании:
Подайте свежий воздух. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь за медицинской помощью.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь за медицинской помощью.
При попадании в глаза:
Промыть открытый глаз под проточной водой в течение нескольких минут. Проконсультируйтесь с врачом.
При проглатывании:
Обратитесь за медицинской помощью.
Информация для врача
Наиболее важные симптомы и воздействия, как острые, так и проявляющиеся с задержкой
Информация отсутствует.
Указание на необходимость немедленной медицинской помощи и специального лечения
Информация отсутствует.
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения
Специальный порошок для металлических возгораний. Не используйте воду.
Средства пожаротушения, непригодные из соображений безопасности
Вода
Особые опасности, исходящие от вещества или смеси
При пожаре могут образоваться следующие вещества:
Дым оксида металла
Рекомендации для пожарных
Защитное снаряжение:
Самостоятельно содержал респиратор.
Надеть полностью защитный непромокаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры личной безопасности, защитное снаряжение и порядок действий в чрезвычайной ситуации
Надевайте защитное снаряжение. Не подпускайте незащищенных людей.
Обеспечьте соответствующую вентиляцию.
Держите подальше от источников возгорания.
Меры по защите окружающей среды:
Не допускайте попадания материала в окружающую среду без официального разрешения.
Не допускать попадания продукта в канализацию или водоемы.
Не допускать проникновения в землю / почву.
Методы и материалы для локализации и очистки:
Хранить вдали от источников возгорания.
Утилизируйте зараженный материал
как отходы в соответствии с разделом 13.
Обеспечьте соответствующую вентиляцию.
Предотвращение вторичных опасностей:
Беречь от источников возгорания.
Ссылка на другие разделы
См. Раздел 7 для получения информации о безопасном обращении.
См. Раздел 8 для получения информации о средствах индивидуальной защиты
.
Информацию об утилизации см. В Разделе 13.
РАЗДЕЛ 7.ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Хранить контейнер плотно закрытым.
Хранить в сухом прохладном месте в плотно закрытой таре.
Обеспечьте соответствующую вентиляцию.
Предотвратить образование пыли.
Информация о защите от взрывов и пожаров:
Защищать от электростатических зарядов.
Условия для безопасного хранения с учетом несовместимости
Хранение
Требования, предъявляемые к складским помещениям и таре:
Хранить в прохладном месте.
Информация о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Дополнительная информация об условиях хранения:
Хранить емкость плотно закрытой.
Хранить в прохладном, сухом месте в хорошо закрытых емкостях.
Конкретное конечное применение
Отсутствует какая-либо соответствующая информация
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ЛИЧНАЯ ЗАЩИТА
Дополнительная информация о конструкции технических систем:
Правильно работающий вытяжной шкаф для химических веществ, предназначенный для опасных химикатов и имеющий среднюю скорость потока. не менее 100 футов в минуту.
Контрольные параметры
Компоненты с предельными значениями, требующие контроля на рабочем месте:
7440-48-4 Кобальт (90,0%)
PEL (США) Долгосрочное значение: 0,1 * мг / м³
как Co; * для металлической пыли и дыма
REL (США) Долгосрочное значение: 0,05 мг / м³
в пересчете на Co; металлическая пыль и дым
TLV (США) Долгосрочное значение: 0,02 мг / м³
as Co, BEI
EL (Канада) Долгосрочное значение: 0,02 мг / м³
IARC 2B
EV (Канада) Долгосрочное значение: 0,1 мг / м³
1308-06-1 Оксид кобальта (II, III) (10.0%)
PEL (США) Долгосрочное значение: 0,1 * мг / м³
в виде Co; * для металлической пыли и дыма
REL (США) Долгосрочное значение: 0,05 мг / м³
в пересчете на Co; металлическая пыль и дым
TLV (США) Долгосрочное значение: 0,02 мг / м³
as Co, BEI
Ингредиенты с биологическими предельными значениями:
7440-48-4 Кобальт (90,0%)
BEI (США) 15 мкг / л
Среда: моча
Время: конец смены в конце рабочей недели
Параметр: кобальт (фон)
1 мкг / л
Среда: кровь
Время: конец смены в конце рабочей недели
Параметр: кобальт (фон, полуколичественный )
1308-06-1 Оксид кобальта (II, III) (10.0%)
BEI (США) 15 мкг / л
Среда: моча
Время: конец смены в конце рабочей недели
Параметр: кобальт (фон)
1 мкг / л
Среда: моча
Время: конец смены в конце рабочей недели
Параметр: Кобальт (исходный, полуколичественный)
Дополнительная информация: Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
При обращении с химическими веществами соблюдайте стандартные меры общей защиты и промышленной гигиены.
Хранить вдали от продуктов питания, напитков и кормов.
Немедленно снимите всю грязную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Дыхательное оборудование:
При высоких концентрациях используйте подходящий респиратор.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Время проницаемости материала перчаток (в минутах): Нет данных.
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид:
Форма: Порошок
Цвет: Черный
Запах: Без запаха
Порог запаха: Нет данных.
pH: нет данных.
Точка плавления / интервал: Нет данных.
Точка кипения / интервал: Нет данных.
Температура сублимации / начало: Нет данных.
Воспламеняемость (твердое тело, газ): Легковоспламеняющийся.
Температура возгорания: данные отсутствуют.
Температура разложения: Нет данных.
Самовоспламенение: Продукт не самовоспламеняется.
Взрывоопасность: данные отсутствуют.
Пределы взрываемости:
Нижний: данные отсутствуют.
Верх: данные отсутствуют.
Давление пара: нет данных.
Плотность: Нет данных.
Относительная плотность: Нет данных.
Плотность пара: N / A.
Скорость испарения: N / A.
Растворимость в воде (H 2 O): Нерастворимый
Коэффициент распределения (н-октанол / вода): Нет данных.
Вязкость:
Динамическая: нет данных.
Кинематика: нет данных.
Содержание растворителя:
Органические растворители: 0,0%
Содержание твердых веществ: 100,0%
Другая информация
Информация отсутствует.
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Нет данных.
Химическая стабильность
Стабилен при рекомендуемых условиях хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит при использовании и хранении в соответствии со спецификациями.
Возможность опасных реакций
Неизвестно ни о каких опасных реакциях
Условия, которых следует избегать
Информация отсутствует.
Несовместимые материалы:
Окисляющие вещества
Опасные продукты разложения:
Дым оксидов металлов
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Реестр токсических эффектов химических веществ (RTECS) содержит данные об острой токсичности для компонентов в этом продукте.
Значения ЛД / ЛК50, которые имеют отношение к классификации: 7440-48-4 Кобальт
Пероральный ЛД50 6171 мг / кг (крыса)
Раздражение или разъедание кожи: Может вызывать раздражение
Раздражение или разъедание глаз: Может вызывать раздражение
Сенсибилизация:
Может вызывает симптомы аллергии, астмы или затрудненное дыхание при вдыхании.
Может вызывать аллергическую кожную реакцию.
Мутагенность зародышевой клетки:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях компонентов этого продукта.
Канцерогенность:
IARC-2B: Возможно канцерогенное действие для человека: ограниченные доказательства у людей при отсутствии достаточных доказательств у экспериментальных животных.
ACGIH A3: Канцероген для животных: Агент канцерогенен для экспериментальных животных в относительно высокой дозе, в зависимости от пути (а) введения, в месте (ах), гистологического типа (ов) или механизма (ов), не имеющего отношения к воздействие на работника. Доступные эпидемологические исследования не подтверждают повышенный риск рака у людей, подвергшихся воздействию.
Имеющиеся данные свидетельствуют о том, что этот агент вряд ли вызовет рак у людей, за исключением редких или маловероятных путей или уровней воздействия.
Реестр токсических эффектов химических веществ (RTECS) содержит данные о онкогенных, канцерогенных и / или неопластических свойствах компонентов этого продукта.
Репродуктивная токсичность:
Реестр токсических воздействий химических веществ (RTECS) содержит репродуктивные данные для компонентов этого продукта.
Специфическая токсичность для системы органов-мишеней – повторное воздействие: нет насколько нам известно, острая и хроническая токсичность этого вещества полностью не изучена.
Продукт показывает следующие опасности в соответствии с одобренными внутри страны методами расчета для препаратов:
Вредно
Раздражающе
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Токсичность для водной среды:
Информация отсутствует.
Стойкость и разлагаемость:
Информация отсутствует.
Потенциал биоаккумуляции:
Информация отсутствует.
Подвижность в почве:
Информация отсутствует.
Дополнительная экологическая информация:
Общие примечания:
Не допускайте попадания материала в окружающую среду без официальных разрешений.
Не допускать попадания неразбавленного продукта или больших количеств продукта в грунтовые воды, водоемы или канализацию.
Может вызывать длительные вредные последствия для водных организмов.
Избегать попадания в окружающую среду.
Результаты оценки PBT и vPvB:
PBT: N / A.
vPvB: н / д.
Другие побочные эффекты
Информация отсутствует.
РАЗДЕЛ 13. УТИЛИЗАЦИЯ
Методы обработки отходов
Рекомендация:
Проконсультируйтесь с государственными, местными или национальными правилами, чтобы обеспечить надлежащую утилизацию.
Неочищенная тара:
Рекомендация:
Утилизация должна производиться в соответствии с официальными предписаниями.
РАЗДЕЛ 14. ТРАНСПОРТНАЯ ИНФОРМАЦИЯ
Номер ООН
DOT, IMDG, IATA
UN3089
Собственное транспортное наименование ООН
DOT
Металлические порошки легковоспламеняющиеся, н.у.к. (Кобальтовый порошок)
IMDG, IATA
МЕТАЛЛИЧЕСКИЙ ПОРОШОК, ВОСПЛАМЕНЯЮЩИЙСЯ, Н.У.К. (Кобальтовый порошок)
Класс (ы) опасности при транспортировке
DOT
Класс
4.1 Воспламеняющиеся твердые вещества, самореактивные вещества и твердые десенсибилизированные взрывчатые вещества
Этикетка
4.1
Класс
4.1 (F3) Легковоспламеняющиеся твердые вещества, самореактивные вещества и твердые десенсибилизированные взрывчатые вещества
Этикетка
4.1
IMDG, IATA
Класс
4.1 Легковоспламеняющиеся твердые вещества, самореактивные вещества и твердые десенсибилизированные взрывчатые вещества.
Этикетка
4,1
Группа упаковки
DOT, IMDG, IATA
II
Опасности для окружающей среды:
Загрязнение морской среды (IMDG):
Нет
Особые меры предосторожности для пользователя
Предупреждение: легковоспламеняющиеся твердые вещества, самореактивные вещества и твердые десенсибилизированные группы взрывчатых веществ
Тяжелые металлы и их соли (включая их металлоорганические соединения), порошковые металлы
Транспортировка наливом в соответствии с Приложением II к MARPOL73 / 78 и Кодексом IBC
N / A.
Транспортировка / Дополнительная информация:
DOT
Морской загрязнитель (DOT):
№
Типовой регламент ООН:
UN3089, Металлические порошки легковоспламеняющиеся, н.у.к. (Кобальтовый порошок), 4.1, II
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Нормативы / законы по безопасности, охране здоровья и окружающей среды, относящиеся к веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в списке токсичных веществ Агентства по охране окружающей среды США. Закон о контроле за веществами Реестр химических веществ.
Все компоненты этого продукта занесены в Канадский список веществ, предназначенных для домашнего использования (DSL).
SARA Раздел 313 (списки конкретных токсичных химических веществ)
7440-48-4 Кобальт
90,0%
1308-06-1 Оксид кобальта (II, III)
10,0%
Предложение штата Калифорния 65
Предложение 65 – Химические вещества, вызывающие рак
7440-48-4 Cobalt
90.0%
Prop 65 – Токсичность для развития
Ни один из ингредиентов не указан.
Предложение 65 – Токсичность для развития, женщины
Ни один из ингредиентов не указан.
Предложение 65 – Токсичность для развития, мужской
Ни один из ингредиентов не указан.
Информация об ограничении использования:
Для использования только технически квалифицированными специалистами.
Этот продукт подпадает под требования к отчетности раздела 313 Закона о чрезвычайном планировании и праве общества на информацию от 1986 года и 40CFR372.
Другие постановления, ограничения и запретительные постановления
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (EC) № 1907/2006.
Ни один из ингредиентов не указан.
Должны соблюдаться условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Ни один из ингредиентов не указан.
Приложение XIV Правил REACH (требуется разрешение на использование)
Ни один из ингредиентов не указан.
REACH – Предварительно зарегистрированные вещества
Все ингредиенты перечислены.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Вышеприведенная информация считается правильной, но не претендует на исчерпывающий характер и должна использоваться только в качестве руководства. Информация в этом документе основана на текущем уровне наших знаний и применима к продукту с учетом соответствующих мер безопасности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом.Дополнительные условия продажи см. На обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 AMERICAN ELEMENTS. ЛИЦЕНЗИОННЫМ ДАННЫМ РАЗРЕШЕНО ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННЫХ КОПИЙ БУМАГИ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
У атома кобальта 27 электронов. Сколько уровней энергии будут использовать его электроны?
Число электронов, которое может удерживать каждый энергетический уровень , увеличивается на по мере того, как вы добавляете к атому все больше и больше уровней энергии.
Связь, которая существует между энергетическим уровнем , # n #, и количеством электронов , которое он может удерживать, может быть записана следующим образом:
# цвет (синий) (| bar (ul (color (white) (a / a) “no.(-) #
и так далее.
В вашем случае кобальт # “Co” #, как говорят, имеет в общей сложности # 27 # электронов , окружающих его ядро. Эти электроны будут размещены на орбиталях в порядке , увеличивая энергию в соответствии с принципом Ауфбау .
Теперь очень важно помнить, что когда вы добавляете электронов к атому, 3d-орбитали , которые расположены на третьем энергетическом уровне , на выше по энергии на , чем 4s- орбитальный .(-) # в # 4s # подоболочка
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните значок рядом со значением выше, чтобы увидеть полную информацию о цитировании для этой записи)
Allred, A. L. «Значения электроотрицательности на основе термохимических данных». Журнал неорганической и ядерной химии, том 17, номер 3-4, 1961 г., стр. 215–221. DOI: 10.1016 /
Allred, A. L. и E.Г. Рохов. «Шкала электроотрицательности, основанная на электростатической силе». Журнал неорганической и ядерной химии, том 5, номер 4, 1958 г., стр. 264–268. DOI: 10.1016 /
Андерс, Эдвард и Николас Гревесс. «Изобилие элементов: метеоритное и солнечное». Geochimica et Cosmochimica Acta, том 53, номер 1, 1989 г., стр. 197–214. DOI: 10.1016 /
Андерсен Т., Х. К. Хауген и Х. Хотоп. «Энергии связи в атомных отрицательных ионах: III.”Journal of Physical and Chemical Reference Data, том 28, номер 6, 1999 г., стр. 1511–1533.
Барсан, Майкл Э., редактор. Карманный справочник NIOSH по химическим опасностям. Цинциннати, Огайо: NIOSH Publications, 2007.
Бацанов С.С. Ван-дер-Ваальсовые радиусы элементов. Неорганические материалы, том 37, номер 9, 2001 г., стр. 871–885. См. Реферат
Bearden, J. A., and A. F. Burr. «Переоценка рентгеновских уровней атомной энергии». Обзоры современной физики, том 39, номер 1, 1967, стр.125–142. DOI: 10.1103 /
Бедфорд, Р. Э., Дж. Бонье, Х. Маас и Ф. Павезе. «Рекомендуемые значения температуры по международной температурной шкале 1990 г. для выбранного набора вторичных контрольных точек». Метрология, том 33, номер 2, 1996 г., стр. 133–154. DOI: 10.1088 /
Боуэн, Х. Дж. М. Экологическая химия элементов. Лондон: Academic Press, Inc., 1979.
Cardarelli, François.Справочник по материалам: Краткий настольный справочник, 2-е издание. Лондон: Springer – Verlag, 2008.
Клементи, Э., и Д. Л. Раймонди. «Константы атомарного экранирования из функций SCF». Журнал химической физики, том 38,
№ 11, 1963, с. 2686–2689. DOI: 10.1063 /
Коэн, Э. Ричард, Дэвид Р. Лид и Джордж Л. Тригг, редакторы. Настольный справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации IUPAC 2005. Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверрия, Эдуард Кремадес, Флавия Барраган и Сантьяго Альварес. «Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. doi: 10.1039 /
Кронан Д. С. «Базальные металлоносные отложения восточной части Тихого океана.”Бюллетень Геологического общества Америки, том 87, номер 6, 1976 г., стр. 928–934. Doi: 10.1130 /
де Подеста, Майкл. Понимание свойств материи , 2-е издание. Лондон: Taylor & Francis, 2002.
Dronskowski, Richard. Computational Chemistry of Solid State Materials. Weinheim, Germany: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Ebbing, Darrell D., and Стивен Д. Гаммон. Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005.
Эмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я. Оксфорд: Издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание. Oxford: Oxford University Press, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С. Ширли, с помощниками редакторов Корал М. Баглин, С. Ю. Франк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc., 1996.
Fuggle, John C., and Nils Mårtensson.«Связующие энергии на уровне ядра в металлах». Журнал электронной спектроскопии и родственных явлений, том 21, номер 3, 1980 г., стр. 275–281. DOI: 10.1016 /
Гош, Дулал К. и Картик Гупта. «Новая шкала электроотрицательности 54 элементов периодической таблицы, основанная на поляризуемости атомов». Журнал теоретической и вычислительной химии, том 5, номер 4, 2006 г., стр. 895–911. DOI: 10,1142 /
Гринвуд, Н. Н., и А. Эрншоу. Химия элементов, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, 1997.
Гвин Уильямс. Энергии связи электронов. http: //
Herchenroeder, J. W., and K. A. Gschneidner. «Стабильные, метастабильные и несуществующие аллотропы». Журнал фазового равновесия, том 9, номер 1, 1988 г., стр. 2–12. DOI: 10.1007 /
Ho, C. Y., R. W.Пауэлл и П. Э. Лили. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 3, приложение 1, 1974 г., стр. С I – 1 по I – 796.
Хорват, А. Л. “Критическая температура элементов и периодическая система”. Журнал химического образования, том 50, номер 5, 1973 г., стр. 335–336. DOI: 10.1021 /
Хухи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы структуры и реакционной способности, 4-е издание.Нью-Йорк: издательство HarperCollins College, 1993.
Международная организация труда (МОТ). Международный
Карта химической безопасности кобальта. http: // 9 9
Джессбергер, Эльмар К., Александр Христофоридис и Йохен Киссель.«Аспекты основного элементного состава пыли Галлея». Природа, том 332, номер 21, 1988 г., стр. 691–695. DOI: 10.1038 /
Каксирас, Эфтимиос. Атомная и электронная структура твердых тел. Кембридж: Cambridge University Press, 2003.
Кинг, Х. У. “Температурно-зависимые аллотропные структуры элементов”. Бюллетень фазовых диаграмм сплавов, том 3, номер 2, 1982 г., стр. 275–276. DOI: 10.1007 /
Киттель, Чарльз. Введение в физику твердого тела, 8-е издание.Хобокен, штат Нью-Джерси: John Wiley & Sons, Inc., 2005.
Краузе, М. О. «Атомные радиационные и безызлучательные выходы для K и L. Shells. “Journal of Physical and Chemical Reference Data”, том 8, номер 2, 1979 г., стр. 307–327.
Леопольд, Дорин Г. и В.К. Линебергер. “Исследование низколежащих электронных состояний Fe2 и Co2 методом фотоэлектронной спектроскопии отрицательных ионов ». Журнал химической физики, том 85, номер 1, 1986, стр. 51–55. Doi: 10.1063 /
Li, Y.-H. И J. E. Schoonmaker. «Химический состав и минералогия морских отложений». С. 1–36 в Отложения, диагенез и осадочные породы. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Либофф, Ричард Л. Введение в квантовую механику, 3-е издание. Ридинг, Массачусетс: Addison Wesley Longman, Inc., 1998.
Лиде, Дэвид Р., редактор. CRC Справочник по химии и физике, 88-е издание. Бока-Ратон, Флорида: Taylor & Francis Group, 2008.
Манн, Джозеф Б., Терри Л. Мик, Юджин Т. Найт, Джозеф Ф. Капитани и Лиланд К. Аллен. «Энергии конфигурации элементов d-блока». Журнал Американского химического общества, том 122, номер 21, 2000 г., стр. 5132–5137. DOI: 10.1021 /
Мануэль, О., редактор. Происхождение элементов в Солнце Система: последствия наблюдений после 1957 г. Нью-Йорк: Kluwer Academic Publishers, 2000.
Маршалл, Джеймс Л. Открытие элементов: поиск фундаментальных принципов Вселенной, 2-е издание.Бостон, Массачусетс: Pearson Custom Publishing, 2002.
Мартин У. К. «Электронная структура элементов». Европейский физический журнал C – Частицы и поля, том 15, номер 1–4, 2000 г., стр. 78–79. DOI: 10.1007 /
Макдонаф, В. Ф. «Композиционная модель ядра Земли». стр. 547–568 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Mechtly, Евгений А. «Свойства материалов». pp. 4–1–4–33 в Справочных данных для инженеров: радио, электроника, компьютер и связь.Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Уоберн, Массачусетс: Баттерворт-Хайнеманн, 2002. DOI: 10.1016 /
Мисслер, Гэри Л. и Дональд А. Тарр. Неорганическая химия, 3-е издание. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2004.
Нэгл, Джеффри К. «Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112, номер 12, 1990 г., стр. 4741–4747. DOI: 10.1021 /
Национальный институт охраны труда и здоровья (NIOSH).Международная карта химической безопасности кобальта. http: //
Национальный институт безопасности и гигиены труда (NIOSH). Реестр токсического действия химических веществ на кобальт. http: //
Николас, Дж. В. и Д. Р. Уайт. «Температура». С. 8–41 в Измерение термодинамических свойств одиночных фаз.Под редакцией А. Р. Х. Гудвина, В. А. Уэйкхема и К. Н. Марш. Амстердам: Elsevier Science, 2003.
Орем, У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия». С. 191–222 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Oxford: Elsevier Ltd., 2005.
Oxtoby, Дэвид У., Х. П. Гиллис и Алан Кэмпион. Принципы современной химии, 6-е издание. Бельмонт, Калифорния: Томсон Брукс / Коул, 2008.
Пальм, Х. и Х. Бир. «Метеориты и состав солнечного
Фотосфера.”стр. 204–206 в Ландольте – Бернштейне – Группа VI: Астрономия и астрофизика. Под редакцией HH Voigt. Нью-Йорк: Springer – Verlag, 1993. DOI: 10.1007 /
Palme, H., and Hugh St. К. О’Нил. “Космохимические оценки мантии” Состав ». Стр. 1–38 в« Мантия и ядро ». Под редакцией Ричарда У. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Полинг, Линус. Природа химической связи, 3-е издание. Итака, штат Нью-Йорк: Корнелл. University Press, 1960.
Пирсон, Ральф Г.«Абсолютная электроотрицательность и твердость: приложение к неорганической химии». Неорганическая химия, том 27, номер 4, 1988 г., стр. 734–740. DOI: 10.1021 /
Pekka Pyykkö. Самосогласованные ковалентные радиусы 2009 г. http: //
Pyykkö, Pekka, and Michiko Atsumi. «Ковалентные радиусы молекул с двойной связью для элементов Li-E112». Химия – Европейский журнал, том 15, номер 46, 2009 г., стр.12770–12779. DOI: 10.1002 / Pyykkö, Pekka и Michiko Atsumi. «Молекулярные ковалентные радиусы одинарной связи для элементов 1-118». Химия – Европейский журнал, том 15, номер 1, 2009 г., стр. 186–197. doi: 10.1002 / Pyykkö, Pekka, Sebastian Riedel и Michael Patzschke. «Ковалентные радиусы с тройной связью». Химия – Европейский журнал, том 11, номер 12, 2005 г., стр. 3511–3520. DOI: 10.1002 / Рингнес, Виви.«Происхождение названий химических элементов». Журнал химического образования, том 66, номер 9, 1989 г., стр. 731–738. DOI: 10.1021 / Рорер, Грегори С. Структура и связь в кристаллических материалах. Кембридж: Издательство Кембриджского университета, 2001. Самсонов Г.В., редактор. Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968. Сандерсон Р. Т. Простые неорганические вещества. Малабар, Флорида: Роберт Э.Krieger Publishing Co., Inc., 1989. Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I. Общая природа». Журнал химического образования, том 65, номер 2, 1988 г., стр. 112–118. DOI: 10.1021 / Sansonetti, J. E., and W. C. Martin. «Справочник по основным данным атомной спектроскопии». Журнал физических и
Справочные данные по химии, том 34, номер 4, 2005 г., стр. 1559–2259. DOI: 10.1063 / Научная группа Thermodata Europe (SGTE).Чистые вещества: Часть 1 – Элементы и соединения от AgBr до Ba3N2. Под редакцией И.
Уртадо и Д. Нойшютц. Берлин: Springer-Verlag, 1999. doi: 10.1007 / Шеннон Р. Д. «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta Crystallographica Раздел A, том 32, номер 5, 1976 г., стр. 751–767. DOI: 10.1107 / Силби, Роберт Дж., Роберт А. Олберти и Мунги Г.Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005. Сингман, Чарльз Н. “Атомный объем и аллотропия элементов”. Журнал химического образования, том 61, номер 2, 1984 г., стр. 137–142. DOI: 10.1021 / Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал
Химическая физика, том 41, номер 10, 1964, стр. 3199–3204. doi: 10.1063 / Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга.”Химический журнал
Образование, том 67, номер 11, 1990 г., стр. 911–914. DOI: 10.1021 / Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии. Кембридж: Кембриджский университет
Press, 1990. Стюарт Г. Р. “Измерение низкотемпературной удельной теплоемкости”. Обзор научных инструментов, том 54, номер 1, 1983 г., стр. 1–11. DOI: 10.1063 / Стюарт, Г. Р. “Измерение низкотемпературной удельной теплоемкости.”Review of Scientific Instruments, volume 54, number 1, 1983, pp. 1–11. Doi: 10.1063 / Sugar, Jack, and Charles Corliss.” Уровни атомной энергии элементов железного периода: от калия до Никель. “Журнал физических и химических справочных данных”, том 14, номер 2, 1985, стр. 1–664. Тари, А. Низкая удельная теплоемкость вещества
Температуры. Лондон: Imperial College Press, 2003. Вайнштейн, Борис К., Владимир М. Фридкин и Владимир Л.Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2. Под ред. Б. К. Вайнштейна, А. А. Чернова, Л. А. Шувалова. Берлин: Springer-Verlag, 1995. Фойгт, Х. Х., редактор. Ландольт – Бёрнштейн — Астрономия и астрофизика VI группы. Берлин: Springer – Verlag, 1993. Waber, J. T., and Don T. Cromer. «Радиусы орбит атомов и ионов». Журнал химической физики, том 42, номер 12, 1965, стр. 4116–4123. DOI: 10.1063 / Вагман, Дональд Д., Уильям Х. Эванс, Вивиан Б. Паркер, Ричард Х. Шумм, Ива Халоу, Сильвия М. Бейли, Кеннет Л. Черни и Ральф Л. Наттолл. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 11, приложение 2, 1982 г., стр. 2–1–2–392. Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э.
Троски и Джошуа Дж. Пирсон. “Процентные оценки, основанные на эффективном ядерном заряде Слэтера, как универсальный инструмент для обучения периодическим тенденциям.”Журнал химического образования, том 78, номер 5, 2001 г., стр. 635–639. Doi: 10.1021 / Weeks, Мэри Эльвира и Генри М. Лестер. Открытие элементов”, 7-е издание. Истон, США. PA: Journal of Chemical Education, 1968. Визер, Майкл Э. и Тайлер Б. Коплен. «Атомные веса элементов 2009 (Технический отчет ИЮПАК)». Чистая и прикладная химия, том 83, номер 2, 2011 г., стр. 359–396. doi: 10.1351 / Yaws, Карл Л.«Жидкая плотность элементов». Химическая инженерия, том 114, номер 12, 2007 г., стр. 44–46. Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws. Хьюстон, Техас: Gulf Publishing Company, 2005. Зарецкий Э. Б. «Реакция кобальта на удар в температурном диапазоне 300–1400 К». Журнал прикладной физики, том 108,
№ 8, 2010 г., с. 083525–1–083525–7. doi: 10.1063 / Практически все исследования поведения электрокатализаторов основаны на измерениях больших ансамблей объемного материала. часто наносится на неактивный носитель, например уголь (1, 2).Такие измерения позволяют только изучить поведение ансамбля, чтобы получить средние свойства электрокаталитических центров или молекул в образце. В этой статье мы демонстрируем, что можно подготовить и провести измерения на изолированных одиночных молекулах (или небольших кластерах), чтобы определить их индивидуальную активность. Это позволяет определить влияние структуры активного центра на каталитические свойства. В предыдущей работе этой лаборатории мы описали электроосаждение одиночных атомов платины (Pt 1 ) на висмут и свинец на ультрамикроэлектродах (УМЭ) нанометрового размера, а также на небольших кластерах (Pt n ) n = 2–9 (3, 4).Результаты показали, что хотя один атом платины показал более высокую скорость реакции выделения водорода (HER) по сравнению с материалом носителя, каталитическая скорость увеличивалась с увеличением размера кластера и в конечном итоге приближалась к скорости основной массы платины. В этой статье мы используем аналогичную стратегию для соединения или молекулярного катализатора, оксида переходного металла, Co n O y, для реакции выделения кислорода (OER). Это расширяет одноатомный или -молекулярный подход на более сложные системы для другой, более сложной электрокаталитической реакции (5).Катализ объемного материала был изучен с помощью ряда переходных металлов, например оксидов Co, Ni, Fe и Mn, с помощью ансамблевых измерений (6⇓⇓⇓ – 10). Катализаторы на основе оксидов переходных металлов для ООР часто получают электроосаждением (11–13). Здесь мы сообщаем об электроосаждении изолированной молекулы оксида кобальта, содержащей один ион Co и кластеры (с n > 1), причем каждый ион кобальта координирован с несколькими ионами оксида, например, мы предполагаем, что молекула с одним ионом Co координирована с до шести оксидов в октаэдрической структуре.Фактически, кластер с одним ионом кобальта показал более высокую активность ОЭР, чем кластеры большего размера. Результаты этого исследования демонстрируют, что атомный подход для катализатора Pt HER одинаково хорошо работает для молекулярных оксидных соединений для OER. Кроме того, этот метод электрохимической визуализации предлагает альтернативный подход для характеристики внутренней активности электрокатализаторов OER. Как показано на рис.1 эксперимент проводится в два этапа. Первый, A, представляет собой электроосаждение отдельной молекулы или кластера путем окисления Co (II). Наноэлектрод из углеродного волокна использовался в качестве подложки для загрузки катализатора, поскольку углерод демонстрирует низкую кинетическую скорость для OER (низкий фоновый ток и широкое окно потенциала) ( SI Приложение , рис. S1). Детали экспериментов по приготовлению углеродного UME с нанометровым размером ( Материалы и методы ) и его характеристики ( SI Приложение , рис.S2) (14). Процедура осаждения молекул оксида металла и кластера и определения размера соответствует предыдущим исследованиям осаждения атомов Pt. Использование UME из углеродного волокна с радиусом 80 нм для осаждения обычно приводит к зародышеобразованию только в одном месте, как показано во многих исследованиях зародышеобразования и роста (N&G). Раствор для электроосаждения представляет собой нитрат кобальта в 0,1 М фосфатном буфере (pH 7,4) по электродной реакции Co 2+ + 2H 2 O → CoOOH + 3H + + e –. Принципиальная схема электроосаждения ( A ) и катализа ( B ). Метод электроосаждения ( A ) изолированной одиночной молекулы Co 1 O x и кластеров Co n O y на поверхность углеродного наноэлектрода и электрокатализа ( B ) выделения кислорода. Осаждение и катализ проводили в двух отдельных ячейках, где ( A ) раствор 1 представлял собой 900 фМ Co 2+ , растворенных в 0.1 М фосфатный буфер (PBS, pH 7,4) и ( B ) раствор 2 был 10 мМ NaOH и 0,2 М NaClO 4 . Предполагается, что среднее количество осажденных электронов ограничено диффузионным потоком иона кобальта в UME, что приводит к уравнению для частоты осаждения Co f = 4DCoCCoaNA, [1] где D Co – коэффициент диффузии Co 2+ (6.5 × 10 −6 cm 2 ⋅s −1 ) (15, 16), C Co – концентрация Co 2+ (900 фемтомолярных , fM, для осаждения в среднем одного атома Co), N A – это число Авогадро, а a – радиус (80 нм) дискообразного наконечника углеродного UME.Следовательно, частота составляет около 0,1 Гц или один ион Co 2+ осаждается каждые 10 с. На основе этой информации можно оценить среднее количество ионов кобальта, столкнувшихся с поверхностью углеродного UME, и контролировать его концентрацию и время осаждения. При доступной чувствительности ток во время потенциального импульса для осаждения (рис. 1 A ) не может быть измерен. Обратите внимание, что при pH раствора для осаждения заметного выделения кислорода не происходит. Исследования N&G объемных оксидов металлов подтвердили, что исходные зародыши, образовавшиеся на углероде, состояли из прерывистых островков наночастиц оксида кобальта (17).Зарождение анодного электроосаждения происходило последовательно, и скорость определялась диффузией Co 2+ к поверхности электрода, а также количеством поверхностных активных центров. Но, N&G очень маленьких отложений на микро- или наноэлектродах из фемтомолярных предшественников отличается от классической термодинамической теории зародышеобразования, которая полагается на коэффициент рождаемости и смертности, чтобы определить время индукции для этого критического ядра, чтобы сформироваться, а затем расти (18 ⇓ – 20).Многие предыдущие исследования показали, что время индукции для образования критического кластера зависит от концентрации прекурсора, а время индукции N&G из фемтомолярного прекурсора будет неоправданно длиннее, чем то, которое мы действительно наблюдали (3, 21–2). 23). А именно, классическая теория никогда не допустит осаждения отдельного атома или небольших кластеров. Однако катализ OER можно наблюдать уже через несколько секунд электроосаждения. Предложенная нами модель осаждения одной молекулы зависит от наличия активных центров, которые могут стабилизировать даже отдельные атомы или молекулы.В этом исследовании углеродная поверхность может предложить энергетически выгодные активные центры для осаждения ионов кобальта, особенно в пределах фемтомолярного предшественника. Поскольку используется анодное осаждение, во время электроосаждения на поверхности углерода образуются формы кислорода. Таким образом, кислородсодержащие сайты, такие как гидроксил и карбоксил, могут способствовать связыванию ионов Со. Из-за относительно небольшого количества центров зародышеобразования на очень маленьком наноэлектроде и благоприятного роста на оксиде кобальта вместо углерода кластеры Co n O y с большей вероятностью будут впоследствии образовываться на начальном ядре путем самосборки после окисление Co 2+ до Co 3+ (17, 24, 25). Как показано на рис. 1 B после этапа осаждения электрокаталитическая амплификация путем проведения ООР окислением гидроксид-ионом (4OH – → O 2 + 2H 2 O + 4e – ) на нанесенный оксид кобальта использовали для характеристики катализатора и оценки размера осадка. Раствор для этой стадии, 10 мМ NaOH и 0,2 М NaClO 4 , показал достаточно большие токи, чтобы наблюдать стационарный вольтамперометрический отклик даже с одной молекулой.Концентрации гидроксид-иона и электролита были подходящими, чтобы избежать образования пузырьков кислорода и подавить миграцию OH – и эффект диффузного слоя к очень маленьким кластерам оксида кобальта. Основываясь на экспериментах с различными анионами, мы не обнаружили поверхностных эффектов ClO 4 – в условиях этого эксперимента и не нашли предшествующей литературы, которая предполагает специфическую адсорбцию перхлорат-аниона. Эквивалентный радиус отложения, предполагаемого полусферой на инертной планарной подложке, был рассчитан из предельного тока полученных вольтамперограмм (3, 4, 26): ilim = nF (2π) DOHCOHrd, [2] где n – перенос электрона при окислении гидроксид-иона ( n = 1), D OH – коэффициент диффузии гидроксид-иона (5.23 × 10 −5 ⋅cm 2 ⋅s −1 ), C OH – концентрация гидроксид-иона (например, 10 мМ), а r d – эквивалентный радиус Депозит. Это уравнение предполагает, что только диффузия гидроксида способствует ограничивающему току. Возможно, что миграция также способствует массопереносу в залежь. Хотя в некоторых теоретических работах описан такой вклад в наноразмерные электроды (27, 28), об экспериментальных исследованиях в этой области не сообщалось, а ключевые факторы, такие как электрическое поле двойного диффузного слоя, для таких небольших отложений, которые рассматриваются здесь, являются Неизвестный.Таким образом, диффузионная модель представляется разумной для представленных здесь оценок. Вольтамперограмма позволяет оценить размер отложения по предельному току. Он также позволяет измерять относительную каталитическую активность по полуволновому потенциалу или потенциалам при небольшой плотности тока. На рис. 2 A показаны вольтамперограммы изолированных кластеров Co 1 O x и Co n O y ( n = 2, 3, 4…) на углеродном наноэлектроде с эквивалентными радиусами. от 0.От 21 до 1,29 нм в 10 мМ OH –. Наименьший размер, найденный электроосаждением по формуле. 2 составляет ∼0,2 нм, что близко к структурному параметру заявленного расстояния Co-O в выделяющей кислород единице октаэдров CoO 6 (1,89 Å), измеренной с помощью рентгеновской абсорбционной спектроскопии (XAS). (29). Более того, кристаллографические данные Co (III) -содержащих оксидов, таких как Co 2 O 3 , Co 3 O 4 и CoO (OH), показывают, что длина связи Co – O в кристаллах составляет около 1 .9–2,2 Å, близко к осадку с эквивалентным радиусом 0,21 нм, найденным для одиночной молекулы Co 1 O x . Во всех контрольных испытаниях в отсутствие этапа электроосаждения подобных вольтамперограмм для ОЭР, даже очень малых, не наблюдалось. Вольтамперограммы кластеров разного размера. ( A ) Типичные вольтамперограммы изолированных Co 1 O x и Co n O y кластеров в 10 мМ NaOH и 0.2 M NaClO 4 , скорость сканирования: 10 мВ с −1 . Эквивалентные радиусы кластеров оценивались по предельному току окисления гидроксид-иона. Для наглядности здесь показаны только прямые сканирования. Полные циклические вольтамперограммы (ЦВА) показаны в Приложении SI , рис. S3. ( Врезка ) Увеличенное изображение типичной вольтамперограммы для наименьшего кластера, полученного в этой работе, который, как предполагается, представляет собой одиночную молекулу Co 1 O x , состоящую только из одного иона кобальта и нескольких кислородных групп.( B ) Предельные токи кластеров в зависимости от расчетных эквивалентных радиусов. Столбики показывают стандартные отклонения (SD), рассчитанные на основе вольтамперограмм шести последовательных испытаний для каждого размера. Конечно, для подтверждения электрохимических результатов было бы желательно определение характеристик с помощью электронного микроскопа, например, с помощью сканирующей просвечивающей электронной микроскопии (STEM). Сложность удаления углеродного UME с радиусом поверхности около 80 нм из водной среды осаждения в высокий вакуум STEM с последующим обнаружением единственной молекулы огромна и, насколько нам известно, еще не решена.Однако в настоящее время мы изучаем методологии, которые могут сделать это возможным. Фактически, уникальность этого подхода к электрохимической визуализации, который мы предложили здесь для характеристики отдельных изолированных молекул и кластеров, является одной из важных особенностей метода, как мы обсуждали в нескольких других публикациях (3, 4). Модель Co 1 O x в зависимости от размера и ее эквивалентная оценка радиуса показаны на рис. 3. Кроме того, другие модели Co n O y ( n = 2, 3 и 4) кластеры показывают соответствующие расчетные радиусы для ближайших полушарий, где длины основаны на данных XAS для объемного катализатора Co-Pi (29).Для более крупных кластеров труднее оценить реальное число атомов только по эквивалентному радиусу из-за разного соотношения атомов кобальта и кислорода, а также структурных сложностей упаковки атомов с увеличением размера. На рис. 2 B показаны графики зависимости предельного тока от эквивалентных радиусов кластеров для осаждения изолированных кластеров оксида кобальта из фемтомолярного раствора Co 2+ . В таблице 1 также приведены предельный ток ( i l im ) и полуволновой потенциал (E 1/2 ) различных радиусов кластеров Co n O y .Как обсуждалось выше, существуют некоторые неточности в отношении радиуса кластера и числа ионов кобальта. Стандартные отклонения (SD) предельных токов, как показано на рис. 2 B и в таблице 1, могут привести к незначительным погрешностям в расчетных радиусах. Кроме того, неопределенности могут также возникать из-за геометрического фактора (уравнение 2 ), который основан на предположении о полусферической модели по сравнению со сферой, как мы обсуждали в нескольких других публикациях (3, 26). Поскольку точные структуры кластеров оксида кобальта неизвестны, расчетное число ионов кобальта в этом исследовании относится к заявленному расстоянию между соседними сайтами Co и O независимо от конкретных групп кислорода (= O, -OH или -H 2 O), скоординированных. с Со (29).Фактически, мы никогда не получали кластеры меньшего размера, чем тот, который мы описали как одиночную молекулу Co 1 O x в наших экспериментах. Схематическое строение кластеров оксида кобальта. Модели одиночной молекулы Co 1 O x и кластеров Co n O y ; кислородная группа: пурпурный шар; кобальт: розовая сфера; атомы водорода в кислородных группах в этих моделях опущены. Стрелки указывают эквивалентные радиусы полушарий на основе сообщенных расстояний Co-O и Co-Co. Данные вольтамперометрии изолированных Co n O y кластеров разного размера Здесь вольтамперограмма является функцией двух параметров: предельного тока, который зависит от размера, и потенциала , которая является функцией кинетики и массопереноса. Таким образом, можно легко различить кластеры разного размера, а сдвиг потенциала подразумевает изменения в массопереносе и кинетике. Для возможного случая нескольких отдельных отложений он не должен отображать разность потенциалов, а только приращение предельного тока.Однако в большинстве экспериментов, которые мы проводили подобным образом, очень редко можно было найти две отдельные частицы, например, всегда есть очевидный сдвиг потенциала ∼40 мВ при данной плотности тока (рис. 4, как обсуждается в следующем разделе). участок) между Co 1 O x и Co 2 O y . По сути, зародышеобразование и рост на UME нанометрового размера, скорее всего, дадут один центр зародышеобразования, а не два отдельных зародыша. Анализ относительной кинетики ООР.( A ) Поведение плотности тока и потенциала по вольтамперограммам на рис. 2 A (предполагаемая площадь эквивалентного радиуса полусферы). Плотности тока нормированы на геометрическую площадь поверхности полусферы. ( B ) Соответствующий потенциал при плотности тока 2.5 пА нм −2 в зависимости от радиусов кластеров Co n O y . Осаждение кластеров каждого размера повторяли пять раз в точно таких же условиях.Стандартные значения рассчитывались по полученным вольтамперограммам. Относительная зависящая от размера каталитическая активность изолированных кластеров Co n O y для OER была оценена из относительного потенциала E k при заданной низкой плотности тока, как показано на рис. последний столбец таблицы 1. Плотность тока была выбрана в той области вольтамперограммы, где кинетика вносит большой вклад по сравнению с массопереносом.Из результатов на рис. 4 A и в таблице 1, Co 1 O x (кривая A) показывает наименьший положительный потенциал, что указывает на самую высокую скорость в этой группе кривых. Разница потенциалов между самым маленьким и самым большим кластерами составляет около 120 мВ. Рис. 4 B суммирует потенциал при 2,5 пА нм -2 против эффективных радиусов кластеров, где потенциал смещается в положительном направлении с увеличением размера кластеров. Это указывает на то, что один кластер ионов кобальта показывает наименьшее перенапряжение для OER.Число переноса заряда в соответствии с плотностью тока 2,5 пА · нм -2 , которую мы выбрали здесь, составляет около 1,5 × 10 7 электронов в секунду. Следовательно, Co 1 O x , минимальная единица в хорошо известных катализаторах OER на основе кобальта, показывает лучшую активность. Обнаруженная здесь кинетика, зависящая от размера, противоположна кинетике атомов и кластеров платины, найденной для HER, где более крупные кластеры и наночастицы показывают меньшее перенапряжение (а объемный материал показывает самую высокую кинетическую скорость) (3, 4).В структуре электроосажденного оксида кобальта Co (IV), вероятно, является активным центром для катализирования OER (5, 29). По мере увеличения размера кластера сайты Co (IV) на единицу площади становятся менее доступными, поскольку большее количество сайтов Co под поверхностным слоем не может участвовать в реакции. В дополнение к этому, кластеры разного размера могут также демонстрировать изменяющуюся каталитическую активность для OER. Хотя реальная структура и каталитический механизм одиночных молекул и кластеров оксида кобальта все еще неизвестны, пока трудно подтвердить доказательства этого эффекта. Время электроосаждения в этой статье зависит от среднего количества Co 2+ , диффундирующего к электроду в соответствии с формулой. 1 . Однако концентрация Co 2+ является стохастической и всегда дает результат n = 0, 1, 2,…, что хорошо соответствует распределению Пуассона, как сообщалось ранее для осаждения Pt 1 (3, 4). Мы провели 20 независимых испытаний при среднем состоянии ионов 1 Co. SI Приложение , рис. S4 показывает вольтамперограммы этих испытаний с предельными токами, соответствующими 0, 1, 2… Co в отложениях. Распределение отложений представлено на гистограмме (рис. 5) и хорошо согласуется с вычисленным распределением вероятностей Пуассона: P (k, λ) = λke − λ / k!, [3] где λ – среднее число ионов кобальта (здесь λ = 1), а k – возможное число (здесь k = 0, 1, 2…). Соответствующая вероятность для P ( k , λ ) равна P (0, 1) = 37%, P (1, 1) = 37%, P (2, 1) = 18%, P (3, 1) = 6% и P (4, 1) = 1%.Экспериментальный подсчет очень близок к теоретическому распределению Пуассона, что указывает на стохастический характер осаждения. Более крупные кластеры с более длительным временем осаждения труднее предсказать с помощью вышеупомянутого стохастического исследования, поскольку теоретическое распределение Пуассона расширяется, и вероятность точного осаждения определенного количества атомов кобальта в оксидные кластеры уменьшается. В этом расчете мы предполагаем вероятность прилипания 1. Статистические распределения количества ионов кобальта, нанесенных за 10 с.Гистограмма экспериментального распределения Co n O y ( n = 0, 1, 2, 3 или 4, n оценена по моделям на рис. Распределение Пуассона при времени осаждения 10 с. Полный ответ: Поатомное электроосаждение отдельных изолированных молекул и кластеров оксида кобальта для изучения реакции выделения кислорода
Результаты и обсуждение
Протокол эксперимента.
Определение характеристик методом электрокаталитического усиления.
Анализ вольтамперограмм.
Размерно-зависимая кинетика ООР.
Стохастическая электрохимия при осаждении Co
1 O x . Какова электронная конфигурация для кобальта z 27 химический класс 10 CBSE
Подсказка: Электронная конфигурация любого элемента сообщает нам общее количество электронов, присутствующих в этом атоме. Он идентифицируется по атомному номеру, поскольку атомный номер атома сообщает нам общее количество электронов в этом атоме.Электронная конфигурация требует заполнения орбитальных или субоболочек (s, p, d, f) в соответствии с принципом Ауфбау.
Электронная конфигурация любого атома сообщает нам общее количество электронов, которое равно общему количеству протонов в этом атоме, которое равно атомному номеру этого элемента.
