периодическая таблица Менделеева — Наука
У каждой области науки есть свой любимый юбилей. У физиков это «Принципы» Ньютона, книга 1687 года, которая ввела законы движения и гравитации. Биологи празднуют дарвиновское «Происхождение видов» (1859 год) и его день рождения (1809). Астрономы отмечают 1543 год, ведь именно тогда Коперник поместил Солнце в центр Солнечной системы. Что касается химии, ни одна причина для празднования не превзойдет появление периодической таблицы элементов, созданной 150 лет назад в марте русским химиком Дмитрием Ивановичем Менделеевым.

Таблица Менделеева стала такой же привычной для студентов-химиков, как калькуляторы для бухгалтеров. Она содержит всю науку в чуть более сотне квадратов, содержащих символы и цифры. Она перечисляет элементы, которые составляют все земные вещества, сгруппированные таким образом, чтобы можно было выявить закономерности в их свойствах, определить цель химического исследования как в теории, так и на практике.
Периодическая таблица — это, бесспорно, самая важная концепция в химии.
Таблица Менделеева выглядела как специальная таблица, однако сам он хотел, чтобы она отражала глубокую научную истину, которую он открыл: периодический закон. Его закон выявил глубокие семейные отношения между известными химическими элементами – они проявляют подобные свойства через регулярные промежутки (или периоды), если расположить их в порядке атомного веса – и позволил Менделееву предсказать существование элементов, которые еще не были обнаружены.
«До обнародования этого закона химические элементы были просто фрагментарными, случайными фактами в Природе», заявил Менделеев. «Закон периодичности впервые позволил нам увидеть неоткрытые элементы на расстоянии, которое раньше было недоступно для химического зрения».

Таблица Менделеева не только предсказала существование новых элементов. Она подтвердила тогда еще спорную веру в реальность атомов. Она намекнула на существование субатомной структуры и предвидела математический аппарат, лежащий в основе правил, управляющих материей, которые в конечном счете проявили себя в квантовой теории. Его таблица завершила превращение химической науки из средневекового магического мистицизма алхимии в область современной научной строгости. Периодическая таблица символизирует не столько составляющие вещества, сколько логическую стройность и принципиальную рациональность науки в целом.
Как создавалась периодическая таблица
Легенда гласит, что Менделеев задумал и создал свою таблицу в один день: 17 февраля 1869 года по русскому календарю (для большей части мира это 1 марта). Но это, вероятнее всего, преувеличение. Менделеев думал о группировании элементов годами, и другие химики несколько раз рассматривали понятие связей между элементами в предыдущие десятилетия.
На самом деле, немецкий физик Иоганн Вольфганг Доберейнер заметил особенности группирования элементов еще в 1817 году. В те дни химики еще не полностью поняли природу атомов, описанную атомной теорией Джона Дальтона в 1808 году. В своей «новой системе химической философии» Дальтон объяснил химические реакции, предполагая, что каждое элементарное вещество состоит из атома определенного типа.
Дальтон предположил, что химические реакции производили новые вещества, когда атомы разъединяются или соединяются. Он полагал, что любой элемент состоит исключительно из одного вида атома, который отличается от других по весу. Атомы кислорода весили в восемь раз больше, чем атомы водорода. Дальтон считал, что атомы углерода в шесть раз тяжелее водорода. Когда элементы объединяются для создания новых веществ, количество реагирующих веществ может быть рассчитано с учетом этих атомных весов.
Дальтон ошибался насчет некоторых масс – кислород в действительности в 16 раз тяжелее водорода, а углерод в 12 раз тяжелее водорода. Но его теория сделала идею об атомах полезной, вдохновив революцию в химии. Точное измерение атомной массы стало основной проблемой химиков на последующие десятилетия.
Размышляя об этих весах, Доберейнер отметил, что определенные наборы из трех элементов (он назвал их триадами) показывают интересную связь. Бром, например, имел атомную массу где-то между массами хлора и йода, и все эти три элемента демонстрировали сходное химическое поведение. Литий, натрий и калий также были триадой.
Другие химики заметили связи между атомными массами и химическими свойствами, но лишь в 1860-х годах атомные массы стали достаточно хорошо поняты и измерены, чтобы выработалось более глубокое понимание. Английский химик Джон Ньюландс заметил, что расположение известных элементов в порядке увеличения атомной массы приводило к повторению химических свойств каждого восьмого элемента. Эту модель он назвал «законом октав» в статье 1865 года. Но модель Ньюландса не очень хорошо держалась после первых двух октав, что заставило критиков предложить ему расставить элементы в алфавитном порядке. И как вскоре понял Менделеев, отношение свойств элементов и атомных масс были чуть более сложными.
Организация элементов
Менделеев родился в Тобольске, в Сибири, в 1834 году и был семнадцатым ребенком у своих родителей. Он жил яркой жизнью, преследуя разные интересы и путешествуя по дороге к выдающимся людям. Во время получения высшего образования в педагогическом институте в Санкт-Петербурге он чуть не умер от тяжелой болезни. После окончания он преподавал в средних школах (это нужно было, чтобы получать жалование в институте), попутно изучая математику и естественные науки для получения степени магистра.
Затем он работал преподавателем и лектором (и писал научные работы), пока не получил стипендию для расширенного тура исследований в лучших химических лабораториях Европы.
Вернувшись в Санкт-Петербург, он оказался без работы, поэтому написал превосходное руководство по органической химии в надежде выиграть крупный денежный приз. В 1862 году это принесло ему премию Демидова. Также он работал редактором, переводчиком и консультантом в различных химических сферах. В 1865 году он вернулся к исследованиям, получил доктора наук и стал профессором Петербургского университета.
Вскоре после этого Менделеев начал преподавать неорганическую химию. Готовясь освоить это новое (для него) поле, он остался неудовлетворен доступными учебниками. Поэтому решил написать собственный. Организация текста требовала организации элементов, поэтому вопрос их наилучшего расположения непрестанно был у него на уме.
К началу 1869 года Менделеев добился достаточного прогресса, чтобы понять, что некоторые группы подобных элементов демонстрировали регулярное увеличение атомных масс; другие элементы с примерно одинаковыми атомными массами имели схожие свойства. Оказалось, что упорядочение элементов по их атомному весу было ключом к их классификации.

По собственным словам Менделеева, он структурировал свое мышление, записав каждый из 63 известных тогда элементов на отдельной карточке. Затем, посредством своего рода игры в химический пасьянс, он нашел закономерность, которую искал. Располагая карточки в вертикальных столбцах с атомными массами от низкой к более высокой, он разместил элементы со схожими свойствами в каждом горизонтальном ряд. Периодическая таблица Менделеева родилась. Он набросал черновую версию 1 марта, отправил ее в печать и включил в свой учебник, который скоро должен был быть опубликован. Также он быстро подготовил работу для представления Российскому химическому обществу.
«Элементы, упорядоченные по размерам их атомных масс, показывают четкие периодические свойства», писал Менделеев в своей работе. «Все сравнения, которые я провел, привели меня к выводу, что размер атомной массы определяет природу элементов».
Тем временем, немецкий химик Лотар Мейер также работал над организацией элементов. Он подготовил таблицу, похожую на менделеевскую, возможно, даже раньше, чем Менделеев. Но Менделеев издал свою первым.
Тем не менее, гораздо более важным, чем победа над Мейером, было то, как Менделеев использовал свою таблицу, чтобы сделать смелые прогнозы о неоткрытых элементах. В подготовке свой таблицы Менделеев заметил, что некоторых карточек недоставало. Он должен был оставить пустые места, чтобы известные элементы могли выровняться правильно. Еще при его жизни три пустых места были заполнены ранее неизвестными элементами: галлий, скандий и германий.
Менделеев не только предсказал существование этих элементов, но также правильно описал их свойства в подробностях. Галлий, например, открытый в 1875 году, имел атомную массу 69,9 и плотность в шесть раз превышающую воды. Менделеев предсказал этот элемент (он назвал его экаалюминий), только по этой плотности и атомной массе 68. Его прогнозы для экакремния близко соответствовали германию (открытому в 1886 году) по атомной массе (72 предсказано, 72,3 фактически) и плотности. Он также верно предсказал плотность германиевых соединений с кислородом и хлором.
Таблица Менделеева стала пророческой. Казалось, что в конце этой игры этот пасьян из элементов раскроет тайны Вселенной. При этом сам Менделеев был мастером в использовании своей же таблицы.
Успешные предсказания Менделеева принесли ему легендарный статус мастера химического волшебства. Но сегодня историки спорят о том, закрепило ли открытие предсказанных элементов принятие его периодического закона. Принятие закона могло быть в большей степени связано с его способностью объяснять установленные химические связи. В любом случае, прогностическая точность Менделеева, безусловно, привлекла внимание к достоинствам его таблицы.
К 1890-м годам химики широко признали его закон как веху в химическом познании. В 1900-м году будущий нобелевский лауреат по химии Уильям Рамсей назвал это «величайшим обобщением, которое когда-либо проводилось в химии». И Менделеев сделал это, сам не понимая как.
Математическая карта
Во многих случаях в истории науки великие предсказания, основанные на новых уравнениях, оказывались верными. Каким-то образом математика раскрывает некоторые природные секреты, прежде чем экспериментаторы их обнаружат. Один из примеров — антиматерия, другой — расширение Вселенной. В случае Менделеева, предсказания новых элементов возникли без какой-либо творческой математики. Но на самом деле Менделеев открыл глубокую математическую карту природы, поскольку его таблица отражала значение квантовой механики, математических правил, управляющих атомной архитектурой.
В своей книге Менделеев отметил, что «внутренние различия материи, которую составляют атомы», могут быть ответственны за периодически повторяющиеся свойства элементов. Но он не придерживался этой линии мышления. По сути, многие годы он размышлял о том, насколько важна атомная теория для его таблицы.
Но другие смогли прочитать внутреннее послание таблицы. В 1888 году немецкий химик Йоханнес Вислицен объявил, что периодичность свойств элементов, упорядоченных по массе, указывает на то, что атомы состоят из регулярных групп более мелких частиц. Таким образом, в некотором смысле таблица Менделеева действительно предвидела (и предоставила доказательства) сложную внутреннюю структуру атомов, в то время как никто не имел ни малейшего представления о том, как на самом деле выглядел атом или имел ли он какую-нибудь внутреннюю структуру вовсе.
К моменту смерти Менделеева в 1907 году ученые знали, что атомы делятся на части: электроны, переносящие отрицательный электрический заряд, плюс некоторый положительно заряженный компонент, делающий атомы электрически нейтральными. Ключом к тому, как эти части выстраиваются, стало открытие 1911 года, когда физик Эрнест Резерфорд, работающий в Манчестерском университете в Англии, обнаружил атомное ядро. Вскоре после этого Генри Мозли, работавший с Резерфордом, продемонстрировал, что количество положительного заряда в ядре (число протонов, которое он содержит, или его «атомное число») определяет правильный порядок элементов в периодической таблице.

Атомная масса была тесно связана с атомным числом Мозли — достаточно тесно, чтобы упорядочение элементов по массе только в нескольких местах отличалось от упорядочения по числу. Менделеев настаивал на том, что эти массы были неправильными и нуждались в повторном измерении, и в некоторых случаях оказался прав. Осталось несколько расхождений, но атомное число Мозли прекрасно легло в таблицу.
Примерно в то же время датский физик Нильс Бор понял, что квантовая теория определяет расположение электронов, окружающих ядро, и что самые дальние электроны определяют химические свойства элемента.
Подобные расположения внешних электронов будут периодически повторяться, объясняя закономерности, которые первоначально выявила таблица Менделеева. Бор создал свою собственную версию таблицы в 1922 году, основываясь на экспериментальных измерениях энергий электронов (наряду с некоторыми подсказками из периодического закона).
Таблица Бора добавила элементы, открытые с 1869 года, но это был тот же периодической порядок, открытый Менделеевым. Не имея ни малейшего представления о квантовой теории, Менделеев создал таблицу, отражающую атомную архитектуру, которую диктовала квантовая физика.
Новая таблица Бора не стала ни первым, ни последним вариантом изначального дизайна Менделеева. Сотни версий периодической таблицы с тех пор были разработаны и опубликованы. Современная форма — в горизонтальном дизайне в отличие от первоначальной вертикальной версии Менделеева — стала широко популярной только после Второй мировой войны, во многом благодаря работе американского химика Гленна Сиборга.
Сиборг и его коллеги создали несколько новых элементов синтетически, с атомными числами после урана, последнего природного элемента в таблице. Сиборг увидел, что эти элементы, трансурановые (плюс три элемента, предшествовавшие урану), требовали новой строки в таблице, которую не предвидел Менделеев. Таблица Сиборга добавила строку для тех элементов под аналогичным рядом редкоземельных элементов, которым тоже не было места в таблице.
Вклад Сиборг в химию принес ему честь назвать собственный элемент — сиборгий с номером 106. Это один из нескольких элементов, названных в честь известных ученых. И в этом списке, конечно, есть элемент 101, открытый Сиборгом и его коллегами в 1955 году и названный менделевием — в честь химика, который прежде всех остальных заслужил место в периодической таблице.
onauke.info
Предсказанные Менделеевым элементы — Википедия
Материал из Википедии — свободной энциклопедии
Периодическая система Д. И. Менделеева (1871 год)В 1869 году Дмитрий Иванович Менделеев опубликовал Периодическую таблицу элементов, в которой химические элементы были расположены в соответствии с наличием у них сходных свойств в порядке возрастания атомного веса[1].
В отличие от работ предшественников Менделеев исходил из допущения существования еще не открытых элементов на основе периодического изменения физических и химических свойств известных элементов. Им были оставлены в таблице пустые ячейки для ещё не открытых элементов и предсказаны их свойства. Чтобы дать предсказанным элементам «временные» названия, Менделеев использовал приставки «эка», «дви» и «три» (от санскритских слов «один», «два» и «три»), в зависимости от того, на сколько позиций вниз от уже открытого элемента с похожими свойствами находился предсказанный элемент. Так, германий до своего открытия в 1886 году носил название «экасилиций», а рений, открытый в 1926 году, назывался «двимарганец».
Первоначальные предсказания (1869—1870 годы)[править | править код]
Уже в первом варианте Периодической таблицы, опубликованном Д. И. Менделеевым в 1869 году, включено больше элементов, чем их было открыто на тот момент. В нём оставлены четыре свободные ячейки для еще неизвестных элементов и указаны их атомные веса (в «паях», близких по значению к массе атома водорода).
Развивая в 1869—1871 годах идеи периодичности, Д. И. Менделеев ввёл понятие о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов. Для предсказания свойств простых веществ и соединений он исходил из того, что свойства каждого элемента являются промежуточными между соответствующими свойствами двух соседних элементов в группе периодической таблицы, двух соседних элементов в периоде и элементов по диагонали — так называемое «правило звезды». На этой основе, в частности, опираясь на результаты изучения последовательности изменения стеклообра
ru.wikipedia.org
Когда была открыта периодическая система Менделеева: предпосылки и последствия
Периодическая система химических элементов стала первой периодической таблицей, которая собрала все химические знания, имеющиеся у человечества ко второй половине XIX века. В статье подробно рассматривается вопрос о том, когда была открыта периодическая система Менделеева.
Знаменитый русский химик

Важно быть в курсе научной биографии нашего соотечественника, чтобы понимать, когда была открыта периодическая система Менделеева. Итак, известный русский химик родился в Сибири в городе Тобольске 8 февраля 1834 года. Окончил магистратуру в Санкт-Петербургском педагогическом институте, а позднее смог получить звание приват-доцента. В 1859 году Д. И. Менделеев едет в Германию, а именно в университет Гейдельберга с целью получения профессорского звания. В 1865 году он возвращается из Германии снова в Санкт-Петербург и получает звание профессора. В 1868 году ученый приступает к работе над книгой «Основы химии».
Научные поиски Менделеева

Во второй половине XIX века человечество уже накопило достаточно знаний по химии, и этот предмет преподавался в качестве обязательного во всех университетах Европы. Однако информация о химических соединениях и их свойствах не была собрана и систематизирована, а находилась в огромном количестве литературных источников. В результате изучение химии становилось очень медленным, скучным и неэффективным занятием, поскольку студенты должны были часами искать в целой горе литературы необходимые «крохи» знаний. Такая ситуация сильно беспокоила Д. И. Менделеева.
После длительных поисков в литературных источниках, а также выполнения собственных химических экспериментов в тех случаях, когда в литературе не было никакой информации, Дмитрий Иванович написал серию статей, которые позволили систематизировать и упорядочить огромное количество химических знаний. Эти работы оказали огромное влияние на историю развития химии, поскольку они снабдили ее предсказательной силой.
В своей работе ученый сравнивал химические свойства различных элементов и обнаружил, что они меняются регулярным образом в зависимости от их атомной массы. В отличие от немецкого химика Юлиуса Лотара Мейера, Дмитрий Иванович изложил результаты своих исследований в виде таблицы, включая в нее элементы с подобными химическими свойствами.
Открытие периодической системы химических элементов
Таблица русского химика стала первой опубликованной упорядоченной таблицей химических элементов в мире. Когда была открыта периодическая система Менделеева? Во многих источниках стоит дата — март 1869 года.

В первую таблицу ученый включил 63 химических элемента, которые были известны в его время, расположив их в порядке возрастания атомного веса. Массы некоторых элементов стояли со знаками вопроса, поскольку ученый не доверял полностью экспериментам, в которых были установлены эти массы. Также в первой таблице Д. И. Менделеева находились пустые клетки, поскольку сам ученый считал, что между соседними элементами не может быть такой большой разницы в атомной массе и что должны существовать другие элементы, которые еще предстоит открыть. Дмитрий Иванович даже предсказал некоторые свойства еще не открытых элементов.
Химическая валентность и периодические свойства

Важно не только то, когда была открыта периодическая система Менделеева, но и тот факт, что ученый при этом обнаружил соответствие между последовательностью расположения химических элементов в таблице и их валентностью.
Например, натрий имеет валентность 1 и может вступать в химическое соединение только с одним другим атомом, то есть соединение NaO2, в котором натрий взаимодействует с двумя атомами кислорода, невозможно. В свою очередь, кислород, валентность которого 2, может соединяться с двумя атомами единичной валентности, что демонстрирует соединение H2O. Если же кислород вступает в реакцию с элементом, у которого также валентность равна 2, тогда реакция в атомных процентах идет в отношении 1:1, например CaO. Азот обладает валентностью 3, поэтому для него соединение NH3 является допустимым и так далее.
Таким образом, относительные позиции, которые занимают элементы в химической системе Менделеева, связаны с их валентностями.
Предсказательная сила периодического закона
Русский ученый также установил периодический закон (причина, по которой его таблицу называют периодической), согласно которому, свойства химических элементов являются периодической функцией от их атомного веса.
Таблица Менделеева привлекла внимание известных химиков конца XIX века только тогда, когда были открыты предсказанные ученым элементы и были экспериментально изучены их свойства. В итоге оказалось, что теоретически установленные химические свойства элементов в пустых клетках таблицы с поразительной точностью совпадали со свойствами вновь открытых элементов.
Например, Менделеев в 1871 году описал свойства для еще неизвестного элемента, который должен был находиться рядом с кремнием и иметь ту же валентность, что и он. Спустя 15 лет этот элемент был открыт немецким химиком Клеменсем Винклером и назван германием.
Благородные газы и периодическая система элементов
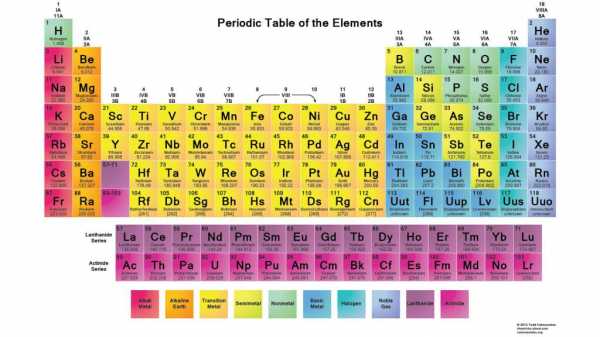
Так называемые благородные газы не были известны, когда Менделеев опубликовал свою таблицу. Однако, после того как они были открыты, то еще раз подтвердили теорию валентностей в периодической таблице.
В конце XIX века было открыто несколько химических элементов, которые не могли быть включены ни в одну из групп периодической таблицы. Эти элементы являлись химически инертными, поэтому получили название благородных газов (аргон, неон, ксенон и другие).
Их химическую неактивность объяснила теория валентностей. Дело в том, что валентность этих элементов равна 0, поэтому они и не способны вступать в реакцию с другими.
Включение в периодическую таблицу благородных газов сделало более стройным и завершенным периодический закон Д. И. Менделеева.
fb.ru
Помогите пожалуйста !!!Мне нужна краткая история открытия ПЕРИОДИЧЕСКОЙ СИСТЕМЫ МЕНДЕЛЕЕВА
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы) . Всего предложено несколько сотен [1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.) . В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу. К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Дёберейнер опубликовал найденный им «закон триад» : атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и иод и др.) . Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности. В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав» ) внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества) ; ещё ранее (февраль 1869 г. ) научное извещение об открытии было им разослано ведущим химикам мира. Д. И. Менделеев По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово» . Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима) , Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим [2]. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы («Опыт системы элементов, основанной на их атомном весе и химическом сходстве») , в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов) . В 1870 году Менделеев в «Основах химии» публикует второй вариант системы («Естественную систему элементов») , имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
История открытия периодического закона К середине XIX в. было известно более 60 химический элементов. Естественно, что предпринимались попытки их классифицировать. Еще в 1829г. Доберейнер предложил ввести триады, т. е. сгруппировать элементы по 3 с близкими свойствами, например Cl, Br, I. Однако, Доберейнер смог найти всего 4 триады. В 1849г. Гесс предложил свою классификацию, недостатком которой было то, что он классифицировал только неметаллы. В 1862г. Шанкуртуа предложил расположить элементы по спирали, нанесенной на цилиндр. При этом элементы со сходными свойствами распологались друг под другом, но эта попытка осталась не замеченной. В 60-х гг. XIXв. Ньюлекс предложил правило активации. В 1864г. Лотер Мейер предлоил систему эхлементов, которая практически соответствовала периодической системе. Заслуга Менделеева в том, что в отличии от всех своих предшественников в основу своей классификации он положил открытый им периодический закон, а периодическая система является просто удобной графической интерпретацией. В отличие от своих предшественников Менделеев не только расположил элементы в определенном порядке, но и предсказал свойства тех элементов, который к моменту открытия периодического закона были еще неизвестны. Он оставил в своей таблице пустые клетки для неоткрытых еще в то время новых химических элементов.
touch.otvet.mail.ru
История открытия таблицы Менделеева 🚩 история создания таблицы менделеева 🚩 Естественные науки
К середине 19 века ученым удалось открыть шестьдесят три химических элемента, однако выстроить из них стройную логическую цепочку никак не получалось. Элементы планировалось разместить по порядку возрастания атомной массы и разделить по сходству химических свойств на группы.
Впервые свою теорию, схожую с будущей теорией Менделеева, предложил музыкант и химик Джон Александр Ньюленд – однако научное сообщество проигнорировало его достижение. Предложение Ньюленда не приняли всерьез из-за его поисков гармонии и связи между музыкой и химией.
Дмитрий Менделеев впервые опубликовал свою периодическую таблицу в 1869 году на страницах журнала Русского химического общества. Также ученый разослал извещения о своем открытии всем ведущим мировым химикам, после чего он неоднократно улучшал и дорабатывал таблицу, пока она не стала такой, какой ее знают сегодня. Суть открытия Дмитрия Менделеева заключалась в периодическом, а не монотонном изменении химических свойств элементов с ростом атомной массы. Окончательное объединение теории в периодический закон произошло в 1871 году.
Наиболее распространенной легендой является открытие таблицы Менделеевым во сне. Сам ученый неоднократно осмеивал данный миф, утверждая, что он придумывал таблицу на протяжении многих лет. По другой легенде Дмитрий Менделеев изобрел водку – она появилась после защиты ученым диссертации «Рассуждение о соединении спирта с водою».
Менделеева до сих пор многие считают первооткрывателем водки, который сам любил творить под водно-спиртовым раствором. Современники ученого часто посмеивались над лабораторией Менделеева, которую тот оборудовал в дупле гигантского дуба.
Отдельным поводом для шуток по слухам являлась страсть Дмитрия Менделеева к плетению чемоданов, которым ученый занимался, проживая в Симферополе. В дальнейшем он своими руками мастерил контейнеры из картона для нужд своей лаборатории, за что его язвительно называли мастером чемоданных дел.
Таблица Менделеева, кроме упорядочивания химических элементов в единую систему, дала возможность предсказать открытие многих новых элементов. Однако в то же время некоторые из них ученые признали несуществующими, поскольку они были несовместимы с концепцией периодического закона. Наиболее известной историей на тот момент являлось открытие таких новых элементов, как короний и небулий.
Химические элементы ученые открывали еще до 1500 года, затем в средние века, уже в Новое время и продолжают открывать в настоящее время. Этому способствовали развитие науки в эпоху Просвещения, промышленный скачок в истории человечества, открытия в спектроскопии, квантовой механики и ядерного синтеза. Так какие элементы, кем и когда были зафиксированы и внесены в химическую таблицу?

Инструкция
Ученые мужи еще глубокой древности открыли медь, серебро, золото, свинец, олово, железо и углерод, а также другие химические элементы – сурьму (ранее 3 тысячного года до н.э.), ртуть (до 1500 до н.э.), цинк (примерно 1300-1000 годы до н.э.) и сера (около 6-го века до н.э.).
Средние века дали человечеству еще три открытия – мышьяк (1250 год, причем автор не известен), висмут (1450 год и также не известно имя первооткрывателя) и фосфор, который в 1669 году открыл немец Хенниг Бранд.
Более плодовитым стал 18 век: в 1735 году кобальт открыл швед Брандт; в 1748-ом платину испанец де Мендоса; в 1751 году никель швед Кронштедт; в 1766 м 1772-ом водород и азот британец Кавендиш; в 1774 году кислород Дж. Пристли; при участии шведа Шееле стали известны марганец, хлор, барий, молибден и вольфрам; в 1782 году австриец фон Рейхенштейн открыл элемент теллур; в 1789-ом уран и цирконий немец Клапрот; в 1790 году британцы Кроуфорд и Клапрот обнаружили стронций; в 1794-ом иттрий открыл финн Гадолин, в 1795 году титан немец Клапрот, а хром и бериллий француз Л. Воклен. Еще больше химических элементов стали известны в 19 веке: в 1801 году Хатчет – ниобий; в 1802-ом Экеберг – тантал; в 1803 году Волластон и Берцелиус обнаружили палладий и церий; в 1804-ом были открыты иридий, осмий и родий учеными из Великобритании; британец Дэви в 1807 обнаружил сразу двоих – натрий и калий; бор в 1808-ом – Гей-Люссак, кальций и магний в том же году тот же Дэви; иод найден в 1811 году Куртуа; кадмий – 1817-ом Штромейер; селен – в том же Берцелиус; литий – тогда же швед Арфведсон; кремний – в 1823-ом Берцелиус; ванадий – в 1830-ом швед Сефстрем; открытие сразу трех элементов (лантан, эрбий и тербий) произошло при участии шведа Мосандера; рутений в 1844-ом в Казани обнаружил Клаус; рубидий и цезий – в 1861 году – Бунзен и Кирхгоф; таллий – в 1861-ом Крукс; индий – в 1863 году немцы Рейх и Рихтер; галлий – в 1875-ом француз Лекок де Буабодран; иттербий – в 1878 году швед Мариньяк; тулий – в 1879-ом Клеве; самарий – в 1879 году Лекок де Буабодран; гольмий – в 1879-ом Клеве; скандий – в 1879 году швед Нильсон; празеодим и неодим – в 1885-ом австриец Ауэр фон Вельсбах; фтор – в 1886 году Муассан; германий – в 1886-ом Винклер; гандолий и диспрозий – в том же году Лекок де Буабодран; аргон, гелий, неон, ксенон и криптон – в 1898 году британцы Рамзай и Траверс; полоний и радий – в 1898 году чета Кюри; радон – в 1899-ом британцы Оуэнс и Резенфорд и в том же году француз Дебьерн обнаружил актиний.В 20 веке ученые из разных стран нашли следующие химические элементы: европий – в 1901-ом Демарсе; лютеций – в 1907 году француз Урбен; протактиний – в 1918-ом команда немецких специалистов; гафний – в 1923 году датчане Костер и Хевеши; рений – в 1927-ом немец Ноддак; технеций – в 1937 году команда ученых из США и Италии; франций – в 1923-ом француз Перей; усилиям американских исследователей человечество обязано известностью астата, нептуния, плутония, америция, кюрия, прометия, берклия, калифорния, эйнштейния, фермия и менделевия; в подмосковной Дубне в 20 веке были найдены нобелий, лоуренсий, резерфордий, дубний, сиборгий и борий; в Германии в 80-х годах обнаружили мейтнерий, хассий, дармштадтий, рентгений и коперниций, а в 1999 и 2000 годах в той же Дубне нашли флеровий и ливерморий.
Видео по теме
www.kakprosto.ru
Химические элементы их год открытия и ученые их открывшие (Таблица)
В справочной таблице, кроме порядкового номера элементов, их символа, названия и атомного веса, даны еще краткие исторические справки: кто и когда открыл тот или другой элемент. Указанные в таблице даты отвечают преимущественно тем годам, когда элементы были получены в чистом виде, т. е. в металлическом или свободном состоянии, а не в виде химических соединений; приводится также имя ученого, который впервые этого достиг. Дополнительные указания по этим вопросам для некоторых элементов даны в примечаниях к таблице. Введенное в таблице сокращение «Изв. с др.» означает «известны с древнего времени», остальные сокращения понятны.
Атомный номер Z | Символ | Название | Атомный вес A | Кто открыл | Год открытия элемента |
1 | H | Водород | 1,0080 | Кавендиш | 1766 |
2 | He | Гелии 1) | 4,003 | Рамзай и Клив | 1895 |
3 | Li | Литий | 6,94 0 | Арфведсон | 1817 |
4 | Be | Бериллий | 9,013 | Велер и Бюсси | 1828 |
5 | В | Бор | 10,82 | Гей-Люссак и Тенар | 1808 |
6 | C | Углерод | 12,011 | Изв. с др. | – |
7 | N | Азот | 14,008 | Д. Резерфорд | 1772 |
8 | O | Кислород | 16,0000 | Пристли и Шееле | 1774 |
9 | F | Фтор 2) | 19,00 | Муассан | 1886 |
10 | Ne | Неон | 20,183 | Рамзай и Траверс | 1898 |
11 | Na | Натрий | 22,991 | Деви | 1807 |
12 | Mg | Магний 3) | 24,32 | Либих и Бюсси | 1831 |
13 | Al | Алюминий | 26,98 | Вёлер | 1827 |
14 | Si | Кремний | 28,09 | Берцелиус | 1823 |
15 | P | Фосфор | 30,975 | Бранд | 1669 |
16 | S | Сера | 32,066 | Изв. с др. | – |
17 | Cl | Хлор | 35,457 | Шееле | 1774 |
18 | Ar | Аргон | 39,944 | Рэлей и Рамзай | 1894 |
19 | К | Калий | 39,100 | Деви | 1807 |
20 | Ca | Кальций | 40,08 | Деви (Берцелиус) | 1808 |
21 | Sc | Скандий | 44,96 | Нильсон | 1879 |
22 | Ti | Титан 4) | 47,90 | Грегор | 1791 |
23 | V | Ванадий | 50,95 | Зефштрем | 1830 |
24 | Cr | Хром | 52,01 | Воклен | 1797 |
25 | Mn | Марганец | 54,94 | Ган | 1774 |
26 | Fe | Железо | 55,85 | Изв. с др. | – |
27 | Co | Кобальт | 58,94 | Брандт | 1735 |
28 | Ni | Никель | 58,69 | Кронстедт | 1751 |
29 | Cu | Медь | 63,54 | Изв. с др. | – |
30 | Zn | Цинк | 65,38 | Маркграф | 1746 |
31 | Ga | Галлий | 69,72 | Лекок де Буабодрант | 1875 |
32 | Ge | Германий | 72,60 | Винклер | 1886 |
33 | As | Мышьяк 5) | 74,91 | Альберт Великий | XIII в. |
34 | Se | Селен | 78,96 | Берцелиус | 1817 |
35 | Br | Бром | 79,916 | Балард | 1826 |
36 | Kr | Криптон | 83,80 | Рамзай и Траверс | 1898 |
37 | Rb | Рубидий | 85,48 | Бунзен и Кирхгоф | 1861 |
33 | Sr | Стронций | 87,63 | Деви | 1808 |
39 | Y | Иттрий | 88,92 | Вёлер | 1828 |
40 | Zr | Цирконий | 91.22 | Берцелиус | 1824 |
41 | Nb | Ниобий 6) | 92,91 | Розе | 1844 |
42 | Mo | Молибден | 95,95 | Гьельм | 1782 |
43 | Tc | Технеций | 99 | Перрье и Сегре | 1937 |
44 | Ru | Рутений | 101,1 | Клаус | 1844 |
45 | Rh | Родий | 102,91 | Волластон | 1803 |
46 | Pd | Палладий | 106,7 | Волластон | 1803 |
47 | Ag | Серебро | 107,880 | Изв. с др. | – |
48 | Cd | Кадмий | 112,41 | Герман и Штромберг | 1817 |
49 | In | Индий | 114,76 | Рейх и Рихтер | 1863 |
60 | Sn | Олово | 118,70 | Изв. с др. | – |
51 | Sb | Сурьма |
| В. Валентин | XV в. |
52 | Те | Теллур | 127,61 | Рихенштейн | 1782 |
53 | J | Иод |
| Куртуа | 1811 |
54 | Xe | Ксенон | 131,3 | Рамзай и Траверс | 1898 |
55 | Cs | Цезий |
| Бунзен и Кирхгофф | 1860 |
56 | Ba | Барий |
| Деви | 1808 |
57 | La | Лантан | 138,92 | Мозандер | 1839 |
58 | Ce | Церий 7) | 140,13 | Гяльдербранд и Нортон | 1875 |
59 | Pr | Празеодим | 140,92 | Вейсбах | 1885 |
60 | Nd | Неодим 8) | 144,27 | Вейсбах | 1885 |
61 | Pm | Прометий | 145 | Марянский и Гленденев | 1947 |
62 | Sm | Самарий | 150,43 | Лекок де Буабодран | 1879 |
63 | Eu | Европий | 152,0 | Демарсей | 1896 |
64 | Gd | Гадолиний | 156,9 | Мариньяк и Лекок де Буабодран | 1880 |
65 | Tb | Тербий | 158,93 | Мозандер | 1843 |
66 | Dy | Диспрозий | 162,46 | Лекок де Буабодран | 1886 |
67 | Ho | Гольмий | 164,94 | Клеве | 1880 |
68 | Er | Эрбий | 167,2 | Мозандер | 1843 |
69 | Tu | Туллий | 168,94 | Клеве | 1879 |
70 | Yb | Иттербий | 173,04 | Мариньяк | 1878 |
71 | Lu | Лютеций | 174,99 | У роен | 1908 |
72 | Hf | Гафний | 178,6 | Костер и Хевеши | 1923 |
73 | Та | Тантал | 180,95 | Экеберг | 1802 |
74 | W | Вольфрам | 183,92 | Бр. д’Эльюар | 1783 |
75 | Re | Рений | 186,31 | Ноддак и Таске | 1925 |
76 | Os | Осмий | 190,2 | Теннант | 1803 |
77 | Ir | Иридий | 192,2 | Теннант | 1804 |
78 | Pt | Платина 9) | 195,23 | Упом. в XVI в. | 1861 |
79 | Au | Золото | 197,0 | Изв. с др. | |
80 | Hg | Ртуть | 200,61 | Упом. за III в. до н. в. | |
81 | Tl | Таллий | 204,39 | Крукс | |
82 | Pb | Ивинец | 207,21 | Упом. Плинием | |
83 | Bi | Висмут | 209,00 | Упом. В. Валентин в XV в. | |
84 | Ро | Полоний | 210 | Кюри М. | 1898 |
85 | At | Астатин | 210 | Корзон и Мэккензи | 1940 |
86 | Rn | Радон | 222 | Дорн | 1900 |
87 | Fr | Франций | 223 | М. Перей | 1939 |
88 | Ra | Радий | 226,05 | Кюри М. | 1898 |
89 | Ac | Актиний | 227 | Дебьерн | 1902 |
90 | Th | Торий | 232,05 | Берцелиус | 1828 |
91 | Pa | Протактиний | 231 | Мейтнер и Ган | 1918 |
92 | U | Уран 10) | 238,07 | Клапрот | 1789 |
93 | Np | Нептуний | 237 | Мэкмиллан и Абельсон | 1940 |
04 | Pu | Плутоний | 242 | Сиборг и Мэкмиллан | 1940 |
95 | Am | Америций | 243 | Сиборг и Джемс | 1945 |
96 | Cm | Кюрий | 245 | Сиборг и Джемс | 1944 |
97 | Bk | Беркелий | 245 | Сиборг и Томпсон | I960 |
98 | Cf | Калифорний | 248 | Сиборг и Томпсон | 1950 |
99 | En | Эйнштейний | 253 |
| 1953 |
100 | Fm | Фермий | 255 |
| 1953 |
101 | Mv | Менделевий | 256 |
| 1953 |
Примечания к таблице:
1) Жансен и независимо от него Локьер в 1868 г. обнаружили в спектре солнца неизвестные до того времени линии; этот новый элемент был назван гелием, так как предполагалось, что он находится только на солнце. Через 27 лет Рамзаи и Клив обнаружили те же линии в спектре нового газа, полученного ими при анализе минерала клевеита; название гелий для этого элемента было сохранено.
2) Еще в конце XVIII в. было известно, что при действии серной кислоты на плавиковый шпат выделяется особая кислота, которая разъедает стекло. В 1810 г. Ампер показал, что эта кислота подобна соляной и является соединением с водородом некоторого неизвестного элемента, который он назвал фтором. В чистом виде фтор удалось получить Муассану только в 1886 г.
3) Окись магния была известна давно, ее исследовал Блэк еще в 1775 г. Деви в 1808 г. пытался получить металлический магний, но в чистом виде металл получить ему не удалось.
4) Двуокись титана была получена лабораторным путем еще в конце XVIII в., Берцелиус получал титан, но не вполне чистый. Более чистый металлический титан был получен Грегор, затем Муассаном.
5) Сернистые соединения мышьяка былп известны в древнее время.
6) В начале XIX в. была получена смесь ниобия и тантала, которая рассматривалась как новый элемент; ему было присвоено название колумбий. В Америке и Англии ниобий до сих пор носит название колумбий.
7) В виде окиси церий был получен в 1803 г.
8) Долгое время смесь празеодима и неодима считалась отдельным элементом, который назывался дидием (Di).
9) Как особый металл платина была описана в 1750 г.; до 1810 г. единственным местом добычи платины была Колумбия. Затем платина была найдена в других местах, в том числе на Урале, который до настоящего времени является наиболее богатым источником ее получения.
10) Двуокись урана, полученная впервые еще в 1789 г., была принята вначале за новый элемент. Металлический уран был получен впервые в 1842 г., его радиоактивные свойства были открыты только в 1896 г.
_______________
Источник информации: КРАТКИЙ ФИЗИКО-ТЕХНИЧЕСКИЙ СПРАВОЧНИК/ Том 1, – М.: 1960.
infotables.ru
Открытия
Русский химик, открывший периодический закон химических элементов, разносторонний учёный, педагог и общественный деятель, физик и натуралист в широком смысле этого слова.Родители Менделеева – чисто русского происхождения. В гимназии Менделеев учился неважно. Благоприятную почву для развития своих способностей Менделеев нашел только в Главном Педагогическом институте. В Санкт-Петербурге, где защитил диссертацию на степень магистра химии: “Об удельных объемах” 23 лет от роду он становится доцентом Петербургского университета, где читает сначала теоретическую, потом органическую химию. В 1864 г. Менделеев был избран профессором Петербургского технологического института.
Менделеев создал современную гидратную теорию растворов, уравнение состояния идеального газа, разработал технологию получения бездымного пороха, открыл Периодический закон и предложил Периодическую систему химических элементов, написал лучший для своего времени учебник химии.
Готовясь к лекциям, собирая материал для своего учебника “Основы химии”, Д. И. Менделеев раздумывал над тем, как систематизировать материал таким образом, чтобы сведения о химических свойствах элементов не выглядели набором разрозненных фактов. Ориентиром в этой работе Д. И. Менделееву послужили атомные массы элементов. После Всемирного конгресса химиков в 1860 году, в работе которого участвовал и Д. И. Менделеев, проблема правильного определения атомных весов была постоянно в центре внимания многих ведущих химиков мира, в том числе и Д. И. Менделеева.
Работая над трудом «Основы химии», Д. И. Менделеев открыл в феврале 1869 года один из фундаментальных законов природы — периодический закон химических элементов. Периодическая система элементов Менделеева была названа самым важным изобретением для человечества в области новых материалов. Периодическая система представляет собой упорядоченное множество химических элементов на основе их атомного числа или на основе числа протонов, находящихся в ядре элементов. Основываясь именно на этой таблице, ученые пытаются создать новые материалы. Среди наиболее известных открытий — периодический закон химических элементов, один из фундаментальных законов мироздания, неотъемлемый для всего естествознания. Одно из важных открытий Менделеева – определение «температуры абсолютного кипения жидкостей», известной ныне под названием критической температуры. Внёс в первоначальный вариант периодической системы ряд исправлений и уточнений, и в 1871 г. опубликовал две классические статьи – «Естественная система элементов и применение ее к указанию свойств некоторых элементов». Учение о периодичности Менделеев развивал до конца жизни. На этой основе, в частности, опираясь на результаты изучения последовательности изменения стеклообразующих оксидов, исправил значения атомных масс 9 элементов.
6 марта 1869 года знаменитый доклад Д. И. Менделеева «Соотношение свойств с атомным весом элементов» был прочтён Н. А. Меншуткиным на заседании Русского химического общества. В том же году это сообщение на немецком языке появилось в журнале «Zeitschrift für Chemie», а в 1871 году в журнале «Annalen der Chemie» была осуществлена развёрнутая публикация Д. И. Менделеева, посвящённая его открытию — «Die periodische Gesetzmässigkeit der Elemente» (Периодическая закономерность химических элементов).
Предсказал в 1870 году существование, вычислил атомные массы и описал свойства трёх ещё не открытых тогда элементов — «экаалюминия», «экабора» и «экасилиция». Затем предсказал существование ещё восьми элементов, в том числе «двителлура» — полония, «экаиода» — астата, «экамарганца» — технеция, «двимарганца» — рения, «экацезия» — франция. В 1900 году Дмитрий Иванович Менделеев и Уильям Рамзай пришли к выводу о необходимости включения в периодическую систему элементов особой, нулевой группы благородных газов.
opiv.narod.ru
