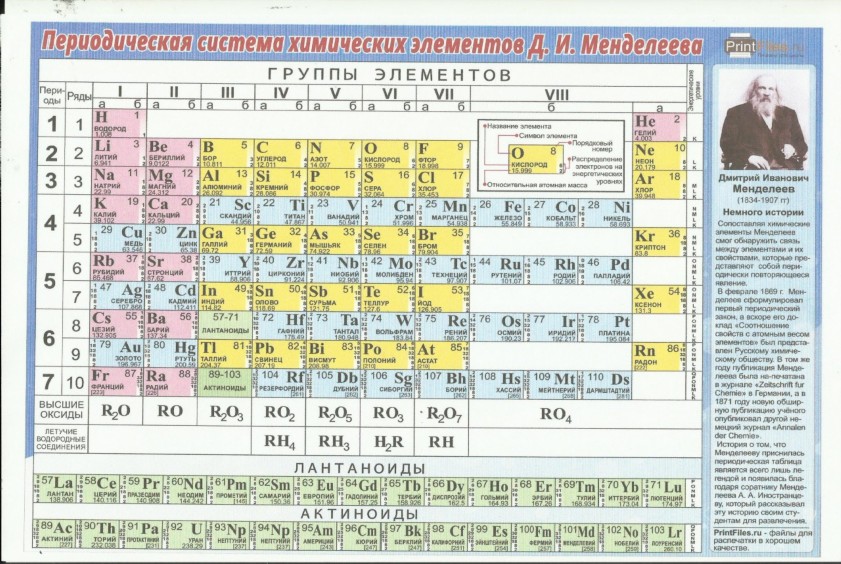
Короткая форма периодической системы элементов
Толкование
- Короткая форма периодической системы элементов
Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6, как у серы и селена, и т. д.
Периодическая система элементов (короткий вариант 1) Группа →
Период ↓I II III IV V VI VII VIII A B A B A B A A B A B A B A B 1 1
H2
He2 3
Li4
Be5
B6
C7
N8
O9
F
Ne3 11
Na12
Mg13
Al14
Si15
P16
S17
Cl18
Ar4 19
K20
Ca21
Sc22
Ti23
V24
Cr25
Mn26
Fe27
Co28
Ni29
Cu30
Zn31
Ga32
Ge33
As34
Se35
Br36
Kr5 37
Rb38
Sr39
Y40
Zr41
Nb42
Mo
Tc44
Ru45
Rh46
Pd47
Ag48
Cd49
In50
Sn51
Sb52
Te53
I54
Xe6 55
Cs56
Ba* 72
Hf73
Ta
W75
Re76
Os77
Ir78
Pt79
Au80
Hg81
Tl82
Pb83
Bi84
Po85
At86
Rn7 87
Fr88
Ra** 104
Rf105
Db
Sg107
Bh108
Hs109
Mt110
Ds111
Rg112
Cn113
Uut114
Fl115
Uup116
Lv117
Uus118
UuoЛантаноиды * 57
La58
Ce59
Pr
Nd61
Pm62
Sm63
Eu64
Gd65
Tb66
Dy67
Ho68
Er69
Tm70
Yb71
LuАктиноиды ** 89
Ac90
Th
Pa92
U93
Np94
Pu95
Am96
Cm97
Bk98
Cf99
Es100
Fm101
Md102
No103
LrСемейства химических элементов
Щелочные металлы Неметаллы Щёлочноземельные металлы Галогены Переходные металлы Инертные газы Металлы Лантаноиды Полуметаллы — металлоиды Актиноиды Для облегчения восприятия символы элементов главных и побочных подгрупп выравниваются в ячейках таблицы в разные стороны.
 В вышеприведённой таблице символы элементов главных подгрупп выровнены влево, а символы элементов побочных подгрупп — вправо.
В вышеприведённой таблице символы элементов главных подгрупп выровнены влево, а символы элементов побочных подгрупп — вправо.Широко распространён и другой вариант выравнивания (см. вариант таблицы ниже): в первой строке каждого периода символы элементов выровнены влево, а во второй строке — вправо. Во втором и третьем периоде, которые состоят только из одной строки, используется смешанное выравнивание.
Периодическая система элементов (короткий вариант 2) Группа →
Период ↓I II III IV V VI VII VIII A B A B B A B B A B A B A B A 1 1
H2
He2 3
Li4
Be5
B6
C7
N8
O9
F
Ne3 11
Na12
Mg13
Al14
Si15
P16
S17
Cl18
Ar4 19
K20
Ca21
Sc22
Ti23
V24
Cr25
Mn26
Fe27
Co28
Ni29
Cu30
Zn31
Ga32
Ge33
As34
Se35
Br36
Kr5 37
Rb38
Sr39
Y40
Zr41
Nb42
Mo43
Tc44
Ru45
Rh46
Pd47
Ag48
Cd49
In50
Sn51
Sb52
Te53
I54
Xe6 55
Cs56
Ba* 72
Hf73
Ta74
W75
Re76
Os77
Ir78
Pt79
Au80
Hg81
Tl82
Pb83
Bi84
Po85
At86
Rn7 87
Fr88
Ra** 104
Rf105
Db106
Sg107
Bh108
Hs109
Mt110
Ds111
Rg112
Cn113
Uut114
Fl115
Uup116
Lv117
Uus118
UuoЛантаноиды * 57
La58
Ce59
Pr60
Nd61
Pm62
Sm63
Eu64
Gd65
Tb66
Dy67
Ho68
Er69
Tm70
Yb71
LuАктиноиды ** 89
Ac90
Th91
Pa92
U93
Np94
Pu95
Am96
Cm97
Bk98
Cf99
Es100
Fm101
Md102
No103
LrКороткая форма таблицы восходит к первоначальной версии Менделеева:
Wikimedia Foundation. 2010.
2010.
Игры ⚽ Нужно решить контрольную?
- Короткая приводящая мышца
- Короткие истории (фильм, 1963)
Полезное
Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона 9
Характеристика разных форм таблицы
В начале XX века было открыто строение атома и стало ясно, что свойства химических элементов находятся в периодической зависимости не от атомных масс, а от заряда ядра атома, т. е. числа протонов в ядре.
Рис. 1. “Длинная” форма таблицы
Дальнейшее развитие Периодической системы заключалось в том, что ученые заполняли пустые клетки в таблице Менделеева: открыли семейство благородных газов. Открывались естественно и искусственно полученные радиоактивные элементы. В 2010 году был открыт последний 117 химический элемент, 7 периода Периодической системы.
Таким образом, перед учеными встал вопрос о нижней границе Периодической системы, который остается открытым до сих пор.
Чаще всего можно увидеть три формы выражения Периодической системы: короткая или короткопериодная, длинная или длиннопериодная или сверхдлинная.
В короткой форме таблица изображена на рис. 2.
1-3 периоды занимают по 1 строке, 4-ый и последующие периоды занимают по 2 строчки. Символы элементов главных и побочных подгрупп выравниваются относительно разных краев клеток. Лантаноиды и актиноиды вынесены из общей таблицы.
В длинном варианте лантаноиды и актиноиды вынесены из общей таблицы, соответственно, так же как и в короткой, делая её более компактной. Нет главных и побочных подгрупп. Каждый период занимает ровно одну строчку (рис. 1).
Короткая форма Периодической системы
| Рис. 2. “Короткая форма” | Рис. 3. Клеточка таблицы |
Каждая клеточка Периодической системы содержит символ одного химического элемента, у которого указан порядковый номер и значения относительной атомной массы элемента (рис. 3).
3).
Период начинается щелочным металлом и заканчивается инертным газом.
Всего периодов семь. Исключением является 1-ый период. В его состав входит только 2 химических элемента: водород, который не считается щелочным металлом, и гелий.
1-ый, 2-ой, 3-ий периоды называются малыми. Они содержат 2 и 8 химических элементов и состоят из одного ряда.
4-7 периоды называются большими. 4-ый и 5-ый периоды включают в себя 18 элементов. 6-ой и 7-й состоят из 32 элементов. В 6-ом и 7-ом периодах есть группы, состоящие из 14 элементов. В 6-ом периоде эти элементы схожи по свойствам с лантаном, а в 7-ом – с актинием. Эти элементы вынесены за основную таблицу и называются лантаноиды и актиноиды. Они обладают одинаковыми свойствами.
Совокупность переходных металлов в каждом периоде называется вставной декадой, потому что этих металлов в каждом периоде 10.
Рис. 4. Вторая группа
Группой называется вертикальный ряд химических элементов. Все элементы группы имеют одинаковое число валентных электронов.
Все элементы группы имеют одинаковое число валентных электронов.
Группы в короткой форме таблицы делятся на главную «А» и побочную «Б» подгруппы.
В каждой главной подгруппе с ростом порядкового номера элемента химические свойства меняются от неметаллических на металлические.
В побочную подгруппу включаются только металлы, называемые переходными элементами.
Если подгруппа начинается элементами малого периода – это главная подгруппа. Подгруппа, которая начинается элементами большого периода, – это побочная подгруппа. Например, рассмотрим II группу периодической системы (рис. 4).
Бериллий Be – элемент 2-го периода.
Он начинает столбик элементов главной подгруппы. В её состав входят: Be. Mg, Ca, Sr, Ba, Ra.
Цинк Zn начинает побочную подгруппу, так как он входит в состав 4-го периода. В побочную подгруппу входит Zn, Cd, Hg.
Характеристика химического элемента по положению в таблице
Рис. 5. Химический элемент бром
5. Химический элемент бром
Рассмотрим элемент Br (рис. 5). Его порядковый номер – 35, относительная атомная масса – 80. Находится в 4-ом периоде, в 7-ой главной подгруппе.
Рис. 6. Химический элемент платина
Рассмотрим элемент платину (рис. 6).
Символ – Pt, порядковый номер – 78, относительная атомная масса – 195. Находится в 6-м периоде, в 8-й побочной подгруппе.
В состав каждой группы входит элементы с одинаковым числом валентных электронов. Следовательно, они будут обладать схожими химическими свойствами.
Названия некоторых групп элементов
Это отражается в названии некоторых групп элементов.
- Например, элементы главной подгруппы 1-ой группы – Li, Na, K, Rb, Cs, Fr – называются щелочные металлы.
- Элементы главной подгруппы 2-ой группы – Ca, Sr, Ba, Ra – называются щелочноземельные металлы.
- Халькогены O, S, Se, Te, Po – элементы 6-й группы главной подгруппы.

- Галогены: F, Cl, Br, J, At – элементы 7-й группы главной подгруппы.
- 8-ю главную подгруппу называют подгруппой инертных или благородных газов. Это He, Ne, Ar, Kr, Xe, Ra.
Химические свойства в периодах меняются с металлических через амфотерные на неметаллические. Таким образом, зная химические свойства элемента, можно предположить, где конкретно он находится в Периодической системе. И наоборот, если знать положение элемента в Периодической системе, можно предположить его химические свойства.
Значение Периодического закона Д. И. Менделеева
С момента открытия Периодического закона и Периодической системы химических элементов Д. И. Менделеева, химия перестала быть описательной наукой. Теперь при помощи его таблицы можно предсказывать свойства любого химического элемента. Дальнейшее развитие физики и химии полностью подтвердило правоту Д. И. Менделеева, так были открыты семейства инертных газов. Для радиоактивных элементов были сначала описаны свойства, а затем они были получены. Периодический закон и Периодическая система химических элементов Д. И. Менделеева носят фундаментальный характер, являются основным законом природы.
Менделеева, так были открыты семейства инертных газов. Для радиоактивных элементов были сначала описаны свойства, а затем они были получены. Периодический закон и Периодическая система химических элементов Д. И. Менделеева носят фундаментальный характер, являются основным законом природы.
Подведение итога урока
На уроке вы изучили тему «Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона». Вы узнали о значении Периодической таблицы Менделеева, ее функциях и возможностях.
Список литературы
- Рудзитис Г. Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение. 2011. – 176 с.: ил.
- Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С. Кривля. – К.: ИЦ «Академия», 2008.
 – 240 с.: ил.
– 240 с.: ил. - Габриелян О. С. Химия. 9 класс. Учебник. – Дрофа, 2001. – 224 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «Химик» (Источник)
- Интернет-портал «hemi.nsu.ru» (Источник)
Домашнее задание
- №№ 193, 194 (с. 143) Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Какие названия имеют некоторые группы химических элементов?
- Сформулируйте Периодический закон. Чем отличается современная формулировка закона от данной Д. И. Менделеевым?
Проблемы с периодической таблицей | Feature
Как химики, мы видим периодическую таблицу в виде значка. Но ее конструкция продолжает развиваться и является источником многочисленных споров.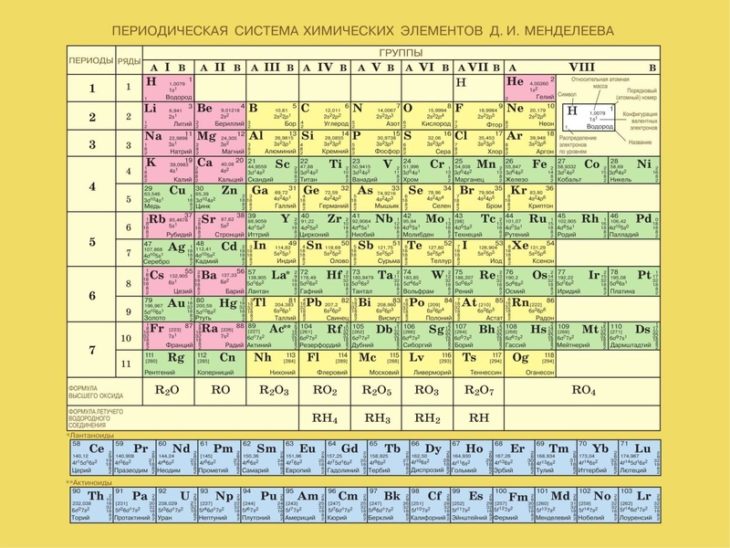
Периодическая таблица существует уже почти 140 лет и пережила множество революционных открытий, включая открытие субатомной структуры и развитие квантовой механики и теории относительности.
Первоначально порядок элементов определялся их возрастающим атомным весом (рис. 1), но позже было обнаружено, что атомный номер обеспечивает лучший принцип упорядочения. Например, элементы теллур и йод идеально встали на свои места в соответствии с их химическим поведением, но их положение в таблице было бы обратным, если бы они были упорядочены строго по их атомным весам.
Порядок элементов
Источник: © Журнал Русскео Физико-Химство, 1871, 3, 25
Рис. . Но периодическая таблица — это двумерное представление, полученное путем «отрезания» одномерной последовательности в определенных точках и размещения следующих последовательностей элементов под предыдущими полосами или последовательностями.
Там, где упорядочение на основе атомного номера можно рассматривать как первичную классификацию, вертикальную группировку элементов, полученных в результате процедуры обрезки и размещения, можно рассматривать как вторичную классификацию.
Узнать больше
Взгляните на все наши статьи и ресурсы о периодической таблице элементов или посетите нашу интерактивную периодическую таблицу, включающую историю, алхимию, подкасты, видео и тенденции данных.
Квантово-механическое решение
Современное объяснение того, почему элементы располагаются в вертикальных столбцах, демонстрирующих сходные свойства, было дано квантовой механикой и описывает оболочечную структуру электронов, вращающихся вокруг ядра атома каждого типа.
Элементы группы 1, например, все имеют один электрон на внешней оболочке, хотя они различаются по структуре внутренней оболочки.
Литий 1s 2 2s 1
Натрий 1s 2 2s 2 2p 6 3s 1
Калий 1s 2 2s 2 2p 6 3p 3 906 2 4s 1
Электроны внешней оболочки управляют их химические свойства, и поэтому они ведут себя одинаково. Например, все эти металлы реагируют с водой, хотя их реакционная способность возрастает по мере перехода от лития к калию и далее к цезию и рубидию.
Например, все эти металлы реагируют с водой, хотя их реакционная способность возрастает по мере перехода от лития к калию и далее к цезию и рубидию.
Множество дизайнов
Принимая во внимание эти основные факты, несколько удивительно обнаружить так много различных форм таблицы Менделеева. 1 Более 1000 из них опубликованы в статьях или на сайтах.
Любопытно, что первые два элемента, водород и гелий, представляют собой некоторую аномалию, и всегда были некоторые разногласия относительно того, к каким именно группам их следует отнести. В обычной современной периодической таблице, известной как среднедлинная форма, эти элементы попадают в группы 1 и 18 соответственно — щелочные металлы и благородные газы (рис. 2).
Рисунок 2. Обычная таблица Менделеева
В результате получается довольно неудобная форма башни-близнеца, которая дополняет и без того неровную форму таблицы Менделеева. Начальная неравномерность возникает из-за того, что щелочные и щелочноземельные металлы располагаются слева в виде высокого блока, за которым следует более мелкий блок шириной в десять элементов, содержащий переходные металлы. За ним справа следует еще один более высокий блок шириной в шесть элементов, содержащий смесь металлов, полуметаллов и неметаллов.
За ним справа следует еще один более высокий блок шириной в шесть элементов, содержащий смесь металлов, полуметаллов и неметаллов.
С точки зрения квантовой механики эти блоки характеризуются заполнением (слева направо) s-орбиталей, d-орбиталей и p-орбиталей. Есть еще одна странность в разрозненном блоке элементов, который выступает как своего рода сноска ко всей системе. Эти элементы связаны с заполнением f-орбиталей.
Место для гелия
Еще одно более правильное представление, левошаговая таблица (рис. 3), было предложено почти 90 лет назад французом Шарлем Жане.
Рисунок 3. Периодическая таблица с левым шагом
Недавно эта форма пережила возрождение, поскольку она также, кажется, более четко отображает порядок заполнения орбит, чем обычная форма. 2 Также отображает элементы в одной непрерывной последовательности без пропусков и перерывов. Досадным недостатком является то, что элемент гелий смещается со своего обычного места среди благородных газов и перемещается, чтобы присоединиться к щелочноземельным элементам, таким как бериллий, магний и кальций.
Этот переход можно обосновать на основании внешнеэлектронной структуры гелия, который имеет два таких электрона, как и члены щелочноземельной группы. С химической точки зрения отнесение гелия к этим металлам равносильно полной ереси. В то время как гелий является самым нереакционноспособным из всех элементов в периодическом реактивном. Вопрос о том, куда поместить гелий, — один из признаков проблемы в периодической таблице.
Водород тоже не подходит
Даже первый элемент, водород, некоторое время вызывал проблемы. Он может как потерять, так и получить электрон. В результате его можно поместить в группу 1, как это обычно бывает, или с галогенами в группу 17 ( рис. 4 ). Высказывались даже предположения, что водород следует группировать во главе углеродной группы, так как его атом, как и углерод, имеет наполовину заполненную внешнюю оболочку.
Рисунок 4. Периодическая таблица с водородом в группе 17
Некоторые авторы полностью избегают проблемы водород-гелий, удаляя их из основного корпуса и позволяя им парить над остальной частью таблицы.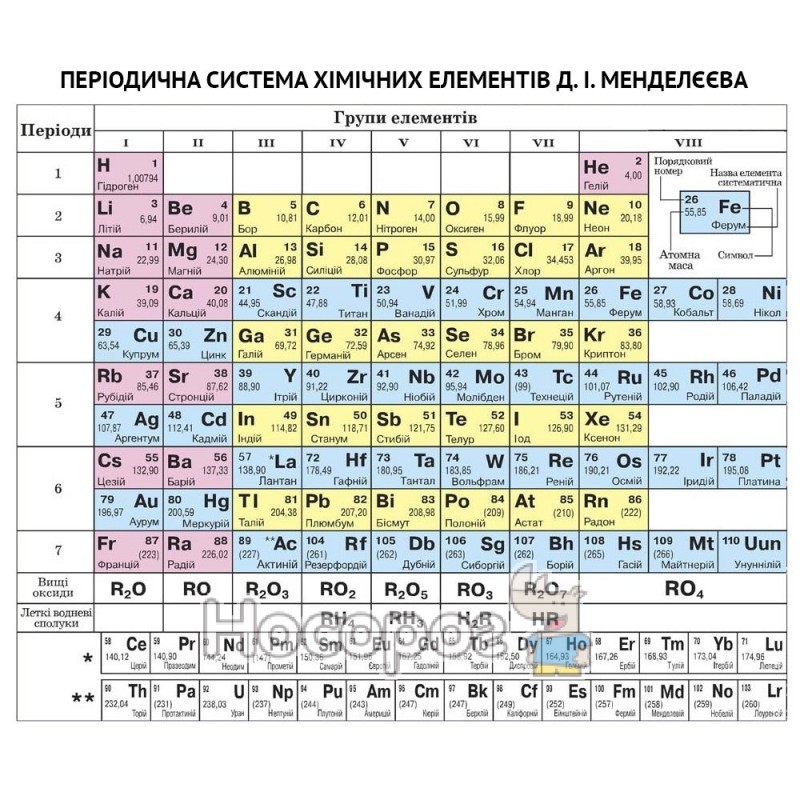
Совсем недавно было предложено изменить таблицу левого шага, чтобы избежать ереси размещения гелия среди щелочноземельных элементов. Эта новая версия перемещает водород в верхнюю часть галогенов, сохраняя при этом общую форму таблицы левого шага (рис. 4).
Представление таблицы Менделеева таким образом дает дополнительный бонус. Первоначальная таблица левого шага Джанет приводит к потере идеальной триады атомных чисел при перемещении гелия из группы благородных газов, тогда как эта новая таблица сохраняет триаду гелия.
Работа с триадами
Триадой называют группу из трех элементов, попадающих вертикально в любую группу периодической таблицы. Атомный номер среднего элемента равен среднему значению элементов выше и ниже него.
Исторически открытие триад с использованием атомных весов, а не атомных номеров, было первым намеком на какие-либо количественные закономерности среди атомных весов элементов. Теперь в предложенной модифицированной таблице левого шага перемещение водорода в группу галогена дает новую триаду совершенных атомных номеров среди элементов водорода, фтора и хлора.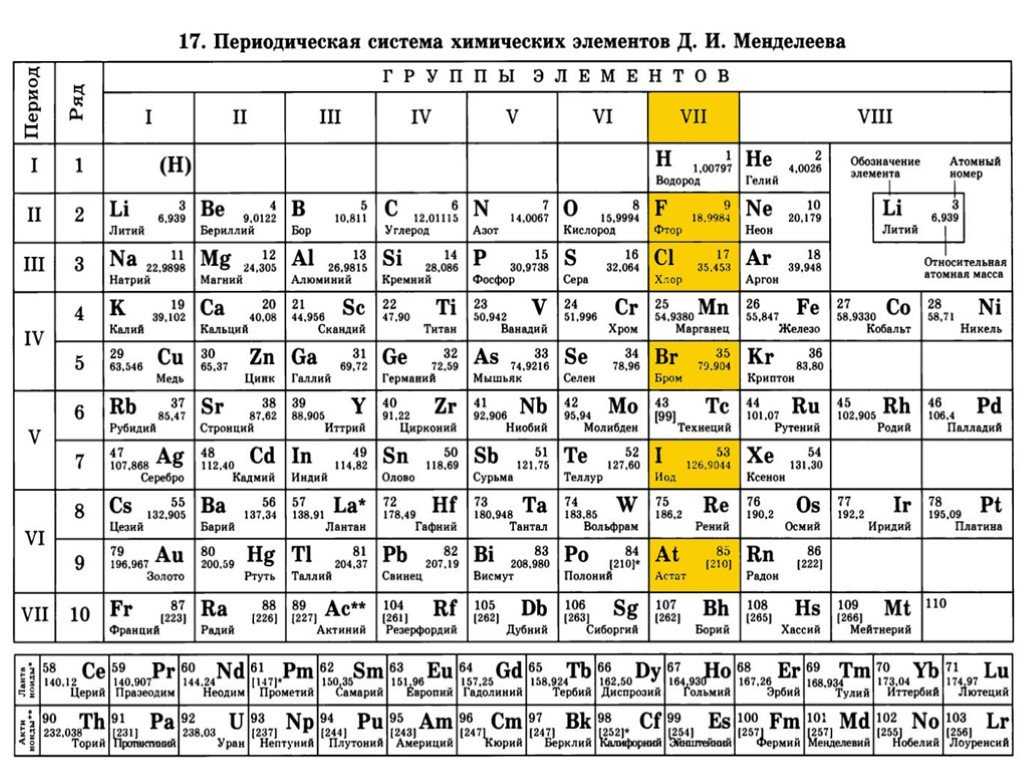
Проблема в группе 3
Другая форма проблемы связана с группой 3. Во многих периодических таблицах учебников и настенных диаграмм группа 3 представлена как состоящая из элементов скандий, иттрий, лантан и актиний. Аналогичное количество таблиц показывает разницу в последних двух элементах, но вместо них используются лютеций и лоуренсий.
Хотя существуют некоторые весьма убедительные химические и физические аналогии в пользу большего сходства между вторым набором из четырех элементов, не все были убеждены внести изменение. 3
Чего не хватает, так это категорического критерия. 4 Вновь таким критерием может стать попытка максимизировать число триад атомных чисел в периодической таблице. Глядя на второй выбор из четырех элементов, Sc, Y, Lu, Lr, последние три образуют идеальную триаду. Однако последних трех элементов среди группы Sc, Y, La и Ac нет (табл. 1).
| Д | 39 | Д | 39 | |
| Ла | 57 | Лу | 71 | |
| Ас | 89 | Лр | 103 | |
| (39+89)/2=64 (не 57) | (39=103)/2=71 Совершенная триада | |||
Возиться со сверхтяжелыми элементами
Переходя к сверхтяжелым элементам на другом конце таблицы Менделеева, мы находим еще больше проблем, по крайней мере, так казалось еще несколько лет назад.
Источник: Science Photo Library
Периодическая таблица претерпела некоторые интересные изменения…
Уже давно известно, что чем тяжелее атом, тем большую роль начинают играть релятивистские эффекты. С увеличением заряда ядра атома увеличивается и скорость внутренних электронов. Если скорости достаточно высоки, это может привести к искажению орбиталей атома и, как следствие, к изменению его химических свойств.
Первоначально, когда они были впервые синтезированы, химические реакции элементов 104 и 105 (резерфордий и дубний) не могли быть изучены, так как время жизни их изотопов было чрезвычайно коротким. Но через несколько лет были синтезированы другие более стабильные изотопы и проведены химические эксперименты.
Например, резерфордий попадает в группу 4, и поэтому ожидается, что он будет вести себя так же, как его собратья, цирконий и гафний. Эксперименты, проведенные в 1990-х годах, показали, что релятивистские эффекты были достаточно значительными, чтобы резерфордий и дубний вели себя аномально. Например, RfCl 4 имеет аномально высокую летучесть.
Рассыпающаяся периодичность
Казалось, что концепция химической периодичности, наконец, начала иссякать. Казалось, что релятивистские эффекты портят химическое обобщение, которое до сих пор выдержало испытание временем, самое общее из всех химических обобщений.
Источник: © www.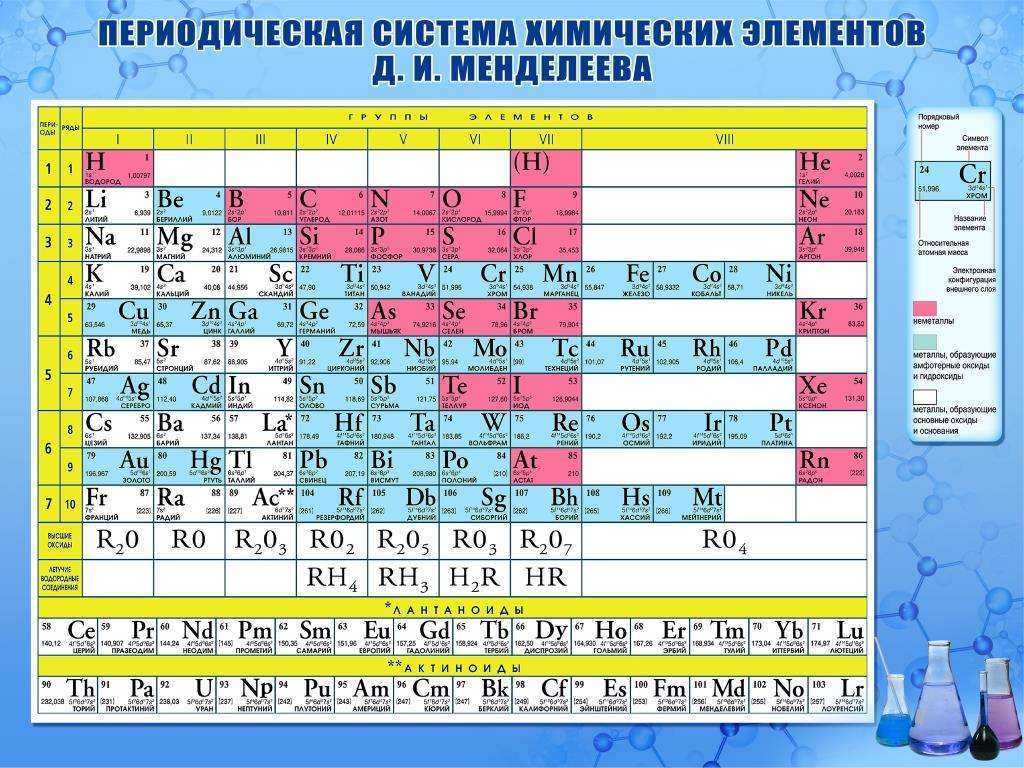 mayanperiodic.com
mayanperiodic.com
Периодическая таблица элементов Майя основана на электронных оболочках. Оболочки показаны концентрическими окружностями. Каждая строка в табличной форме показана в виде кольца.
Вскоре были синтезированы еще более высокие элементы. Неудивительно, что ожидалось, что они будут вести себя еще более аномально из-за их еще более высоких атомных номеров, но, как оказалось, это не то, что произошло.
Когда химические свойства элемента 106 (сиборгий) были исследованы, в заголовках новостей были слова «Скучный сиборгий». Когда элемент 107 (борий) был синтезирован, а затем исследован химически, это также показало, что химическая периодичность снова в деле.
То, что казалось угрозой или проблемой для таблицы Менделеева, оказалось недолгим беспокойством. Классификация элементов с более высоким атомным номером по-прежнему в значительной степени определяется периодической таблицей, независимо от наличия релятивистских эффектов.
Доберейнер и триады
Возвращаясь к борию, мы можем рассмотреть некоторые количественные данные, полученные по этому элементу, чтобы более подробно рассмотреть вопрос о его классификации.
Как мы видели, концепция триад элементов существует гораздо дольше, чем периодическая таблица. Эта концепция была первоначально открыта химиком Доберейнером за добрых пятьдесят лет до того, как Менделеев опубликовал первую вполне зрелую периодическую систему. 5
Когда атомный номер сменил атомный вес, триады, которые были только приблизительными, стали точными. Возникновение триад стало объясняться как следствие двойникования длин периодов, которое происходит в периодической таблице. Помимо исключительного первого очень короткого периода из двух элементов, следующий период из восьми повторений повторяется, затем период из восемнадцати повторений, а затем период из тридцати двух повторений.
В результате этого шаблона любые три элемента, попадающие вертикально в периодическую таблицу, образуют идеальную триаду, если второй и третий из них являются членами периодов равной длины.
Предсказания для бория
Источник: © Martyn Poliakoff
Наименьшая в мире таблица Менделеева, выгравированная на волоске
Какое отношение все это имеет к элементу 107?
Если рассматривать энтальпии сублимации TcO 3 Cl, ReO 3 Cl и BhO 3 Cl, значения равны 49, 66 и 89 кДж моль -1 соответственно. Если бы кто-то попытался предсказать значение бория по двум другим на основе принципа триады, предсказание составило бы 83 кДж моль -1 , что всего на 6,7% отличается от экспериментального значения.
Если бы кто-то попытался предсказать значение бория по двум другим на основе принципа триады, предсказание составило бы 83 кДж моль -1 , что всего на 6,7% отличается от экспериментального значения.
Эта небольшая ошибка помогает поддержать представление о том, что борий твердо принадлежит к группе 7, независимо от каких-либо релятивистских эффектов.
Две триады направлений
Когда Менделеев сделал свои знаменитые предсказания свойств галлия, германия и скандия, он в основном использовал вычисления, подобные триадам. На самом деле, просто для верности, он использовал трезвучия в двух направлениях.
Например, он объяснил, как можно предсказать атомный вес селена, хотя он был фактически известен и мог использоваться для демонстрации эффективности метода (таблица 2).
Триады имеют прекрасную родословную, когда дело доходит до периодической таблицы. Может быть, теперь они снова помогут нам в решении этих постоянных проблем, связанных с размещением определенных элементов в таблице Менделеева.
Споры продолжаются
Источник: © Science & Society Picture Library
Спираль Крукса (1888 г.), представляющая порядок эволюции элементов Периодическая таблица теперь утихла, по крайней мере, на данный момент. Проблема с низкими атомными номерами, а именно с водородом и гелием, до сих пор остается открытым вопросом.
Видно, что в обычной таблице водород и гелий хорошо классифицированы, но таблица нерегулярна и содержит неудобные промежутки между многими элементами. В левой таблице закономерность проявляется в наибольшей степени, но химики по понятным причинам беспокоятся о том, чтобы отнести гелий к щелочноземельным элементам.
Что бы вы ни думали об этих дебатах, факт остается фактом: периодическая система, которую содержит и отображает периодическая таблица, является одним из самых замечательных открытий во всей науке. Он обеспечивает базовую связь между всеми 118 элементами, открытыми или синтезированными до сих пор. Такие разные вещества, как золото, гелий, сера, ртуть и кислород, связаны друг с другом в двумерном массиве.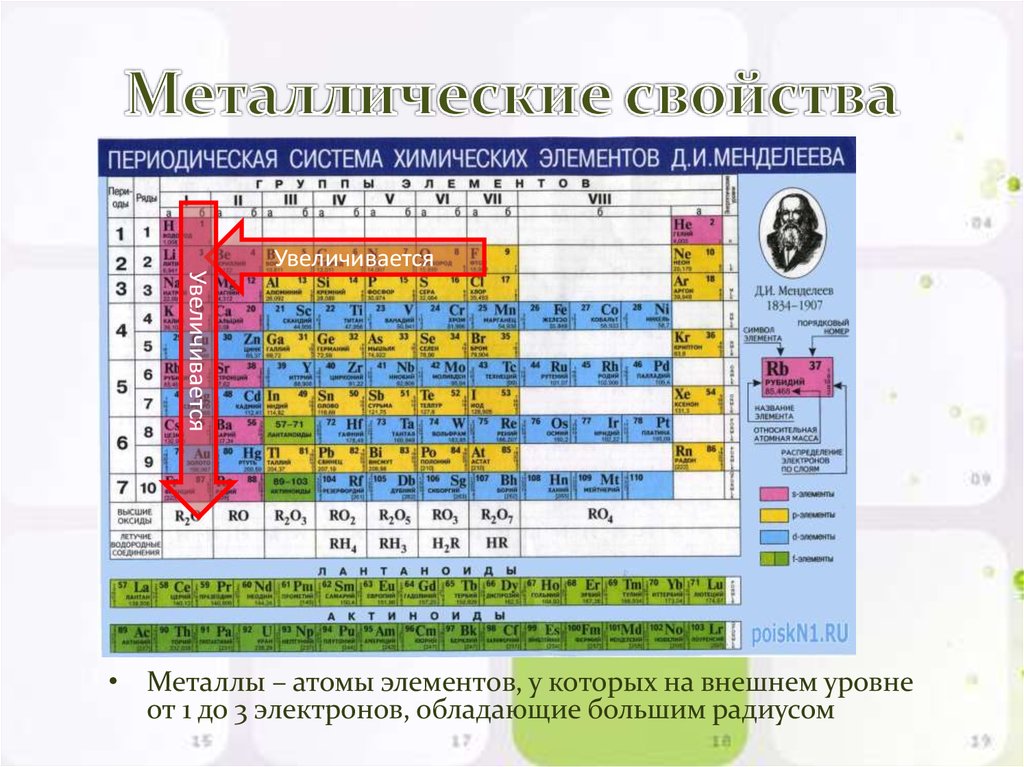 Тот же самый двумерный массив также послужил мотивом для многочисленных открытий в атомной и молекулярной физике, а также, конечно же, для многих других в области химии.
Тот же самый двумерный массив также послужил мотивом для многочисленных открытий в атомной и молекулярной физике, а также, конечно же, для многих других в области химии.
Эрик Шерри — преподаватель химии и философии науки в Калифорнийском университете в Лос-Анджелесе, Калифорния, США.
Периодическая таблица: краткая история периодической таблицы
В 1789 г., опираясь на работы как предшественников, так и современников, французы химик Антуан Лоран Лавуазье впервые определил элемент как основное вещество который нельзя было разрушить никакими известными тогда химическими средствами. В то же самое Трактат о химических элементах, он составил список из 33 элементов (ряд которые на самом деле не были элементами) и разработал систему именования для открытия новых элементы.
Определение и список элементов Лавуазье подстегнули попытки химиков систематизировать и
понять элементы. В 1803 году английский химик Джон Дальтон использовал общенаучную
признание того, что элементы соединяются друг с другом в различных весовых соотношениях для создания
атомная теория, утверждавшая, что все элементы состоят из переменного числа атомов водорода. Как часть
этой теории Дальтон создал шкалу атомного веса, основанную на водородной
атом (вес
водород был принят равным 1). В 1869 г.русский химик Дмитрий Менделеев организовал элементы в
таблицу по их атомному весу (немецкий химик Юлиус Лотар Мейер самостоятельно составил
при той же организации в 1870 г.).
Как часть
этой теории Дальтон создал шкалу атомного веса, основанную на водородной
атом (вес
водород был принят равным 1). В 1869 г.русский химик Дмитрий Менделеев организовал элементы в
таблицу по их атомному весу (немецкий химик Юлиус Лотар Мейер самостоятельно составил
при той же организации в 1870 г.).
Через шестьдесят семь лет после того, как Дальтон сформулировал атомную
значение периодической таблицы Менделеева многие ученые пытались создать работающую организационную
структура для элементов. Менделеев преуспел там, где другие потерпели неудачу, потому что понял, что
существовал ряд еще неизвестных элементов с атомным весом между весами уже известных
элементы. Оставив вакантными места для тех элементов, которые, по его мнению, не были открыты, он наткнулся на
организационная схема, которая, казалось, вертикально группировала элементы со сходными
характеристики. Среди
элементов с низким атомным весом, он обнаружил, что подобные химические характеристики повторяются каждые семь
элементы.

 В вышеприведённой таблице символы элементов главных подгрупп выровнены влево, а символы элементов побочных подгрупп — вправо.
В вышеприведённой таблице символы элементов главных подгрупп выровнены влево, а символы элементов побочных подгрупп — вправо.
 – 240 с.: ил.
– 240 с.: ил.