Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
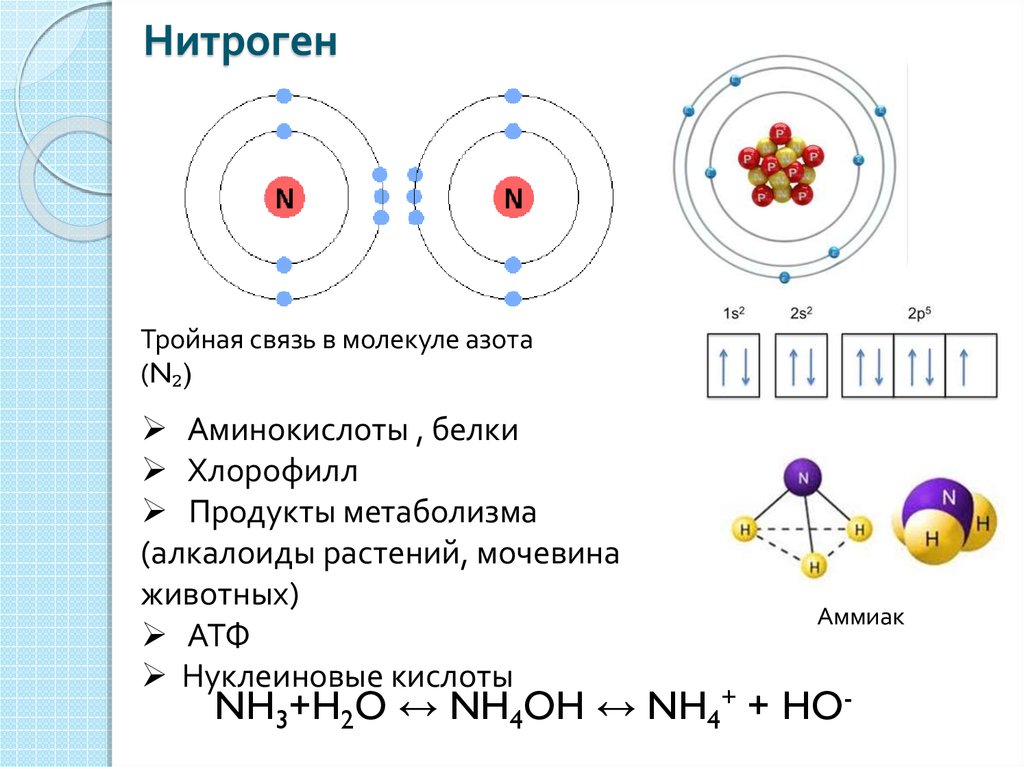
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10. 806
806
6
C
12.01
7
N
14.006
8
O
15.999
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87. 62
62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree. ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Kr Информация об элементе криптона: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура криптона
Твердотельная структура криптона Гранецентрированная кубическая .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ребер ячейки Константы решетки (a, b и c)
| a | b | c |
|---|---|---|
570. 6 pm 6 pm | 570.6 pm | 570.6 pm |
and the angles between them Lattice Angles (alpha, beta and gamma).
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | π/2 |
The positions of the atoms inside the unit cell are described by the set атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными). Степени окисления
Krypton Atomic and Orbital Properties
Krypton atoms have 36 electrons and the electronic shell structure is [2, 8, 18, 8 ] с символом атомарного члена (квантовые числа) 1 S 0 .
| Атомный номер | 36 |
| Число электронов (бесплатно) | 36 |
| Количество протонов | 36 |
| Массовый номер | 84 |
| Количество нейтронов | 48 | . 18, 8 |
| Электронная конфигурация | [AR] 3D10 4S2 4P6 |
| Валентные электроны | 4S2 4P6 |
| Валентность (Валентность) | 2 |
| Валентность (Валентность) | 2 |
| (Валентность) | 2 |
| (Валентность) | 2 |
| (Валентность) | 2 |
| (Валентность) | 2 |
| (Валентность)0028 | |
| Main Oxidation States | 0 |
| Oxidation States | 0, 1, 2 |
| Atomic Term Symbol (Quantum Numbers) | 1 S 0 |
Атомная модель криптона по Бору – количество электронов на энергетический уровень
Электронная конфигурация криптона в основном состоянии – нейтральный атом криптона
Сокращенная электронная конфигурация криптона
Сокращенная электронная конфигурация основного состояния нейтрального атома криптона: [Ar] 3d10 4s2 4p6. Часть конфигурации криптона, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, так как именно валентные электроны 4s2 4p6, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации криптона, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, так как именно валентные электроны 4s2 4p6, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального криптона
Полная электронная конфигурация основного состояния атома криптона. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
Электроны заполнены атомными орбиталями в порядке, определяемом принципом Ауфбау, принципом запрета Паули и правилом Хунда.
 …
…Атомная структура криптона
Атомный радиус криптона составляет 88 пм, а ковалентный радиус – 110 пм.
| Расчетный атомный радиус | 88 пм (0,88 Å) |
| Atomic Radius Empirical | – (0 Å) |
| Atomic Volume | 22.35 cm3/mol |
| Covalent Radius | 110 pm (1.1 Å) |
| Van der Waals Radius | 202 pm |
| Neutron Cross Section | 25 |
| Neutron Mass Absorption | 0.013 |
Atomic Spectrum of Krypton
Химические свойства криптона: Энергия ионизации криптона и сродство к электрону
Сродство к электрону криптона составляет 0 кДж/моль.
| Valence | 2 |
| Electronegativity | 3 |
| ElectronAffinity | 0 kJ/mol |
Ionization Energy of Krypton
Refer to table below for Ionization energies of Krypton
| Ionization energy number | Enthalpy – kJ/mol | |
|---|---|---|
| 1st | 1350.8 | |
| 2nd | 2350.4 | |
| 3rd | 3565 | |
| 4th | 5070 | |
| 5th | 6240 | |
| 6th | 7570 | |
| 7th | 10710 | |
| 8th | 12138 | |
| 9th | 22274 | |
| 10th | 25880 | |
| 11th | 29700 | |
| 12th | 33800 | |
| 13th | 37700 | |
| 14th | 43100 | |
| 15th | 47500 | |
| 16th | 52200 | |
| 17th | 57100 | |
| 18 -й | 61800 2 | 8|
. 0016 0016 | 19th | 75800 |
| 20th | 80400 | |
| 21st | 85300 | |
| 22nd | ||
| 23rd | 96300 | |
| 24th | 101400 | |
| 25th | 111100 | |
| 26th | 116290 | |
| 27th | 282500 | |
| 28th | 296200 | |
| 28th | 296200 | |
| 28th | 296200 | |
| 0028 | ||
| 29th | 311400 | |
| 30th | 326200 |
Krypton Physical Properties
Refer to below table for Krypton Physical Properties
| Density | 0.00375 g/cm3 |
| Молярный объем | 22,35 см3/моль |
Упругие свойства
| Модуль Юнга | – |
| Shear Modulus | – |
| Bulk Modulus | – |
| Poisson Ratio | – |
Hardness of Krypton – Tests to Measure of Hardness of Element
| Mohs Hardness | – |
| Твердость по Виккерсу | – |
| Твердость по Бринеллю | – |
Электрические свойства криптона
0004 Криптон — проводник электричества. Refer to table below for the Electrical properties ofKrypton
Refer to table below for the Electrical properties ofKrypton| Electrical Conductivity | – |
| Resistivity | – |
| Superconducting Point | – |
Krypton Heat and Conduction Properties
| Теплопроводность | 0,00943 Вт/(м·К) |
| Тепловое расширение | – |
Krypton Magnetic Properties
| Magnetic Type | Diamagnetic |
| Curie Point | – |
| Mass Magnetic Susceptibility | -4.4e-9 m3/kg |
| Молярная магнитная восприимчивость | -3,69e-10 м3/моль |
| Объемная магнитная восприимчивость | -1,65e-8 |
Оптические свойства криптона
| Refractive Index | 1. 000427 000427 |
Acoustic Properties of Krypton
| Speed of Sound | 1120 m/s |
Krypton Thermal Properties – Enthalpies and thermodynamics
Refer to table ниже для тепловых свойств криптона
| Температура плавления | 115,79 K (-157,36°C, -251,24799999999993 °F) |
| Температура кипения | 119.93 K (-153.22°C, -243.79599999999994 °F) |
| Critical Temperature | 209.41 K |
| Superconducting Point | – |
Enthalpies of Krypton
| Heat of Fusion | 1,64 кДж/моль |
| Тепло испарения | 9,02 кДж/моль |
| Тепло сжигания | – |
 0003
0003Криптон состоит из 32 изотопов, содержащих от 69 до 100 нуклонов. Криптон имеет 6 стабильных естественных изотопов.
Изотопы криптона – Встречающиеся в природе стабильные изотопы: 78Kr, 80Kr, 82Kr, 83Kr, 84Kr, 86Kr.
| Изотоп | Z | N | Изотопная масса | % | T половина | Режим запядно0027 69 | Synthetic | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 70Kr | 36 | 34 | 70 | Synthetic | ||||||||||||||||||||||||
| 71Kr | 36 | 35 | 71 | Synthetic | ||||||||||||||||||||||||
| 72Kr | 36 | 36 | 72 | Synthetic | ||||||||||||||||||||||||
| 73Kr | 36 | 37 | 73 | Synthetic | ||||||||||||||||||||||||
| 74Kr | 36 | 38 | 74 | Synthetic | ||||||||||||||||||||||||
| 75Kr | 36 | 39 | 75 | Synthetic | ||||||||||||||||||||||||
| 76Kr | 36 | 40 | 76 | Synthetic | ||||||||||||||||||||||||
| 77Kr | 36 | 41 | 77 | Synthetic | ||||||||||||||||||||||||
| 78Kr | 36 | 42 | 78 | 0. 35% 35% | Stable | N/A | ||||||||||||||||||||||
| 79Kr | 36 | 43 | 79 | Synthetic | ||||||||||||||||||||||||
| 80Kr | 36 | 44 | 80 | 2.28% | Stable | N/A | ||||||||||||||||||||||
| 81Kr | 36 | 45 | 81 | Synthetic | ||||||||||||||||||||||||
| 82Kr | 36 | 46 | 82 | 11.58% | Stable | N/A | ||||||||||||||||||||||
| 83Kr | 36 | 47 | 83 | 11.49% | Stable | N/A | ||||||||||||||||||||||
| 84Kr | 36 | 48 | 84 | 57% | Stable | |||||||||||||||||||||||
| 85Kr | 36 | 49 | 85 | Synthetic | ||||||||||||||||||||||||
| 86Kr | 36 | 50 | 86 | 17.3% | Stable | N/A | ||||||||||||||||||||||
| 87Kr | 36 | 51 | 87 | Synthetic | ||||||||||||||||||||||||
| 88Kr | 36 | 52 | 88 | Synthetic | ||||||||||||||||||||||||
| 89Kr | 36 | 53 | 89 | Synthetic | ||||||||||||||||||||||||
| 90Kr | 36 | 54 | 90 | Synthetic | ||||||||||||||||||||||||
| 91Kr | 36 | 55 | 91 | Synthetic | ||||||||||||||||||||||||
| 92Kr | 36 | 56 | 92 | Synthetic | ||||||||||||||||||||||||
| 93Kr | 36 | 57 | 93 | Synthetic | ||||||||||||||||||||||||
| 94Kr | 36 | 58 | 94 | Synthetic | ||||||||||||||||||||||||
| 95Kr | 36 | 59 | 95 | Synthetic | ||||||||||||||||||||||||
| 96Kr | 36 | 60 | 96 | Synthetic | ||||||||||||||||||||||||
| 97Kr | 36 | 61 | 97 | Синтетический | ||||||||||||||||||||||||
| 98KR | 36 | 98 | 98 | 78 | 98 | 78 | 98 | 98 | 98 | 0764 | ||||||||||||||||||
| 99Kr | 36 | 63 | 99 | Synthetic | ||||||||||||||||||||||||
| 100Kr | 36 | 64 | 100 | Synthetic |
The Element Krypton– Криптон Атом
| |||||
| Общие | |||||
|---|---|---|---|---|---|
| Имя, символ, номер | криптон, Кр, 36 | ||||
| Химическая серия | Благородные газы | ||||
| Группа, период, блок |  | ||||
| Плотность, твердость | 3,708 кг/м 3 ( 273 К ), нет данных | ||||
| Внешний вид | бесцветный | ||||
| Атомные свойства | |||||
| Атомный вес | 83,798 а.е.м. | ||||
| Атомный радиус (расч.) | нет данных (88) м | ||||
| Ковалентный радиус | 110 вечера | ||||
| Радиус Ван-дер-Ваальса | 202 вечера | ||||
| Электронная конфигурация | [Ар]3d 10 4s 2 4p 6 | ||||
| е – -е на уровень энергии | 2, 8, 18, 8 | ||||
| Степени окисления (оксид) | 0 (неизвестно) | ||||
| Кристаллическая структура | кубический центрированный по граням | ||||
| Физические свойства | |||||
| Состояние вещества | газ (немагнитный) | ||||
| Температура плавления | 115,79 К (-251,25 Ф) | ||||
| Точка кипения | 119,93 К (-153,22 Ф) | ||||
| Молярный объем | 27,99 10 -6 м 3 /моль | ||||
| Теплота парообразования | 9,029 кДж/моль | ||||
| Теплота плавления | 1,638 кДж/моль | ||||
| Давление паров | нет данных | ||||
| Скорость звука | 1120 м/с при 293,15 К | ||||
| Разное | |||||
| Электроотрицательность | 3,00 (шкала Полинга) | ||||
| Удельная теплоемкость | 248 Дж/(кг*К) | ||||
| Электропроводность | нет данных | ||||
| Теплопроводность | 0,00949 Вт/(м*К) | ||||
| 1 ст ионизация потенциал | 1350,8 кДж/моль | ||||
| 2 nd ионизация потенциал | 2350,4 кДж/моль | ||||
| 3 рд ионизация потенциал | 3565 кДж/моль | ||||
| 4 -й ионизация потенциал | 5070 кДж/моль | ||||
| 5 -й ионизация потенциал | 6240 кДж/моль | ||||
| 6 -й ионизация потенциал | 7570 кДж/моль | ||||
| 7 -й ионизация потенциал | 10710 кДж/моль | ||||
| 8 -й ионизация потенциал | 12138 кДж/моль | ||||
СИ
единицы и STP являются
используется, за исключением случаев, когда
отмеченный.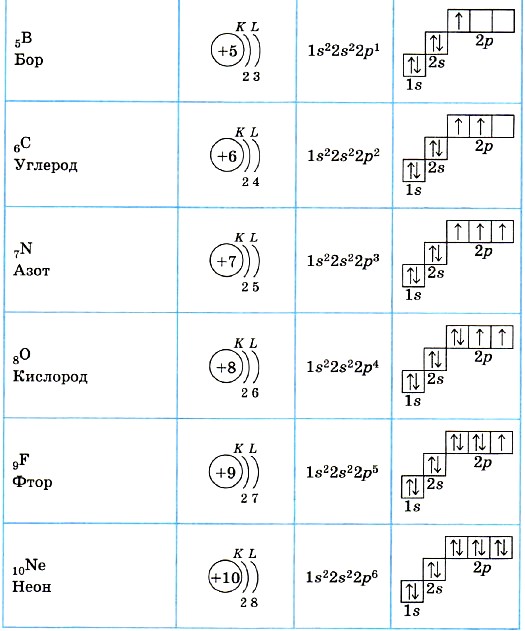 | |||||
Криптон это химический элемент
в периодической таблице
с символом Kr и атомный номер 36.
Бесцветный благородный газ,
криптон встречается в виде следов
количества в атмосфере,
выделяют фракционированием
сжиженный воздух и
часто используется с другими
редкие газы в флуоресцентном
лампы.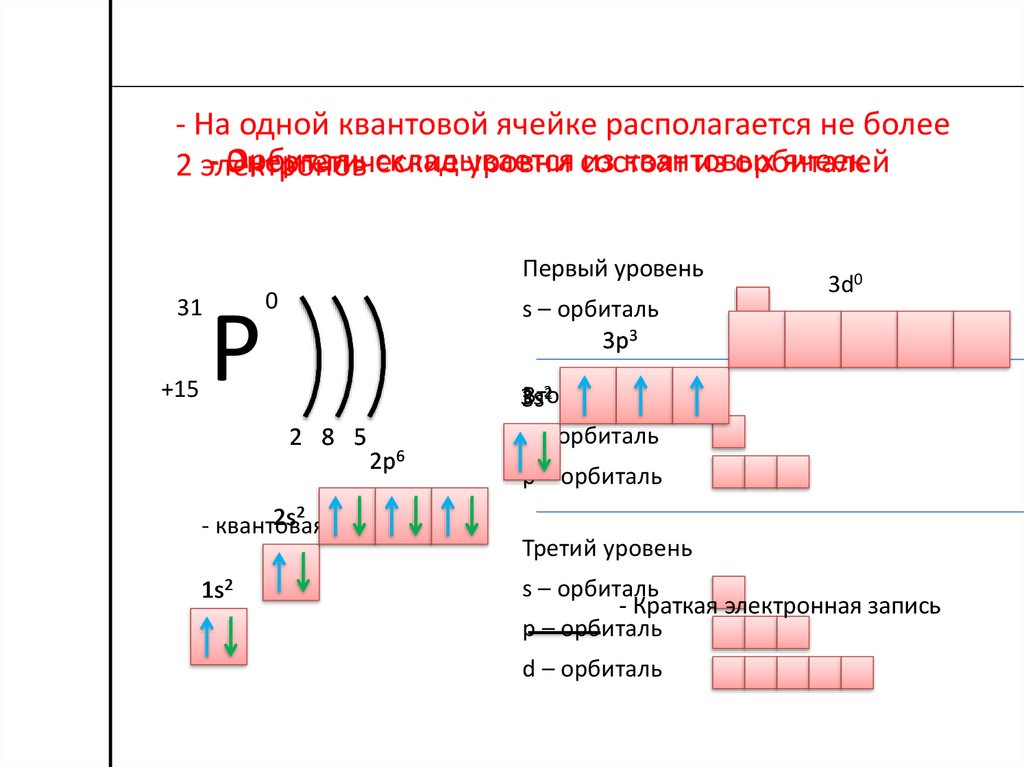 Криптон инертен
для большинства практических целей
но известно, что он формируется
соединения с фтором.
Криптон также может образовываться
клатраты с водой
когда его атомы захвачены
в решетке воды
молекулы.
Криптон инертен
для большинства практических целей
но известно, что он формируется
соединения с фтором.
Криптон также может образовываться
клатраты с водой
когда его атомы захвачены
в решетке воды
молекулы.
Примечательно характеристики
Криптон, т.н.
благородный газ из-за его очень
низкая химическая активность,
характеризуется
ярко-зеленый и оранжевый
спектральная подпись. Это
является одним из продуктов
деления урана. Затвердевший
криптон белый и кристаллический
с гранецентрированной кубической
кристаллическая структура, которая
является общим достоянием
все «редкие газы».
Это
является одним из продуктов
деления урана. Затвердевший
криптон белый и кристаллический
с гранецентрированной кубической
кристаллическая структура, которая
является общим достоянием
все «редкие газы».
Приложения
Стандартное определение SI
длины метра
было с 1960 по 1983 г.
на основе излучаемого света
возбужденными атомами криптона:
точнее метр
был определен как 1 650 763,73
длины волн оранжево-красного
испускаемая линия излучения
атомами криптона-86.
Клатраты криптона имеют
был сделан с гидрохиноном
и фенол. Кр-85 используется
в химическом анализе.
При размещении в различных
твердые вещества криптонаты
формируется и их деятельность
чувствителен к поверхности
химические реакции. Этот
благородный газ также используется
в фотовспышке
лампы нужны для скоростных
фотография, но это использование
ограничен из-за
высокая стоимость криптона.
История
Криптон (греч. криптос означает «скрытый») был
обнаружен в 1898 г.
Уильям Рамзи и Моррис
Траверсы в остатке слева
от испарения почти
все компоненты жидкости
воздух. В 1960 международных
соглашение определило
метр по свету
испускаемый из криптона
изотоп. Это соглашение
заменил давний
стандартный метр расположен
в Париже, который был металлом
стержень из платино-иридиевой
сплав (штанга изначально была
оценивается в один десяток
миллионная часть квадранта
полярной окружности Земли). 19 октября83 криптон
стандарт в свою очередь был заменен
Международным бюро
des Poids et Mesures (Международный
Бюро весов и
Меры). Метр
теперь определяется как расстояние
что свет проходит в
вакуум в течение 1/299 792 458
с.
19 октября83 криптон
стандарт в свою очередь был заменен
Международным бюро
des Poids et Mesures (Международный
Бюро весов и
Меры). Метр
теперь определяется как расстояние
что свет проходит в
вакуум в течение 1/299 792 458
с.
Возникновение
Концентрация
этот газ в земной атмосфере
составляет около 1 промилле.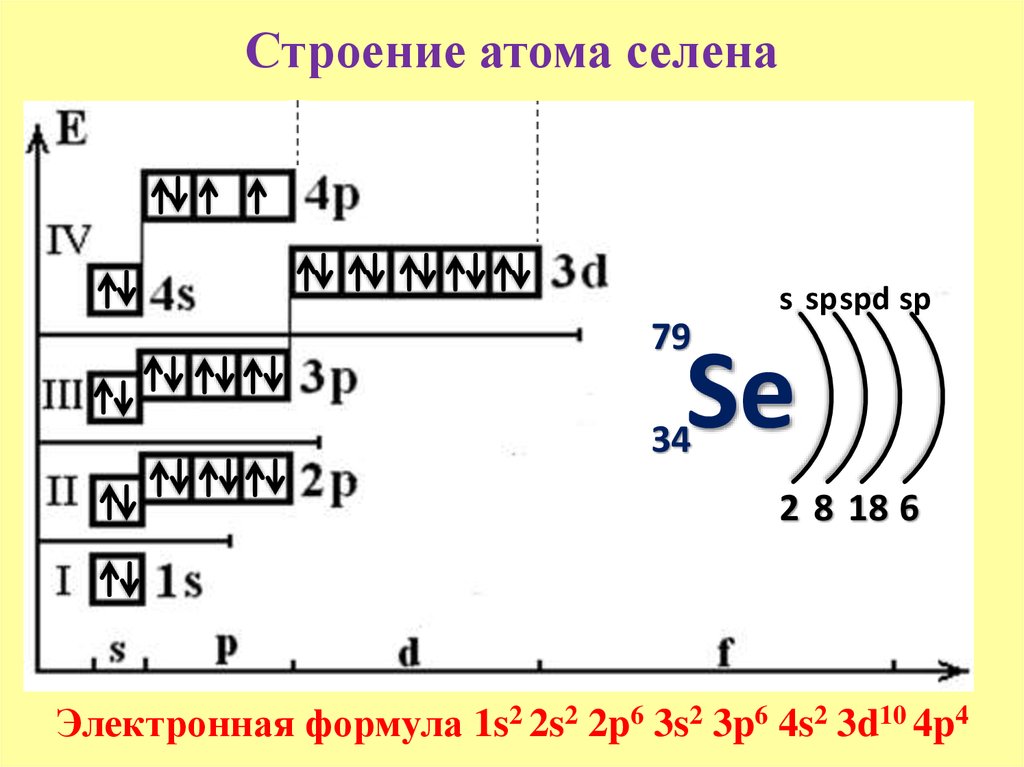 Он может
извлекаться из жидкости
воздух фракционной перегонкой.
Он может
извлекаться из жидкости
воздух фракционной перегонкой.
Соединения
Подобно другим инертным газам
криптон широко известен
быть химически инертным.
Однако исследования, проведенные
с 1960-е годы раскрыли
некоторые соединения криптона.
Криптон дифторид имеет
производится в граммах
и может производиться в
несколько разных способов.
Другие фториды и
соль криптона называется
оксикислота также была
найденный. АрКр+ и КрН+
молекулы-ионы были
расследовали и там
является доказательством KrXe или
КрХе+.
АрКр+ и КрН+
молекулы-ионы были
расследовали и там
является доказательством KrXe или
КрХе+.
Изотопы
Природный криптон
состоит из шести устойчивых
изотопы. Спектральный спектр Криптона
подпись легко производится
с некоторыми очень резкими линиями.
Кр-81 является продуктом
атмосферные реакции
с другим естественно
встречающиеся изотопы
криптон. это радиоактивно
с периодом полураспада 250 000
годы. Как ксенон, криптон
очень изменчив, когда
это вблизи поверхностных вод
и Кр-81 имеет поэтому
использовался для знакомства со старым
(50 000 – 800 000 лет)
грунтовые воды. Кр-85 есть
инертный радиоактивный благородный
газ с периодом полураспада
10,76 лет, что производится
делением урана
и плутоний.
это радиоактивно
с периодом полураспада 250 000
годы. Как ксенон, криптон
очень изменчив, когда
это вблизи поверхностных вод
и Кр-81 имеет поэтому
использовался для знакомства со старым
(50 000 – 800 000 лет)
грунтовые воды. Кр-85 есть
инертный радиоактивный благородный
газ с периодом полураспада
10,76 лет, что производится
делением урана
и плутоний. Источники
включили ядерную
испытание бомбы, ядерный
реакторы и выпуск
Кр-85 при переработке
топливных стержней ядерных
реакторы. Сильный градиент
существует между северным
и южные полушария
где концентрации при
Северный полюс примерно
на 30% выше, чем на юге
Полюс из-за конвекции
смешивание.
Источники
включили ядерную
испытание бомбы, ядерный
реакторы и выпуск
Кр-85 при переработке
топливных стержней ядерных
реакторы. Сильный градиент
существует между северным
и южные полушария
где концентрации при
Северный полюс примерно
на 30% выше, чем на юге
Полюс из-за конвекции
смешивание.
