А. Дроздов – Неорганическая химия читать онлайн
12 3 4 5 6 7 …28
М. В. Дроздова, А. А. Дроздов
Неорганическая химия
1. Взаимосвязь между процессами обмена веществ и энергии в организме. Термодинамическая система
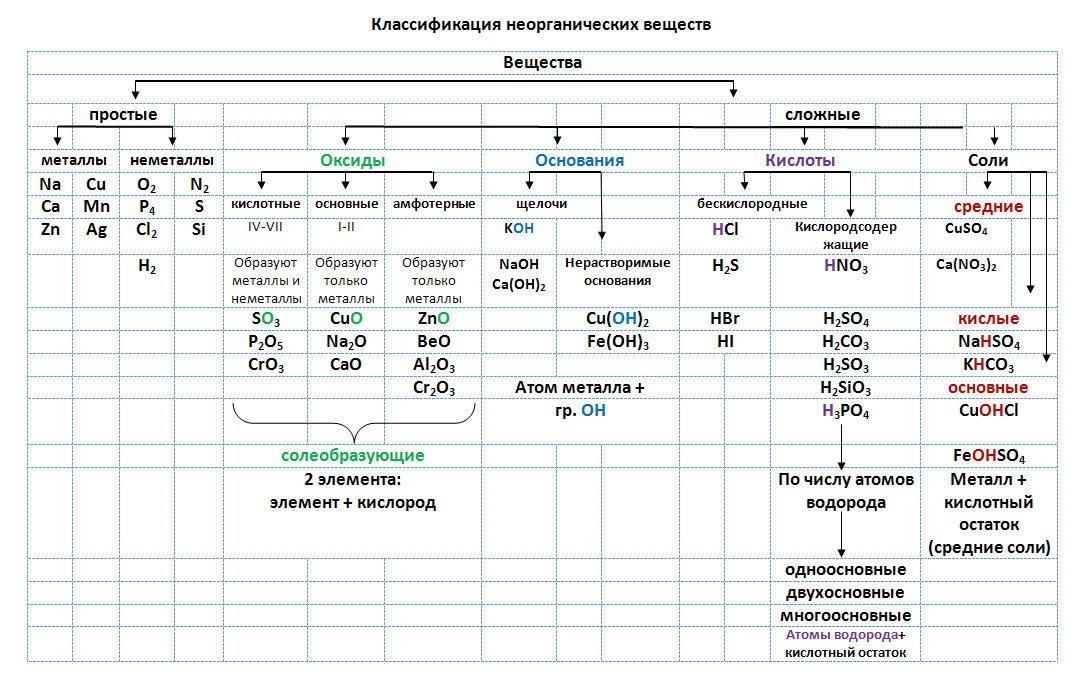
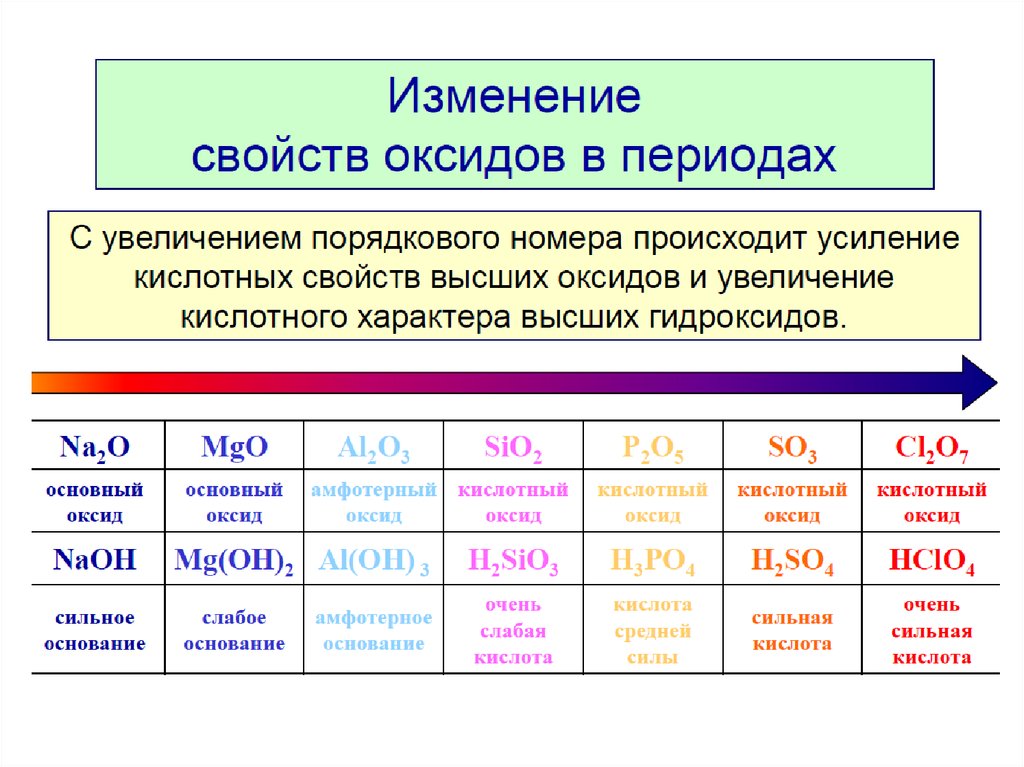
Процессы жизнедеятельности на Земле обусловле–ны в значительной мере накоплением солнечной энер–гии в биогенных веществах (белках, жирах, углеводах) и последующими превращениями этих веществ в жи–вых организмах с выделением энергии.
Работы А. М. Лавуазье (1743—1794) и П. С. Лапласа (1749– 1827) прямыми калориметрическими измерениями показа–ли, что энергия, выделяемая в процессе жизнедеятельнос–ти, определяется окислением продуктов питания кислородом воздуха, вдыхаемого животными.
С развитием в XIX—XX вв. термодинамики стало воз–можно количественно рассчитывать превращение энер–гии в биохимических реакциях и предсказывать их на–правление. Термодинамический метод основан на ряде строгих понятий: «система», «состояние системы», «внут–ренняя энергия системы», «функция состояния системы».
Термодинамической системой называется всякий объект природы, состоящий из достаточно большого чис–ла молекул (структурных единиц) и отделенный от дру–гих объектов природы реальной или воображаемой гра–ничной поверхностью (границей раздела).
Объекты природы, не входящие в систему, называют–ся средой.
Наиболее общими характеристиками систем являют–ся т – масса вещества, содержащегося в системе, и Е – внутренняя энергия системы. Масса вещества системы определяется совокупностью масс молекул, из которых она состоит. Внутренняя энергия системы представляет собой сумму энергий теплового движения молекул и энер–гии взаимодействия между ними.
Системы по характеру обмена веществом и энер–гией с окружающей средой подразделяют на три типа: изолированные, закрытые и открытые.
Изолированной системой называется такая систе–ма, которая не обменивается со средой ни веществом, ни энергией (Δm = 0, ΔE = 0). Закрытой системой назы–вается такая система, которая не обменивается со сре–дой веществом, но может обмениваться энергией (Δm = 0, ΔE^ 0).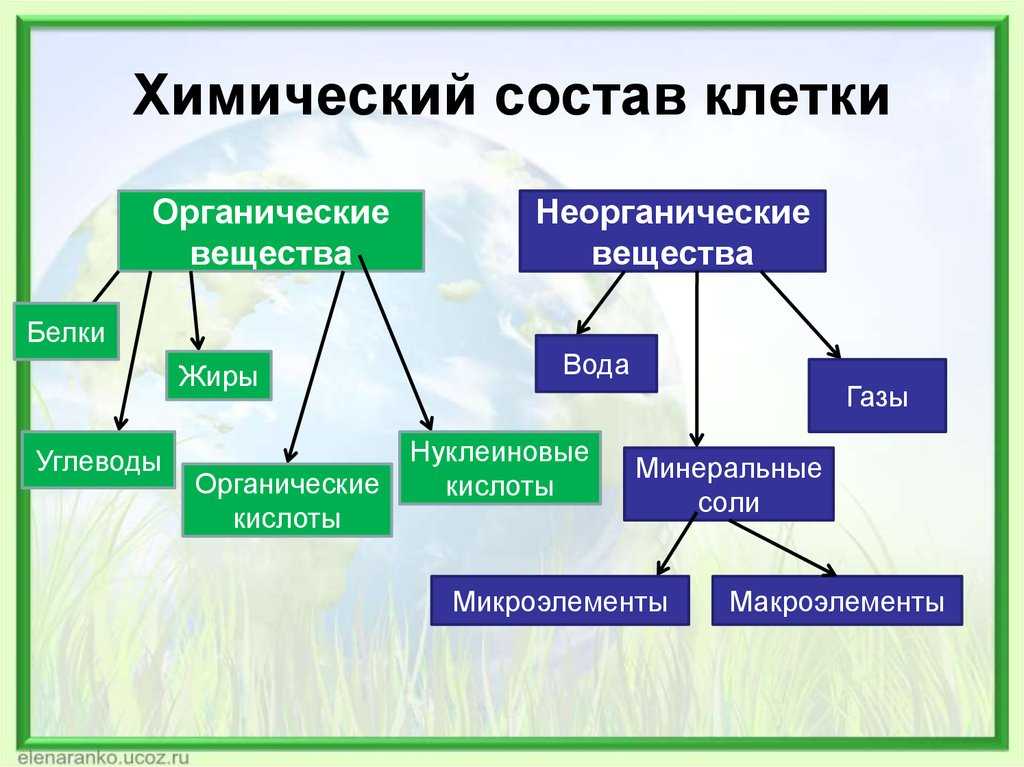
Обмен энергии может осуществляться передачей теп–лоты или совершением работы.
Открытой системой называется такая система, ко–торая может обмениваться со средой как веществом, так и энергией (Δm ≠ 0, ΔE ≠ 0).
Важным примером открытой системы является жи–вая клетка. Системы в зависимости от агрегатного состояния вещества, из которого они состоят, подраз–деляют на гомогенные и гетерогенные.
В гомогенной системе отсутствуют резкие измене–ния физических и химических свойств при переходе от одних областей системы к другим. Примером такой сис–темы может служить плазма крови, представляющая со–бой раствор различных биогенных веществ.
Гетерогенная система состоит из двух или более го–могенных частей. Примером гетерогенной системы яв–ляется цельная кровь, т. е. плазма с клетками – эри–троцитами и лейкоцитами.
2. Первое начало термодинамики. Понятия, характеризующие систему
Первое начало термодинамики представляет собой стро–гую количественную основу для анализа энергетики различ–ных систем. Для его формулировки необходимо ввести ряд новых понятий, характеризующих систему.
Для его формулировки необходимо ввести ряд новых понятий, характеризующих систему.
Одним из важнейших понятий является состояние системы.
Под состоянием понимают совокупность свойств сис–темы, позволяющих определить систему с точки зрения тер–модинамики.
В качестве обобщенной характеристики состояния системы применяют понятия: «равновесное», «стацио–нарное», «переходное состояние».
Состояние системы называется равновесным, если все свойства остаются постоянными в течение какого угодно большого промежутка времени и в системе от–сутствуют потоки вещества и энергии.
Если свойства системы постоянны во времени, но име–ются потоки вещества и энергии, состояние называется стационарным.
Количественно состояния различают с помощью термо–динамических переменных. Термодинамические перемен–ные – такие величины, которые характеризуют состояние системы в целом. Их называют еще термодинамическими параметрами системы. Важнейшими термодинамическими переменными являются давление р, температура Т, объем системы V или общая масса системы m, массы химических веществ (компонент) mk, из которых состоит система, или концентрация этих веществ те. Следует отметить, что ана–логичные характеристики (температура, масса, состав био–логических жидкостей, артериальное давление) использу–ются врачом для определения состояния больного.
Следует отметить, что ана–логичные характеристики (температура, масса, состав био–логических жидкостей, артериальное давление) использу–ются врачом для определения состояния больного.
Переход системы из одного состояния в другое называется процессом.
В результате процесса состояние системы и термоди–намические переменные изменяются. Если обозначить значение термодинамической переменной в начальном состоянии через Х1 ,ав конечном – X2 , то изменение этой переменной соответственно равно ΔX = X2 – X1 и на–зывается приращением термодинамической перемен–ной X. Приращение, взятое с обратным знаком, называ–ется убылью переменной X.
Внутренняя энергия системы Е – одна из термодинами–ческих функций состояния. Важная особенность функций со–стояния – их независимость от способа достижения данно–го состояния системы.
Изменение внутренней энергии системы ΔE обуслов–лено работой W, которая совершается при взаимодейст–вии системы со средой, и обмен теплотой Q между средой и системой, отношение между этими величинами состав–ляет содержание первого начала термодинамики.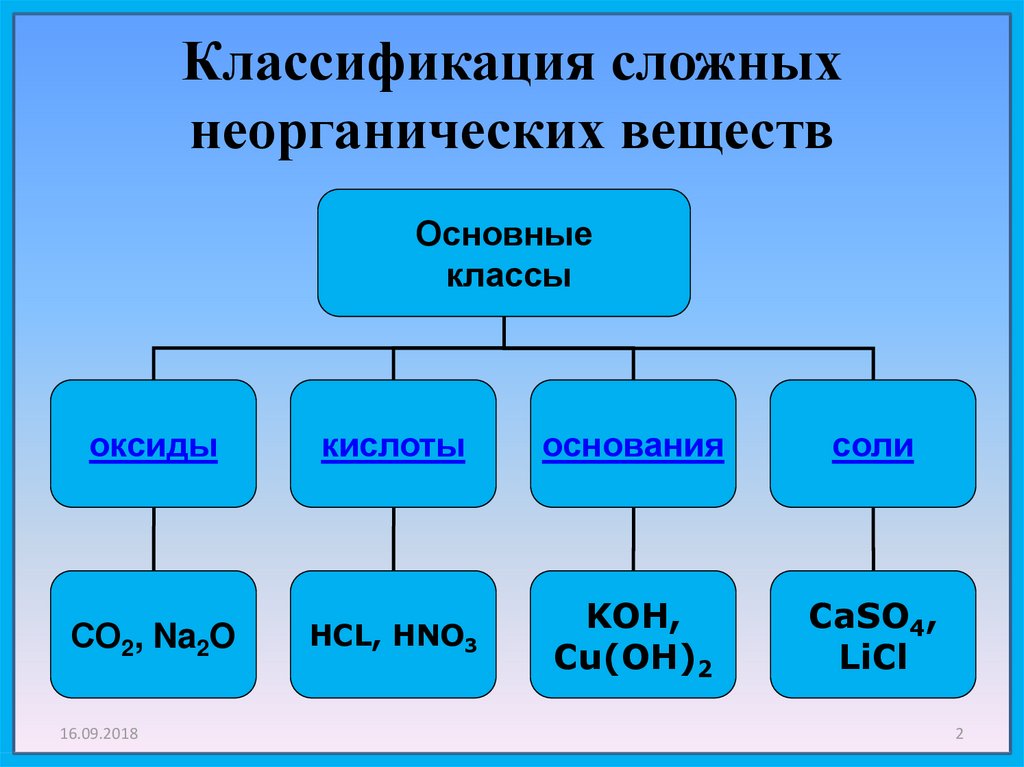
Приращение внутренней энергии системы ΔE в некотором процессе равно теплоте Q, получен–ной системой, плюс работа W, совершенная над системой в этом процессе:
ΔE = Q + W.
В биологических системах теплота обычно отдается системой во внешнюю среду, а работа совершается системой за счет убыли внутренней энергии. Матема–тическую запись первого начала термодинамики удоб–но представить в виде:
-ΔE = –Q – W.
Все величины в приведенных формулах измеряются в джоулях (Дж).
3. Первое начало термодинамики
Первое начало термодинамики относится к числу фун–даментальных законов природы, которые не могут быть выведены из каких-то других законов. Его справедливость доказывают многочисленные эксперименты, в частности неудачные попытки построить вечный двигатель первого рода, т. е. такую машину, которая смогла бы как угодно долго совершать работу без подвода энергии извне.
В зависимости от условий протекания процесса в сис–теме используют различные функции состояния, которые выводят из первого начала термодинамики. При этом вместо сложных биологических систем для получения выводов о превращениях массы и энергии используют упрощенные модели. Давление в системе при этом под–держивается постоянным, оно равно внешнему давле–нию. Такие процессы, протекающие при р = const, назы–ваются изобарными. Работа расширения, совершае-мая при изобарном процессе, как известно, равна:
При этом вместо сложных биологических систем для получения выводов о превращениях массы и энергии используют упрощенные модели. Давление в системе при этом под–держивается постоянным, оно равно внешнему давле–нию. Такие процессы, протекающие при р = const, назы–ваются изобарными. Работа расширения, совершае-мая при изобарном процессе, как известно, равна:
Читать дальше
12 3 4 5 6 7 …28
Кафедра неорганической химии и химической технологии
- Направления подготовки
- Научная деятельность
- Международная деятельность
- Сотрудничество
- Документы
| Уровень образования | Направление подготовки/специальность | Код | Профили | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| бакалавриат | Химическая технология | 18. 03.01 03.01 |
Технология неорганических, органических соединений и переработки полимеров | ||||||||||||
|
18.03.01 Химическая технология (Технология полимеров, неорганических материалов и материалов, биологически активных соединений)
|
|||||||||||||||
|
18.03.01 Химическая технология (Химическая технология неметаллических и силикатных материалов)
|
|||||||||||||||
| специалитет | Химическая технология материалов современной энергетики | 18.05.02 | Технология теплоносителей и радиоэкология ядерных энергетических установок | ||||||||||||
|
18.05.02 Химическая технология материалов современной энергетики (Технология теплоносителей и радиоэкология ядерных энергетических установок)
|
|||||||||||||||
| магистратура | Химическая технология | 18.04.01 | Химическая технология неорганических веществ | ||||||||||||
|
18.
|
|||||||||||||||
| аспирантура | Химическая технология | 18. 06.01 06.01 |
– | ||||||||||||
|
18.06.01 Химическая технология (-)
|
|||||||||||||||
| аспирантура | Химические науки | 04.06.01 | Неорганическая химия | ||||||||||||
|
04.06.01 Химические науки (Нерганическая химия)
|
|||||||||||||||
Основное научное направление кафедры:
Исследование физико-химических процессов, протекающих в гетерогенных системах.
Научные школы:
| Научный сотрудник | Направление научных исследований |
|---|---|
|
– |
Электродиализ технологических водных растворов – отходов крупнотоннажных производств |
|
– |
Исследование кинетики и механизма протекания твердофазных процессов при нагревании |
|
– |
Исследование процессов кристаллизации в многокомпонентных системах на основе растворов неорганических солей |
|
– |
Очистка водных сред от различных поллютантов модифицированными сорбентами на основе природных и техногенных материалов |
|
– |
Синтез и исследование нанодисперсных оксидов редкоземельных металлов |
|
– |
Концентрирование и разделение благородных металлов |
Сотрудники кафедры осуществляют научное консультирование по вопросам технологии производства и переработки неорганических веществ.
Ведется активная научно-исследовательская работа со студентами, которые участвуют в различных мероприятиях, становясь призерами и дипломантами международных и всероссийских олимпиад и конкурсов.
Отчет по НИД
Партнерами кафедры являются: Филиал АО «Концерн Росэнергоатом» -«Нововоронежская атомная станция», АНО ДПО «Техническая академия Росатома», АО «Минудобрения», АО «Корпорация НПО «РИФ», ОАО ПКФ «Воронежский Керамический Завод», ОАО «Электросигнал», ООО «БЗС «Монокристалл», Воронежский филиал «Евроцемент Груп»
- Положение о кафедре
- Отчет о самообследовании 04.06.01
- Отчет о самообследовании 18.04.01
- Отчет о самообследовании 18.05.02
1.3: История неорганической химии
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 151354
Металлы играют важную роль во многих аспектах человеческой цивилизации и определили века человеческой истории. Период времени примерно с 3300 г. до н.э. по 1200 г. до н.э. часто называют бронзовым веком. В этот период наши предки впервые начали использовать металл и научились смешивать различные элементы с медью, чтобы получить прочный сплав, называемый бронзой. Этот век принес значительный прогресс в изготовлении более острых ножей и более прочного оружия из металла, а не из камня, дерева и кости. Около 1200 г. до н.э. человечество нашло еще более твердый металл и открыло гораздо более прочный сплав, названный сталью. Этот период известен как железный век. Совсем недавно периоды времени, известные как «Золотая лихорадка», вызвали огромные изменения в распределении населения и благосостоянии в некоторых странах. Металл имеет очевидное значение в нашем современном образе жизни. Сегодня железо и сталь используются для изготовления зданий, машин, автомобилей, ювелирных изделий, кастрюль, инструментов, оружия, транспортных средств, электроники, хирургических инструментов и символических сооружений, таких как Эйфелева башня и Статуя Свободы.
Период времени примерно с 3300 г. до н.э. по 1200 г. до н.э. часто называют бронзовым веком. В этот период наши предки впервые начали использовать металл и научились смешивать различные элементы с медью, чтобы получить прочный сплав, называемый бронзой. Этот век принес значительный прогресс в изготовлении более острых ножей и более прочного оружия из металла, а не из камня, дерева и кости. Около 1200 г. до н.э. человечество нашло еще более твердый металл и открыло гораздо более прочный сплав, названный сталью. Этот период известен как железный век. Совсем недавно периоды времени, известные как «Золотая лихорадка», вызвали огромные изменения в распределении населения и благосостоянии в некоторых странах. Металл имеет очевидное значение в нашем современном образе жизни. Сегодня железо и сталь используются для изготовления зданий, машин, автомобилей, ювелирных изделий, кастрюль, инструментов, оружия, транспортных средств, электроники, хирургических инструментов и символических сооружений, таких как Эйфелева башня и Статуя Свободы.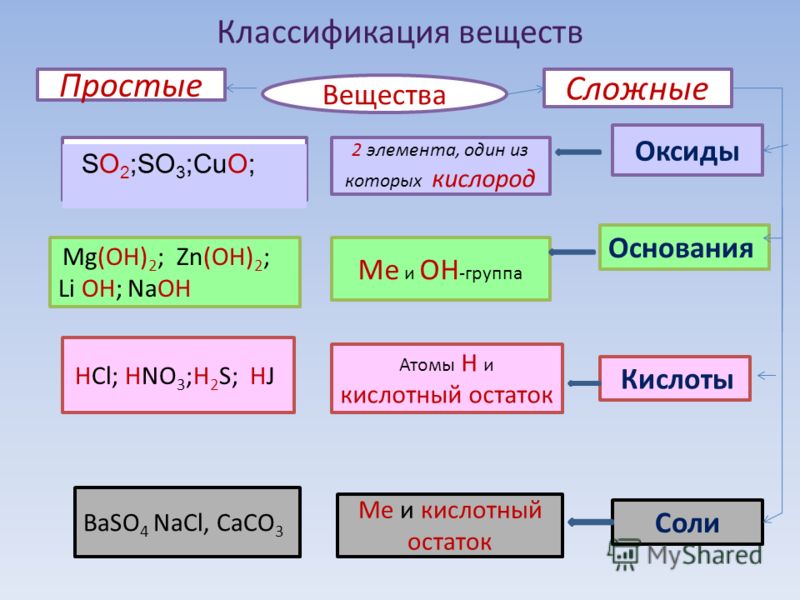 Золото, серебро и медь по-прежнему служат валютой для торговли и обмена товарами и услугами.
Золото, серебро и медь по-прежнему служат валютой для торговли и обмена товарами и услугами.
Химия как область изучения во многом обязана тому факту, что золото было ценным товаром на протяжении всей нашей истории. Как в древнеегипетском обществе, так и во времена Римской империи золотые прииски были собственностью государства, а не отдельного лица или группы. Таким образом, у большинства людей было немного способов легально получить золото для себя. Алхимики были разнообразной группой ученых и шарлатанов, которые стремились решить эту проблему, создав Философский камень (который вызвал превращение свинца в золото). Известны три основных течения алхимии: китайское, индийское и европейское, причем все три течения имеют некоторые общие черты. Методы, разработанные в европейском потоке, в конечном итоге повлияли на развитие науки о химии.
Рисунок \(\PageIndex{1}\). Алхимический рецепт. Многие конкретные подходы, которые использовали алхимики, пытаясь превратить свинец в золото, расплывчаты и неясны. У каждого алхимика был свой код для записи своих данных. Процессы держались в секрете, чтобы другие не могли получить от них прибыль. Различные ученые разработали свой собственный набор символов, записывая полученную информацию. Многие алхимики были не очень честны, брали деньги у дворянина, заявляя, что способны делать золото из свинца, а затем уезжали из города посреди ночи. Иногда дворянин обнаруживал мошенничество и вешал алхимика. К 1300-м годам несколько европейских правил объявили алхимию незаконной и установили строгие наказания для тех, кто занимается алхимическими искусствами.
У каждого алхимика был свой код для записи своих данных. Процессы держались в секрете, чтобы другие не могли получить от них прибыль. Различные ученые разработали свой собственный набор символов, записывая полученную информацию. Многие алхимики были не очень честны, брали деньги у дворянина, заявляя, что способны делать золото из свинца, а затем уезжали из города посреди ночи. Иногда дворянин обнаруживал мошенничество и вешал алхимика. К 1300-м годам несколько европейских правил объявили алхимию незаконной и установили строгие наказания для тех, кто занимается алхимическими искусствами. Хотя алхимикам так и не удалось превратить свинец в золото, они внесли некоторый вклад в современную химию. Были открыты сильные кислоты и основания, в том числе азотная кислота (\(ce{HNO3}\)), серная кислота (\(\ce{h3SO4}\)), соляная кислота (\(\ce{HCl}\)), а также гидроксид натрия (\(\ce{NaOH}\)). Была разработана стеклянная посуда для проведения химических реакций, а также методы дистилляции, кристаллизации и сублимации. Алхимия помогла улучшить изучение металлургии и извлечения металлов из руд. Были разработаны более систематические подходы к исследованиям, которые позволили открыть атомы и заложили основу для разработки периодической таблицы. Чтобы узнать больше об истории химии в целом, посетите страницу LibreText A Brief History of Chemistry.
Алхимия помогла улучшить изучение металлургии и извлечения металлов из руд. Были разработаны более систематические подходы к исследованиям, которые позволили открыть атомы и заложили основу для разработки периодической таблицы. Чтобы узнать больше об истории химии в целом, посетите страницу LibreText A Brief History of Chemistry.
Неорганические соединения известны и используются с древних времен; вероятно, самым старым является темно-синий пигмент, называемый берлинской лазурью (\(\ce{Fe4[Fe(CN)6]3}\)). Однако химическая природа этих веществ была неизвестна до конца девятнадцатого и начала двадцатого века, когда возникла современная область координационной химии. Многое из того, что мы знаем о неорганической химии, в основном основано на работах и дебатах между Альфредом Вернером (1866–1919; Нобелевская премия по химии в 1913 г.) и Софусом Мадсом Йоргенсеном (1837–1919 гг.).14). После того, как Вернер преуспел в этих дебатах, популярность области неорганической химии снизилась до середины двадцатого века, когда вторая мировая война вызвала новый интерес. В послевоенное время было сделано несколько важных открытий и теорий. Например, были разработаны важные теории связи в координационных соединениях.
В послевоенное время было сделано несколько важных открытий и теорий. Например, были разработаны важные теории связи в координационных соединениях.
Вскоре после Второй мировой войны были разработаны Теория кристаллического поля (CFT) и Теория лигандного поля (LFT). Это две критически важные и дополняющие друг друга теории, которые объясняют спектроскопические, химические и структурные свойства неорганических координационных соединений, причем CFT более проста, а LFT более точна. В 19В 50-х годах были открыты металлоорганические катализаторы, катализирующие важные органические реакции, и был открыт процесс Габера-Боша. Процесс Габера-Боша катализируется неорганическим оксидным катализатором и является одной из самых важных промышленных реакций в мире. Он предусматривает синтез аммиака непосредственно из элементарного азота N 2 и водорода H 2 .
\[ \ce{N_2(g) + 3H_2(g) \rightleftharpoons 2NH_3 (g)} \label{eq1} \]
С момента своего появления в начале двадцатого века он привел к производству огромного количества удобрений, значительно увеличив глобальное производство продуктов питания. В результате было подсчитано, что значительная часть содержания азота в типичном человеческом организме в конечном итоге образуется в результате этого процесса. Тем не менее, в то время как реакция должна проходить при высоких температурах и давлении в промышленных условиях, фермент нитрогеназа в корнях растений может проводить эту реакцию в мягких условиях в почве. Затем интенсивные исследования были направлены на улучшение неорганических катализаторов за счет понимания металлических кофакторов в ферментах. Связь между промышленным процессом Габера-Боше и ферментом нитрогеназой была ранним мостом между областями металлоорганической химии и биохимии.
В результате было подсчитано, что значительная часть содержания азота в типичном человеческом организме в конечном итоге образуется в результате этого процесса. Тем не менее, в то время как реакция должна проходить при высоких температурах и давлении в промышленных условиях, фермент нитрогеназа в корнях растений может проводить эту реакцию в мягких условиях в почве. Затем интенсивные исследования были направлены на улучшение неорганических катализаторов за счет понимания металлических кофакторов в ферментах. Связь между промышленным процессом Габера-Боше и ферментом нитрогеназой была ранним мостом между областями металлоорганической химии и биохимии.
https://chem.libretexts.org/Bookshel…tion_Compounds
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- философский камень
Что такое неорганическая химия?
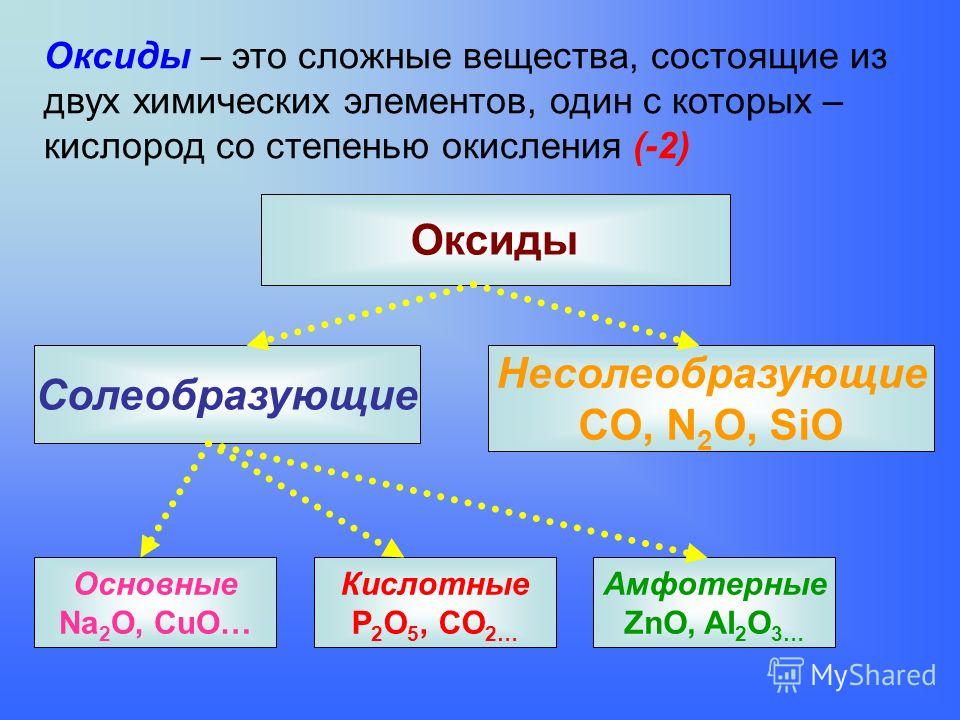
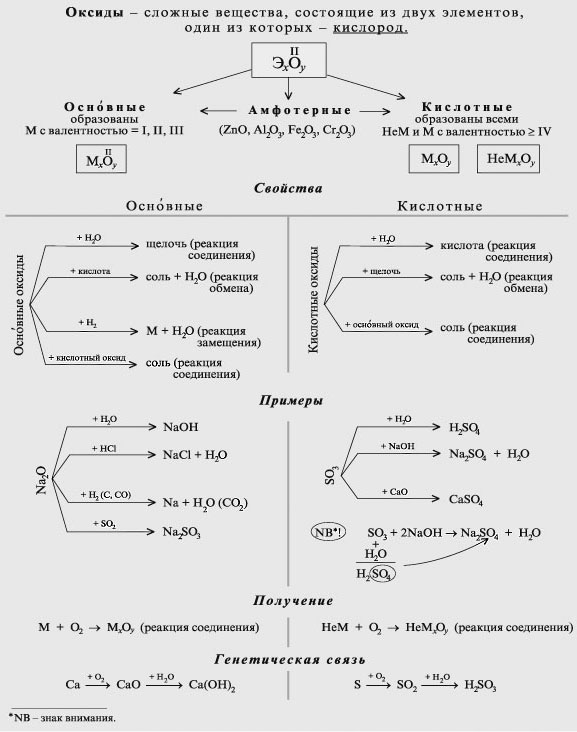
Неорганическая химия изучает свойства и реакции неорганических элементов и соединений, существующих в природе в земле и не содержащих углерод-водородной связи. Неорганические вещества, такие как углекислый газ, кислород, минералы и вода, необходимы для поддержания жизни.
В чем разница между неорганической химией и органической химией?
В то время как неорганическая химия занимается изучением элементов и соединений, не содержащих углерод-водородной связи, органическая химия занимается изучением элементов и соединений, содержащих углерод-водородную связь. Эти два поля могут также перекрываться в соединениях, которые содержат металл, связанный непосредственно с углеродом, таких как металлоорганические соединения.
Примеры неорганических соединений и элементов:
- Table salt or sodium chloride
- Carbon dioxide
- Diamond (pure carbon)
- Silver
- Sulfur
- Oxides
- Sulfates
- Phosphates
- Chlorides
- Fluorides
- Nitrites
- Nitrates
- Bromides
- Все элементы Периодической таблицы, кроме элементов, связанных с углеродом
Примеры органических соединений и элементов:
- ДНК
- Столовый сахар или сахароза
- Бензол
- Метан
- Этанол или зерновой спирт
- углерод (когда связан с водородом)
Примеры соединений с перекрывающимися органическими и неорганическими элементами являются металлы или металлоиды, связанные с углеродом:
- Boron
- Сили.
- Германий
- Теллур
- Мышьяк
- Сурьма
- Водород
- Кислород
- Азот
Какое значение имеет все живое для человека?
Металлы
Неорганические металлы настолько важны для цивилизации, что века человеческого существования названы в честь металла, наиболее используемого в этот период, начиная с бронзового века (3300 г. до н.э. – 1200 г. до н.э.). Металлы используются в бесчисленном количестве предметов повседневного обихода, таких как транспортные средства, машины, инструменты, оружие, посуда и вся электроника, включая сотовые телефоны, компьютеры и телевизоры. В то время как некоторые металлы встречаются в чистом виде, большинство из них находится в силикатах и оксидах, из которых металлы должны быть выделены из минералов.
до н.э. – 1200 г. до н.э.). Металлы используются в бесчисленном количестве предметов повседневного обихода, таких как транспортные средства, машины, инструменты, оружие, посуда и вся электроника, включая сотовые телефоны, компьютеры и телевизоры. В то время как некоторые металлы встречаются в чистом виде, большинство из них находится в силикатах и оксидах, из которых металлы должны быть выделены из минералов.
Пигменты
Еще одним ранним примером неорганических химикатов, используемых в обществе, является темно-синий пигмент, называемый берлинской лазурью, который состоит из катионов железа, анионов цианида и воды. Название возникло в 18 веке, когда смесь использовалась для окрашивания пальто для прусской армии. На протяжении веков пигмент имел другие названия, а также множество других применений, таких как:
- Краски, чернила и эмали
- Текстиль, резина и пластик
- Противоядие при отравлении тяжелыми металлами
- Гистопатологический краситель для обнаружения железа
- Ленты для пишущих машинок и копировальная бумага
Несмотря на то, что этот важный пигмент содержит цианидные группы, он не токсичен для человека.


 Квалификация
Квалификация Должности (с учетом присваиваемых квалификаций)
Должности (с учетом присваиваемых квалификаций) Нормативный срок обучения (очная форма)
Нормативный срок обучения (очная форма) Трудоустройство в зависимости от квалификации (примеры компаний и организаций)
Трудоустройство в зависимости от квалификации (примеры компаний и организаций)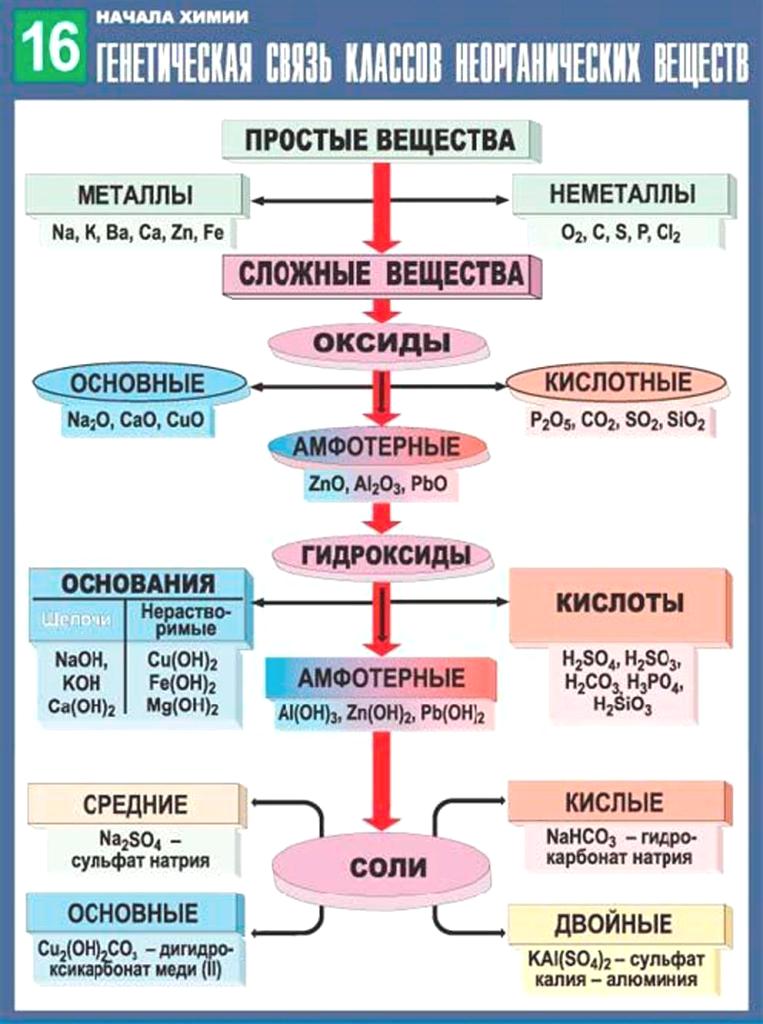
 Трудоустройство в зависимости от квалификации
Трудоустройство в зависимости от квалификации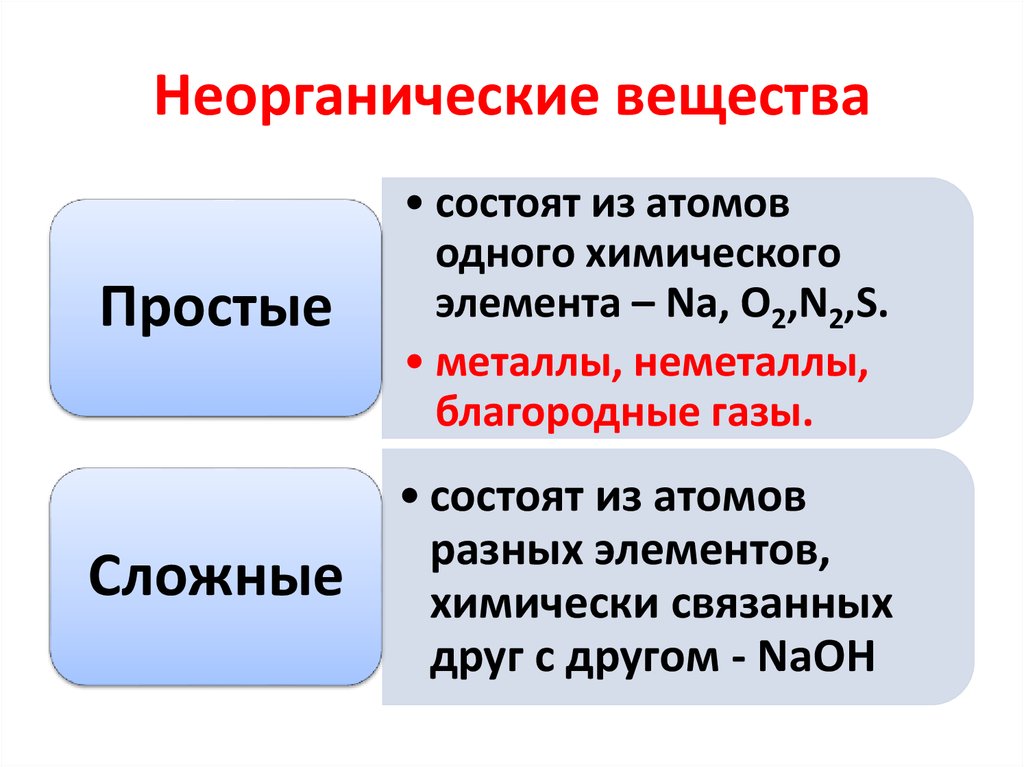 Преподаватель-исследователь
Преподаватель-исследователь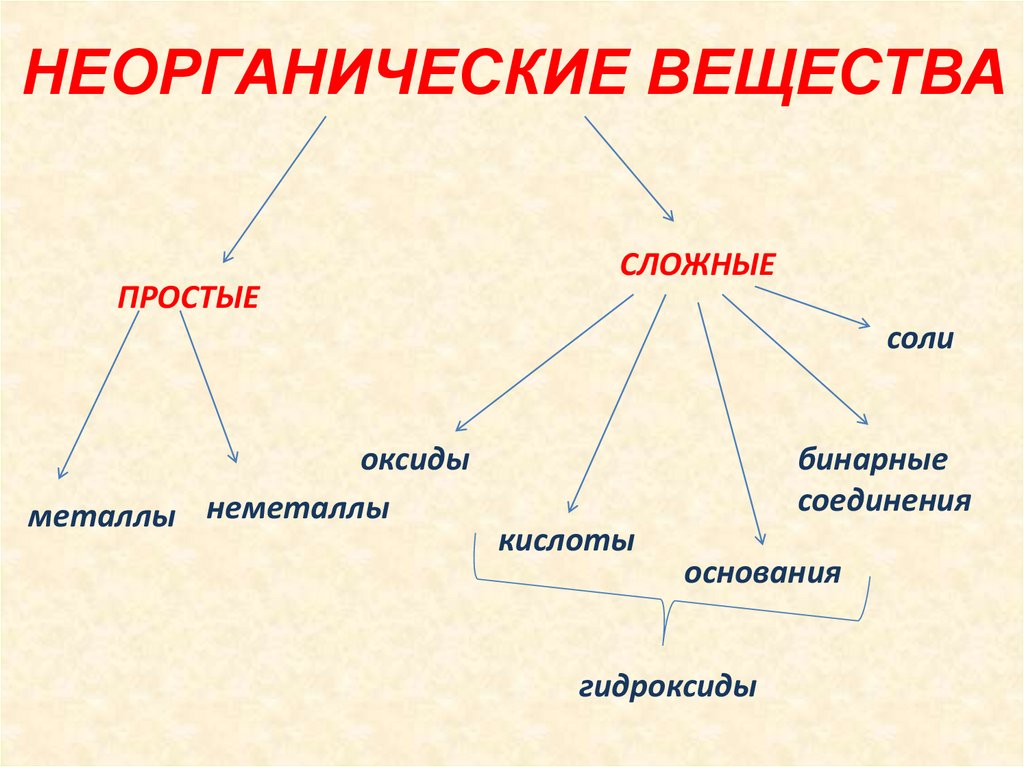 Должности
Должности