[PDF] Предмет органической химии – Free Download PDF
Download Предмет органической химии…
ПЛАН – КОНСПЕКТурока химии в 9 классе МОУ СОШ № 13 ТЕМА: Предмет органической химии.
Учитель: Шпикалева Татьяна Юрьевна
Копейск 2008 г.
ЗАДАЧИ УРОКА: Учебный аспект: 1. Сформировать понятие о предмете органической химии 2. Рассмотреть особенности органических веществ. 3. Раскрыть основные положения теории химического строения органических веществ А.М.Бутлерова.
Развивающий аспект: 1. Формирование навыков составления структурных формул
Воспитательный аспект: 1. Воспитание активности, аккуратности, умения работать в сотрудничестве с другими. 2. Активизация внимательности, настойчивости, упорства в достижении поставленной цели, заинтересованности в получении знаний; 3. Точный аналитический подход к рассмотрению химического строения веществ.
ТИП УРОКА: изучение нового материала
этап урока
Вре мя
деятельность Учителя
учащихся
Методы обучения
Формы работы
и
I. Организационный
Организационный
3 мин
– проверить готовность к уроку; – назвать тему, цели урока – объявить план урока Сегодня мы начинаем изучать органические вещества, общая численность которых в настоящее время составляет более 27 млн веществ, причем каждый год их число увеличивается на 200 – 300 тысяч новых соединений. Общее число неорганических соединений не превышает 700 тысяч. Таким образом число органических соединений превышает в десятки раз число неорганических соединений. Чем обусловлено такое многообразие органических веществ? В чем их особенность? Ответы на эти вопросы вы получите при изучении нового раздела химической науки – органической химии
Фронталь-ная Приветствуют преподавателя. Адаптируются к рабочему месту. Осмысливают поставленные преподавателем учебные цели. Записывают в тетради дату, тему занятия.
информац ионносообщающий
Слайд №№ 1-3 Компьютер, мультимедиапроектор. Экран. Шаростержневы е модели молекул органических веществ Крахмал, лимонная кислота, сахар, целлюлоза, уксусная ктакислота Жиры (твердый и жидкий)
Возникновение органической химии как науки можно Внимательно слушают отнести к началу 19 века, когда в 1807 г известный шведский химик Иенс Яков Берцелиус впервые ввел понятия «органическая химия» и «органические вещества».
II. Изучение нового материала
32 мин
Фронталь-ная
информац ионносообщающий
Габриелян О.С., Химия. 9 класс, М.:Дрофа, 2002, 2006
Происхождение названия «органические вещества» – это Внимательно слушают вещества, которые в природе встречаются почти всегда в организмах животных или растениях, или же являются продуктами распада живых организмов. Органические вещества отличаются от неорганических тем, что в их состав обязательно входит углерод, такие вещества и изучает органическая химия. Органическая химия – это химия соединений углерода. – Учение о витализме Слайд № 4 С давних времен возникло естественное разделение всех веществ на неорганические (минеральные, неживые) и органические, то есть получаемые из живых организмов – растений, животных. Позже это понятие расширилось, и в настоящее время к органическим веществам относят и такие, которые не имеют никакого отношения к живым организмам, например, полимеры, пластмассы, искусственные волокна и другие.
Фронталь-ная
информац ионносообщающий
Слайд №5 Слайд № 6
В состав органических веществ помимо углерода входят и Внимательно слушают другие атомы – С, Н, О, HaI, S, N. Основные элементы в органических соединениях – это углерод и водород. Поэтому при их горении всегда образуются СО2 и Н2О – Д! органических веществ: Лимонная к – та Уксусная к – та Жиры: раст. масло сливочн. масло крахмал целлюлоза Все эти соединения состоят из атомов С, Н и О. – Органические вещества построены более сложно, чем неорганические, и многие из них имеют огромную молекулярную массу. Это, например, те вещества, благодаря которым происходят жизненные процессы: белки, жиры, углеводы, нуклеиновые кислоты.
Фронталь-ная
информац ионносообщающий
Слайд № 7
Значение и роль органической химии в современной жизни: Внимательно слушают В современной жизни органическая химия играет огромную роль, настолько, что трудно представить жизнь современного человека без ее достижений.
Фронталь-ная
информац ионносообщающий Слайд №8 объяснительнопобуждающий
Многообразие органических веществ, особенности их Внимательно слушают строения объяснил великий русский ученый А.М.Бутлеров. Он обобщил имеющиеся знания по органической химии и сформулировал основные положения теории строения органических веществ, которая была названа его именем – теория строения органических веществ А.М. Бутлерова. Эта теория имеет для органической химии такое же большое значение, как для неорганической химии периодический закон Д.И.Менделеева. Для того, чтобы нам познакомиться с теорией А.М.Бутлерова мы должны изучить некоторые новые понятия. 1) Химическое строение вещества – это определенный порядок , последовательность соединения атомов в молекуле.
Н2О2
Фронталь-ная
информац ионносообщающий
Слайд № 9
Слайд №10
Водорода, поэтому он тоже в данном соединении одновалентен. Работают с учебником Работа с учебником – стр. 152 – старый учебник. Что такое одна связь? Отвечают на вопросы Н–О Н–О–Р Н–О
О
Фронталь-ная
информац ионносообщающий объяснительнопобуждающий
Н3РО4
Исходя из приведенной структурной формулы фосфорной кислоты определите валентности элементов: Н, Р, О. Сосчитав число черточек (химических связей), исходящих от каждого элемента. Валентность и степень окисления элемента не всегда численно совпадают. Н–О–О–Н Н2О2 Степень окисления кислорода в пероксиде водорода равна -1. Постоянную валентность имеют: Н – одновалентен О – двухвалентен С – в органических соединениях – четырехвалентен – Почему углерод может образовывать четыре химических связи? Вспомните строение атома углерода.
Сосчитав число черточек (химических связей), исходящих от каждого элемента. Валентность и степень окисления элемента не всегда численно совпадают. Н–О–О–Н Н2О2 Степень окисления кислорода в пероксиде водорода равна -1. Постоянную валентность имеют: Н – одновалентен О – двухвалентен С – в органических соединениях – четырехвалентен – Почему углерод может образовывать четыре химических связи? Вспомните строение атома углерода.
Слайд № 11 Внимательно слушают Отвечают на вопросы
Слайд № 12 проговари -вание, отве ты на вопросы
Структурные формулы органических веществ. Химическое строение вещества – это определенный порядок, последовательность соединения атомов в молекуле согласно их валентности. – Какую валентность имеет углерод в органических соединениях? Атомы углерода способны соединяться друг с другом в цепи разной длинны. Этот порядок отображается с помощью структурных формул, в которых валентности атомов обозначаются черточками: каждая черточка соответствует единице валентности атома химического элемента.
Фронталь-ная
информац ионносообщающий объяснительнопобуждающий Слайд №13
Слайд 14
Д! Шаростержневая модель этана Запишите структурную формулу бутана – С4Н10 Подумайте, только ли линейный вариант строения возможен для бутана? (Д! шаростержневые молекулы , бутана, изобутана) Кроме этого четыре атома углерода бутана могут замыкаться в цепь (Д! шаростержневая молекула бутана)
Слайд 15
проговари -вание, отве ты на вопросы
Образовывать замкнутую цепь. Д! циклобутан Слайд 16
III. Обобщение и систематизация знаний
4-5 мин
Органические соединения с другим числом атомов углерода в цепи также может образовывать прямые, разветвленные и циклические цепи. Проводит эвристическую беседу: Отвечают на поставленные – К какому выводу мог прийти А.М. Бутлеров имея все эти вопросы; знания? Делают выводы – Как соединяются атомы химических элементов входящих в состав органических веществ?
фронталь-ная
Эвристиче ская беседа
– Влияет ли различное химическое строение молекул на свойства веществ? Основные положения теории химического органических веществ А. М.Бутлерова
М.Бутлерова
строения
Слайды №№17,18
IV. закрепление , контроль приобретенных знаний
4 мин
Индиви дуальная, парная
Частич нопоисковы й
Слайд № 19
Исследо ватель ский
2 мин
V. Домашнее задание с пояснениями
Помогает учащимся в написании структурных формул Записывают веществ структурные формулы предложенных веществ
Определяют Даёт домашнее задание, связанное с ключевыми моментами местонахож-дение темы домашнего задания в учебнике. Обязательно прочитывает задания вслух и вопросами «наталкивает» учащихся на правильное решение задач Отвечают на вопросы преподавателя. Анализируют полученное задание и намечают траекторию его решения в общем виде.
фронталь-ная коллективная
Репродуктивный и частично поисковы й
Габриелян О.С., Химия. 9 класс, М.:Дрофа, 2002, 2006
Великие химики. Биографии. – Ивановский государственный химико-технологический университет
АВОГАДРО Амедео
(Avogadro A.)
(9. VIII 1776 – 9.VII 1856)
VIII 1776 – 9.VII 1856)
Итальянский физик и химик, член Туринской академии наук (с 1819 г.). Родился в Турине. Окончил юридический факультет Туринского университета (1792 г.). С 1800 самостоятельно изучал математику и физику. В 1809 – 1819 гг. преподавал физику в лицее г. Верчелли. В 1820 – 1822 и 1834 – 1850 гг. – профессор физики Туринского университета.
Научные работы относятся к различным областям физики и химии.
В 1811 г. заложил основы молекулярной теории, обобщил накопленный к тому времени экспериментальный материал о составе веществ и привел в единую систему противоречащие друг другу опытные данные Ж. Гей-Люссака и основные положения атомистики Дж. Дальтона.
Открыл (1811 г.) закон, согласно которому в одинаковых объемах газов при одинаковых температурах и давлениях содержится одинаковое количество молекул (закон Авогадро).
Именем Авогадро названа универсальная постоянная – число молекул в 1 моль идеального газа.
Создал (1811 г.) метод определения молекулярных масс, посредством которого по экспериментальным данным других исследователей первым правильно вычислил (1811-1820 г.) атомные массы кислорода, углерода, азота, хлора и ряда других элементов.
Установил количественный атомный состав молекул многих веществ (в частности, воды, водорода, кислорода, азота, аммиака, оксидов азота, хлора, фосфора, мышьяка, сурьмы), для которых он ранее был определен неправильно.
Указал (1814 г.) состав многих соединений щелочных и щелочноземельных металлов, метана, этилового спирта, этилена.
Первым обратил внимание на аналогию в свойствах азота, фосфора, мышьяка и сурьмы – химических элементов, составивших впоследствии VA-группу Периодической системы.
Результаты работ Авогадро по молекулярной теории были признаны лишь в 1860 г. на I Международном конгрессе химиков в Карлсруэ.
В 1820-1840 гг. занимался электрохимией, изучал тепловое расширение тел, теплоемкости и атомные объемы; при этом получил выводы, которые координируются с результатами позднее проведенных исследований Д. И. Менделеева по удельным объемам тел и современными представлениями о строении вещества.
И. Менделеева по удельным объемам тел и современными представлениями о строении вещества.
Издал труд “Физика весовых тел, или же трактат об общей конструкции тел” (т. 1-4, 1837 – 1841 гг.), в котором, в частности, намечены пути к представлениям о нестехиометричности твердых тел и о зависимости свойств кристаллов от их геометрии.
По материалам биографического справочника “Выдающиеся химики мира” (авторы Волков В.А и др.) – Москва, “Высшая школа”, 1991 г.
Сванте Аррениус
Сванте-Август Аррениус родился 19 февраля 1859 года в старинном шведском городе Упсале. В гимназии он был одним из лучших учеников, особенно легко ему давалось изучение физики и математики.
В 1876 году юноша был принят в Упсальский университет. И уже через два года (на шесть месяцев раньше срока) он сдал экзамен на степень кандидата философии.
Однако впоследствии он жаловался, что обучение в университете велось по устаревшим схемам: например, “нельзя было услышать ни единого слова о менделеевской системе, а ведь ей было уже больше десяти лет”…
В 1881 году Аррениус переехал в Стокгольм и поступил на работу в Физический институт Академии наук. Там он приступил к изучению электрической проводимости сильно разбавленных водных растворов электролитов.
Там он приступил к изучению электрической проводимости сильно разбавленных водных растворов электролитов.
Хотя Сванте Аррениус по образованию – физик, он знаменит своими химическими исследованиями и стал одним из основателей новой науки – физической химии. Больше всего он занимался изучением поведения электролитов в растворах, а также исследованием скорости химических реакций. Работы Аррениуса долгое время не признавали его соотечественники, и только когда его выводы получили высокую оценку в Германии и Франции, он был избран в Шведскую академию наук. За разработку теории электролитической диссоциации Аррениусу была присуждена Нобелевская премия 1903 года.
Веселый и добродушный великан Сванте Аррениус, настоящий “сын шведской сельской местности”, всегда был душой общества, располагал к себе коллег и просто знакомых. Он был дважды женат; его двух сыновей звали Олаф и Свен. Он получил широкую известность не только как физикохимик, но и автор множества учебников, научно-популярных и просто популярных статей и книг по геофизике, астрономии, биологии и медицине.
Но путь к мировому признанию для Аррениуса-химика был совсем не прост. У теории электролитической диссоциации в ученом мире были очень серьезные противники. Так, Д. И. Менделеев резко критиковал не только саму идею Аррениуса о диссоциации, но и чисто “физический” подход к пониманию природы растворов, не учитывающий химических взаимодействий между растворенным веществом и растворителем.
Впоследствии выяснилось, что и Аррениус, и Менделеев были каждый по-своему правы, и их взгляды, дополняя друг друга, составили основу новой – протонной – теории кислот и оснований.
Клод-Луи БЕРТОЛЛЕ
Французский химик Клод-Луи Бертолле (1748-1822) был коллегой и соратником Лавуазье, доктором медицины и лейб-медиком при дворе герцога Орлеанского, членом Парижской академии наук, правительственным инспектором государственных красильных фабрик, смотрителем монетного двора и, наконец, научным консультантом Наполеона.
Бертолле, родина которого – Таллуар в Савойе, изучал медицину в Турине, где получил диплом в 1770 году. Вскоре после этого он переселился в Париж, где начал свою научную карьеру как врач. Одновременно он изучал химию под руководством известных французских ученых Макера и Буке.
Вскоре после этого он переселился в Париж, где начал свою научную карьеру как врач. Одновременно он изучал химию под руководством известных французских ученых Макера и Буке.
После 1786 года сблизился с Лавуазье; вместе с ним и еще двумя видными учеными – Гитоном де Морво и Фуркруа – Бертолле разработал основы химической номенклатуры и классификации веществ.
Едва только заблистала звезда Наполеона, Бертолле последовал за ним в Египетский поход. Император осыпал его почестями, назначил сенатором и присвоил ему графский титул, но это не помешало Бертолле, как члену Сената, голосовать в 1814 году за отставку Наполеона. После реставрации монархии Бертолле сумел не только сохранить все свои привилегии, но и получить титул пэра Франции.
В период Революции и Империи Бертолле занимался вопросами, связанными с национальной обороной, а также прикладной химией (например, крашением ткани). Он впервые применил хлор для отбеливания бумаги и тканей, открыл гипохлориты щелочных металлов и хлорат кали (“бертоллетову соль“) (1788). Кроме того, он установил состав аммиака, сероводорода и циановодородной кислоты.
Кроме того, он установил состав аммиака, сероводорода и циановодородной кислоты.
В своем “Опыте химической статики” (1803) он связал представление о массе с химическими реакциями и утверждал, что элементы могут соединяться друг с другом в любых пропорциях в зависимости от массы реагирующих веществ. Против этого вывода выступил Пруст. Понятие о массе и ее влиянии на ход химических реакций, однако имело большое значение для создания химической статики в XIX в.
Бертолле был основателем Аркейского общества, труды которого выходили в свет с 1807 по 1817 г. Он умер в 1822 г. в Аркейе, где располагалась созданная им лаборатория.
Клод-Луи Бертолле, который в глазах многих современников и потомков имел репутацию беспринципного и тщеславного придворного и даже не выступил в защиту своего друга и коллеги Лавуазье, когда тот был осужден и приговорен к смертной казни, был тем не менее талантливым ученым и вошел в историю как автор многих химических открытий.
Роберт БОЙЛЬ
(25.I. 1627 – 30.XII. 1691)
Он родился 25 января 1627 года в Лисморе (Ирландия), а образование получил в Итонском колледже (1635-1638) и в Женевской академии (1639-1644). После этого почти безвыездно жил в своем имении в Столбридже, там и проводил свои химические исследования в течение 12 лет. В 1656 году Бойль перебирается в Оксфорд, а в 1668 году переезжает в Лондон.
Научная деятельность Роберта Бойля была основана на экспериментальном методе и в физике, и в химии, и развивала атомистическую теорию. В 1660 году он открыл закон изменения объема газов (в частности, воздуха) с изменением давления. Позднее он получил имя закона Бойля-Мариотта: независимо от Бойля этот закон сформулировал французский физик Эдм Мариотт.
Бойль много занимался изучением химических процессов — например, протекающих при обжиге металлов, сухой перегонке древесины, превращениях солей, кислот и щелочей. В 1654 году он ввел в науку понятие анализа состава тел. p> Одна из книг Бойля носила название “Химик-скептик”. В ней были определены элементы – как “первоначальные и простые, вполне не смешанные тела, которые не составлены друг из друга, но представляют собой те составные части, из которых составлены все так называемые смешанные тела и на которые последние могут быть в конце концов разложены“.
p> Одна из книг Бойля носила название “Химик-скептик”. В ней были определены элементы – как “первоначальные и простые, вполне не смешанные тела, которые не составлены друг из друга, но представляют собой те составные части, из которых составлены все так называемые смешанные тела и на которые последние могут быть в конце концов разложены“.
А в 1661 году Бойль формулирует понятие о “первичных корпускулах” как элементах и “вторичных корпускулах” как сложных телах.
Он также впервые дал объяснение различиям в агрегатном состоянии тел. В 1660 году Бойль получил ацетон, перегоняя ацетат калия, в 1663 году обнаружил и применил в исследованиях кислотно-основный индикатор лакмус в лакмусовом лишайнике, произрастающем в горах Шотландии. В 1680 году он разработал новый способ получения фосфора из костей, получил ортофосфорную кислоту и фосфин. ..
..
В Оксфорде Бойль принял деятельное участие в основании научного общества, которое в 1662 году было преобразовано в Лондонское Королевское общество (фактически это английская Академия наук).
Роберт Бойль умер 30 декабря 1691 года, оставив будущим поколениям богатое научное наследие. Бойлем было написано множество книг, некоторые из них вышли в свет уже после смерти ученого: часть рукописей была найдена в архивах Королевского общества…
БОР Нильс-Хенрик-Давид
(7.Х 1885 – 18.XI 1962)
Датский физик, член Датского королевского общества наук (с 1917 г.), его президент в 1939 г. Родился в Копенгагене. Окончил Копенгагенский университет (1908 г.). В 1911-1912 гг. работал под руководством английского физика Дж. Дж. Томсона в Кавендишской лаборатории Кембриджского университета, в 1912 – 1913 гг. – в лаборатории Э. Резерфорда в Манчестерском университете. С 1916 г. – профессор Копенгагенского университета и одновременно с 1920 г. – директор созданного им Института теоретической физики.
Научные работы Бора, относящиеся к теоретической физике, вместе с тем заложили основы новых направлений в развитии химии.
Создал (1913 г.) первую квантовую теорию атома водорода, в которой:
· показал, что электрон может вращаться вокруг ядра не по любым, а лишь по определенным квантовым орбитам
· дал математическое описание устойчивости орбит, или стационарного состояния атома
· показал, что всякое излучение либо поглощение энергии атомом связано с переходом между двумя стационарными состояниями и происходит дискретно с выделением или поглощением планковских квантов
· ввел понятие главного квантового числа для характеристики электрона.
Рассчитал спектр атома водорода, показав полное совпадение расчетных данных с эмпирическими. Построил (1913-1921 гг.) модели атомов других элементов Периодической системы, охарактеризовав движение электронов в них посредством главного n и побочного l квантовых чисел.
Заложил (1921 г.) основы первой физической теории Периодической системы элементов, в которой связал периодичность свойств элементов с формированием электронных конфигураций атомов по мере увеличения заряда ядра. Обосновал подразделение групп периодической системы на главные и побочные. Впервые объяснил подобие свойств редкоземельных элементов.
Сформулировал (1918 г.) важный для атомной теории принцип соответствия. Многое сделал для становления и интерпретации квантовой механики, в частности предложил (1927 г.) имеющий большое значение для ее понимания принцип дополнительности. Внес значительный вклад в ядерную физику. Развил (1936 г.) теорию составного ядра, является одним из создателей капельной модели ядер (1936 г.) и теории деления ядер (1939 г.), предсказал явление спонтанного деления ядер урана.
Создал большую школу физиков-теоретиков.
Член многих академий наук и научных обществ. Иностранный член АН СССР (с 1929 г.). Нобелевская премия по физике (1922 г. ).
).
По материалам биографического справочника “Выдающиеся химики мира” (авторы Волков В.А и др.) – Москва, “Высшая школа”, 1991 г.
Алексадр Михайлович Бутлеров
Александр Михайлович Бутлеров родился в сентябре 1828 года в городе Чистополе бывшей Казанской губернии. В 1844 году он поступил в Казанский университет. К занятиям химией Бутлерова привлек Николай Николаевич Зинин, который читал курс органической химии и под руководством которого проводились практические занятия в лаборатории. Вскоре Зинин переехал в Петербург, а начинающий ученый остался без руководителя.
Русский химик-органик Владимир Васильевич Марковников писал, что “в течение целых десяти лет Бутлеров на первых порах был предоставлен самому себе в самом восточном университете, вдали от оживляющих сношений с другими учеными”. Видимо, полная свобода и отсутствие подавляющего влияния авторитетов создали благоприятные условия для формирования будущего талантливого химика. Результаты не заставили себя долго ждать.
Результаты не заставили себя долго ждать.
В 1851 году Бутлеров защитил в Казанском университете магистерскую диссертацию “Об окислении органических соединений”, а в 1854 году уже в Московском университете – докторскую диссертацию “Об эфирных маслах”. Спустя четыре года молодой Бутлеров выступил на заседании Парижского химического общества с докладом “О конституции тел вообще”, который был встречен с большим интересом и привлек внимание научной общественности.
В шестидесятых годах XIX столетия Бутлеров работал в химической лаборатории Казанского университета. Эти года были ознаменованы блестящими синтетическими работами ученого. Он получил уротропин C6h22N4 из полимера формальдегида HC(O)H и аммиака Nh4, впервые выделил “метиленитан” – сахаристое вещество состава C6h22O6. По словам немецкого химика Эмиля Фишера “Среди всех искусственных сахарообразных продуктов, о которых литература сообщала до 1887 года, только один выдержал проверку временем. Это сахарный сироп, полученный А. М. Бутлеровым”.
М. Бутлеровым”.
Колоссальное значение имеет бутлеровская теория химического строения . 19 сентября 1861 года Александр Михайлович выступил на 36-м съезде немецких врачей и естествоиспытателей в городе Шпейер с докладом “О химическом строении вещества”. Бутлеров сказал, что “химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением. Каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определенным количеством принадлежащей ему химической силы (сродства)”.
В 1862/63 учебном году студенты Казанского университета впервые услышали на лекции Александра Михайловича, что “в смысле химического строения может для каждого тела существовать только одна рациональная формула, выражающая это строение. От химического строения зависят реакции, следовательно, зная эту зависимость и, выражая формулой строение, мы выражаем все те превращения, которым вещество может подвергнуться”. Впоследствии материал этих лекций лег в основу книги “Введение к полному изучению органической химии”. На основании своей теории химического строения Бутлерову удалось объяснить теоретически и подтвердить экспериментальным путем явление изомерии, а для углеводородов и спиртов – предсказать новые виды изомерии.
Впоследствии материал этих лекций лег в основу книги “Введение к полному изучению органической химии”. На основании своей теории химического строения Бутлерову удалось объяснить теоретически и подтвердить экспериментальным путем явление изомерии, а для углеводородов и спиртов – предсказать новые виды изомерии.
В 1868 году, по представлению Менделеева, Бутлеров был избран на кафедру органической химии в Петербургском университете, где он работал до 1885 года. Менделеев впоследствии писал: “Александр Михайлович Бутлеров – один из замечательнейших русских ученых. Он русский и по ученому образованию, и по оригинальности своих трудов. Ученик знаменитого академика Зинина, он сделался химиком не в чужих краях, а в Казани…”. Спустя шесть лет Бутлеров был избран академиком Петербургской академии наук.
Умер Александр Михайлович в 1886 году, не дожив нескольких дней до своего пятидесятивосьмилетия.
Якоб-Хендрик Вант-Гофф
Якоб-Хендрик Вант-Гофф годился в Роттердаме в Голландии в 1852 году. У Якоба было четыре брата и две сестры. Двое из братьев погибли в младенческом возрасте, а одна из сестер умерла от туберкулеза в возрасте восьми лет.
У Якоба было четыре брата и две сестры. Двое из братьев погибли в младенческом возрасте, а одна из сестер умерла от туберкулеза в возрасте восьми лет.
В 1874 году Вант-Гофф защитил диссертацию, посвященную исследованию некоторых органических кислот, и стал доктором математики и натурфилософии. Однако в университетах Голландии ему не нашлось места для работы. Даже в должности учителя химии было отказано. В течение двух лет он давал частные уроки по химии и физике. Только в 1876 году Вант-Гофф получил должность доцента в ветеринарной школе Утрехта. Здесь, после опубликования работы о структурах молекул, к нему и пришла известность.
В 1878 году Вант-Гоффа стал профессором химии в незадолго до этого основанном Амстердамском университете. В том же году он женился на купеческой дочери Женни Месс, которую он давно любил. С ней он прожил до конца своих дней.
В 1896 году Вант-Гоффа избрали действительным членом Берлинской академии наук, и он с семьей переехал в Берлин.
В списке лауреатов Нобелевской премии по химии имя Якоба-Хендрика Вант-Гоффа стоит первым.
Последние годы жизни Вант-Гоффа были омрачены смертями его родных и близких: в 1902 году умер его отец, через шесть лет застрелился муж дочери Евгении. Вскоре после этого умер младший брат, другая дочь уехала в США. В начале 1907 года Вант-Гофф заболел туберкулезом, и в 1911 году умер в возрасте 59 лет. Его старший брат, врач, писал впоследствии: “Переход от жизни к смести был тихий, совершенно соответствующий тому единственному желанию, которое он высказывал в моменты сознания”.
Владимир Иванович Вернадский
(12.III. 1863 – 6.I. 1945)
Владимир Иванович Вернадский (1863-1945) во время учебы в Петербургском университете слушал лекции Д.И. Менделеева, А.М. Бутлерова и других известных российских химиков.
Со временем он сам стал строгим и внимательным учителем. Его учениками или учениками его учеников являются почти все минералоги и геохимики нашей страны.
Выдающийся естествоиспытатель не разделял точку зрения, что минералы есть нечто неизменное, часть установившейся “системы природы”. Он считал, что в природе идет постепенное взаимное превращение минералов. Вернадский создал новую науку – геохимию.
Владимир Иванович первым отметил огромную роль живого вещества – всех растительных и животных организмов и микроорганизмов на Земле – в истории перемещения, концентрации и рассеяния химических элементов. Ученый обратил внимание, что некоторые организмы способны накапливать железо, кремний, кальций и другие химические элементы и могут участвовать в образовании месторождений их минералов, что микроорганизмы играют огромную роль в разрушении горных пород.
Вернадский утверждал, что “разгадка жизни не может быть получена только путем изучения живого организма. Для ее разрешения надо обратиться и к его первоисточнику – к земной коре“.
Изучая роль живых организмов в жизни нашей планеты, Вернадский пришел к выводу, что весь атмосферный кислород – это продукт жизнедеятельности зеленых растений.
Владимир Иванович уделял исключительное внимание проблемам экологии. Он рассматривал глобальные экологические вопросы, влияющие на биосферу в целом.
Более того, он создал само учение о биосфере – области активной жизни, охватывающей нижнюю часть атмосферы, гидросферу и верхнюю часть литосферы, в которой деятельность живых организмов (в том числе и человека) является фактором планетарного масштаба.
Он считал, что биосфера под влиянием научных и производственных достижений постепенно переходит в новое состояние – сферу разума, или ноосферу.
Решающим фактором развития этого состояния биосферы должна стать разумная деятельность человека, гармоничное взаимодействие природы и общества. Это возможно лишь при учете тесной взаимосвязи законов природы с законами мышления и социально-экономическими законами.
Жозеф-Луи Гей-Люссак
Французский химик и физик Жозеф-Луи Гей-Люссак родился в Сен-Леонаре в 1778 году. В 1800 году окончил Политехническую школу в Париже, где учился у Клода Бертолле. Работал там же, в 1800-1802 гг. был ассистентом Бертолле.
В 1800 году окончил Политехническую школу в Париже, где учился у Клода Бертолле. Работал там же, в 1800-1802 гг. был ассистентом Бертолле.
В 1805-1806 гг. совершил путешествие по Европе вместе со знаменитым немецким естествоиспытателем Александром Гумбольдтом. С 1809 года Гей-Люссак – профессор химии в Политехнической школе и профессор физики в Сорбонне. С 1832 года он стал профессором химии в Ботаническом саду Парижа.
Работы Гей-Люссака относятся к различным областям химии (свойства галогенов и их соединений, синильной кислоты и дициана, бора и борной кислоты, щелочных металлов и т.д.) и физики (газовые законы).
Ученый впервые построил кривые зависимости растворимости солей в воде от температуры (политермы растворимости), усовершенствовал методы объемного анализа, изобрел башню для получения серной кислоты нитрозным методом, способ получения щавелевой кислоты из древесных опилок и способ производства стеариновых свечей (совместно с Шеврелем)…
Джозайя-Уиллард Гиббс
(Gibbs J.
 W.)
W.)(11.II.1839 – 28.IV.1903)
Один из основателей химической термодинамики Джозайя-Уиллард Гиббс родился в 1839 году в небольшом американском городке Нью-Хейвене. Девятнадцати лет от роду он окончил Йельский университет, а уже через пять лет стал доктором философии и начал преподавать студентам математику.
Позднее он совершенствовал свое образование во Франции, в Сорбонне и Коллеж де Франс, а также в Германии, в знаменитых Берлинском и Гейдельбергском университетах.
Наконец, Гиббс получил должность профессора в родном Йельском университете и начал самостоятельное исследование тепловых процессов в химии. И здесь ему удалось достичь выдающихся результатов. Имя американца Гиббса было присвоено многим величинам и понятиям новой отрасли химии – химической термодинамики (энергия Гиббса, треугольник Гиббса, правило фаз Гиббса).
В сорок лет Гиббс был избран в Национальную академию наук США, хотя перед этим опубликовал в печати всего три научных статьи. Неудивительно: Гиббс писал редко, но “метко”. Например, за целых 13 лет (с 1890 по 1903 гг.) он написал всего восемь небольших статей и одну книгу.
Например, за целых 13 лет (с 1890 по 1903 гг.) он написал всего восемь небольших статей и одну книгу.
В 1880 году Джозайя Гиббс стал членом Американской академии искусств и наук – авторитетнейшего научного общества, созданного в Бостоне еще в 1780 году.
Семья Гиббса состояла из двух его сестер и шурина. Они прожили вместе всю жизнь в одном и том же доме в Нью-Хейвене. От дома было полквартала до школы, где учился Гиббс в юности, один квартал до колледжа, где он провел студенческие годы, два квартала до университета, где он преподавал, и столько же до кладбища, где он был похоронен. Тихий провинциальный городок – американская “глубинка” – давал Гиббсу все, что нужно для работы: спокойную размеренную жизнь среди родных, необходимые книги в библиотеке, свободное время для размышлений, живописные окрестности для прогулок. На досуге Гиббс иногда угощал домочадцев собственноручно приготовленными изысканными салатами, которые назывались вполне научно – “гетерогенные равновесия”…
Гиббса отличали скромность, приветливость в общении с людьми. Никогда он не проявлял ни малейшего высокомерия или честолюбия. Даже в пожилом возрасте он не потерял стройной фигуры, всегда был тщательно одет и причесан. Он никогда не спешил и тем не менее никогда никуда не опаздывал.
Никогда он не проявлял ни малейшего высокомерия или честолюбия. Даже в пожилом возрасте он не потерял стройной фигуры, всегда был тщательно одет и причесан. Он никогда не спешил и тем не менее никогда никуда не опаздывал.
В 1901 году Лондонское королевское общество присудило Гиббсу медаль Коплея – самую почетную международную награду, учрежденную раньше Ноболевских премий. И это была последняя награда Гиббса: через два года, в 1903 году, он скончался. Понадобилось почти полвека, чтобы заслуги ученого получили признание не только в Европе, но и на родине. Только в 1950 году его бюст поместили в “Галерее славы великих американцев”.
ЗЕЛИНСКИЙ Николай Дмитриевич
(6.II 1861 – 31.VII 1953)
Советский химик-органик, академик (с 1929 г.). Родился в г. Тирасполе. Окончил Новороссийский университет в Одессе (1884 г.). С 1885 г. совершенствовал образование в Германии: в Лейпцигском университете у Я. Вислиценуса и в Гёттингенском университете у В. Мейера. В 1888-1892 гг. работал в Новороссийском университете, с 1893 г. – профессор Московского университета, который оставил в 1911 г. в знак протеста против реакционной политики царского правительства. В 1911-1917 гг. – директор Центральной химической лаборатории министерства финансов, с 1917 г. – вновь в Московском университете, одновременно с 1935 г. – в Институте органической химии АН СССР, одним из организаторов которого он был.
Мейера. В 1888-1892 гг. работал в Новороссийском университете, с 1893 г. – профессор Московского университета, который оставил в 1911 г. в знак протеста против реакционной политики царского правительства. В 1911-1917 гг. – директор Центральной химической лаборатории министерства финансов, с 1917 г. – вновь в Московском университете, одновременно с 1935 г. – в Институте органической химии АН СССР, одним из организаторов которого он был.
Научные исследования относятся к нескольким областям органической химии – химии алициклических соединений, химии гетероциклов, органическому катализу, химии белка и аминокислот.
Вначале занимался исследованием изомерии производных тиофена и получил (1887 г.) ряд его гомологов. Исследуя стереоизомерию предельных алифатических дикарбоновых кислот, нашел (1891 г.) способы получения из них циклических пяти- и шестичленных кетонов, из которых в свою очередь получил (1895-1900 гг.) большое количество гомологов циклопентана и циклогексана. Синтезировал (1901-1907 гг.) многочисленные углеводороды, содержащие от 3 до 9 атомов углерода в кольце, что послужило основой искусственного моделирования нефти и нефтяных фракций. Положил начало ряду направлений, связанных с изучением взаимных превращений углеводородов.
Синтезировал (1901-1907 гг.) многочисленные углеводороды, содержащие от 3 до 9 атомов углерода в кольце, что послужило основой искусственного моделирования нефти и нефтяных фракций. Положил начало ряду направлений, связанных с изучением взаимных превращений углеводородов.
Открыл (1910 г.) явление дегидрогенизационного катализа, заключающееся в исключительно избирательном действии платины и палладия на циклогексановые и ароматические углеводороды и в идеальной обратимости реакций гидро- и дегидрогенизации только в зависимости от температуры.
Совместно с инженером А. Кумантом создал (1916 г.) противогаз. Дальнейшие работы по дегидрогенизационно-гидрогенизационному катализу привели его к открытию (1911 г.) необратимого катализа. Занимаясь вопросами химии нефти, выполнил многочисленные работы по бензинизации нефтяных остатков посредством крекинга (1920-1922 гг.), по “кетонизации нафтенов”. Получил (1924 г.) алициклические кетоны каталитическим ацилированием нефтяных цикланов. Осуществил (1931-1937 гг.) процессы каталитической и пирогенетической ароматизации нефтей.
Осуществил (1931-1937 гг.) процессы каталитической и пирогенетической ароматизации нефтей.
Совместно с Н. С. Козловым впервые в СССР начал (1932 г.) работы по получению хлоропренового каучука. Синтезировал труднодоступные нафтеновые алкоголи и кислоты. Разработал (1936 г.) методы обессеривания высокосернистых масел. Является одним из основоположников учения об органическом катализе. Выдвинул идеи о деформации молекул реагентов в процессе адсорбции на твердых катализаторах.
Совместно со своими учениками открыл реакции селективного каталитического гидрогенолиза циклопентановых углеводородов (1934 г.), деструктивного гидрирования, многочисленные реакции изомеризации (1925-1939 гг.), в том числе взаимные превращения циклов в направлении, как их сужения, так и расширения.
Экспериментально доказал образование метиленовых радикалов в качестве промежуточных соединений в процессах органического катализа.
Внес существенный вклад в решение проблемы происхождения нефти.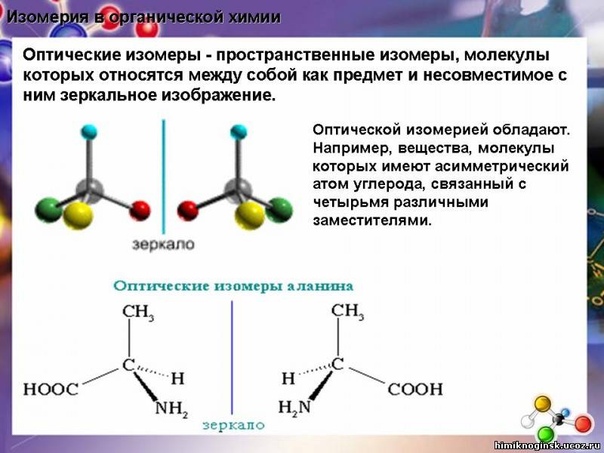 Был сторонником теории органического происхождения нефти.
Был сторонником теории органического происхождения нефти.
Проводил также исследования в области химии аминокислот и белка. Открыл (1906 г.) реакцию получения aльфа-аминокислот из альдегидов или кетонов действием смеси цианистого калия с хлористым аммонием и последующим гидролизом образующихся aльфа-аминонитрилов. Синтезировал ряд аминокислот и оксиаминокислот.
Разработал методы получения эфиров аминокислот из их смесей, образующихся при гидролизе белковых тел, а также способы разделения продуктов реакции. Создал крупную школу химиков-органиков, в которую вошли Л. Н. Несмеянов, Б. А. Казанский, А. А. Баландин, Н. И. Шуйкин, А. Ф. Платэ и др.
Один из организаторов Всесоюзного химического общества им. Д. И. Менделеева и его почетный член (с 1941 г.).
Герой Социалистического Труда (1945 г.).
Премия им. В. И. Ленина (1934 г.), Государственные премии СССР (1942, 1946, 1948 гг.).
Имя Зелинского присвоено (1953 г.) Институту органической химии АН СССР.
По материалам биографического справочника “Выдающиеся химики мира” (авторы Волков В.А и др.) – Москва, “Высшая школа”, 1991 г.
Пьер Кюри и Мария Склодовская-Кюри
Когда французскому физику Пьеру Кюри (1859-1906) исполнилось 35 лет, он уже был широко известным ученым. Ему принадлежали интересные открытия в области физики кристаллического состояния вещества и пьезоэлектрического эффекта, магнитных свойств веществ при высоких температурах. Закономерное изменение свойств парамагнитных веществ от температуры носит его имя (закон Кюри).
Однако на рубеже XIX и XX вв. сфера его научных интересов изменилась: вместе со своей женой – выпускницей Парижского университета Марией Склодовской-Кюри (1867-1934) он занялся выяснением природы уранового излучения и изучением радиоактивности. Супруги Кюри посвятили лучшие годы жизни беззаветному труду во имя науки – при отсутствии необходимых средств, в плохо оборудованной лаборатории они открыли и выделили два новых химических элемента. Пьер Кюри установил, что соли радия самопроизвольно выделяют теплоту.
Пьер Кюри установил, что соли радия самопроизвольно выделяют теплоту.
19 апреля 1906 г. в результате нелепого несчастного случая трагически погиб Пьер Кюри (он был сбит экипажем при переходе одной из парижских улиц). Горе не сломило Марию: она продолжила дело жизни своего мужа – научные исследования в области радиоактивности, возглавила в Парижском университете кафедру, которой руководил ранее Пьер. А в 1914 г. она стала первым руководителем физико-химического отдела Парижского Института радия, созданного при ее деятельном участии. Во время первой мировой войны Мария Склодовская-Кюри впервые в широком масштабе организовала медицинское применение излучений (она обучила работе на рентгеновских установках более 1500 человек).
Мария Склодовская-Кюри умерла в 1934 г. от лучевой болезни. Ее лабораторные тетради до сих пор сохраняют высокий уровень радиоактивности.
В честь супругов Кюри был назван искусственно полученный химический элемент с порядковым номером 96 – кюрий Cm.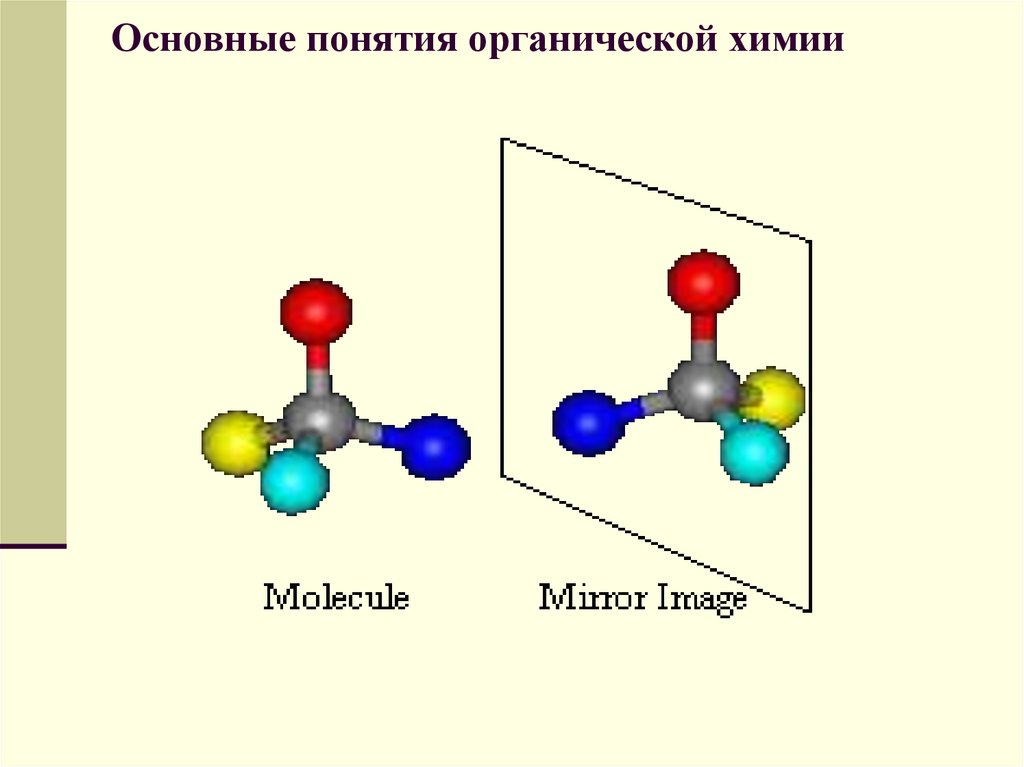
Антуан-Лоран Лавуазье
Французский химик Антуан-Лоран Лавуазье (1743-1794), по образованию юрист, был очень богатым человеком. Он состоял в “Компании откупов” – организации финансистов, бравшей на откуп государственные налоги. На этих финансовых операциях Лавуазье приобрел огромное состояние.
Политические события, происходившие во Франции, имели для Лавуазье печальные последствия: он был казнен за то, что работал в “Генеральном откупе” (акционерном обществе по сбору налогов). В мае 1794 года в числе других обвиняемых-откупщиков Лавуазье предстал перед революционным трибуналом и на следующий день был приговорен к смертной казни “как зачинщик или соучастник заговора, стремившийся содействовать успеху врагов Франции путем вымогательств и незаконных поборов с французского народа”.
Вечером 8 мая приговор был приведен в исполнение, а Франция лишилась одной из самых блестящих голов… Через два года Лавуазье был признан несправедливо осужденным, однако это уже не могло вернуть Франции замечательного ученого.
…Еще обучаясь на юридическом факультете Парижского университета, будущий генеральный откупщик и выдающийся химик одновременно изучал естественные науки. Часть своего состояния Лавуазье вложил в обустройство химической лаборатории, оснащенной прекрасным по тем временам оборудованием, ставшую научным центром Парижа. В своей лаборатории Лавуазье провел многочисленные опыты, в которых он определял изменения масс веществ при их прокаливании и горении.
Лавуазье первым показал, что масса продуктов горения серы и фосфора больше, чем масса сгоревших веществ, и что объем воздуха, в котором горел фосфор, уменьшился на 1/5 часть. Нагревая ртуть с определенным объемом воздуха, Лавуазье получил “ртутную окалину” (оксид ртути) и “удушливый воздух” (азот), непригодный для горения и дыхания. Прокаливая ртутную окалину, он разложил ее на ртуть и “жизненный воздух” (кислород). Этими и многими другими опытами Лавуазье показал сложность состава атмосферного воздуха и впервые правильно истолковал явления горения и обжига как процесс соединения веществ с кислородом. Этого не смогли сделать английский химик и философ Джозеф Пристли и шведский химик Карл-Вильгельм Шееле, а также другие естествоиспытатели, которые сообщили об открытии кислорода раньше.
Этого не смогли сделать английский химик и философ Джозеф Пристли и шведский химик Карл-Вильгельм Шееле, а также другие естествоиспытатели, которые сообщили об открытии кислорода раньше.
Лавуазье доказал, что углекислый газ (диоксид углерода) – это соединение кислорода с “углем” (углеродом), а вода – соединение кислорода с водородом. Он на опыте показал, что при дыхании поглощается кислород и образуется углекислый газ, то есть процесс дыхания подобен процессу горения. Более того, французский химик установил, что образование углекислого газа при дыхании является главным источником “животной теплоты”. Лавуазье одним из первых попытался объяснить сложные физиологические процессы, происходящие в живом организме, с точки зрения химии.
Лавуазье стал одним из основоположников классической химии. Он открыл закон сохранения веществ, ввел понятия “химический элемент” и “химическое соединение”, доказал, что дыхание подобно процессу горения и является источником теплоты в организме…
Лавуазье был автором первой классификации химических веществ и учебника “Элементарный курс химии”. В 29 лет он был избран действительным членом Парижской Академии наук.
В 29 лет он был избран действительным членом Парижской Академии наук.
Кто знает, какие еще открытия успел бы совершить этот выдающийся ученый, если бы его не постигла судьба жертв революционного террора?..
Анри-Луи ЛЕ-ШАТЕЛЬЕ
(Le Chatelier H. L.)
(8.X.1850 – 17.IX.1936)
Анри-Луи Ле-Шателье родился 8 октября 1850 года в Париже. После окончания Политехнической школы в 1869 году он поступил в Высшую Национальную горную школу.
Будущий открыватель знаменитого принципа был широко образованным и эрудированным человеком. Его интересовали и техника, и естественные науки, и общественная жизнь. Много времени он посвятил изучению религии и древних языков. В возрасте 27 лет Ле-Шателье стал уже профессором Высшей горной школы, а тридцать лет спустя – Парижского университета. Тогда же он был избран в действительные члены Парижской Академии наук.
Наиболее важный вклад французского ученого в науку был связан с изучением химического равновесия, исследованием смещения равновесия под действием температуры и давления. Студенты Сорбонны, слушавшие лекции Ле-Шателье в 1907-1908 годах, так записывали в своих конспектах: “Изменение любого фактора, могущего влиять на состояние химического равновесия системы веществ, вызывает в ней реакцию, стремящуюся противодействовать производимому изменению. Повышение температуры вызывает реакцию, стремящуюся понизить температуру, то есть идущую с поглощением тепла. Увеличение давления вызывает реакцию, стремящуюся вызвать уменьшение давления, то есть сопровождающуюся уменьшением объема…”.
Студенты Сорбонны, слушавшие лекции Ле-Шателье в 1907-1908 годах, так записывали в своих конспектах: “Изменение любого фактора, могущего влиять на состояние химического равновесия системы веществ, вызывает в ней реакцию, стремящуюся противодействовать производимому изменению. Повышение температуры вызывает реакцию, стремящуюся понизить температуру, то есть идущую с поглощением тепла. Увеличение давления вызывает реакцию, стремящуюся вызвать уменьшение давления, то есть сопровождающуюся уменьшением объема…”.
К сожалению, Ле-Шателье не был удостоен Нобелевской премии. Причина заключалась в том, что эта премия присуждалась только авторам работ, выполненных или получивших признание в год получения премии. Важнейшие работы Ле Шателье были выполнены задолго до 1901 года, когда состоялось первое присуждение Нобелевских премий.
ЛОМОНОСОВ Михаил Васильевич
(19.XI.1711 – 15.IV.1765)
Русский ученый, академик Петербургской АН (с 1745 г.). Родился в д. Денисовка (ныне с. Ломоносове Архангельской обл.). В 1731-1735 гг. учился в Славяно-греко-латинской академии в Москве. В 1735 г. был послан в Петербург в академический университет, а в 1736 г. – в Германию, где учился в Марбургском университете (1736-1739 гг.) и во Фрейберге в Школе горного дела (1739-1741 гг.). В 1741-1745 гг. – адъюнкт Физического класса Петербургской АН, с 1745 г. – профессор химии Петербургской АН, с 1748 г. работал в учрежденной по его инициативе Химической лаборатории АН. Одновременно с 1756 г. проводил исследования на основанном им в Усть-Рудицах (вблизи Петербурга) стекольном заводе и в домашней лаборатории.
Денисовка (ныне с. Ломоносове Архангельской обл.). В 1731-1735 гг. учился в Славяно-греко-латинской академии в Москве. В 1735 г. был послан в Петербург в академический университет, а в 1736 г. – в Германию, где учился в Марбургском университете (1736-1739 гг.) и во Фрейберге в Школе горного дела (1739-1741 гг.). В 1741-1745 гг. – адъюнкт Физического класса Петербургской АН, с 1745 г. – профессор химии Петербургской АН, с 1748 г. работал в учрежденной по его инициативе Химической лаборатории АН. Одновременно с 1756 г. проводил исследования на основанном им в Усть-Рудицах (вблизи Петербурга) стекольном заводе и в домашней лаборатории.
Творческая деятельность Ломоносова отличается как исключительной широтой интересов, так и глубиной проникновения в тайны природы. Его исследования относятся к математике, физике, химии, наукам о Земле, астрономии. Результаты этих исследований заложили основы современного естествознания. Ломоносов обратил внимание (1756 г.) на основополагающее значение закона сохранения массы вещества в химических реакциях; изложил (1741-1750 гг. ) основы своего корпускулярного (атомно-молекулярного) учения, получившего развитие лишь спустя столетие; выдвинул (1744-1748 гг.) кинетическую теорию теплоты; обосновал (1747-1752 гг.) необходимость привлечения физики для объяснения химических явлений и предложил для теоретической части химии название “физическая химия”, а для практической части – “техническая химия”. Его труды стали рубежом в развитии науки, отграничивающим натурфилософию от экспериментального естествознания.
) основы своего корпускулярного (атомно-молекулярного) учения, получившего развитие лишь спустя столетие; выдвинул (1744-1748 гг.) кинетическую теорию теплоты; обосновал (1747-1752 гг.) необходимость привлечения физики для объяснения химических явлений и предложил для теоретической части химии название “физическая химия”, а для практической части – “техническая химия”. Его труды стали рубежом в развитии науки, отграничивающим натурфилософию от экспериментального естествознания.
До 1748 г. Ломоносов занимался преимущественно физическими исследованиями, а в период 1748-1757 гг. его работы посвящены главным образом решению теоретических и экспериментальных вопросов химии. Развивая атомистические представления, он впервые высказал мнение о том, что тела состоят из “корпускул”, а те в свою очередь из “элементов”; это соответствует современным представлениям о молекулах и атомах.
Был зачинателем применения математических и физических методов исследования в химии и первым начал читать в Петербургской АН самостоятельный “курс истинно физической химии”. В руководимой им Химической лаборатории Петербургской АН выполнялась широкая программа экспериментальных исследований. Разработал точные методы взвешивания, применял объемные методы количественного анализа.
В руководимой им Химической лаборатории Петербургской АН выполнялась широкая программа экспериментальных исследований. Разработал точные методы взвешивания, применял объемные методы количественного анализа.
Проводя опыты по обжигу металлов в запаянных сосудах, показал (1756 г.), что их вес после нагревания не изменяется и что мнение Р. Бойля о присоединении тепловой материи к металлам ошибочно.
Изучал жидкое, газообразное и твердое состояния тел. Достаточно точно определил коэффициенты расширения газов. Изучал растворимость солей при разных температурах. Исследовал влияние электрического тока на растворы солей, установил факты понижения температуры при растворении солей и понижения точки замерзания раствора по сравнению с чистым растворителем. Проводил различие между процессом растворения металлов в кислоте, сопровождающимся химическими изменениями, и процессом растворения солей в воде, происходящим без химических изменений растворяемых веществ. Создал различные приборы (вискозиметр, прибор для фильтрования под вакуумом, прибор для определения твердости, газовый барометр, пирометр, котел для исследования веществ при низком и высоком давлениях), достаточно точно градуировал термометры.
Был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора). Разработал технологию и рецептуру цветных стекол, которые он употреблял для создания мозаичных картин. Изобрел фарфоровую массу. Занимался анализом руд, солей и других продуктов.
В труде “Первые основания металлургии, или рудных дел” (1763 г.) рассмотрел свойства различных металлов, дал их классификацию и описал способы получения. Наряду с другими работами по химии труд этот заложил основы русского химического языка. Рассмотрел вопросы образования в природе различных минералов и нерудных тел. Высказал идею биогенного происхождения гумуса почвы. Доказывал органическое происхождение нефтей, каменного угля, торфа и янтаря. Описал процессы получения железного купороса, меди из медного купороса, серы из серных руд, квасцов, серной, азотной и соляной кислот.
Первым из русских академиков приступил к подготовке учебников по химии и металлургии (“Курс физической химии”, 1754 г. ; “Первые основания металлургии, или рудных дел”, 1763 г.). Ему принадлежит заслуга создания Московского университета (1755 г.), проект и учебная программа которого составлены им лично. По его проекту в 1748 г. завершена постройка Химической лаборатории Петербургской АН. С 1760 г. был попечителем гимназии и университета при Петербургской АН. Создал основы современного русского литературного языка. Был поэтом и художником. Написал ряд трудов по истории, экономике, филологии. Член ряда академий наук.
; “Первые основания металлургии, или рудных дел”, 1763 г.). Ему принадлежит заслуга создания Московского университета (1755 г.), проект и учебная программа которого составлены им лично. По его проекту в 1748 г. завершена постройка Химической лаборатории Петербургской АН. С 1760 г. был попечителем гимназии и университета при Петербургской АН. Создал основы современного русского литературного языка. Был поэтом и художником. Написал ряд трудов по истории, экономике, филологии. Член ряда академий наук.
Именем Ломоносова названы Московский университет (1940 г.), Московская Академия тонкой химической технологии (1940 г.), город Ломоносов (бывший Ораниенбаум). АН СССР учредила (1956 г.) Золотую медаль им. М. В. Ломоносова за выдающиеся работы в области химии и других естественных наук.
По материалам биографического справочника “Выдающиеся химики мира” (авторы Волков В.А и др.) – Москва, “Высшая школа”, 1991 г.
МАРКОВНИКОВ Владимир Васильевич
(25.XII.1837 – 11. II.1904)
II.1904)
Русский химик – органик. Родился в Княгинине (ныне Горьковской обл.). Окончил Казанский университет (1860 г.) и по представлению Л. М. Бутлерова оставлен при университете лаборантом. В 1865-1867 гг. с целью подготовки к профессорской деятельности находился в командировке в Берлине, Мюнхене, Лейпциге, где работал в лабораториях А. Байера, Р. Эрленмейера и А. Кольбе. В 1867-1871 гг. преподавал в Казанском университете (с 1869 – профессор), в 1871-1873 гг. – в Новороссийском университете в Одессе, в 1873-1904 гг. – в Московском университете.
Научные исследования посвящены теоретической органической химии, органическому синтезу и нефтехимии. Получил (1862-1867 гг.) новые данные об изомерии спиртов и жирных кислот, открыл оксиды ряда олефиновых углеводородов, впервые синтезировал галоген- и оксопроизводные изомеров масляной кислоты. Результаты этих исследований послужили основой его учения о взаимном влиянии атомов как главном содержании теории химического строения.
Сформулировал (1869 г.) правила о направлении реакций замещения, отщепления, присоединения по двойной связи и изомеризации в зависимости от химического строения (правила Марковникова).
Показал особенности двойных и тройных связей в непредельных соединениях, заключающиеся в большой прочности их по отношению к ординарным связям, но не в эквивалентности двум и трем простым связям.
Совместно с сотрудником Г. А. Крестовниковым впервые синтезировал (1879 г.) циклобутандикарбоновую кислоту. Исследовал (с 1880 г.) состав нефти, заложив основы нефтехимии как самостоятельной науки.
Открыл (1883 г.) новый класс органических веществ – нафтены. Показал, что наряду с гексагидробензольными углеводородами Вредена существуют углеводороды ряда циклопентана, циклогептана и других циклоалканов. Доказал существование циклов с числом углеродных атомов от 3 до 8; впервые получил (1889 г.) суберон; установил взаимные изомерные превращения циклов в сторону как увеличения, так и уменьшения числа атомов в кольце; открыл (1892 г. ) первую реакцию изомеризации циклических углеводородов с уменьшением цикла (циклогептана в метилциклогексан).
) первую реакцию изомеризации циклических углеводородов с уменьшением цикла (циклогептана в метилциклогексан).
Ввел много новых экспериментальных приемов анализа и синтеза органических веществ. Впервые изучил переход нафтенов к ароматические углеводородам.
Один из основателей Русского физико-химического общества (1868 г.).
По материалам биографического справочника “Выдающиеся химики мира” (авторы Волков В.А и др.) – Москва, “Высшая школа”, 1991 г.
Дмитрий Иванович Менделеев
Дмитрий Иванович Менделеев (1834-1907) – великий русский ученый-энциклопедист, химик, физик, технолог, геолог и даже метеоролог. Менделеев обладал удивительно ясным химическим мышлением, он всегда ясно представлял конечные цели своей творческой работы: предвидение и пользу. Он писал: “Ближайший предмет химии составляет изучение однородных веществ, из сложения которых составлены все тела мира, превращений их друг в друга и явлений, сопровождающих такие превращения”.
Менделеев создал современную гидратную теорию растворов, уравнение состояния идеального газа, разработал технологию получения бездымного пороха, открыл Периодический закон и предложил Периодическую систему химических элементов, написал лучший для своего времени учебник химии.
Д. И. Менделеев родился в Сибири, в Тобольске, и был семнадцатым ребенком в большой семье. Он был дважды женат, у него было трое сыновей и две дочери. Его дочь Люба была замужем за великим русским поэтом А. Блоком, а сестра Менделеева Ольга – за Н. В. Басаргиным, одним из декабристов.
Современники говорили, что этот великий ученый “создал свою жизнь как произведение искусства”.
Альфред-Бернхард Нобель (Nobel)
(1833—1896)
Альфред-Бернхард Нобель — шведский инженер, изобретатель динамита. Нобель родился в 1833 г. в. России, где отец его был директором казенного порохового завода.
Отдавшись химическим занятиям, Нобель с 1862 г. задался целью применить в качестве взрывчатого вещества нитроглицерин, открытый в 1845 г. итальянским ученым Собреро. Нобелю удалось разрешить поставленную задачу в 1867 г. он изобрел динамит.
итальянским ученым Собреро. Нобелю удалось разрешить поставленную задачу в 1867 г. он изобрел динамит.
Пользуясь поддержкой французского правительства, Нобель основал большую фабрику динамита во Франции; вслед затем ему удалось основать значительные фабрики динамита также в Германии и Англии.
Нобель умер в 1896 г. в своей вилле в Сан-Ремо, оставив громадное состояние (35 миллионов крон). В своем завещании он выразил желание, чтобы часть этого состояния была отдана в распоряжение стокгольмского университета для учреждения ряда премий: за важнейшие исследования в области физики, химии и физиологии или медицины, за лучшее произведение изящной словесности идеалистического направления и за труды, ведущие к осуществлены идеи мира и к сближению народов.
НОБЕЛЕВСКИЕ ЛАУРЕАТЫ
В 1896 году Альфред Нобель завещал специальному фонду превратить его имущество в ценные бумаги, доход от которых должен ежегодно выдаваться в виде премий его имени ученым за крупные научные открытия и изобретения в области физики, химии, физиологии и медицины, а также лицам, достигшим наибольших успехов в литературе и борьбе за мир.
Проект устава Нобелевского комитета был принят шведским риксдагом, и завещание вступило в силу, несмотря на многие возражения. Противники назначения таких премий указывали, в частности, на возможность возникновения вокруг них всяческих махинаций. Действительно, время от времени происходят те или иные промашки как субъективного, так и объективного характера.
Первыми нобелевскими лауреатами в 1901 году стали Вильгельм Рентген — по физике, Якоб Вант-Гофф — по химии и Эмиль Беринг — по медицине. Имя Рентгена известно всем, Вант-Гоффа, возможно, вспомнят те, кто внимательно читал школьные учебники, а Беринга не знает никто, но изобретенной им противодифтерийной сывороткой пользуется весь мир.
Дальнейшее премирование шло не столь гладко. Один из принципов отбора кандидатов — частота цитирования, но не все ученые широко рекламировали свои открытия, не все имели возможность публиковать работы за рубежом. Сейчас нам трудно понять, почему кандидатуры таких русских ученых, как В. И. Вернадский, К. А. Тимирязев, К. Э. Циолковский и многие другие, не получили достаточной поддержки международной научной общественности.
И. Вернадский, К. А. Тимирязев, К. Э. Циолковский и многие другие, не получили достаточной поддержки международной научной общественности.
Д. И. Менделееву в 1906 году не присудили премию по химии из-за его преклонного возраста. Иван Петрович Павлов стал нобелевским лауреатом в 1904 году за работы в области физиологии пищеварения, которые в его жизни были просто эпизодом. Предложение двадцать лет спустя отметить премией его гениальные работы по условным рефлексам поддержки не получило.
Когда наконец Нобелевский комитет решился на этот шаг, Павлов умер, а посмертно премия не вручается. Были и «запоздалые» премии. Пример этого — присужденная в 2000 году премия крупнейшему российскому ученому Жоресу Алферову за работы, выполненные 20 лет назад. Петр Капица ждал премии 40 лет. Своеобразный рекорд — премия Френсису Пейтону Роусу, которого наградили через 55 лет после того, как он обнаружил вирус, вызывающий злокачественные опухоли.
Несмотря на трудности и ошибки, Нобелевская премия остается одной из наиболее авторитетных и почетных. Ее вручение всегда превращается в настоящий праздник.
Ее вручение всегда превращается в настоящий праздник.
В 1998 году премию, основанную на деньги от производства нитроглицерина-взрывчатки, дали за исследование нитроглицерина-лекарства. Давно известного, но открывшего тайну своего влияния на сосуды всего лишь несколько лет тому назад.
Эрнест Резерфорд
Биография
Эрнест Резерфорд родился 30 августа 1871 года в Брайтуотере, живописном местечке Новой Зеландии. Он был четвертым ребенком в семье выходцев из Шотландии Джеймса Резерфорда и Марты Томсон, и из двенадцати детей он оказался наиболее одаренным. Эрнест блестяще закончил начальную школу, получив 580 баллов из 600 возможных и премию в 50 фунтов стерлингов для продолжения образования.
В колледже в Нельсоне, где Эрнеста Резерфорда приняли в пятый класс, учителя обратили внимание на его исключительные математические способности. Но математиком Эрнест не стал. Не стал он и гуманитарием, хотя проявлял недюжинные способности к языкам и литературе. Судьбе угодно было распорядиться, чтобы Эрнест увлёкся естественными науками — физикой и химией.
Судьбе угодно было распорядиться, чтобы Эрнест увлёкся естественными науками — физикой и химией.
После окончания колледжа Резерфорд поступил в Кентерберийский университет, и уже на втором курсе он выступил с докладом “Эволюция элементов”, в котором высказал предположение, что химические элементы представляют собой сложные системы, состоящие из одних и тех же элементарных частиц. Студенческий доклад Эрнеста не был должным образом оценён в университете, однако его экспериментальные работы, например, создание приёмника электромагнитных волн, удивили даже крупных учёных. Спустя всего несколько месяцев ему была присуждена “стипендия 1851 года”, которой отмечались самые талантливые выпускники провинциальных английских университетов.
После этого Резерфорд в течение трёх лет работал в Кембридже, в Кавендишской лаборатории, под руководством известного физика Джозефа-Джона Томсона. В 1898 г. он начал изучать радиоактивность. Первое же фундаментальное открытие Резерфорда в этой области – обнаружение неоднородности излучения, испускаемого ураном — сделало его имя известным в научном мире; благодаря ему в науку вошло понятие об альфа- и бета-излучении.
В том же году 26-летнего Резерфорда пригласили в Монреаль в качестве профессора Мак-Гиллского университета — лучшего в Канаде. Этот университет получил название по имени своего основателя — переселенца из Шотландии, которому под конец жизни удалось разбогатеть. Перед отъездом Резерфорда в Канаду Дж. Томсон вручил ему рекомендательное письмо, где было написано: “В моей лаборатории ещё никогда не было молодого учёного с таким энтузиазмом и способностями к оригинальным исследованиям, как господин Резерфорд, и я уверен, что, если он будет избран, то создаст выдающуюся школу физиков в Монреале…”. Предсказание Томсона сбылось. Резерфорд проработал в Канаде 10 лет и действительно создал там научную школу.
В 1903 г. 32-летний ученый был избран членом Лондонского Королевского общества — британской Академии наук.
В 1907 г. Резерфорд вместе с семьей переезжает из Канады в Англию, чтобы занять должность профессора кафедры физики Манчестерского университета. Сразу же после приезда Резерфорд занялся экспериментальными исследованиями радиоактивности. Вместе с ним работал его помощник и ученик, немецкий физик Ханс Гейгер (1882-1945), разработавший ионизационный метод измерения интенсивности излучения – широко известный счетчик Гейгера. Резерфорд произвел серию опытов, подтвердивших, что альфа-частицы представляют собой дважды ионизованные атомы гелия. Вместе с другим своим учеником, Эрнестом Марсденом (1889-1970), он исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. На основании этих опытов ученый предложил планетарную модель атома: в центре атома – ядро, вокруг которого вращаются электроны. Резерфорд предсказал открытие нейтрона, возможность расщепления атомных ядер легких элементов и искусственных ядерных превращений.
Сразу же после приезда Резерфорд занялся экспериментальными исследованиями радиоактивности. Вместе с ним работал его помощник и ученик, немецкий физик Ханс Гейгер (1882-1945), разработавший ионизационный метод измерения интенсивности излучения – широко известный счетчик Гейгера. Резерфорд произвел серию опытов, подтвердивших, что альфа-частицы представляют собой дважды ионизованные атомы гелия. Вместе с другим своим учеником, Эрнестом Марсденом (1889-1970), он исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. На основании этих опытов ученый предложил планетарную модель атома: в центре атома – ядро, вокруг которого вращаются электроны. Резерфорд предсказал открытие нейтрона, возможность расщепления атомных ядер легких элементов и искусственных ядерных превращений.
В течение 18 лет – с 1919 года и до конца своей жизни – Резерфорд возглавлял основанную в 1874 году Кавендишскую лабораторию. До него ею руководили великие английские физики Максвелл, Релей и Томсон. Резерфорд не дожил всего нескольких лет до того, как немецкие физики Отто Ган (1879-1968) и Лизе Майтнер (Мейтнер) (1878-1968) открыли деление урана.
Резерфорд не дожил всего нескольких лет до того, как немецкие физики Отто Ган (1879-1968) и Лизе Майтнер (Мейтнер) (1878-1968) открыли деление урана.
По словам Патрика Блэкетта, одного из ближайших сотрудников Резерфорда, это открытие “в известном смысле явилось последним из великих открытий в ядерной физике, отличающейся от физики элементарных частиц. Резерфорд не дожил до кульминационного пункта развития направления, которое фактически было областью его научной деятельности“.
ФАРАДЕЙ Майкл
(Faraday M.)
(22.IX 1791 – 25.VIII 1867)
Английский физик и химик, член Лондонского королевского общества (с 1824 г.). Родился в Лондоне. Учился самостоятельно. С 1813 г. работал в лаборатории Г. Дэви в Королевском институте в Лондоне (с 1825 г. – ее директор), с 1827 г. – профессор Королевского института.
Научные исследования начал в области химии. Занимался (1815-1818 гг.) химическим анализом известняка, с целью улучшения качества стали исследовал сплавы железа, изучал влияние различных добавок на качество стали.
Впервые получил (1824 г.) в жидком состоянии хлор, затем сероводород, диоксид углерода, аммиак и диоксид азота. Получил в жидком виде также арсин, фосфин, бромоводород и иодоводород, этилен. Открыл (1825 г.) бензол, изучил его физические и некоторые химические свойства. Открыл (1825 г.) изобутилен. Получил (1826 г.) альфа- и бета-сульфокислоты нафталина и приготовил 15 их солей. Положил начало (1826 г.) исследованиям натурального каучука.
Показал возможность фотохимического хлорирования этилена за 15 лет до осуществленного Ж. Дюма открытия реакции металепсии.
Один из пионеров исследования каталитических реакций. Пытался синтезировать (1825 г.) аммиак из азота и водорода действием едкого кали в присутствии металлов. Рассматривал адсорбцию на поверхности твердых катализаторов как чисто физическое явление. Впервые получил (1828 г.) этилсерную кислоту взаимодействием этилена и серной кислоты.
Проводил работу (1824-1830 гг.) по улучшению качества оптического стекла. Предложил тяжелое свинцовое стекло, с помощью которого открыл явление магнитного вращения плоскости поляризации. Установил (1833 г.) количественные законы электролиза.
Предложил тяжелое свинцовое стекло, с помощью которого открыл явление магнитного вращения плоскости поляризации. Установил (1833 г.) количественные законы электролиза.
Огромны его заслуги в области физики. Проводил исследования по электромагнетизму. Создатель учения об электромагнитном поле. Ввел понятие диэлектрической проницаемости.
Член многих академий наук и научных обществ. Иностранный член Петербургской АН (с 1831 г.).
По материалам биографического справочника “Выдающиеся химики мира” (авторы Волков В.А и др.) – Москва, “Высшая школа”, 1991 г.
Великие химики
Карл-Вильгельм Шееле
(Scheele C. W.)
(9.XII.1742 – 21.V.1786)
Карл-Вильгельм Шееле появился на свет в городке Штральзунд в семье преуспевающего торговца, когда Померания входила в состав Шведского королевства. Ему исполнилось пятнадцать лет, и сбылась его детская мечта: отец отдал его учеником к знакомому аптекарю Бауху из Гётеборга. Ученье, по обычаям того времени, должно было длиться около десяти лет. Карл Шееле уже через шесть лет успешно сдал экзамены и получил звание аптекаря. В совершенстве овладев профессией и перебравшись в Стокгольм, Шееле приступает к самостоятельным научным изысканиям.
Карл Шееле уже через шесть лет успешно сдал экзамены и получил звание аптекаря. В совершенстве овладев профессией и перебравшись в Стокгольм, Шееле приступает к самостоятельным научным изысканиям.
Самыми первые его научные достижения были связаны с выделением и характеристикой винной кислоты C2h3(OH)2(COOH)2, которую он получил из ее соли – винного камня (гидротартрата калия), и плавиковой (фтороводородной) HF из плавикового шпата – фторида кальция CaF2.
После переезда сначала в Упсалу, где Шееле тоже ждала большая аптека, а потом – в маленький и тихий городок Чёпинг научные исследования пытливого аптекаря продолжались и дали поразительные результаты. Шведский химик оказался автором стольких открытий, что их хватило бы на добрый десяток ученых, и многие их этих открытий относились к получению и очистке кислот.
Судите сами. В 1775 году Шееле приготовил мышьяковую кислоту h4AsO4, в 1782-1783 годах – синильную (циановодородную) кислоту HCN, в период с 1776 по 1785 год – целый набор органических кислот: мочевую C5(NH)4O3, щавелевую h3C2O4, молочную C2h5(OH)COOH, лимонную C3h5(OH)(COOH)3, яблочную С2h4(OH)(СOOH)2, галловую C6h3(OH)3COOH, а также глицерин C3H5(OH)3. ..
..
Шееле первым получил и исследовал перманганат калия KMnO4 – всем известную “марганцовку”, которая теперь широко применяется в химических экспериментах и в медицине, разработал способ получения фосфора P из костей, открыл сероводород h3S.
Наконец, именно Карлу Вильгельму Шееле принадлежит приоритет открытия химических элементов кислорода O, хлора Cl, фтора F, бария Ba, молибдена Mo, вольфрама W…
Годы упорного самоотверженного труда, к сожалению, подорвали здоровье этого поразительно целеустремленного человека, и он прожил всего до 44 лет.
Итак, путь в химию как науку еще каких-то две-три сотни лет назад пролегал чаще всего через аптеку – место получения, хранения и исследования не только лекарств, но и всех иных химических препаратов, средоточие новых идей и методов, обиталище пытливых умов…
Разработка урока по химии в 10 классе “Органические вещества в природе и жизни человека. Предмет органической химии. Причины многообразия органических веществ.
 Теория строения органических соединений А.М. Бутлерова”
Теория строения органических соединений А.М. Бутлерова”Просмотр содержимого документа
«Разработка урока по химии в 10 классе “Органические вещества в природе и жизни человека. Предмет органической химии. Причины многообразия органических веществ. Теория строения органических соединений А.М. Бутлерова”»
10 класс
Тема 1. Теория химического строения органических соединений
Урок №2.
Тема урока: Органические вещества в природе и жизни человека. Предмет органической химии. Причины многообразия органических веществ. Теория строения органических соединений А.М. Бутлерова.
Цели и задачи урока:
Образовательные: изучить предпосылки создания теории химического строения, ее основные положения, зависимость свойств веществ от строения молекулы, значение теории строения для развития науки и жизнедеятельности человека.
 Углубить основные химические понятия: вещество, химическая реакция.
Углубить основные химические понятия: вещество, химическая реакция.Развивающие: развивать у учащихся умение сравнивать, анализировать и применять информацию из других областей знаний, развивать коммуникативные способности, умение предъявлять результаты групповой деятельности.
Воспитательные: способствовать воспитанию у учащихся активной жизненной позиции.
Здоровьесберегающие технологии: следить за осанкой учащихся; проводить упражнения для снятия напряжения глаз; проветривание помещения.
Реактивы и оборудование: Образцы органических веществ. На доске записаны молекулярные формулы органических веществ.
Ход урока:
Организационный момент.
Проверка знаний:
Методы исследования в химии
Почему возникло учение витализм и как оно потерпело крах.

Какие типы орг. соединений (по происхождению) вы знаете? Приведите примеры и укажите области их применения.
Основная часть.
1. Органической химией изначально называлась химия веществ, полученных из организмов растений и животных.
шведский химик Й. Я. Берцелиус определил органическую химию как химию растительных или животных веществ, образующихся под влиянием «жизненной силы». Именно Берцелиус ввел понятия органические вещества и органическая химия.
Основные идеи новой теории впервые были высказаны А.М. Бутлеровым в 1861 г. в докладе «О химическом строении веществ» на съезде немецких естествоиспытателей и врачей в г. Шпейере.
1. Атомы в молекулах веществ соединены согласно их валентности. Углерод в органических соединениях в большинстве случаев четырёхвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи.
2. Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением вещества (изомерия).
3. Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга. (Наибольшее влияние оказывают атомы, непосредственно связанные друг с другом. Влияние атомов или групп атомов, не связанных непосредственно, ослабевает по мере их удаления друг от друга.)
Различное количество атомов углерода в молекулах и их способность, соединяясь друг с другом, образовывать разные комбинации («скелеты» молекул) делают понятной причину многообразия органических веществ.
С этой точки зрения основное положение современной теории строения можно сформулировать так:
Д/з § 1,2, записи в тетради, упр.
 1-4 (у), упр. 5,6 стр.13; выучить Алканы стр. 26
1-4 (у), упр. 5,6 стр.13; выучить Алканы стр. 26
Органическая химия на сайте Игоря Гаршина
Органическая химия на сайте Игоря Гаршина Ни одна вещь не возникает, не уничтожается, но каждая составляется из смешения существующих вещей или выделяется из них. (Анаксагор)|
Органическая химия изучает свойства и реакции органических соединений –
веществ, построенных на основе “углеродного скелета”.
Наибольшее количество соединений углерод образует с так элементами-органогенами: H, N, O, S, P.
Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения
обусловливает многообразие органических соединений. Название «органические соединения» связано со словом «организм»: из этих соединений в основном состоят все живые организмы. Бурное развитие органической химии началось после создания выдающимся русским химиком А.М. Бутлеровым ее теоретической основы – структурной теории, основная идея которой в том, что свойства органических соединений зависят не только от их состава, но и от структуры, т.е. последовательности связи атомов в молекуле. А.М. Бутлеров ввел понятие изомеров. Изомеры – это варианты веществ с одинаковым молекулярным составом и массой, но с разной структурой и потому с разными свойствами.
Именно возможность построения из одних и тех же немногих элементов большого числа изомерных структур
объясняет существование огромного количества органических соединений
(их более пяти миллионов, тогда как неорганических – около пятисот тысяч). |
Простые “органические” соединения могут образовываться абиогенно (даже в космосе), сложные – результат жизнедеятельности биоты. Абиогенную (пребиотическую) эволюцию неорганических соединений в органические изучет эволюционная химия. Химическая эволюция закономерно приводит к образованию самокаталитических веществ и дальнейшему биогенезу.
Разделы страницы о химии органических соединений:
- Органические вещества
- Химия элементоорганических соединений
- Химия полимеров
Органические вещества
Основными классами органических соединений являются:
-
Углеводороды — соединения, состоящие только из атомов углерода и водорода, которые делятся на:
- Насыщенные — не содержат кратные связи в своей структуре.

- Ненасыщенные — имеют в своём составе хотя бы одну двойную и/или тройную связь.
- С открытой цепью.
- С замкнутой цепью — содержат цикл – это алканы, алкены, алкины, диены, циклоалканы, арены.
- Насыщенные — не содержат кратные связи в своей структуре.
-
Соединения с гетероатомами в функциональных группах —
соединения, в которых углеродный радикал R связан с функциональной группой.
По характеру функциональных групп они делятся на:
- Галогенсодержащие.
- Спирты, фенолы.
- Простые эфиры (этеры).
- Сложные эфиры (эстеры).
- Соединения, содержащие карбонильную группу.
- Альдегиды.
- Кетоны.
- Хиноны.
- Соединения, содержащие карбоксильную группу (карбоновые кислоты, сложные эфиры).

- Серосодержащие соединения.
- Азотсодержащие соединения.
- Металлоорганические соединения.
- Гетероциклические — содержат гетероатомы в составе кольца. Различаются по числу атомов в цикле, по виду гетероатома, по количеству гетероатомов в цикле.
- Органического происхождения — как правило соединения очень сложной структуры, зачастую принадлежат сразу к нескольким классам органических веществ, часто полимеры. Из-за этого их сложно классифицировать и их выделяют в отдельный класс веществ.
- Полимеры — вещества очень большой молекулярной массы, которые состоят из периодически повторяющихся фрагментов — мономеров.
Химия полимеров
В ХХ веке начала интенсивно развиваться и другая область органической химии – химия полимеров. Полимеры – это длинноцепочечные структуры, состоящие из повторяющихся звеньев,
число которых может достигать десятков и даже сотен тысяч.
Основной элемент, входящий в органические молекулы – углерод – в отличие от всех других химических элементов
способен образовывать длинные цепочки. Такие большие молекулы называют макромолекулами.
К полимерам относятся все пластмассы, синтетические каучуки, без которых было бы невозможно
развитие автомобильной промышленности и, наконец, искусственные (на природной основе) и синтетические волокна.
Полимеры – это длинноцепочечные структуры, состоящие из повторяющихся звеньев,
число которых может достигать десятков и даже сотен тысяч.
Основной элемент, входящий в органические молекулы – углерод – в отличие от всех других химических элементов
способен образовывать длинные цепочки. Такие большие молекулы называют макромолекулами.
К полимерам относятся все пластмассы, синтетические каучуки, без которых было бы невозможно
развитие автомобильной промышленности и, наконец, искусственные (на природной основе) и синтетические волокна.
ХХ век по праву можно назвать не только веком выхода в космос и освоения ядерной энергии, но также и веком полимеров.
Были синтезированы десятки тысяч новых веществ с полезными человеку свойствами, которых не создала природа.
Оборотной стороной этих успехов полимерной химии явилось возникновение проблемы утилизации отходов производства и быта.
Химия элементоорганических соединений
В ХХ веке появился еще один молодой раздел химии – химия элементоорганических соединений. Это соединения, в состав которых, кроме углерода, водорода, кислорода, азота и серы входят кремний, фтор, бор, а также некоторые металлы. На основе кремнийорганических соединений созданы полимеры, обладающие уникальными свойствами, что делает их незаменимыми в авиации и энергетике. Фторорганические соединения обладают исключительной устойчивостью даже в кислотах и щелочах, из них изготавливают всевозможные покрытия (фторопласты). Некоторые металлоорганические соединения (например, ферроцен) используют в качестве лекарств и кровезаменителей.
Создателем школы элементоорганической химии, внесшим огромный вклад в развитие этого раздела химической науки,
был выдающийся русский ученый академик Александр Николаевич Несмеянов (1899-1980).
|
Ключевые слова для поиска сведений об органической химии и органических веществах: На русском языке: органическая химия, элементы-органогены, углеродный скелет, полимеры, углеводороды; На английском языке: organic chemistry. |
|
Страница обновлена 10.10.2015
Общие сведения об органических веществах.

Слайды и текст этой онлайн презентации
Слайд 1
Общие сведения об органических веществах.
Слайд 2
« Органическая химия может сейчас кого угодно свести с ума. Она представляется мне дремучим лесом. Полным удивительных
вещей , безграничной чащей, из которой
нельзя выбраться, куда не осмелишься
проникнуть».
Ф. Вёлер.
Слайд 3
Цель: актуализировать знания учащихся о составе, общих свойствах, особенностях, строении, признаках органических веществ; о гомологах и изомерах; умение составлять структурные формулы органических веществ по молекулярным формулам.
Слайд 4
Йенс Якобс Берцелиус (1779-1848). Ввел понятия «органические вещества» и «органическая химия»
Слайд 5
Органическая химия – это химия углеводородов и их производных
Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: C и H (Ch5; C6H6 и т. д.)
Производные УВ – продукты замещения атомов H в молекулах УВ на другие атомы или группы атомов.
д.)
Производные УВ – продукты замещения атомов H в молекулах УВ на другие атомы или группы атомов.
Слайд 6
Например: H H I I H – C – H → H – C – Cl I I H H Метан (УВ) Хлорметан (производное УВ метана)
Слайд 7
Многообразие органических веществ:
Слайд 8
Органические вещества
нефть
Слайд 9
Формулы органических веществ
(С6Н10О5)n – крахмал
СхНу – парафин
С2 Н5ОН – спирт
С12Н22О11 -сахароза
СН3СООН – уксусная кислота
СН2-О-СО-С15Н31
СН-О-СО –С17Н35 – жиры
СН2-О-СО-С17Н33
Слайд 10
Общие признаки органических веществ:
Наличие углерода
Валентность углерода, равная IV
Способность гореть и (или) разлагаться с образованием углеродсодержащих продуктов
низкие температуры плавления и кипения
Наличие в молекулах ковалентных связей
Характерны низкие температуры плавления и кипения
Непосредственное соединение углерода с другими элементами.
Слайд 11
Строение атома углерода
Слайд 12
Причины многообразия органических веществ:
1) Углерод образует цепи разной длины (от 1 до 100 атомов) и разной формы:
линейная
I I I I
-С – С – С – С –
I I I I
разветвленная циклическая
I I I I I I
– С – С – С – С – – С – С –
I I I I I I
– С – -С – С –
I I I
Слайд 13
2) Углерод может образовывать простые, двойные, тройные связи и соединяться с различными элементами. 3) Существование изомеров. Изомеры – это вещества, имеющие одинаковый состав, но разное строение и потому разные свойства. Изомерами являются бутан и изобутан, циклобутан и бутен-1. Изобразите структурные формулы этих изомеров.
Слайд 14
С4h20 Сh4 – Ch3 – Ch3 – Ch4 бутан и Сh4 – CH – Ch4 I Ch4 изобутан (2- етилпропан)
Слайд 15
Ch3 – Ch3 ı ı Ch3 – Ch3 циклобутан C4H8 и Сh3 = CH – Ch3 – Ch4 бутен-1
Слайд 16
Гомологи – это вещества, сходные по строению и по свойствам, но различающиеся по составу на один или несколько гомологических разниц – групп Ch3. Например: C2H6 и C3H8
Ch4 – Ch4 и Ch4 – Ch3 – Ch4
этан пропан
Например: C2H6 и C3H8
Ch4 – Ch4 и Ch4 – Ch3 – Ch4
этан пропан
Слайд 17
Построение моделей органических веществ:
Используя весь «строительный материал»
постройте модель молекулы органического
вещества С5Н12 (пентан).
С
А) С-С-С-С-С; Б) С-С-С; В) С-С-С-С; Г) С-С
С С С-С-С
Изобразите структурную
формулу этого вещества в тетради.
Слайд 18
Применение органических веществ:
Слайд 19
Домашнее задание.
§ 51 (в старых учебниках §48,49)
знать определения понятий «органическая химия», «изомеры», «гомологи», «валентность».
Слайд 20
Спасибо за работу!
1.1: Истоки органической химии
Цель обучения
- обсудить истоки органической химии
Все живые существа на Земле состоят в основном из соединений углерода. Преобладание углеродных соединений в живых существах привело к появлению эпитета «углеродная жизнь». По правде говоря, мы не знаем другой жизни. Ранние химики считали вещества, выделенные из организмов (растений и животных), другим типом вещества, которое невозможно синтезировать искусственно, и поэтому эти вещества были известны как органические соединения.Широко распространенное мнение, называемое витализмом, считало, что органические соединения образуются благодаря жизненной силе, присутствующей только в живых организмах. Немецкий химик Фридрих Велер был одним из первых химиков, опровергающих этот аспект витализма, когда в 1828 году он сообщил о синтезе мочевины, компонента многих жидкостей организма, из неживых материалов. С тех пор было признано, что органические молекулы подчиняются тем же естественным законам, что и неорганические вещества, и категория органических соединений эволюционировала, чтобы включить как природные, так и синтетические соединения, содержащие углерод.Некоторые углеродсодержащие соединения не классифицируются как органические, например карбонаты и цианиды, и простые оксиды, такие как \ (\ ce {CO} \) и \ (\ ce {CO2} \). Хотя единого точного определения химическому сообществу еще предстоит найти, большинство согласны с тем, что определяющей чертой органических молекул является присутствие углерода в качестве основного элемента, связанного с водородом и другими атомами углерода.
По правде говоря, мы не знаем другой жизни. Ранние химики считали вещества, выделенные из организмов (растений и животных), другим типом вещества, которое невозможно синтезировать искусственно, и поэтому эти вещества были известны как органические соединения.Широко распространенное мнение, называемое витализмом, считало, что органические соединения образуются благодаря жизненной силе, присутствующей только в живых организмах. Немецкий химик Фридрих Велер был одним из первых химиков, опровергающих этот аспект витализма, когда в 1828 году он сообщил о синтезе мочевины, компонента многих жидкостей организма, из неживых материалов. С тех пор было признано, что органические молекулы подчиняются тем же естественным законам, что и неорганические вещества, и категория органических соединений эволюционировала, чтобы включить как природные, так и синтетические соединения, содержащие углерод.Некоторые углеродсодержащие соединения не классифицируются как органические, например карбонаты и цианиды, и простые оксиды, такие как \ (\ ce {CO} \) и \ (\ ce {CO2} \). Хотя единого точного определения химическому сообществу еще предстоит найти, большинство согласны с тем, что определяющей чертой органических молекул является присутствие углерода в качестве основного элемента, связанного с водородом и другими атомами углерода.
Сегодня, органические соединения являются ключевыми компонентами пластмасс, мыла, парфюмерии, подсластителей, тканей, фармацевтических препаратов и многих других веществ, которые мы используем каждый день. Ценность органических соединений для нас гарантирует, что органическая химия является важной дисциплиной в общей области химии.В этой главе мы обсуждаем, почему элемент углерод дает начало огромному количеству и разнообразию соединений, как эти соединения классифицируются, а также роль органических соединений в репрезентативных биологических и промышленных условиях.
Авторы и авторство
Определение органической химии | Что такое органическая химия
Определение органической химии
Органическую химию можно определить как изучение структуры, свойств и реакций органических соединений и органических материалов, т.е.е., вещество в его различных формах, содержащее атомы углерода. Углерод уникален по разнообразию и размеру структур, которые могут возникнуть в результате трехмерных связей его атомов.
Диапазон химических веществ, изучаемых в органической химии, включает углеводороды, а также множество составов на основе углерода, но также содержащих другие элементы, такие как кислород, азот, серу, фосфор и радиоактивные элементы галогенов.
Основным направлением органической химии является выделение, очистка и структурное исследование этих природных веществ.Многие натуральные продукты представляют собой простые молекулы. Примеры включают муравьиную кислоту (HCO2H) в муравьях, этиловый спирт (C2H5OH) в ферментирующих фруктах и щавелевую кислоту (C2h3O4) в листьях ревеня.
Химики обычно считали, что соединения, полученные из живых организмов, наделены жизненной силой, которая отличает их от неорганических соединений. Согласно концепции витализма, органическое вещество наделено «жизненной силой». В первой половине девятнадцатого века были опубликованы некоторые из первых систематических исследований органических соединений.
В 1828 году Фридрих Велер произвел органическую химическую мочевину (карбамид), входящую в состав мочи, из неорганических исходных материалов (соли цианата калия и сульфата аммония) в том, что сейчас называется синтезом Велера.
Решающим прорывом в органической химии стала концепция химической структуры, независимо разработанная в 1858 году Фридрихом Августом Кекуле и Арчибальдом Скоттом Купером.
В начале 20 века было показано, что полимеры и ферменты представляют собой большие органические молекулы, а нефть имеет биологическое происхождение.
Открытие нефти и развитие нефтехимической промышленности стимулировали развитие органической химии.
Большинство химических соединений, встречающихся в биологических организмах, на самом деле являются соединениями углерода, поэтому существует связь между органической химией и биохимией.
Названия органических соединений являются либо систематическими, логически вытекающими из набора правил, либо несистематическими, следуя различным традициям. Систематическая номенклатура предусмотрена спецификациями IUPAC.
Органические молекулы обычно описываются рисунками или структурными формулами, комбинациями рисунков и химических символов. Формула линейный угол проста и однозначна. В этой системе конечные точки и пересечения каждой линии представляют один углерод, и атомы водорода могут быть либо явно обозначены, либо предположительно присутствуют, как подразумевается четырехвалентным углеродом.
Концепция функциональных групп занимает центральное место в органической химии как средство классификации структур и прогнозирования свойств.Функциональная группа представляет собой молекулярный модуль, и предполагается, что реакционная способность этой функциональной группы в определенных пределах одинакова в различных молекулах. Функциональные группы могут иметь решающее влияние на химические и физические свойства органических соединений.
Молекулы классифицируются на основе их функциональных групп. Например, все спирты имеют субъединицу C-O-H. Все спирты имеют тенденцию к некоторой гидрофильности, обычно образуют сложные эфиры и обычно могут быть преобразованы в соответствующие галогениды.Большинство функциональных групп содержат гетероатомы (атомы, отличные от C и H). Органические соединения классифицируются по функциональным группам, спиртам, карбоновым кислотам, аминам и т. Д.
Что такое органический углерод почвы?
Чем органический углерод почвы отличается от органического вещества почвы?
Органический углерод почвы (SOC) относится только к углеродному компоненту органических соединений. Органическое вещество почвы (ПОВ) трудно измерить напрямую, поэтому лаборатории, как правило, измеряют и сообщают ПОВ.
Почвенный органический углерод и связывание углерода
Улавливание углерода в SOC рассматривается как один из способов смягчения последствий изменения климата за счет сокращения выбросов двуокиси углерода в атмосфере. Аргумент состоит в том, что небольшое увеличение SOC на очень больших площадях сельскохозяйственных и пастбищных угодий значительно снизит выбросы двуокиси углерода в атмосфере. Чтобы восстановление было длительным, органические вещества должны находиться в более стабильных или устойчивых фракциях (Таблица 1). Для получения дополнительной информации см. Почвенный органический углерод и связывание углерода.
Что такое органическое вещество почвы?
ПОВ состоит в основном из углерода, водорода и кислорода и имеет небольшие количества других элементов, таких как азот, фосфор, сера, калий, кальций и магний, содержащихся в органических остатках. Он делится на «живые» и «мертвые» компоненты и может варьироваться от совсем недавних поступлений, таких как стерня, до сильно разложившихся материалов, возраст которых составляет тысячи лет. Около 10% подземного ПОВ, такого как корни, фауна и микроорганизмы, является «живым» (Рисунок 1).
ПОВ существует в виде 4 отдельных фракций, которые сильно различаются по размеру, времени оборота и составу в почве (таблица 1):
- растворенное органическое вещество
- твердое органическое вещество
- гумус
- устойчивое органическое вещество.
| Фракция | Размер микрометры (мкм) и миллиметры (мм) | Время оборота | Состав |
|---|---|---|---|
| Растворенные органические вещества | <45 мкм (в растворе) | От минут до дней | Растворимые корневые экссудаты, простые сахара и побочные продукты разложения.Обычно он составляет менее 5% от общего органического вещества почвы. |
| Твердые органические вещества | 53 мкм – 2 мм | 2–50 лет | Свежее или разлагающееся вещество растений и животных с идентифицируемой клеточной структурой. Составляет 2–25% органического вещества почвы. |
| Гумус | <53 мкм | Десятилетия (от 10 до 100 лет) | Старые, разложившиеся органические соединения, сопротивляющиеся разложению.Может составлять более 50% всего органического вещества почвы. |
| Устойчивое органическое вещество | <53 мкм – 2 мм | От 100 до 1000 лет | Относительно инертный материал, такой как химически стойкие материалы или органические остатки (например, древесный уголь). Может составлять до 10% органического вещества почвы. |
Вернуться к началу
Сколько органического углерода содержится в почвах Западной Австралии?
Большинство почв Западной Австралии имеют низкое содержание SOC (Viscarra Rossel et al.2014). Низкое количество осадков, теплые условия в течение большей части года и песчаные почвы ограничивают накопление стабильного SOC.
Как правило, содержание органического углерода в сельскохозяйственных почвах засушливых земель Западной Австралии составляет от 0,7% до 4% (рис. 2), хотя SOC может быть от 0,3% для пустынных почв и до 14% для интенсивных молочных почв. Большинство органических веществ находится у поверхности почвы. На юго-западе Западной Австралии около 60% органического вещества в верхних 30 см почвы находится в верхних 10 см.
Оценка запасов органического вещества почвы на основе органического углерода почвы
1 Начните с измеренного общего органического углерода%
Около 58% массы органического вещества существует в виде углерода.Мы можем оценить процент SOM от SOC%, используя коэффициент преобразования 1,72 (полученный из 100/58).
Органическое вещество (%) = общий органический углерод (%) x 1,72
Этот коэффициент преобразования может варьироваться в зависимости от почв, но 1,72 обеспечивает разумную оценку ПОВ для большинства целей.
2 Преобразовать% в вес для заданной глубины и площади
Запасы SOC в тоннах углерода на гектар (тС / га) = (органический углерод почвы%) x (масса почвы в заданном объеме)
Для Например, почва с SOC 1.3% (0,013) и насыпная плотность 1,2 грамма на кубический сантиметр (эквивалент 1,2 тонны на кубический метр), будут иметь SOC на глубине 10 см (0,1 м) на гектар (10 000 м 2 ) из:
(0,013) x (1,2 x 0,1 x 10 000) = 15,6 тС / га.
Используя коэффициент преобразования 1,72, количество ПОВ будет: 15,6 x 1,72 = 26,8 тонны органического вещества.
Вернуться к началу
Круговорот органических веществ в почве
Тип почвы, климат и управление влияют на поступление органических веществ в почву и ее круговорот или разложение.Осадки являются основным фактором роста растений (биомассы) и биологической активности, что приводит к разложению органических веществ, попадающих в почву. Различные фракции ПОВ (растворенные, твердые, гумусовые и устойчивые) изменяются с совершенно разной скоростью (рис. 3). Кроме того, ПОВ непрерывно циклически перемещается между живыми, разлагающимися и стабильными фракциями в почве (рис. 4).
- Входные данные: растения и животные становятся частью SOM, когда они умирают или создают побочные продукты.
- Трансформация: почвенные организмы разрушаются и потребляют органическое вещество, создавая различные формы органических остатков.Например, свежие растительные остатки разбиваются на более мелкие части (<2 мм) и становятся частью фракции твердых частиц органического вещества. Этот материал разлагается дальше, и меньшее количество более биологически стабильного материала попадает в гумусовый бассейн.
- Выделение питательных веществ: высвобождаются питательные вещества и другие соединения, в которых не нуждаются микроорганизмы, а затем они становятся доступными для растений.
- Стабилизирующие органические вещества: по мере разложения органических остатков они становятся более устойчивыми к дальнейшим изменениям.
Вернуться к началу
Какая часть почвенного органического углерода, попадающего в почву, остается там?
Микроорганизмы переваривают до 90% органического углерода, поступающего в почву в виде органических остатков. При этом они вдыхают углерод обратно в атмосферу в виде углекислого газа. В то время как до 30% вводимых органических веществ в конечном итоге может быть преобразовано в гумус, в зависимости от типа почвы и климата, на сельскохозяйственных почвах Австралии это значение часто значительно меньше. Есть 3 основных фактора, влияющих на способность данного типа почвы удерживать SOC (Рисунок 5).Почвы с более высоким содержанием глины обычно удерживают больше органического вещества и, следовательно, могут удерживать больше органического углерода, чем песчаные почвы.
ПОВ в первую очередь является результатом затрат за вычетом потерь и может зависеть от типа почвы, климата и управления (таблица 2). SOM увеличивается, когда входы превышают потери, и наоборот. Поступления в значительной степени зависят от производства растительной биомассы, хотя также могут быть результатом внесения поправок в почвы или побочных продуктов животноводства. Потери происходят при разложении органических веществ и, в некоторых случаях, при эрозии почвы.
| Факторы | Влияние |
|---|---|
| Тип почвы |
|
| Климат |
|
| Управление земельными ресурсами и почвами |
|
Вернуться к началу
Как мне измерить или интерпретировать результаты определения содержания органического углерода в почве?
Изменения в стабильном SOC обычно происходят очень медленно (в течение десятилетий), и часто бывает трудно измерить небольшие изменения на относительно большом фоне почвенного углерода.Изменения в SOC в значительной степени определяются тем, сколько биомассы выращивается и сохраняется над и под землей.
Около 45% органического вещества составляет углерод, и более легкие почвы удерживают менее 30% этого вещества. Например, в почвах Западной Австралии измеряется от 20 до 160 тС / га. Типичная австралийская система производства зерна, дающая урожайность 2 т / га пшеницы, вероятно, будет ежегодно удерживать в почве 0,1–0,5 т органического вещества на гектар. Это приравнивается к изменению SOC во многих случаях менее чем на 1% от общего запаса.
Для того, чтобы можно было с какой-либо степенью уверенности измерить значительное изменение, необходимо большее изменение в общем запасе органического углерода, которое может произойти через несколько лет или больше. Учитывая, что годовые поступления органических остатков, вероятно, будут менее 0,2 тС / га в типичной системе возделывания зерновых, время, необходимое для обнаружения значительного изменения SOC, обычно составляет более 10 лет.
Отслеживая SOC с течением времени, можно оценить изменения, вызванные руководством (рис. 6).Однако свежие пожнивные остатки (рис. 1) могут сильно различаться в зависимости от урожая или пастбищ, выращиваемых каждый год.
Для точного измерения изменений SOC требуется:
- стратегия отбора проб почвы, которая фиксирует естественные вариации содержания углерода в почве
- показатель концентрации SOC
- оценку объемной плотности почвы для корректировки изменений массы почвы при заданные интервалы глубины.
Изменения SOC, скорее всего, будут наблюдаться в верхнем слое почвы 0–10 см.
При тестировании почвы на органический углерод обычно указывается общий процент SOC. Используя меру насыпной плотности, можно рассчитать количество углерода на гектар на заданной глубине почвы, как показано ранее.
СсылкиГриффин, Э., Хойл, Ф. К. и Мерфи, Д. В. 2013, «Органический углерод почвы», в Табель успеваемости по устойчивому использованию природных ресурсов в сельском хозяйстве , Министерство сельского хозяйства и продовольствия, Западная Австралия, просмотрено 16 Ноябрь 2016 г., https: // www.Agric.wa.gov.au/sites/gateway/files/2.4%20Soil%20organic%20carbon.pdf
Hoyle, FC 2013, Управление органическими веществами почвы: практическое руководство , Grains Research and Development Corporation, Kingston, просмотрено 15 октября 2018 г., https://grdc.com.au/resources-and-publications/all-publications/publications/2013/07/grdc-guide-managingsoilorganicmatter.
Хойл, Ф.К., Мерфи, Д.В. и Филлери, IRP 2006, «Температура и обработка стерни влияют на микробный CO 2 -C эволюция и скорость валовой трансформации азота», Soil Biology and Biochemistry , vol.38. С. 71–80.
Ingram, JSI, Fernandes, ECM 2001, «Управление секвестрацией углерода в почвах: концепции и терминология», Journal of Agriculture, Ecosystems and Environment , vol. 87, pp. 111–117, просмотрено 15 октября 2018 г., https://www.sciencedirect.com/science/article/pii/S01678801451
Viscarra Rossel, RA, Webster, R, Bui, EN & Baldock, JA 2014, «Базовая карта содержания органического углерода в почве Австралии для поддержки национального учета и мониторинга углерода в условиях изменения климата», Global Change Biology , vol.20, стр. 2953–2970, DOI: 10.1111 / gcb.12569
Органическое вещество почвы в системах земледелия
Ayotte, J. D., S.M. Фланаган, У.С. Завтра. Октябрь 2007 г. Обнаружение урана и радона-222 в ледниковых и коренных водоносных горизонтах на севере Соединенных Штатов, Отчет о научных исследованиях за 1993-2003 гг. 2007-5037, Технический отчет.
Буол, С.В., Р.Дж. Саутард, Р. Грэм, П.А. Макдэниел. 2003. Генезис и классификация почв. Айова Стейт Пресс.
DeJong-Hughes, J., A.L.M.Daigh. 2017. Руководство по обработке почвы в Верхнем Среднем Западе. Публикация по расширению Университета Миннесоты. Доступно по адресу: https://extension.umn.edu/soil-and-water/soil-management-and-health#upper-midwest-tillage-guide-1233360
.ДеЙонг-Хьюз, Дж., Д. Францен, А. Вик. 2015. Снижение ветровой эрозии для долгосрочной рентабельности. Публикация по расширению Университета Миннесоты. Доступно по адресу: https://extension.umn.edu/soil-management-and-health/reduce-wind-erosion-long-term-profitability
.Харгроув, W.W. и R.J. Люксмор. 1988. Содержание органического вещества в почве в Соединенных Штатах, Источник: Новая национальная карта растительных экорегионов с высоким разрешением, составленная эмпирическим путем с использованием многомерной пространственной кластеризации, выпущенная Министерством сельского хозяйства США, общественное достояние.
Ховард, П.Дж.А., Д.М. Говард. 1990. Использование органического углерода и потерь при возгорании для оценки органического вещества почвы в различных типах почв и горизонтах. Биология и плодородие почв 9: 306-310.
Hudson, B.D. 1994. Органическое вещество почвы и доступная водоемкость.Журнал охраны почв и водоемов март / апрель, т. 49 нет. 2. С. 189–194.
Дженкинсон, Д.С. 1977. Биомасса почвы. NZ Soil News 25: 213-218.
Lamb, J., S. Huerd, K. Moncada. Университет Миннесоты. Руководство по управлению рисками для производителей органических продуктов. Глава 3. Здоровье почвы. На сайте: https://organicriskmanagement.umn.edu/
Лауэр, Дж. Июль 2006 г. Обеспокоенность по поводу засухи в начале опыления кукурузы. Университет Висконсина. Полевые культуры 28.493 – 42. Онлайн: http: // 128.104.50.45 / Pubs / Default.aspx
Oldfield, E.E., S.A. Woods, M.A. Bradford. 2018. Прямое воздействие органического вещества почвы на продуктивность аналогично тому, которое наблюдается с органическими добавками. Обычная статья в растительной почве. На сайте: https://doi.org/10.1007/s11104-017-3513-5
Ovington, J.D., D. Haitkamp, D.B. Лоуренс. 1963. Биомасса растений и продуктивность экосистем прерий, саванн, дубовых лесов и кукурузных полей в центральной Миннесоте. Экология 44: 52-63.
Пол, Э.А., Х.П. Коллинз, С. Ливитт. 2001. Динамика устойчивого почвенного углерода сельскохозяйственных почв Среднего Запада, измеренная по естественному содержанию углерода 14 C. Геодерма 104: 239-256.
Сильвия, Д.М., Дж. Дж. Фурманн, П. Хартель, Д.А. Зуберер. 2005. Принципы и применения почвенной микробиологии. Пирсон.
Вейл Р.Р., Северная Каролина Брэди. 2017. Природа и свойства почв. Пирсон.
Курсы – Химия
Последний раз предлагался осенью 2017 г.
В этом курсе, предназначенном для студентов, которые не планируют изучать естественные науки, мы используем тематический подход для изучения избранных тем судебной медицины.К ним относятся: [подробнее]
Мы окружены материалами. Они с древних времен удовлетворяли потребности человека. От финикийского стекла до гибких OLED-дисплеев – материалы повлияли на общество и изменили образ жизни людей [подробнее]
Последний раз предлагался осенью 2018 года
С момента открытия вируса иммунодефицита человека (ВИЧ-1) в 1983 году, современные методы молекулярной биологии многое узнали о его структуре и жизненном цикле. Интенсивность научного [подробнее]
CHEM 116 LEC Химия и физика кулинарии
Последнее предложение Весна 2016
Приготовление пищи – это творческий и художественный процесс, но он основан на фундаментальных химических и физических принципах.Этот курс предназначен для студентов, которые не планируют [подробнее]
Последнее предложение Весна 2021 г.
Вас когда-нибудь щекотали розовым? Почувствовал себя синим? Видели красный?, Зеленый от зависти? Курс будет рассматривать цвет, начиная с физического и химического происхождения цвета (электромагнитный [подробнее]
Этот курс представляет собой введение в химию для тех учащихся, которые мало или совсем не знают химию в средней школе. Студенты будут ознакомлены с концепциями, фундаментальными для изучения молекулярная материя [подробнее]
Этот курс расширяет и углубляет основы химии студентов, которые обычно изучали химию в течение одного года на уровне средней школы.Большинство студентов начинают изучать химию [подробнее]
Этот курс предназначен для студентов с сильной подготовкой по химии (включая лабораторный опыт) в средней школе, например, предоставленный курсом химии Advanced Placement (или его эквивалентом) с [подробнее]
Этот курс обеспечивает необходимую подготовку по органической химии для студентов, которые планируют углубленное изучение или карьеру в области химии, биологических наук или медицинских профессий. Он инициирует [подробнее]
Этот курс является продолжением химии 156 и завершает систематическое изучение общих классов органических соединений с акцентом на теории структуры и реакционной способности.Конкретный [подробнее]
Последний раз предлагался осенью 2019 г.
Этот курс является продолжением CHEM 156 и содержит тот же материал, что и CHEM 251, за исключением лабораторной программы, описанной ниже: Целью этого продвинутого лабораторного раздела является [подробнее]
Этот курс рассматривает множество тем современной химии, уделяя особое внимание широким концепциям, которые соединяют и переплетаются между различными субдисциплинами области – биохимией, неорганической химией, органической химией и физикой. [Подробнее]
Последнее предложение Весна 2021 г.
Чему вычислительная биология может научить нас в отношении рака? В этом интенсивном лабораторном опыте по программе геномики, протеомики и биоинформатики вычислительный анализ и исследования в мокрой лаборатории будут информировать друг друга по мере того, как студенты [подробнее]
Этот курс знакомит с основополагающими концепциями биохимии с упором на структуру и функция биологических макромолекул.В частности, структура белков и нуклеиновых кислот изучается в [подробнее]
. Этот курс лекций обеспечивает углубленное представление сложных метаболических реакций, которые являются центральными для жизни. Особое внимание уделяется биологическому потоку энергии, включая альтернативные способы [подробнее]
Ферменты – это сложные биологические молекулы, способные катализировать химические реакции с очень высокой эффективностью, стереоселективностью и специфичностью. Изучение реакций, катализируемых ферментами, дает представление об изучении органических реакций [подробнее]
Последнее предложение Весна 2021 г.
Этот курс рассматривает быстро развивающиеся, междисциплинарные и взаимосвязанные области химической и синтетической биологии.Химическая биология использует точные манипуляции на молекулярном уровне для воздействия на живые системы снизу вверх, часто [подробнее]
Этот курс охватывает фундаментальные аспекты химии элементов основных групп и переходных металлов и подчеркивает, как эти свойства являются ключевыми для понимания ролей. этих элементов в [подробнее]
Материалы определили многое из того, что возможно в нашей повседневной жизни. Материаловеды находятся в центре воображения и достижения прогресса, поскольку они улучшают существующие материалы и развивают [подробнее]
Последнее предложение Весна 2021 года
Биоинорганическая химия – это междисциплинарная область, изучающая роль металлов в живых системах.Металлы являются ключевыми компонентами широкого спектра процессов, включая транспорт и активацию кислорода, [подробнее]
Последнее предложение Весна 2018
Что такое яд и что делает его ядовитым? Парацелькус прокомментировал в 1537 году: «Что не является ядом? Все вещи – яды (и ничто не обходится без яда). Одна доза [подробнее]
Истоки органической химии следует искать в химии живых существ и акцентировании внимания на ней. Этот курс посвящен химии природных соединений.Этот курс [подробнее]
CHEM 343 LEC Medicinal Chemistry
Последний раз предлагался осенью 2014 г.
Этот курс исследует дизайн, разработку и функцию фармацевтических препаратов. Фундаментальные концепции органической химии распространяются на изучение фармакодинамики – взаимодействия между лекарствами и их мишенями, которые вызывают [подробнее]
Структура молекулы неразрывно связана с ее реакционной способностью, и эти корреляции формируют основу для понимания органических реакций. механизмы.Этот курс углубляет понимание из предыдущих органических [подробнее]
Последний раз предлагалось осень 2019
От синтетических до природных макромолекул, мы сталкиваемся с полимерами повсюду и каждый день. Этот курс исследует множество доступных синтетических методов и обсуждает, как структура определяет функцию. Темы включают конденсацию и [подробнее]
Этот курс представляет собой введение в квантовую механику, которая служит основой для понимания атомной и молекулярной структуры, а также спектроскопических методов.Это приводит к обсуждению [подробнее]
Инструментальные методы анализа предоставляют ученым различные линзы для наблюдения и объяснения фундаментальных химических явлений, а также для измерения параметров и свойств в атомарном, молекулярном и объемном масштабах. Это [подробнее]
Термодинамические законы предоставляют нам самые мощные и общие научные принципы для предсказания направления спонтанных изменений в физических, химических и биологических системах. Этот курс развивает [подробнее]
Последнее предложение Весна 2021 г.
Этот курс предназначен для предоставления практических знаний по базовой физической химии студентам, которые в первую очередь интересуются биохимическими, биологическими или медицинскими профессиями.Представлены темы физической химии [подробнее]
Этот курс представляет собой введение в принципы вычислительной квантовой механики и их применение к проблемам, представляющим интерес для химии, таким как химическая связь, химическая реакционная способность и молекулярная спектроскопия. Акцент [подробнее]
Последнее предложение Осень 2020 г.
Этот курс знакомит студентов с методами, используемыми для оценки рисков, создаваемых органическими химическими веществами для здоровья человека, животных и экосистем. Наша цель – развить количественное понимание [подробнее]
Независимое исследование химии для юниоров.[Подробнее]
Самостоятельное занятие по химии для юниоров. [Подробнее]
Индивидуальные исследовательские проекты в интересующей студента области выполняются под руководством преподавателя и завершаются диссертацией; это часть [подробнее]
Индивидуальные исследовательские проекты в интересующей студента области выполняются под руководством преподавателя и завершаются диссертацией; это часть [подробнее]
Независимое исследование химии для пожилых людей.Индивидуальные исследовательские проекты в интересующей студента области выполняются под руководством преподавателя. [Подробнее]
Самостоятельное занятие по химии для пожилых людей. Индивидуальные исследовательские проекты в интересующей студента области выполняются под руководством преподавателя. [Подробнее]
Происхождение и классификация органических веществ в кластических системах по JSTOR
Классификация органических частиц, основанная на их состоянии разложения и биологическом происхождении, представлена для использования в палинологическом анализе.Эта классификация использовалась в различных формах с 1969 года и оказалась полезной при анализе органического вещества обломочных пород от девона до современности. Органические частицы называются мацералами и делятся на фитокласты (полученные из растений), зоокласты (полученные из животных), протистокласты (полученные из протистана) и склератокласты (полученные из грибов). Кроме того, термин «рецепторные кластеры» используется для обозначения осажденного органического вещества. Фитокласты подразделяются на следующие категории в зависимости от степени их разложения: хорошо сохранившиеся, без признаков биодеградации; плохо сохраняется, биоразложение незначительное; зараженные, сильно разрушенные клеточные стенки; аморфная структура, только остаточная клеточная структура; аморфная бесструктурная, блочная масса.Помимо аморфных неструктурированных фитокластов существуют аморфные неструктурированные протистокласты (пушистые массы) и аморфные зараженные индетерминантные мацералы (массы с включениями). В эту классификацию можно включить и другие методы классификации мацералов, такие как отражательная способность и УФ-флуоресценция. Время пребывания органической частицы в поверхностной среде влияет на уровень ее разложения. Продолжительное воздействие аэробного биоценоза особенно увеличивает скорость разложения всех органических веществ.Среди растительных фрагментов пропорция разложившегося вещества используется для определения «индекса деградации». Индекс деградации древних отложений сопоставим с углеродно-азотным индексом современных отложений, поскольку он измеряет уровень разложения, имевшего место во время осаждения. Поскольку органическое вещество из разных сред показывает разные индексы деградации, а также различное биологическое происхождение захороненных органических частиц, можно использовать совокупность органических частиц как показатель среды осаждения.Очевидно, что анализ мацеральных фаций вносит свой вклад в палеоэкологический анализ. Используя двойственный подход, основанный на биологическом происхождении и уровне деградации, мацеральные ассоциации дают ключ к разгадке условий осадконакопления, а также потенциала нефтедобычи (видов и количеств углеводородов) конкретной нефтематеринской породы. Изменения свойств мацералов, связанные с термическим созреванием, обычно известны для кластических сред. Важные изменения происходят в отражательной способности, флуоресценции и цвете витринита, и они используются в качестве меры степени термического созревания.Объемные изменения мацералов связаны с термическим созреванием в результате катагенеза и могут вызывать микродавление при образовании углеводородов.
Информация о журналеЖурнал «Палинология» является основным изданием Американской ассоциации стратиграфических палинологов (AASP) и принимает подходящие рукописи по всем аспектам изучения палинологии. Палинология – один из лучших журналов своего жанра, и весь иллюстративный материал воспроизводится на высшем уровне.Он публикуется ежегодно с 1977 года, и ему предшествовали выпуски журнала AASP Geoscience and Man с 1968 по 1974 год. Помимо рецензируемых статей, Palynology включает цитаты из наград AASP, биографические очерки авторов, выдержки из презентаций, представленных на ежегодных собраниях AASP. , групповые фотографии участников годового собрания и инструкции для авторов.
Информация об издателеОсновываясь на двухвековом опыте, Taylor & Francis за последние два десятилетия быстро выросла и стала ведущим международным академическим издателем.Группа издает более 800 журналов и более 1800 новых книг каждый год, охватывающих широкий спектр предметных областей и включая журнальные оттиски Routledge, Carfax, Spon Press, Psychology Press, Martin Dunitz и Taylor & Francis. Тейлор и Фрэнсис полностью привержены делу. на публикацию и распространение научной информации высочайшего качества, и сегодня это остается первоочередной задачей.
Как состав органического вещества почвы влияет на связывание углерода
В недавней статье Nature Geoscience рекомендуется, чтобы стратегии связывания углерода учитывали присущую почве углеродную емкость и доступность азота в экосистемах, поскольку количество углерода, захваченного почвой, и его стабильность зависят от различных органических веществ. фракции материи, из которых он состоит.
Авторы обнаружили, что средний запас углерода в почве на европейских пастбищах и в верхнем слое лесов колеблется от 46 до 84 Mg C га -1 , с самыми высокими значениями в хвойных или смешанных лесных почвах.
Они показывают, что дополнительная емкость для хранения углерода зависит от относительного распределения углерода между типами почвенного органического вещества (органическое вещество в виде твердых частиц и органическое вещество, связанное с минералами), и рекомендуют, чтобы стратегии основывались на четких научно обоснованных рекомендациях, которые учитывают: специфические свойства почвы и экосистемы.
Смягчение последствий изменения климата за счет связывания углерода
Связывание углерода в органическом веществе почвы является одной из основных экономически эффективных стратегий смягчения последствий изменения климата для удаления из атмосферы двуокиси углерода (CO 2 ), вызывающей глобальное потепление.
Связывание углерода почвой – это процесс, при котором CO 2 удаляется из атмосферы растительностью и сохраняется в резервуаре органического углерода почвы.
Помимо уменьшения количества углерода в атмосфере, связывание углерода в почве может также улучшить здоровье почвы и ее способность обеспечивать жизненно важные экосистемные услуги, такие как создание среды для роста растений, переработка органических отходов и питательных веществ, изменение атмосферы, обеспечение среды обитания для почвенных организмов и регулирование подачи и очистки воды.
Чтобы эффективно способствовать смягчению последствий изменения климата, наземные решения должны максимизировать накопление углерода в почве без образования излишка азота (что может привести к загрязнению воды и выбросам парниковых газов).
Однако большинство стратегий управления земельными ресурсами для связывания углерода не учитывают форму, в которой хранится углерод, его емкость, устойчивость и потребность в азоте.
Авторы намеревались исправить это, измерив европейские запасы углерода и азота в верхнем слое почвы в лесах и лугах и продемонстрировав их распределение между пулами органических веществ, связанных с минералами, и твердых частиц.
Они проанализировали 186 образцов почвы из базы данных «Обследование территории землепользования / земельного покрова» (LUCAS), разделив органическое вещество почвы на твердые частицы и органическое вещество, связанное с минералами. Затем они соединили данные с панъевропейским набором данных о встречаемости деревьев с высоким разрешением, чтобы определить, как микоризная ассоциация может влиять на путь образования и стабилизации почвенного органического углерода.
Лесные и пастбищные почвы имеют решающее значение для управления почвенным углеродом
Почвы лесов и пастбищ умеренного пояса могут играть решающую роль в управлении почвенным углеродом, поскольку они занимают обширную площадь земной поверхности, часто управляются и могут хранить большое количество углерод.
Авторы обнаружили, что луга и арбускулярные микоризные леса (корни которых образуют внутриклеточный симбиоз с грибами) накапливают больше почвенного углерода в связанном с минералами органическом углероде, который сохраняется в течение длительного времени, но требует большого количества азота и может быстро стать насыщенным углеродом. .
Эктомикоризные леса (корни которых образуют внеклеточный симбиоз с грибами) накапливают больше углерода в твердых частицах органического вещества, которое более уязвимо для нарушений, но имеет более низкую потребность в азоте и потенциально может накапливаться бесконечно долго.
Твердые органические вещества и связанные с минералами органические вещества
Общий органический углерод можно разделить на два типа почвенного органического вещества: твердые частицы и органическое вещество, связанное с минералами. Концептуализация органического углерода в этих фракциях обеспечивает реальную, хорошо обоснованную и полезную основу, которая позволит ученым получить знания о механизмах, которые управляют преобразованием углерода в почвах.
Твердые органические вещества преимущественно состоят из твердых частиц растительного происхождения 0.Размером от 053 мм до 2 мм, в то время как органическое вещество, связанное с минералами, состоит из отдельных молекул или микроскопических кусочков органического материала, которые либо выщелочились непосредственно из растений, либо были химически преобразованы почвенной биотой.
Твердые органические вещества часто используются в качестве индикатора качества почвы, поскольку они являются легкодоступным источником питательных веществ в почве, вносят свой вклад в структуру почвы, очень чувствительны к управлению почвой и имеют низкое содержание азота.
Органическое вещество, связанное с минералами, в основном состоит из микробных продуктов, которые более богаты азотом и более стойкие во времени.
Их резко контрастирующие физические и химические свойства и среднее время пребывания в почве определяют их различную реакцию на глобальное давление, такое как изменение землепользования, потепление и обогащение CO 2 в атмосфере.
Четкие научно обоснованные руководящие принципы для стратегий связывания углерода
Авторы рекомендуют, чтобы реализация стратегий по связыванию углерода в почве основывалась на четких научно обоснованных руководящих принципах, которые учитывают свойства почвы и экосистемы для конкретных участков, включая относительное распределение почвенных органических веществ. вещество в виде твердых частиц и фракций, связанных с минералами.
Они показывают, что луга (на которых преобладают органические вещества, связанные с минералами) являются хорошим долгосрочным поглотителем углерода, но требуют большого количества азота и быстро становятся насыщенными углеродом. Следовательно, стратегии управления по секвестру углерода на пастбищах должны быть нацелены на почвы, которые еще не насыщены.
Это указывает на необходимость географических оценок дефицита углеродной насыщенности почвы.
Леса, с другой стороны, обладают большей пластичностью в том, как может накапливаться почвенный углерод, потому что они могут накапливать больше углерода во фракции твердых частиц органического вещества.

 Углубить основные химические понятия: вещество, химическая реакция.
Углубить основные химические понятия: вещество, химическая реакция.
 1-4 (у), упр. 5,6 стр.13; выучить Алканы стр. 26
1-4 (у), упр. 5,6 стр.13; выучить Алканы стр. 26
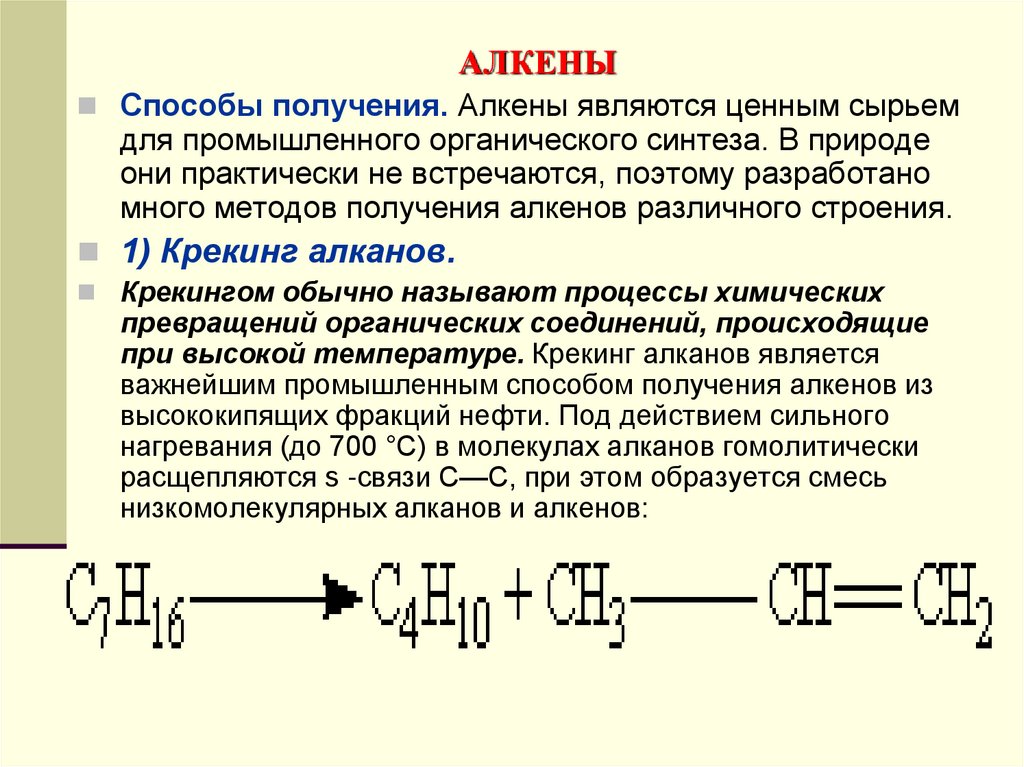 Конец ХIХ века был периодом триумфального шествия органического синтеза;
в эти годы были впервые получены анилиновые красители, взрывчатые органические вещества, многие лекарства.
Конец ХIХ века был периодом триумфального шествия органического синтеза;
в эти годы были впервые получены анилиновые красители, взрывчатые органические вещества, многие лекарства.

