La Vanguardia (Испания): Менделеев создал Периодическую таблицу химических элементов, но не получал Нобелевской премии и не изобретал водки
https://inosmi.ru/20190313/244733332.html
La Vanguardia: Менделеев не изобретал водки
La Vanguardia: Менделеев не изобретал водки
La Vanguardia: Менделеев не изобретал водки
«Вангуардия» опубликовала материал о русском химике Дмитрии Менделееве, чья таблица химических элементов является важнейшим наследием человечества. Менделеев… | 13.03.2019, ИноСМИ
2019-03-13T01:12
2019-03-13T01:12
2022-10-07T15:32
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn1.inosmi.ru/images/sharing/article/244733332.jpg?2447330871665145978
россия
ИноСМИ
+7 495 645 66 01
ФГУП МИА «Россия сегодня»
2019
ИноСМИ
+7 495 645 66 01
ФГУП МИА «Россия сегодня»
Новости
ru-RU
https://inosmi. ru/docs/about/copyright.html
ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
ИноСМИ
+7 495 645 66 01
ФГУП МИА «Россия сегодня»
ИноСМИ
+7 495 645 66 01
ФГУП МИА «Россия сегодня»
ИноСМИ
+7 495 645 66 01
ФГУП МИА «Россия сегодня»
общество, история, история в лицах, россия, дмитрий менделеев
Материалы ИноСМИ содержат оценки исключительно зарубежных СМИ и не отражают позицию редакции ИноСМИ
Читать inosmi.ru в
«Вангуардия» опубликовала материал о русском химике Дмитрии Менделееве, чья таблица химических элементов является важнейшим наследием человечества. Менделеев никогда не получал Нобелевской премии из-за своего сложного характера, хотя он заложил основы нынешнего устойчивого развития и, вопреки мнению многих его соотечественников, не изобретал водки.
Игнасио Ортега (Ignacio Ortega)
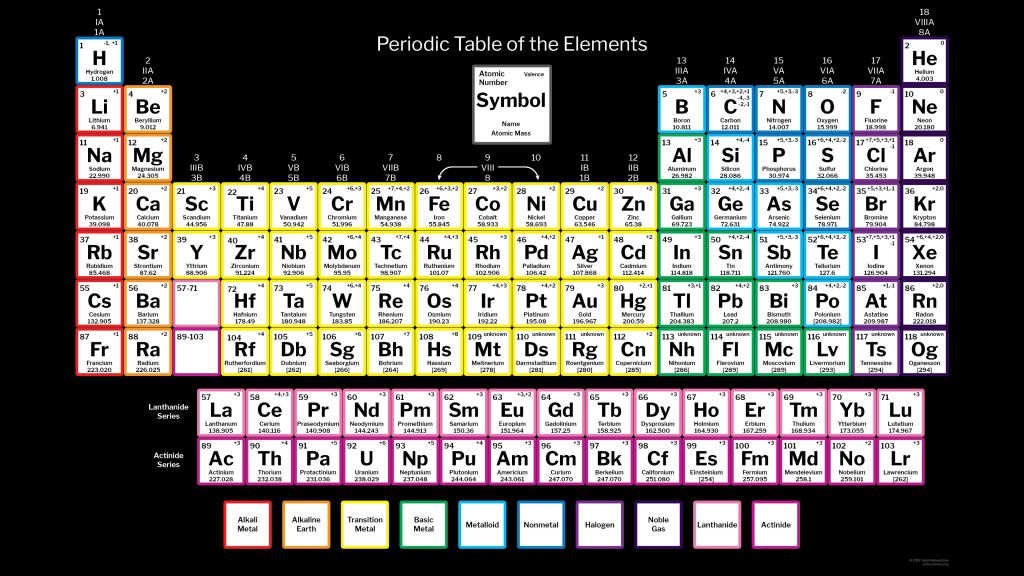
«Все, что мы видим, состоит из элементов, находящихся в таблице. Например, смартфон, который я держу сейчас в руках. В нем 30 химических элементов из таблицы. Некоторые из них даже еще не существовали, когда Менделеев составил таблицу», — сообщает агентству «ЭФЕ» Степан Калмыков, декан Химического факультета Московского государственного университета.
Например, смартфон, который я держу сейчас в руках. В нем 30 химических элементов из таблицы. Некоторые из них даже еще не существовали, когда Менделеев составил таблицу», — сообщает агентству «ЭФЕ» Степан Калмыков, декан Химического факультета Московского государственного университета.
Менделеев (1834 — 1907) и его таблица являются теперь важнейшим наследием человечества. ООН объявила 2019 год Международным годом Периодической таблицы химических элементов. Но великий ученый получил заслуженное национальное и международное признание только уже в преклонном возрасте, в значительной степени из-за своего трудного характера.
Удивительным образом, в науке середины XIX века визуальная систематизация законов природы считалась чем-то маргинальным. «Это подтверждает то, что Менделеев был гением и очень смелым человеком. Ведь чтобы создать таблицу, недостаточно быть просто ученым — нужно быть философом», — говорит Игорь Дмитриев, директор петербургского Музея-архива Менделеева.
Калмыков также считает, что Менделеев не ограничился простым изучением уже известного мира окружавшей его природы.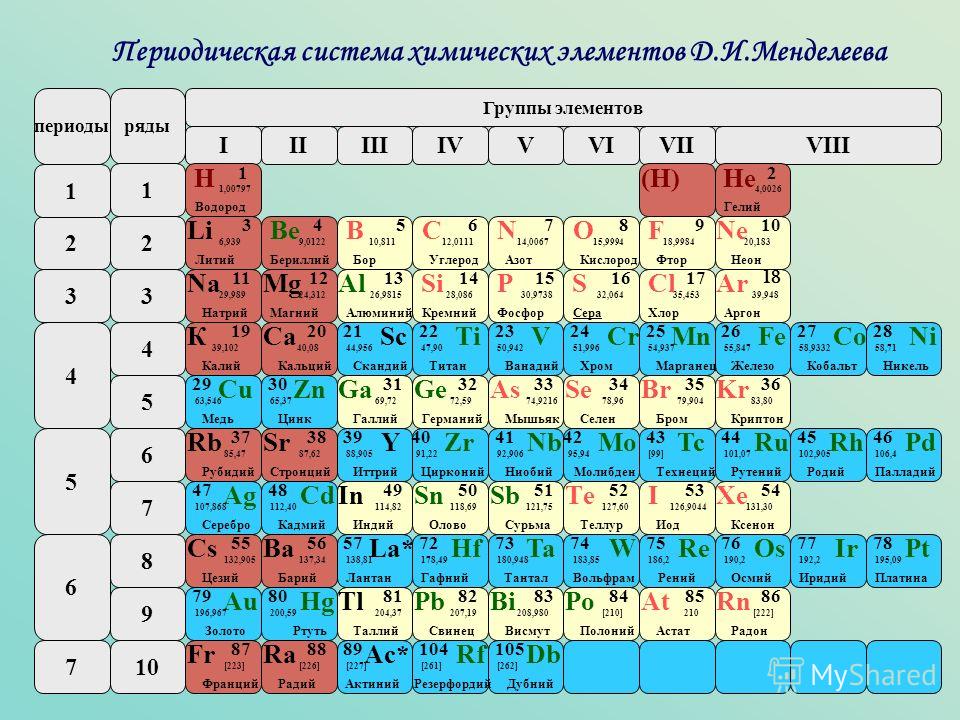
«Это большее, что русская наука смогла дать миру. Он был пророком. Другие составляли таблицы из уже существовавших элементов, а Менделеев опережал свое время. Он был человеком XX века», — говорит Калмыков.
Действительно, Менделеев как будто был алхимиком. Исходя из атомной массы, он предсказал появление элементов, которые будут обнаружены годами позже, например галлий, скандий или германий. Он также опередил открытие радиоактивных полония и радия, которые принесут Мари Кюри Нобелевскую премию по физике в 1905 году и по химии в 1911 году. Изначальная таблица, опубликованная 6 марта 1869 года, содержала 63 элемента (по ошибке она не включала водород), сейчас же известно 118 элементов. «Менделеев был гением, но нельзя же быть гением каждый день. Иногда он ошибался», — признает Дмитриев.
При всем этом, «фундаментально нового с тех пор ничего не появилось. Заводы продолжают пользоваться его периодической системой химических элементов», — настаивает Калмыков. Он говорит, что один из соперников Менделеева, Юлиус Мейер, который также пытался создать первую периодическую систему, признал, что ему не хватало «научной смелости», которая переполняла Менделеева.
Заводы продолжают пользоваться его периодической системой химических элементов», — настаивает Калмыков. Он говорит, что один из соперников Менделеева, Юлиус Мейер, который также пытался создать первую периодическую систему, признал, что ему не хватало «научной смелости», которая переполняла Менделеева.
Однако это не гарантировало получение ни Нобелевской премии, ни премии Ломоносова, высшей научной награды в России. Менделеев даже не состоял в Академии наук, хотя впоследствии он был принят в Кембридж и Оксфорд.
«Ему не дали Нобелевскую премию, потому что его поддерживали немногие. Это говорит о разделении, характерном для русского научного сообщества. Менделеев трижды выдвигался на Нобелевскую премию, но ему все время не везло. У него был сложный характер», — подчеркнул Дмитриев, намекая на его конфликты с коллегами, как русскими, так и иностранными, которые отклоняли его кандидатуру.
Таблицу тоже признали не сразу, а окончательно приняли ее только двадцать лет спустя, хотя на данный момент Менделеев вместе с Иваном Павловым — единственные русские ученые, которые являлись членами Американской академии наук.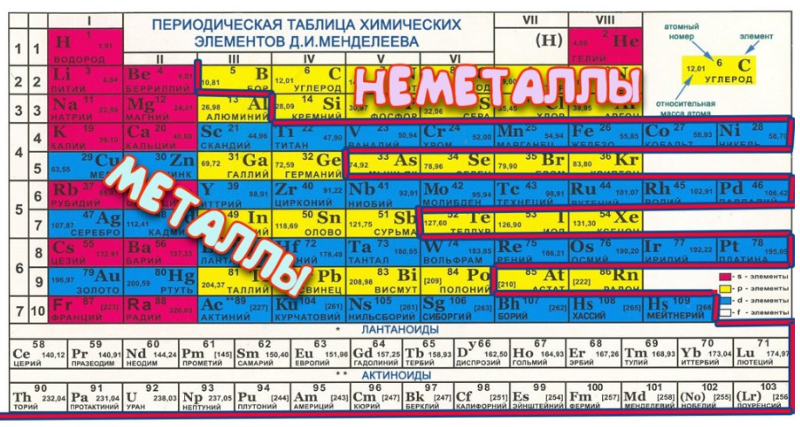 И все же после его смерти в 1907 году радиоактивный элемент № 101 был назван Менделевием в его честь.
И все же после его смерти в 1907 году радиоактивный элемент № 101 был назван Менделевием в его честь.
Менделеев также интересовался использованием природных ресурсов — водой, нефтью и углем — и рациональной эксплуатацией земли, без чего сегодня было бы немыслимо устойчивое развитие. По словам Калмыкова, он также заявил о том, что природные запасы минералов не бесконечны, исследовал происхождение нефти и изучал сжижение газов.
Легенда гласит, что Менделеев был единственным, кто в конце XIX века попытался установить стандартный градус водки, что с незапамятных времен волновало русских. «Не больше и не меньше. 40 градусов — это идеал», — сказал он. Тем не менее, Дмитриев утверждает, что на тот момент правительство уже давно установило стандартные 40 градусов — когда ученому было всего 9 лет. Знаменитый же химик создал методику для производства алкоголя без единой капли воды, что сильно ускорило производство водки в Российской империи.
La Vanguardia (Испания): Менделеев создал Периодическую таблицу химических элементов, но не получал Нобелевской премии и не изобретал водки
13 марта 2019
ИноСМИиещё 13
«Все, что мы видим, состоит из элементов, находящихся в таблице. Например, смартфон, который я держу сейчас в руках. В нем 30 химических элементов из таблицы. Некоторые из них даже еще не существовали, когда Менделеев составил таблицу», — сообщает агентству «ЭФЕ» Степан Калмыков, декан Химического факультета Московского государственного университета.
Например, смартфон, который я держу сейчас в руках. В нем 30 химических элементов из таблицы. Некоторые из них даже еще не существовали, когда Менделеев составил таблицу», — сообщает агентству «ЭФЕ» Степан Калмыков, декан Химического факультета Московского государственного университета.
Фото: ИноСМИИноСМИ
Менделеев (1834 — 1907) и его таблица являются теперь важнейшим наследием человечества. ООН объявила 2019 год Международным годом Периодической таблицы химических элементов. Но великий ученый получил заслуженное национальное и международное признание только уже в преклонном возрасте, в значительной степени из-за своего трудного характера.
Видео дня
Удивительным образом, в науке середины XIX века визуальная систематизация законов природы считалась чем-то маргинальным. «Это подтверждает то, что Менделеев был гением и очень смелым человеком. Ведь чтобы создать таблицу, недостаточно быть просто ученым — нужно быть философом», — говорит Игорь Дмитриев, директор петербургского Музея-архива Менделеева.
Калмыков также считает, что Менделеев не ограничился простым изучением уже известного мира и окружавшей его природы. Он предсказывал будущее. Не зря он оставлял свободное место в своей таблице для новых химических элементов.
«Это большее, что русская наука смогла дать миру. Он был пророком. Другие составляли таблицы из уже существовавших элементов, а Менделеев опережал свое время. Он был человеком XX века», — говорит Калмыков.
Действительно, Менделеев как будто был алхимиком. Исходя из атомной массы, он предсказал появление элементов, которые будут обнаружены годами позже, например галлий, скандий или германий. Он также опередил открытие радиоактивных полония и радия, которые принесут Мари Кюри Нобелевскую премию по физике в 1905 году и по химии в 1911 году. Изначальная таблица, опубликованная 6 марта 1869 года, содержала 63 элемента (по ошибке она не включала водород), сейчас же известно 118 элементов. «Менделеев был гением, но нельзя же быть гением каждый день. Иногда он ошибался», — признает Дмитриев.
При всем этом, «фундаментально нового с тех пор ничего не появилось. Заводы продолжают пользоваться его периодической системой химических элементов», — настаивает Калмыков. Он говорит, что один из соперников Менделеева, Юлиус Мейер, который также пытался создать первую периодическую систему, признал, что ему не хватало «научной смелости», которая переполняла Менделеева.
Однако это не гарантировало получение ни Нобелевской премии, ни премии Ломоносова, высшей научной награды в России. Менделеев даже не состоял в Академии наук, хотя впоследствии он был принят в Кембридж и Оксфорд.
«Ему не дали Нобелевскую премию, потому что его поддерживали немногие. Это говорит о разделении, характерном для русского научного сообщества. Менделеев трижды выдвигался на Нобелевскую премию, но ему все время не везло. У него был сложный характер», — подчеркнул Дмитриев, намекая на его конфликты с коллегами, как русскими, так и иностранными, которые отклоняли его кандидатуру.
Таблицу тоже признали не сразу, а окончательно приняли ее только двадцать лет спустя, хотя на данный момент Менделеев вместе с Иваном Павловым — единственные русские ученые, которые являлись членами Американской академии наук. И все же после его смерти в 1907 году радиоактивный элемент № 101 был назван Менделевием в его честь.
И все же после его смерти в 1907 году радиоактивный элемент № 101 был назван Менделевием в его честь.
Менделеев также интересовался использованием природных ресурсов — водой, нефтью и углем — и рациональной эксплуатацией земли, без чего сегодня было бы немыслимо устойчивое развитие. По словам Калмыкова, он также заявил о том, что природные запасы минералов не бесконечны, исследовал происхождение нефти и изучал сжижение газов.
Легенда гласит, что Менделеев был единственным, кто в конце XIX века попытался установить стандартный градус водки, что с незапамятных времен волновало русских. «Не больше и не меньше. 40 градусов — это идеал», — сказал он. Тем не менее, Дмитриев утверждает, что на тот момент правительство уже давно установило стандартные 40 градусов — когда ученому было всего 9 лет. Знаменитый же химик создал методику для производства алкоголя без единой капли воды, что сильно ускорило производство водки в Российской империи.
Другое,Иван Павлов,Игорь Дмитриев,РАН,МГУ,ООН,
La Информация об элементе лантана: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура лантана
Твердотельная структура лантана Простая гексагональная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ребер ячейки Константы решетки (a, b и c)
| A | B | C |
|---|---|---|
| 377,2 PM | 377,2 PM | 1214,4 PM |
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | 2 π/3 |
The positions of the atoms inside the unit cell are described by the набор атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными).
Lanthanum Atomic and Orbital Protperties
LANTHANUM ATOMS ИБЛИЦИЯ И ЭЛЕКТРОНА И ЭЛЕКТРОНА. 9, 2] с символом атомного термина (квантовые числа) 2 D 3/2 .
| Атомный номер | 57 |
| Количество электронов (бесплатно) | 57 |
| Number of Protons | 57 |
| Mass Number | 139 |
| Number of Neutrons | 82 |
| Shell structure (Electrons per energy level) | 2, 8, 18, 18, 9, 2 |
| Электронная конфигурация | [xe] 5d1 6s2 |
| Валентные электроны | 5D1 6S2 |
| Валентность (Валентность) | |
| (валентность) | |
| (валентность) | |
| (валентность) | |
| (валентность) | |
| (валентность) | |
| (валентность) | |
| (валентность)0028 | |
| Main Oxidation States | 3 |
| Oxidation States | 0, 1, 2, 3 |
| Atomic Term Symbol (Quantum Numbers) | 2 D 3/2 |
Атомная модель лантана по Бору – количество электронов на энергетический уровень
Электронная конфигурация лантана в основном состоянии – нейтральный атом лантана
Сокращенная электронная конфигурация лантана
Сокращенная электронная конфигурация основного состояния нейтрального атома лантана [Xe] 5d1 6s2. Часть конфигурации лантана, эквивалентная благородному газу предшествующего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 5d1 6s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации лантана, эквивалентная благородному газу предшествующего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 5d1 6s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального лантана
Полная электронная конфигурация основного состояния атома лантана. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 5d1 6s2 Принцип и правило Хунда.

Атомная структура лантана
Атомный радиус лантана составляет 195 пм, а его ковалентный радиус равен 169 пм.
| Расчетный атомный радиус | 195 пм (1,95 Å) |
| Atomic Radius Empirical | 195 pm (1.95 Å) |
| Atomic Volume | 22.386 cm3/mol |
| Covalent Radius | 169 pm (1.69 Å) |
| Van der Waals Radius | – |
| Нейтронный поперечный сечение | 8,98 |
| Абсорбция нейтрона | 0,0023 |
.0011
Лантан Химические свойства: Энергия ионизации лантана и сродство к электрону
Сродство лантана к электрону составляет 48 кДж/моль.
| Valence | 3 |
| Electronegativity | 1.1 |
| ElectronAffinity | 48 kJ/mol |
Ionization Energy of Lanthanum
Refer to table below for Ionization energies of Lanthanum
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 538.1 |
| 2nd | 1067 |
| 3rd | 1850.3 |
| 4th | 4819 |
| 5-й | 5940 |
Физические свойства лантана
Физические свойства лантана см. в таблице ниже
| Density | 6.146 g/cm3(when liquid at m.p density is $5.94 g/cm3) |
| Molar Volume | 22.386 cm3/mol |
Elastic Properties
| Young Modulus | 37 |
| Shear Modulus | 14 GPa |
| Bulk Modulus | 28 GPa |
| Poisson Ratio | 0. 28 28 |
Hardness of Lanthanum – Tests to Measure of Hardness of Element
| Mohs Hardness | 2.5 MPa |
| Vickers Hardness | 491 MPa |
| Brinell Hardness | 363 MPa |
Lanthanum Electrical Properties
Lanthanum is Conductor of electricity. Электрические свойства лантана
| Электропроводность | 1600000 См/м |
| Удельное сопротивление | 6.1e-7 m Ω |
| Superconducting Point | 4.88 |
Lanthanum Heat and Conduction Properties
| Thermal Conductivity | 13 W/(m K) |
| Thermal Expansion | 0,0000121 /K |
Лантан Магнитные свойства
| Магнитный тип | Парамагнитный |
| – | |
| Mass Magnetic Susceptibility | 1. 1e-8 m3/kg 1e-8 m3/kg |
| Molar Magnetic Susceptibility | 1.528e-9 m3/mol |
| Volume Magnetic Susceptibility | 0.00006761 |
Optical Свойства лантана
| Показатель преломления | – |
Акустические свойства лантана
| Скорость звука | . |
| Точка кипячения | 3737 K (3463,85 ° C, 6266,929999999999 ° F) |
| Критическая температура | – |
| SUPERCOND | –|
| SUPE0028 |
Enthalpies of Lanthanum
| Heat of Fusion | 6.2 kJ/mol |
| Heat of Vaporization | 400 kJ/mol |
| Heat of Combustion | – |
Изотопы лантана – Ядерные свойства лантана
Лантан состоит из 39 изотопов, содержащих от 117 до 155 нуклонов. Лантан имеет 1 стабильный природный изотоп.
Лантан имеет 1 стабильный природный изотоп.
Изотопы лантана- – Встречающиеся в природе стабильные изотопы: 139La.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 117La | 57 | 60 | 117 | Synthetic | ||||||||||||||
| 118La | 57 | 61 | 118 | Синтетика | ||||||||||||||
| 119La | 57 | 62 | 119 | Synthetic | ||||||||||||||
| 120La | 57 | 63 | 120 | Synthetic | ||||||||||||||
| 121La | 57 | 64 | 121 | Synthetic | ||||||||||||||
| 122La | 57 | 65 | 122 | Synthetic | ||||||||||||||
| 123La | 57 | 66 | 123 | Synthetic | ||||||||||||||
| 124La | 57 | 67 | 124 | Synthetic | ||||||||||||||
| 125La | 57 | 68 | 125 | Synthetic | ||||||||||||||
| 126LA | 57 | 69 | 126 | Синтетик | ||||||||||||||
| 127LA | 57 | 777777778 | 778 | 7778 | 778 | 7778 | 778 | 778 | 778 | 778 | 778 | 778 | 778 | 778 | 770028 | Synthetic | ||
| 128La | 57 | 71 | 128 | Synthetic | ||||||||||||||
| 129La | 57 | 72 | 129 | Synthetic | ||||||||||||||
| 130La | 57 | 73 | 130 | Синтетик | ||||||||||||||
| 131LA | 57 | 131 | 131 | 0614 | ||||||||||||||
| 132La | 57 | 75 | 132 | Synthetic | ||||||||||||||
| 133La | 57 | 76 | 133 | Synthetic | ||||||||||||||
| 134La | 57 | 77 | 134 | Synthetic | ||||||||||||||
| 135La | 57 | 78 | 135 | Synthetic | ||||||||||||||
| 136La | 57 | 79 | 136 | Synthetic | ||||||||||||||
| 137La | 57 | 80 | 137 | Synthetic | ||||||||||||||
| 138La | 57 | 81 | 138 | 0. 09% 09% | Stable | N/A | ||||||||||||
| 139La | 57 | 82 | 139 | 99.91% | Stable | |||||||||||||
| 140La | 57 | 83 | 140 | Synthetic | ||||||||||||||
| 141La | 57 | 84 | 141 | Synthetic | ||||||||||||||
| 142La | 57 | 85 | 142 | Synthetic | ||||||||||||||
| 143La | 57 | 86 | 143 | Synthetic | ||||||||||||||
| 144La | 57 | 87 | 144 | Synthetic | ||||||||||||||
| 145La | 57 | 88 | 145 | Synthetic | ||||||||||||||
| 146La | 57 | 89 | 146 | Synthetic | ||||||||||||||
| 147La | 57 | 90 | 147 | Synthetic | ||||||||||||||
| 148La | 57 | 91 | 148 | Synthetic | ||||||||||||||
| 149La | 57 | 92 | 149 | Synthetic | ||||||||||||||
| 150La | 57 | 93 | 150 | Synthetic | ||||||||||||||
| 151La | 57 | 94 | 151 | Синтетический | ||||||||||||||
| 152LA | 57 | 95 | 152 | 900 2 | 152 | 152 | 152 | 0614 | ||||||||||
| 153La | 57 | 96 | 153 | Synthetic | ||||||||||||||
| 154La | 57 | 97 | 154 | Synthetic | ||||||||||||||
| 155La | 57 | 98 | 155 | Синтетический |
Элемент, символ, химические свойства, применение
Лантан Элемент
Лантан — f-блочный элемент или редкоземельный металл периодической таблицы с атомным номером 57 и символом La . Электронная конфигурация валентной оболочки La: [Xe] 5d 1 6s 2 4f 0 . Название редкоземельных элементов было дано потому, что они были первоначально извлечены из оксида редкоземельных элементов.
Электронная конфигурация валентной оболочки La: [Xe] 5d 1 6s 2 4f 0 . Название редкоземельных элементов было дано потому, что они были первоначально извлечены из оксида редкоземельных элементов.
Впервые он был обнаружен шведским химиком Карлом Густавом Мосандером в 1839 году, а название лантан было дано от древнегреческого lanthanein, что означает лежать скрытым. Это первый f-блочный элемент и прототип семейства лантаноидов.
Свойства лантана
Это мягкий серебристо-белый редкоземельный металл, который быстро тускнеет на воздухе и легко горит при нагревании. Лантан входит в группу скандия или группу 3 (IIIA) из-за наличия (n – 1) d 1 нс 2 электронной конфигурации.
Из-за отсутствия общих черт элементов d-блока он показывает одну стабильную степень окисления или состояние, такое как +3, и очень напоминает лантаноиды.
| Лантан | |||
| Символ | Ла | ||
| Дискавери | Открыт Карлом Густавом Мосандером в 1839 году | ||
| Название производное от | Греческое слово лантанеин, означающее скрытый | ||
| Обычный изотоп | 57 Ла 139 | ||
| Номер CAS | 7439-91-0 | ||
| Периодические свойства | |||
| Атомный номер | 57 | ||
| Атомный вес | 138,905 | ||
| Электрон на оболочку | 2, 8, 18, 18, 9, 2 | ||
| Электронная конфигурация | [Хе] 5d 1 6s 2 | ||
| Блок | F-блок | ||
| Период | период 6 | ||
| Физические свойства | |||
| Состояние при 20 °C | Твердый | ||
| Температура плавления | 920 °C или 1688 °F | ||
| Точка кипения | 3464 °C или 6267 °F | ||
| Плотность | 6,162 г/см 3 | ||
| Молярная теплоемкость | 27,11 Дж моль −1 K −1 | ||
| Удельное электрическое сопротивление | 615 нОм·м | ||
| Химические свойства | |||
| Атомный радиус (несвязанный) | 2,43 Å | ||
| Ковалентный радиус | 1,94 Å | ||
| Номер окисления | +3 | ||
| Электроотрицательность | 1,10 (шкала Полинга) | ||
| Электронное сродство | 45,35 кДж моль −1 | ||
| Энергия ионизации (кДж/моль) | 1-й | 2-й | 3-й |
538. 1 1 | 1067 | 1850.3 | |
Лантан в периодической таблице
Лантан — редкоземельный элемент, помещенный в элемент f-блока в периодической таблице.
Где встречается лантан?
Лантан является третьим по распространенности из всех лантаноидов. Известно около 200 минералов, содержащих редкоземельные металлы.
Двумя наиболее коммерчески важными минералами являются монацит и бастнезит. Монацит представляет собой смешанный фосфат лантана, церия, тория и других редкоземельных элементов. Бастнезит представляет собой фтористый карбонат лантана и других редкоземельных металлов, но более тяжелые элементы в нем практически отсутствуют.
Встречающийся в природе лантан содержит два изотопа, такие как 139 La и 138 La. 139 La наиболее распространен, но 138 La встречается редко.
Монацит химически достаточно инертен и имеет высокую плотность. В основном он концентрируется в пляжных песках и руслах рек в результате выветривания.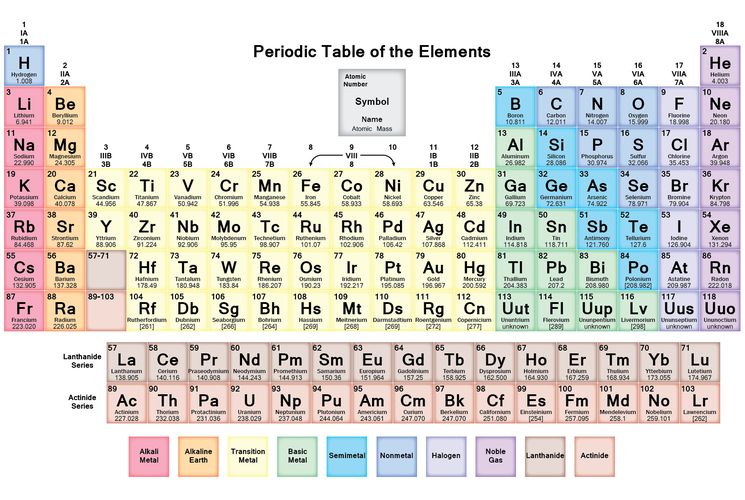
Встречается на юге Индии, в Южной Африке, Бразилии, Австралии и Малайзии. Обычно мы использовали монацит для извлечения лантана и других редкоземельных металлов.
Производственный процесс
Основными этапами производства лантана и других редкоземельных элементов являются следующие:
- Вываривание концентрированной руды концентрированным водным раствором гидроксида натрия (NaOH) при 140 °C с последующей экстракцией водой.
- Суспензию нечистых водных оксидов кипятят с соляной кислотой при рН около 3,5. ThO 2 осаждают и отфильтровывают.
- Фильтрат, содержащий LaCl 3 и LnCl 3 (Ln = лантаниды) обрабатывают раствором BaCl 2 .
- Стехиометрическое количество Ln 2 (SO 4 ) 3 используется для осаждения всего бария в виде BaSO 4 . BaSO 4 содержит следы RaSO 4 , которые удаляются фильтрованием.
- Фильтрат содержит LaCl 3 и LnCl 3 , из которых La может быть выделен фракционной кристаллизацией.

Однако наиболее современными методами экстракции лантаноидов являются экстракция растворителем и ионообменная хроматография.
Химические свойства
Лантан — серебристо-белый, мягкий и податливый материал с высокой электропроводностью. Он очень электроположителен и реактивен. Реакционная способность высших представителей лантаноидов сравнима с кальцием, а скандия с алюминием.
Компактный металл довольно устойчив к сухому воздуху при обычных температурах. На воздухе сгорает с образованием оксида (La 2 O 3 ) и нитрида (LaN).
При нагревании лантан реагирует с рядом неметаллов, таких как азот, сера, кремний, фосфор, водород и т. д. Он образует солеподобный гидрид (LaH 3 и LaH 2 ), который содержит ион H – в соединении.
Использование лантана
- Редкоземельный металл лантан не используется в коммерческих целях. Он используется в качестве добавки к стали для повышения прочности и обрабатываемости.


