основные признаки, симптомы и лечение.
Лимфоэкстравазат у собак возникает, как правило, из-за травматического воздействия тяжелыми предметами, ушибов и падений. Кожные покровы при этом не повреждается, но под кожей образуется полость, в которой находится лимфа из поврежденных лимфатических сосудов. У собак часто возникает лимфоэкстравазат уха, который вызывается излишним раздражением и потряхиванием ушей у собаки. Кожа ушных раковин очень нежная, также тонкими и хрупкими являются кровеносные и лимфатические сосуды, здесь проходящие, поэтому и происходит их повреждение с излиянием лимфы, иногда — и крови под кожу. Это приводит к ее отслоению от ушного хряща и появлению полости, заполненной жидкостью.
Лимфоэкстравазат у собак бывает нескольких видов
Данная патология может быть глубокой и наружной.
Когда лимфа выходит в глубоко расположенные ткани, например, между мышцами, формируется припухлость, похожая на обычный отек, который сопровождается небольшим повышением температуры в месте травмы и малой болезненностью.
При наружной форме лимфоэкстравазата у собак лимфа выделяется под подкожную клетчатку, образуя «карман» под кожей, наполненный прозрачной или светло-желтой жидкостью.
Если повреждаются не только лимфатические, но и кровеносные сосуды, то речь идет о гемолимфоэкстравазате.
Лимфоэкстравазат уха у собаки вызывает образование полости в ушной раковине собаки. Ухо становится отечным и теплым, в сложных случаях — напряженным и горячим, при большей травматизации.
Как определяется лимфоэкстравазат у собак
Диагностируя это заболевание, врач примет во внимание все симптомы, о которых мы говорили выше, внимательно осмотрев животное. Важно собрать анамнез: не
Также необходимо исключить болезни, дающие похожие признаки:
- патологии сердечно-сосудистой системы
- болезни почек и мочевыводящих путей
- отечность из-за крайне тяжелого истощения животного
- паразиты, воздействие токсинов могут вызвать выход плазмы крови через поврежденные стенки сосудов крови
- обширные, системные аллергические реакции тоже вызывают повышенную проницаемость сосудов.

Для подтверждения диагноза берется проба жидкости специальной иглой и определяется ее природа. Если это лимфа, то жидкость будет прозрачной, желтоватой или красноватой, слегка отсвечивающей на свету.
Лечение лимфоэкстравазата у собак
Прогноз при этом заболевании практически всегда благоприятный, за исключением тех случаев, когда оно осложняется инфицированием лимфы патогенными микробами.
Разные виды болезни требуют разного подхода в лечении, иногда бывает необходимо проведение хирургической операции. Это особенно актуально при лимфоэкстравазате уха у собаки, так как его
Консервативное лечение лимфоэкстравазата у собак
Основное требование в уходе за больным псом — это как можно более полный покой, так как циркуляция лимфы при активных нагрузках увеличивается в пять раз, а при этой болезни важно, наоборот уменьшить ее выделение и помочь организму создать тромбы в травмированных лимфатических сосудах.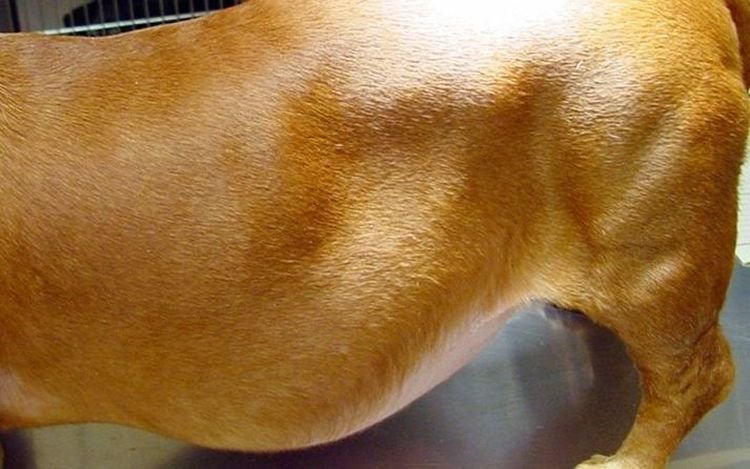 Ни прикладывание холодных предметов, ни согревание полости
Ни прикладывание холодных предметов, ни согревание полости
Если лимфоэкстравазат поверхностный и занимает небольшую площадь, то ветеринарный врач выберет консервативно-оперативную тактику в лечении. В первый день используют давящие, влажные компрессы с различными спиртовыми растворам. Используют также пункции с опорожнением полости от экссудата и внесением в нее 1-2% раствора йода, после накладывают давящую повязку. Такие манипуляции проделывают не один раз. а курсом. Если же данное лечение малоэффективно, то используют хирургические методы
Причины и способ хирургического лечения лимфоэкстравазата у собак
Вмешательство хирурга подразумевает тщательное соблюдение правил антисептики и асептики, так как важно не допустить занесение патогенной микрофлоры вовнутрь полости. Для этого кожу внизу полости разрезают небольшим надрезом, содержимое удаляют, в полость вставляют дренаж, пропитанный растворами антисептиков. Через два дня дренаж убирают, обрабатывая место разреза мазью Вишневского, сульфаниламидами. Такие меры позволят собаке выздороветь
Для этого кожу внизу полости разрезают небольшим надрезом, содержимое удаляют, в полость вставляют дренаж, пропитанный растворами антисептиков. Через два дня дренаж убирают, обрабатывая место разреза мазью Вишневского, сульфаниламидами. Такие меры позволят собаке выздороветь
При хирургическом лечении лимфоэкстравазата уха у собак применяются разные хирургические методики. Суть их заключается также в удалении жидкости и накладывании нескольких швов — стежков по поверхности ушной раковины, чтобы кожа и ушной хрящ срастались, а поврежденные сосуды перестали выделять лимфу или кровь. Швы не снимаются в течение примерно трех недель. За это время появляются рубцы, необходимые для заживления поврежденных тканей и препятствующие рецидивам лимфоэкстравазата.
Профилактические меры предупредить лимфоэкстравазат у собак
Для предупреждения этой патологии у собак нужно позаботиться о
 Также при лимфоэкстравазате ушей важно определить первопричину травмирования ушной раковины самой собакой, когда она чрезмерно трясет ушами и ранит их передними и задними лапами. Наличие кожных паразитов, аллергическая реакция или инфекция могут спровоцировать такое поведение у собаки и вызвать возникновение этой болезни. В таком случае нужно срочно обратиться к ветеринару для выяснения источника проблемы и его устранения, будь-то клещи, аллерген или патогенная микрофлора.
Также при лимфоэкстравазате ушей важно определить первопричину травмирования ушной раковины самой собакой, когда она чрезмерно трясет ушами и ранит их передними и задними лапами. Наличие кожных паразитов, аллергическая реакция или инфекция могут спровоцировать такое поведение у собаки и вызвать возникновение этой болезни. В таком случае нужно срочно обратиться к ветеринару для выяснения источника проблемы и его устранения, будь-то клещи, аллерген или патогенная микрофлора.Важную роль играет правильный уход за ушами собаки, особенно если они длинные, как у спаниелей. Такие уши нужно подвергать регулярному осмотру и очищению, после купания — вытирать насухо и просушивать от излишней влаги. Это позволить уберечь слуховые проходы от размножения в них болезнетворных микробов.
В заключение хочется добавить, что только квалифицированный врач-ветеринар должен ставить диагноз и назначать адекватное лечение, особенно в случае заболевания, требующего хирургического лечения.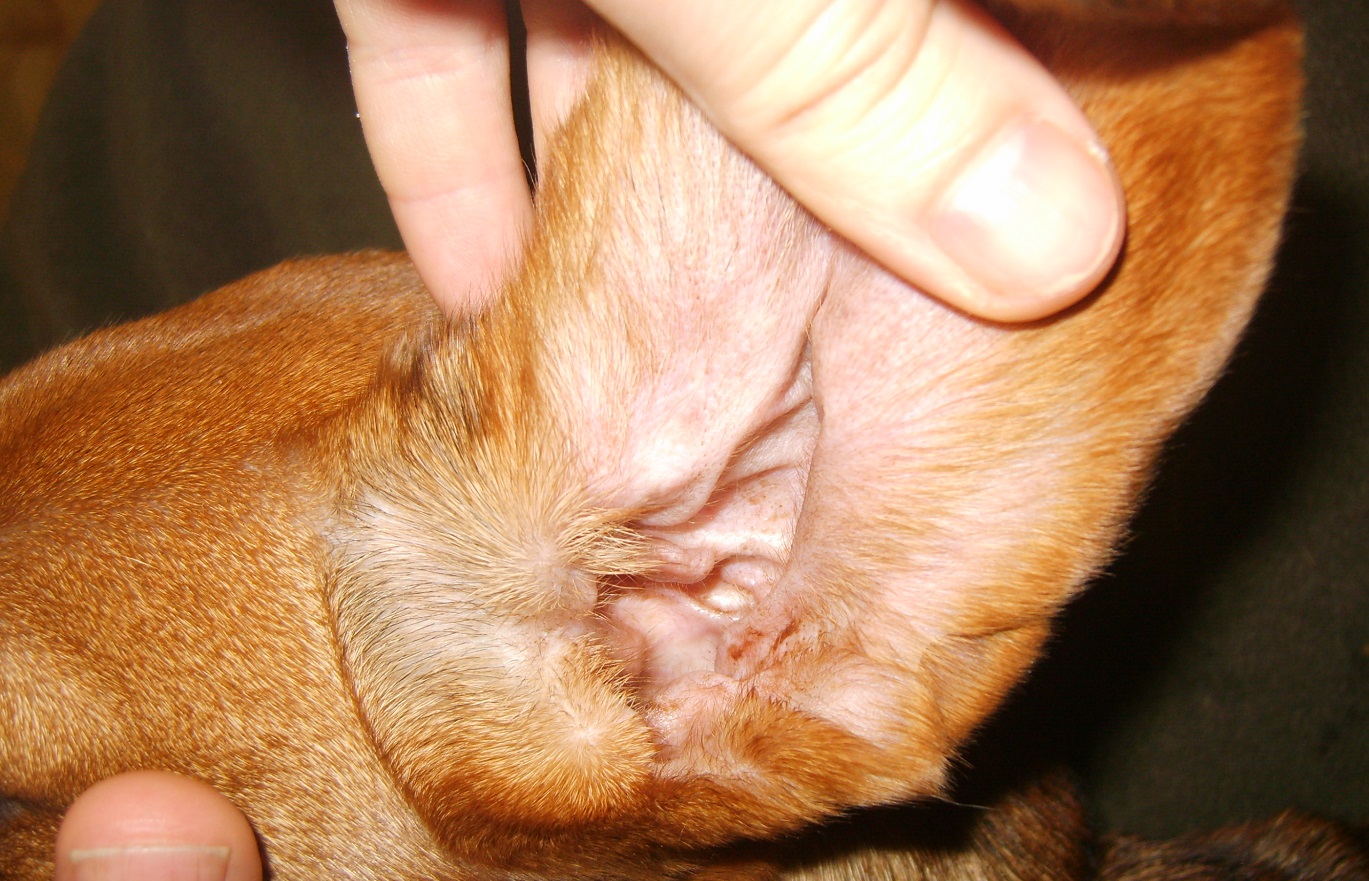 Поэтому в распоряжении хирургов нашего ветеринарного центра находится современный арсенал диагностических и лечебных мероприятий, призванный решить самые сложные проблемы, возникающие со здоровьем домашних любимцев.
Поэтому в распоряжении хирургов нашего ветеринарного центра находится современный арсенал диагностических и лечебных мероприятий, призванный решить самые сложные проблемы, возникающие со здоровьем домашних любимцев.
Легкие оперативные вмешательства могут проводиться на дому пациента, сложные — в условиях стационара, под дальнейшим постоянным наблюдением. Скорая ветеринарная помощь в случае острой необходимости будет оказана вашему питомцу через 40 минут после срочного вызова, который вы можете оформить, позвонив по телефону нашего центра. Первую помощь своей собаке вы сможете оказать после бесплатной консультации нашего врача по телефону. Наш центр работает для вас круглосуточно, 365 дней в году!
Теперь вам известны причины, по которым может возникнуть лимфоэкстравазат у собак. Если с вашим четвероногим дургом случилась такая неприятность, смело обращайтесь за консультацией и помощью в ветеринарный центр Я-Вет.
Лимфоэкстравазат (lymphoextravasat) / Хирургические болезни сельскохозяйственных животных / Московский Ветеринарный WEB-Центр
Лимфоэкстравазат (lymphoextravasat) – это закрытое повреждение тканей, сопровождаемое разрывом лимфатических сосудов и скоплением лимфы во вновь образованной полости.
Этиология. Лимфоэкстравазаты развиваются при повреждениях тупыми предметами, действующими на ткани в косом направлении. Они возникают при скользящих ударах рогами, копытами, падениях, при насильственном перемещении лежащего животного волоком. У лошадей лимфоэкстравазаты нередко возникают в области боковых склонов холки, вследствие смещения тканей седлом либо седелкой, а у крупного рогатого скота – в области переднего склона холки от сдавливания ограничительной трубой перед кормушками.
Классификация. При одновременном повреждении кровеносных сосудов и примеси крови в лимфе развиваются гемолимфоэкстравазаты. Под действием механической силы происходит расслоение тканевых пластов с одновременным разрывом лимфатических и мелких кровеносных сосудов. В зависимости от глубины повреждения тканей лимфоэкстравазаты могут быть поверхностными, подкожными, глубокими, межфасциальными, межмышечными.
У крупного рогатого скота лимфоэкстравазаты чаще развиваются в области паха, бедер, промежности, брюшной и грудной стенок, а у лошадей – в области холки и затылка. У свиней лимфоэкстравазаты не образуются.
У свиней лимфоэкстравазаты не образуются.
Клинические признаки. Вначале в зоне повреждения возникает небольшой отек тканей с наличием ссадины на коже. После рассасывания отека, на 3 – 4-й день после нанесения повреждения, обнаруживается ограниченная флюктуирующая припухлость, при надавливании на которую происходит перемещение жидкости из одного отдела в другой. Кожа в области припухлости не напряжена и в связи с этим создается впечатление, что объем полости значительно больше содержащейся в ней жидкости. С течением времени припухлость может приобретать различную форму и величину, достигая иногда объема до 10–15 л. Наносимые слабые удары по стенке лимфоэкстравазата вызывают волнообразное движение содержимого (ундуляцию).
В случаях развития глубоких лимфоэкстравазатов припухлость обнаруживается значительно позднее, чем поверхностных. При этом она не имеет резкой очерченности и наружная стенка ее напряжена. В отличие от гематом лимфоэкстравазаты развиваются медленно в течение нескольких дней и даже недель после нанесения травмы. При образовании гемолимфоэкстравазата пальпацией обнаруживается фибринозная крепитация, пунктат имеет красный или розовый цвет, тогда как при лимфоэкстравазате он имеет вид желтой опалесцирующей жидкости. В большинстве случаев при лимфоэкстравазатах отсутствует болезненность, повышение местной и общей температуры тела.
При образовании гемолимфоэкстравазата пальпацией обнаруживается фибринозная крепитация, пунктат имеет красный или розовый цвет, тогда как при лимфоэкстравазате он имеет вид желтой опалесцирующей жидкости. В большинстве случаев при лимфоэкстравазатах отсутствует болезненность, повышение местной и общей температуры тела.
Прогноз. При небольших лимфоэкстравазатах обычно благоприятный, при обширных – осторожный (в связи с плохим тромбообразованием в сосудах).
Лечение. С целью уменьшения лимфоизлияния животному обязательно предоставляется полный покой, поскольку активные движения увеличивают лимфоток в 5 раз. Холод и тепло противопоказаны, так как холод может вызвать некроз отслоенной кожи, а тепловые процедуры в значительной степени усиливают лимфоизлияние. Для уменьшения лимфоизлияния в первые 1–2 суток применяют умеренно давящие повязки с камфорным, борным или ихтиоловым спиртом. В последующем проводят опорожняющие пункции с введением после них в полость лимфоэкстравазата 1–2%-ного спиртового раствора йода.
С целью повышения свертываемости и резорбции лимфы в полость лимфоэкстравазата (после ее опорожнения) целесообразно вводить аутокровь. Более эффективным является введение (после опорожняющей пункции) гидрокортизона, который, воздействуя на интиму лимфатических сосудов, вызывает уменьшение лимфоизлияния. В случае неэффективности вышеуказанного лечения прибегают к вскрытию полости лимфоэкстравазата линейным разрезом его стенки. После вскрытия из полости удаляют сгустки фибрина, иссекают пропитанную лимфой клетчатку, стенки полости обрабатывают антибиотиками, отслоенную кожу подшивают к подлежащим тканям вертикальными петлевидными швами с валиками, кожный разрез закрывают наложением узлового шва.
При отсутствии возможности наложения швов полость лимфоэкстравазата дренируют марлей, пропитанной 1–2%-ным спиртовым раствором йода или 10%-ным йодоформным эфиром. Дренаж удаляют через 2 суток и дальнейшее лечение проводят как при обычной ране. Однако согласно исследованиям (Э. И.Веремей, В.М.Лакисов и др.) наиболее эффективным является применение для дренирования полости лимфоэкстравазата марли, пропитанной 2,5%-ным раствором ваготила на 70%-ном этиловом спирте или аятине. После однократного применения указанного раствора лимфоизлияние полностью прекращается.
И.Веремей, В.М.Лакисов и др.) наиболее эффективным является применение для дренирования полости лимфоэкстравазата марли, пропитанной 2,5%-ным раствором ваготила на 70%-ном этиловом спирте или аятине. После однократного применения указанного раствора лимфоизлияние полностью прекращается.
Управление ветеринарии Брянской области – Лимфоэкстравазат у собак
Опубликовано: 26.04.2018
О значении лимфатической системы в обеспечении защиты организма собаки от инфекционных агентов знает далеко не каждый их хозяин. Тем не менее, она действительно важна. Взять, к примеру, те же лимфатические узлы, воспаление которых со 100% вероятностью говорит о наличии инфекции. Бывают и более простые патологии, которые, пусть даже не являясь свидетельством серьезных заболеваний, все же могут представлять опасность для здоровья псов. Пример — лимфоэкстравазат у собак.
В Советскую ветеринарную лечебницу поступала собака по кличке «Арчи», 9 лет. Со слов владельца у животного появилась припухлость в области уха с внутренней стороны, которая начала увеличиваться. На ощупь она мягкая, ощущается легкое «потрескивание». Так же со слов владельца собака содержалась в будке, был доступ к выгулу на улице. Рацион кормления разнообразен, вода без ограничений.
Со слов владельца у животного появилась припухлость в области уха с внутренней стороны, которая начала увеличиваться. На ощупь она мягкая, ощущается легкое «потрескивание». Так же со слов владельца собака содержалась в будке, был доступ к выгулу на улице. Рацион кормления разнообразен, вода без ограничений.
При клиническом осмотре температура тела составляла 37,9; частота пульса 73 удара в минуту; дыхание спокойное; слизистые оболочки бледно-розовые. На левом ухе была заметна припухлость, кожа на ней имеет ссадины. При проведении пункции было выявлено: содержимое чистое, прозрачное, желтоватого цвета. Был поставлен диагноз – лимфоэкстравазат. Отличают данную патологию от гематом. Прощупываемая область сохраняет нормальную местную температуру. Что еще важнее – жидкость в полости как бы «перетекает», есть ощущение наличия «дополнительного» там места. Гематомы имеют тугую, напряженную поверхность.
Животному был назначен радикальный способ лечения – оперативное вскрытие.
Операцию проводили с соблюдением асептики и антисептики. Кожу обработали раствором йода. В верхнем отделе на коже определили предполагаемое место разрыва сосудов. Затем надавливанием снизу сместили содержимое вверх и над ссадинами вскрыли полость вертикальным разрезом длиной 5 см.
Кожу обработали раствором йода. В верхнем отделе на коже определили предполагаемое место разрыва сосудов. Затем надавливанием снизу сместили содержимое вверх и над ссадинами вскрыли полость вертикальным разрезом длиной 5 см.
После того как жидкость переместилась к нижнему краю, сделали второй такой же разрез для стока лимфы, через который удалили сгустки фибрина. Полость промыли антисептической жидкостью. Через верхнюю рану под фасцию в зоне ссадин ввели марлевый дренаж, пропитанный 5%-ным спиртовым раствором йода. После этого обе раны закрыли стерильными салфетками с йодоформом и наложили тугую повязку.
Дренаж удалили через пару дней.
Прогноз в основном при оказании своевременной помощи – благоприятный.
После проведения манипуляций животное чувствует себя хорошо. Владельцу были даны рекомендации, чтобы животное оставалось в покое. Противопоказано активные движения и холод.
Источник: http://vashipitomcy.ru
Если заметили ошибку, выделите фрагмент текста и нажмите Ctrl+Enter
описание болезни, симптомы, диагностика, лечение
Справочная информация о болезни Гематомы и лимфоэкстравазаты (собаки): описание, симптомы, признаки, диагностика, лечение домашних животных
Вид животного:
Собаки
Описание болезни:
Гематома – скопление крови в полости, образующейся при расслоении ткани в результате кровоизлияния. Лимфоэкстравазат – скопление лимфы в полости, образующейся при расслоении ткани в результате разрыва лимфатического сосуда.
Лимфоэкстравазат – скопление лимфы в полости, образующейся при расслоении ткани в результате разрыва лимфатического сосуда.
Причины развития болезни
Чаще всего гематомы и лимфоэкстравазаты возникают вследствие травм. Изливающаяся кровь постепенно сворачивается, образуя сгустки, которые затем прорастают соединительной тканью. Лимфа и кровь оказывают давление на окружающие ткани. При попадании микроорганизмов в полость гематомы или лимфоэкстравазата возможно развитие абсцесса или флегмоны.
Симптомы болезни
Легче обнаруживаются поверхностные (подкожные) гематомы и лимфоэкстравазаты. Наиболее часто поражаемые области тела – ушные раковины, холка, брюшная стенка.
Внезапно образуется флуктуирующая, практически безболезненная припухлость, которая в течение нескольких дней или недель уплотняется. При эвакуации содержимого с помощью шприца гематома и лимфоэкстравазат имеют склонность к повторному возникновению.
При эвакуации содержимого с помощью шприца гематома и лимфоэкстравазат имеют склонность к повторному возникновению.
Диагностика болезни
Окончательный диагноз устанавливают путем прокола полости гематомы или лимфоэкстравазата. В первом случае шприцом отсасывают кровь, во втором – лимфу. Возможна эвакуация смеси крови и лимфы (гемолимфоэкстравазат).
Лечение болезни
В первые сутки — холод (не злоупотребляйте, контакт с паузами), давящие повязки. С 3—4 дня — сухое тепло (соллюкс, лампы инфракрасных лучей), теплые укутывания. Затем парафин, диатермию, в поздних стадиях — массаж, грязелечение. Крупные гематомы и нагноившиеся нуждаются в оперативном вмешательстве.
Болезни по видам животных
Забавное видео
Этот 5-ти летний малыш удивит вас своими баскетбольными навыками!
Нужны деньги до зарплаты?
более 30 сервисов
Кредиты онлайн на карту за 15 минут
до 180 дней
макс срок
до 20 000 грн.
макс сумма
Первая помощь при гематомах и лимфоэктравазатах | Здоровье | Povodok.by
Механические повреждения закрытого типа могут вызывать возникновение гематом или лимфоэкстравазатов, требующих лечения в ветклинике квалифицированным специалистом.
Гематома — тип кровоподтеков, при которых разрываются сосуды. Под кожей образовывается полость, содержащая свернувшуюся или жидкую кровь. Часто образуются у собак после травм ушных раковин.
Лимфоэкстравазат — подкожное скопление лимфы, образовавшееся в результате разрыва лимфатических сосудов.
Чаще всего у собак возникают в районе грудной клетки. Под кожей собаки образуется припухлость, которая увеличивается с каждым днем. На ощупь чувствуется, как при нажатии под пальцами перемещается жидкость. Первая помощь — наложение давящей повязки, но, как правило, лимфоэкстравазат обнаруживают через несколько дней после образования, когда первую помощь оказать уже нельзя: нужно вызывать ветеринара, чтобы он сделал прокол.
Гематома развивается вследствие разрыва кровеносного сосуда и скопления вытекающей крови в тканях с образованием полости. Гематомы могут возникать при различных видах кровотечений, сопровождающих ушибы, переломы, операции. По месту расположения различают межмышечные, подкожные, подфасциальные, внутричерепные, внутриорганные, забрюшинные и параректальные гематомы; по степени распространения процесса различают гематомы диффузные и ограниченные.
Лечение гематом основано на тех же принципах, что и лечение ушибов. Рассасыванию кровоизлияний способствуют озокеритовые или парафиновые аппликации, соллюкс, резорбирующие мази. При гематомах большого размера необходимо удалить из полости скопившуюся кровь, оросить ее раствором новокаина с антибиотиками и наложить давящую повязку.
При гематомах большого размера необходимо удалить из полости скопившуюся кровь, оросить ее раствором новокаина с антибиотиками и наложить давящую повязку.
Вскрытие гематом необходимо производить с соблюдением правил антисептики и асептики. После вскрытия полости кровь и сгустки удаляют, промывают полость фурацилиновым раствором и припудривают ее стенки сложные антисептическим порошком. При пульсирующих и диффузных гематомах необходимо перевязать сосуд или наложить на него гемостатический пинцет на срок до 48 часов.
Лимфоэкстравазат, гемолимфоэкстравазат
При разрыве лимфатического сосуда в тканях может образоваться лимфоэкстравазат, если одновременно произошел разрыв кровеносного сосуда, образуется гемолимфоэкстравазат. Лимфоэкстравазаты образуются медленнее, чем гематомы, в них не развиваются воспалительные процессы, поскольку лимфа не раздражает окружающие ткани.
Лечение заключается в обеспечении пострадавшей собаке покоя. Холодовые и тепловые процедуры не проводят, применяют лишь спиртовые повязки. Скопившуюся во вновь образованной полости лимфу удаляют, в полость вводят раствор йода или формальдегида, накладывают давящую повязку.
Скопившуюся во вновь образованной полости лимфу удаляют, в полость вводят раствор йода или формальдегида, накладывают давящую повязку.
Лимфоэкстравазат
Лимфоэкстравазат – вновь образованная между тканевыми пластами полость, заполненная лимфой, излившейся из поврежденных сосудов.
Лимфоэкстравазаты – следствие скользящих ударов рогами, копытами, падений, насильственных перемещений животных волоком, сдавливаний переднего склона холки у крупного рогатого скота об ограничительную трубу перед кормушками, смещений тканей сбруей и других механических воздействий. При этом происходит расслоение тканевых пластов, разрыв лимфатических и мелких кровеносных сосудов. Лимфоэкстравазаты могут быть поверхностными (подкожными) и глубокими (между фасциями и мускулами) в различных областях тела. У крупных животных они чаще наблюдаются на боковых поверхностях грудной и брюшной стенок, холки и верхних отделах конечностей.
Патогенез. Под действием механической силы кожа, фасции и мускулы смещаются за их возможные пределы. Это ведет к расслоению между ними рыхлой клетчатки и разрыву находящихся здесь лимфатических сосудов. В образовавшуюся щель изливается лимфа. Накопление ее идет медленно вследствие узости просвета сосудов и незначительного в них давления. В силу малой способ-ности лимфы к свертыванию тромбоз нарушенных сосудов не происходит, лимфоизлияние продолжается длительное время. Накапливаясь, лимфа механически своей тяжестью расслаивает рыхлую клетчатку под кожей, фасцией или между мускулами по направлению вниз и в стороны. В нижнем отделе полости могут скопляться рыхлые сгустки фибрина. Обратно лимфа всасывается крайне незначительно. По периферии лимфоэкстравазата реактивное воспаление обычно не развивается, так как лимфа не вызывает необходимого раздражения.
Аналогичным путем образуется и гемолимфоэкстравазат, при котором нарушенные артерии и вены сравнительно быстро тромбируются, а излияние лимфы продолжается. Сгустки фибрина крови оседают в нижнем отделе полости. В прилегающих к ним стенках развивается реактивное воспаление, что ведет к прочной демаркации полости в этом участке.
Сгустки фибрина крови оседают в нижнем отделе полости. В прилегающих к ним стенках развивается реактивное воспаление, что ведет к прочной демаркации полости в этом участке.
Клинические признаки. При подкожных лимфоэкстравазатах на 3-4-й день или позже с момента нанесения травмы отмечается появление ограниченной плоской флюктуирующей припухлости, кожа над ней имеет ссадины. Позднее, в зависимости от давности процесса, припухлость может быть различной величины и формы. Нижний ее отдел становится мешкообразно выпуклым. Содержимое полости иногда достигает более 8 л. При надавливании в нижней части припухлости жидкость свободно перемещается до верхней границы полости, как вода в слабо наполненной грелке. Легкие удары по стенке сопровождаются волнообразными движениями содержимого (ундуляция). Пунктат представляет собой лимфу. В случаях большой давности в нижней части припухлости отмечается уплотнение тканей.
При глубоких лимфоэкстравазатах припухлость выявляется гораздо позже, чем при поверхностных. Она не имеет резких границ, наружная стенка напряжена, возможно ее зыбление. В гемо- лимфоэкстравазатах уже на 4-6-е сутки пальпацией выявляется фиброзная крепитация, пунктат красного или розового цвета. Почти при всех лимфоэкстравазатах не отмечается болевой реакции, повышения местной и общей температуры тела.
Она не имеет резких границ, наружная стенка напряжена, возможно ее зыбление. В гемо- лимфоэкстравазатах уже на 4-6-е сутки пальпацией выявляется фиброзная крепитация, пунктат красного или розового цвета. Почти при всех лимфоэкстравазатах не отмечается болевой реакции, повышения местной и общей температуры тела.
Прогноз. В большинстве случаев благоприятный.
Лечение. Больным животным предоставляют полный покой, так как активные движения усиливают лимфоток в 5 раз. Противопоказаны: холод, который, не уменьшая лимфоизлияния, может способствовать некрозу кожи; тепловые процедуры, усиливающие излияние лимфы. Обычно применяют спиртовысыхающие повязки или делают проколы для удаления содержимого полости и введения в нее 1-2%-ного спиртового раствора йода или 0,25%-ного спиртового раствора формалина, затем накладывают давящую повязку. Однако эти приемы редко дают положительный результат, особенно при обширных лимфоэкстравазатах.
Радикальным способом лечения при любых лимфоэкстравазатах является оперативное вскрытие их с применением дубящих и прижигающих средств в очаге повреждения сосудов. Под действием этих средств ткани уплотняются, ускоряется развитие воспаления, которое сопровождается образованием грануляции, что ведет к сдавливанию просвета разорванных лимфатических сосудов и их тромбозу.
Под действием этих средств ткани уплотняются, ускоряется развитие воспаления, которое сопровождается образованием грануляции, что ведет к сдавливанию просвета разорванных лимфатических сосудов и их тромбозу.
Операцию проводят в следующем порядке. Со всей поверхности флюктуирующей припухлости удаляют волосы, кожу смазывают раствором йода. В верхнем ее отделе на коже определяют расположение ссадин – предполагаемое место разрыва сосудов. Затем надавливанием снизу смещают содержимое вверх и над ссадинами вскрывают полость вертикальным разрезом в 5-10 см. Дав жидкости переместиться к нижнему краю, здесь делают для стока лимфы второй такой же разрез, через который удаляют и сгустки фибрина. Полость промывают антисептической жидкостью. Через верхнюю рану под кожу или фасцию в зоне ссадин вводят марлю, пропитанную 5-10%-ным спиртовым раствором йода, насыщенным раствором калия перманганата или спиртоформалином по Б. М- Оливкову (Spiritus vini rectificati 100,0; Formalini 1,0; Tincturae iodi gutt. VIII). Слои марли распределяют по плоскости верхнего отдела полости, одним стежком закрепляют ее к краю раны. Закрыв незашитую рану салфетками с йодоформом, накладывают тугой бандаж или повязку. Марлю удаляют через двое-трое суток. Если лимфотечение не прекратилось, эту процедуру повторяют. Дальнейшее лечение, как обычной раны.
При небольших лимфоэкстравазатах делают один разрез, полость осушают салфеткой, а стенки припудривают порошком калия перманганата с борной кислотой (1:10-20). Рану частично зашивают и накладывают антисептическую давящую повязку.
Применением оперативного лечения достигается клиническое выздоровление больных в свежих случаях через 10-15, в запущенных – через 18-22 сут. Лимфоиздияние, как правило, прекращается в первые 5 дней после операции.
- Подробности
- Раздел: Хирургические болезни животных
- Просмотров: 15629
Способы лечения лимфоэкстравазатов | Ветеринарный справочник
Лимфоэкстравазаты могут локализоваться в различных областях тела. У крупного рогатого скота они наиболее часто возникают в области бедер, промежности (рис. 93), брюшной и грудной стенок, а у лошадей – в области холки, затылка и подгрудка.
В первые часы на месте травмы возникает незначительный малоболезненный воспалительный отек тканей с небольшим повышением местной температуры. После рассасывания отека отчетливо выступает резко отграниченная припухлость, при надавливании на которую ощущается волнообразное перемещение жидкости из одного отдела в другой,- ундуляция.
Для лимфоэкстравазата характерно медленное и продолжительное развитие припухлости. Она достигает максимальных размеров спустя несколько дней и даже недель после нанесения травмы. Несмотря на значительное накопление лимфы в образованной ею полости, напряжение кожи в области поражения отсутствует. Создается такое впечатление, что объем образовавшейся полости гораздо больше объема находящейся в ней лимфы. Характерно для лимфоэкстравазатов и то, что воспалительная реакция и болезненность при них выражены слабо, местное повышение температуры и общая реакция организма отсутствуют.
При пункции припухлости получают прозрачную или слегка опалесцирующую лимонно-желтую жидкость – лимфу, иногда с примесью фибрина. Наличие в пунктате крови свидетельствует о гемолимфоэкстравазате.
Прогноз. При лимфоэкстравазатах прогноз в большинстве случаев благоприятный, так как животные обычно выздоравливают даже при наличии у них обширных лимфоэкстравазатов. В случаях осложнения лимфоэкстравазатов развитием в них микробов прогноз зависит от вида микроорганизмов, вызвавших осложнение.
Лечение. Больному животному предоставляют покой, что особенно важно для уменьшения выделения лимфы и ускорения организации тромба в поврежденных лимфатических сосудах. Следует иметь в виду, что консервативные методы лечения при лимфоэкстравазатах малоэффективны, а некоторые из них, например применение холода и тепла, даже противопоказаны. Последнее связано с тем, что холод может вызвать некроз кожи, а тепловые процедуры усиливают циркуляцию лимфы и способствуют лимфоизлияниям. По этим же причинам не применяют при лимфоэкстравазатах массаж.
Учитывая изложенное, при небольших поверхностно расположенных лимфоэкстравазатах используют консервативно-оперативный метод лечения. Он заключается в следующем. В течение первых суток применяют умеренно давящие влажно-высыхающие повязки с камфорным спиртом или со спиртовым раствором ихтиола. В дальнейшем применяют опорожняющие пункции с последующим введением в полость лимфоэкстравазата 1 -2%-ного спиртового раствора йода и Наложением давя щей повязки. Эти процедуры обычно приходится повторять несколько раз.
Наиболее надежным способом лечения при лимфоэкстравазатах является оперативное вмешательство. Стенку лимфоэкстравазата рассекают небольшим линейным разрезом вблизи его нижней границы, содержимое полости удаляют, а саму полость дренируют марлей, обильно пропитанной 1 -2%-ным спиртовым раствором йода, 10%-ным йодоформным эфиром или 1 %-ным спиртовым раствором формалина. Дренаж удаляют через двое суток. В дальнейшем применяют жидкую мазь Вишневского, сульфаниламиды и другие антисептики. При таком способе лечения выздоровление наступает через 2 – 3 недели. Для ускорения заживления И. Е. Поваженко рекомендует сближение стенки полости лимфоэкстравазата путем наложения шва с валиками.
Tags: ветеринария, лечение, травмы
Лимфома у собак | TANOVEA для ветеринаров
Важная информация для ветеринаров о TANOVEA-CA1
Предназначен для нацеливания и уничтожения клеток лимфомы
1, 2- Накапливается в основном в лимфоидных клетках
- Подавляет пролиферацию лимфоцитов и клеточных линий лимфомы, подавляя синтез ДНК
Простота администрирования
- Одна доза каждые три недели
- Всего пять доз для полного лечения
- Простая 30-минутная внутривенная инфузия 1 мг / кг
- Пошаговое снижение дозы или отсрочка дозировки могут помочь справиться с побочными реакциями
Разумные ожидания эффективности
3- 77% общий процент ответа в клинических исследованиях с участием 22 собак, получавших TANOVEA-CA1 один раз в три недели
- 134 дня общего среднего времени выживаемости без прогрессирования у отвечающих собак
- Может применяться у собак с наивной и рецидивирующей / рефрактерной лимфомой
В целом хорошо переносится в клинических исследованиях
3- Большинство побочных реакций было ветеринарной кооперативной онкологической группой (VCOG) 4 степень 1 или 2
- Общие побочные реакции включали нейтропению, диарею, анорексию, потерю веса, летаргию и кожные проблемы
- Происходили менее частые, но более серьезные побочные реакции – дополнительные сведения см. В информации о назначении.
- Большинство побочных реакций разрешаются спонтанно при поддерживающем лечении, изменении дозы или отсрочке введения дозы
Было обнаружено, что TANOVEA-CA1 ингибирует пролиферацию клеток лимфомы
in vivo .Поглощение индикатора 18F-фтортимидина с помощью позитронно-эмиссионной томографии / компьютерной томографии (ПЭТ / КТ) после лечения TANOVEA-CA1. 5, 6
На рисунке A показан индикатор, присутствующий в лимфатических узлах, костном мозге, мочевом пузыре, почках и селезенке собаки с лимфомой до лечения.На фиг. B показана та же собака через девять недель после лечения TANOVEA-CA1 с заметно сниженным поглощением индикатора в лимфатических узлах, что коррелировало с полным ответом у этой собаки.
TANOVEA-CA1 механизм действия
Условно одобрен FDA в ожидании полной демонстрации эффективности под номером заявки 141-475.
ВНИМАНИЕ! Федеральный закон (США) ограничивает использование этого препарата лицензированными ветеринарами или по их указанию. Использование этого продукта не в соответствии с указаниями на этикетке является нарушением Федерального закона.
Важная информация по безопасности: TANOVEA®-CA1 (рабакфосадин для инъекций) не предназначен для использования людьми и должен храниться в недоступном для детей месте.Надевайте устойчивые к химиотерапии перчатки, чтобы предотвратить контакт с фекалиями, мочой, рвотой и слюной обработанных собак в течение пяти дней после лечения. Рабакфосадин цитотоксичен и может вызывать врожденные дефекты и влиять на женскую и мужскую фертильность. Беременным и кормящим женщинам не следует готовить или вводить продукт. У собак, получавших TANOVEA®-CA1, возникали серьезные и иногда со смертельным исходом респираторные осложнения, включая фиброз легких. Не используйте у собак с легочным фиброзом, хроническим заболеванием легких, которое может привести к фиброзу в анамнезе, а также у пород с предрасположенностью к этому заболеванию, таких как вест-хайленд-уайт-терьеры.С осторожностью применять для других пород терьеров. Не использовать беременным, кормящим или предназначенным для разведения собакам. Наиболее частые побочные реакции включали диарею, нейтропению, гипорексию, потерю веса и летаргию. Пожалуйста, см. Вкладыш в упаковке для получения полной информации о назначении.
Руководство по событиям экстравазации TANOVEA-CA1:
TANOVEA-CA1 (рабакфосадин для инъекций) представляет собой цитотоксическое противораковое средство и должно вводиться под наблюдением ветеринара, имеющего опыт применения химиотерапевтических средств против рака.Следует использовать стандартные меры для безопасного обращения с цитотоксическим агентом и его введения, и рекомендуется использовать полные СИЗ в соответствии с требованиями USP-800 и / или OSHA.
Исследования пузырьковых свойств TANOVEA-CA1 не проводились. Однако, основываясь на ограниченных отчетах клиник об экстравазации, кажется, что он обладает пузырьковыми свойствами от легких до умеренных. Эффекты примерно аналогичны эффектам, наблюдаемым у алкалоидов барвинка (например, винкристина), а не к серьезным, потенциально опасным для конечностей эффектам, которые могут наблюдаться при экстравазации таких агентов, как доксорубицин или актиномицин D.Менее чем в половине зарегистрированных случаев экстравазации появились клинические признаки, и все они исчезли в течение 2–4 недель.
Поскольку TANOVEA-CA1 может вызывать боль и повреждение тканей, избегайте экстравазационных травм. При появлении признаков экстравазации рекомендуется следующее:
- Немедленно прекратите инфузию.
- Если возможно, возьмите от 3 до 5 мл крови через катетер, чтобы удалить часть препарата.
- Попробуйте аспирировать дополнительный материал из любого отека через отдельные чрескожные палочки с иглой 25-го размера.
- Удалите инфузионный катетер и очертите инфильтрированный участок на коже пациента с помощью фломастера.
- Рассмотрите возможность периодической холодной упаковки в течение 48-72 часов.
- Избегайте давления или трения; не трите область.
- Обратите внимание на признаки повышенной эритемы, боли или некроза кожи.
- Убедитесь, что лекарство не вводится дистальнее места экстравазации.
- Через 48 часов посоветуйте пациенту нормально использовать конечность, чтобы обеспечить полный диапазон движений.
- Избегайте членовредительства с помощью елизаветинского ошейника.
- При необходимости окажите поддерживающую помощь.
- В случае некроза, десквамации или изъязвления тканей следует отдавать предпочтение клиницистам в отношении лечения ран. Как ни странно, некоторые клиницисты сообщают об успешном разрешении этих явлений с помощью различных методов лечения, включая нераздражающие очистители ран, стероиды, местные агенты, перевязки, обезболивание и / или системные антибиотики, когда это необходимо.
- Поскольку было зарегистрировано всего несколько случаев экстравазации, а сообщаемая информация была чрезвычайно ограниченной (см. Ниже краткое изложение сообщенных событий), нет информации о влиянии или целесообразности использования таких агентов, как ДМСО или гиалуронидаза. для смягчения последствий экстравазации TANOVEA-CA1.
Пожалуйста, сообщайте о любых возможных случаях экстравазации в VetDC, Inc. по телефону 1-844-342-8129 для получения дополнительных указаний.
ССЫЛКИ 1. Reiser H, Wang J, Chong L, et al. GS-9219 – новый аналог ациклических нуклеотидов с сильной противоопухолевой активностью у собак со спонтанной неходжкинской лимфомой. Clin Cancer Res 2008; 14: 2824–2832. 2. Крамата П., Дауни К.М., Паборский Л.Р. Инкорпорация и удаление 9- (2-фосфонилметоксиэтил) гуанина (PMEG) с помощью ДНК-полимеразы дельта и эпсилон in vitro. J Biol Chem 1998; 273: 21966–21971. 3. TANOVEA-CA1 [листок-вкладыш]. VetDC Inc., декабрь 2016 г.Данные в файле, VetDC Inc., Fort Collins, CO. 4. Veterinary Cooperative Oncology Group – общие терминологические критерии для нежелательных явлений (VCOG-CTCAE) после химиотерапии или биологической противоопухолевой терапии у собак и кошек v1.1. Vet Comp Oncol. 20 июля 2011 г., DOI: 10.1111 / j.1476-5829.2011.00283.x. 5. Лоуренс Дж., Вандерхук М., Барби Д. и др. Использование 3’-дезокси-3 ’- [18F] фтортимидина ПЭТ / КТ для оценки ответа на цитотоксическую химиотерапию у собак с неходжкинской лимфомой. Vet Radiol Ultrasound 2009; 50: 660–668. 6. Vail DM, Thamm DH, Reiser H, Ray AS, Wolfgang GHI, Watkins WJ, Babusis D, Henne IN, Hawkins MJ, Kurzman ID, Jeraj R, Vanderhoek M, Plaza S. Оценка GS-9219 в собачья модель неходжкинской лимфомы. Clin Cancer Res 2009 May 15; 15 (10): 3503-10.
Химиотерапия, лечение экстравазации
Экстравазация – это термин, который описывает непреднамеренное или случайное попадание лекарственного средства в окружающие ткани или подкожное пространство во время внутривенных инфузий.Объем, время контакта и свойства препарата – все это факторы, которые необходимо учитывать при оценке события экстравазации. Химиотерапевтические агенты подвергаются наибольшему риску осложнений из-за природы агентов и способности вызывать сильное клеточное повреждение при экстравазации. Тяжесть повреждения тканей может быть ограничена быстрым обнаружением экстравазации и быстрым лечением. Химиотерапевтическая экстравазация считается неотложной онкологической ситуацией.
При оценке экстравазации химиотерапевтического средства важно понимать классификацию химиотерапевтического агента с точки зрения его способности вызывать клеточное повреждение в случае экстравазации.Химиотерапевтические средства можно разделить на три категории: везиканты, раздражители и нераздражающие средства.
Везиканты могут вызывать боль, отек и эритему, а при экстравазации потенциально могут привести к образованию волдырей и некрозу тканей. Раздражители описаны в медицине как ощущение жжения, боли и / или эритемы во время инъекции и экстравазации. Нераздражающие вещества обычно не вызывают местных реакций на окружающие ткани; однако сообщалось о легком воспалении. Среди ветеринарных пациентов разумной практикой было бы тщательное наблюдение за пациентом и местом инъекции на предмет проявлений эритемы и утечки лекарственного средства во время инъекции / инфузии.
К сожалению, в настоящее время нет единого мнения относительно лечения экстравазации химиотерапии в медицине человека. Несмотря на большое количество опубликованной литературы по этой теме, большинство рекомендаций основано на эмпирических или анекдотических данных. Отсутствие силы и большая вариативность методов управления в описаниях случаев затрудняют стандартизацию и ранжирование практики управления с точки зрения эффективности. Следовательно, этот инструментарий служит только руководством для возможных вариантов лечения.
Многие химиотерапевтические агенты не имеют известных антидотов, которые можно было бы безопасно использовать для нейтрализации их токсической активности. Алгоритм на противоположной странице должен помочь в процессе принятия решения при проведении химиотерапевтической экстравазации. Важно отметить, что первая цель лечения – немедленно локализовать экстравазированный агент или рассеять его. Выбор локализации или дисперсии зависит от химиотерапевтических агентов. Холодный компресс поможет сузить местные кровеносные сосуды и локализовать повреждение тканей.Теплый компресс будет действовать наоборот, помогая распределить химиотерапевтическое средство в окружающих тканях. Вторая цель лечения – нейтрализовать локализованный химиотерапевтический препарат или разбавить его, чтобы позволить ему абсорбироваться и, следовательно, метаболизироваться.
Для целей этого документа мы сосредоточимся на пяти обычно используемых химиотерапевтических средствах и их антидотах: доксорубицин, винкристин, винбластин, карбоплатин и L-аспарагиназа.
ТАБЛИЦА 1. УПРАВЛЕНИЕ ЭКСТРАВАЗАЦИЯМИ
* Нет рекомендованного антидота.† Рекомендуемый антидот: дексразоксан или диметилсульфоксид (ДМСО). ‡ Рекомендуемый антидот: ДМСО. §Рекомендуемый антидот: гиалуронидаза. По материалам [1].
Экстравазии антрациклина
Антидоты доксорубицина
Дексразоксан
Дексразоксан – хелатор железа, предотвращающий образование комплексов антрациклин-железо и образование свободных радикалов, вызывающих окислительное повреждение. Кроме того, дексразоксан оказывает защитное действие на здоровые ткани, стабилизируя топоизомеразу II, тем самым предотвращая повреждение антрациклином.Этот механизм действия отвечает за его способность снижать кардиотоксичность, связанную с антрациклинами, такими как доксорубицин. Дексразоксан имеет наибольшее количество доказательств, подтверждающих его использование в медицине. В двух исследованиях в одной группе с участием 54 пациентов с экстравазиями антрациклина было показано, что дексразоксан эффективен в предотвращении серьезного повреждения тканей. Дексразоксан вводили внутривенно по трехдневному графику (1000, 1000 и 500 мг / м2 в соответствующие дни), начиная не позднее чем через 6 часов после события экстравазации [2].На моделях мышей было показано, что дексразоксан оказывает защитное действие против экстравазации через 3 часа после экстравазации [3].
В ветеринарии, Venable et al. описали четыре случая экстравазации доксорубицина у собак; три собаки получили различные дозы дексразоксана в течение 2 часов после экстравазации и 1 – через 48 часов. Собаки, получившие дексразоксан в течение 2 часов, полностью выздоровели без хирургической обработки, тогда как собаке, получившей дексразоксан через 48 часов после события, потребовалась хирургическая обработка.Дозы варьировали от 231 до 500 мг / м2 с некоторым изменением количества вводимых доз [4].
Диметилсульфоксид (ДМСО)
ДМСО успешно применялся при экстравазации антрациклина у человека. У людей местный ДМСО применялся сразу после экстравазации, покрывая дважды пораженную область. Это лечение повторялось дважды в день в течение 14 дней с разрешением [1]. Важно отметить, что одновременный прием ДМСО и дексразоксана не рекомендуется и, как было показано на мышах, снижает эффективность дексразоксана [5, 6].Однако в сообщении о 4 собаках с экстравазацией доксорубицина все собаки получали дексразоксан вместе с местной мазью с 90% ДМСО каждые 8 часов в течение 14 дней; только 1 собаке потребовалась хирургическая обработка раны, но все выжили при медикаментозном лечении [4]. Доказательства в пользу использования ДМСО при экстравазации доксорубицина существуют; однако сила и изменчивость этих данных не подтверждают использование ДМСО в качестве терапии первой линии при экстравазации доксорубицина.
Экстравазии алкалоидов барвинка
Винкристин и антидоты винбластина
Гиалуронидаза
Гиалуронидаза – это фермент, который расщепляет гиалуроновую кислоту, улучшая абсорбцию экстравазированных лекарств в кровоток, где они могут метаболизироваться [1].Исследование с участием семи пациентов с случайной экстравазацией алкалоида барвинка не показало некроза кожи после местного лечения гиалуронидазой [7]. Данные этого исследования показали, что использование раствора гиалуронидазы 150 Ед / мл, вводимого через существующую катетерную линию, было полезным. Доза составляла 1: 1, 1 мл гиалуронидазы (150 Ед / мл) на каждый 1 мл экстравазированного препарата. Теплые компрессы помогают рассеять алкалоиды барвинка, что снижает токсичность пузырей.
Алкилирующие агенты
Карбоплатин
ДМСО
Было показано, что нанесение местного ДМСО на пораженную поверхность кожи каждые 8 часов в течение 1 недели вместе с местным сухим холодным компрессом полезно для людей [8].При необходимости может оказаться полезным лечение с применением антигистаминных или противовоспалительных средств.
L-аспарагиназа
Поскольку L-аспарагиназа не вызывает раздражения, она довольно безвредна. При любых реакциях помогут местные сухие холодные компрессы [1].
РЕЗЮМЕ ХИМИОТЕРАПЕВТИЧЕСКИХ АНТИДОТОВ
Список литературы
- Фидальго Дж. А., Перес Л., Гарсия Фабрегат А. и др. Лечение экстравазации химиотерапии: Руководство по клинической практике ESMO-EONS.Энн Онкол 2012; 23 (Приложение 7): vii167 – vii173. Издательство Оксфордского университета. http://annonc.oxfordjournals.org/content/23/suppl_7/vii167.full.pdf. По состоянию на 3 марта 2015 г.
- Mouridsen HT, Langer SW, Buter J, et al. Лечение экстравазации антрациклина савеном (дексразоксаном): результаты двух проспективных клинических многоцентровых исследований. Энн Онкол 2007; 18: 546–550.
- Langer SW, Sehested M, Jensen PB. Лечение антрациклиновой экстравазации дексразоксаном. Clin Cancer Res 2000; 6: 3680–3686.
- Venable RO, Saba CF, Endicott MM, et al. Лечение дексразоксаном травмы, вызванной экстравазацией доксорубицина, у четырех собак. Журнал Американской ветеринарной медицинской ассоциации 2012 г .; 240 (3): 304-07.
- Langer SW. Экстравазация химиотерапии. Curr Oncol Rep 2010; 12 (4): 242–246. DOI: 10.1007 / s11912-010-0110-7.
- Langer SW, Thougaard AV, Sehested M, Jensen PB. Лечение экстравазации антрациклина у мышей дексразоксаном с ДМСО и гидрокортизоном или без них. Cancer Chemother Pharmacol 2006; 57 (1): 125–128.DOI: 10.1007 / s00280-005-0022-7.
- Бертелли Г., Дини Д., Форно Г.Б. и др. Гиалуронидаза как противоядие от экстравазации алкалоидов барвинка: клинические результаты. J Cancer Res Clin Oncol 1994; 120: 505–506.
- Bertelli G, Gozza A, Forno GB, et al. Диметилсульфоксид для местного применения для профилактики повреждения мягких тканей. После экстравазации везикантных цитотоксических препаратов: проспективное клиническое исследование. J Clin Oncol 1995; 13: 2851–2855.
Хилезный асцит: обзор, патофизиология, этиология
Ким Дж., Вон Дж. Х.Чрескожное лечение хилезного асцита. Техника Vasc Interv Radiol . 2016 декабря 19 (4): 291-8. [Медлайн].
Лизаола Б., Бондер А., Триведи HD, Таппер Э. Б., Карденас А. Обзорная статья: диагностический подход и текущее лечение хилезного асцита. Алимент Фармакол Тер . 2017 Ноябрь 46 (9): 816-24. [Медлайн].
Малагелада-младший, Ибер, Флорида, Линшер, РГ. Происхождение жира при хилезном асците у пациентов с циррозом печени. Гастроэнтерология . 1974 ноябрь 67 (5): 878-86. [Медлайн].
Блэлок А, Каннингем Р.С., Робинсон С.С. Экспериментальное получение хилоторакса путем окклюзии верхней полой вены. Энн Сург . 1936 Сентябрь 104 (3): 359-64. [Медлайн]. [Полный текст].
Sathiravikarn W, Apisarnthanarak A, Apisarnthanarak P, Bailey TC. Хилезный асцит, связанный с Mycobacterium tuberculosis, у ВИЧ-инфицированных пациентов: отчет о болезни и обзор литературы. Инфекция . 2006 августа 34 (4): 230-3. [Медлайн].
Aalami OO, Allen DB, Organ CH Jr. Хилезный асцит: коллективный обзор. Хирургия . 2000 ноябрь 128 (5): 761-78. [Медлайн].
Кипсон А.П., Онайтис М.В., Фельдман Дж. М., Тайлер Д.С. Карциноид и хилезный асцит: необычная ассоциация. Дж Гастроинтест Сург . 2002 сентябрь-октябрь. 6 (5): 781-3. [Медлайн].
Айерс Р. Хилезный асцит и карциноид тощей кишки: диагностическая проблема. ANZ J Surg . 2005 июл.75 (7): 618-9. [Медлайн].
Akram S, Pardi DS, Schaffner JA, Smyrk TC. Склерозирующий мезентериит: клинические особенности, лечение и исход у девяноста двух пациентов. Клин Гастроэнтерол Гепатол . 2007 май. 5 (5): 589-96; викторина 523-4. [Медлайн].
Witte MH, Witte CL, Dumont AE. Прогресс в заболевании печени: физиологические факторы, вызывающие цирротический асцит. Гастроэнтерология .1971, ноябрь 61 (5): 742-50. [Медлайн].
Evans JG, Spiess PE, Kamat AM и др. Хилезный асцит после рассечения забрюшинных лимфатических узлов после химиотерапии: обзор опыта М. Д. Андерсона. Дж Урол . 2006 октябрь 176 (4, часть 1): 1463-7. [Медлайн].
Cheung CK, Khwaja A. Хилезный асцит: необычное осложнение перитонеального диализа. Отчет о болезни и обзор литературы. Перит Наберите Int . 2008 май-июнь. 28 (3): 229-31.[Медлайн].
Assumpcao L, Cameron JL, Wolfgang CL, et al. Частота и лечение утечки хилуса после резекции поджелудочной железы: большой объем одноцентрового институционального опыта. Дж Гастроинтест Сург . 2008 12 (11): 1915-23. [Медлайн].
Edoute Y, Nagachandran P, Assalia A, Ben-Ami H. Преходящий хилезный асцит после дистального спленоренального шунта. Гепатогастроэнтерология . 2000 март-апрель. 47 (32): 531-2.[Медлайн].
Йылмаз М., Акбулут С., Исик Б. и др. Хилезный асцит после трансплантации печени: частота и факторы риска. Трансплантация печени . 2012 Сентябрь 18 (9): 1046-52. [Медлайн].
Ijichi H, Soejima Y, Taketomi A, et al. Успешное лечение хилезного асцита после трансплантации печени от живого донора с помощью соматостатина. Печень Инт . 2008, 28 января (1): 143-5. [Медлайн].
Баран М., Чакир М., Юксеккая Н.А. и др.Хилезный асцит после трансплантации родственной печени, леченной аналогом соматостатина и парентеральным питанием. Протокол трансплантологии . 2008 янв-фев. 40 (1): 320-1. [Медлайн].
Кара Х. Хилезный асцит, развивающийся после открытой пластики аневризмы торакоабдоминальной аорты у пациента с синдромом Марфана. Braz J Cardiovasc Surg . 2019 3 сентября [Medline].
Шарма А., Хеер М., Субраманайм Маллади С.В., Минц М. Хилезный асцит после лапароскопической донорской нефрэктомии. Дж Эндоурол . 2005 сентября 19 (7): 839-40. [Медлайн].
Бахманн А., Русзат Р., Дикенманн М. и др. Хилоретроперитонеум с вторичным хилотораксом после ретроперитонеоскопической донорской нефрэктомии. Урология . 2005 Октябрь, 66 (4): 881. [Медлайн].
Aerts J, Matas A, Sutherland D, Kandaswamy R. Хилезный асцит, требующий хирургического вмешательства после донорской нефрэктомии: серия случаев и опыт одного центра. Ам Дж. Трансплантат .2010 января 10 (1): 124-8. [Медлайн].
Press OW, Press NO, Kaufman SD. Оценка и лечение хилезного асцита. Энн Интерн Мед. 1982 марта 96 (3): 358-64. [Медлайн].
Никс Дж. Т., Альберт М., Дугас Дж. Э., Вендт ДЛ. Хилоторакс и хилезный асцит; исследование 302 избранных случаев. Ам Дж. Гастроэнтерол . 1957, 28 июля (1): 40–53; обсуждение, 53-5.
Press OW, Press NO, Kaufman SD. Оценка и лечение хилезного асцита. Энн Интерн Мед. 1982 марта 96 (3): 358-64. [Медлайн].
Lamblin A, Mulliez E, Lemaitre L. [Острый перитонит: редкое проявление хилезного асцита] [французский язык]. Энн Чир . 2003 Февраль 128 (1): 49-52. [Медлайн].
Smith EK, Ek E, Croagh D, Spain LA, Farrell S. Острый хилезный асцит, имитирующий острый аппендицит у пациента с панкреатитом. Мир Дж. Гастроэнтерол . 2009 14 октября. 15 (38): 4849-52. [Медлайн].[Полный текст].
Poo S, Pencavel TD, Jackson J, Jiao LR. Портальная гипертензия и хилезный асцит, осложняющие острый панкреатит: терапевтическое значение стентирования воротной вены. Энн Р Колл Сург Англ . 2018 января 100 (1): e1-e3. [Медлайн].
Weinstein LD, Scanlon GT, Hersh T. Хилезный асцит. Лечение триглицеридов со средней длиной цепи и обострение с помощью лимфангиографии. Ам Джи Диг Дис . 1969 14 июля (7): 500-9. [Медлайн].
Чен Дж., Линь Р.К., Хассанейн Т. Использование орлистата (ксеникала) для лечения хилезного асцита. Дж Клин Гастроэнтерол . 2005 Октябрь 39 (9): 831-3. [Медлайн].
Берзиготти А., Магалотти Д., Коччи С., Ангелони Л., Пирони Л., Золи М. Октреотид в амбулаторной терапии цирроза хилезного асцита: клинический случай. Dig Liver Dis . 2006 Февраль 38 (2): 138-42. [Медлайн].
Widjaja A, Gratz KF, Ockenga J, Wagner S, Manns MP.Октреотид для лечения хилезного асцита при синдроме желтого ногтя. Гастроэнтерология . 1999 апр. 116 (4): 1017-8. [Медлайн].
Zhou DX, Zhou HB, Wang Q, Zou SS, Wang H, Hu HP. Эффективность лечения октреотидом при хилезном асците после цирроза печени. Dig Dis Sci . 2009 Август 54 (8): 1783-8. [Медлайн].
Olivieri C, Nanni L, Masini L, Pintus C. Успешное лечение врожденного хилезного асцита у новорожденного с помощью раннего октреотида и полного парентерального питания. BMJ Case Rep . 2012 25 сентября; 2012. [Medline].
Hengl G, Prager J, Pointner H. Влияние соматостатина на абсорбцию триглицеридов у частично подвергнутых гастрэктомии субъектов. Acta Гепатогастроэнтерол (Штутг) . 1979 26 октября (5): 392-5. [Медлайн].
Hengl G, Prager J, Morz R, Pointner H, Deutsch E. [Дальнейшие исследования влияния соматостатина на абсорбцию триглицеридов (авторский перевод)] [немецкий]. Wien Med Wochenschr . 1980, 30 января. 130 (2): 49-52. [Медлайн].
Накабаяши Х., Сагара Х., Усукура Н. и др. Влияние соматостатина на скорость потока и уровни триглицеридов в лимфе грудного протока у здоровых собак и собак после ваготомии. Диабет . 1981 Май. 30 (5): 440-5. [Медлайн].
Намба М., Масуда Т., Накамура Т. и др. Дополнительная терапия октреотидом к сиролимусу позволила снизить хилезный выпот, рефрактерный к сиролимусу, осложненный лимфангиолейомиоматозом. Медицинский работник . 2017 15 декабря. 56 (24): 3327-31. [Медлайн].
Аблан CJ, Littooy FN, Freeark RJ. Послеоперационный хилезный асцит: диагностика и лечение. Отчет о серии и обзор литературы. Arch Surg . 1990 Февраль 125 (2): 270-3. [Медлайн].
Дженсен Э. Х., Вайс, Калифорния, 3-й. Ведение хилезного асцита после лапароскопической холецистэктомии с использованием малоинвазивных методов: отчет о клиническом случае и обзор литературы. Am Surg .2006 Январь 72 (1): 60-3. [Медлайн].
Zeidan S, Delarue A, Rome A, Roquelaure B. Применение фибринового клея в лечении рефрактерного хилезного асцита у детей. J Педиатр Гастроэнтерол Нутр . 2008 апр. 46 (4): 478-81. [Медлайн].
Хван П.Ф., Оспина К.А., Ли Э.Х., Реринг С.Р. Нетрадиционное лечение хилоасцитов после лапароскопической фундопликации по Ниссену. ЖСЛС . 2012 апрель-июнь. 16 (2): 301-5. [Медлайн]. [Полный текст].
Ямагами Т., Масунами Т., Като Т. и др. Самопроизвольное заживление утечки хилуса после лимфангиографии. Бр. Дж. Радиол . 2005 сентябрь 78 (933): 854-7. [Медлайн].
Мацумото Т., Ямагами Т., Като Т. и др. Эффективность лимфангиографии как метода лечения различных утечек хилуса. Бр. Дж. Радиол . 2009 апр. 82 (976): 286-90. [Медлайн].
Надольски Г.Дж., Чаухан Н.Р., Иткин М. Лимфангиография и лимфатическая эмболизация для лечения рефрактерного хилезного асцита. Кардиоваск Интервент Радиол . 2018 Март 41 (3): 415-423. [Медлайн].
Шриниваса Р.Н., Геммете Дж. Дж., Ошер М.Л., Хаге А.Н., Цыпленок Дж.Ф. Эндолимфатическая ретроградная абдоминальная лимфангиография (BORAL) с окклюзией баллона и эмболизация (BORALE) для диагностики и лечения хилезного асцита: подход, технический успех и клинические результаты. Анн Васк Сург . 2018 май. 49: 49-56. [Медлайн].
Matsufuji H, Nishio T, Hosoya R.Успешное лечение трудноизлечимого хилезного асцита у ребенка с помощью перитонеовенозного шунта. Педиатр Хирург Инт. . 2006 май. 22 (5): 471-3. [Медлайн].
de Vries GJ, Ryan BM, de Bievre M, et al. Хилезный асцит, связанный с циррозом печени, успешно лечится с помощью TIPS. Eur J Гастроэнтерол Hepatol . 2005 г., 17 (4): 463-6. [Медлайн].
Кикольски С.Г., Арьяфар Х., Роуз СК, Робертс А.С., Кинни ТБ. Трансъюгулярный внутрипеченочный портосистемный шунт для лечения хилоторакса, связанного с циррозом, и хилезного асцита: ретроспективный опыт одного учреждения. Кардиоваск Интервент Радиол . 2013 августа, 36 (4): 992-7. [Медлайн].
Thiel FC, Parvanta P, Hein A, et al. Хилезный асцит после лимфаденэктомии по поводу гинекологических злокачественных новообразований. J Surg Oncol . 2016 Октябрь 114 (5): 613-8. [Медлайн].
Yarmohammadi H, Brody LA, Erinjeri JP, et al. Терапевтическое применение чрескожного перитонеовенозного (Денверского) шунта при лечении хилезного асцита у онкологических больных. J Vasc Interv Radiol .2016 май. 27 (5): 665-73. [Медлайн].
Bhattacharya D, Indla RT, Tiewsoh K, Rathore V. Хилезный асцит во время перитонеального диализа у малыша: редкое осложнение. BMJ Case Rep . 2019 21 августа. 12 (8): [Medline].
Miserachs M, Lurz E, Levman A, et al. Диагностика, исход и лечение хилезного асцита после трансплантации печени у детей. Трансплантация печени . 2019 Сентябрь 25 (9): 1387-96. [Медлайн].
Корреляция на основе молекулярного портрета между первичной опухолью молочной железы собаки и ее метастазами в лимфатические узлы: возможные прогностико-прогностические модели и / или твердыня для конкретного лечения? | BMC Veterinary Research
Фергюсон Х.Р .: Опухоли молочной железы собак. Ветеринарная клиника North Am Small Anim Pract. 1985, 15: 501-511.
Артикул CAS PubMed Google Scholar
Moulton JE: Опухоли молочной железы. Опухоли домашних животных. Под редакцией: Moulton JE. 1990, Беркли: Калифорнийский университет Press, 518-553. 3
Google Scholar
Steinman S, Wang J, Bourne P, Yang Q, Tang P: Экспрессия маркеров цитокератина, ER-альфа, PR, HER-2 / neu и EGFR в чистой протоковой карциноме in situ (DCIS) и DCIS с сосуществующей инвазивной протоковой карциномой (IDC) груди.Ann Clin Lab Sci. 2007, 37: 127-134.
CAS PubMed Google Scholar
Guarneri V, Conte P: Метастатический рак молочной железы: терапевтические варианты в соответствии с молекулярными подтипами и предшествующей адъювантной терапией. Онколог. 2009, 14: 645-656. 10.1634 / теонколог.2009-0078.
Артикул CAS PubMed Google Scholar
Тавассоли Ф.А., Девили П.Л .: Классификация опухолей Всемирной организации здравоохранения.Патология и генетика. Опухоли груди и женских половых органов. 2003, Лион: Международное агентство по изучению рака
Google Scholar
Misdorp W, Else RW, Hellmén E, Lipscomb TP: Гистологическая классификация опухолей молочных желез у собак и кошек. 1999, Вашингтон, округ Колумбия: опубликовано Институтом патологии вооруженных сил в сотрудничестве с Американским регистром патологии и Центром сотрудничества Всемирной организации здравоохранения по всемирной справке по сравнительной онкологии
Google Scholar
Goldschmidt M, Peña L, Rasotto R, Zappulli V: Классификация и классификация опухолей молочной железы собак. Vet Pathol. 2011, 48: 117-131. 10.1177 / 0300985810393258.
Артикул CAS PubMed Google Scholar
Гама А., Алвес А., Шмитт Ф: Идентификация молекулярных фенотипов карциномы молочной железы у собак с клиническими последствиями: применение классификации человека. Арка Вирхова. 2008, 453: 123-132. 10.1007 / s00428-008-0644-3.
Артикул CAS PubMed Google Scholar
Sassi F, Benazzi C, Castellani G, Sarli G: Молекулярные подтипы опухолей карциномы молочной железы собак, оцененные с помощью иммуногистохимии. BMC Vet Res. 2010, 6: 5-10.1186 / 1746-6148-6-5.
PubMed Central Статья PubMed Google Scholar
Мория Т., Каномата Н., Кодзука Ю., Хиракава Н., Кимидзима И., Кимура М., Ватанабэ М., Сасано Н., Исида Т., Охучи Н., Куребаяси Дж., Сону Н.: Молекулярно-морфологический подход к патологическому исследованию развитие и продвижение рака груди человека.Мед Мол Морфол. 2010, 43: 67-73. 10.1007 / s00795-010-0504-5.
Артикул CAS PubMed Google Scholar
Сорли Т., Тибширани Р., Паркер Дж., Хасти Т., Маррон Дж. С., Нобель А., Денг С., Йонсен Х., Песич Р., Гейслер С., Деметра Дж., Перу С. М., Лоннинг П. Е., Браун П. О., Борресен- Дейл А.Л., Ботштейн Д.: Повторное наблюдение подтипов опухолей молочной железы в независимых наборах данных экспрессии генов. Proc Natl Acad Sci USA. 2003, 100: 8418-8423.10.1073 / pnas.0932692100.
PubMed Central Статья CAS PubMed Google Scholar
Rexhepaj E, Brennan DJ, Holloway P, Kay W., McCann AH, Landberg G, Duffy MJ, Jirstrom K, Gallagher WM: новый подход к анализу изображений для количественной оценки экспрессии ядерных белков, оцененной с помощью иммуногистохимии: применение для измерения уровней рецепторов эстрогена и прогестерона при раке груди. Рак молочной железы Res. 2008, 10: R89-10.1186 / bcr2187.
PubMed Central Статья PubMed Google Scholar
Conforti R, Boulet T, Tomasic G, Taranchon E, Arriagada R, Spielmann M, Ducourtieux M, Soria JC, Tursz T, Delalodge S, Michiels S, Andre F: молекулярная подклассификация рака груди и экспрессия рецепторов эстрогена для прогнозирования эффективности адъювантной химиотерапии на основе антрациклинов: исследование биомаркеров из двух рандомизированных исследований. Энн Онкол. 2007, 18: 1477-1483.10.1093 / annonc / mdm209.
Артикул CAS PubMed Google Scholar
Ян XR, Шерман М.Э., Римм Д.Л., Лиссовска Дж., Бринтон Л.А., Пеплонска Б., Хьюитт С.М., Андерсон В.Ф., Шешеня-Дабровска Н., Бардин-Миколайчак А., Затонский В., Картун Р., Мандич Д., Рымкевич G, Llgaj M, Lukaszek S, Kordek R, Garcia-Closas M: Различия в факторах риска молекулярных подтипов рака груди в популяционном исследовании. Биомаркеры эпидемиологии рака Пред.2007, 16: 439-443. 10.1158 / 1055-9965.EPI-06-0806.
Артикул CAS PubMed Google Scholar
Wu JM, Fackler MJ, Halushka MK, Molavi DW, Taylor ME, Teo WW, Griffin C, Fetting J, Davidson NE, DeMarzo AM, Hicks JL, Chitale D, Marc L, Sukumar S, Argani P : Гетерогенность метастазов рака молочной железы: сравнение терапевтической целевой экспрессии и метилирования промотора между первичными опухолями и их мультифокальными метастазами.Clin Cancer Res. 2008, 10: 1938-1946.
Артикул Google Scholar
Тарин D: Сравнение метастазов в различных органах: биологическое и клиническое значение. Clin Cancer Res. 2008, 14: 1923-1925. 10.1158 / 1078-0432.CCR-07-5259.
Артикул PubMed Google Scholar
Klopfleisch R, Lenze D, Hummel M, Gruber AD: Метастатические карциномы молочной железы собак можно идентифицировать по профилю экспрессии гена, который частично перекрывается с профилями рака груди человека.BMC Рак. 2010, 10: 618-10.1186 / 1471-2407-10-618.
PubMed Central Статья CAS PubMed Google Scholar
Ривера П., фон Эйлер Х: Молекулярно-биологические аспекты опухолей молочной железы у собак и человека. Vet Pathol. 2011, 48: 132-146. 10.1177 / 0300985810387939.
Артикул CAS PubMed Google Scholar
Матос А.Дж., Баптиста С.С., Гертнер М.Ф., Руттеман Г.Р.: Прогностические исследования опухолей молочной железы у собак и кошек: необходимость стандартизированных процедур.Вет Дж. 2012, 193: 24-31. 10.1016 / j.tvjl.2011.12.019.
Артикул CAS PubMed Google Scholar
Peppercorn J, Perou CM, Carey LA: Молекулярные подтипы в оценке и лечении рака груди: разделяй и властвуй. Canc Invest. 2008, 26: 1-10. 10.1080 / 073571784238.
Артикул CAS Google Scholar
Кэри Л.А.: Направленная терапия подтипов тройного отрицательного рака груди.Онколог. 2011, 15: 49-56.
Артикул Google Scholar
Romanelli G: Tumori mammari. Oncologia del cane e del gatto. Отредактировано: Strambini T. 2007, Милан: Elsevir Masson, 215-222. 1
Google Scholar
Lavalle GE, De Campos CB, Bertagnolli AC, Cassali GD: Злокачественные новообразования молочной железы собак с продвинутой клинической стадией, леченные карбоплатином и ингибиторами циклооксигеназы.In Vivo. 2012, 26: 375-379.
CAS PubMed Google Scholar
Моррис Дж. С., Добсон Дж. М., Босток, Делавэр: Использование тамоксифена для контроля неоплазии молочной железы у собак. Vet Rec. 1993, 27: 539-542.
Артикул Google Scholar
Гилбертсон С.Р., Курцман И.Д., Закрау Р.Э., Гурвиц А.И., Блэк М.М.: Эпителиальные новообразования молочной железы собак: биологические последствия мофологических характеристик, оцененные у 232 собак.Vet Pathol. 1983, 20: 127-142.
Артикул CAS PubMed Google Scholar
Ким MJ, Ro JY, Ahn SH, Kim HH, Kim SB, Gong G: Клинико-патологическое значение базального подтипа рака груди: сравнение с рецептором гормона и фенотипами, сверхэкспрессирующими Her2 / neu . Hum Pathol. 2006, 37: 1217-1226. 10.1016 / j.humpath.2006.04.015.
Артикул CAS PubMed Google Scholar
Millanta F, Calandrella M, Citi S, Della Santa D, Poli A: Сверхэкспрессия HER-2 в кошачьих инвазивных карциномах молочной железы: иммуногистохимическое исследование и оценка его прогностического потенциала. Vet Pathol. 2005, 42: 30-34. 10.1354 / вп.42-1-30.
Артикул CAS PubMed Google Scholar
Millanta F, Calandrella M, Bari G, Niccolini M, Vannozzi I, Poli A: Сравнение экспрессии стероидных рецепторов в нормальных, диспластических и опухолевых тканях молочной железы собак и кошек.Res Vet Sci. 2005, 79: 225-232. 10.1016 / j.rvsc.2005.02.002.
Артикул CAS PubMed Google Scholar
Ramalho LNZ, Ribeiro-Silva A, Cassali GD, Zucoloto S: Экспрессия p63 и цитокератина 5 в смешанных опухолях молочной железы собаки дает новое понимание гистогенеза этих новообразований. Vet Pathol. 2006, 43: 424-429. 10.1354 / вп.43-4-424.
Артикул CAS PubMed Google Scholar
Лестер СК: Грудь. Патологические основы болезни Роббинса и Котрана. Под редакцией: Кумар В., Аббас А., Фаусто Н., Астер Дж. К.. 2010, Филадельфия: Сондерс Эльзевьер, 1084-1085. 8
Google Scholar
Лу Х, Лу Х, Ван З. К., Иглхарт Дж. Д., Чжан Х, Ричардсон А. Л.: Прогнозирование признаков рака груди с помощью паттернов экспрессии генов. Лечение рака груди Res. 2008, 108: 191-201. 10.1007 / s10549-007-9596-6.
Артикул CAS PubMed Google Scholar
Nakshatri H, Srour EF, Badve S: стволовые клетки рака груди и внутренние подтипы: споры продолжаются. Curr Stem Cell Res Ther. 2009, 4: 50-60. 10.2174 / 157488809787169110.
Артикул CAS PubMed Google Scholar
Weigelt B, Glas AM, Wessels LF, Witteveen AT, Peterse JL, van’t Veer LJ: Профили экспрессии генов первичных опухолей молочной железы поддерживаются в отдаленных метастазах. Proc Natl Acad Sci USA. 2003, 100: 15901-15905.10.1073 / pnas.2634067100.
PubMed Central Статья CAS PubMed Google Scholar
Weigelt B, Hu Z, He X, Livasy C, Carey LA, Ewend MG, Glas AM, Perou CM, Van’t Veer LJ: молекулярные портреты и сигнатура прогноза 70 генов сохраняются на протяжении всего метастатического процесса рака груди. Cancer Res. 2005, 65: 9155-9158. 10.1158 / 0008-5472.CAN-05-2553.
Артикул CAS PubMed Google Scholar
Hsu HC, Chang HK, Lin YC, Hseu S, Chen JS, Yang TS, Wang HM, Shen WC: Роль HER2 в метастатическом раке молочной железы, леченном комбинацией таксанов и цисплатина. Чанг Гунг Мед Дж. 2009, 32: 33-41.
PubMed Google Scholar
Perou CM, Sorlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, Pollack JR, Ross DT, Johnsen H, Akslen LA, Fluge O, Pergamenschikov A, Williams C, Zhu SX, Lonning PE, Borresen-Dale AL, Brown PO, Botstein D: Молекулярные портреты опухолей груди человека.Природа. 2000, 406: 747-752. 10.1038 / 35021093.
Артикул CAS PubMed Google Scholar
Demir H, Turna H, Can G, Ilvan S: Клинико-патологическая и прогностическая оценка молекулярных подтипов инвазивной карциномы молочной железы и экспрессии GATA3. Дж. Буон. 2010, 15: 774-782.
CAS PubMed Google Scholar
Брунетти Б., Аспрони П., Беха Г., Мускателло Л.В., Милланта Ф., Поли А, Бенацци С., Сарли Г.: Молекулярный фенотип в опухолях молочных желез у маток: корреляция между первичной опухолью и метастазами лимфатических узлов.J Comp Pathol. 2012 г., [http://dx.doi.org/10.1016/j.jcpa.2012.05.012]
Google Scholar
Gown AM: Текущая проблема тестирования ER и HER2, проводимого IHC при раке груди. Мод Pathol. 2008, 21: 8-15.
Артикул Google Scholar
Барду В.Дж., Арпино Дж., Элледж Р.М., Осборн К.К., Кларк Г.М.: Статус рецептора прогестерона значительно улучшает прогнозирование результатов по сравнению с одним только статусом рецептора эстрогена для адъювантной эндокринной терапии в двух больших базах данных рака груди.J Clin Oncol. 2003, 21: 1973-1979. 10.1200 / JCO.2003.09.099.
Артикул CAS PubMed Google Scholar
Martin De Las Mulas J, Millan Y, Dios R: проспективный анализ иммуногистохимически определенных экспрессии рецептора эстрогена α и прогестерона, а также факторов хозяина и опухоли как предикторов периода без заболевания при опухолях молочной железы у собак. Vet Pathol. 2005, 42: 200-212. 10.1354 / вп.42-2-200.
Артикул PubMed Google Scholar
Chang CC, Tsai MH, Liao JW, Chan JPW, Wong ML, Chang SC: Оценка использования экспрессии гормональных рецепторов для прогнозирования выживаемости самок собак со злокачественными опухолями молочной железы. ЯВМА. 2009, 235: 391-396. 10.2460 / javma.235.4.391.
Артикул CAS PubMed Google Scholar
Munirah MA, Siti-Aishah MA, Reena MZ, Sharifah NA, Rohaizak M, Norlia A, Rafie MK, Asmiati A, Hisham A, Fuad I, Shahrun NS, Das S: Идентификация различных подтипов груди рак с использованием тканевого микрочипа.Rom J Morphol Embryol. 2011, 52: 669-677.
CAS PubMed Google Scholar
Pal SK, Childs BH, Pegram M: Тройной негативный рак груди: неудовлетворенные медицинские потребности. Лечение рака груди Res. 2011, 125: 627-636. 10.1007 / s10549-010-1293-1.
PubMed Central Статья CAS PubMed Google Scholar
Экстравазация адриамицина и других вазосклеротических средств (Материалы)
Повреждение ткани может быть обширным, если экстравазация не будет обнаружена и не лечится.Даже небольшое количество адриамицина может вызвать серьезное необратимое ленивое повреждение тканей. Актиномицин D также является сильнодействующим вазосклерозом. Винкристин, винбластин и мехлоретамин (Мустарген®) являются умеренными вазосклеротическими средствами. Цисплатин, митоксантрон, дакарбазин (DTIC), 5-фторурацил, митрамицин, этопозид, стрептозотоцин и блеомицин считаются мягкими везикантами.
При работе с химиотерапевтическими агентами важно четко идентифицировать лекарства в соответствии с их «вазосклеротическим» потенциалом.Этот автор использует формы лечения химиотерапией, в которых есть поле с предупреждением о вазосклерозе, которое обведено кружком или проверено врачом, когда он / она пишет заказ. Эта мера предосторожности предупреждает медперсонал о том, что пролитие жидкости может привести к локальному повреждению тканей.
Медперсонал сразу заметит большинство периваскулярных утечек. Непосредственно рядом с местом венепункции появляется «пузырек» или припухлость. Некоторые больные онкологией испытывают немедленный дискомфорт. Они корчатся, плачут или борются.Если во время процедуры пациенту вводят седативные препараты, медперсонал должен находиться под непосредственным наблюдением во время инфузии вазосклеротического средства.
Важно, чтобы медперсонал чувствовал себя свободным и был обязан громко и ясно указывать лечащему врачу, когда есть подозрение на утечку. Если пациента отправляют домой с невыявленной экстравазацией, клиент может заметить проблему в течение нескольких часов или в течение 10 дней после химиотерапии. Питомец начинает лизать место венепункции. Клиент звонит в больницу с жалобой на боль, отек, воспаление, шелушение и / или хромоту у питомца.
Настаивайте на седации, когда это необходимо для всех вазосклеротических средств.
В целях собственной безопасности всем онкологическим больным, которые сопротивляются ограничению во время введения любого едкого химиотерапевтического агента, требуется седация. В соответствии с политикой, седация должна быть рекомендована для безопасности пациента, чтобы избежать затруднений и случайной экстравазации. При работе с адриамицином исключений быть не должно. Найдите время, чтобы обучить семью питомца, сказав что-то вроде этого: «Без седативных препаратов ваш питомец может отстраниться или бороться во время проведения химиотерапии.Это может привести к тому, что часть препарата выльется за пределы вены. Препарат может вызвать серьезное повреждение тканей, что в конечном итоге может потребовать ампутации ». Лечащий персонал должен проявлять бдительность при принятии решения о том, какие пациенты нуждаются в седации, а какие нет. Процедура седации повлечет за собой дополнительные расходы, но это для самого пациента. Если ваш лечащий врач врач не согласен с вашей рекомендацией по применению седативных средств и вашим внутренним чутьем по поводу сотрудничества с домашним животным, вы должны высказаться и умолять о безопасности питомца.
При использовании адриамицина избегайте ацепромазина, фенотиазинов и препаратов, вызывающих аритмию или вазодилатацию. Авторский R.V.T. Персонал предпочитает использовать комбинацию низких доз домитор-буторфанол-атропин (низкие дозы DBA). Он вводится внутривенно и в обратном направлении с помощью Антезедана ™. Мы считаем эту комбинацию идеальной для большинства здоровых онкологических больных. Многие ветеринары предпочитают использовать Domitor ™ строго в рекомендованной внутримышечной (IM) дозе. Некоторые врачи отдают предпочтение Телазолу для иммобилизации здоровых беспокойных собак.
Животные с сердечными заболеваниями, преклонным возрастом, почечной недостаточностью, печеночной недостаточностью или истощением подвергаются несколько более высокому риску побочных эффектов при применении седативных препаратов. Некоторые лечащие врачи предпочитают использовать комбинацию фентанила (опиоид короткого действия) и мидазолама (бензодиазепин короткого действия) внутривенно. Эта комбинация позволяет избежать брадикардии, которая обычно наблюдается при домиторе. Комбинация буторфанола и диазепама внутримышечно или внутривенно – еще один хороший вариант для пожилых домашних животных, который безопасен и в целом эффективен.Некоторые лечащие врачи считают, что лучшим методом является использование маски или закрытой седации / анестезии с ингаляционной анестезией (севофлуран / изофлуран). Этот метод часто предпочитают гериатрическим больным раком кошачьих. Цель состоит в том, чтобы обезвредить пациента во время приема едких вазосклеротических химиотерапевтических препаратов.
Общение с обезумевшими клиентами
Медперсонал и неопытный лечащий врач могут не полностью осознавать последствия разлива адриамицина.Это понятно, потому что последствия трудно представить, если вы на самом деле не видели дело. Важно не недооценивать проблему клиенту. Вероятно, лучше всего с самого начала описать клиентам наихудший сценарий. Клиента необходимо предупредить о том, что участок, скорее всего, будет очень болезненным, будет опухать, шелушиться и со временем ухудшаться. Объясните клиенту, что повреждение тканей происходит, несмотря на лучшее лечение ран и медсестринский уход.
Страховые компании учат и поощряют врачей извиняться и сочувствовать своим пациентам при возникновении осложнений.Они сообщают меньше жалоб и меньше горечи, когда врач приносит извинения за ухудшение состояния пациента и дискомфорт в связи с осложнениями. Поэтому определенно важно показать свою заботу и сочувствие пациенту и клиенту, извиниться за несчастный случай и решить все проблемы вашего клиента.
По опыту автора, большинство ветеринарных учреждений предлагают нести бремя затрат на поддерживающую терапию при экстравазации. Если клиент подписывает форму информированного согласия на проведение химиотерапии и осложнениях, ваша клиника может принять меры, чтобы разделить стоимость лечения с клиентом приемлемым способом.В форме информированного согласия может конкретно указываться риск экстравазации и возможные расходы для клиента.
Чтобы объяснить клиенту серьезность разлива адриамицина, лечащий техник или лечащий врач может сказать что-то вроде этого: «К сожалению, сегодня во время проведения химиотерапии произошел несчастный случай. Некоторое лекарство просочилось за пределы вены. Это называется «экстравазация» или «разлив». Эта проблема может возникнуть при любой внутривенной инъекции. К сожалению, мы сталкиваемся с большим количеством повреждений тканей и проблем после лечения, когда используем определенные химиотерапевтические препараты, которые по своей природе являются вазосклеротиками.Хотя этот препарат очень хорошо убивает раковые клетки, при прямом контакте с тканями он ведет себя как кислота. Адриамицин – один из самых едких химиотерапевтических препаратов, и он может продолжать безжалостно разрушать ткани, несмотря на все наши усилия. Если повреждение ткани обширное, нам может потребоваться хирургическая обработка раны и, к сожалению, нам, возможно, придется прибегнуть к ампутации, чтобы остановить боль ».
Полное объяснение последствий экстравазации поможет вашим клиентам понять, почему это необходимо успокаивают всех нервных и нервных больных раком, получающих едкие химиотерапевтические препараты, особенно адриамицин.
Слазы экстравазации
Слажи винкристинового типа проявляются в течение первых 1-7 дней. Поврежденная ткань раздражается в течение нескольких дней, после чего на месте образуется некротическая корка. Место разлива на самом деле похоже на жесткую кожу. Когда отмершие ткани отшелушиваются, может появиться язва. В конечном итоге это заживает в течение 6-недельного периода.
Места экстравазации типа адриамицина могут сначала не выглядеть угрожающими. После первых 3–10 дней или даже после второй недели все может показаться обнадеживающим.Необнаруженные адриамициновые выделения обычно становятся клинически очевидными через 7-10 дней. Вид экстравазации кажется опухшим и воспаленным еще на 1-3 недели. К сожалению, при значительном разливе адриамицина область слущивания увеличивается и ухудшается в течение следующих 2-3 месяцев. Некроз тканей может распространяться глубже и обнажать мышцы, сухожилия и кости. Струп (шелушение, образовавшееся в результате термического ожога, коррозионного агента или гангрены) увеличивается и углубляется, что может затруднить лечение вторичных инфекций.
Уход за ребенком может показаться бесполезным, и владельцу домашнего животного очень неприятно размышлять о том, что случилось с его любимым питомцем. Рану нужно ежедневно лечить усердно. Лечащий врач должен обеспечить надлежащий упреждающий контроль боли, чтобы пациенту было максимально комфортно. Для удаления некротической ткани с участка может потребоваться хирургическая обработка раны. Уход за ранами и продукты, выводящие токсины, могут оказать некоторую помощь. Принятие решения об ампутации ноги онкобольному затруднено.Следует принимать во внимание соотношение риска и пользы и прогноз общей выживаемости больного раком. Всегда утешайте клиента и дайте ему понять, что вы разделяете его горе и что никто не хотел, чтобы эта авария произошла.
Предотвращение экстравазации
Дискомфорт и стоимость, описанные выше, должны мотивировать весь ваш профессиональный персонал предотвращать экстравазацию. В кабинете химиотерапии должно быть тихо и не отвлекаться. Медсестры и их помощники должны быть сосредоточены и не должны получать перекрестных указаний или принуждаться к поспешному выполнению процедуры.При установке катетера в вену должна быть чистая палочка. Постоянный визуальный и практический мониторинг места инъекции от начала до конца. Убедитесь, что катетер или игла-бабочка все еще находится в вене на протяжении всего введения каждой капли препарата.
Некоторые онкологи предлагают использование постоянного катетера и разведение адриамицина в небольшом мешочке с физиологическим раствором. Это настаивается в течение 30-45 минут. Эта техника может привести к самым большим экстравазиям.Другие онкологи предпочитают вводить адриамицин внутривенно через хорошо расположенный постоянный катетер одновременно с быстро протекающим физиологическим раствором в течение 15–20 минут. Многие онкологи (в том числе и я) и медсестры онкологи чувствуют себя наиболее комфортно при непосредственном и тщательном наблюдении за каждой каплей адриамицина, вводимой через небольшие катетеры-бабочки (не более 23 размера).
Общая рассчитанная доза адриамицина разводится в шприце объемом 12 см3 стерильным физиологическим раствором до 10 мл для средней кошки.Мы разводим дозу для собак примерно до 1 мл / фунт стерильным физиологическим раствором или стерильной водой для инъекций с использованием шприца на 35 мл для маленьких собак и шприца на 60 мл для крупных собак. Тщательно установленный катетер-бабочка промывают физиологическим раствором. Разбавленный адриамицин вводят при частом оттягивании шприца назад настолько, чтобы увидеть, что кровь всасывается в трубку. Это подтверждает, что катетер остается в правильном положении и не упирается в стенку вены. Мы вводим адриамицин кошкам медленным болюсом в течение 5–7 минут, а собакам – медленной, постоянной скоростью инфузии в течение 15–20 минут.Наши специалисты по химиотерапии считают, что лучше всего применять непосредственный визуальный контроль во время приема препарата. Также полезно использование разбавленных растворов препарата. Выбор пациентов с хорошим поведением и седация капризных пациентов также помогают избежать проблем.
Отличное предложение по предотвращению экстравазации появилось в разделе «Tech Talk» бюллетеня Ветеринарного онкологического общества, Vol. 28-1, весна 2004 г., автор: Jenny Rose, CVT. Роуз рекомендует использовать катетер «бабочка» малого диаметра с трубкой диаметром 12 дюймов.Она прикрепляет трехходовой кран к катетеру и помещает шприц с люэровским замком объемом 12 мл с 0,9% физиологическим раствором для промывания в один порт и химиотерапевтический препарат в другой порт. Промывание до и после введения препарата легко выполняется без переключения с одного шприца на другой. Медсестра химиотерапевта контролирует кровоток путем непрерывной аспирации небольшого количества крови, чтобы проверить размещение катетера в вене в течение всего периода введения препарата.
Лечение экстравазации
Во всех ссылках лечащему персоналу предписывается действовать немедленно при обнаружении разлива.Авторы рекомендуют не удалять катетер, а держать его на месте, чтобы очистить перед удалением. Используйте шприц, чтобы удалить как можно больше лекарства из катетера, трубки и ткани. Достаточно удалить от 5 до 6 мл крови у кошки и 10 мл у собаки. Вставьте иглу 27-го размера в пузырек для разлива и выполните аспирацию как можно большего количества препарата, чтобы минимизировать количество препарата в месте попадания. В некоторых источниках говорится, что нужно вводить «соответствующий антидот» или промывать физиологический раствор через катетер, чтобы разбавить остаточное лекарство.
Пакеты со льдом или холодные компрессы рекомендуются при разливе адриамицина, актиномицина-D и мехлорэтамина на 6–10 часов. Все источники согласны с тем, что на разливы винкристина / винбластина и этопозида следует накладывать теплые компрессы в течение первых 3-4 часов. Эти процедуры рекомендуются для минимизации токсичности везикантного препарата. Цель теплых компрессов – развести лекарство в кровеносной системе. Обратный эффект желателен при холодных компрессах. Обоснование состоит в том, что холодные компрессы предназначены для уменьшения циркуляции и локализации разливов адриамицина для снижения токсичности.
Литературу читать ужасно. Большинство экспертов согласны с тем, что ничто, включая список рекомендуемых «антидотов», таких как дексразоксан (Zinecard®), DHM3, стероиды и гидрофильные повязки на раны, на самом деле не компенсирует разрушительное повреждение тканей от необнаруженных экстравазий антрациклина (семейство адриамицинов). Полезно использовать Zinecard или DHM3, введенные в область в течение 3 часов после аварии. Некоторые онкологи применяют Зинекард внутривенно в 10 раз превышающей дозу адриамицина в течение 3 часов, а также через 24 и 48 часов после разлива.(Vail 2006) Он используется для компенсации кардиотоксичности у людей и стоит примерно 250-350 долларов за флаконы по 250 и 500 мг соответственно.
«Модифицированная техника разрезания укуса змеи Виллалобос»
В начале моей карьеры этот автор и наши штатные онкологи испытывали чувство страха и беспомощности из-за экстравазации адриамицина. Мне было трудно согласиться с тем, что мы должны жить в этой суматохе безнадежности, нависшей над нашей ежедневной онкологической службой. Казалось, что если наши техники собирались каждый день работать с едкими химиотерапевтическими препаратами, нам нужна была более агрессивная процедура, чтобы остановить серьезные проблемы со слущиванием и устранить угрозу для наших пациентов.Чувство обреченности заставило автора придумать план действий на случай непредвиденных обстоятельств. Либо нам пришлось изменить препарат, либо, что еще лучше, удалить каждую каплю лекарства из периваскулярного участка разлива. К сожалению, об этом подходе написано немного. В большинстве учебников говорится, что все, что бы ни было сделано, вероятно, не повлияет на результат. Опыт использования нашей новой техники говорит об обратном. В литературе есть лишь мимолетные упоминания о промывании мест экстравазации физиологическим раствором. Также упоминается осторожность с этой процедурой, так как это может привести к распространению препарата на более глубокую или более широкую область.Казалось разумным разработать более эффективную технику промывания. Мы начали рассматривать каждую утечку едкого наркотика как чрезвычайную ситуацию и как самый страшный укус змеи на земле.
Самое главное, что техник / медсестра, которые наблюдают и / или сообщают о разливе, не испытывают вины или беспокойства. Вместо того, чтобы создавать напряжение в воздухе, мы предлагаем поддержку и благодарность за сообщение о разливе. Происходят несчастные случаи, и гордыня и чувства задеты. Эти личные проблемы необходимо отложить в сторону, чтобы вылечить пациента и избежать проблем, описанных выше.
Мы отсасываем остатки лекарственного средства из катетера и пузыря. Затем мы вводим физиологический раствор в участок, как описано выше. Бригада готовит ногу к хирургическому разрезу. Используя скос стерильной иглы 18-го размера, автор делает от 10 до 30 параллельных прерывистых глубоких разрезов (разрезов) кожи, избегая вены. Мы делаем разрезы для проникновения в периваскулярные ткани SQ в виде «салатного мешочка» или в шахматном порядке параллельными разрезами. Разрезы должны выходить за пределы всего места экстравазации и при необходимости на 360 градусов по всей конечности.Используя ту же технику, которая используется для введения жидкости SQ, пропустите физиологический раствор или раствор изолита по всему участку и вокруг конечности в течение 20-45 минут.
Промойте, промойте и промойте, а затем промойте еще раз, осторожно выдавливая или «доливая» жидкости. Это действие помогает вывести жидкость и опасное лекарство через кожные щели. При более крупных разливах введите иглу 18-го размера в более глубокие части конечности, в мышцы и жир, чтобы жидкость проникла в более глубокие ткани. Это позволяет пузырчатому веществу просачиваться вместе с жидкостями.Будем надеяться, что каждая капля вредного пузырька будет просачиваться через кожные разрезы в разбавленном виде. В одном случае мы видели характерный красный цвет адриамицина при его выходе из ткани. Пропустите один или два литра через место экстравазации за период от 20 до 45 минут, в зависимости от того, какое лекарство было пролито, и от размера пациента. Убедитесь, что весь задействованный персонал носит защитные очки, халаты и перчатки для химиотерапии.
По мнению автора, эта методика активно удаляет опасное везикантное средство с места разлива.Пациент может пойти домой с легким обертыванием и инструкциями для членов семьи по применению холодных компрессов в течение следующих 24 часов. Пациента еженедельно в течение 3 недель проверяют на предмет повреждения тканей, инфекции и заживления разрезов кожи.
Эта техника хорошо зарекомендовала себя у технических специалистов в нашей практике. Мы полностью избежали проблем, связанных с известными экстравазиями любого типа. Использование в вашей практике “модифицированной техники укуса змеи виллалобос” должно дать аналогичный успех.Надеемся, что этот метод повысит доверие персонала и минимизирует осложнения для ваших пациентов, их семей и вашей практики.
Ссылки
Kisseberth, W.C., MacEwen, E.G., Осложнения рака и их лечение, Глава 14, Клиническая онкология мелких животных, 3-е изд., S.J. Уитроу и Э. MacEwen, Eds., W.B. Saunders Co., 2001, стр. 198-219.
Моррисон, У. Б., Принципы лечения химиотерапией
Осложнения, Глава 25, Рак у собак и кошек, 2-е изд., W.B. Моррисон, Эд., Тетон Нью Медиа, 2002, стр. 365-374.
Вейл, Д.М. и др., Консенсусный документ: Общие терминологические критерии ветеринарной кооперативной онкологической группы для нежелательных явлений (VCOG-CTCAE) после химиотерапии или биологической противоопухолевой терапии у собак и кошек, Ветеринарная и сравнительная онкология, Vol. 2, No. 4, 2004, p194-213.
Вейл Д.М., Новые поддерживающие методы лечения онкологических больных. Материалы 24-го Ежегодного форума ACVIM, 2006 г.
Вильялобос, А.(личный опыт с 1975 г. по настоящее время)
Вильялобос, А.Е., Побочные эффекты терапии рака у гериатрических домашних животных, Глава 6D, Гериатрическая онкология собак и кошек, уважающая связь человека и животного, издательство Blackwell Publishing, будет выпущено в 2006 году.
Идентификация внутрибрюшные лимфатические сосуды в тушах собак методом лапароскопической флуоресцентной лимфографии с внутрикожным и внутрипоплитеальным введением ИКГ
Аннотация
Цель
Оценить возможность лапароскопической флуоресцентной лимфографии (LFL) с использованием индоцианинового зеленого (ICG) посредством внутрикожного (ID) или интраплитеального (IPP) введения на модели ex vivo на собаках.
Методы
Шесть размороженных туш взрослых самцов собак были помещены в положение Тренделенбурга после размещения трех хирургических портов при триангуляции. ICG (0,5 мг / мл; 0,05 мг / кг) вводили пяти тушам (одна туша была пилотной) через ID в левом туловище и IPP (правое положение, хирургический доступ) для окрашивания лимфатических путей и медиальной подвздошной кости. лимфатический узел (MILN). Оценивали качество флуоресценции, время окрашивания, окрашенные структуры и гистопатологию лимфатических узлов.Также оценивалось окрашивание грудного протока.
Результаты
ВведениеID показало окрашивание частей лимфатического пути подвздошно-крестцового лимфатического центра во всех случаях с использованием однократной дозы ICG, с визуализацией левой MILN в четырех тушах. Введение IPP показало окрашивание правого MILN во всех случаях при использовании однократной дозы в четырех тушах. В одном случае ICG достигла грудного протока. Два пути введения показали аналогичные результаты с точки зрения требуемого объема ICG, времени окрашивания и качества визуализации, хотя IPP был более эффективным при окрашивании MILN.
Выводы
Это исследование подтверждает возможность окрашивания подвздошно-крестцового лимфатического центра (в основном MILN) с помощью LFL в оттаявших тушах собак с помощью ID или IPP введения ICG. Однако путь IPP показал большую эффективность в окрашивании MILN.
Образец цитирования: Sánchez-Margallo FM, Veloso Brun M, Sánchez-Margallo JA (2020) Идентификация внутрибрюшных лимфатических сосудов в тушах собак с помощью лапароскопической флуоресцентной лимфографии с внутрикожным и интраполитическим введением ICG.PLoS ONE 15 (11): e0241992. https://doi.org/10.1371/journal.pone.0241992
Редактор: Цзянь Сюй, Университет штата Луизиана, США
Поступила: 25 апреля 2020 г .; Одобрена: 24 октября 2020 г .; Опубликован: 12 ноября 2020 г.
Авторские права: © 2020 Sánchez-Margallo et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах вспомогательной информации.
Финансирование: Эта работа частично финансировалась Хунта де Эстремадура (Испания), Европейским фондом регионального развития (ERDF) (GR18199, TA18023) и Национальным советом по научному и технологическому развитию (CNPq; 200346 / 2017- 2; 305876 / 2018-0).
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Хирургия лимфатических протоков и лимфатических узлов у собак приобретает все большее значение из-за ее важности для определения стадии, прогноза и лечения злокачественных новообразований [1, 2], а также ее применения для демаркации грудного протока и его ветви для лечения хилоторакса [3]. Кроме того, учитывая установленную роль лимфаденэктомии при онкологических заболеваниях с участием различных медико-хирургических специальностей, необходимы дальнейшие исследования лимфатических путей и окрашивания лимфатических узлов у собак для улучшения развития и результатов этой процедуры.
Лимфатические красители, используемые у собак, включали заполненные октафторпропаном липидные микросферы [4], патент синий V [5], патент синий плюс технеций [6], метиленовый синий [7, 8], изосульфановый синий [9], гемосидерин плюс технеций [6], иопамидол [3, 10], индоцианиновый зеленый (ICG) [3] и ICG плюс метиленовый синий [3]. Использование ICG в качестве прямого флуоресцентного маркера ближнего инфракрасного диапазона в видеохирургии все еще исследуется на собаках. Однако он показал применимость для интраоперационной идентификации гепатоцеллюлярной карциномы при лапаротомии [11], анализа кровоснабжения при аноректальной аутотрансплантации [12], идентификации сосудов и проходимости трансплантата при роботизированном эндоскопическом шунтировании коронарной артерии [13], идентификации лимфатических протоков. во время торакоскопической перевязки грудного протока [3], обнаружения сторожевых лимфатических узлов в слизистой оболочке полости рта [14], а также при лимфографии и лимфангиографии при переносе васкуляризированных лимфатических узлов [9].
ICG часто вводят внутривенно [11–13], через подколенный лимфатический узел (с хирургической диссекцией или без нее) и брыжеечные лимфатические узлы [3], подкожно (SC) вокруг ануса [15], в подслизистую оболочку щеки [14]. ] и внутрикожно [9, 16].
Предыдущее исследование на собачьих моделях ex vivo показало, что внутрикожное (ID) введение ICG позволяет идентифицировать поверхностную лимфатическую систему в оттаявших тушах собак [17]. Другое исследование продемонстрировало, что внутриматочное введение лакированного синего с помощью открытого подхода позволяет окрашивать медиальные подвздошные лимфатические узлы (MILN) в свежих тушах собак [5].Основываясь на сообщенной эффективности окрашивания ICG на моделях собак ex vivo, мы предположили, что использование ICG в лапароскопической ближней инфракрасной флуоресцентной лимфографии также может быть возможным способом окрашивания брюшных и / или тазовых лимфатических протоков и MILN в оттаявших тушах собак. . Подтверждение этой гипотезы может предоставить новые возможности для дальнейшего развития анатомических и хирургических исследований на моделях собак ex vivo с использованием флуоресцентной лимфографии.
Целью этого исследования было оценить возможность лапароскопической флуоресцентной лимфографии (LFL) с использованием ICG посредством ID или интраплитеального (IPP) введения на модели ex vivo на собаках.Насколько нам известно, это первое исследование, изучающее эту возможность, демонстрирующее эффективность окрашивания узлов подвздошно-крестцового лимфатического центра посредством введения ICG через IPP или ID в туловище размороженных туш собак.
Материалы и методы
В настоящем исследовании использовались шесть размороженных туш самцов собак породы бигль, подвергнутых эвтаназии для целей, отличных от данного исследования. Животные, использованные в этом исследовании, были повторно использованы из предыдущих обучающих или исследовательских исследований, которые были одобрены Этическим комитетом и учреждением по уходу за животными Центра минимально инвазивной хирургии (MISCJU).Первая туша (C1) использовалась в качестве пилотного исследования. У всех животных брили вентральную область брюшной полости, левый торс, правую грудную клетку и правую область подколенных лимфатических узлов.
Для каждого животного в положении лежа на спине делали кожный разрез в пупочном рубце для инсуффляции брюшной полости лекарственным CO 2 (12 мм рт. Ст. При 5 л / мин) с использованием модифицированной техники Хассона. 11-миллиметровый троакар (Versaport; Covidien, Дублин, Ирландия) был введен через этот хирургический порт доступа, а две другие канюли, 11 мм и 5 мм (Versaport; Covidien), были помещены в триангуляцию с первым троакаром (рис. 1A).Затем каждую тушу помещали в положение Тренделенбурга с поворотом живота вправо, открывая левый бок для внутрикожного введения ICG в туловище. Полость брюшины промывали 0,9% раствором NaCl. Впоследствии промывная жидкость и остаточная кровь были аспирированы. Каждой собаке 0,05 мг / кг ICG (Verdye, 5 мг / мл, Diagnostic green GmbH, Aschheim, Germany) разводили в 0,9% NaCl до 0,5 мг / мл и вводили через ID в различных точках слева. область туловища (рис 2).Туловище массировали непрерывно, в то время как интраабдоминальная область, соответствующая лимфатическим путям и MILN, оценивалась лапароскопией. Оптика 10 мм и 0 градусов, соединенная с видеосистемой (Image1 Spies TC 200; Karl Storz SE & Co. KG, Туттлинген, Германия) и источником света (SCB D-light P; Karl Storz SE & Co. KG ) использовались для оценки люминесценции. Ксеноновый источник света излучает возбуждающий свет как в видимом, так и в ближнем ИК-диапазоне с длиной волны от 690 нм до 790 нм. Все процедуры были записаны для дальнейшей оценки времени окрашивания и результатов трансоперационных операций.
Для IPP-введения ICG доступ к правой подколенной ямке всех животных осуществлялся путем кожного разреза и тупого рассечения, чтобы обнажить лимфатический узел с минимальным рассечением прилегающей жировой ткани для уменьшения вмешательства в лимфатический путь (рис. 2). Была введена та же доза ICG, что и при ID-способе. Введение было медленным и осуществлялось импульсами, как описано ранее [3]. Выполнялись непрерывный массаж, сгибание и разгибание правой тазовой конечности.
Еще одна доза ICG вводилась каждые 15 минут и до четырех дополнительных доз вводили обоими путями в отсутствие флуоресценции. В течение всего периода оценки (до 15 минут после приема последней дозы) учитывались наличие или отсутствие лимфатического пути и окрашивание MILN, а также наличие других брюшных или тазовых лимфатических / микролимфатических узлов с учетом предыдущего анатомического описания [ 18]. Степень окрашивания каждой структуры оценивалась от 0 до 3 [3] (Таблица 1), а диапазон времени окрашивания – от I до V (Таблица 2).Когда окрашивалось более одного MILN, учитывали только время окрашивания первого. Для описания интраоперационных результатов было рассмотрено шесть трупов. Однако пять туш, подвергнутых той же дозе ICG (C2-C6), были рассмотрены для статистического анализа общего объема ICG, времени окрашивания и качества окрашивания.
Через пятнадцать минут после последнего введения ICG (правая сторона) были собраны двусторонние лимфатические узлы с использованием лапароскопического доступа, и образцы были помещены в отдельные флаконы для гистологического анализа.Впоследствии пять из шести трупов были помещены в положение лежа на груди для торакоскопической оценки окрашивания грудного протока. В пилотном исследовании (C1) торакоскопия выполнялась перед лимфаденэктомией. Для проведения торакоскопии два троакара 10,5 мм (Thoracoport; Covidien) и троакар 5 мм (Vesaport; Covidien) были помещены между 7-м и 10-м правыми межреберными промежутками (рис. 1B). Плевру средостения иссекали для выявления флуоресценции грудного протока.
Для сравнения объемов ICG, времени окрашивания и качества визуализации между путями введения (ID и IPP) использовались тестыWilcoxon со знаком ранговых рангов.Все статистические анализы были выполнены с использованием R версии 3.6.1 (R Foundation for Statistical Computing, Вена, Австрия). Результаты представлены в виде средних значений и стандартного отклонения. Для всех тестов статистически значимым считалось p <0,05.
Результаты
C1 использовался в качестве экспериментального для проверки возможности прямой флуоресценции ICG с помощью видеохирургии на размороженном туше собаки. Расчетный вес этого животного составлял 25,0 кг, а доза ICG составляла> 0,06 мг / кг. После подтверждения двустороннего лимфатического пути и окрашивания MILN в пилотном исследовании все оставшиеся тушки (C2 – C6) были взвешены после размораживания и непосредственно перед операциями.Средний вес этих туш составлял 15,9 ± 4,2 кг (16,5–22,0 кг). Результаты трансоперационных операций представлены в таблицах 3 и 4.
Таблица 3. Распределение структур, визуализированных LFL при внутрикожном введении ICG в туловище размороженных туш собак (C1 – C6), в зависимости от дозы ICG (0,05%), времени окрашивания и качества визуализации.
https://doi.org/10.1371/journal.pone.0241992.t003
Таблица 4. Распределение структур, визуализированных LFL при интраплитеальном введении ICG в туши размороженных собак (C1 – C6) в соответствии с дозой ICG (0.05%), время окрашивания и качество визуализации.
https://doi.org/10.1371/journal.pone.0241992.t004
Не наблюдалось статистически значимых различий в объеме ICG между способами введения ID и IPP (0,056 ± 0,018 против 0,06 ± 0,021 мг / кг; p = 0,73) как для внутрибрюшных лимфатических сосудов, так и для окрашивания MILN. Кроме того, оба подхода имели среднюю временную классификацию II и качество окрашивания 2. MILN окрашивали во всех случаях с помощью введения IPP, но только в трех случаях с помощью ID (рис. 3-5).Таким образом, введение IPP было более эффективным, чем введение ID при окрашивании MILN. Путь введения IPP требовал аналогичного объема ICG (ID: 0,067 ± 0,029 мг / кг; IPP: 0,06 ± 0,022 мг / кг; p = 0,84) и времени для окрашивания MILN (ID: III; IPP: II; p = 0,64), чем для ID. Напротив, введение IPP было технически сложнее, чем соответствующее ID, и требовало хирургического доступа для введения ICG.
Рис. 3.
Лапароскопическая флуоресцентная лимфография (LFL) в туше 1 (C1) (A-D), C2 (E-H) и C3 (I-L).В пунктах A, B, C, E и F индоцианин зеленый (ICG) вводился внутрикожно в туловище. В D, G, H, I, J, K и L управление ICG осуществлялось через IPP. Синим пятном показан средний подвздошный лимфатический узел (MILN) (белые стрелки) и / или эфферентные лимфатические пути (зеленые стрелки). В C1 левые эфферентные лимфатические сосуды (A) и левый MILN (B) окрашиваются при входе в брюшную полость вместе с глубокими огибающими подвздошными сосудами. Показаны два левых MILN (C) и один правый MILN (D). Эфферентные лимфатические пути без (E) и с (F) фильтрацией ближней инфракрасной флуоресценции и правым MILN без (G) и с (H) фильтрацией ближней инфракрасной флуоресценции видны на C2.В C3 правый MILN (I, J и L) и лимфатические протоки (K, с зелеными узлами) сообщаются с левым MILN (не окрашенным). (L) показывает афферентный лимфатический сосуд (красная стрелка) к цистерне хили. Во всех тушах флуоресценция ICG улучшила (или позволила) визуализацию MILN и лимфатических путей. UR = мочеточник.
https://doi.org/10.1371/journal.pone.0241992.g003
Рис. 4.
Лапароскопическая флуоресцентная лимфография (LFL) туши 4 (C4) (AD), C5 (EH) и C6 (IL) .В A, B, E, F, I и J индоцианин зеленый (ICG) вводили внутрикожно в туловище. В C, D, G, H, K и L управление ICG осуществлялось через IPP. Синий цвет показывает средний подвздошный лимфатический узел (MILN) и / или эфферентные лимфатические пути. В C4 левый MILN показан без (A) и с (B) фильтрацией флуоресценции в ближней инфракрасной области. Правый MILN показан без (C) и с (D) фильтрацией флуоресценции в ближней инфракрасной области. В C5 введение IPP ICG не окрашивало левый MILN, но окрашивало эфферентные лимфатические пути (E и F).Правый MILN показан без (G) и с (H) фильтрацией флуоресценции в ближней инфракрасной области. В C6 флуоресценция ICG усиливала идентификацию MILN и лимфатических путей (I-L). UR = мочеточник; DC = нисходящее двоеточие.
https://doi.org/10.1371/journal.pone.0241992.g004
Рис. 5.
Левый медиальный подвздошный лимфатический узел (MILN) во время лапароскопической лимфаденэктомии без (A) и с (B) фильтрацией флуоресценции в ближнем инфракрасном диапазоне каркас 1 (С1). В C2, в то время как левый MILN не окрашивается (C), но окрашиваются лимфатические сосуды, сообщающие между правым и левым MILN (D).В C6 правый внутренний подвздошный лимфатический узел (IILN R ) был локализован при лапароскопической визуализации (E, пунктирная окружность), но не окрашен. В C5 IILN R был окрашен после интраплитеального (IPP) введения индоцианинового зеленого (ICG) (F), что позволило локализовать его и провести лимфаденэктомию с помощью лапароскопии (G). В C6 каудальная полая вена (H) была окрашена (I) после введения IPP ICG. C2 был единственной тушей, в которой грудной проток (J) был окрашен (K) с помощью ICG. Лапароскопическая флуоресцентная лимфография (LFL) с использованием ICG позволяет легко идентифицировать грудной проток (L и M) для окклюзии с помощью титановых зажимов.DI = диафрагма.
https://doi.org/10.1371/journal.pone.0241992.g005
В большинстве случаев внутрилимфонодальное введение занимало менее 10 минут (классификация II) для окрашивания внутриполостного афферентного лимфатического пути (4/5) и правого MILN. (3/5). Введение ID позволило визуализировать люминесценцию в афферентных лимфатических сосудах менее чем за 10 мин (5/5) (фиг. 3F и 4F). ID привел к окрашиванию MILN в трех случаях (3/5), два из которых получили дозу ICG, равную 0.05 мг / кг (C4 и C5) и время окрашивания менее 10 мин.
Что касается гистологического анализа, 62,5% образцов, взятых из туш, были идентифицированы как лимфатические узелки при введении как ID, так и IPP ICG (Таблица 5). Два образца, собранные после введения IPP, были классифицированы как сомнительно-отрицательные (рис. 6). Они были идентифицированы как фрагменты фиброваскулярной ткани и как жировая и фиброзная ткань, соответственно, без видимой клеточности.
Рис 6.Гистологические срезы.
(a) Фрагмент фиброваскулярной ткани с артефактами с участками аморфного гранулярного фона, кристаллами меатеина и в отсутствие идентифицируемой клеточности. (b) Трабекулярная жировая и фиброзная ткань с аморфным узловатым агрегатом с небольшим количеством идентифицируемых гемофагоцитарных клеток.
https://doi.org/10.1371/journal.pone.0241992.g006
Что касается длительности флуоресценции ICG, то сначала ее вводили через ID, а затем каждые 15 минут вводили новые, если не было окрашивания в покинул MILN.Контралатеральное свечение все еще было очень очевидным в конце оценки правого MILN. Лимфаденэктомия была произведена через 66–113 мин (> 88,2 ± 17,0 мин) после первоначального введения ICG, при этом во всех случаях сохранялось свечение лимфатических сосудов и MILN. В единственном случае (C2), в котором был окрашен грудной проток, эта структура была идентифицирована через 37 мин инъекции IPP (рис. 5J – 5M).
Обсуждение
Результаты этого исследования подтвердили возможность окрашивания лимфатических путей и лимфатических узлов подвздошно-крестцового лимфатического центра (брюшной и тазовой) в оттаявших тушах собак с использованием прямой ближней инфракрасной флуоресценции с ИКГ при лапароскопии.Эти результаты расширяют возможности анатомических исследований и обучения методам видеохирургии с участием лимфатической системы собак без использования моделей in vivo.
Насколько нам известно, ни в одном исследовании не сообщалось о времени окрашивания MILN в модели собак ex vivo по люминесценции с использованием ICG, вводимого через ID или IPP. Предыдущее исследование показало, что подколенная аппликация ICG у собак требовала <10 минут (классификация по времени: II) для окрашивания грудного протока у всех животных, у которых этот путь был эффективен (7/11).У большинства этих животных (4/7) время окрашивания составляло 2–5 мин [3]. Enwiller et al. применяли метиленовый синий через IPP для эффективного окрашивания грудного протока у 6/10 животных через 5 минут после введения [7]. При подкожном введении иопамидола вокруг ануса в течение следующих 10 минут наблюдалось окрашивание средостенных лимфатических узлов [15]. При чрескожном обнаружении сторожевых лимфатических узлов в слизистой оболочке полости рта ипсилатеральный нижнечелюстной лимфоцентр визуально определялся в течение 4–15 мин [14].
Учитывая начальное время окрашивания лимфатических путей и MILN, результаты этого исследования подтвердили, что флуоресценция в ближнем инфракрасном диапазоне с использованием ICG при лапароскопии также позволяет проводить быструю внутриполостную лимфографию оттаявших туш собак. Это наблюдение, вместе с результатами лимфографии метиленового синего и IPP введения ICG собакам [3, 7], привело нас к мысли, что время окрашивания MILN двумя тестируемыми путями (ID и IPP) может быть даже ниже in vivo. моделей, чем в тушах.Факторы, присутствующие в тушах, такие как вмешательство в процесс замораживания и оттаивания, обезвоживание и возможное препятствие лимфатической сети из-за автолиза или присутствия кристаллов льда, не будут существовать у живых животных.
Поскольку это было экспериментальное исследование, оно было сосредоточено на установлении времени свечения каждой структуры отдельно, что не имело бы такого значения в клинической практике, поскольку целью было бы окрашивание сторожевого лимфатического узла (ов) для облегчения лимфаденэктомии и, таким образом, , улучшить качество хирургического вскрытия.Правильное окрашивание сторожевых лимфатических узлов повысит вероятность их удаления без вторжения в капсулу и уменьшения повреждений прилегающих структур. Кроме того, подходящее окрашивание позволит идентифицировать другие лимфатические узлы, связанные с целевым лимфатическим центром. Наши результаты относительно продолжительности окрашивания ICG в лимфатических узлах и лимфатических путях подтверждают долговременную характеристику флуоресценции ICG с использованием лапароскопического ближнего инфракрасного света у собак.
По качеству окрашивания оценка 2 была достигнута во всех случаях с окрашенными структурами (лимфатические сосуды или лимфатические узлы), что идеально для лимфаденэктомии.Пятно имеет тенденцию распространяться на соседние ткани, уменьшая четкость краев сосудов и лимфатических узлов и иногда достигая 3-й степени по оценочной шкале. Этот образец распространения через лимфатическую ткань не может быть воспроизведен у живых пациентов, поскольку в этом исследовании использовались ткани, которые утратили некоторую целостность. Однако эти данные позволяют предположить, что после достижения желаемого окрашивания лимфатических узлов лимфаденэктомию не следует откладывать.
Что касается объема ICG, для большинства туш (C2 – C4) потребовалась только одна доза в подколенный лимфатический узел для окрашивания правого внутреннего подвздошного лимфатического узла (IILN).Только C5 потребовалось три дозы для визуализации. Один такой лимфатический узел также был идентифицирован в C6, но не был окрашен. Использование аналогичных или больших объемов ICG через ID в шести проанализированных тушах не позволяло наблюдать за другими тазовыми лимфатическими узлами из подвздошно-крестцового лимфатического центра (медиальные крестцовые, латеральные крестцовые и внутренние подвздошные лимфатические узлы) [18–20]. что идентификационный маршрут не подходил для визуализации этих структур в тушах собак. Основываясь на предыдущих открытиях лимфатических путей от кожи к брюшной / тазовой лимфатической системе у собак [17, 21], введение IGG через ID в ягодичную область у основания хвоста может позволить идентифицировать другие лимфатические узлы в подвздошно-крестцовом отделе. лимфатический центр.Для проверки этой гипотезы необходимы дальнейшие исследования туш.
Подколенный тракт отводится к MILN [17, 18]. Однако этот способ введения может потребовать хирургического доступа [3] и технически сложнее, чем введение ID. Кроме того, область туловища в тушах собак также стекает непосредственно в соответствующий MILN [17, 21]. Мы подтвердили этот вывод на всех тушах в нашем исследовании. Это наблюдение демонстрирует возможность клинического применения этого метода у пациентов, у которых лимфаденэктомия данного лимфатического узла показана в качестве дополнительного лечения или для определения прогноза определенных типов новообразований.MILN получает эфферентные лимфатические сосуды от кожи дорсальной брюшной стенки; кожа таза; брюшная мышца; мышца и кость задней конечности; тазовые и поясничные мышцы; толстая кишка, простата, прямая кишка, анус, влагалище, яички, мочеточник, лимфатические узлы (поверхностные и глубокие паховые, левая колика, крестцовая и внутренняя подвздошная кость), мочевой пузырь и уретра, среди других тканей [18]. МИЛН является стражем в поясничной области и последним лимфатическим узлом перед оттоком в венозное кровообращение [21].MILN также может получать дренаж из грудных цепей [22]. Более того, MILN может метастазировать из новообразований молочной железы у самок собак, не увеличиваясь в размерах [1].
Подтверждая наблюдения из предыдущих исследований [22], мы наблюдали связи между MILN на каждой стороне в трех из шести туш (C1, C2 и C4), что указывает на то, что окрашивание лимфатических сосудов с одной стороны может напрямую мешать другой (рис. 5D). ). Этот факт может затруднить точное определение времени, необходимого для люминесценции в каждой MILN отдельно.Это открытие также указывает на то, что у собак контралатераль также может быть поражена при наличии метастатического поражения одного из MILN.
Результаты этого исследования показали, что введение ICG через ID в туловище позволило быстро обнаружить флуоресценцию в лимфатическом пути, связанном с MILN в тушах собак. В настоящее время существует разрыв между введением ICG в туши собак и у живых пациентов, у которых идеальная доза / кг и концентрация ICG еще не установлены для введения через ID.Suami et al. использовали 0,2 мл 0,25% ICG у двух собак и не сообщали об ассоциированных осложнениях [9]. Однако Соуза и др. вводили ICG через ID (1% ICG; 0,5 мл для самок собак <15 кг и 1 мл для> 15 кг) шести животным, сообщая о значительной местной заболеваемости, включая некроз кожи и отек кожи и эритему (соответствует гиперчувствительности IV типа. ), потребовавшего лечения [16]. Поскольку настоящее исследование было направлено на сравнение двух путей введения (ID и IPP), доза по умолчанию была выбрана для введения через IPP [3].
Положение каркаса и размещение хирургического порта для лапароскопической лимфаденэктомии отличались от описанных ранее на модели собаки [19, 20]. В настоящем исследовании триангуляция троакаров в вентральной средней линии (около пупочного рубца) вместе с позой Тренделенбурга позволила нам завершить исследование брюшной и тазовой полостей в области, соответствующей подвздошно-крестцовому лимфатическому центру, из которых MILN является частью [18–20]. Поскольку мы полагали, что в дополнение к MILN могут быть обнаружены другие узлы / микролимфатические узлы, было выбрано положение спинного пролежня, чтобы предоставить больше рабочего пространства для двусторонних обследований и экстракций, поскольку боковой доступ не позволял идентифицировать контралатеральный MILN [19]. .Триангуляция, предложенная для хирургических портов, отличалась от предложенной Lim et al. [20], у которых один из троакаров был помещен в паховую область. В настоящем исследовании три троакара размещались краниально по отношению к MILN для уменьшения инструментальных движений зеркала.
Предыдущее исследование на собачьей модели in vivo показало, что подколенный путь позволяет флуоресценции грудного протока у 7/11 животных с хилотораксом [3]. В настоящем исследовании флуоресценция грудного протока также наблюдалась в одной туше (C2) (рис. 5J – 5M).Несколько факторов могут помешать достижению ICG грудного протока в оставшихся оттаявших тушах собак. Однако методология, использованная для этого исследования, не позволяет нам определить причину этого. Поскольку целью исследования было окрашивание подвздошно-крестцового лимфатического центра, доза / концентрация ICG через IPP не увеличивалась в поисках грудного протока. Однако окрашивание грудного протока в одной размороженной туше собаки также открывает новую возможность с точки зрения использования моделей ex vivo для тренировки окклюзии грудного протока у собак.
Что касается наблюдаемых осложнений, то во время лимфаденэктомии каркаса C2 случайно был сделан разрез левого мочеточника. Анализ записанных лапароскопических видео показал, что свечение рассредоточилось в результате резекции правой МИЛН. Также было замечено, что поиск лимфатической ткани проводился очень близко к шейке мочевого пузыря, и сбор проводился с явно недостаточной осторожностью, отдавая приоритет большой резекции окрашенной жировой ткани.После этого было проведено тщательное тупое рассечение окрашенных структур с целью их гистологического исследования, всегда проверяя положение мочеточника и постоянно меняя тип освещения операционного поля (инфракрасный свет и нормальный свет). Кроме этого случая, других случаев поражения мочеточника или крупных сосудов не обнаружено.
В туше C6 внутривенная флуоресценция наблюдалась в сосудах таза и брюшной полости, включая наружные подвздошные и полые сосуды (рис. 5H и 5I).Причину установить не удалось, но мы полагаем, что это произошло из-за экстравазации ICG в перинодальные ткани или неправильного внутривенного введения, поскольку у этого животного лимфатический узел был маленьким, и его нужно было проколоть как минимум три раза.
Это исследование имеет некоторые ограничения, такие как ограниченный размер выборки, который будет учтен в будущих исследованиях в этой области. Кроме того, оценка флуоресценции ICG в оттаявших тушах собак имеет некоторые ограничения из-за природы этого образца.На адекватное окрашивание лимфатических узлов могут влиять несколько факторов, включая качество процесса оттаивания, проницаемость лимфатического пути и автолиз / разложение туши. Факторы, включая массаж места введения ICG, объем ICG, анатомические характеристики лимфатического пути и лимфатических узлов и количество жировой ткани у пациента, также могут влиять на время лимфатической флуоресценции, правильную идентификацию лимфатических узлов и восприятие точного времени окрашивания.Хотя ближний инфракрасный свет может проникать на несколько миллиметров [23], количество жировой ткани, покрывающей лимфатический путь, может затруднить визуализацию его небольших ответвлений, как это видно на C5 и C6 в нашем исследовании. Мы полагаем, что люминесценция присутствовала в этих двух тушах задолго до того, как она была обнаружена. Однако после удаления покрывающей его жировой ткани можно было увидеть только часть лимфатического сосуда. Поскольку одной из целей этого исследования было оценить окрашивание лимфатических узлов без необходимости рассечения тканей (в основном MILN), мы не можем исключить возможность того, что некоторые лимфатические узлы были окрашены, но не идентифицированы.Несмотря на ограничения, связанные с моделью, наши результаты свидетельствуют о потенциальном применении этих методов в анатомических, экспериментальных и клинических исследованиях, включающих видеохирургическую оценку лимфатических путей и лимфатических узлов с помощью люминесценции ICG в оттаявших тушах собак. Насколько нам известно, это первое исследование, демонстрирующее эффективность лапароскопической оценки подвздошно-крестцового лимфатического центра с помощью люминесценции ICG через ID или IPP.
Выводы
Введение как ID, так и IPP ICG позволило провести лапароскопическую флуоресцентную лимфографию подвздошно-крестцового лимфатического центра в оттаявших тушах собак.Однако администрирование ICG через IPP было более эффективным.
Ссылки
- 1. Феранти Дж.П.С., Корадини Г.П., Линьярес М.Т., Хартманн Х.Ф., Кампос Р.В., Оливейра М.Т. и др. Подвздошная лимфаденэктомия после внутриутробного картирования у суки с новообразованием груди. Acta Scient Vet. 2018. 46 (Дополнение 1): 273. 1–4.
- 2. Szczubial M, Lopuszynski W. Прогностическое значение статуса регионарных лимфатических узлов при карциномах молочной железы собак. Vet Comp Oncol. 2011; 9 (4): 296–303.pmid: 22077411
- 3.
Стеффи MA, Mayhew PD. Использование прямой флуоресцентной лимфографии в ближнем инфракрасном диапазоне для торакоскопической идентификации грудного протока у 15 собак с хилотораксом. Vet Surg. 2017; 00: 1–10. pmid: 2
90
- 4. Гелб Х.Р., Фриман Л.Дж., Роледер Дж.Дж., Синдер П.В. Возможность проведения биопсии сторожевых лимфатических узлов под контролем УЗИ с контрастированием у собак. Vet Radiol Ultrasound. 2010; 51 (6): 628–633. pmid: 21158235
- 5. Justino RC, Cardoso GS, Trautwein LGC, Dessunti GT, Oliveira DV, Bernardes R и др.Лимфангиография матки: сравнение двух методов определения местоположения медиального подвздошного лимфатического узла. Бюстгальтеры Pesq Vet. 2014; 34 (11): 1121–1126.
- 6. Pinheiro LGP, Oliveira Filho RS, Vasques PHD, Filgueira PHO, Aragão DHP, Barbosa PME и др. Гемосидерин. Новый маркер для идентификации сторожевых лимфатических узлов. Acta Cir Bras. 2009; 24 (6): 432–436. pmid: 20011826
- 7. Энвиллер TM, Радлинский М.Г., Мейсон Д.Е., Руш Дж.К. Инъекция метиленового синего в подколенные и брыжеечные лимфатические узлы для окрашивания грудного протока у собак.Vet Surg. 2003; 32: 359–364. pmid: 12865998
- 8. Соуза Ф.В., Брун М.В., Нарди А.Б., Хуппес Р.Р., Квартерон С, Рапозо ТММ и др. Linfadenectomia laparoscópica em cadela com neoplasma mamario. Cienc Rural. 2013; 43 (4): 750–753.
- 9. Суами Х., Скаглиони М.Ф., Диксон К.А., Портной Р. Взаимодействие между переносом васкуляризированных лимфатических узлов и лимфатическими сосудами реципиента после лимфодиссекции – пилотное исследование на модели собак. J Surg Res. 2016; 204 (2): 418–427 pmid: 27565078
- 10.Суга К., Карино Ю., Фудзита Т., Окада М., Каваками Ю., Уэда К. и др. Лимфатическая карта дренажа кожи с интерстициальной мультидетекторной компьютерной томографической лимфографией с использованием иопамидола: предварительные результаты. Лимфология. 2007; 40 (2): 63–73. pmid: 17853616
- 11. Иида Дж., Асано К., Секи М., Исигаки К., Тешима К., Йошида О. и др. Интраоперационная идентификация гепатоцеллюлярной карциномы собак с помощью флуоресцентной визуализации индоцианинового зеленого. J Small Anim Pract. 2013; 54 (11): 594–600.pmid: 24580016
- 12. Араки Дж., Нисидзава Ю., Накамура Т., Сато Т., Наито М., Фуджи С. и др. Разработка модели аноректальной аутотрансплантации собак на основе кровоснабжения: предварительный отчет о клиническом случае. PLoS One. 2012; 7 (9): e44310. pmid: 22970198
- 13. Хассан М., Кердок А., Энгель А., Герш К., Смит Дж. М.. Флуоресцентная визуализация в ближнем инфракрасном диапазоне с помощью ICG в хирургии TECAB с использованием хирургической системы da Vinci Si на модели собаки. J Card Surg. 2012; 27 (2): 158–162.pmid: 22372818
- 14. Таунсенд К.Л., Милованцев М., Браха С. Возможность использования флуоресцентной визуализации в ближнем инфракрасном диапазоне для оценки сторожевых лимфатических узлов полости рта у здоровых собак. Am J Vet Res. 2018; 79 (9): 995–1000. pmid: 30153060
- 15. Иванага Т., Токунага С., Момои Ю. Лимфография грудного протока путем подкожной инъекции контрастного вещества собаке с хилотораксом. Open Vet J. 2016; 6 (3): 238–241. pmid: 27995081
- 16. Соуза Ф.В., Брун М.В., Феранти Дж.П.С., Оливейра М.Т., Копат Б., Баумер С. и др.Лапароскопическая пахово-подвздошная лимфаденэктомия после окрашивания с использованием различных лимфатических маркеров у здоровых собак. Cienc Rural. 2016; 46 (9): 1629–1634.
- 17. Суами Х., Ямасита С., Сото-Миранда М.А., Чанг Д.А. Лимфатические территории (лимфосомы) у собак: модель на животных для исследования послеоперационных лимфатических изменений. PLoS One. 2013; 8 (7): e69222. pmid: 23894435
- 18. Bezuidenhout AJ. Лимфатическая система. В: Эванс Х. Э., редактор. Анатомия собаки Миллера.3-е изд. Филадельфия: W.B. Компания Сондерс; 1993. С. 717–757.
- 19. Стеффи М.А., Дэниел Л., Мэйхью П.Д., Аффолтер В.К., Соарес Дж. Х., Фуллер М.С. Лапароскопическая экстирпация медиальных лимфатических узлов подвздошной кости у нормальных собак. Vet Surg. 2015; 44 (добавление 1): 59–65. pmid: 24899462
- 20. Лим Х, Ким Дж., Ли Л., Ли А., Чжон Дж., Ко Дж. И др. Двустороннее иссечение медиального подвздошного лимфатического узла вентральным лапароскопическим доступом: описание методики. J Vet Med Sci. 2017; 79 (9): 1603–1610.
- 21. Суами Х., О’Нил Дж. К., Пан В., Тейлор Г. И.. Перфорирующие лимфатические сосуды туловища собаки: прямой лимфатический путь от кожи к глубоким лимфатическим сосудам. Plast Reconstr Surg. 2008; 121 (1): 31–36. pmid: 18176203
- 22. Риз С., Будрас К.Д., Муллинг Чр, Брагулла Х., Кениг Х. Integumentum commune. В: Кениг Х., Либих Х.Г., редакторы. Anatomia dos animais domésticos. 6-е изд. Сан-Паулу: ArtMed; 2016. С. 615–66.
- 23. Gioux S, Choi HS, Frangoni JV.Хирургия под визуальным контролем с использованием невидимого ближнего инфракрасного света: основы клинического перевода. Mol Imaging. 2010; 9 (5): 237–255. pmid: 20868625
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.


 Чаще всего у собак возникают в районе грудной клетки. Под кожей собаки образуется припухлость, которая увеличивается с каждым днем. На ощупь чувствуется, как при нажатии под пальцами перемещается жидкость. Первая помощь — наложение давящей повязки, но, как правило, лимфоэкстравазат обнаруживают через несколько дней после образования, когда первую помощь оказать уже нельзя: нужно вызывать ветеринара, чтобы он сделал прокол.
Чаще всего у собак возникают в районе грудной клетки. Под кожей собаки образуется припухлость, которая увеличивается с каждым днем. На ощупь чувствуется, как при нажатии под пальцами перемещается жидкость. Первая помощь — наложение давящей повязки, но, как правило, лимфоэкстравазат обнаруживают через несколько дней после образования, когда первую помощь оказать уже нельзя: нужно вызывать ветеринара, чтобы он сделал прокол.