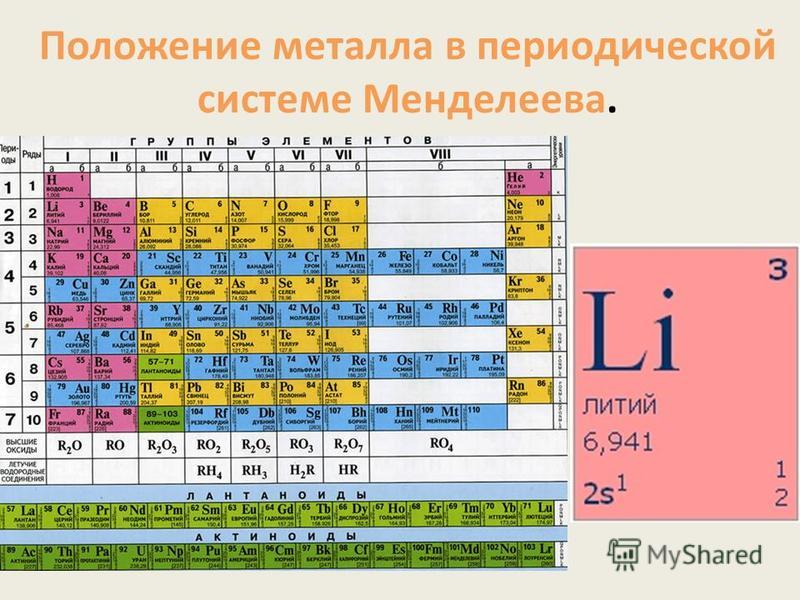
Литий
Ли́тий (лат. Lithium; обозначается символом Li) — элемент главной подгруппы первой группы, второго периода периодической системы химических элементов таблицы Менделеева, с атомным номером 3. Простое вещество литий (CAS-номер: 7439-93-2) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Металлический литий впервые получил Гемфри Дэви в 1825 году. Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Нахождение в природе
Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий.
Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранится в керосине (к тому же плотность лития столь мала, что он будет в нём плавать) и может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом, находящимся в воздухе, превращаясь в нитрид Li

Источник: Википедия
Другие заметки по химии
Характеристика лития | Периодическая таблица химических элементов Д. И. Менделеева с историческими сведениями
Общая характеристика лития как элемента
Химический знак – Li
Относительная атомная масса – 6,941
В соединениях литий одновалентен, степень окисления в соединениях с неметаллами равна +1.
Литий как вещество
Способы получения лития:
- Восстановлением из гидрида лития при нагревании:
2LiH → 2Li + H2
- Электролизом раствора гидрида лития:
2LiH(ж) → 2Li + H2
- Взаимодействием оксида лития с неметаллами:
2Li2O + Si → 4Li + SiO2
- Взаимодействием оксида лития с металлами:
Li2O + Mg → 2Li + MgO
3Li2O + 2Al → 6Li + Al2O3
Физические свойства лития:
- Мягкий, пластичный щелочной металл серебристо-белого цвета.

- Имеет металлический блеск.
- На воздухе покрывается оксидно-нитридной пленкой.
- Температура плавления равна 180,5°С и температура кипения равна 1336,6°С.
Химические свойства лития:
Литий весьма реакционноспособен и при химических реакциях, как правило, отдаёт электроны, превращаясь в положительно заряженный ион. Воспламеняется при умеренном нагревании, окрашивая пламя газовой горелки в тёмно-красный цвет.
Реагирует с водой, кислотами, неметаллами, аммиаком.
1. Наиболее энергично реагирует с галогенами, кислородом и серой (это обусловлено их высокой электроотрицательностью):
4Li + O2 → 2Li2O
2Li + S → Li2S
2Li + Cl2 → 2LiCl
2. Может окисляться ионами водорода или ионами других металлов
2Li + 2H2O → 2LiOH + H2
2Li + 2HCl → 2LiCl + H2
3. Литий, взаимодействуя с аммиаком, образует амид и имид лития
2Li + 2NH3 → 2LiNH2 + H2
2Li + NH
Применение лития:
Сплав, содержащий в своем составе литий, является эффективным полупроводником для термоэлектропреобразователей. Из лития изготавливают аноды химических источников тока (аккумуляторов, гальванических элементов и пр.). Нитрат лития используют в пиротехнике для окрашивания огней в красный цвет. Огромной прочностью обладает стекло, созданное из литий-алюминий-силиката. Сплавы лития с различными металлами – это новые перспективные материалы в авиации и космонавтике. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов. Применяется в ядерных реакторах как эффективный теплоноситель. В медицине соединения лития применяются в виде психотропных препаратов. Соединения лития широко применяют в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Из лития изготавливают аноды химических источников тока (аккумуляторов, гальванических элементов и пр.). Нитрат лития используют в пиротехнике для окрашивания огней в красный цвет. Огромной прочностью обладает стекло, созданное из литий-алюминий-силиката. Сплавы лития с различными металлами – это новые перспективные материалы в авиации и космонавтике. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов. Применяется в ядерных реакторах как эффективный теплоноситель. В медицине соединения лития применяются в виде психотропных препаратов. Соединения лития широко применяют в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Источники
1. https://ru.wikipedia.org/wiki.
2. Лидин, Р. А. Химические свойства неорганических веществ / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. – М.: Химия, 2000.
3. Рудзитис, Г. Е. Химия. Учебное пособие для 7–11 классов вечерней (сменной) общеобразовательной школы. Часть 2. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 1985.
Учебное пособие для 7–11 классов вечерней (сменной) общеобразовательной школы. Часть 2. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 1985.
Литий и все о нем
Литий. Самый легкий металл во Вселенной. Истекаем ли мы, и почему так важно, чтобы мы этого не делали?
Литий является третьим элементом в периодической таблице элементов и относится к группе щелочных металлов (I). Литий также является самым легким металлом в периодической таблице. Он настолько легкий, что может плавать на воде. Мы используем элемент лития в ряде важных случаев, но знаете ли вы, что его можно использовать для лечения серьезных проблем со здоровьем?
Свойства литиевого элемента:
| Atomic Number: | 3 |
| Atomic Symbol: | Li |
| Atomic Weight (amu): | 6.941 |
| Electronegativity: | 0. 98 98 |
| Melting point: | 180,54°С | 356,97°F | 453,69K |
| Температура кипения: | 1342,00°C | 2447,60°F | 1615.15К |
Как выглядит литий?
Литий — мягкий блестящий серебристый металл, который обычно хранят в керосине или минеральном масле, чтобы предотвратить или ограничить реакцию с кислородом воздуха. Необработанный литий обычно имеет тусклый серый цвет, потому что он покрыт слоем оксида и нитрида.
Где можно найти литий?
Большая часть лития в мире добывается из горных пород или рассола. Чили обладает крупнейшими в мире известными запасами лития в размере 8 миллионов тонн, что больше, чем в Австралии (2,7 миллиона тонн), Аргентине (2 миллиона тонн) и Китае (1 миллион тонн). По оценкам, предстоит добыть около 14 миллионов тонн лития, что в 165 раз превышает количество, произведенное в 2018 году9.0005
По оценкам, предстоит добыть около 14 миллионов тонн лития, что в 165 раз превышает количество, произведенное в 2018 году9.0005
Значит ли это, что у нас может закончиться литий?
По мнению многих профессионалов отрасли, таких как Илон Маск. На Земле достаточно литиевого элемента, чтобы удовлетворить наши потребности, но процесс производства и очистки этого элемента идет медленно и с трудом удовлетворяет текущий спрос. Усовершенствованная технология добычи полезных ископаемых и более эффективные методы переработки практически гарантируют, что литий не закончится в ближайшее время.
Можно ли переработать литий?
Литий может быть переработан, и мы настоятельно рекомендуем перерабатывать литий-ионные аккумуляторы, но этот процесс сложен, что объясняет отсутствие заводов по переработке по всему миру. Это создает серьезное препятствие для тех, кто считает, что литий-ионные аккумуляторы — это будущее хранения энергии.
Кто открыл литий?
Наиболее важным применением лития сегодня являются аккумуляторы. В мире, который стремится к зеленому и безуглеродному будущему, мощность аккумуляторов и технологии важнее, чем когда-либо. Литий является важным элементом в производстве аккумуляторов.
Литий используется в сплавах с другими металлами, чтобы сделать их легче в таких устройствах, как самолеты, велосипедные рамы и высокоскоростные поезда.
Для чего можно использовать литий?
Хлорид лития является одним из наиболее гигроскопичных материалов и поэтому используется в кондиционерах и промышленных сушильных системах.
Стеарат лития используется в качестве консистентной смазки общего назначения.
Карбонат лития используется в качестве лекарства от маниакально-депрессивного расстройства, однако неясно, как именно это соединение выполняет свою магическую работу.
Гидрид лития используется для хранения водорода, который предполагается использовать в качестве топлива.
Опасен ли литий
Литий, как и многие другие лекарства, токсичен. Прием внутрь лития имеет токсические побочные эффекты, такие как тремор, диарея, рвота и ухудшение памяти. Проглатывание небольших количеств лития не должно быть смертельным, если требуется немедленная медицинская помощь. Неочищенный металлический литий никогда не следует принимать внутрь, так как это может привести к передозировке лития.
Литий используется для лечения психологических расстройств и должен приниматься внутрь только под строгим наблюдением врачей.
Интересные факты о литии
- Литий является наименее плотным твердым элементом
- Литиевая смазка нашла применение в качестве машинной смазки во время Второй мировой войны.

- Обе стороны холодной войны использовали литий для производства ядерного оружия
- Разработка литий-ионных аккумуляторов привела к восстановлению литиевого рынка в 2000-х годах
- Литий настолько мягкий, что его можно резать ножом для масла.
Какие соединения образуются с литием?
Как упоминалось выше в разделе об использовании лития, литий образует множество полезных соединений. Самые популярные из них:
- Гидроксид лития
- Карбонат лития
- Ацетат лития
- Фторид лития
Смешные литиевые шутки, каламбуры и остроты
Как назвать того, кто говорит, что литий и аргон связаны. Ли-Ар
Какие элементы жизни? литий + железо = (Li) +(Fe)
Мы составили список 50 лучших химических шуток и каламбуров всех времен!
Литий (Li) — атомный номер 3
Произносится
LITH-i-em
Литий (Li) представляет собой металл серебристо-белого цвета, имеющий атомный номер 3 в периодической таблице.
 Это щелочной металл с символом Li, расположенный в группе 1 периодической таблицы.
Это щелочной металл с символом Li, расположенный в группе 1 периодической таблицы. Наиболее распространенные области применения лития включают создание батарей и его применение в медицине. Литий — очень активный металл, и в отличие от многих других металлов его можно резать ножом. Он бурно реагирует с водой, и если оставить его на воздухе, он будет реагировать с кислородом в процессе окисления. Литий очень часто приходится держать в масле для хранения, чтобы он не вступал в реакцию с влагой и кислородом воздуха. Литий относится к группе 1 таблицы Менделеева. Он является твердым при комнатной температуре и имеет температуру плавления 1330°C и точку кипения 180°C. Литий был открыт в 1817 году шведским ученым Йоханом Августом Арфведсоном в результате анализа минерала петалита. Поскольку литий настолько реакционноспособен, он не встречается в природе свободно, однако он встречается в виде руды. В 1855 году британскому химику Августу Маттиссену удалось выделить литий из хлорида лития. Литий — это металл с наименьшей известной плотностью, который легко плавает в воде.
Литий — это металл с наименьшей известной плотностью, который легко плавает в воде.
Загрузить литий в виде изображения для печати и с полным масштабированием
Получить бесплатную загрузку здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления лития?
Литий имеет температуру плавления 180,5°C, что означает, что при 180,5°C он превратится в жидкость.
Какова температура кипения лития?
Литий имеет температуру кипения 1342°C, что означает, что при 1342°C он превратится в газ.
Какова электроотрицательность лития?
Электроотрицательность лития равна 0,98. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Открыт
Иоганном Арфведсоном
Дата открытия
1817
Что такое Теплота испарения лития?
Литий имеет теплоту испарения 145,92 кДж/моль.
Применение
Используется в батареях. Также для некоторых видов стекла и керамики. Некоторые используются в смазочных материалах.
Также для некоторых видов стекла и керамики. Некоторые используются в смазочных материалах.
Источники
Получают пропусканием электрического заряда через расплавленный хлорид лития и из силикатного минерала сподумена [LiAl(Si2O6)].
Об авторе
Nathan M
Автор
Nathan имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Citation
“Lithium” Published on Dec 30, 2019. https://breakingatom.com/elements/lithium
3
Protons
3
Electrons
4
Neutrons
Element Symbol
LI
Атомный вес
6.941
Атомный номер
3
СОСТОЯНИЕ
Сплошной
.0005
1342
Unknown
°C
Heat of Vaporization
145. 92
92
Unknown
kJ/mol
Crystal Structure
Cubic: Body centered
Thermoconductivity
0.847
Unknown
W/cmK
Shells
2,1
Группа
Алкали металл
Период
2
Блок
S Блок
Орбиты
[HE] 2S1 96/см ом
Первый потенциал ионизации
5,3917 V
Второй потенциал ионизации
76,638 V
Третий потенциал ионизации
122,451 V
70005
9.76 (+1) Å
49494949494949494949494949494944949494949494949494949494949494949494949494949494.
9494949494949999.76 (+1) Å
949999999.76. 1
Параметр решетки
3,5101 Å
Параметр решетки 2
—
Параметр решетки 3
6,7080 Å
10 20905 Орбитальная конфигурация0005Download the Periodic Table
Explore Other Alkali Metals
Fr
Francium
39.