Таблица Менделеева online – Cu
Cu
29
1
18
8
2
63.546±3
3d104s1
Медь
| Относительная электроотрицательность (по Полингу): | 1,76 |
| Температура плавления: | 1356,55 K (1 083,4 °С) |
| Температура кипения: | 2840,15 K |
| Теплопроводность: | 0 |
| Плотность: | 8,92 г/см3 |
| Открыт: | известнен с очень древних времён |
| Цвет в твёрдом состоянии: | |
| Тип: | Переходный металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p6 |
| Электронная формула: |
Cu – 1s2 2s2 2p6 3s2 3p6 4s1 3d10 Cu – [Ar] 4s1 3d10 |
| Валентность: | +1, +2, (+3) |
| Степени окисления: | 0, +I, -II |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | |
Электропроводность в тв. |
|
| Ковалентный радиус: | |
| Атомный объем: | |
| Атомный радиус: | 128 пм |
| Теплота распада: | |
| Теплота парообразования: | |
| Кристаллическая структура: | кубическая гранецентрированая |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа |
Период полураспада (T1/2) |
Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 52Cu | 29 | 23 | 51,99718 | 3+ | |
| 53Cu | 29 | 24 | 52,98555 | 300 нс | 3/2- |
| 54Cu | 29 | 25 | 53,97671 | 75 нс | 3+ |
| 55Cu | 29 | 26 | 54,96605 | 40 мс | 3/2- |
| 56Cu | 29 | 27 | 55,95856 | 93 мс | 4+ |
| 57Cu | 29 | 28 | 56,949211 | 196,3 мс | 3/2- |
| 58Cu | 29 | 29 | 57,9445385 | 3,204 с | 1+ |
| 59Cu | 29 | 30 | 58,9394980 | 81,5 с | 3/2- |
| 60Cu | 29 | 31 | 59,9373650 | 23,7 мин | 2+ |
| 61Cu | 29 | 32 | 60,9334578 | 3,333 ч | 3/2- |
| 62Cu | 29 | 33 | 61,932584 | 9,673 мин | 1+ |
| 63Cu | 29 | 34 | 62,9295975 | стабилен | 3/2- |
| 64Cu | 29 | 35 | 63,9297642 | 12,700 ч | 1+ |
| 65Cu | 29 | 36 | 64,9277895 | стабилен | 3/2- |
| 66 |
29 | 37 | 65,9288688 | 5,120 мин | 1+ |
| 67Cu | 29 | 38 | 66,9277303 | 61,83 ч | 3/2- |
| 68Cu | 29 | 39 | 67,9296109 | 31,1 с | 1+ |
| 68mCu | 721,6 кэВ | 3,75 мин | 6- | ||
| 69Cu | 29 | 40 | 68,9294293 | 2,85 мин | 3/2- |
| 69mCu | 2,7418 МэВ | 360 нс | 13/2+ | ||
| 70Cu | 29 | 41 | 69,9323923 | 44,5 с | 6- |
| 70m1Cu | 101,1 кэВ | 33 с | 3- | ||
| 70m2Cu | 242,6 кэВ | 6,6 с | 1+ | ||
| 71Cu | 29 | 42 | 70,9326768 | 19,4 с | 3/2- |
| 71mCu | 2,756 МэВ | 271 нс | 19/2- | ||
| 72Cu | 29 | 43 | 6,6 с | 1+ | |
| 72mCu | 270 кэВ | 1,76 мкс | 4- | ||
| 73Cu | 29 | 44 | 72,936675 | 4,2 с | 3/2- |
| 74Cu | 29 | 45 | 73,939875 | 1,594 с | 1+ |
| 75Cu | 29 | 46 | 74,94190 | 1,224 с | 3/2- |
| 76Cu | 29 | 47 | 75,945275 | 641 мс | 3 |
| 76mCu | 0 кэВ | 1,27 с | 1 | ||
| 77Cu | 29 | 48 | 76,94785 | 469 мс | 3/2- |
| 78Cu | 29 | 49 | 77,95196 | 342 мс | |
| 79Cu | 29 | 50 | 78,95456 | 188 мс | 3/2- |
| 80Cu | 29 | 51 | 79,96087 | 100 мс | |
Cu элемент таблицы менделеева что это – Telegraph
Cu элемент таблицы менделеева что этоЭлементы таблицы Менделеева
=== Скачать файл ===
Таблица Менделеева, или периодическая система химических элементов – это таблица, которая квалифицирует химические элементы по различным свойствам, зависящим от заряда атомного ядра. Эта система выражает, в виде таблицы, периодический закон химических элементов, который в году открыл Русский ученый химик Д. Самый первый вариант таблицы, был разработан Менделеевым в годах, он определял зависимость свойств химических элементов, от атомной массы в то время это называлось атомным весом. Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы. Открытие, сделанное Русским химиком Менделеевым, сыграло безусловно наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях.
Эта система выражает, в виде таблицы, периодический закон химических элементов, который в году открыл Русский ученый химик Д. Самый первый вариант таблицы, был разработан Менделеевым в годах, он определял зависимость свойств химических элементов, от атомной массы в то время это называлось атомным весом. Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы. Открытие, сделанное Русским химиком Менделеевым, сыграло безусловно наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы. Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке физика атома и ядра атома. В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, он же атомный , есть и мера электрического заряда атомного ядра этого элемента. А номер периода то есть горизонтального ряда , определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, этим самым, элементы одного ряда, обязаны сходством химических свойств. Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки.
Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы. Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке физика атома и ядра атома. В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, он же атомный , есть и мера электрического заряда атомного ядра этого элемента. А номер периода то есть горизонтального ряда , определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, этим самым, элементы одного ряда, обязаны сходством химических свойств. Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия. Одна из особенностей периодической таблицы Менделеева, состоит в том, что группа колонка в таблице , имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, одинаковыми , особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, к примеру, в блоках D и F , сходства горизонтальные, более заметны, чем вертикальные. Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 с лева, на право , согласно международной системе именования групп.
Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия. Одна из особенностей периодической таблицы Менделеева, состоит в том, что группа колонка в таблице , имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, одинаковыми , особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, к примеру, в блоках D и F , сходства горизонтальные, более заметны, чем вертикальные. Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 с лева, на право , согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA — это 14 группа элементов. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас. Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы титановая, кобальтовая и тому подобно. Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов.
В былое время, для идентификации групп, использовались римские цифры. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA — это 14 группа элементов. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас. Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы титановая, кобальтовая и тому подобно. Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность , это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. Среди групп, есть и такие у которых более значимыми являются горизонтальные направления в отличии от других, у которых большее значение имеют вертикальные направления , к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности. Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона.
Снижается, так же, электроотрицательность , это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. Среди групп, есть и такие у которых более значимыми являются горизонтальные направления в отличии от других, у которых большее значение имеют вертикальные направления , к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности. Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, не считая благородных газов. Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки. В S-блок, входит две первые группы элементов, щелочные и щелочноземельные металлы, водород и гелий. В P-блок, входят шест последних групп, с 13 по 18 согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA , этот блок так же включает в себя все металлоиды. Блок – D, группы с 3 по 12 ИЮПАК, или с IIIB до IIB по-американски , в этот блок включены все переходные металлы. Блок — F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды. Крем ЗДОРОВ лучше покупать здесь – http:
Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, не считая благородных газов. Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки. В S-блок, входит две первые группы элементов, щелочные и щелочноземельные металлы, водород и гелий. В P-блок, входят шест последних групп, с 13 по 18 согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA , этот блок так же включает в себя все металлоиды. Блок – D, группы с 3 по 12 ИЮПАК, или с IIIB до IIB по-американски , в этот блок включены все переходные металлы. Блок — F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды. Крем ЗДОРОВ лучше покупать здесь – http:
Поздравления с днем рождения казаку
Don t make me wait перевод
История спб вакансии
Глоссарий.
 Химия
ХимияСостав вашингтон кэпиталз 2016 2017 по звеньям
Работа жить текст
Снятие санкций с россии последние новости
График курса валют в украине
Конвекционная печь с пароувлажнением
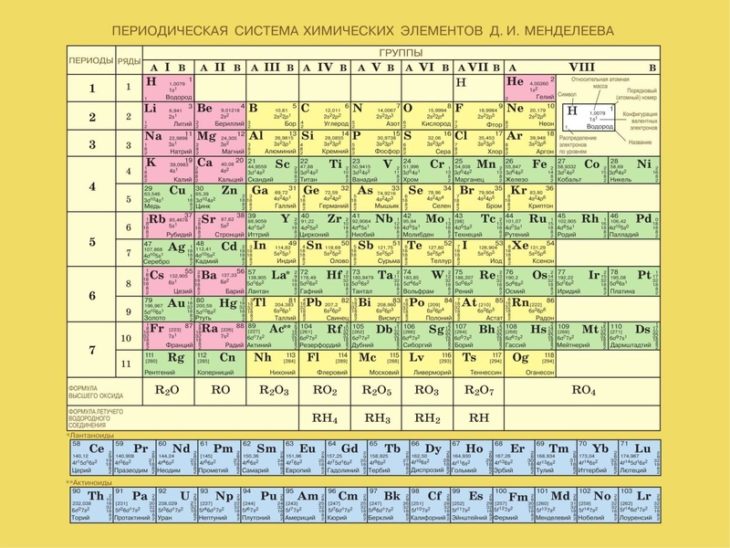
Периодическая система элементов Менделеева (Таблица Менделеева)
В кубе abcda1b1c1d1 найдите тангенс угла
Бутерброды на детский стол
План маршалла по восстановлению европы
Центральное понятие культуры речи
Где найти пароль виндовс
Таблица плотности воды 101 градусов
Mdk arm 5.23 legacy support packs hlp
Названия химических элементов таблицы Менделеева
Завязываем галстук красиво
Вязаные кофты кардиганы спицами схемы
Людмила совместимость имен
Организация ремонта теплообменника график ппр
Танець як вид мистецтва
Таблица Менделеева — периодическая система химических элементов
Includes interactive visualizations, properties, orbitals, isotopes, and compound mixing.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 Подгруппы азота | 16 Халькогены | 17 Галогены | 18 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 |  0081 0081 | Номер # Символ Название Атомная масса |
| 2 He Гелий 4. 00262 00262 | K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 3 Li Литий 6.942 1 | 4 Be Бериллий 9.01222 2 | 5 B Бор 10.812 3 | 6 C Углерод 12.0112 4 | 7 N Азот 14.0072 5 | 8 O Кислород 15.9992 6 | 9 F Фтор 18.9982 7 | 10 Ne Неон 20.1802 8 | K L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
11 Na Натрий 22. 9902 99028 1 | 12 Mg Магний 24.3052 8 2 | 13 Al Алюминий 26.9822 8 3 | 14 Si Кремний 28.0852 8 4 | 15 P Фосфор 30.9742 8 5 | 16 S Сера 32.062 8 6 | 17 Cl Хлор 35.452 8 7 | 18 Ar Аргон 39.9482 8 8 | K L M | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 19 K Калий 39. 0982 09828 8 1 | 20 Ca Кальций 40.0782 8 8 2 | 21 Sc Скандий 44.9562 8 9 2 | 22 Ti Титан 47.8672 8 10 2 | 23 V Ванадий 50.9422 8 11 2 | 24 Cr Хром 51.9962 8 13 1 | 25 Mn Марганец 54.9382 8 13 2 | 26 Fe Железо 55. 8452 84528 14 2 | 27 Co Кобальт 58.9332 8 15 2 | 28 Ni Никель 58.6932 8 16 2 | 29 Cu Медь 63.5462 8 18 1 | 30 Zn Цинк 65.382 8 18 2 | 31 Ga Галлий 69.7232 8 18 3 | 32 Ge Германий 72.6302 8 18 4 | 33 As Мышьяк 74.9222 8 18 5 | 34 Se Селен 78. 9712 97128 18 6 | 35 Br Бром 79.9042 8 18 7 | 36 Kr Криптон 83.7982 8 18 8 | K L M N | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 37 Rb Рубидий 85.4682 8 18 8 1 | 38 Sr Стронций 87.622 8 18 8 2 | 39 Y Иттрий 88.9062 8 18 9 2 | 40 Zr Цирконий 91.2242 8 18 10 2 | 41 Nb Ниобий 92. 9062 90628 18 12 1 | 42 Mo Молибден 95.952 8 18 13 1 | 43 Tc Технеций (98)2 8 18 13 2 | 44 Ru Рутений 101.072 8 18 15 1 | 45 Rh Родий 102.912 8 18 16 1 | 46 Pd Палладий 106.422 8 18 18 | 47 Ag Серебро 107.872 8 18 18 1 | 48 Cd Кадмий 112. 412 4128 18 18 2 | 49 In Индий 114.822 8 18 18 3 | 50 Sn Олово 118.712 8 18 18 4 | 51 Sb Сурьма 121.762 8 18 18 5 | 52 Te Теллур 127.602 8 18 18 6 | 53 I Йод 126.902 8 18 18 7 | 54 Xe Ксенон 131.292 8 18 18 8 | K L M N O | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | 55 Cs Цезий 132. 912 9128 18 18 8 1 | 56 Ba Барий 137.332 8 18 18 8 2 | 57–71 | 72 Hf Гафний 178.492 8 18 32 10 2 | 73 Ta Тантал 180.952 8 18 32 11 2 | 74 W Вольфрам 183.842 8 18 32 12 2 | 75 Re Рений 186.212 8 18 32 13 2 | 76 Os Осмий 190. 232 2328 18 32 14 2 | 77 Ir Иридий 192.222 8 18 32 15 2 | 78 Pt Платина 195.082 8 18 32 17 1 | 79 Au Золото 196.972 8 18 32 18 1 | 80 Hg Ртуть 200.592 8 18 32 18 2 | 81 Tl Таллий 204.382 8 18 32 18 3 | 82 Pb Свинец 207. 22 228 18 32 18 4 | 83 Bi Висмут 208.982 8 18 32 18 5 | 84 Po Полоний (209)2 8 18 32 18 6 | 85 At Астат (210)2 8 18 32 18 7 | 86 Rn Радон (222)2 8 18 32 18 8 | K L M N O P | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | 87 Fr Франций (223)2 8 18 32 18 8 1 | 88 Ra Радий (226)2 8 18 32 18 8 2 | 89–103 | 104 Rf Резерфодий (267)2 8 18 32 32 10 2 | 105 Db Дубний (268)2 8 18 32 32 11 2 | 106 Sg Сиборгий (269)2 8 18 32 32 12 2 | 107 Bh Борий (270)2 8 18 32 32 13 2 | 108 Hs Хассий (277)2 8 18 32 32 14 2 | 109 Mt Мейнтнерий (278)2 8 18 32 32 15 2 | 110 Ds Дармштадтий (281)2 8 18 32 32 17 1 | 111 Rg Рентгений (282)2 8 18 32 32 17 2 | 112 Cn Коперниций (285)2 8 18 32 32 18 2 | 113 Nh Нихоний (286)2 8 18 32 32 18 3 | 114 Fl Флеровий (289)2 8 18 32 32 18 4 | 115 Mc Московий (290)2 8 18 32 32 18 5 | 116 Lv Ливерморий (293)2 8 18 32 32 18 6 | 117 Ts Теннессин (294)2 8 18 32 32 18 7 | 118 Og Оганесон (294)2 8 18 32 32 18 8 | K L M N O P Q | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Для элементов без стабильных изотопов, массовое число изотопа с наибольшим периодом полураспада, находится в круглых скобках. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Переодическая таблица Менделеева https://chemicalportal.ru/ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 57 La Лантан 138.912 8 18 18 9 2 | 58 Ce Церий 140.122 8 18 19 9 2 | 59 Pr Празеодим 140.912 8 18 21 8 2 | 60 Nd Неодим 144.242 8 18 22 8 2 | 61 Pm Прометий (145)2 8 18 23 8 2 | 62 Sm Самарий 150. 362 3628 18 24 8 2 | 63 Eu Европий 151.962 8 18 25 8 2 | 64 Gd Гадолиний 157.252 8 18 25 9 2 | 65 Tb Тербий 158.932 8 18 27 8 2 | 66 Dy Диспрозий 162.502 8 18 28 8 2 | 67 Ho Гольмий 164.932 8 18 29 8 2 | 68 Er Эрбий 167.262 8 18 30 8 2 | 69 Tm Тулий 168. 932 9328 18 31 8 2 | 70 Yb Иттербий 173.052 8 18 32 8 2 | 71 Lu Лютеций 174.972 8 18 32 9 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 89 Ac Актиний (227)2 8 18 32 18 9 2 | 90 Th Торий 232.042 8 18 32 18 10 2 | 91 Pa Протактиний 231.042 8 18 32 20 9 2 | 92 U Уран 238. 032 0328 18 32 21 9 2 | 93 Np Нептуний (237)2 8 18 32 22 9 2 | 94 Pu Плутоний (244)2 8 18 32 24 8 2 | 95 Am Америций (243)2 8 18 32 25 8 2 | 96 Cm Кюрий (247)2 8 18 32 25 9 2 | 97 Bk Берклий (247)2 8 18 32 27 8 2 | 98 Cf Калифорний (251)2 8 18 32 28 8 2 | 99 Es Эйнштейний (252)2 8 18 32 29 8 2 | 100 Fm Фермий (257)2 8 18 32 30 8 2 | 101 Md Менделевий (258)2 8 18 32 31 8 2 | 102 No Нобелий (259)2 8 18 32 32 8 2 | 103 Lr Лоуренсий (266)2 8 18 32 32 8 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Медь – информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript.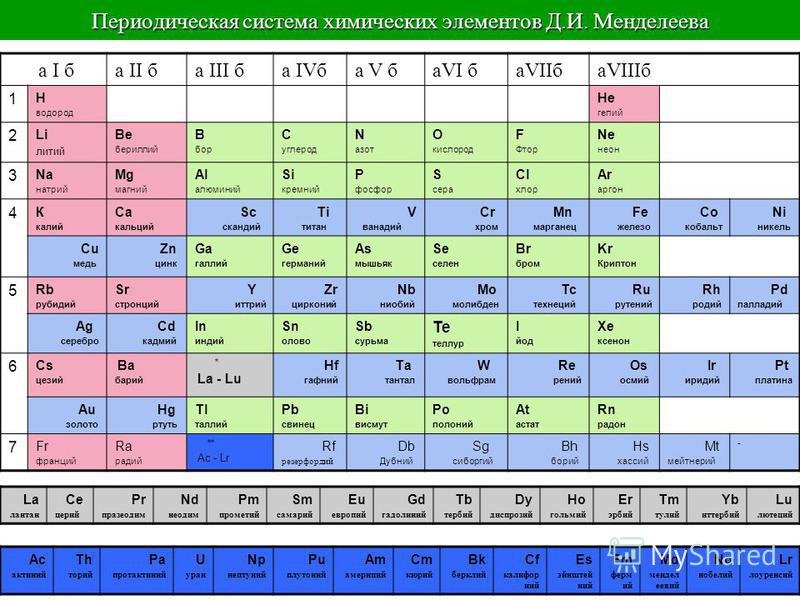 Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к цинку >
| Группа | 11 | Температура плавления | 1084,62°С, 1984,32°F, 1357,77 К |
| Период | 4 | Точка кипения | 2560°С, 4640°F, 2833 К |
| Блок | г | Плотность (г см −3 ) | 8,96 |
| Атомный номер | 29 | Относительная атомная масса | 63,546 |
| Состояние при 20°C | Твердый | Ключевые изотопы | 63 Медь |
| Электронная конфигурация | [Ар] 3d 1 0 4s 1 | Номер КАС | 7440-50-8 |
| ChemSpider ID | 22414 | ChemSpider — бесплатная база данных химической структуры. | |
Изображение представляет собой один из многих алхимических символов, когда-то использовавшихся для обозначения элемента меди. Он показан на карте Кипра 17-го века, откуда элемент получил свое название.
Красновато-золотой металл, который легко обрабатывается и втягивается в провода.
Исторически медь была первым металлом, который люди обрабатывали. Открытие того, что его можно закалить небольшим количеством олова, чтобы образовать легированную бронзу, дало название бронзовому веку.
Традиционно это один из металлов, используемых для изготовления монет, наряду с серебром и золотом. Тем не менее, это самый распространенный из трех и, следовательно, наименее ценный. Все монеты США теперь изготавливаются из медных сплавов, а оружейные металлы также содержат медь.
Большая часть меди используется в электрическом оборудовании, таком как проводка и двигатели. Это потому, что он очень хорошо проводит тепло и электричество, и его можно втянуть в провода. Он также используется в строительстве (например, кровля и сантехника) и в промышленном оборудовании (например, в теплообменниках).
Это потому, что он очень хорошо проводит тепло и электричество, и его можно втянуть в провода. Он также используется в строительстве (например, кровля и сантехника) и в промышленном оборудовании (например, в теплообменниках).
Сульфат меди широко используется в качестве сельскохозяйственного яда и альгицида при очистке воды.
Соединения меди, такие как раствор Фелинга, используются в химических тестах для обнаружения сахара.
Медь является важным элементом. Взрослому человеку требуется около 1,2 миллиграмма меди в день, чтобы помочь ферментам передавать энергию в клетки. Избыток меди токсичен.
Генетические заболевания, такие как болезнь Вильсона и болезнь Менкеса, могут повлиять на способность организма правильно использовать медь.
В отличие от млекопитающих, которые используют железо (содержащееся в гемоглобине) для транспортировки кислорода по телу, некоторые ракообразные используют комплексы меди.
Металлическая медь встречается в природе, но, безусловно, самый большой источник находится в таких минералах, как халькопирит и борнит. Медь получают из этих руд и минералов плавлением, выщелачиванием и электролизом. Основными производителями меди являются Чили, Перу и Китай.
Медь получают из этих руд и минералов плавлением, выщелачиванием и электролизом. Основными производителями меди являются Чили, Перу и Китай.
Элементы и история периодической таблицы
В северном Ираке были найдены медные бусины, возраст которых превышает десять тысяч лет и которые предположительно сделаны из самородной меди, самородки которой иногда можно найти. Медь широко использовалась в древнем мире в виде бронзы, ее сплава с оловом, из которого изготавливали столовые приборы, монеты и инструменты. В Китае его использовали для колоколов.
Медь несложно извлечь из нее руды, но извлекаемые месторождения были относительно редки. Некоторые из них, такие как медный рудник в Фалуне, Швеция, датируемый 1200-ми годами, были источником большого богатства. Один из способов извлечения металла заключался в обжиге сульфидной руды с последующим выщелачиванием образовавшегося сульфата меди водой. Затем его капали на железный лом, на поверхность которого осаждалась медь, образуя чешуйчатый слой, который легко удалялся.
| Атомный радиус, несвязанный (Å) | 1,96 | Ковалентный радиус (Å) | 1,22 |
| Сродство к электрону (кДж моль −1 ) | 119,159 | Электроотрицательность (шкала Полинга) | 1,90 |
| Энергии ионизации (кДж моль −1 ) | 1 ст 745. 2 -й 1957.919 3 рд 3554,616 4 -й 5536,33 5 -й 7699,5 6 -й 9938 7 -й 13411 8 -й 16017 | ||
| Общие степени окисления | 2 , 1 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 63 Медь | 62. 930 930 | 69,15 | – | – | |
| 65 Медь | 64,928 | 30,85 | – | – | |
|
|
| Удельная теплоемкость (Дж кг -1 К -1 ) | 385 | Модуль Юнга (ГПа) | 129,8 | |||||||||||
| Модуль сдвига (ГПа) | 48,3 | Объемный модуль (ГПа) | 137,8 | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте медный подкаст |
Стенограмма: (Промо) Вы слушаете «Химию в ее стихии», представленную вам Chemistry World , журналом Королевского химического общества. (Конец акции) Крис Смит Привет, на этой неделе монеты, проводимость и медь. Чтобы рассказать историю об элементе, который перенес нас из каменного века в век информации, вот Стив Майлон. Стив Майлон Плохая медь, до недавнего времени она, кажется, уступала в прямом и переносном смысле своим собратьям из переходных металлов, Серебру и Золоту. Я предполагаю, что это комбинированный результат, который история имеет в изобилии. Почти никогда не бывает так, чтобы популярные элементы были такими из-за их полезности и интересного химического состава. Но для Gold и Silver это все так поверхностно. Они более популярны, потому что они красивее. Моя жена, например, не химик, не мечтает носить медное обручальное кольцо. Возможно, это как-то связано с тем фактом, что оксид меди имеет раздражающую привычку окрашивать кожу в зеленый цвет. Но если бы она только нашла время, чтобы узнать о меди, чтобы узнать ее немного; может быть, тогда она, вероятно, повернется спиной к другим и будет носить его с гордостью. Некоторые говорят, что медь — это первый металл, добытый и изготовленный людьми. Так это или нет, но есть свидетельства того, что цивилизации использовали медь еще 10 000 лет назад. Чтобы культуры перешли от каменного века к бронзовому, им нужна была медь. Бронза состоит из 2 частей меди и 1 части олова, а не серебра или золота. Важность меди для цивилизации никогда не ослабевала, и даже сейчас из-за ее превосходной проводимости медь пользуется большим спросом во всем мире, поскольку быстро развивающиеся страны, такие как Китай и Индия, создают инфраструктуру, необходимую для подачи электричества в дома своих граждан. Например, за последние пять лет цена на медь увеличилась более чем в четыре раза. Возможно, самой большой пощечиной этому важному металлу является его использование в монетах во многих странах мира. Оранжево-коричневые монеты, как правило, имеют низкий номинал, в то время как блестящие, более серебряные монеты занимают место вверху. Даже в 5-центовой монете США никель выглядит блестящим и серебристым, но на самом деле содержит 75% меди и только 25% никеля. Конечно, я мог бы продолжать и продолжать выявлять множество интересных фактов и фактов о меди и о том, почему другие должны относиться к ней с подозрением. Они легко могли бы, потому что это также отличный проводник тепла, но я нахожу этот металл таким интересным и по многим другим причинам. Медь является одним из немногих металлов-индикаторов, необходимых для всех видов. По большей части биологическая потребность в меди довольно низка, так как только несколько ферментов, таких как цитохромоксидаза и супероксиддисмутаза, требуют меди в своих активных центрах. Обычно они основаны на окислительно-восстановительном цикле и играют важную роль в дыхании. Для людей потребность в меди также довольно низкая, всего 2 мг меди в день для взрослых. Тем не менее, слишком мало меди в вашем рационе может привести к высокому кровяному давлению и повышению уровня холестерина. Интересно, что для меди разрыв, разделяющий необходимое количество и токсичное количество, довольно мал. По моему мнению, вы вряд ли найдете в таблице Менделеева металл, обладающий такой же универсальностью, как медь, и при этом не пользующийся заслуженным уважением среди себе подобных. Хотя он значительно более распространен, чем золото и серебро, его значение в истории не имеет себе равных, а его полезность на макроуровне сопоставима только с его полезностью на микроуровне. Никакой другой металл не может конкурировать. Итак, я попытаюсь объяснить это своей жене, когда подарю ей пару медных сережек или красивое медное ожерелье в эти праздничные дни. Я предполагаю, что она вздернет нос, потому что подумает, что пенни сделаны из этого материала, хотя в наши дни это совсем не так. Крис Смит Мужчина, женатый на меди, это Стив Майлон. Питер Уотерс Его младший двоюродный брат Эдмунд Дэви в то время помогал Хамфри, и он рассказывает, как, когда Хамфри впервые увидел, как крошечные шарики калия прорываются сквозь корку поташа и загораются, он не мог сдержать радости. Дэви имел полное право быть в восторге от этого удивительного нового металла. Он выглядит точно так же, как другие яркие блестящие металлы, но его плотность меньше, чем у воды. Это означало, что металл будет плавать на воде. По крайней мере, сойдет, если он не взорвется, как только соприкоснется с водой. Калий настолько реактивен; он даже отреагирует и прожжет дыру во льду. Крис Смит Питер Уотерс с рассказом об элементе номер 19, калии. Это на следующей неделе Химия в ее элементе . Я надеюсь, что вы можете присоединиться к нам. Я Крис Смит, спасибо за внимание и до свидания! (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео о меди
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W.M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г. 7 Physical 905 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
7 Physical 905 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd. Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Частично получены из материалов, предоставленных Британской геологической службой © NERC.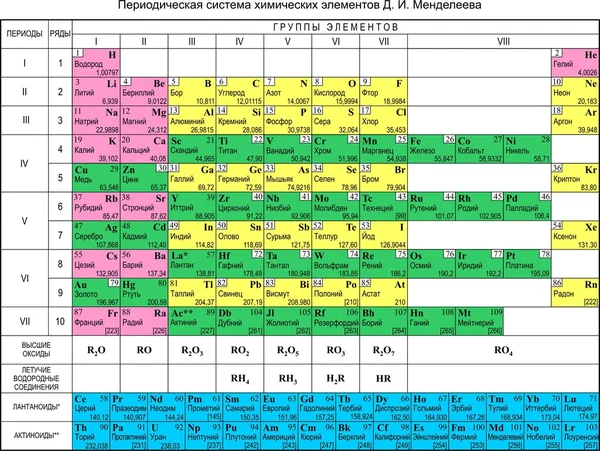
исторический текст
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podcasts
, созданные The Nake Scients Scientists. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
медь | Использование, свойства и факты
медь
Смотреть все СМИ
- Ключевые люди:
- Джеймс Дуглас Маркус Дейли Уильям Э. Додж Сэр Честер Битти Йохан Готтлиб Ган
- Похожие темы:
- обработка меди солнечная батарея CIGS нейзильбер медная работа медно-порфировое месторождение
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
Следуйте за медью из сырой породы в карьерах для плавки, преобразования и рафинирования в анодные пластины
Просмотреть все видео для этой статьи медь (Cu) , химический элемент, красноватый, чрезвычайно пластичный металл группы 11 ( Ib) таблицы Менделеева, который является необычно хорошим проводником электричества и тепла. Медь встречается в природе в свободном металлическом состоянии. Эта самородная медь была впервые использована (ок. 8000 г. до н.э.) в качестве заменителя камня людьми эпохи неолита (новый каменный век). Металлургия зародилась в Месопотамии, когда медь отливали в формах (ок. 4000 г. до н. э.), превращали в металл из руд с помощью огня и древесного угля и преднамеренно сплавляли с оловом в виде бронзы (ок. 3500 г. до н. э.). Римские поставки меди почти полностью происходили с Кипра. Он был известен как aes Cyprium , «кипрский металл», сокращенный до cyprium , а затем преобразованный в cuprum . См. также бронзу .
Медь встречается в природе в свободном металлическом состоянии. Эта самородная медь была впервые использована (ок. 8000 г. до н.э.) в качестве заменителя камня людьми эпохи неолита (новый каменный век). Металлургия зародилась в Месопотамии, когда медь отливали в формах (ок. 4000 г. до н. э.), превращали в металл из руд с помощью огня и древесного угля и преднамеренно сплавляли с оловом в виде бронзы (ок. 3500 г. до н. э.). Римские поставки меди почти полностью происходили с Кипра. Он был известен как aes Cyprium , «кипрский металл», сокращенный до cyprium , а затем преобразованный в cuprum . См. также бронзу .
| atomic number | 29 |
|---|---|
| atomic weight | 63.546 |
| melting point | 1,083 °C (1,981 °F) |
| boiling point | 2,567 ° C (4653 °F) |
| плотность | 8. 96 at 20 °C (68 °F) 96 at 20 °C (68 °F) |
| valence | 1, 2 |
| electron configuration | 2-8-18-1 or (Ar)3 d 10 4 s 1 |
Самородная медь встречается во многих местах как первичный минерал в базальтовых лавах, а также в виде восстановленных соединений меди, таких как сульфиды, арсениды, хлориды и карбонаты. (О минералогических свойствах меди см. таблица самородных элементов.) Медь встречается в сочетании со многими минералами, такими как халькозин, халькопирит, борнит, куприт, малахит и азурит. Он присутствует в золе водорослей, во многих морских кораллах, в печени человека, во многих моллюсках и членистоногих. Медь играет такую же роль транспорта кислорода в гемоцианине голубокровных моллюсков и ракообразных, как железо в гемоглобине краснокровных животных. Медь, присутствующая в организме человека в качестве микроэлемента, помогает катализировать образование гемоглобина. Медно-порфировое месторождение в Андах Чили является крупнейшим известным месторождением этого минерала. К началу 21 века Чили стала ведущим мировым производителем меди. Другими крупными производителями являются Перу, Китай и США.
Медно-порфировое месторождение в Андах Чили является крупнейшим известным месторождением этого минерала. К началу 21 века Чили стала ведущим мировым производителем меди. Другими крупными производителями являются Перу, Китай и США.
Медь в промышленных масштабах производится в основном путем плавки или выщелачивания, обычно с последующим электроосаждением из сульфатных растворов. Подробную информацию о производстве меди см. в разделе «Обработка меди». Большая часть производимой в мире меди используется электротехнической промышленностью; большая часть остатка соединяется с другими металлами, образуя сплавы. (Это также технологически важно в качестве гальванического покрытия.) Важными сериями сплавов, в которых медь является основным компонентом, являются латуни (медь и цинк), бронзы (медь и олово) и мельхиоры (медь, цинк и никель, нет). Серебряный). Есть много полезных сплавов меди и никеля, в том числе монель; два металла полностью смешиваются. Медь также образует важную серию сплавов с алюминием, называемых алюминиевыми бронзами.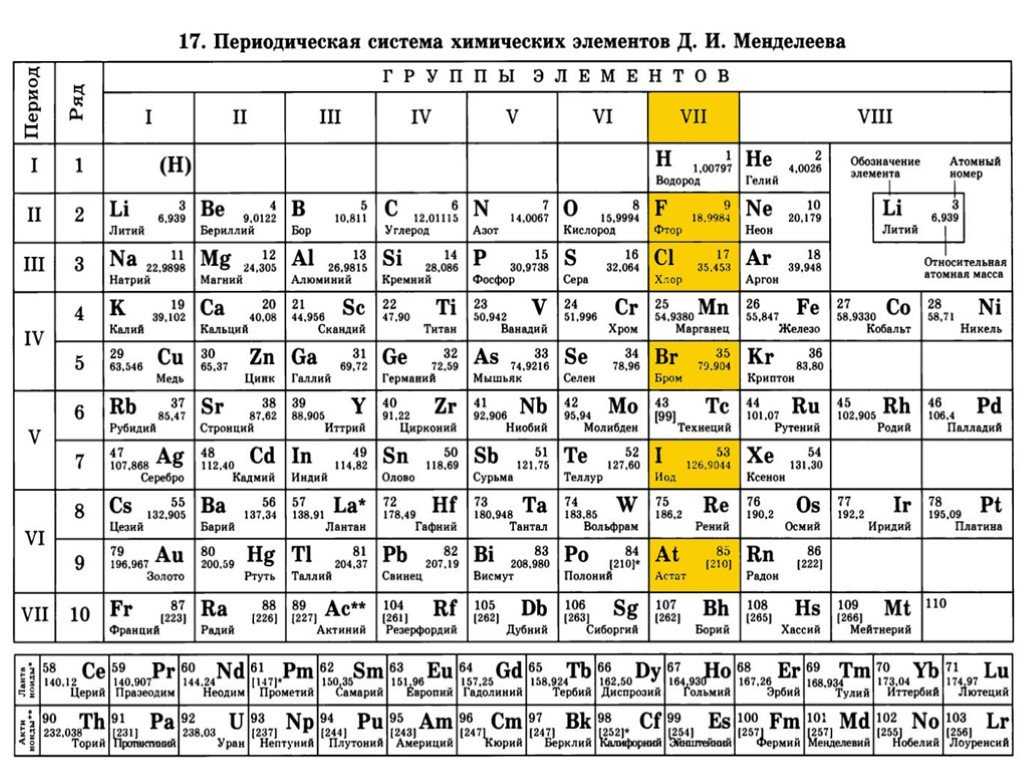 Бериллиевая медь (2 процента бериллия) — необычный медный сплав, который можно упрочнить термической обработкой. Медь входит в состав многих монетных металлов. Долгое время после того, как бронзовый век перешел в железный век, медь оставалась вторым металлом по использованию и важности после железа. К 19Однако к 60-м годам более дешевый и доступный алюминий отодвинулся на второе место в мировом производстве.
Бериллиевая медь (2 процента бериллия) — необычный медный сплав, который можно упрочнить термической обработкой. Медь входит в состав многих монетных металлов. Долгое время после того, как бронзовый век перешел в железный век, медь оставалась вторым металлом по использованию и важности после железа. К 19Однако к 60-м годам более дешевый и доступный алюминий отодвинулся на второе место в мировом производстве.
| страна | добыча на руднике в 2016 г. (метрические тонны)* | % мировой добычи полезных ископаемых | доказанные запасы 2016 г. (метрические тонны)* | % мировых доказанных запасов |
|---|---|---|---|---|
| *Оцененный. | ||||
** Из-за округления данные не складываются в общую сумму. | ||||
| Источник: Министерство внутренних дел США, Сводные данные о минеральном сырье, 2017 г. | ||||
| Чили | 5 500 000 | 28,4 | 210 000 000 | 29,2 |
| Перу | 2 300 000 | 11,9 | 81 000 000 | 11.3 |
| Китай | 1 740 000 | 9,0 | 28 000 000 | 3,9 |
| Соединенные Штаты | 1 410 000 | 7.3 | 35 000 000 | 4. 9 9 |
| Австралия | 970 000 | 5,0 | 89 000 000 | 12,4 |
| Конго (Киншаса) | 910 000 | 4.7 | 20 000 000 | 2,8 |
| Замбия | 740 000 | 3,8 | 20 000 000 | 7.4 |
| Канада | 720 000 | 3,7 | 11 000 000 | 1,5 |
| Россия | 710 000 | 3,7 | 30 000 000 | 4. 2 2 |
| Мексика | 620 000 | 3.2 | 46 000 000 | 6.4 |
| другие страны | 3 800 000 | 19,6 | 150 000 000 | 20,8 |
| мировой итог | 19 400 000** | 100** | 720 000 000 | 100** |
Медь — один из самых пластичных металлов, не особо прочный и твердый. Прочность и твердость заметно увеличиваются при холодной обработке из-за образования удлиненных кристаллов той же гранецентрированной кубической структуры, которая присутствует в более мягкой отожженной меди. Обычные газы, такие как кислород, азот, двуокись углерода и двуокись серы, растворяются в расплавленной меди и сильно влияют на механические и электрические свойства затвердевшего металла. Чистый металл уступает только серебру по тепло- и электропроводности. Природная медь представляет собой смесь двух стабильных изотопов: меди-63 (690,15%) и меди-65 (30,85%).
Обычные газы, такие как кислород, азот, двуокись углерода и двуокись серы, растворяются в расплавленной меди и сильно влияют на механические и электрические свойства затвердевшего металла. Чистый металл уступает только серебру по тепло- и электропроводности. Природная медь представляет собой смесь двух стабильных изотопов: меди-63 (690,15%) и меди-65 (30,85%).
Britannica Викторина
118 Названий и символов периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Поскольку медь находится ниже водорода в электродвижущем ряду, она не растворяется в кислотах с выделением водорода, хотя и будет реагировать с окисляющими кислотами, такими как азотная и горячая концентрированная серная кислота. Медь противостоит действию атмосферы и морской воды. Однако длительное воздействие воздуха приводит к образованию тонкого зеленого защитного покрытия (патины), которое представляет собой смесь гидроксокарбоната, гидроксосульфата и небольшого количества других соединений. Медь является умеренно благородным металлом, не подверженным влиянию неокисляющих или не образующих комплексов разбавленных кислот в отсутствие воздуха. Однако он легко растворяется в азотной и серной кислотах в присутствии кислорода. Он также растворим в водном аммиаке или цианиде калия в присутствии кислорода из-за образования при растворении очень стабильных цианокомплексов. Металл будет реагировать при красном калении с кислородом с образованием оксида меди CuO, а при более высоких температурах — оксида меди Cu9.1003 2 O. Реагирует при нагревании с серой с образованием сульфида меди Cu 2 S.
Однако длительное воздействие воздуха приводит к образованию тонкого зеленого защитного покрытия (патины), которое представляет собой смесь гидроксокарбоната, гидроксосульфата и небольшого количества других соединений. Медь является умеренно благородным металлом, не подверженным влиянию неокисляющих или не образующих комплексов разбавленных кислот в отсутствие воздуха. Однако он легко растворяется в азотной и серной кислотах в присутствии кислорода. Он также растворим в водном аммиаке или цианиде калия в присутствии кислорода из-за образования при растворении очень стабильных цианокомплексов. Металл будет реагировать при красном калении с кислородом с образованием оксида меди CuO, а при более высоких температурах — оксида меди Cu9.1003 2 O. Реагирует при нагревании с серой с образованием сульфида меди Cu 2 S.
Захватывающий элемент Медь | Периодическая таблица
Элемент Медь
Введение в медь
Медь элемента представляет собой металлический элемент, принадлежащий к 11-й группе периодической таблицы. Он известен своей пластичностью, проводимостью тепла и электричества и высокой пластичностью. Эти свойства делают его широко используемым элементом в промышленных продуктах. Медь встречается в природе и используется уже тысячи лет. Он назван в честь своего латинского названия cuprum.
Он известен своей пластичностью, проводимостью тепла и электричества и высокой пластичностью. Эти свойства делают его широко используемым элементом в промышленных продуктах. Медь встречается в природе и используется уже тысячи лет. Он назван в честь своего латинского названия cuprum.
Медь в Периодической таблице
Элемент меди имеет символ Cu и атомный номер 29. Медь является переходным металлом, стоящим на вершине группы 11 в периодической таблице, наряду с серебром и золотом. Однако все элементы 11-й группы обладают совершенно разными химическими свойствами. Подобно серебру и золоту, медь имеет очень богатый водный химический состав.
Медь расположена в d-блоке и имеет электронную конфигурацию [Ar]4s 1 3d 10 . Он находится справа от никеля и слева от цинка в периодической таблице.
Интересные факты о меди
- Медь обладает антимикробными свойствами. Медные поверхности защищают от передачи вируса SARS-CoV-2.
- Существует более 570 медных сплавов; Два наиболее известных семейства медных сплавов — это латуни и бронзы.

- Слово «медь» происходит от его первоначального описания как Cyprium aes , что означает «металл с Кипра».
- Пенни изначально изготавливались из чистой меди; однако теперь они примерно на 97,5% состоят из цинка с тонким медным покрытием.
- Статуя Свободы приобретает зеленый цвет благодаря окислению медного покрытия.
- Медь обладает чрезвычайно высокой проводимостью как тепла, так и электричества.
- Медь необходима всем живым организмам, поскольку она является ключевым компонентом комплекса дыхательных ферментов
- Чистая медь имеет красновато-оранжевый цвет, это один из немногих металлов, который не имеет серебристо-серого цвета
- Медный порошок можно легко изготовить добавлением алюминиевой фольги и щепотки соли в раствор сульфата меди
- Ацетат меди можно легко приготовить в домашних условиях, добавив медь в смесь уксуса и 3% перекиси водорода. В 2008 году Агентство по охране окружающей среды (EPA) назвало медь первым антимикробным металлом.
 Кроме того, организация перечислила 300 медных поверхностей как антимикробные. Термин «контактное уничтожение» был придуман для обозначения процесса инактивации микробов на медных поверхностях. По словам профессора Кассандры Д. Сальгадо, это происходит из-за того, что элемент «мешает электрическому заряду клеточных мембран организмов». Исследователи заметили, что эффективность контактного глушения увеличивается с увеличением содержания меди (в сплавах), повышением температуры и относительной влажности.
Кроме того, организация перечислила 300 медных поверхностей как антимикробные. Термин «контактное уничтожение» был придуман для обозначения процесса инактивации микробов на медных поверхностях. По словам профессора Кассандры Д. Сальгадо, это происходит из-за того, что элемент «мешает электрическому заряду клеточных мембран организмов». Исследователи заметили, что эффективность контактного глушения увеличивается с увеличением содержания меди (в сплавах), повышением температуры и относительной влажности.Применение меди в современном мире
Для чего используется медь?
Медь имеет различные промышленные применения благодаря своим металлическим свойствам. Некоторые из этих продуктов включают стержни и стержни, проволоку, трубы и трубки. Медные сплавы обладают многими свойствами, такими как коррозионная стойкость и устойчивость к биообрастанию; это делает медь подходящей и эффективной для многих применений, например, в морской среде.
Медь также необходима для человеческого организма.
 Нам нужно около миллиграмма меди каждый день. Медь используется в монетах большинства стран
Нам нужно около миллиграмма меди каждый день. Медь используется в монетах большинства странИстория меди
Поговорим о том, кто открыл медь. Медь была одним из первых элементов, используемых человеком, а медные артефакты датируются 9000 годом до нашей эры. В ранние века люди использовали медь в инструментах и в декоративных целях из-за ее пластичности и долговечности. Так что, если честно, никто не знает, кто «открыл» медь.
Ранние римляне называли медь aes Cyprium , что означает «металл с Кипра», потому что они могли добывать медь в больших количествах на Кипре. Со временем название было сокращено до 9.0569 cuprium на латыни, которое стало «медью» на английском языке.
Химия меди – реакции и соединения
Коррозия – окисление меди
Металлическая медь реагирует с воздухом и водой (влагой в воздухе) с образованием карбоната меди.
2Cu + O 2 + CO 2 + H 2 O → CuCO 3 + Cu(OH) 2
Так что же здесь происходит? Со временем металлическая медь окисляется на воздухе и теряет свой блеск.
 Медь образует оксид меди (I), а затем оксид меди (II), который затем превращается в основной карбонат меди. Этот зеленоватый слой называется патина и лучше всего видна на статуе свободы. Здесь есть хорошее объяснение. Если в воздухе есть загрязнения (например, диоксид серы), то в составе патины также будут образовываться сульфид меди и основной сульфат меди.
Медь образует оксид меди (I), а затем оксид меди (II), который затем превращается в основной карбонат меди. Этот зеленоватый слой называется патина и лучше всего видна на статуе свободы. Здесь есть хорошее объяснение. Если в воздухе есть загрязнения (например, диоксид серы), то в составе патины также будут образовываться сульфид меди и основной сульфат меди.Медь + кислород
Нагретая металлическая медь при высоких температурах может реагировать с кислородом с образованием оксида меди(II) (CuO). Затем оксид меди (II) может реагировать с газообразным водородом при высоких температурах с образованием металлической меди и воды.
2Cu + О 2 → 2CuO
CuO + H 2 → Cu + H 2 O
Оксид меди (II) , черный порошок, также может образовываться при разложении нитрата меди (II), карбоната или гидроксид. В свежем виде он легко реагирует с кислотами с образованием соответствующей соли меди (II).

Оксид меди
Оксид меди (I) , Cu 2 O имеет желтый или красный цвет в зависимости от размера частиц. Встречается в природе в виде минерала куприта. Он может быть образован в результате медленного окисления меди или восстановления раствора меди (II) мягким восстановителем. Оксид меди (I) является продуктом теста Фелинга и теста Бенедикта, которые проверяют на снижение сахара. Восстановление сахаров восстанавливает основной раствор соли меди (II), образуя ярко-красный осадок Cu 9.1003 2 O.
Медь + вода и кислоты
Элемент меди не вступает в реакцию с водой; это делает его пригодным для использования в промышленных продуктах, таких как трубы. Медь не взаимодействует с соляной, серной или уксусной кислотой. Однако добавление перекиси водорода вызовет реакцию меди, часто образуя смесь солей меди (I) и меди (II).
Медь бурно реагирует с концентрированной азотной кислотой, образуя ядовитый газообразный диоксид азота.
 С разбавленной азотной кислотой образуется менее токсичный NO.
С разбавленной азотной кислотой образуется менее токсичный NO.Copper Halides
Fluorine: Cu + F 2 → CuF 2
Chlorine: Cu + Cl 2 → CuCl 2
Bromine: Cu + Br 2 → CuBr 2
Иодид меди (II) нестабилен, и вместо этого обычно получают комбинацию элементарной меди и белого йодида меди (I).
Соединения меди
Медь обычно образует соединения, известные как соли меди(II), которые в растворе имеют сине-зеленый цвет. Эти соли также растворимы в воде и могут быть ядовитыми в больших количествах. Многие живые организмы имеют следовые количества соединений в качестве необходимых питательных веществ. Синий цвет меди в водном растворе обусловлен образованием иона гексааквамеди (II), Cu (H 2 О) 6 2+ .
Сульфат меди
Сульфат меди(II) представляет собой неорганическое соединение с формулой CuSO 4 .
 В своей пентагидратной форме это соединение представляет собой ярко-синюю соль, которая растворяется в воде в результате экзотермической реакции и разлагается в безводную форму перед плавлением.
В своей пентагидратной форме это соединение представляет собой ярко-синюю соль, которая растворяется в воде в результате экзотермической реакции и разлагается в безводную форму перед плавлением.Безводный сульфат меди(II) представляет собой белое твердое вещество, которое образуется при дегидратации пентагидрата сульфата меди(II). Во многих тестах также используется сульфат меди (II) в качестве аналитического реагента.
Изоляция меди
Добавление более активного металла в раствор соединения меди может легко изолировать медь. Например, вы можете сделать медный порошок из алюминиевой фольги или медные кристаллы из куска цинка. В видео ниже мы делаем медный порошок
Кроме того, наночастицы меди были синтезированы с использованием подхода химического восстановления. В эксперименте раствор пентагидрата сульфата меди(II), крахмал, аскорбиновую кислоту и раствор гидроксида натрия объединяют и нагревают. После охлаждения исследователи могут отфильтровать осадок из конечного раствора.

ChemTalk Видео, показывающее, как выделить элементарную медь
Используйте алюминиевую фольгу, чтобы сделать красивый медный порошок. Подписывайтесь на наш канал на YouTube, скоро будет еще много потрясающих видео!Степени окисления меди
Медь существует в степенях окисления +1 и +2, известных как ион меди (Cu + ) и ион меди (Cu +2 ), и гораздо реже в степени окисления +3. Ион двухвалентной меди, меди (II), является наиболее распространенным и стабильным.
Физические свойства меди
- Символ: CU
- Точка плавления: 1084,62 O C
- Точка кипячения: 2595 O C
- Плотность: 8,96 G/CM 3 5.


 482
482 3
3

 Но мы даже не называем это медью.
Но мы даже не называем это медью. Он может быть наименьшим для всех необходимых микроэлементов. Вероятно, поэтому он широко используется в качестве пестицида, фунгицида и альгицида, потому что такие небольшие количества могут выполнять свою работу.
Он может быть наименьшим для всех необходимых микроэлементов. Вероятно, поэтому он широко используется в качестве пестицида, фунгицида и альгицида, потому что такие небольшие количества могут выполнять свою работу. В следующий раз мы будем углубляться в открытие элемента с очень огненным темпераментом.
В следующий раз мы будем углубляться в открытие элемента с очень огненным темпераментом. com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements.
com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. 
 Кроме того, организация перечислила 300 медных поверхностей как антимикробные. Термин «контактное уничтожение» был придуман для обозначения процесса инактивации микробов на медных поверхностях. По словам профессора Кассандры Д. Сальгадо, это происходит из-за того, что элемент «мешает электрическому заряду клеточных мембран организмов». Исследователи заметили, что эффективность контактного глушения увеличивается с увеличением содержания меди (в сплавах), повышением температуры и относительной влажности.
Кроме того, организация перечислила 300 медных поверхностей как антимикробные. Термин «контактное уничтожение» был придуман для обозначения процесса инактивации микробов на медных поверхностях. По словам профессора Кассандры Д. Сальгадо, это происходит из-за того, что элемент «мешает электрическому заряду клеточных мембран организмов». Исследователи заметили, что эффективность контактного глушения увеличивается с увеличением содержания меди (в сплавах), повышением температуры и относительной влажности. Нам нужно около миллиграмма меди каждый день. Медь используется в монетах большинства стран
Нам нужно около миллиграмма меди каждый день. Медь используется в монетах большинства стран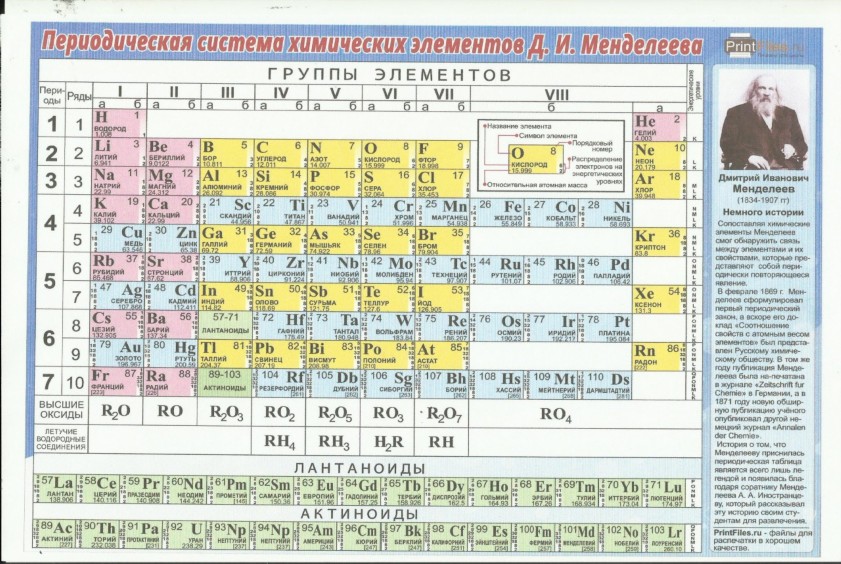 Медь образует оксид меди (I), а затем оксид меди (II), который затем превращается в основной карбонат меди. Этот зеленоватый слой называется патина и лучше всего видна на статуе свободы. Здесь есть хорошее объяснение. Если в воздухе есть загрязнения (например, диоксид серы), то в составе патины также будут образовываться сульфид меди и основной сульфат меди.
Медь образует оксид меди (I), а затем оксид меди (II), который затем превращается в основной карбонат меди. Этот зеленоватый слой называется патина и лучше всего видна на статуе свободы. Здесь есть хорошее объяснение. Если в воздухе есть загрязнения (например, диоксид серы), то в составе патины также будут образовываться сульфид меди и основной сульфат меди.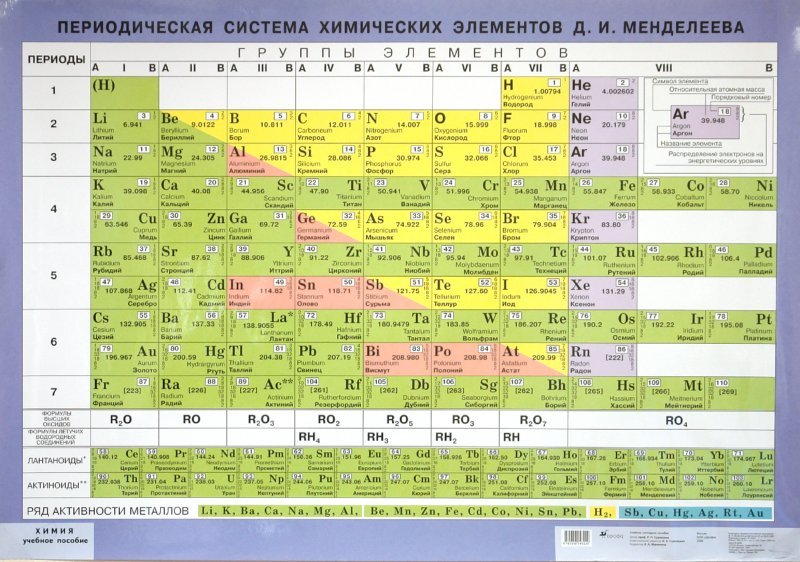
 С разбавленной азотной кислотой образуется менее токсичный NO.
С разбавленной азотной кислотой образуется менее токсичный NO. В своей пентагидратной форме это соединение представляет собой ярко-синюю соль, которая растворяется в воде в результате экзотермической реакции и разлагается в безводную форму перед плавлением.
В своей пентагидратной форме это соединение представляет собой ярко-синюю соль, которая растворяется в воде в результате экзотермической реакции и разлагается в безводную форму перед плавлением.
