Правило креста (“Конверт Пирсона”)
Разбавле́ние — уменьшение концентрации химического вещества в растворе добавлением растворителя или смешиванием с менее концентрированным раствором. При разбавлении сохраняется количество растворенного вещества.
Расчет растворов
Для приготовления растворов определенной концентрации следует тщательно рассчитывать массы и объемы смешиваемых растворов, исходя из сохранения количества растворенного вещества при разбавлении:
ω1⋅m1=ω2⋅m2,{\displaystyle \omega _{1}\cdot m_{1}=\omega _{2}\cdot m_{2},} либо
v1⋅V1=v2⋅V2,{\displaystyle v_{1}\cdot V_{1}=v_{2}\cdot V_{2},}
где ωi{\displaystyle \omega _{i}}, vi{\displaystyle v_{i}} означают массовые или объёмные доли, а mi{\displaystyle m_{i}} и Vi{\displaystyle V_{i}} означают массу или объем раствора до (i=1{\displaystyle i=1}) и после (i=2{\displaystyle i=2}) разбавления растворителем. При смешивании некоторых веществ (например, этанола и воды) суммарный объем смеси отличается от суммы объемов составляющих.
Пример
Запись концентраций ωi{\displaystyle \omega _{i}} по «правилу креста» показывает, сколько массовых или объемных частей компонентов mi{\displaystyle m_{i}} нужно для раствора ω{\displaystyle \omega } и массой m{\displaystyle m}.
Друг над другом пишутся процентные концентрации (массовые или объемные) соответственно разбавляемого раствора и разбавителя (для чистого растворителя пишется 0 %). Справа посередине пишется желаемая концентрация (её значение должно быть между концентрациями разбавляемого раствора и разбавителя). Далее производится вычитание по диагоналям от большего значения меньшего и полученные разности записываются напротив исходных растворов. Полученные цифры являются массами (если были взяты массовые проценты) или объемами (если были взяты объемные проценты) соответствующих растворов, которые необходимо взять для приготовления раствора, с концентрацией записанной в середине. Затем полученные значения приводят к необходимым массам или объемам по условиям задания (для перевода массовых единиц в объемы может понадобится знать плотность растворов).
ω1(ω2−ω)↘↗ω↗↘ω2(ω−ω1)}→m1=m⋅ω2−ωω2−ω1(ω2−ω1)→m2=m⋅ω−ω1ω2−ω1{\displaystyle \left.{\begin{array}{ccccccc}\omega _{1}&&&&\left(\omega _{2}-\omega \right)\\&\searrow &&\nearrow \\&&\omega \\&\nearrow &&\searrow \\\omega _{2}&&&&\left(\omega -\omega _{1}\right)\end{array}}\right\}{\begin{array}{ccc}&\rightarrow &m_{1}=m\cdot {\frac {\omega _{2}-\omega }{\omega _{2}-\omega _{1}}}\\&&\\\left(\omega _{2}-\omega _{1}\right)&&\\&&\\&\rightarrow &m_{2}=m\cdot {\frac {\omega -\omega _{1}}{\omega _{2}-\omega _{1}}}\end{array}}}
Действительно, чтобы из 50%-го раствора (по массовой концентрации) и воды (0 %) получить 18%-й раствор, следует взять (18−0)=18{\displaystyle (18-0)=18} массовых частей раствора и (50−18)=32{\displaystyle (50-18)=32} массовых частей воды.
Техника разбавления
При приготовлении растворов кислот требуется соблюдать правила техники безопасности: использовать очки, перчатки и фартуки.
Правило креста в химии — Dudom
Алгоритм нахождения массы растворенного вещества и массы воды, необходимые для приготовления раствора.
Задача.
Вычислить массу соли и воды, необходимые для приготовления 40 г раствора NаСl с массовой долей 5%.
1. Запишите условие задачи с помощью общепринятых обозначений
Дано:
Решение:
1. Рассчитайте массу растворенного вещества по формуле:
m (NаСl) = 5% · 40г/100% = 2г
2. Найдите массу воды по разности между массой раствора и массой растворенного вещества:
m (Н2О) = 40г – 2г = 38 г.
Ответ: для приготовления раствора необходимо взять 2г соли и 38г воды.
Алгоритм нахождения массовой доли растворенного вещества
При разбавлении (упаривании) раствора
Задача
К 15% раствору, масса которого 80г, добавили 30г воды. Какой стала массовая доля растворённого вещества в полученном растворе?
Какой стала массовая доля растворённого вещества в полученном растворе?
1. Запишите условие задачи с помощью общепринятых обозначений.
Дано:
Решение:
1. В результате разбавления (упаривания) раствора масса раствора увеличилась (уменьшилась), а вещества в нём осталось столько же.
Рассчитайте массу растворённого вещества, преобразуя формулу:
m в-ва = 15% · 80г/100%= 12 г
2. При разбавлении раствора общая масса его увеличивается (при упаривании — уменьшается).
Найдите массу вновь полученного раствора:
3. Рассчитайте массовую долю растворённого вещества в новом растворе:
ω2 = 12г/ 110г· 100% = 10,9%
4. Запишите ответ
Ответ: массовая доля растворенного вещества в растворе при разбавлении равна 10,9%
Алгоритм решения задач по «правилу креста»
Для получения раствора с заданной массовой долей (%) растворенного вещества путем смешивания двух растворов с известной массовой долей растворенного вещества пользуются диагональной схемой (“правило креста”).
Сущность этого метода состоит в том, что по диагонали из большей величины массовой доли растворенного вещества вычитают меньшую.
| a с – в / с / в а – с | где а – большая, в – меньшая, с – искомая массовая доля (%) растворенного вещества в растворе |
Разности (с-в) и (а-с) показывают, в каких соотношениях нужно взять растворы а и в, чтобы получить раствор с.
Если для разбавления в качестве исходного раствора используют чистый растворитель, например, Н20, то концентрация его принимается за 0 и записывается с левой стороны диагональной схемы.
Задача
Для обработки рук хирурга, ран, послеоперационного поля используется йодная настойка с массовой долей 5%. В каком массовом соотношении нужно смешать растворы с массовыми долями йода 2,5% и 30%, чтобы получить 330 г йодной настойки с массовой долей йода 5%?
1. Запишите условие задачи с помощью общепринятых обозначений.
Дано:
Решение:
1. Составьте “диагональную схему”. Для этого запишите массовые доли исходных растворов друг под другом, по левую сторону креста, а в центре заданную массовую долю раствора.
Составьте “диагональную схему”. Для этого запишите массовые доли исходных растворов друг под другом, по левую сторону креста, а в центре заданную массовую долю раствора.
2. Вычитают из бóльшей массовой доли меньшую (30–5=25; 5–2,5=2,5) и находят результаты.
Записывают найденные результаты с правой стороны диагональной схемы: при возможности сокращают полученные числа. В данном случае 25 в десять раз больше, чем 2,5, то есть вместо 25 записывают 10, вместо 2,5 пишут 1.
Числа (в данном случае 25 и 2,5 или 10 и 1) называют массовыми числами. Массовые числа показывают, в каком соотношении необходимо взять исходные растворы, чтобы получить раствор с массовой долей йода 5%.
3. Определите массу 30% и 2,5% раствора по формуле:
m (р-ра) = число частей · m3/ сумму массовых частей
m1(30%) = 1· 330г /1+10 = 30г
m2(2,5%) = 10 · 330г/ 1+10 = 300г
4. Запишите ответ.
Ответ: для приготовления 330 г раствора с массовой долей йода 5% необходимо смешать 300 г раствора с массовой долей 2,5% и 30 г с массовой долей 30%.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9507 —
| 7341 — или читать все.
91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Многие важные вопросы изучения курса химии по ряду причин исключены из школьной программы. Среди них закон эквивалентов, разные способы выражения концентрации растворов, правило креста и многие другие. Однако на факультативных занятиях, при подготовке ребят к олимпиадам без них не обойтись. Да и в жизни ребятам они пригодятся, особенно тем, кто свяжет будущую профессию с химией (заводские лаборатории, аптеки, научно-исследовательская работа, да и просто химия в быту).
Особенно трудно в этом отношении молодым учителям – у них нет той массы дополнительной литературы, которую накопили старые учителя за десятки лет работы в школе, а что издает современная книгопечатная отрасль промышленности – известно всем. Поэтому предлагаемая методика решения задач на растворы с применением правила креста, думается, хоть сколько-то поможет молодым коллегам в этом деле.
Очень часто в лабораторной практике и при решении олимпиадных задач приходится встречаться со случаями приготовления растворов с определенной массовой долей растворенного вещества, смешением двух растворов разной концентрации или разбавлением крепкого раствора водой. В некоторых случаях можно провести достаточно сложный арифметический расчет. Однако это малопродуктивно. Чаще для этого лучше применить правило смешения (диагональную модель «конверта Пирсона», или, что то же самое, правило креста).
Допустим, нужно приготовить раствор определенной концентрации, имея в распоряжении два раствора с более высокой и менее высокой концентрацией, чем нужно нам. Тогда, если обозначить массу первого раствора через m1, а второго – через m2, то при смешивании общая масса смеси будет слагаться из суммы этих масс. Пусть массовая доля растворенного вещества в первом растворе –
Тогда, если обозначить массу первого раствора через m1, а второго – через m2, то при смешивании общая масса смеси будет слагаться из суммы этих масс. Пусть массовая доля растворенного вещества в первом растворе –
1, во втором – 2, а в их смеси – 3. Тогда общая масса растворенного вещества в смеси будет слагаться из масс растворенного вещества в исходных растворах:
m1•
1 + m2•2 = 3(m1 + m2).
m1(
1 – 3) = m2(3 – 2),
m1/m2 = (
3 – 2)/(1 – 3).
Видно, что отношение массы первого раствора к массе второго раствора есть отношение разности массовых долей растворенного вещества в смеси и во втором растворе к разности соответствующих величин в первом растворе и в смеси.
При решении задач на растворы с разными концентрациями чаще всего применяют диагональную схему правила смешении. При расчетах записывают одну над другой массовые доли растворенного вещества в исходных растворах, справа между ними – его массовую долю в растворе, который нужно приготовить, и вычитают по диагонали из большего меньшее значение. Разности их вычитаний показывают массовые доли для первого и второго растворов, необходимые для приготовления нужного раствора.
Для пояснения этого правила сначала решим простейшую задачу.
ЗАДАЧА 1
Определите концентрацию раствора, полученного при слиянии 150 г 30%-го и 250 г 10%-го растворов какой-либо соли.
Дано:
m1 = 150 г,
m2 = 250 г,
1 = 30%,
2 = 10%.
Найти:
Решение
1-й способ (метод пропорций).
Общая масса раствора:
Массу вещества в первом растворе находим методом пропорций, исходя из определения: процентная концентрация раствора показывает, сколько граммов растворенного вещества находится в 100 г раствора:
100 г 30%-го р-ра – 30 г в-ва,
150 г 30%-го р-ра – х г в-ва,
х = 150•30/100 = 45 г.
Для второго раствора составляем аналогичную пропорцию:
100 г 10%-го р-ра – 10 г в-ва,
250 г 10%-го р-ра – y г в-ва,
y = 250•10/100 = 25 г.
Следовательно, 400 г нового раствора содержит 45 + 25 = 70 г растворенного вещества.
Теперь можно определить концентрацию нового раствора:
400 г р-ра – 70 г в-ва,
100 г р-ра – z г в-ва,
z = 100•70/400 = 17,5 г, или 17,5%.
2-й способ (алгебраический).
m1•
1 + m2•2 = 3(m1 + m2).
3 = (m1•1 + m2•2)/(m1 + m2).
В результате находим:
3 = (150•30 + 250•10)/(150 + 250) = 17,5%.
3-й способ (правило креста).
(
3 – 10)/(30 – 3) = 150/250.
(30 –
3)•150 = (3 – 10)•250,
4500 – 150
3 = 2503 – 2500,
4500 – 2500 = 250
3 – 1503,
7000 = 400
3, 3 = 7000/400 = 17,5%.
Ответ. При слиянии взятых растворов получится новый раствор с концентрацией
3 = 17,5%.
Теперь решим задачи посложнее.
ЗАДАЧА 2
Определите, сколько нужно взять 10%-го раствора соли и 30%-го раствора этой же соли для приготовления 500 г 20%-го раствора.
Дано:
1 = 10%,
2 = 30%,
3 = 20%,
m3 = 500 г.
Найти:
Решение
Используем правило креста.
Для приготовления 500 г 20%-го раствора соли нужно взять по 10 частей растворов исходных концентраций.
Проверим правильность нашего решения, учитывая, что 1 часть равна 500/(10 + 10) = 25 г.
250 г 10%-го р-ра – х г соли,
100 г 10%-го р-ра – 10 г соли,
х = 250•10/100 = 25 г.
250 г 30%-го р-ра – y г соли,
100 г 30%-го р-ра – 30 г соли,
y = 250•30/100 = 75 г.
m(р-ра) = 250 + 250 = 500 г.
m(соли) = 25 + 75 = 100 г.
Отсюда находим
3:
500 г р-ра – 100 г соли,
100 г р-ра –
3 г соли,
3 = 100•100/500 = 20 г, или 20%.
Ответ. Для приготовления 500 г 20%-го раствора нужно взять исходные растворы по 250 г
(m1 = 250 г, m2 = 250 г).
ЗАДАЧА 3
Определите, сколько нужно взять растворов соли 60%-й и 10%-й концентраций для приготовления 300 г раствора 25%-й концентрации.
Дано:
1 = 60%,
2 = 10%,
3 = 25%,
3 = 300 г.
Найти:
Решение
Масса одной части: 300/50 = 6 г.
Проверим правильность решения.
100 г 60%-го р-ра – 60 г соли,
90 г 60%-го р-ра – х г соли,
100 г 10%-го р-ра – 10 г соли,
210 г 30%-го р-ра – y г соли,
m(соли) = 54 + 21 = 75 г.
Находим концентрацию нового раствора:
300 г р-ра – 75 г соли,
100 г р-ра – z г соли,
z = 100•75/300 = 25 г, или 25%.
Теперь перейдем к еще более сложным задачам.
ЗАДАЧА 4
Определите массу раствора Nа2СО310%-й концентрации и массу сухого кристаллогидрата Na2CO3•10H2O, которые нужно взять для приготовления 540 г раствора 15%-й концентрации.
Дано:
1 = 10%,
3 = 15%,
m3 = 540 г.
Найти:
Решение
1-й способ (через систему уравнений с двумя неизвестными).
Определяем массу соли Na2CO3 в 540 г 15%-го раствора:
100 г 15%-го р-ра – 15 г соли,
540 г 15%-го р-ра – z г соли,
z = 540•15/100 = 81 г.
Cоставляем систему уравнений:
Находим молярную массу:
Избавляемся от лишних неизвестных:
100 г 10%-го р-ра – 10 г соли,
Подставляем m2 и m1 в систему уравнений:
С учетом того, что х = 81 – y, избавляемся от второго неизвестного:
Тогда m2 = 286y/106 = 2,7•37
100 г – это масса необходимого количества кристаллогидрата Na2СО3•10H2O.
Далее находим: х = 81 – y = 81 – 37 = 44 г – это масса соли из 10%-го раствора.
Находим массу 10%-го раствора:
100 г 10%-го р-ра – 10 г соли,
m1 г 10%-го р-ра – 44 г соли,
Видно, что так можно решить данную задачу – способ надежный, но, к сожалению, достаточно длинный, громоздкий и сложный. Им успешно могут воспользоваться учащиеся с достаточно развитым логическим мышлением. Для других он будет сложноват.
2-й способ (правило креста).
Допустим, что Na2СО3•10H2O – это «сухой раствор» (ведь он же содержит воду). Тогда найдем его «концентрацию»:
286 г – 106 г соли,
100 г – х г соли,
х = 100•106/286 = 37 г, или 37%.
Применяем правило креста.
Находим массу одной части и массы веществ:
Ответ. Для приготовления 540 г раствора Na2CO3 15%-й концентрации необходимо взять 440 г 10%-го раствора и 100 г кристаллогидрата.
Таким образом, применение правила креста удобнее и проще при решении подобных задач. Этот способ более экономичен по времени и менее трудоемок.
Правило креста можно применять и в тех случаях, когда нужно получить раствор меньшей концентрации путем разбавления водой более концентрированного раствора или получить более концентрированный раствор путем добавления к исходному раствору сухой смеси. Рассмотрим это на примерах.
Рассмотрим это на примерах.
ЗАДАЧА 5
Сколько воды нужно добавить к 250 г раствора соли для понижения его концентрации с 45% до 10%?
Дано:
1 = 45%,
3 = 10%,
m1 = 250 г.
Найти:
Решение
Принимаем, что концентрация для добавляемой воды –
2 = 0%. Используем правило креста.
Определяем массу одной части через первый раствор: 250/10 = 25 г.
Тогда масса необходимой воды равна:
Проверим правильность решения.
Масса нового раствора:
Масса соли в исходном растворе:
250 г 45%-го р-ра – х г соли,
100 г 45%-го р-ра – 45 г соли,
х = 250•45/100 = 112,5 г.
Находим
3:
1125 г р-ра – 112,5 г соли,
100 г р-ра – y г соли,
y = 100•112,5/1125 = 10 г, или 10%.
ЗАДАЧА 6
Сколько сухой соли нужно добавить к 250 г раствора 10%-й концентрации для ее увеличения до 45%?
Дано:
1 = 10%,
m1 = 250 г,
3 = 45%.
Найти:
Решение
Принимаем, что сухая соль – это раствор с
2 = 100%. Используем правило креста.
Определяем массу одной части через первый раствор: 250/55 = 4,5 г.
Определяем массу сухой соли:
m(с. с.) = 4,5•35 = 158 г.
Проверяем правильность решения.
Масса нового раствора:
Масса соли в исходном растворе:
100 г 10%-го р-ра – 10 г соли,
250 г 10%-го р-ра – х г соли,
х = 250•10/100 = 25 г.
Общая масса соли в новом растворе:
Концентрация нового раствора:
408 г р-ра – 183 г соли,
100 г р-ра – y г соли,
y = 100•183/408 = 45 г, или 45%.
Ответ. m(с. с.) = 158 г.
Думается, что опытный учитель всегда найдет несколько способов решения любой задачи. Но как учила меня моя первая учительница по химии Клавдия Макаровна в школе № 17 г. Иркутска, так и я стараюсь учить своих учеников: всегда глубоко продумывать и понимать химическую сущность задачи и находить наиболее рациональный способ ее решения, а не просто подгонять под ответ в конце учебника.
В данном разделе рассмотрены задачи на пересчет концентрации растворов, применение правила креста для нахождения концентрации при смешении и разбавлении растворов. Больше задач на расчет массовой доли растворенного вещества представлены в разделе подготовки к ОГЭ по химии.
Концентрация растворов и способы ее выражения
Задача 1. К 150 г 20% раствора сахарозы добавили 45 г глюкозы. Рассчитайте массовые доли углеводов в новом растворе.
Решение.
Вначале сахарозы было 30 г:
20 г сахарозы содержится в 100 г раствора
После прибавления глюкозы:
mобщ = m (сахарозы) + m (глюкозы) = 150 + 45 = 195 г
m раствора стала 195 г
Найдем полученные массовые доли сахарозы и глюкозы:
30 г сахарозы содержится в 195 г раствора
ω2 (сахарозы) = 15,4%:
45 г глюкозы содержится в 195 г раствора
ω2 (глюкозы) = 23,1%
Задача 2. Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра.
Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра.
Решение.
Согласно закону эквивалентов при нейтрализации в точке эквивалентности действует равенство, называемое Золотым правилом аналитики:
Задача 3. Нормальная концентрация раствора KNO3равна 0,2 моль/л. Найти процентную концентрацию раствора KNO3и молярную концентрацию раствора KNO3.Плотность раствора принять раной 1 г/мл.
Решение:
Найдем молярную массу и молярную массу эквивалента KNO3.
В данном случае, они совпадают.
М (KNO3) = 39+14+(16×3) = 101 г/моль
Найдем массу KNO3, содержащуюся в его 0,2 н. растворе:
растворе:
1 н раствор KNO3 содержит – МЭ KNO3 в 1000 мл
1М раствор KNO3 содержит – М KNO3 в 1000 мл
Таким образом, Сн = См= 0,2 моль/л
Сначала необходимо рассчитать массу раствора объемом 1000 мл.
m = ρ×V = 1×1000 = 1000 г
тогда, решая пропорцию, находим:
20,2 г KNO3 содержится – в 1000 г раствора
х г – в 100 г раствора
ω = 2,02%
Задача 4. Вычислите молярную и молярную концентрацию эквивалента 20 % раствора хлорида кальция плотностью 1,178 г/мл.
Решение.
Найдем массу раствора
mр-ра = V·ρ = 1000 · 1,178 = 1178 г.
Найдем массу CaCl2, содержащуюся в 1178 г. 20 % раствора
20 г CaCl2 содержится в 100 г раствора
х г — в 1178 г раствора
n = m/M = 235,6/111 = 2,1 моль
M(CaCl2) = 40+35,5·2 = 111 г/моль
См = 2,1/1 = 2,1 М
Молярная концентрация эквивалента определяется с помощью соотношения:
Мэ = fэкв· М(CaCl2) = 1/2·111 = 55,5 г/моль
Сн = 4,2/1 = 4,2 н
Задача 5. Чему равна нормальность 30% раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора.
Чему равна нормальность 30% раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора.
Решение.
Найдем массу NaOH, содержащуюся в 1328 г. 30 % раствора используя формулу:
ω(NaOH) = m (NaOH)/m
mр-ра = V·ρ = 1000 · 1,328 = 1328 г.
m(NaOH) = ω(NaOH) · m = 0,3 · 1328 = 398,4 г.
M(NaOH) = 23+16+1 = 40 г/моль
Мэ = fэкв· М(NaOH) = 1·40 = 40 г/моль
Найдем массу раствора после прибавления 5 л воды:
m2 = 1328 + 5000 = 6328 г
ω2(NaOH) = m (NaOH)/m2 = 398,4/6328 = 0,063 или 6,3 %
Задача 6. К 3 л 10 % раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2 % раствора той же кислоты плотностью 1,009 г/мл. Вычислите массовую долю в процентах и молярную концентрацию полученного раствора, объем которого равен 8 л.
Решение.
Найдем массу растворов объемом 3 л и 5 л
m1= V1·ρ = 3000·1,054 = 3162 г
m2= V2·ρ = 5000·1,009 = 5045 г
Найдем массу HNO3, содержащуюся в 3162 г. 10 % раствора
10 г HNO3 содержится в 100 г ее раствора
х1 г — в 3162 г раствора
Найдем массу HNO3, содержащуюся в 5045 г. 2 % раствора
2 г HNO3 содержится в 100 г ее раствора
х2 г — в 5045 г раствора
При смешивании:
m (HNO3) = 316,2+100,9 = 417,1 г
n = m/M = 417,1/63 = 6,62 моль
M(HNO3) = 1+14+16·3 = 63 г/моль
См= 6,62/1 = 6,62 М
Задача 7. Определить молярность, нормальность, моляльность и титр 4 % раствора FeSO4 объем которого равен 1,5 л, плотность 1037 кг/м 3
Решение.
M (FeSO4) = 56+32+16·4 = 152 г/моль
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
Найдем m раствора объемом 1,5 л
m = V·ρ = 1,5·10 -3 ·1037 = 1,56 кг
Найдем m 4 % раствора
m(FeSO4) = ω(FeSO4) · mр-ра = 0,04·1,56 = 0,0624 кг = 62,4 г
Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора
n = m/М = 62,4/152 = 0,41 моль
Найдем нормальность:
b (x) = n(x)/m
Масса растворителя равна: mH2O = 1560-62,4 = 1497,6 г = 1,5 кг
b (FeSO4) = n(FeSO4)/m = 0,41/1,5 = 0,27 моль/кг
Титр определим следующим образом:
Т (х) = m (х)/V
Т (FeSO4) = m (FeSO4)/V = 62,4/1500 = 0,0416 г/мл
Задачи на смешение и разбавление растворов
Такие задачи можно решить с помощью правила креста или правила смешения. Суть его заключается в составлении «креста», в виде которого располагают две прямые линии. В центре пишут ту концентрацию, которую надо получить, у концов линий креста слева – концентрации исходных растворов (большую – сверху, меньшую — снизу), у концов линий креста справа – искомые концентрации (или массы) растворов, которые получают вычитанием по направлению линий из большей величины меньшей. В общем виде схема решения задач по правилу креста имеет вид:
Суть его заключается в составлении «креста», в виде которого располагают две прямые линии. В центре пишут ту концентрацию, которую надо получить, у концов линий креста слева – концентрации исходных растворов (большую – сверху, меньшую — снизу), у концов линий креста справа – искомые концентрации (или массы) растворов, которые получают вычитанием по направлению линий из большей величины меньшей. В общем виде схема решения задач по правилу креста имеет вид:
Таким образом, следует взять mА грамм раствора с массовой долей а% и прибавить к нему mB грамм раствора с массовой долей b%. Если надо узнать, какие массы растворов данной концентрации следует взять, чтобы получить заданную массу раствора новой концентрации, то сначала определяют отношение mА и mB . Затем пропорционально этому отношению делят заданную массу.
Задача 8. Сколько граммов раствора с массовой долей серной кислоты 96% необходимо влить в 1 л воды, чтобы получить раствор с массовой долей 10%
Решение .
Для решения данной задачи используем правило креста.
Чистый растворитель (воду) можно представить как раствор с массовой долей растворенного вещества 0%
Определим m раствора с ω (H2SO4) = 96%, который надо влить в 1 л воды:
10 г H2SO4 надо влить в 86 г воды
Задача 9. Сколько мл 0,5 М и 0,1 М растворов азотной кислоты следует взять для приготовления 1000 мл 0,2 М раствора.
Решение.
По правилу креста, определяем в каких соотношениях следует взять 0,5 М и 0,1 М растворы азотной кислоты, чтобы получить раствор заданной концентрации:
Взяв 0,1 л и 0,3 л исходных растворов, получим 0,4 л 0,2 М раствора HNO3, но по условию задачи нужно получить 1 л. Для этого разделим 1 л на две части в соотношении 1:3, составив пропорции:
из 0,1 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
из 0,3 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
Как рассчитать и смешать химические растворы
••• Creatas Images/Creatas/Getty Images
Обновлено 14 марта 2018 г.
Автор Douglas Bintzler
Учащимся старших классов может потребоваться смешивать химические растворы при проведении лабораторных экспериментов. Важно правильно смешать химические вещества в полезный химический раствор. Некоторые растворы рассчитываются как весовые проценты, вес/объем, или проценты объема, объемные. Другие основаны на молярности или молях на литр. Химическое вещество, которое разбавляется или растворяется, называется растворенным веществом, а жидкая среда — растворителем. Понимание правильных методов смешивания химических веществ с раствором важно для студентов, чтобы провести успешный лабораторный эксперимент.
Растворы, основанные на процентах
Определите, дается ли процентный раствор как масса/объем или объем/объем. Растворы, основанные на измерениях масса/объем, обычно представляют собой твердые химические вещества, растворенные в жидком растворителе, таком как вода. Растворы, основанные на измерениях объема/объема, представляют собой жидкость, разбавленную в жидкости.
Рассчитайте соответствующее объемное разведение по формуле C1V1 = C2V2, где C представляет собой концентрацию растворенного вещества, а V представляет собой объем в миллилитрах или мл. Примером может быть объединение 95-процентного этанола с водой смешать 100 мл 70-процентного этанола. Расчет: 95% X V1 = 70% X 100 мл. Неизвестный объем составляет 73,6 мл 95-процентного этанола с 26,4 мл воды, чтобы получить 100 мл.
Перед добавлением растворителя налейте растворенное вещество в мерный цилиндр или мерную колбу. Мерные цилиндры и мерные колбы используются, потому что измерения более точны, чем с химическими стаканами. Химические стаканы обычно используются для приблизительных объемов и смешивания.
Взвешивание соответствующего твердого химического вещества для смешивания раствора масса/объем. 10-процентный раствор равен 10 граммам сухого химиката в конечном объеме 100 мл. Растворенное вещество добавляет объем и учитывается в конечном объеме раствора.
Перед добавлением растворителя добавьте в химический стакан твердое растворенное вещество. Это позволит избежать добавления избытка растворителя в раствор. Вы должны дать сухому раствору раствориться в растворителе, прежде чем добавлять его к общему объему. Перелейте раствор в мерный цилиндр или мерную колбу и добавьте растворитель до достижения конечного объема.
Это позволит избежать добавления избытка растворителя в раствор. Вы должны дать сухому раствору раствориться в растворителе, прежде чем добавлять его к общему объему. Перелейте раствор в мерный цилиндр или мерную колбу и добавьте растворитель до достижения конечного объема.
Растворы, рассчитанные с использованием молярности
Определите, находится ли растворенное вещество в твердой или жидкой форме. Обычно указывается молярность или M жидкого растворенного вещества, и может потребоваться только простое разбавление. Твердое растворенное вещество потребует точного измерения веса.
Рассчитайте разведение жидких растворенных веществ по формуле C1V1 = C2V2. Разбавление 5M хлорида натрия, NaCl, для получения 100 мл 1M раствора будет рассчитано как 5M X V1 = 1M X 100 мл. Значение для V1 составляет 20 мл с 80 мл воды для конечного объема 100 мл.
Перед добавлением растворителя налейте растворенное вещество в мерный цилиндр или мерную колбу. Затем добавьте растворитель для достижения желаемого объема.
Затем добавьте растворитель для достижения желаемого объема.
Определите молекулярную массу сухого растворенного вещества. Молекулярная масса будет указана на контейнере с химическим веществом и в Паспорте безопасности материала или MSDS. Молекулярная масса равна 1 моль. Хлорид натрия имеет молекулярную массу 58,4 грамма. Следовательно, 58,4 грамма, растворенные в общем объеме 1 литра, равны 1М раствору.
Рассчитайте вес растворенного вещества в граммах для приготовления 1 литра раствора. Вы можете рассчитать вес в граммах из заданной молярности раствора, используя формулу MW X молярность. Для 2М раствора хлорида натрия требуется 58,4 грамма X 2М, или 116,8 грамма на 1 литр.
Определите общий объем, необходимый для эксперимента. Для экспериментального метода не обязательно требуется 1 литр раствора. Может потребоваться всего 100 мл или 0,1 л. Масса граммов, необходимая для смешивания 2М раствора хлорида натрия в 100 мл, составляет 0,1 литра X 116,8 грамма или 11,7 грамма хлорида натрия.
Добавьте твердое растворенное вещество в химический стакан перед добавлением растворителя. Добавьте достаточное количество растворителя, чтобы растворить твердое вещество. Перелейте раствор в мерный цилиндр или мерную колбу и добавьте растворитель до конечного объема.
Регулировка pH раствора
- Аналитические весы
- Мерные цилиндры
- Мерный стакан или колба Эрленмейера
- pH-метр или индикаторная бумага pH
- Мерная колба
- 90 Мерные цилиндры также можно использовать, если мерные колбы недоступны. Мензурки и колбы Эрленмейера не очень точны для измерения объема, но обычно используются для смешивания.
При смешивании химических растворов всегда следует использовать соответствующее защитное оборудование, включая средства защиты глаз. Кислоты и щелочи, используемые для регулирования pH, могут быть вредны для глаз. Другие химические вещества выделяют вредные пары и могут потребовать вытяжного шкафа. Паспорт безопасности обычно предоставляется вместе с химическим веществом или доступен в Интернете и содержит важную информацию о безопасности.
Измерьте pH конечного раствора с помощью pH-метра или pH-бумаги. pH-метр обеспечивает наиболее точное измерение. Однако бумаги для измерения pH может быть достаточно, если нет измерительного прибора. Примером буфера является хлорид натрия, раствор NaCl в воде.
Определите, является ли pH выше, более щелочным или ниже, более кислым, чем требуемый pH. NaCl растворяется в воде, что дает нейтральный pH 7.
Добавьте реагент, чтобы изменить pH до желаемого значения. Реагент, используемый для изменения pH, должен быть достаточно разбавлен и не изменять химический состав раствора. Соляная кислота, 0,1 М HCl, будет использоваться для снижения рН, а гидроксид натрия, 0,1 М NaOH, будет использоваться для повышения рН. Сочетание HCl и NaOH в воде дает хлорид натрия.
Сочетание HCl и NaOH в воде дает хлорид натрия.
Вещи, которые вам понадобятся
Предупреждения
Статьи по теме
Ссылки
- Университет Райса: Формулы для решений
- ChemGuide: Кривые титрования pH
Наконечники
- Мерные колбы являются точными устройствами для измерения конечного объема.
 Мерные цилиндры также можно использовать, если мерные колбы недоступны. Мензурки и колбы Эрленмейера не очень точны для измерения объема, но обычно используются для смешивания.
Мерные цилиндры также можно использовать, если мерные колбы недоступны. Мензурки и колбы Эрленмейера не очень точны для измерения объема, но обычно используются для смешивания.
Предупреждения
- При смешивании химических растворов всегда следует использовать соответствующее защитное оборудование, включая средства защиты глаз. Кислоты и щелочи, используемые для регулирования pH, могут быть вредны для глаз. Другие химические вещества выделяют вредные пары и могут потребовать вытяжного шкафа. Паспорт безопасности обычно предоставляется вместе с химическим веществом или доступен в Интернете и содержит важную информацию о безопасности.
Об авторе
Дуглас Бинтцлер начал писать внештатно в 2010 году. Он более 20 лет занимается написанием научного контента для веб-сайтов, информационных бюллетеней и руководств для научно-исследовательской аудитории. Его исследовательские публикации появились в «Журнале биотехнологии». Образование Бинцлера включает степени в области зоологии, химии и аспирантуру в области генетики.
Фотокредиты
Creatas Images/Creatas/Getty Images
Обработка, расчеты, подготовка и хранение стандартов
Руководство по эксплуатации ICP: часть 3 Пол Гейнс, доктор философии.
Обзор
В этом разделе содержится основная информация об обращении, подготовке и хранении стандартов, а также основные расчеты и номенклатура.
Обращение
Соблюдение следующих рекомендаций значительно сэкономит время, деньги и нервы:
- Никогда не помещайте устройства для переноса раствора в стандартный раствор. Эта мера предосторожности позволяет избежать возможного загрязнения пипеткой или устройством для переноса.
- Всегда переливайте аликвоту из стандартного раствора в подходящий контейнер для переноса раствора пипеткой и не добавляйте удаленную аликвоту обратно в исходный контейнер со стандартным раствором. Эта предосторожность предназначена для предотвращения загрязнения исходного стандартного раствора.
- Выполните перенос раствора пипеткой при комнатной температуре.
 Водные стандартные растворы, хранящиеся при «более низкой» температуре, будут иметь более высокую плотность. Передача весового раствора позволяет избежать этой проблемы, если известна плотность стандартного раствора или единицы концентрации выражены в мас./мас. а не масса/объем.
Водные стандартные растворы, хранящиеся при «более низкой» температуре, будут иметь более высокую плотность. Передача весового раствора позволяет избежать этой проблемы, если известна плотность стандартного раствора или единицы концентрации выражены в мас./мас. а не масса/объем. - Никогда не используйте стеклянные пипетки или устройства для переноса со стандартными растворами, содержащими HF. Свободный HF воздействует на стекло, но иногда считается безопасным использовать стекло, если HF указан как след и/или как комплекс. Однако многие фторированные соединения так же легко разъедают стекло, как и свободный HF.
- Не доверяйте переносу стандартного раствора с помощью мерной пипетки. Взвесьте аликвоту взятого стандарта. Это легко вычислить, если известна плотность стандартного раствора. Существует слишком много возможных ошибок пипетирования, чтобы рисковать объемным переносом без проверки точности путем взвешивания аликвоты.
- Вскройте стандартные растворы на складе за минимально возможное время.
 Это делается для того, чтобы избежать концентрации аналитов при испарении, а также возможного загрязнения окружающей среды.
Это делается для того, чтобы избежать концентрации аналитов при испарении, а также возможного загрязнения окружающей среды. - Регулярно заменяйте свои стандартные растворы. Регулирующие органы рекомендуют или требуют как минимум ежегодную замену. Почему предпринимается такая предосторожность, учитывая тот факт, что подавляющее большинство неорганических стандартных растворов химически стабильны в течение многих лет? Это связано с изменением концентрации стандарта из-за испарения контейнера и возможностью ошибки оператора при обычном использовании (дополнительная информация). Ошибка может произойти при первом использовании стандартного раствора или может никогда не произойти с вероятностью, увеличивающейся по мере использования и времени. Кроме того, эффект концентрации транспирации возникает независимо от того, открыт/использован стандартный раствор или нет, и увеличивается с использованием и увеличением парового пространства (скорость транспирации пропорциональна отношению длины окружности отверстия бутылки к паровому пространству).

Расчеты
Единицы концентрации для химических стандартных растворов, используемых для ИСП, обычно выражаются в мкг/мл (микрограммы на миллилитр) или нг/мл (нанограммы на миллилитр). Например, раствор Ca +2 с концентрацией 1000 мкг/мл содержит 1000 мкг Ca +2 на каждый мл раствора, а раствор Ca +2 с концентрацией 1 мкг/мл содержит 1000 нг Ca +2. на миллилитр раствора. Для преобразования метрических единиц концентрации применяются следующие преобразования:
| Префикс | Научное обозначение | Десятичные эквиваленты | Примеры Единицы |
|---|---|---|---|
| кило- (k) | = 10 3 | = 1000 г | килограмм (кг) |
| милли- (м) | = 10 -3 | = 0,001 г | миллиграмм (мг) |
| микро- (мк) | = 10 -6 | = 0,000001 г | микрограмм (мкг) |
| нано-(н) | = 10 -9 | = 0,000000001 г | нанограмм (нг) |
| пико-(п) | = 10 -12 | = 0,000000000001 г | пикограмм (пг) |
| Префикс | Научное обозначение | Десятичные эквиваленты | Примеры Единицы |
|---|---|---|---|
| милли- (м) | = 10 -3 | = 0,001 л | миллилитр (мл) |
| микро- (мк) | = 10 -6 | = 0,000001 л | микролитр (мкл) |
| нано-(н) | = 10 -9 | = 0,000000001 л | нанолитр (нл) |
| пико-(п) | = 10 -12 | = 0,000000000001 л | пиколитр (пл) |
Часто путают разницу между ppm и мкг/мл. Распространенной ошибкой является обращение к единицам концентрации в ppm как к сокращению (частям на миллион), когда на самом деле мы имеем в виду мкг/мл. Один ppm в действительности равен 1 мкг/г. Аналогичным образом ppb (частей на миллиард) часто приравнивают к нг/мл. Одна часть на миллиард в действительности равна 1 нг/г. Для преобразования ppm или ppb в мкг/мл или нг/мл необходимо знать плотность раствора. Уравнение для преобразования между мас./мас. и мас./об. единиц:
Аналогичным образом ppb (частей на миллиард) часто приравнивают к нг/мл. Одна часть на миллиард в действительности равна 1 нг/г. Для преобразования ppm или ppb в мкг/мл или нг/мл необходимо знать плотность раствора. Уравнение для преобразования между мас./мас. и мас./об. единиц:
(мкг/г) (плотность в г/мл) = мкг/мл
и/или
(нг/г) (плотность в г/мл) = нг/мл
Следовательно, если у нас есть решение это 1000 мкг/мл Ca +2 и знать или измерить плотность, которая составляет 1,033 г/мл, тогда ppm Ca +2 = (1000 мкг/мл) / (1,033 г/мл) = 968 мкг/г = 968 частей на миллион.
При разведении полезно использовать следующее уравнение: мкг/мл раствора Ca +2 требуется для приготовления 250 мл раствора Ca +2 с концентрацией 0,3 мкг/мл, мы будем использовать приведенное выше уравнение следующим образом:
(мл A )(1000 мкг/мл) = (250 мл) (0,3 мкг/мл)
(мл A ) = [(250 мл)(0,3 мкг/мл)]/ (1000 мкг/мл)
(мл A ) = 0,075 мл = 75 мкл
3
3
3 Приготовление
Вес ≠ Объем
Стандартные химические растворы могут быть приготовлены по весу или объему. Отказ от стеклянных мерных колб может быть необходим для устранения определенных проблем загрязнения при использовании боросиликатного стекла или для предотвращения химического воздействия на стекло. Часто предполагается, что 100 граммов водного раствора достаточно близки к 100 мл, чтобы не иметь существенного значения, поскольку плотность воды при комнатной температуре очень близка к 1,00 (0,9).98203 при 20,0 °С). Разводить/приготовлять стандартные растворы по весу намного проще. Тем не менее, вышеуказанное предположение не должно быть сделано. Проблема заключается в том, что стандарты микроэлементов чаще всего готовят в смесях вода + кислота, где плотность обычных минеральных кислот значительно превышает 1,00. Например, 5% об./об. водный раствор азотной кислоты будет иметь плотность ~1,017 г/мл, что соответствует фиксированной погрешности ~1,7%. Более высокие уровни азотной кислоты приведут к большим фиксированным ошибкам. Этот же тип проблемы верен для растворов других кислот в степени, которая является функцией плотности и концентрации кислоты в стандартном растворе, как описано следующим уравнением (используется только для оценки):
Отказ от стеклянных мерных колб может быть необходим для устранения определенных проблем загрязнения при использовании боросиликатного стекла или для предотвращения химического воздействия на стекло. Часто предполагается, что 100 граммов водного раствора достаточно близки к 100 мл, чтобы не иметь существенного значения, поскольку плотность воды при комнатной температуре очень близка к 1,00 (0,9).98203 при 20,0 °С). Разводить/приготовлять стандартные растворы по весу намного проще. Тем не менее, вышеуказанное предположение не должно быть сделано. Проблема заключается в том, что стандарты микроэлементов чаще всего готовят в смесях вода + кислота, где плотность обычных минеральных кислот значительно превышает 1,00. Например, 5% об./об. водный раствор азотной кислоты будет иметь плотность ~1,017 г/мл, что соответствует фиксированной погрешности ~1,7%. Более высокие уровни азотной кислоты приведут к большим фиксированным ошибкам. Этот же тип проблемы верен для растворов других кислот в степени, которая является функцией плотности и концентрации кислоты в стандартном растворе, как описано следующим уравнением (используется только для оценки):
d S = [(100-%) + (d A )(%)] / 100
Где:
d S = плотность конечного раствора
% = % по объему заданный водный раствор кислоты
d A = плотность используемой концентрированной кислоты
Например, давайте оценим плотность 10% об/об водного раствора азотной кислоты, приготовленного с использованием 70% концентрированной азотной кислоты с плотностью 1,42 г/мл.
D S = [(100-%) + (d A )(%)]/100 = [(100-10) + (1,42)(10)]/100 = (90 + 14,2)/100 = 1,042 г/мл
Содержание кислоты
Еще одна непонятная область связана с выражением содержания кислоты в растворе. Мы все согласны с тем, что важно, чтобы матрица соответствовала раствору стандарта и образца, чтобы избежать фиксированной ошибки в скорости поглощения раствора и/или эффективности распыления, которую иногда называют интерференцией матрицы. Если раствор помечен как 5% HNO 3 , что это означает? Если взять 5 мл 70% концентрированной азотной кислоты и разбавить до объема 100 мл то это 5% HNO 3 (об./об.), где предполагается использование 70% концентрированной кислоты. Однако азотную кислоту можно приобрести с концентрацией 40%, 65%, 70% и > 90%. Поэтому обратите внимание на концентрацию используемой концентрированной кислоты, если она отличается от «нормы», а также на метод приготовления, т. е. объем/объем или вес/вес, или вес/объем, или объем/вес.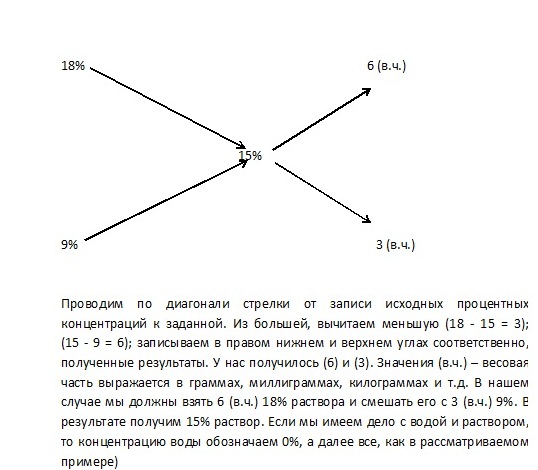 Вес. % концентрации обычных минеральных кислот, плотности и другая информация показаны в следующей таблице:
Вес. % концентрации обычных минеральных кислот, плотности и другая информация показаны в следующей таблице:
| Кислота | Мол. Вес. | Плотность (г/мл) | Вес. % | Молярность |
|---|---|---|---|---|
| Соляная кислота | 36,46 | 1,19 | 37.2) | 12,1 |
| Фтористоводородная | 20,0 | 1,18 | 49.0) | 28,9 |
| Азотная | 63.01 | 1,42 | 70.4 | 15,9 |
| Перхлорная | 100,47 | 1,67 | 70,5 | 11,7 |
| Фосфорный | 97.10 | 1,70 | 85,5 | 14,8 |
| Серный | 98.08 | 1,84 | 96,0 | 18,0 |
Содержание кислоты в молярности
Важно знать, что означают единицы концентрации используемой концентрированной кислоты. Если взять в качестве примера 70%-ную концентрированную азотную кислоту, это означает, что в 100 граммах этой кислоты содержится 70 граммов HNO 3 . Концентрация выражена как 70% мас./мас. или 70 вес. % HNO 3 . Некоторые аналитики предпочитают работать с концентрацией матричной кислоты в единицах молярности (моль/литр). Для расчета молярности 70 мас. % азотной кислоты вычисляем, сколько молей HNO 3 содержится в 1 л кислоты. Допустим, мы тарируем мерную колбу объемом 1 л и затем разбавляем до метки 70,4 мас. % HNO 3 . Затем мы измерили бы вес раствора как 1420 граммов. Зная, что раствор содержит 70,4 мас.%, мы можем рассчитать количество граммов HNO 3 , которое будет (0,704)(1420 г) = 999,7 граммов HNO 3 на литр. Разделив количество граммов HNO 3 на молекулярную массу HNO 3 (63,01 г/моль), мы получим количество молей HNO3/л или молярность, которая равна 15,9 М. Приведенная выше логика объясняет следующее уравнение, используемое для расчета молярности кислот, где концентрация кислоты указана в мас.
Если взять в качестве примера 70%-ную концентрированную азотную кислоту, это означает, что в 100 граммах этой кислоты содержится 70 граммов HNO 3 . Концентрация выражена как 70% мас./мас. или 70 вес. % HNO 3 . Некоторые аналитики предпочитают работать с концентрацией матричной кислоты в единицах молярности (моль/литр). Для расчета молярности 70 мас. % азотной кислоты вычисляем, сколько молей HNO 3 содержится в 1 л кислоты. Допустим, мы тарируем мерную колбу объемом 1 л и затем разбавляем до метки 70,4 мас. % HNO 3 . Затем мы измерили бы вес раствора как 1420 граммов. Зная, что раствор содержит 70,4 мас.%, мы можем рассчитать количество граммов HNO 3 , которое будет (0,704)(1420 г) = 999,7 граммов HNO 3 на литр. Разделив количество граммов HNO 3 на молекулярную массу HNO 3 (63,01 г/моль), мы получим количество молей HNO3/л или молярность, которая равна 15,9 М. Приведенная выше логика объясняет следующее уравнение, используемое для расчета молярности кислот, где концентрация кислоты указана в мас. %:
%:
[(% x d) / MW] x 10 = Молярность
Где:
% = вес. % кислоты
d = плотность кислоты (можно использовать удельный вес, если плотность недоступна)
MW = молекулярная масса кислоты
Используя приведенное выше уравнение для расчета молярности азотной кислоты с концентрацией 70 мас.%, мы имеем:
[(70,4 x 1,42) / 63,01] x 10 = 15,9 M
Разбавления концентрированной кислоты для приготовления определенных объемов указанной молярности можно приготовить, используя (мл A )(C A ) = (мл B )(C B ) уравнение.
Предотвращение образования осадков
При приготовлении смесей элементов следует избегать образования осадков. Обычно осадки образуются при смешивании концентратов элементов, считающихся совместимыми (см. часть 1 этой серии). Многие осадки необратимы (т. е. не переходят в раствор при разбавлении). Поэтому лучше добавить всю кислоту и большую часть воды в мерную колбу или стандартный контейнер с раствором (разведения по весу) перед добавлением аликвот концентрата отдельных элементов. Настоятельно рекомендуется перемешивание после добавления каждой аликвоты. При разбавлении до объема часто обнаруживается, что раствор имеет температуру выше комнатной. Поэтому дайте раствору остыть до комнатной температуры и доведите до отметки с помощью деионизированной воды. Лучше всего приготовить разведение за день до необходимости, чтобы можно было правильно отрегулировать объем.
Настоятельно рекомендуется перемешивание после добавления каждой аликвоты. При разбавлении до объема часто обнаруживается, что раствор имеет температуру выше комнатной. Поэтому дайте раствору остыть до комнатной температуры и доведите до отметки с помощью деионизированной воды. Лучше всего приготовить разведение за день до необходимости, чтобы можно было правильно отрегулировать объем.
Хранение
Ниже приведены некоторые соображения, которые вы можете принять во внимание перед хранением растворов химических стандартов:
- Знайте химическую стабильность вашего стандарта. Химическая стабильность может быть изменена путем изменения исходных материалов и условий приготовления. Поэтому рекомендуется проводить исследования стабильности всех стандартных растворов, чтобы избежать трудоемких и дорогостоящих задержек или ошибок, а также строго придерживаться методологии приготовления, включая порядок добавления многокомпонентных стандартных растворов.
- Обратите внимание на температуру во время хранения и постарайтесь поддерживать температуру хранения на уровне 20 °C или около того.


 2: Объемная доля единицы концентрации, где L = литр
2: Объемная доля единицы концентрации, где L = литр