Мезомерный эффект (М) | Химия онлайн
Мезомерный эффект (М) – это поляризующее влияние атомов или группы атомов, проявляющееся в смещении электронов π-связей или неподеленных электронных пар отдельных отдельных атомов (О, S, N) в сторону атомов с недостроенной до октета электронной облочкой. В результате на противоположных концах системы появляются одинаковые по величине, но разные по знаку заряды.
Мезомерный эффект (эффект сопряжения) характерен для соединений с сопряженными связями, в которых простые связи чередуются с кратными связями или (и) с атомами, имеющими неподеленные электронные пары (О, S, N).
Мезомерный эффект проявляется лишь в том случае, когда заместитель включен в сопряженную систему молекулы.
Благодаря подвижности π-электронов мезомерный эффект передаётся по системе сопряжённых связей без эффекта затухания.
Направление смещения электронной плотности под влиянием М-эффекта обозначается изогнутыми стрелками.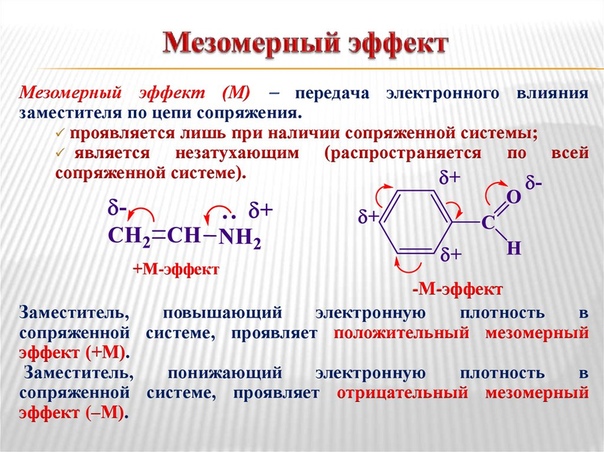
+М-эффектом обладают заместители, которые смещают электронную плотность по системе сопряжения от себя (повышают электронную плотность в сопряженной системе). К ним относятся группы, которые содержат атомы с неподеленной парой электронов, способные к передаче этой пары электронов в общую систему сопряжения.
Заместители, вызывающие положительный мезомерный эффект (электронодоноры): -NH2, -OH.
Например, в молекуле фенола С6Н5ОН группа –ОН проявляет +М-эффект за счет участия одной из неподеленных электронных пар атома кислорода в системе сопряжения:
–М-эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя (понижают электронную плотность в сопряженной системе).
Заместители, вызывающие отрицательный мезомерный эффект (электроноакцепторы): СН=О, -NO2, -COOH. Эти группы имеют неподеленные электронные пары, но пространственное расположение орбиталей с этими электронами не позволяет им вступать в систему сопряжения. Поэтому, в этом случае, заместитель оттягивает электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
Поэтому, в этом случае, заместитель оттягивает электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
Например, π-орбиталь кратной связи С=О и sp2-орбитали с неподеленными парами электронов атома кислорода расположены перпендикулярно друг другу, т.е. их перекрывание невозможно и ни одна электронная пара кислорода не может передаваться в π-систему:
Взаимное влияние атомов в молекулах органических соединений
Что нужно знать о мезомерном эффекте. | Начала химии
Одним из основных постулатов основополагающей теории органической химии – теории строения органических соединений А.М. Бутлерова является мысль, согласно которой атомы и группы атомов в молекуле оказывают друг на друга непосредственное влияние (подробнее об этом здесь)
Характер этого влияния в химии принято называть электронными эффектами. Дело в том, что за счёт взаимного влияния атомов и групп атомов в молекуле происходит перераспределение электронной плотности, что сказывается на её реакционной способности, а это в свою очередь – ключ к пониманию огромного числа протекающих в органике процессов.
Так давайте же попробуем во всём этом разобраться!
Логическая цепочка, раскрывающая важность рассматриваемой темыЛогическая цепочка, раскрывающая важность рассматриваемой темы
Мезомерный эффект (+М, -М)
В предыдущей части мы достаточно подробно обсудили явление индуктивного эффекта.
Мезомерный эффект в свою очередь – это явление смещения электронной плотности вдоль сопряжённой системы π-связей.
(подробнее о δ- и π-связи тут)
π-связь встречается только в тех случаях, когда в молекуле имеются кратные (двойные и тройные связи), поэтому и мезомерный эффект, который обозначается изогнутой стрелочкой, мы можем наблюдать только в молекулах с двойными и(или) тройными связями между атомами углерода.
Примеры молекул, подходящих для наблюдения мезомерного эффекта.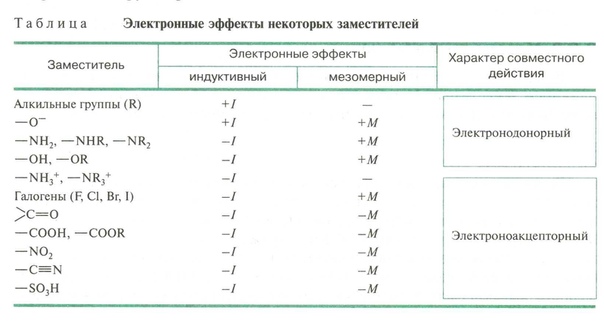
Примеры молекул, подходящих для наблюдения мезомерного эффекта.
В каком же случае мы имеем дело с сопряжённой системой π-связей?
Тут у нас два варианта:
Вариант №1: кратные (двойные, тройные) связи отделяет друг от друга одна одинарная связь.
Как, например, в молекуле акролеина.
Пример сопряжённой системы π-связейПример сопряжённой системы π-связей
Вариант №2: кратная связь соседствует с гетероатомом (не атомом углерода или водорода), содержащим на p-электронной орбитали неподелённую электронную пару.
(Подробнее узнать об р-электронных орбиталях и неподелённых электронных парах Вы можете здесь)
Как, например, в молекуле хлорбензола
Пример взаимодействия НЭП гетероатома с сопряжённой системой бензольного кольцаПример взаимодействия НЭП гетероатома с сопряжённой системой бензольного кольца
Дело в том, что неподелённая электронная пара (НЭП) на р-электронной орбитали, будучи сгустком электронной плотности, сосредоточенным вне плоскости молекулы, способна взаимодействовать с негибридными р-электронными орбиталями атома углерода (подробнее об этом здесь).
Однако есть один нюанс. Дело в том, что, например, в молекуле бутадиена-1,3, содержащей сопряжённую систему π-связей, наблюдать мезомерный эффект оказывается несколько затруднительно. Почему?
Электронная модель π-сопряжённой системы молекулы бутадиена-1,3Электронная модель π-сопряжённой системы молекулы бутадиена-1,3
Дело в том, что эта молекула симметрична, а значит и электронная плотность распределена в ней более-менее равномерно, без выраженных сдвигов электронной плотности и формирования частичных положительных и отрицательных зарядов δ+(-).
Мезомерный эффект подобно индуктивному может быть положительным (+М) и отрицательным (-М) в зависимости от природы заместителя.
Положительный мезомерный эффект (+М)
Группы, проявляющие +MГруппы, проявляющие +M
Эти атомы и группы атомов повышают электронную плотность кратной связи.
Отрицательный мезомерный эффект (-M)
Отрицательным мезомерным эффектом обладают группы атомом, содержащие кратную (двойную и тройную) связь с электроотрицательным атомом.
Группы, проявляющие -MГруппы, проявляющие -M
Среди вышеперечисленных групп наибольшее внимание стоит уделить карбонильной группе – частому гостю на органическом столе
-M карбонильной группы-M карбонильной группы
Важно знать!
1) Особенностью мезомерного эффекта является то, что смещение электронной плотности, вызванное соответствующими заместителями в плоскости π-связи, передаётся по всей π-сопряжённой системе, поэтому, например, бензольное кольцо, как Вы уже могли наблюдать, поляризуется целиком.
2) Мезомерный эффект нередко “вступает в противоречие” с проявляемым группами индуктивным эффектом, и в каждом конкретном случае необходимо быть внимательным к тому, какой эффект окажется сильнее.
3) Мезомерный эффект объясняет перераспереление электронной плотности в молекуле, а значит позволяет отследить формирование реакционных центров, что бесценно для понимания органической химии.
А на этом у меня всё. Спасибо. Пока.
Электронные эффекты в органической химии
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Кемеровский государственный университет»
ХИМИЧЕСКИЙ ФАКУЛЬТЕТ
Кафедра органической химии
Создание web-пособия по теме
«Электронные эффекты в органической химии»
(Курсовая работа по дисциплине спецпрактикума)
Научный руководитель:

Кемерово 2014
СОДЕРЖАНИЕ:
Введение…………………………………………………………
- Литературный обзор…………………………….………………………….
….5 - Понятие электронное учебное пособие……………………….….………5
- Достоинства и недостатки электронных пособий…………….…………..
 7
7 - Современное состояние и перспективы развития электронных книгоизданий.……………………………………………
………….………9 - Обсуждение результатов…………………….……….…………
……………12 - Достоинства электронного пособия «Электронные эффекты в органической химии»……………………………………………………
- Основные электронные эффекты………………..………………….……13
- Индуктивный эффект………..………………………………………
….…13 - Мезомерный эффект………….………………………………………
….…14 - Совместное проявление индуктивного и мезомерного эффектов…….15
- Остальные электронные эффекты…..………………………………….…1
5
Заключение………………………….…………………….
Список использованных источников……………………………..…………….
ВВЕДЕНИЕ
Органическая химия — раздел
химии, изучающий соединения углерода,
их структуру, свойства, методы синтеза.
Предмет органической химии включает: экспериментальные методы и теоретические представления.
Значение теоретических исследований играет важную роль в изучении органической химии. Множество процессов, механизмов и реакций было изучено и обоснованно благодаря теории, также изучения механизмов реакции, поведения веществ значительно упрощают процесс эксперимента , теперь уже можно предположить возможные пути синтеза и продукты реакции, тем самым уменьшить количество времени и затрат на проведение тех синтетических операций в которых не предполагается образования определённого, нужного для исследователя, продукта.
Но для того чтобы приступать к таким этапам как например изучение механизма реакции, нужно познать ещё много других разделов органической химии, которые взаимосвязаны между собой.
И целью данной курсовой работы становится создание web- пособия по теме: «Электронные эффекты в органической химии».
Электронные влияния атомов
или групп атомов – одно из важнейших
понятий в органической химии.
Также известно, что разделы органической химии, касающиеся электронных эффектов заместителей, традиционно являются сложными для усвоения студентами
Создание web- пособие и его дальнейшее использование студентами поможет изучить и понять важный раздел органической химии – электронные эффекты. А чтобы данная тема помогала студентам разобраться как в теоретических так и практических аспектах данного раздела, используются различные приемы представления материала в пособии
Для этого ставится несколько важных задач:
- Создание пособия по теме электронные эффекты в органической химии
- Модифицирования представления литературных данных
- Переведение данного пособия в форму web-пособия
- ЛИТЕРАТУРНЫЙ ОБЗОР
- Понятие электронного учебного пособия
Электронное учебное пособие
– программно-методический обучающий комплекс,
соответствующий типовой учебной программе
и обесᴨечивающий возможность студенту
самостоятельно или с помощью преподавателя
освоить учебной курс или его раздел.
Электронное учебное пособие может быть предназначено для самостоятельного изучения учебного материала по определенной дисциплине или для поддержки лекционного курса с целью его углубленного изучения.
Простейшим электронным учебником может являться конспект лекций преподавателя, набранный им самим (или даже студентами с целью размножения хорошего конспекта в большом числе экземпляров при минимальных затратах) и размещенный на студенческом сервере или на другом общедоступном электронном узле. Однако такой учебник, по существу, ничем не отличается от размноженного печатным методом конспекта и в нем никак не использованы специфические возможности электронного издания. К главным таким особенностям можно причислить:
1. возможность построения
простого и удобного механизма
навигации в пределах
2. развитый поисковый
механизм в пределах
3. возможность встроенного
автоматизированного контроля
возможность встроенного
автоматизированного контроля
4. возможность специального варианта структурирования материала;
5. возможность адаптации изучаемого материала учебника, к уровню знаний обучаемого, следствием чего является резкий рост уровня мотивации обучаемого;
6. возможность адаптации
и оптимизации
К дополнительным особенностям электронного учебного пособия по сравнению с печатным следует отнести:
1. возможность включения специальных фрагментов, моделирующих течение многих физических и технологических процессов;
2. возможность включения в учебник аудио-файлов, в частности, для сближения процесса работы с учебником и прослушивания лекций этого же преподавателя;
3. возможность включения
в состав учебника фрагментов
видеофильмов для иллюстрации
определенных положений
4. включение в состав
пособия интерактивных
5. полномасштабное
полномасштабное
Итак, кроме разного носителя, электронное учебное пособие имеет ряд принципиальных отличий от учебника, изготовленного типографским способом:
возможность мультимедиа;
обеспечение виртуальной реальности;
высокая степень интерактивности;
возможность индивидуального подхода к обучающемуся.
Внедрение в структуру электронного пособия элементов мультимедиа позволяет осуществить одновременную передачу различных видов информации. Обычно это означает сочетание текста, звука, графики, анимации и видео. Средства наглядной демонстрации позволяют улучшить восприятие нового материала, включить в процесс запоминания не только слуховые, но и зрительные центры.
Многие процессы и объекты в
электронном учебнике могут быть представлены
в динамике их развития, а также в виде
2-х или 3-х мерных моделей, что вызывает
у пользователя иллюзию реальности изображаемых
объектов.
Интерактивность позволяет установить обратную связь от пользователя информации (студента) к ее источнику (преподавателю). Для интерактивного взаимодействия характерна немедленная ответная и визуально подтвержденная реакция на действие, сообщение.
Итак, электронные пособия имеют большую практическую ценность. С их помощью можно не только сообщать фактическую информацию, снабженную иллюстративным материалом, но и наглядно демонстрировать те или иные процессы, которые невозможно показать при использовании стандартных методов обучения. Кроме того, обучаемый может воспользоваться электронным пособием самостоятельно, без помощи преподавателя или руководителя, находя ответы на интересующие его вопросы. Также важное значений электронных пособий состоит в том, что преподаватель может быстро дополнять и изменять текстовый или иллюстративный материал при возникновении такой необходимости.
- Достоинства и недостатки электронных пособий
Существенных недостатков у электронного учебника два:
- необходимость специального дополнительного оборудования для работы с ним, прежде всего – компьютера с соответствующим программным обеспечением и качественным монитором, а иногда дополнительно также дисковода для компакт-дисков и/или сетевой карты или модема для работы в локальной или глобальной сети;
- непривычность, не традиционность электронной формы представления информации и повышенной утомляемости при работе с монитором.

Достоинств электронных учебников гораздо больше. К ним можно отнести:
- Возможность адаптации и оптимизации пользовательского интерфейса под индивидуальные запросы обучаемого. В частности, имеется в виду возможность использования как текстовой или гипертекстовой, так и фреймовой структуры учебника, причем количество фреймов, их размеры и заполнение может изменяться. Вместо части фреймов, по желанию студента, можно использовать всплывающие окна с тем же самым содержимым, например, с рисунками или списком определений.
- Возможность использования
дополнительных (по сравнению с печатным
изданием) средств воздействия на обучаемого
(мультимедийное издание), что позволяет
быстрее осваивать и лучше запоминать
учебный материал. Особенно важным нам представляется включение в текст пособия анимационных моделей. Положительный эффект можно достигнуть и с помощью звукового сопровождения, соответствующего лекторскому тексту.

- Возможность построения простого и удобного механизма навигации в пределах электронного учебника. В печатном издании таких возможностей две: оглавление и колонтитулы, иногда к ним также относят глоссарий. Однако для практической реализации этих возможностей необходимо листать страницы учебника. В электронном пособии используются гиперссылки и фреймовая структура или карты-изображения, что позволяет, не листая страниц, быстро перейти к нужному разделу или фрагменту и при необходимости так же быстро возвратиться обратно. При этом не требуется запоминать страницы, на которых были расположены соответствующие разделы.
- Развитый поисковый механизм
не только в пределах электронного учебника,
но и вне его. В частности, по гипертекстовым
ссылкам можно перемещаться по тексту
издания, просматривать рисунки, обращаться
к другим изданиям, ссылки на которые имеются
в нем (литература и пр.), даже написать
электронное письмо автору пособия с просьбой
объяснить те или иные положения учебника.
 При использовании сетевых обучающих структур возможно обсудить положения учебника с другими студентами (в электронном
читальном зале), оставаясь на своем рабочем
месте.
При использовании сетевых обучающих структур возможно обсудить положения учебника с другими студентами (в электронном
читальном зале), оставаясь на своем рабочем
месте. - Возможность встроенного автоматизированного контроля уровня знаний студента, и на этой основе автоматический выбор соответствующего уровню знаний слоя учебника, как указано в следующем пункте.
- Возможность адаптации изучаемого материала к уровню знаний студента, следствием чего является улучшение восприятия и запоминания информации. Адаптация основана на использовании слоистой структуры издания, причем в соответствии с результатами тестирования студенту предоставляется слой, соответствующий уровню его знаний.
- Главное преимущество электронного учебника это возможность интерактивного взаимодействия между студентом и элементами учебника. Уровни ее проявления изменяются
от низкого и умеренного при перемещении
по ссылкам до высокого при тестировании
и личном участии студента в моделировании
процессов.
 Если тестирование подобно собеседованию с преподавателем, то участие в моделировании процессов можно сопоставить с приобретением практических навыков в процессе производственной практики в реальных или приближенных к ним условиях производства.
Если тестирование подобно собеседованию с преподавателем, то участие в моделировании процессов можно сопоставить с приобретением практических навыков в процессе производственной практики в реальных или приближенных к ним условиях производства.
Лекция 5
Лекция №5
СТРУКТУРНЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ МОЛЕКУЛАХ И ИНТЕРМЕДИАТАХ (ИНДУКТИВНЫЙ/МЕЗОМЕРНЫЙ ЭФФЕКТ)
План
- Электронные и пространственные эффекты в органических молекулах и интермедиатах.
- Связь структурных эффектов с реакционной способностью органических молекул.
Химическое
поведение органических молекул и интермедиатов определяется структурным
окружением реакционного центра. Структурные эффекты заместителей на химическую
реакцию определяются объемом заместителей и характером их электронного
взаимодействия с реакционным центром. Последние подразделяются на индуктивный
эффект, эффект сопряжения и эффект сверхсопряжения (гиперконьюгации).
Полярность химических связей в органических молекулах. Индуктивный эффект.
Если химическая связь образуется между двумя различными атомами, то связывающие их электроны смещены в сторону более электроотрицательного атома. В результате центры тяжести положительного и отрицательного заряда смещены и связь становится полярной. Это явление изображается при помощи частичных зарядов например, Cd – – Hd +; Cld – – Cd + .
Смещение электронов можно также изображать стрелкой по линии связи, Cd + ® Cld -.
Электронное смещение осуществляется также в двойных и тройных связях, однако в этом случае имеет место большая поляризация, так как электроны этих связей более подвижны (поляризуемы). Для обозначения смещения электронов в кратных связях применяют изогнутую стрелку.
Электронное смещение за счет поляризации
вызывает смещение в соседних связях, причем этот эффект затухает по длине цепи. Экспериментально наблюдаемый эффект передачи смещения электронов и поляризации
на другие, соседние связи, называется индуктивным эффектом и
обозначается I. Если заместитель оттягивает электроны в свою сторону, то его
эффект называется отрицательным индуктивным эффектом и обозначается -I. Если
заместитель отталкивает от себя электроны в сторону соседних связей или атомов,
то такой эффект называется положительным индуктивным эффектом и
обозначается +I.
Экспериментально наблюдаемый эффект передачи смещения электронов и поляризации
на другие, соседние связи, называется индуктивным эффектом и
обозначается I. Если заместитель оттягивает электроны в свою сторону, то его
эффект называется отрицательным индуктивным эффектом и обозначается -I. Если
заместитель отталкивает от себя электроны в сторону соседних связей или атомов,
то такой эффект называется положительным индуктивным эффектом и
обозначается +I.
Полярность играет важную роль в химических
реакциях. Если в качестве атакующих частиц выступают катионы, то они имеют
сродство к отрицательному заряду (электрофильность) и предпочтительно атакуют
места в молекуле с повышенной электронной плотностью. Как следствие,
заместители с +I эффектом ускоряют такие реакции, а с -I эффектом замедляют. Если
атакующим агентом является отрицательно заряженная частица или частица, имеющая
неподеленную пару электронов, то эти частицы имеют сродство к положительному
заряду (нуклеофильность) и предпочтительно атакуют места с пониженной
электронной плотностью. Поэтому заместители с +I эффектом замедляют такие
реакции, а с -I эффектом – ускоряют их. Индуктивный эффект быстро затухает по
длине цепи.
Поэтому заместители с +I эффектом замедляют такие
реакции, а с -I эффектом – ускоряют их. Индуктивный эффект быстро затухает по
длине цепи.
Полярность молекул – результат векторного сложения дипольных моментов химических связей, входящих в молекулу. Полярность среды, обусловленная полярностью молекул растворителя, является важным фактором скорости химических реакций.
Эффект сопряжения (мезомерный эффект)
Эффект сопряжения проявляется в тех случаях, когда заместитель имеет p -связи, заполненные , вакантные или полувакантные р-орбитали и находятся при атоме углерода в состоянии sp2– или sp- гибридизации.
При таком сочетании структуры заместителя и
остальной части молекулы происходит перекрывание р- или p -орбиталей заместителя с p -орбиталями кратных
связей остальной части молекулы. В результате заместитель оказывается связанным
с остатком молекулы кроме обычной s -связи
дополнительно посредством небольшого p -электронного
облака. Такой эффект называется эффектом сопряжения и изображается с помощью
изогнутых стрелок:
Такой эффект называется эффектом сопряжения и изображается с помощью
изогнутых стрелок:
или с помощью резонансных структур:
Если заместитель путем сопряжения отдает электроны, то такой эффект называется положительным мезомернымэффектом и обозначается +М.
Если заместитель путем сопряжения оттягивает на себя электроны, то такой эффект называется отрицательным мезомерным эффектом и обозначается -М.
Эффект сопряжения является важным фактором
протекания химических реакций. Например, если атом хлора находится при
ароматическом ядре, то он дополнительно связан с ароматическим ядром за счет
перекрывания его р-орбиталей с p -электронами ароматического
ядра.
За счет такого дополнительного связывания связь
С-Cl упрочняется и ее трудно разорвать. Это делает хлор малоподвижным.
Например, очень трудно прогидролизовать хлорбензол по сравнению с хлоралканом. Наоборот, аллилхлорид реагирует гораздо быстрее хлоралкана, что связано со
стабилизацией образующегося в скорость-определяющей стадией карбкатиона.
Наоборот, аллилхлорид реагирует гораздо быстрее хлоралкана, что связано со
стабилизацией образующегося в скорость-определяющей стадией карбкатиона.
Можно видеть, что стабилизация аллильного карбкатиона обусловлена сопряжением вакантной р-орбитали атома углерода с p -орбиталью двойной связи.
Сверхсопряжение.
Под сверхсопряжением понимают эффект p -s -сопряжения, которая заключается во взаимодействии электронов s -связи с незаполненной или частично заполненной р-орбиталью. Сильнее всего этот эффект проявляется в случае C-H связей при соседнем с реакционным центром атоме углерода. В случае карбкатиона этот эффект изображается следующим образом:
или
Такое взаимодействие приводит к существенной
делокализации положительного заряда, что делает карбкатион более стабильным.
Если карбкатион – продукт реакции, то эффект сверхсопряжения ускоряет реакцию,
если реагент – замедляет реакцию.
Стерические (объемные) эффекты.
Стерические эффекты связывают с влиянием объема заместителей на успех химических реакций. В этом плане различают 1-3-эффект, приводящий к торможению реакции. Такой эффект возникает когда объемные заместители затрудняют подход атакующего агента к этому центру. Например, в бимолекулярной реакции гидролиза объемные алкильные заместители блокируют подход гидроксил-аниона к центральному атому углерода.
Стерическое ускорение связано со снятием напряжений между валентными углами, имеющей место из-за отталкивания объемных заместителей в молекуле.
Обычно стерические ускорения имеют место при реализации реакций отрыва водорода.
Согласно современной трактовке ряда реакционных способностей С-Н связей алканов в реакциях радикального замещения связан со снижением степени снятия стерических напряжений в этом ряду.
Электронные эффекты : Farmf | литература для фармацевтов
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛЕ И СПОСОБЫ ЕГО ПЕРЕДАЧИ
Составляющие молекулу атомы влияют друг на друга, это влияние передается по цепи ковалентно связанных атомов и приводит к перераспределению электронной плотности в молекуле.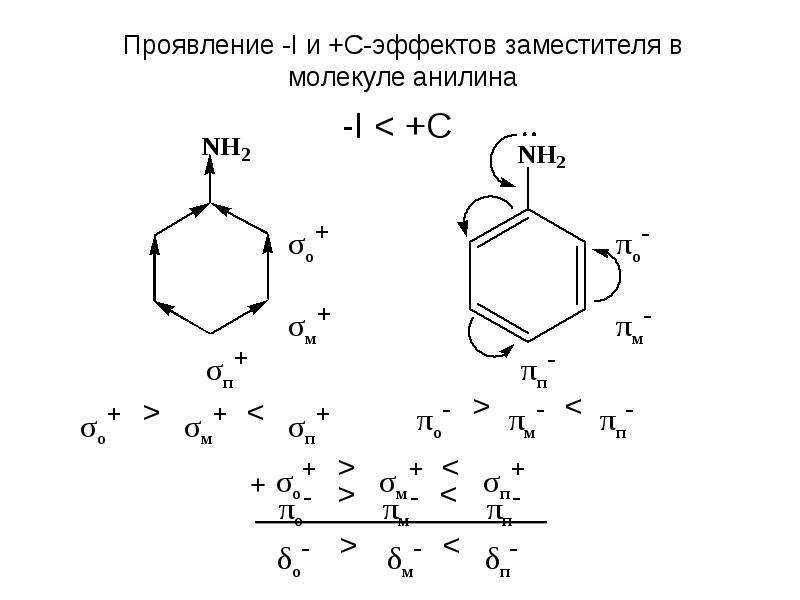 Такое явление называется электронным эффектом заместителя.
Такое явление называется электронным эффектом заместителя.
ИНДУКТИВНЫЙ ЭФФЕКТ
Поляризация связей:
Индуктивным эффектом заместителя (I-эффектом) называется передача электронного влияния заместителя по цепи σ-связей.
По своей физической природе индуктивный эффект – это электростатическое взаимодействие положительно заряженных ядер и отрицательно заряженных электронов
.
Индуктивный эффект быстро затухает (через 2-3 связи)
Индуктивный эффект водорода принят = 0
Электроноакцепторы (- I-эффект):
Электронодоноры (+ I-эффект): Алкильные группы рядом с sp2-углеродом:
Сильные электронодоноры – анионы: -О, -S, -NH
Металлы 1-й и 2-й групп:
МЕЗОМЕРНЫЙ ЭФФЕКТ
Основную роль в перераспределении электронной плотности молекулы играют делокализованные π- и р-электроны. Мезомерный эффект или эффект сопряжения (М-эффект) – это перераспределение электронов по сопряженной системе.
Мезомерным эффектом обладают те заместители, атомы которых имеют негибридизованную р-орбиталь и могут участвовать в сопряжении с остальной частью молекулы.
Мезомерные электронодоноры
Мезомерные электроноакцепторы
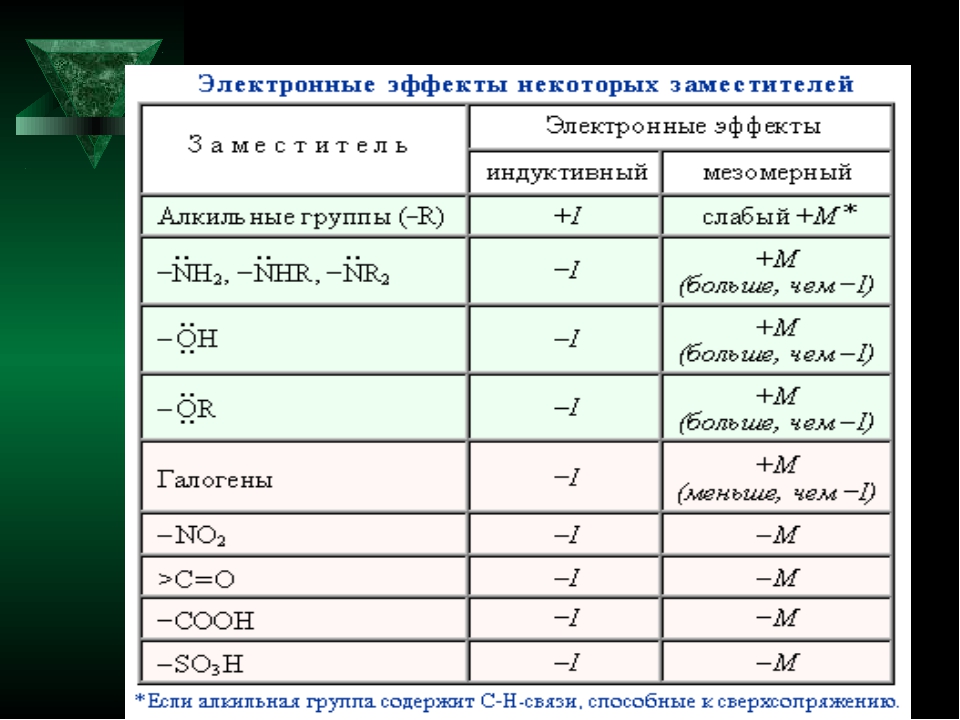
Многие заместители обладают одновременно и индуктивным, и мезомерным эффектами (см. таблицу).
Для всех заместителей кроме галогенов: I < M Для галогенов: I > M
ПРОСТРАНСТВЕННЫЕ ЭФФЕКТЫ
Влияние заместителя, особенно если он несет электрический заряд, может передаваться не только через химические связи, но и через пространство. В этом случае определяющее значение имеет пространственное положение заместителя. Такое явление называется пространственным эффектом заместителя.
Заместитель может препятствовать подходу активной частицы к реакционному центру и тем самым снижать скорость реакции:
Взаимодействие лекарственного вещества с биорецептором также требует определенного геометрического соответствия контуров молекул, и изменение молекулярной геометрической конфигурации лекарственного вещества значительно влияет на его биологическую активность.
Разница между индукционным эффектом и мезомерным эффектом
Ключевое различие – индукционный эффект и мезомерный эффектИндуктивный эффект и мезомерный эффект – это два типа электронных эффектов в многоатомных молекулах. Однако индукционный эффект и мезомерный эффект возникают из-за двух разных факторов. Например, индуктивный эффект является результатом поляризации σ-связей, а мезомерный эффект является результатом заместителей или функциональных групп в химическом соединении .В некоторых сложных молекулах может существовать как мезомерный, так и индуктивный эффект.
Что такое индукционный эффект?
Индуктивный эффект – это электронный эффект в полярных молекулах или ионах, вызванный поляризацией σ-связей. Основная причина индуктивного эффекта – разность электроотрицательностей между атомами на обоих концах связи. Это создает некоторую полярность связи между двумя атомами. Большинство электроотрицательных атомов притягивают электроны связи к себе, и это приводит к поляризации связи.Некоторыми примерами являются связи O-H и C-Cl.
Это создает некоторую полярность связи между двумя атомами. Большинство электроотрицательных атомов притягивают электроны связи к себе, и это приводит к поляризации связи.Некоторыми примерами являются связи O-H и C-Cl.
Диполь воды
Что такое мезомерный эффект?
Мезомерный эффект возникает из-за заместителей или функциональных групп в химическом соединении и обозначается буквой M. Этот эффект представляет собой качественный метод описания электроноакцепторных или высвобождающих свойств заместителей, основанный на соответствующих резонансных структурах. Это постоянный эффект в химических соединениях, состоящих по крайней мере из одной двойной связи и другой двойной связи или неподеленной пары, разделенных одинарной связью.Мезомерный эффект можно разделить на «отрицательный» и «положительный» в зависимости от свойств заместителя. Эффект положительный (+ M), когда заместитель представляет собой группу, высвобождающую электроны, и эффект отрицательный (-M), когда заместитель является группой, выделяющей электроны.
В чем разница между индукционным эффектом и мезомерным эффектом?
Недвижимость:
Индуктивный эффект: Индуктивный эффект – это постоянное состояние поляризации.Когда существует сигма-связь между двумя разными атомами (когда электроотрицательные значения двух атомов не похожи), электронная плотность между этими двумя атомами неоднородна. Электронная плотность более плотная по направлению к более электроотрицательному атому. Несмотря на то, что это постоянный эффект, он относительно слаб, и поэтому его можно легко превзойти другими сильными электронными эффектами.
Мезомерный эффект: Мезомерный эффект вызван делокализацией электронов.Он может передаваться по любому количеству атомов углерода в сопряженной системе. Его можно рассматривать как постоянную поляризацию, которая в основном встречается в ненасыщенных цепях.
Влияющие факторы:
Индуктивный эффект: Разница электроотрицательностей между двумя атомами в связи напрямую влияет на индуктивный эффект. Кроме того, это явление, зависящее от расстояния; следовательно, длина связи также является другим влияющим фактором; чем больше расстояние, тем слабее эффект.
Кроме того, это явление, зависящее от расстояния; следовательно, длина связи также является другим влияющим фактором; чем больше расстояние, тем слабее эффект.
Мезомерный эффект: Мезомерный эффект – это постоянный эффект, который зависит от заместителей или функциональных групп в химическом соединении. Он встречается в химических соединениях, содержащих по крайней мере одну двойную связь и другую двойную связь или неподеленную пару, разделенную одинарной связью.
Категории:
Индуктивный эффект: Индуктивный эффект делится на две категории в зависимости от их эффекта удаления или высвобождения электронов по отношению к водороду.
Отрицательный индуктивный эффект (-I):
Группы или атомы, обладающие электроноакцепторными свойствами, вызывают отрицательный индукционный эффект. Некоторые примеры перечислены ниже в порядке убывания эффекта –I.
NH 3 + > NO 2 > CN> SO 3 H> CHO> CO> COOH> COCl> CONH 2 > F> Cl> Br> I> OH> OR> NH 2 > C 6 H 5 > H
Положительный индуктивный эффект (-I):
Группы или атомы, обладающие свойствами высвобождения электронов, вызывают положительный индуктивный эффект.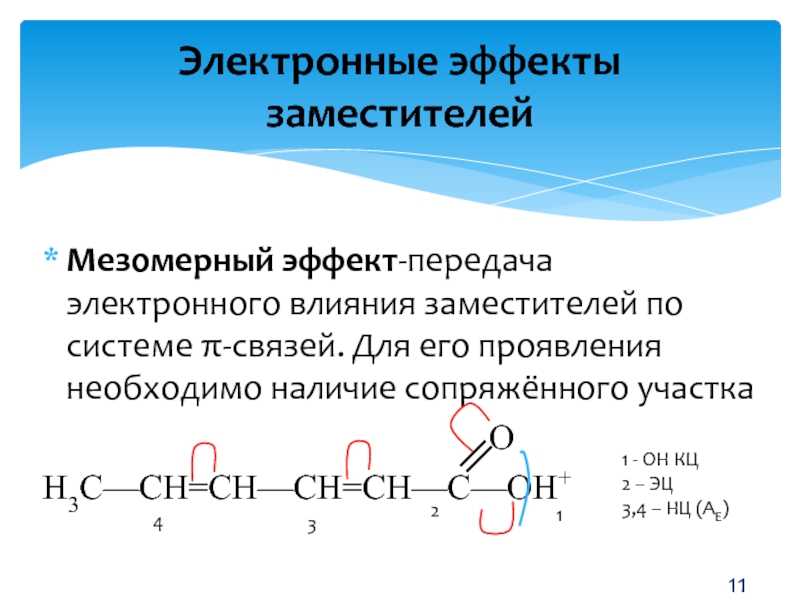 Некоторые примеры перечислены ниже в порядке убывания эффекта + I.
Некоторые примеры перечислены ниже в порядке убывания эффекта + I.
C (CH 3 ) 3 > CH (CH 3 ) 2 > CH 2 CH 3 > CH 3 > H
Мезомерный эффект:
Положительный мезомерный эффект (+ M):
Когда заместитель можно рассматривать как группу, высвобождающую электроны, на основании резонансных структур, эффект положительный (+ M).
+ M заместители: спирт, амин, бензол
Отрицательный мезомерный эффект (- M):
Когда заместитель представляет собой электроноакцепторную группу, мезомерный эффект отрицательный (-M)
–М заместители: ацетил (этаноил), нитрил, нитро
Ссылки: «Мезомерный эффект» – Википедия «Индуктивный эффект» – Википедия «Глава 4: Спирты и алкилгалогениды» – Химический факультет Университета Калгари «Индуктивный эффект, электромерный эффект, резонансные эффекты и гиперконъюгация» – BRILLIANT «Индуктивный эффект» – Сборник химической терминологии ИЮПАК – Золотая книга «Реакции ароматических соединений (общие)» – Chemgapedia https: // школы.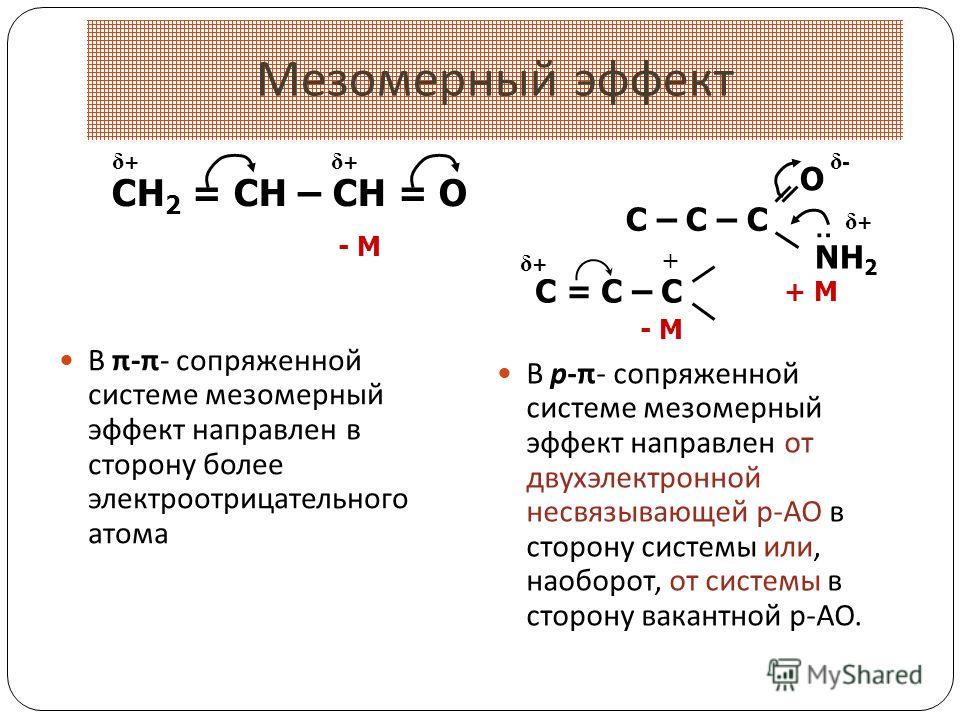 aglasem.com/4464 Изображение предоставлено: «Water V» Автор: Jü – собственная работа (CC0) через Commons Wikimedia «Мезомерный эффект (–M) V» Автор: Jü – собственная работа (общественное достояние) через Commons Wikimedia
aglasem.com/4464 Изображение предоставлено: «Water V» Автор: Jü – собственная работа (CC0) через Commons Wikimedia «Мезомерный эффект (–M) V» Автор: Jü – собственная работа (общественное достояние) через Commons Wikimedia Индуктивные, мезомерные и электромерные эффекты – стенограмма видео и урока
Индуктивный эффект
Постоянный диполь, индуцированный сигма-связью другим непосредственно вдоль цепочки атомов внутри молекулы, называется индуктивным эффектом .Индуктивный эффект является постоянным и действует через одинарные связи, поэтому он также известен как постоянная поляризация одинарных связей.
Связь C1-Li в цепи C4-C3-C2-C1-Li является постоянным диполем из-за большей электроотрицательности углерода, чем лития. Этот диполь индуцирует постоянный диполь в связи C2-C1, и C2 получает слегка отрицательный заряд, величина которого меньше, чем у C1.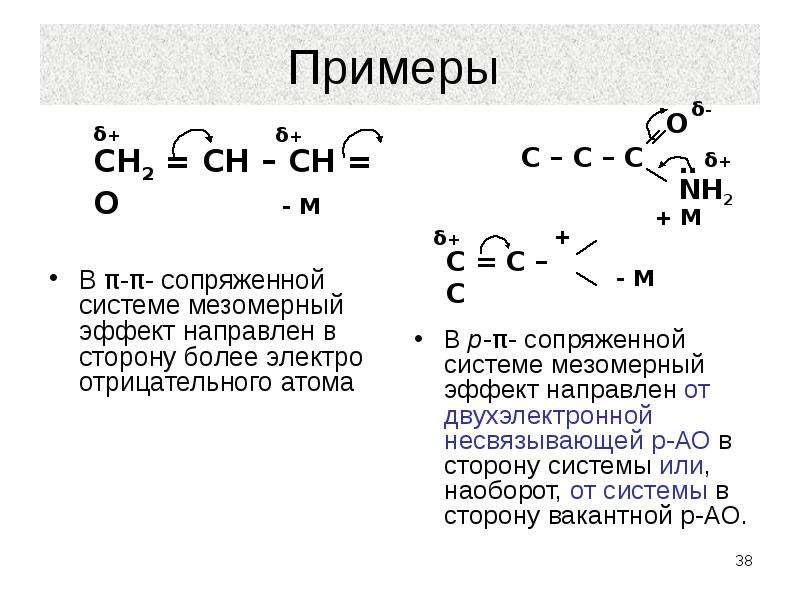 Таким образом, индукция отрицательного заряда может передаваться вниз по цепочке, но эффект усиливается с увеличением расстояния от начальной точки:
Таким образом, индукция отрицательного заряда может передаваться вниз по цепочке, но эффект усиливается с увеличением расстояния от начальной точки:
Li → C1 → C2 → C3 → C4
Давайте обсудим другой пример.В цепи C4-C3-C2-C1-F, F – отрицательный полюс, а C1 – положительный полюс, поскольку электроотрицательность фтора больше, чем у углерода. Следовательно, индукция положительного заряда будет происходить в углеродной цепи следующим образом:
C4 → C3 → C2 → C1 → F
Большинство атомов или групп атомов, таких как F, Cl, Br, -OH, притягивают электроны к сами по себе или вдали от углеродной цепи; они называются электроноакцепторными группами, а эффект называется эффектом отвода электронов.Это символически обозначается как -I-эффект.
Металлы, кремний и алкильные группы отталкивают электроны и известны как группы, высвобождающие электроны; эффект называется эффектом донорства электронов. Это символически представлено как эффект + I. Относительная сила и направление индуктивного воздействия различных атомов и групп даны по шкале Ингольда.
Вот порядок убывания эффекта + I:
COO-, R3 C, R2 CH, RCh3, Ch4, D, H
А вот порядок увеличения эффекта -I:
H, R2 C = CH, Ar, OH, SR, SH, OR, COOR, OAr, I, Br, Cl, F, COOH, CN, NO2, Nh4 +, NR3 +
Вот пример использования индуктивного эффекта.Обычно дипольный момент увеличивается с увеличением индуктивного эффекта. Таким образом, дипольный момент цис-2-бутена больше, чем транс-2-бутена, поскольку в последнем соединении аннулируется + I-эффект групп -Ch4, поскольку они действуют в противоположных направлениях.
Индуктивный эффект играет доминирующую роль в реакционной способности соединения.Следовательно, толуол можно легко нитровать концентрированной HNO3 и концентрированной h3 SO4 с получением орто- и пара-нитротолуолов.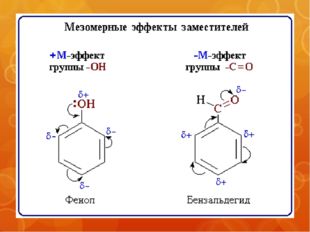 Но мета-динитробензол при нитровании дает тринитробензол, и реакция занимает пять дней.
Но мета-динитробензол при нитровании дает тринитробензол, и реакция занимает пять дней.
Эффект -I нитрогрупп в метадинитробензоле делает молекулу менее реакционной, чем толуол, содержащий метильную группу, который имеет эффект + I. Итак, нитрование требует жестких условий в метадинитробензоле, а в толуоле – нет. Деактивирующий эффект нитрогрупп приглашает входящую нитрогруппу в мета-положение, а активирующий эффект метильной группы направляет входящую нитрогруппу в орто- и пара-положение.
Электронодонорные группы, такие как амин (-Nh3), присоединенные к атомам N или O, увеличивают основность, а электроноакцепторные группы уменьшают электронную плотность и, следовательно, уменьшают его основность. Таким образом, метиламин является более основным, чем аммиак. Точно так же метильная группа в уксусной кислоте, имеющая эффект + I, снижает кислотность больше, чем у муравьиной кислоты.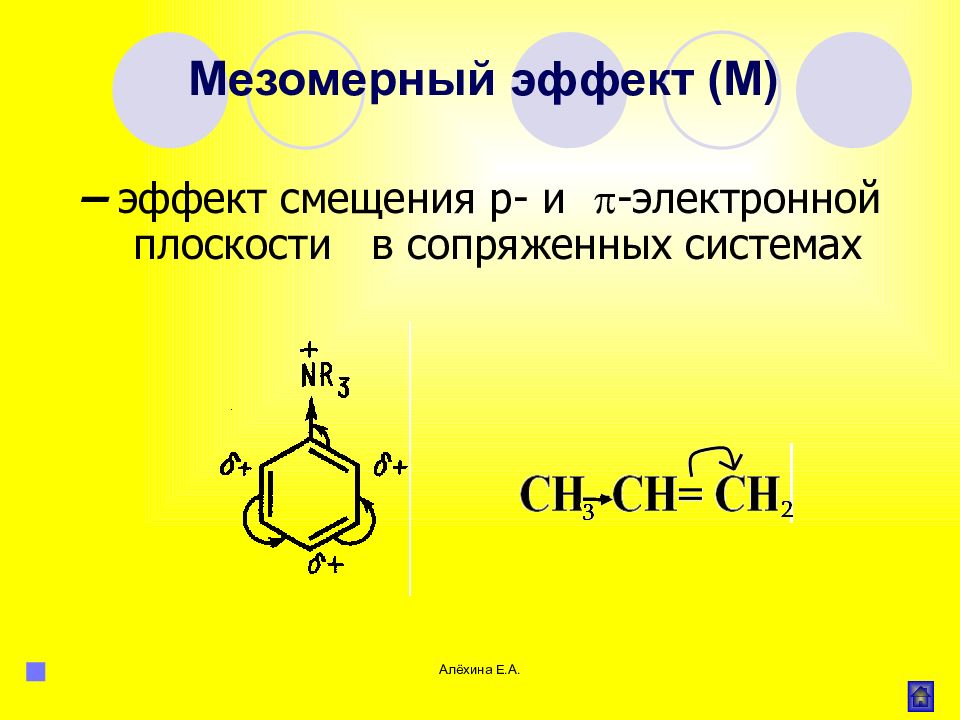
Электромерный эффект
Временный эффект переменной времени, включающий полную передачу общей электронной пары одному из атомов, соединенных множественными связями, при необходимости атакующего реагента, называется электромерным эффектом .Когда атакующий реагент удаляется, перенесенная пара пи-электронов снова образует связь, и молекула возвращается в свою конфигурацию основного состояния.
Электромерный эффект может быть эффектом + E или -E в зависимости от направления переноса электронной пары. Когда электронная пара движется к атакующему реагенту, это называется эффектом + E. Добавление кислот (соединений с H +) к алкенам (органическим соединениям с двойными связями) является примером эффекта + E.
Эффект -E может быть обнаружен в таких реакциях, как присоединение нуклеофилов (соединений, содержащих электронные пары) к карбонильным соединениям (соединениям, содержащим C = O).
Чтобы объяснить это, давайте рассмотрим атакующий компонент Z. Он приближается к связи пи, когда связь пи разрывается, и электронная пара из Z будет полностью передана одному из атомов углерода:
Он приближается к связи пи, когда связь пи разрывается, и электронная пара из Z будет полностью передана одному из атомов углерода:
Мезомерный эффект
Резонанс с участием пи-электронов говорит нам, что он уменьшает электронную плотность в одном месте и увеличивает электронную плотность в другом месте молекулы.Это перераспределение электронов происходит при постоянной поляризации в молекуле.
Это явление обычно имеет место в сопряженных пи-системах с участием пи-орбиталей и называется мезомерным или конъюгативным эффектом. Он представлен символом M. Эффект во многом зависит от заместителей, присутствующих в молекуле. Мезомерный эффект отрицательный (-M), когда заместитель представляет собой электроноакцепторную группу, и эффект положительный (+ M), когда заместитель представляет собой группу, высвобождающую электроны.
Вот порядок эффекта + M:
– O> -Nh3> -NHR> -OR> -NHCOR> -OCOR> -Ph> -F> -Cl> -Br> -I
Теперь вот -M порядок эффектов:
-NO2> -CN> -CHO> -C = O> -COOCOR> -COOR> -COOH> -CONh3> -COO-
Итоги урока
Хорошо, давайте сделаем пару минут, чтобы повторить.Как мы узнали, этот урок был посвящен некоторым вопросам из области органической химии , огромной области химии, которая занимается соединениями углерода. Мы также узнали о трех очень важных факторах, которые влияют на доступность электронов в органических соединениях. Он объясняет
- индуктивный эффект , который является постоянным эффектом и действует через одинарные связи
- электромерный эффект , который является временным изменяющимся эффектом, включающим полный перенос общей пары электронов на один из атомов, соединенных множественными связями, по требованию атакующего реагента
- мезомерный эффект , который представляет собой явление, которое включает уменьшение электронной плотности в одной позиции и увеличение электронной плотности где-то еще в молекуле
Различные типы заместителей в молекуле несут ответственность за увеличение и уменьшение этих эффектов.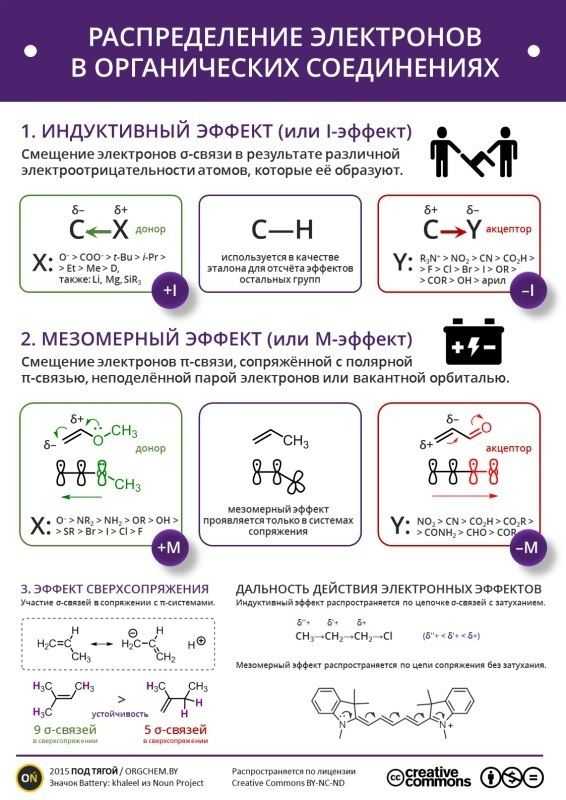
Мезомерный эффект – обзор
2.12.3.3 Электрофильная атака на углерод
3-, 4-, 5- и 6-позиции в ядре пиридазина являются электронодефицитными из-за отрицательного мезомерного эффекта атомов азота. Следовательно, электрофильное замещение в пиридазинах затруднено даже в присутствии одной или двух электронодонорных групп. Первым описанным примером является нитрование 4-амино-3,6-диметоксипиридазина с получением соответствующего 5-нитропроизводного.Нитрование 3-метокси-5-метилпиридазина дает 6-нитро-, 4-нитро- и 4,6-динитропроизводные. Однако в случае пиридазинонов известно несколько электрофильных реакций. Нитрование 4,5-дихлор-2-метилпиридазин-3 (2 H ) -она происходит в положении 6.
Прямое хлорирование 3,6-дихлорпиридазина пентахлоридом фосфора дает 3,4,5,6-тетрахлорпиридазин. Галоген обычно вводят рядом с активирующей оксогруппой. Таким образом, 1,3-дизамещенные пиридазин-6 (1 H ) -оны дают соответствующие 5-хлорпроизводные, часто сопровождаемые 4,5-дихлорсоединениями в качестве побочных продуктов при обработке хлором, пентахлоридом фосфора или фосфорилхлоридом– пентахлорид фосфора.
1,2-Дизамещенные пиридазин-3,6 (1 H , 2 H ) -дионы добавляют галогены к 4,5-двойной связи с последующим дегидрогалогенированием с образованием 4-галогенпроизводных. 1,2-Дизамещенные 5-бромпиридазин-3,6 (1 H , 2 H ) -дионы реагируют с бромом с образованием соответствующего 4,5-дибромпроизводного. Реакция Манниха с 2-арилпиридазин-3 (2 H ) -оном происходит в положении 4.
Поведение пиридазинового ядра по отношению к электрофильным реагентам изменяется после окисления N из-за мезомерного эффекта N -оксидная группа, в соответствии с которой α- и γ-положения по отношению к N -оксидной группе становятся более реакционноспособными 〈B-71MI21200〉.Нитрование 1-оксида пиридазина и многих 3- и 6-монозамещенных и 3,6-дизамещенных производных смесью азотной и серной кислот происходит в положении 4 с образованием соответствующих 4-нитропиридазин-1-оксидов. Когда позиция 4 занята, нитрование происходит либо в α-, , то есть в 6-положении , либо полностью не удается.
Когда нитрование пиридазина N -оксидов проводят ацилнитратами (полученными in situ из ацилхлоридов и нитрата серебра), реакция протекает в β-положении относительно N -оксидной группы.В этих условиях образуются только мононитропроизводные. Например, нитрование 1-оксида пиридазина ацетилнитратом дает 1-оксид 3-нитропиридазина (17%) и 1-оксид 5-нитропиридазина (0,8%), тогда как с бензоилнитратом лучший выход 1-оксида 5-нитропиридазина составляет полученный.
Пиридазин-1-оксиды, замещенные в положении 3 или положениях 3 и 6, дают соответствующие 5-нитропроизводные. Метильная группа в положении 6 (α по отношению к оксидной группе N ) часто превращается в цианогруппу, а метоксигруппа в положении 6 деметилируется бензоилхлоридом / нитратом серебра.Например, 3-замещенные 6-метилпиридазин-1-оксиды дают 5-нитропроизводные ( 96 ) и 6-циано-5-нитропроизводные ( 97 ), тогда как 1-оксид 3,6-диметоксипиридазина превращается бензоилхлоридом / нитратом серебра в 1-бензоилокси-3-метоксипиридазин-6 (1 H ) -он ( 98 ) и 1-гидрокси-3-метоксипиридазин-6 (1 H ) -он ( 99 ; схема 26).
Схема 26.
1,2-диоксид 3,6-диметилпиридазина дает 4-нитропроизводное с хорошим выходом с азотной кислотой, тогда как с бензоилнитратом выход значительно ниже.
Реакция Манниха с пиридазинон-1-оксидами протекает в α- или γ-положениях относительно N -оксидной группы, в отличие от реакции в пиридазиноновом ряду, где образуются N -замещенные продукты. 1-оксид пиридазин-3 (2 H ) -она дает сначала соответствующее 6-замещенное производное; при избытке реагентов получаются 4,6-дизамещенные продукты. При блокировании положения 6 получают соответствующие 4-диалкиламинометильные производные.
Бромирование 1-оксида пиридазин-3 (2 H ) -она и 1-оксида 5-гидроксипиридазина дает в качестве единственных продуктов 4,6-дибромпроизводные. 1-оксиды пиридазин-3 (2 H ) -она с заблокированным положением 6 дают 4-монобромпроизводные. Аналогично происходит хлорирование с образованием дихлорпродуктов, а после нитрования получаются только 4-нитропроизводные.
MO расчеты системы циннолиновых колец показывают, что относительный порядок реакционной способности для электрофильного замещения составляет 5 = 8> 6 = 7> 3 4.Это подтверждено экспериментально, так как нитрование циннолина смесью азотной и серной кислот дает 5-нитроциннолин (33%) и 8-нитроциннолин (28%). Точно так же 4-метилциннолин дает смесь 4-метил-8-нитроциннолина (28%) и 4-метил-5-нитроциннолина (13%).
Нитрование циннолин-4 (1 H ) -она дает смесь 3-нитро (0,9%), 5-нитро (0,38%), 6-нитро (58,4%), 7-нитро (0,36%). ) и 8-нитро (39,9%) производные. Постулируется, что 3-нитроизомер является результатом нитрования свободного основания, в то время как другие мононитроизомеры образуются из протонированной молекулы.
4-Аминоциннолин нитрируется в дымящейся азотной и концентрированной серной кислотах с образованием 4-амино-6-нитроциннолина.
Циннолин-4 (1 H ) -он и его 6-хлор, 6-бром, 6-нитро и 8-нитропроизводные реагируют с сульфурилхлоридом или бромом в уксусной кислоте с образованием соответствующих 3-галогенпроизводных примерно с 20% доходности. Иодирование 8-гидроксициннолин-4 (1 H ) -она смесью иодида калия и иодата калия дает 5,7-дийодпроизводное; 6,8-дийодопроизводное образуется из 5-гидроксициннолин-4 (1 H ) -она.
Иодирование 8-гидроксициннолин-4 (1 H ) -она смесью иодида калия и иодата калия дает 5,7-дийодпроизводное; 6,8-дийодопроизводное образуется из 5-гидроксициннолин-4 (1 H ) -она.
Когда циннолин-1-оксид обрабатывают азотной и серной кислотами или нитратом калия в серной кислоте, получается 4-нитроциннолин-1-оксид с выходами от 3 до 64% в зависимости от условий реакции. Со смесью дымящей азотной и серной кислот получаются соответствующие 4-нитро-, 4,5-динитро- и небольшое количество 5-нитро-циннолиновых производных. Как 4-нитроциннолин-1-оксид, так и 5-нитро-изомер дают 4,5-динитроциннолин-1-оксид при обработке дымящей азотной и серной кислотами.Циннолин-1-оксид также реагирует с бензоилхлоридом / нитратом серебра с образованием 3-нитроциннолин-1-оксида с выходом 71%.
Нитрование циннолин-2-оксида протекает иначе. С азотной и серной кислотами или с нитратом калия и серной кислотой получается смесь 8-нитроциннолин-2-оксида, 6-нитроциннолин-2-оксида и 5-нитроциннолин-2-оксида, тогда как с бензоилнитратом в хлороформе только низкий выход (1,5 %) 5-нитропроизводного.
При нитровании фталазинов нитрогруппа вводится только в карбоциклическое кольцо.Часто возникают побочные реакции. Например, нитрование фталазина или его 1-метилового аналога нитратом калия в концентрированной серной кислоте дает 5-нитропроизводное ( 100 ) в качестве основного продукта вместе с 5-нитрофталазин-1 (2 H ) -он ( 101 ) как побочный продукт (Схема 27).
Схема 27.
(PDF) Основные понятия органической химии – Электронные и стерические эффекты в органических молекулах
– 1 –
1. Структурное разнообразие органических молекул
Органические соединения демонстрируют огромное структурное разнообразие и большое количество органических соединений.
Составыбывают натуральными и синтетическими.Органические соединения имеют жизненно важное значение
для поддержания жизни на Земле и включают сложные молекулы, такие как генетическая
информация, несущая дезоксирибонуклеиновую кислоту (ДНК) и белки, которые составляют
основных компонентов нашей крови, мышц и кожи. Органические химические вещества присутствуют
Органические химические вещества присутствуют
в таких материалах, как одежда, топливо, полимеры, красители и лекарства, что делает их
предметами первой необходимости в нашей повседневной жизни
2. Что такое органическая молекула и каковы уникальные характеристики углеродных элементов
Органическая молекула представляет собой углеродсодержащее соединение, и ковалентная связь
между углеродом и водородом составляет основу органических молекул.Большинство из
органических молекул содержат «O», «N», «S» и «P» и другие элементы.
Молекулы, содержащие только «C» и «H», называются углеводородами. Молекулы
, содержащие ’C’, ’H’ и набор других атомов (функциональную группу), называются функционализированными углеводородами
. Другая категория молекул, которые представляют собой гидратированную форму углерода
, называются углеводами
2.1. Уникальные характеристики углеродных элементов?
Углерод занимает в периодической таблице во втором периоде и четвертой группе.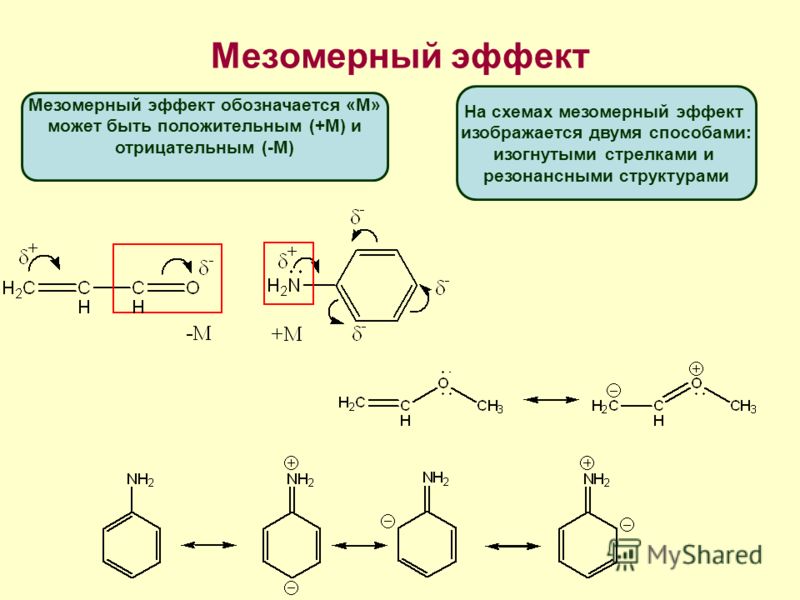 Он
Он
показывает промежуточную электроотрицательность (2,5 по шкале Полинга) и валентность, равную четырем. Тетравалентность углерода
делает способность образовывать четыре связи одновременно, и ковалентные связи
являются предпочтительными. Образование ковалентных связей – это уникальная особенность углерода
, связанная с его промежуточной электроотрицательностью, а также
, объясняемая с точки зрения его электронной конфигурации и гибридизации s- и
p-орбиталей.Способность углерода претерпевать различные состояния гибридизации, такие как sp3, sp2
и sp, дает возможность создавать различные соединения наряду с углеродом, углерод-водород
и многими другими элементами.
2.1.1 Гибридизация углерода
Гибридизация влияет на длину связи, прочность связи и геометрию органических соединений
. Гибридная орбиталь sp содержит больше символов s и, следовательно,
находится ближе к своему ядру и образует более короткие и более прочные связи, чем sp3
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
3.4 Структурные эффекты на кислотность и основность – Органическая химия I
Мы узнали, что разные функциональные группы имеют разную кислотность.В этом разделе мы получим понимание фундаментальных причин этого, а именно: , почему одна группа более кислая, чем другая. Многие концепции, которые мы здесь изучим, будут по-прежнему применяться на протяжении всего курса, поскольку мы будем заниматься многими другими органическими темами.
3.4.1 Эффект элемента
A. Периодический тренд: электроотрицательность
Эффект элемента составляет около человека на ом, который соединяется с водородом (имейте в виду, что кислотность связана со способностью отдавать определенный водород).Давайте сравним кислотность водорода в этане, метиламине и этаноле, как показано ниже.
Четкая тенденция в отношении кислотности этих соединений: кислотность увеличивается для элементов слева направо по второй строке периодической таблицы, от C до N, а затем до O. Это согласуется с тенденцией к увеличению электроотрицательности вдоль период слева направо. Связь между электроотрицательностью и кислотностью можно объяснить тем, что атом с более высокой электроотрицательностью способен лучше приспособиться к отрицательному заряду сопряженного основания, поэтому лучше стабилизирует сопряженное основание. Следовательно, чем более стабильное основание конъюгата, тем слабее основание конъюгата и тем сильнее кислота . Что касается обсуждений в этом разделе, тенденция стабильности (или основности) конъюгированных оснований часто помогает объяснить тенденцию изменения кислотности.
Следовательно, чем более стабильное основание конъюгата, тем слабее основание конъюгата и тем сильнее кислота . Что касается обсуждений в этом разделе, тенденция стабильности (или основности) конъюгированных оснований часто помогает объяснить тенденцию изменения кислотности.
Относительная кислотность элементов за тот же период:
Для элементов в один и тот же период: чем электроотрицательнее атом, тем сильнее кислота; t Кислотность увеличивается слева направо в течение периода.
Б. Группа (по вертикали) Тренд: Размер атома
При вертикальном движении в пределах данной группы периодической таблицы наблюдается тенденция к увеличению кислотности сверху вниз. Это можно проиллюстрировать с помощью галогенкислоты HX и галогенидов, как показано ниже: кислотность HX увеличивается сверху вниз, а основность конъюгированных оснований X – уменьшается сверху вниз.
Кислотность H в тиоловой SH-группе также выше, чем у соответствующей спиртовой OH-группы, следуя той же тенденции.Например, p K a CH 3 CH 2 SH составляет ~ 10, что намного более кислотно, чем этанол CH 3 CH 2 OH с ap K a из ~ 16.
Чтобы разобраться в этой тенденции, мы еще раз рассмотрим устойчивость сопряженных оснований. При перемещении по вертикали в той же группе периодической таблицы, размер атома размером перекрывает его электроотрицательность в отношении основности. Атомный радиус йода примерно в два раза больше, чем у фтора, поэтому в иодид-ионе отрицательный заряд распространяется на значительно больший объем, поэтому I – более стабилен и менее щелочной, что делает HI более кислым.
Рисунок 3.4a Стабильность фтора и йодид-ионаОтносительная кислотность элементов одной группы составляет:
Для элементов одной группы: чем больше размер атома, тем сильнее кислота; кислотность увеличивается сверху вниз по группе.
3.4.2. Резонансный эффект
Резонансный эффект объясняет разницу в кислотности этанола и уксусной кислоты.И для этанола, и для уксусной кислоты водород связан с атомом кислорода, поэтому влияние элемента не имеет значения. Однако значения (и кислотность) этанола и уксусной кислоты сильно различаются. Что делает карбоновую кислоту более кислой, чем спирт? Как указывалось ранее, мы начинаем с рассмотрения стабильности конъюгированных оснований, помня, что более стабильное (более слабое) конъюгатное основание соответствует более сильной кислоте.
Для ацетата, сопряженного основания уксусной кислоты, можно выделить два участника резонанса, и, следовательно, отрицательный заряд может быть делокализован (разделен) на два атома кислорода.Однако у этоксид-иона, сопряженного основания этанола, нет другого резонансного элемента, поэтому отрицательный заряд локализован на атоме кислорода. Как мы узнали в разделе 1. 3 , , разновидности, которые имеют больше вкладчиков резонанса, приобретают стабильность , поэтому ацетат более стабилен, чем этоксид, и слабее основания, поэтому уксусная кислота является более сильной кислотой, чем этанол.
3 , , разновидности, которые имеют больше вкладчиков резонанса, приобретают стабильность , поэтому ацетат более стабилен, чем этоксид, и слабее основания, поэтому уксусная кислота является более сильной кислотой, чем этанол.
Делокализация заряда за счет резонанса имеет очень сильное влияние на реакционную способность органических молекул, достаточную для того, чтобы учесть большую разницу в более чем 10 p K a единиц между этанолом и уксусной кислотой.Поскольку p K a = –log K a , это означает, что существует коэффициент примерно 10 10 между значениями K и для двух молекул!
p K a группы OH в спирте составляет около 15, однако OH в феноле (группа OH, соединенная с бензольным кольцом) имеет pK a около 10, что намного сильнее по кислотности, чем другие спирты. Объясните разницу.
Решение :
Разницу можно объяснить эффектом резонанса. Как упоминалось ранее, не наблюдается резонансного эффекта на сопряженное основание этанола. Однако сопряженное основание фенола стабилизируется резонансным эффектом с еще четырьмя вкладчиками резонанса, а отрицательный элемент делокализован на бензольном кольце, поэтому сопряженное основание фенола намного более стабильно и является более слабым основанием. Следовательно, фенол намного более кислый, чем другие спирты.
Как упоминалось ранее, не наблюдается резонансного эффекта на сопряженное основание этанола. Однако сопряженное основание фенола стабилизируется резонансным эффектом с еще четырьмя вкладчиками резонанса, а отрицательный элемент делокализован на бензольном кольце, поэтому сопряженное основание фенола намного более стабильно и является более слабым основанием. Следовательно, фенол намного более кислый, чем другие спирты.
- Потренируйтесь рисовать резонансные структуры сопряженного основания фенола самостоятельно!
- Именно из-за особой кислотности фенола (и других ароматических спиртов) NaOH можно использовать для эффективного депротонирования фенола, но не для нормальных спиртов, таких как этанол.Покажите уравнения этих реакций и объясните разницу, применив значения p K a .
Ответы на практические вопросы Глава 3
3.4.3 Индуктивный эффект
Давайте сравним p K a значения уксусной кислоты и ее моно-, ди- и трихлорированных производных:
Рис. 3.4b Уксусная кислота и ее моно-, ди- и трихлорированные производные
3.4b Уксусная кислота и ее моно-, ди- и трихлорированные производныеПрисутствие атомов хлора явно увеличивает кислотность группы карбоновой кислоты, и аргумент здесь, очевидно, не имеет отношения к эффекту элемента.Эффект резонанса также не имеет к этому отношения, потому что для хлорированных молекул не может быть получено никаких дополнительных вкладов в резонанс. Скорее, объяснение этого явления связано с так называемым индуктивным эффектом . Атом хлора более электроотрицателен, чем водород, и, таким образом, способен “ индуцировать ” или “ притягивать ” электронную плотность к себе через σ-связи между ними, и, следовательно, помогает распределить электронную плотность сопряженного основания, карбоксилата и стабилизируйте его.Заместитель хлора может упоминаться как электроноакцепторная группа из-за индуктивного эффекта.
Индуктивный эффект – это эффект рассеивания заряда электроотрицательных атомов через σ-связи. Индуктивный эффект вызывает привыкание; большее количество атомов хлора оказывает в целом более сильный эффект, что объясняет повышение кислотности от моно-, ди- и трихлорированной уксусной кислоты. На следующей диаграмме в качестве примера показан индукционный эффект трихлорацетата.
Индуктивный эффект вызывает привыкание; большее количество атомов хлора оказывает в целом более сильный эффект, что объясняет повышение кислотности от моно-, ди- и трихлорированной уксусной кислоты. На следующей диаграмме в качестве примера показан индукционный эффект трихлорацетата.
Поскольку индукционный эффект зависит от электроотрицательности, фторсодержащие заместители обладают более сильным индуктивным эффектом, чем хлорные заместители, что делает трифторуксусную кислоту (ТФУ) очень сильной органической кислотой.
Рис. 3.4d трихлоруксусная кислота (pKa = 0,64) и трифторуксусная кислота (TfOH) (pKa = -0,25) Кроме того, поскольку индукционный эффект происходит через ковалентные связи, его влияние значительно уменьшается с расстоянием – таким образом, хлор состоит из двух атомов углерода. вдали от группы карбоновой кислоты имеет более слабый эффект по сравнению с хлором, находящимся всего в одном углероде.
3.4.4 Эффект гибридизации
Чтобы представить эффект гибридизации, мы рассмотрим разницу в кислотности алкана, алкена и алкина.
Атом водорода связан с атомом углерода во всех трех функциональных группах, поэтому эффект элемента не возникает. Кроме того, учитывая сопряженное основание каждого из них, невозможно получить дополнительный резонансный вклад.
Ключевое различие между сопряженными анионами оснований заключается в гибридизации атома углерода, то есть sp 3 , sp 2 и sp соответственно для алкана, алкена и алкина.Различные гибридизации приводят к разным s символу , то есть проценту s орбиталей от общего количества орбиталей. Гибридизация sp 3 означает 25% s признак (один s и три p орбитали, поэтому s символ равен 1/4 = 25%), sp 2 гибридизация имеет 33,3% s характер, а число составляет 50% для sp гибридизации. Электроны 2 s орбиталей находятся на более низком энергетическом уровне, чем электроны 2 p орбиталей, потому что 2 s гораздо ближе к ядру.Таким образом, для аниона с характером более s электроны находятся ближе к ядру и испытывают более сильное притяжение, поэтому анион имеет меньшую энергию и более стабилен.
Электроны 2 s орбиталей находятся на более низком энергетическом уровне, чем электроны 2 p орбиталей, потому что 2 s гораздо ближе к ядру.Таким образом, для аниона с характером более s электроны находятся ближе к ядру и испытывают более сильное притяжение, поэтому анион имеет меньшую энергию и более стабилен.
Относительная стабильность трех анионов (сопряженных оснований) также может быть проиллюстрирована картой электростатического потенциала, на которой более светлый цвет (менее красный) указывает на меньшую электронную плотность аниона и более высокую стабильность.
Рисунок 3.4e Карта электростатического потенциала коннектора.Основания Это также может быть заявлено в более общем виде, что более 90–150 символов в гибридных орбиталях делают атом более электроотрицательным. Для того же атома sp-гибридизованный атом более электроотрицателен, чем sp 2 гибридизированный атом, который более электроотрицателен, чем sp 3 гибридизированный атом.

 7
7

 При использовании сетевых обучающих структур возможно обсудить положения учебника с другими студентами (в электронном
читальном зале), оставаясь на своем рабочем
месте.
При использовании сетевых обучающих структур возможно обсудить положения учебника с другими студентами (в электронном
читальном зале), оставаясь на своем рабочем
месте. Если тестирование подобно собеседованию с преподавателем, то участие в моделировании процессов можно сопоставить с приобретением практических навыков в процессе производственной практики в реальных или приближенных к ним условиях производства.
Если тестирование подобно собеседованию с преподавателем, то участие в моделировании процессов можно сопоставить с приобретением практических навыков в процессе производственной практики в реальных или приближенных к ним условиях производства.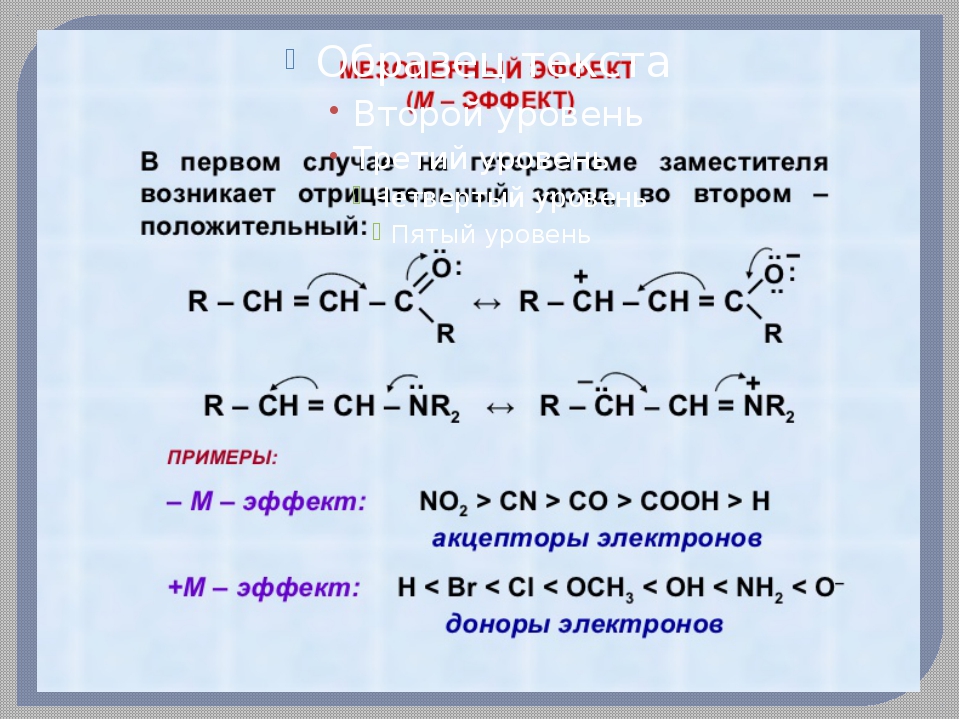
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.