что это, история открытия, место в таблице Менделеева, применение, физические и химические свойства, строение атома
Магний – элемент таблицы Менделеева, атомный номер которого 12. Обозначается знаком Mg, от латинского Magnesium. Вещество магний – легкий и углеродистый металл серебристо-белого оттенка.
Оглавление
- История открытия
- Магний в таблице Менделеева
- Строение атома магния
- Физические свойства
- Химические свойства
- Магний в природе
- Применение
- Роль металла в организме
История открытия
В 1695 году из минеральных вод Эпсомских кладезей в Британии выделили соль. Она обладала едким привкусом и очищающим эффектом. Ей дали название «горькая соль». Латинское же ее наименование берет корни из Малой Азии.
В 1792 году из белой магнезии был выделен неведомый ранее металл. Позже его назвали «австрий». Затем установили, что это был магний, загрязненный железом, отличающийся минимальным уровнем чистоты.
В 1809 году британский химик Гемфри Дэви при помощи электролиза двух компонентов получил амальгаму, которую назвал «магнезиум».
Магний в таблице Менделеева
В таблице металл занимает 12 место. Атомная масса элемента – 24.3040000. Степень окисления атомов Mg в соединениях – 2. Это условный заряд атома в соединении. Связь в молекуле между мельчайшими частицами основана на разделении электронов. Когда у атома увеличивается заряд, степень окисления становится негативной.
Валентность атомов – II. Поэтому элемент способен образовывать химические связи. Валентность выделяется из строения электронной оболочки атома и электронов, участвующих в появлении химических соединений.
Строение атома магния
Металл расположен в третьем периоде таблицы. Отличается он тремя оболочками. Первая (внешняя) содержит валентные электроны. Атом элемента имеет положительно заряженное ядро (+12), состоящее из 12 протонов и 12 нейтронов. Это разница между атомной массой и порядковым номером.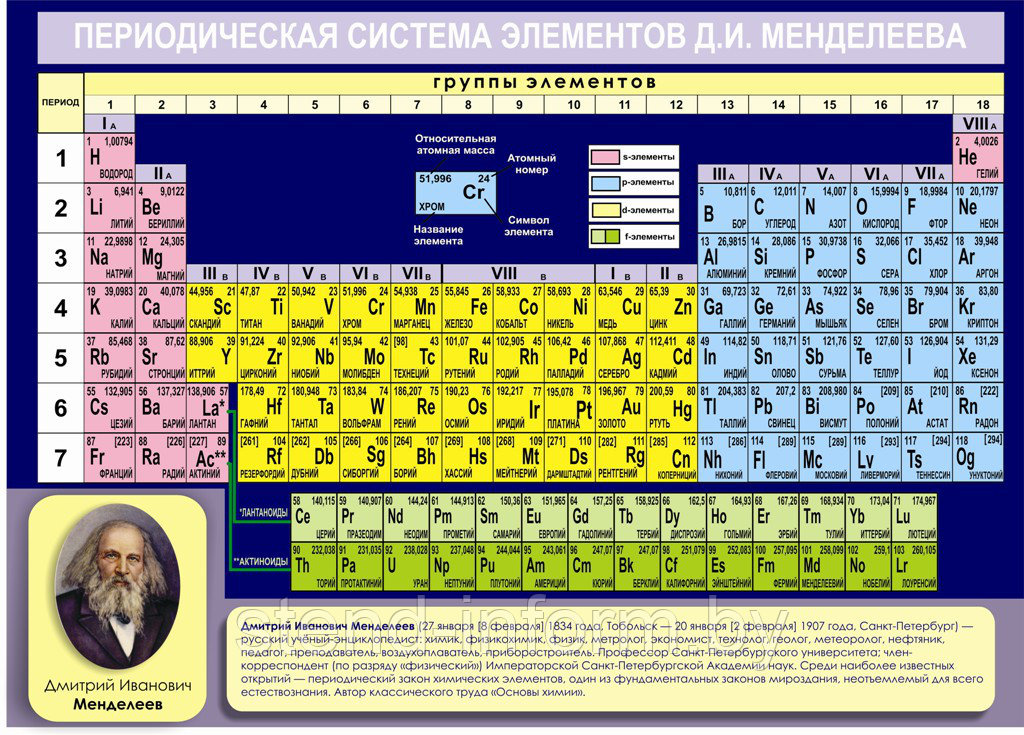 По орбитам вокруг ядра движутся 12 электронов.
По орбитам вокруг ядра движутся 12 электронов.
Металл относится к категории s-элементов. Его энергетическая диаграмма с валентными электронами, превращающимися в позитивно заряженный ион (Mg2+), выглядит так: Mg0 –2e → Mg2+.
При хранении на воздухе оксид постепенно поглощает влагу и CO₂, переходя в уравнение реакции магния Mg(OH)₂ и в MgCO₃.
MgO2₂ – это бесцветное кристаллическое вещество, малорастворимое в воде. Mg(OH)₂ – это белое составляющее, практически не растворяющееся в воде, но растворимое в солях аммония. Его часто встречают в природе в качестве минерала брусита.
Соли металла растворяются в H₂O. Растворы содержат бесцветные ионы Mg2+, придающие жидкости горький привкус.
Физические свойства
Магний – металл с гексагональной решеткой и серебристым оттенком. В стандартной среде поверхность элемента имеет надежную защитную пленку MgO. Она начинает разрушаться при температуре свыше +599 °C.
Скорость воспламенения очень большая, потому при неосторожной работе с элементом человек получает ожоги. На воспламененный металл рекомендуется смотреть через темные линзы или стекло, чтобы на некоторое время не ослепнуть.
На воспламененный металл рекомендуется смотреть через темные линзы или стекло, чтобы на некоторое время не ослепнуть.
Главные параметры элемента:
- плотность при 20 °C – 1,738 г/см³;
- t плавления 650 °C;
- t кипения 1090 °C;
- проводимость тепла при 20 градусах – 156 Вт/(м·К).
Высокочастотный Mg податливый, прессуется, прокатывается, поддается обработке резанием.
Химические свойства
Mg стойкий к окислению, ведь имеет надежная оксидную пленку. Однако при нагревании он интенсивно откликается на неметаллы. При контакте с огнем, Mg образует галогениды, превращается в оксид MgO.
С холодной водой магний не контактирует, но из кипящей жидкости он выпаривается, образуя гидроксид Mg(OH)₂. Оксидная пленка быстро растворяется в слабокислотной среде, особенно от смеси хлорида аммония.
Аммиак соприкасается с элементом при высоком температурном режиме, в результате образуется нитрид магния. Метанол контактирует с ним при 200 градусах, образовывая Mg(OMe)₂, а этанол взаимодействует с металлом при температуре 23-26 градусов.
Магний в природе
Магний – распространенный элемент на Земле. В основных породах его содержание достигает 25,9%. В коре и гранитах элемента меньше.
Производные магния входят в состав некоторых горных пород, таких как силикаты, карбонаты, хлориды.
Этот элемент присутствует в морской и океанической воде. Но концентрация его несколько меньше, чем натрия. При испарении морской воды с солями калия образуется хлорид магния.
Применение
Область применения металла широкая. Компонент используется в:
- Сплавах. Это конструкционный материал в авиа и машинной индустрии. Отличается легкостью, податливостью, прочностью.
- Источниках тока. Магний включают в электрические аккумуляторы. Продукция отличается максимальными показателями удельных энергетических параметров.
- Магний вместе с некоторыми окислителями применяют при создании пиротехники, осветительных и зажигательных составов.
- Медицине. Препараты магния показаны для улучшения психического здоровья, состояния сердца и сосудов.
 Часто применяют MgSO₄ (успокаивающее, противосудорожное, спазмолитическое средство) и MgCO₃ (легкое слабительное).
Часто применяют MgSO₄ (успокаивающее, противосудорожное, спазмолитическое средство) и MgCO₃ (легкое слабительное).
Элемент используют для создания батареей в фотоаппараты и другую технику. Также он применяется для получения легких и сверхлегких сплавов, производстве транспорта, военной аппаратуре.
Роль металла в организме
Магний – компонент, находящийся организме растений и животных. Его концентраторы – водоросли. Mg – часть хлорофилла, активирующего ферменты, обеспечивая тем самым стабильность структуры хромосом. Элемент стимулирует усвоение кислорода и полезных компонентов.
Животные и человек получают магний в продуктах. Потребность в химическом элементе за сутки – до 0,5 г. Концентрация в крови – 4,3 мг. Повышенное содержание элемента в теле вызывает сонливость и потерю чувствительности. В организме Mg накапливается в печени, затем переходя в мышечные ткани.
Магний – элемент, который необходим во всех сферах человеческой жизни. Он нужен для нормального функционирования организма, его активно применяют в промышленности, медицине. А что вы еще знаете об этом элементе? Расскажите в комментариях. Поделитесь статьей в социальных сетях и сохраните ее в закладках, чтобы не потерять полезную информацию.
А что вы еще знаете об этом элементе? Расскажите в комментариях. Поделитесь статьей в социальных сетях и сохраните ее в закладках, чтобы не потерять полезную информацию.
Магний – самый горячий металл на Земле. Смотрите ниже видео рассказ об этом интересном металле + несколько химических реакций с ним.
Источники:
- https://melscience.com/RU-ru/articles/chto-takoe-magnij
- http://kontren.narod.ru/x_el/info12.htm
- http://thermalinfo.ru/svojstva-materialov/metally-i-splavy/fizicheskie-svojstva-magniya-plotnost-teploemkost-teploprovodnost
118 элементов. Глава 12: самый фотографический металл
Элемент: магний (Magnesium)
Химический символ: Mg
Порядковый номер: 12
Год открытия: 1755
Стандартная атомная масса: 24.305
Температура плавления: 923 К
Температура кипения: 1363 К
Плотность при стандартных условиях: 1. 738 г/cм3
738 г/cм3
Скорость звука в магнии: 4940 м/с
Число стабильных изотопов: 3
Кристаллическая решётка: гексагональная
Горькая слава греческого города
История открытия магния началась в XVII веке, в графстве Суррей, в источнике у города Эпсом. В 1618 году местный фермер попытался напоить своих коров из колодца, на что те заявили своему хозяину: сам пей эту горечь. Однако, как выяснилось, «эта горечь» вроде бы лечит царапины и сыпь. В 1695 году из странной воды выделили вещество – «эпсомскую соль» (она же горькая соль или английская соль). Сейчас мы знаем, что это – кристаллогидрат сульфата магния, MgSO4·7 H2O. Как пишут, соль получил некий химик Н. Гро, имя которого мы так и не смогли установить.
Далее стало понятно, что при взаимодействии с поташем (гидроксидом калия) образуется вещество, точь-в-точь такое же, как при прокаливании минерала, который добывали в окрестностях греческого города Магнесия-на-Меандре (забегая вперед, скажем, что от того же города получили свое название и магнит с магнетизмом, и марганец).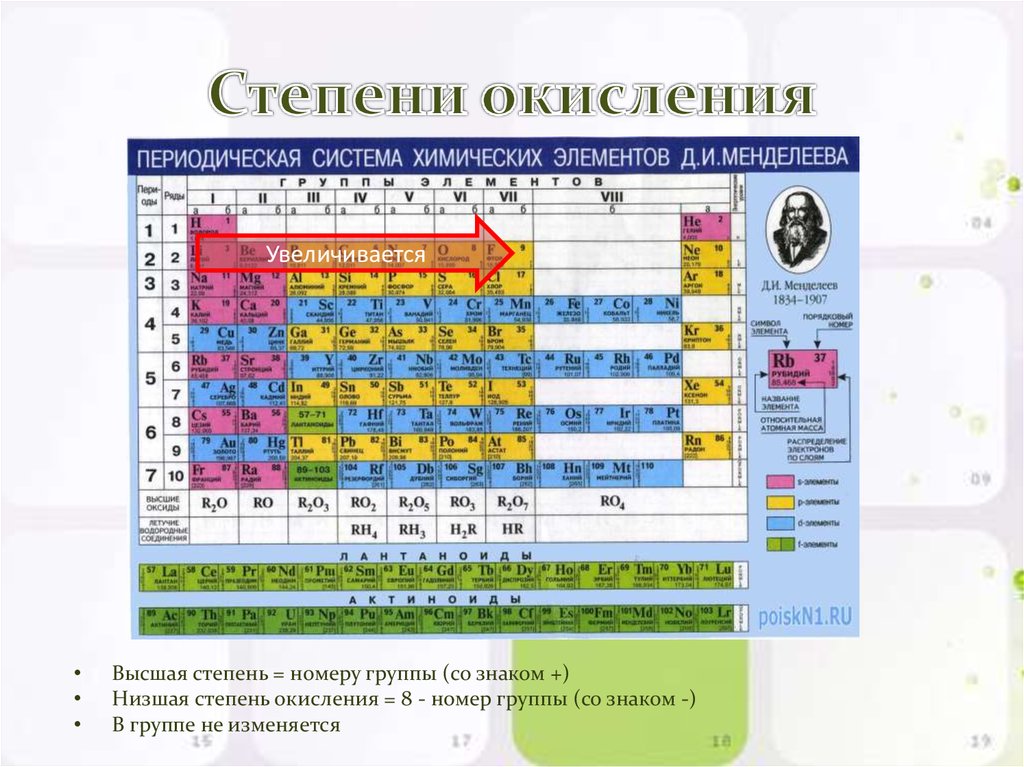 Именно так слово «магнезия прочно вошло в химический оборот, а эпсомскую соль стали называть белой магнезией (или просто магнезией). Впрочем, карбонат или оксид магния именовали также.
Именно так слово «магнезия прочно вошло в химический оборот, а эпсомскую соль стали называть белой магнезией (или просто магнезией). Впрочем, карбонат или оксид магния именовали также.
Пропилеи Магнесии-на-Меандре
К чистому металлу смогли подобраться заметно позже. Обнаруженный в 1754 году шотландским врачом и химиком Джозефом Блэком факт, что при нагревании белой магнезии (в данном случае – карбоната магния) выделяется связанный воздух (углекислый газ) и образуется жженая магнезия (оксид магния), привело годом позже к признанию магния самостоятельным химическим элементом, а Блэка – к статусу его первооткрывателя. Кстати, параллельно Блэк еще и доказал, что воздух – это смесь газов, а не один газ.
Интересный факт про Блэка и магний: еще того, как открыть магний как элемент, он написал докторскую диссертацию (он же врач!) о лечении камней в почках при помощи того самого карбоната магния.
Джозеф Блэк
В 1792 году Антон фон Рупрехт, восстанавливая углем белую магнезию (оксид магния MgO), смог выделить некий металл, который он патриотично назвал австрием. Увы, название этой страны так и не закрепилось в таблице Менделеева, поскольку оказалось, что исходный материал был очень загрязнен железом. Кстати, потом название «австрий» всплывало еще не раз, но тем не менее, вместо него заветные клетки занимал галлий и полоний.
Увы, название этой страны так и не закрепилось в таблице Менделеева, поскольку оказалось, что исходный материал был очень загрязнен железом. Кстати, потом название «австрий» всплывало еще не раз, но тем не менее, вместо него заветные клетки занимал галлий и полоний.
Кое-как выделить сравнительно чистый магний удалось великому сэру Хемфри Дэви в 1808 году. Впрочем, получить пригодный к употреблению магний и ему не удалось: Дэви проводил электролиз смеси магнезии и оксида ртути, так что на выходе у него получилась амальгама магния. Кстати, еще забавный факт: сам Дэви предложил назвать новый металл «магнием» (magnium), но в итоге в романских языках устаканилось слово magnesium. А вот в России с 1831 года закрепилось слово «магний».
Металлический магний получил французский химик и фармацевт Антуан Александр Брутус Бюсси, восстанавливая расплав хлорида магния металлическим калием. Это случилось в 1829 году, а уже в 1830 году Майкл Фарадей провел прямой электролиз хлорида магния и получил металлический магний в «промышленных» масштабах.
Антуан Александр Брутус Бюсси
Фотографический металл – и другие применения магния
Вообще-то, магния на нашей планете много.Он один из самых распространенных элементов, его кларк (извините, что ввели новое слово — не надо путать его с кварком, в одном атоме магния более семидесяти кварков, а кларк – это процентное содержание элемента в земной коре в среднем, этот термин ввел американский геохимик Франк Уиглсуорт Кларк в 1889 году, когда впервые прикинул, сколько и каких элементов присутствует до глубины в 16 километров) – почти два процента. Каждая средняя тонна земной коры содержит в себе 19,5 килограммов чистого магния.
Франк Уиглсуорт Кларк
Магний – очень легкий металл. Он всего лишь в 1,7 раз тяжелее воды – и самый легкий из всех используемых человечеством металлов в чистом виде для конструкционных материалов. Натрий и литий использовать сложно из-за мягкости и реакционной активности, бериллий очень ядовит…
Металлический магний
Впрочем, магний тоже очень легко горит – и горит очень ярким белым светом. И именно это его свойство привело к первому массовому практическому применению магния. Догадались, какому?
И именно это его свойство привело к первому массовому практическому применению магния. Догадались, какому?
Правильно, многие хотя бы по фильмам помнят магниевые вспышки. Дело в том, что первые фотографические эмульсии были не очень чувствительны. Экспозиции достигали минут, и о съемке в помещении не могло идти и речи. А все искусственные источники света – свечи, лучины, масляные и керосиновые лампы – имели жёлтый спектр, к которому эмульсия была почти нечувствительна.
Магниевая вспышка 1909 года в действии
Поэтому белый свет вспышки магниевого порошка пришелся как нельзя кстати. Впервые такое применение магнию предложил физик Уильям Крукс, известный работами по катодным трубкам (к нему мы еще вернемся, когда поговорим об открытии таллия). Первая фотовспышка заработала в 1859 году. Магний служил фотографам верой и правдой – и даже когда вспышка порошка на платформе ушла в прошлое, в 1929 году магний переместился в одноразовые колбы-вспышки, продержавшиеся до 1960-70 годов, когда магний победил ксенон (об этом – в соответствующей главе).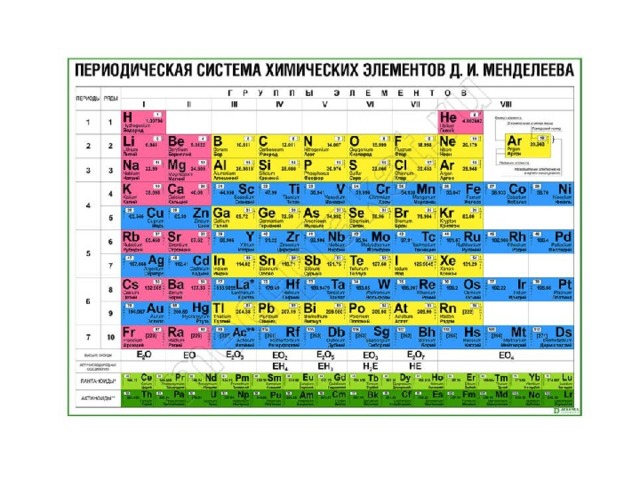
Одноразовые магниевые вакуумные вспышки фирмы OSRAM
Но, сойдя со сцены как составляющая вспышек, магний остался в фотографии. Шасси (металлическая рама) всех современных топовых зеркалок сделаны именно из магния, иначе бы прочные профессиональные камеры было бы очень тяжело носить.
Магниевое шасси камеры Nikon D800
Ну а магниевые сплавы используются много где именно как легкие конструкционные материалы и поныне. Другое дело, что если можно заменить магний более тяжёлым алюминием, это делают – всё же магний горит, и если горит, то потушить его непросто: он горит и в воде.
Магниевые «нобели»: реактив ГриньяраНеорганические соединения магния хорошо известны. О некоторых (всевозможных магнезиях) мы уже рассказали. Среди самых важных минералов магния нужно назвать доломит (карбонаты кальция и магния), бишофит (водный хлорид магния), брусит (гидроксид магния). Иногда среди минералов магния называют… морскую воду. С другой стороны, его там достаточно много – около 0,12% Но, пожалуй, самые интересные (и самые важные) для нас – органические соединения магния.
С другой стороны, его там достаточно много – около 0,12% Но, пожалуй, самые интересные (и самые важные) для нас – органические соединения магния.
Рассказывая об них, не нужно забывать, что органическая химия этого металла принесла исследователям четыре (можно сказать, что и пять с половиной) Нобелевские премии. Но, конечно, самый главный «магниевый нобель» был вручен в 1912 году Виктору Гриньяру.
Виктор Гриньяр
Гриньяр получил высшее физическое образование и собирался работать школьным учителем. Но завалил экзамены на лицензию, «сходил» в армию… А когда вернулся, ему встретился школьный приятель, Луи Руссе, уже ставший учителем химии. Он и убедил Гриньяра, что химия — это круто.
Руссе рассказал другу, что открылась вакансия ассистента химического факультета на кафедре профессора Филиппа Барбье. Виктор поспешил занять эту вакансию. Впрочем, поначалу Гриньяру казалось, что вся химия — это эмпирическая наука, бессистемная и требующая огромного количества памяти (благодаря учителям химии подавляющее большинство современных школьников именно так и считает), однако потом внутренняя структура науки начала проступать, и наш герой начал показывать выдающиеся успехи.
Барбье был очень хорошим ученым и сильной личностью и умел ценить таких же. Он быстро начал привлекать ассистента кафедры к исследованиям и в 1900 году попросил его попробовать еще раз сделать работы по металлоорганической химии, в которых у него уже несколько лет наблюдались трудности.
Чем занимался Барбье? Он пытался усовершенствовать реакцию Зайцева — присоединение к углероду при кетоновой группе цинкорганических соединений с образованием третичных спиртов и новой связи «углерод – углерод». В те годы вообще единственными металлоорганическими соединениями (органическими веществами, в которых присутствует связь «углерод-металл») была цинкорганика. За одним единственным исключением.
Учитель Гриньяра попытался заменить в этой реакции цинк магнием, потому что знал, что в 1898 году в Германии получили соединения R-Mg-R (R — это углеводородный радикал: метил, этил и так далее), но они получались с непредсказуемым выходом и были нестабильны. Впрочем, у Барбье особо ничего не получилось: он попытался проводить реакцию с двумя органическими веществами в присутствии магния. Реакция, конечно, получалась, но шла непредсказуемо.
Реакция, конечно, получалась, но шла непредсказуемо.
Как потом вспоминал сам Гриньяр, Барбье был очень плодовитым на идеи, но если работа сразу же «не шла», то химик охладевал к ней и брал следующую идею. Поэтому Барбье «скинул» эту работу на Гриньяра.
Молодой ученый уперся в те же проблемы, что и учитель, но потом его осенило: а что, если получить магнийорганику не прямо в реакции, как при реакции Зайцева, а получить промежуточное вещество заранее. И внезапно оказалось, что реакция RX+Mg = R-Mg-X (X – это галоген: хлор, бром, йод) идет в растворе очень легко, а полученные вещества идеально реагируют с кетонами и вообще с очень многими органическими соединениями. Так у органиков появился очень мощный метод для направленного органического синтеза. Им пользуются до сих пор, а вещества R-Mg-X везде, кроме Франции, получили название «реактив Гриньяра».
Работа Гриньяра произвела эффект разорвавшейся бомбы. В 1900 году вышла его статья в журнале Comptes Rendus de l’Académie des sciences, и он был ее единственным автором.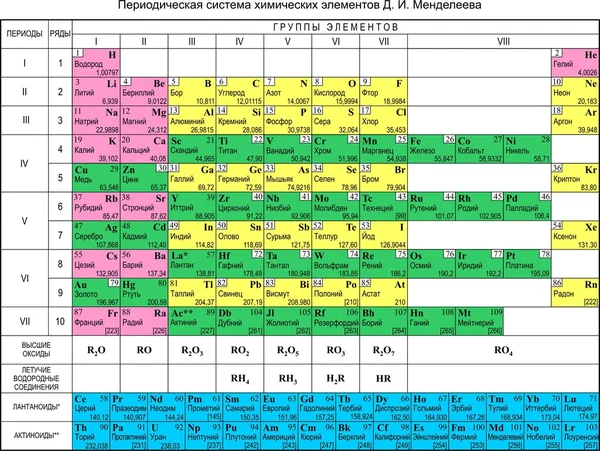 Этот факт стал, кстати, поводом для серьезной полемики во Франции: почему же Барбье, поставивший задачу, не стал соавтором. По воспоминаниям нашего героя, ему это было просто неинтересно.
Этот факт стал, кстати, поводом для серьезной полемики во Франции: почему же Барбье, поставивший задачу, не стал соавтором. По воспоминаниям нашего героя, ему это было просто неинтересно.
Любопытно, что свою степень по химии Гриньяр получил только в 1901 году, когда он стал уже всемирно знаменит. Правда, он озаботился защитой своих интеллектуальных прав: в 1900 году, сразу после открытия своей реакции, Гриньяр попросил двух французских академиков, Анри Муассана (Нобелевская премия 1906 года) и Марелена Бертло о защите своего открытия. Оба написали ему: никак без публикаций защитить свой приоритет не получится. Гриньяр внял совету, заручился поддержкой в публикациях статей, и с 1900 по 1904 год опубликовал четырнадцать.
Надо сказать, влияние на развитие химии эти публикации оказали немалое: только за его «нобелевский» 1912 год было опубликовано 700 статей, посвященных применению реактива Гриньяра. Поэтому Нобелевская премия была абсолютно по делу.
Магниевые «нобели»: хлорофиллСледующий наш рассказ о нобелевских премиях, связанных с магнием, будет посвящен Рихарду Вильштеттеру, ученику Адольфа фон Байера, изучавшего красители.
Рихард Вильштеттер
В год, когда его патрон удостоился Нобелевской премии по химии (1905), он перешел на полную профессорскую ставку в Цюрих, в знаменитый ETH, и начал работать на производстве красителя хлорофилла — вещества, которое делает листья зелеными и который обеспечивает превращение углекислого раза растениями в углеводы (процесс фотосинтеза).
Именно на поприще изучения хлорофилла (до Вильштеттера вообще никто не знал даже брутто-формулы этого важнейшего вещества) он добился наибольших успехов. Сначала он выявил эмпирическую формулу хлорофилла — относительное содержание в нем атомов углерода, азота, водорода, кислорода и магния.
Вильштеттеру удалось опровергнуть утверждение о том, что у каждого растения — свой хлорофилл. Химик вместе со своим учеником Артуром Штоллем показал, что во всем растительном царстве существуют всего две очень близкие формы хлорофилла: a и b (правда, потом нашлись и c1, и c2, и некоторые другие).
Хлорофилл C1 и C2
Постепенно Вильштеттер начал расшифровывать структуру пигмента и обнаружил в нем тетрапиррольное кольцо (порфирин) с центральным атомом магния. Нужно отметить, что сырьем «хлорофилловой фабрики» Вильштеттера стала крапива, ведь в ней содержится очень много хлорофилла.
Нужно отметить, что сырьем «хлорофилловой фабрики» Вильштеттера стала крапива, ведь в ней содержится очень много хлорофилла.
«Цель моей работы состояла в том, чтобы установить структурные характеристики наиболее широко распространенных пигментов растений, в частности хлорофилла, и найти определенные критерии, касающиеся их химической функции», — так описал свой труд Рихард Вильштеттер в нобелевской лекции.Это была первая премия «за хлорофилл». Но далеко не последняя.
В 1930 году Нобелевскую премию по химии с формулировкой «За исследования по конструированию гемина и хлорофилла, особенно за синтез гемина» получил немец Ханс Фишер, который сделал первые шаги по синтезу хлорофилла.
На представлении лауреата Ханс Седербаум из Шведской королевской академии сказал: «Работы Фишера стали научным достижением, которое вряд ли могло бы быть получено предыдущими поколениями. […] Исследования Фишера показали, что природа, несмотря на ее непомерное многообразие, довольно экономно использует стандартный строительный материал для конструирования таких сильно различающихся как по внешнему виду, так и по распространению двух веществ, [таких как хлорофилл и красный пигмент крови]».
Ханс Фишер
Дальше – больше. Как вы думаете, кто сделал первый в истории направленный синтез хлорофилла? Можно даже не гадать, «второй по крутизне химик после природы» (цитируя представителя Нобелевского комитета) – Роберт Бернс Вудворд,который опубликовал очередной рутинный великий синтез в 1960 году. Так что и этот синтез стал кирпичиком в нобелевской премии великого Вудворда, получившего премию «потому, что он молодец».
Американский биохимик Мелвин Кальвин при помощи радиоактивного углерода сумел показать, как именно работает хлорофилл в растениях. Как итог – Нобелевская премия по химии 1961 году «За исследование усвоения двуокиси углерода растениями». И, наконец, отчасти с хлорофиллом связана Нобелевская премия по химии 1988 года, которую получили немцы Иоганн Дайзенхофер, Хармут Михель и Роберт Хубер, которые установили трёхмерную структуру фотосинтетического реакционного центра.
Но, конечно, магний важен для человека не только Нобелевскими премиями. Магний – одиннадцатый по распространенности в нашем организме элемент, при этом он входит в состав или участвует в работе почти 300 ферментов (это из известных!), так что этот элемент нам просто необходим.
Магний – одиннадцатый по распространенности в нашем организме элемент, при этом он входит в состав или участвует в работе почти 300 ферментов (это из известных!), так что этот элемент нам просто необходим.
А в завершение нашего длинного рассказа мы покажем вам видео из знаменитой серии популярных видеороликов о химических элементах серии «Периодическое видео химических элементов», которую ведет замечательный профессор Ноттингемского университета Мартин Полякофф
Текст: Алексей Паевский
Magnificent Magnesium Магний Элемент Периодической таблицы
Магний , атомный символ Mg, является элементом, принадлежащим к группе 2a периодической таблицы. Это блестящий металл серебристого цвета, одновременно прочный и легкий. Фактически, это самый легкий из существующих металлических элементов. Все это звучит довольно великолепно для меня.
Все это звучит довольно великолепно для меня.
Интересные факты о магнии
- Магний, мг, является восьмым по распространенности элементом.
- Оксид магния является вторым наиболее распространенным соединением, обнаруженным в земной коре.
- На каждый кубический километр морской воды приходится около 1,3 миллиарда килограммов магния.
- Магний — самый легкий из всех металлических элементов.
- Название Магний происходит от Магнезии, региона Греции. Минерал магнезия белая была впервые обнаружена в этом месте.
- Пожар магния очень трудно потушить, его нельзя потушить водой
Магний в периодической таблице
Магний, символ Mg, имеет атомный номер 12 в периодической таблице. Это щелочноземельный металл в группе 2, расположенный ниже бериллия, выше кальция и справа от натрия. Он имеет низкую электроотрицательность 1,31, а атом магния имеет электронную конфигурацию [Ne] 3s 2 или 1s 2 2s 2 2p 6 3s 2
Изобилие магния в природе
Магний является третьим наиболее распространенным металлом в земной коре. Он встречается не только в шестидесяти различных минералах, но также может быть найден в морской воде и под землей. Однако в природе он не встречается в свободном виде. Для получения чистого металлического магния его необходимо обработать, о чем будет сказано далее.
Он встречается не только в шестидесяти различных минералах, но также может быть найден в морской воде и под землей. Однако в природе он не встречается в свободном виде. Для получения чистого металлического магния его необходимо обработать, о чем будет сказано далее.
Элемент магний образуется в больших стареющих звездах в результате добавления трех ядер гелия к углеродному ядру. Когда взрываются сверхновые, большая часть магния выбрасывается в космос, где он может стать частью новых звездных систем.
Воздействие магния на здоровье
Минерал магния имеет решающее значение для человека и необходим для правильного функционирования организма. Он играет роль в движении мышц, прочности костей, уровне сахара в крови и здоровье сердечно-сосудистой системы. Взрослые имеют около 25 граммов запасенного магния и должны потреблять от 300 до 400 мг ежедневно. Достичь идеального потребления может быть легко с помощью диеты, наполненной продуктами, богатыми магнием, включая цельнозерновые продукты, орехи, семена и зеленые листовые овощи.
Применение магния в современном мире
Подобно титану, магний имеет высокое отношение прочности к весу. Это делает магний благоприятным выбором для продуктов, которые должны быть легкими. К ним относятся самолеты, автомобильные двигатели и ракеты. Его также можно найти во взрывчатых и пиротехнических устройствах, так как этот элемент излучает чрезвычайно яркий белый свет, когда он горит в воздухе.
Соединения магния используются для изготовления огнеупорных материалов, предназначенных для выдерживания чрезвычайно высоких температур. Печи из огнеупорных материалов используются для производства металлов, стекла и цемента.
Магниево-алюминиевые сплавы
Магний, несмотря на его изобилие, является дорогостоящим металлом. Для экономии его часто комбинируют с алюминием в сплаве. Эти двое составляют хорошую команду, потому что они оба представляют собой легкие металлы со многими конструкционными применениями. Однако и у них есть свои отличия. Алюминий — гораздо более дешевая альтернатива магнию. Он более стабилен и обладает большей прочностью. Но магний более легкий. Магниевые сплавы также легче производить в том смысле, что они затвердевают быстрее. С другой стороны, магний очень реактивен и требует защитного покрытия для предотвращения коррозии. Кроме того, он мягче алюминия, что не подходит для промышленного использования. Когда они соединяются в сплав, два металла работают, объединяя свои сильные стороны, чтобы получить гораздо более эффективный сплав.
Он более стабилен и обладает большей прочностью. Но магний более легкий. Магниевые сплавы также легче производить в том смысле, что они затвердевают быстрее. С другой стороны, магний очень реактивен и требует защитного покрытия для предотвращения коррозии. Кроме того, он мягче алюминия, что не подходит для промышленного использования. Когда они соединяются в сплав, два металла работают, объединяя свои сильные стороны, чтобы получить гораздо более эффективный сплав.
История магния
Кто открыл магний?
До 1755 года никто не знал разницы между магнием и кальцием; Считалось, что эти два элемента представляют собой один и тот же элемент. Шотландский химик по имени Джозеф Блэк провел эксперимент, чтобы отличить два элемента друг от друга. Несколько лет спустя, в 1808 году, сэр Хамфри Дэви (который также играет роль в открытии бора и йода) смог выделить магний, взяв амальгаму магния и ртути и выпарив из нее этот элемент.
Если говорить более подробно, он построил большую батарею, которая должна была проводить электричество через соль, которая должна была быть амальгамой магния. Амальгама была изготовлена путем приготовления пасты из влажного оксида магния и красного оксида ртути. Затем Дэви сделал небольшое углубление в пасте и добавил металлическую ртуть в качестве отрицательного электрода (и платину в качестве положительного электрода). Затем, используя батарею, он провел электричество через пасту, чтобы сформировать амальгаму. Наконец, амальгаму нагревали, и можно было выделить элементарный магний.
Амальгама была изготовлена путем приготовления пасты из влажного оксида магния и красного оксида ртути. Затем Дэви сделал небольшое углубление в пасте и добавил металлическую ртуть в качестве отрицательного электрода (и платину в качестве положительного электрода). Затем, используя батарею, он провел электричество через пасту, чтобы сформировать амальгаму. Наконец, амальгаму нагревали, и можно было выделить элементарный магний.
Реакции магния
Твердый металлический магний защищен слоем оксида. Несмотря на свою тонкость, этот слой предотвращает реакцию металла с воздухом. Почему мы хотим защитить магний от воздуха? Металлический магний горит на воздухе. Затем он будет реагировать с кислородом, производя яркое белое пламя, образуя оксид магния.
Магний более реакционноспособен, чем переходные металлы или редкоземельные элементы, такие как молибден или эрбий. Он медленно реагирует с горячей водой и быстро с паром с образованием гидроксида магния и оксида магния соответственно.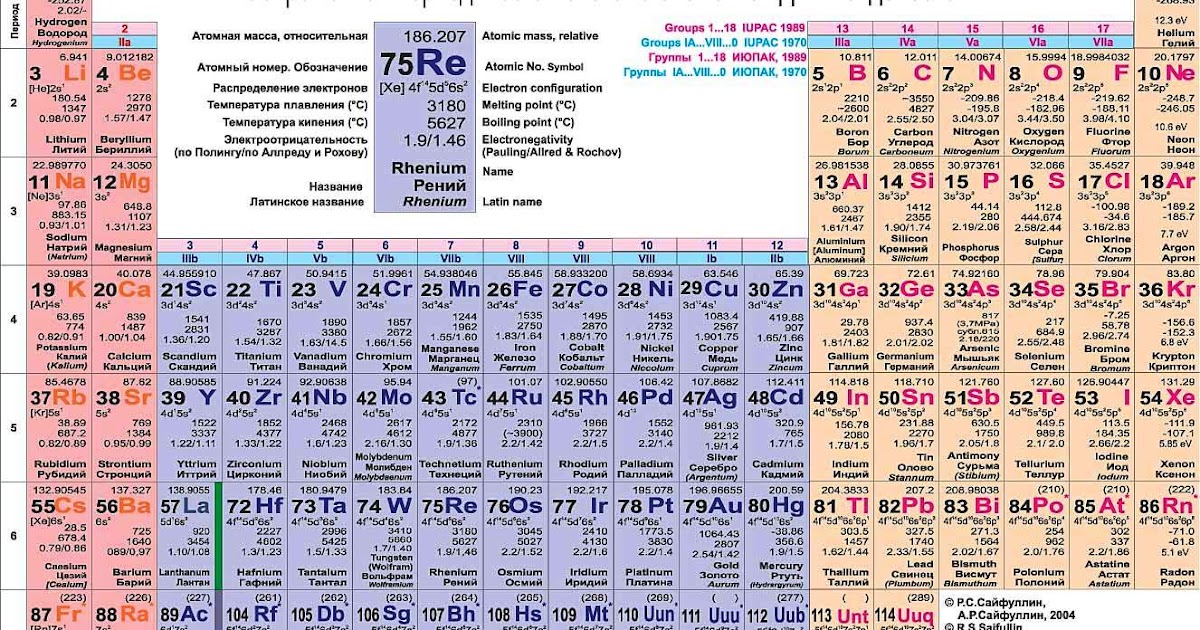
Магний в органической химии
Те, кто изучал органическую химию, вероятно, знакомы с реактивом Гриньяра. Реактив Гриньяра представляет собой продукт реакции магния с алкил- или алкенилгалогенидом. Это сильный нуклеофил и основание, которое реагирует с протонными соединениями (протонные означает протоны). Реакции Гриньяра важны в органической химии, потому что они приводят к образованию связи углерод-углерод, которая используется для синтеза различных спиртов.
Соединения магния
В природе широко распространено множество соединений магния. Некоторые из них имеют важное коммерческое применение, а другие можно использовать в лаборатории.
Оксиды
Когда вы сжигаете полоску магниевой ленты, она не только производит чрезвычайно яркий белый свет, но и оставляет после себя белый порошок, который в основном состоит из оксида магния , MgO.
Посмотрите, как ярко светится магниевая лента при нагревании, из Chemistry Demo Lab Университета штата Огайо:
Оксид магния, природный минерал, представляет собой белый термостойкий порошок. Ионы магния и кислорода образуют прочную ионную связь, что делает его нерастворимым в воде. Его высокая температура плавления 2851,85°C (5165,33°F) и химическая стабильность делают его важным в огнеупорной промышленности. Он содержится в футеровке печей, тиглях и является обычным огнезащитным ингредиентом. Оксид магния является основным, что также делает его полезным в медицине. Mag-Caps и Mag-Ox 400 — это препараты, содержащие оксид магния, которые лечат изжогу и расстройство желудка, нейтрализуя избыток кислоты. Учащиеся также полагаются на оксид магния, когда читают учебники или делают записи — оксид магния лечит бумагу. Без оксида магния бумага сгнила бы из-за своей кислотности.
Оксид магния является основным, что также делает его полезным в медицине. Mag-Caps и Mag-Ox 400 — это препараты, содержащие оксид магния, которые лечат изжогу и расстройство желудка, нейтрализуя избыток кислоты. Учащиеся также полагаются на оксид магния, когда читают учебники или делают записи — оксид магния лечит бумагу. Без оксида магния бумага сгнила бы из-за своей кислотности.
Пероксид магния , MgO 2 , является продуктом соединения оксида магния с пероксидом водорода в экзотермической реакции. Выпускается в виде беловатого порошка без запаха. При разрушении он выделяет кислород, что делает его полезным в сельском хозяйстве и для очистки воды. Он «исправляет» поврежденную почву, восполняя дефицит магния и действуя как источник кислорода. Перекись магния очищает воду, регулируя уровень pH и уменьшая количество загрязняющих веществ.
При соединении оксида магния с водой образуется гидроксид магния , Mg(OH) 2 . И наоборот, при нагревании гидроксид магния теряет влагу и снова превращается в оксид магния. Гидроксид магния представляет собой неорганическое соединение, которое либо встречается в природе в виде минерала брусита, либо выпадает в виде осадков из морской воды. Он нерастворим в воде и обладает антацидными и слабительными свойствами. Гидроксид магния при суспендировании в воде или щелочном растворе образует ‘ молочко магнезии ’. Это кислотонейтрализующее средство хорошо известно своими слабительными и антацидными свойствами осмотического типа. Механизм действия магнезиального молока заключается в привлечении ионов гидроксида в желудок, которые опосредуют желудочную кислоту и удерживают воду в кишечнике.
И наоборот, при нагревании гидроксид магния теряет влагу и снова превращается в оксид магния. Гидроксид магния представляет собой неорганическое соединение, которое либо встречается в природе в виде минерала брусита, либо выпадает в виде осадков из морской воды. Он нерастворим в воде и обладает антацидными и слабительными свойствами. Гидроксид магния при суспендировании в воде или щелочном растворе образует ‘ молочко магнезии ’. Это кислотонейтрализующее средство хорошо известно своими слабительными и антацидными свойствами осмотического типа. Механизм действия магнезиального молока заключается в привлечении ионов гидроксида в желудок, которые опосредуют желудочную кислоту и удерживают воду в кишечнике.
Сульфид и сульфат магния
Сульфат магния , MgSO 4 , представляет собой сульфатсодержащую соль и сульфат металла. Это бесцветное кристаллическое твердое вещество является продуктом смешивания гидроксида магния с диоксидом серы и кислородом. Он имеет множество применений в медицине: это противосудорожное средство, блокатор кальциевых каналов, анестезия, токолитическое средство, антиаритмический препарат и анальгетик. Сульфат магния также полезен в промышленности, где его добавляют в цемент и удобрения. Из него можно даже приготовить домашнюю еду для лужайки. Существует несколько форм гидратов сульфата магния, включая безводный MgSO 4, и гептагидрат, MgSO 4 · 7H 2 Кристаллы O.
Он имеет множество применений в медицине: это противосудорожное средство, блокатор кальциевых каналов, анестезия, токолитическое средство, антиаритмический препарат и анальгетик. Сульфат магния также полезен в промышленности, где его добавляют в цемент и удобрения. Из него можно даже приготовить домашнюю еду для лужайки. Существует несколько форм гидратов сульфата магния, включая безводный MgSO 4, и гептагидрат, MgSO 4 · 7H 2 Кристаллы O.
Сульфат магния наиболее растворим в безводной форме. Его получают, когда кристаллы гексагидрата сульфата магния нагревают до температуры около 300°C (572°F). Он распространен в научных лабораториях, так как является осушителем. При воздействии влаги кристаллы сульфата магния впитывают воду и слипаются. Затем этот комок удаляют фильтрованием.
После тяжелой тренировки вы можете почувствовать боль в мышцах. Обычный способ облегчить эту боль — погрузиться в ванну с английской солью . Английская соль представляет собой синтетически полученное соединение гептагидрата сульфата магния. На вид она идентична поваренной соли, за исключением того, что крупнее и грубее. Тем не менее, , а не , используйте его для приправы к еде. Проглатывание слишком большого количества химического вещества может иметь серьезные последствия, включая остановку сердца и брадиаритмию. В воде соль диссоциирует на ионы магния и сульфата, которые * предположительно впитывается через кожу во время принятия ванны. Это помогает вылечить боль в мышцах за счет повышения уровня магния в крови.
Английская соль представляет собой синтетически полученное соединение гептагидрата сульфата магния. На вид она идентична поваренной соли, за исключением того, что крупнее и грубее. Тем не менее, , а не , используйте его для приправы к еде. Проглатывание слишком большого количества химического вещества может иметь серьезные последствия, включая остановку сердца и брадиаритмию. В воде соль диссоциирует на ионы магния и сульфата, которые * предположительно впитывается через кожу во время принятия ванны. Это помогает вылечить боль в мышцах за счет повышения уровня магния в крови.
* Исследования показали разные результаты того, насколько эффективны ванны с английской солью для облегчения мышечной боли.
Карбонат
Карбонат магния , MgCO 3 Встречается в природе в виде магнезита. Магнезит представляет собой желтовато-серую или коричневую кристаллическую руду, устойчивую к очень высоким температурам.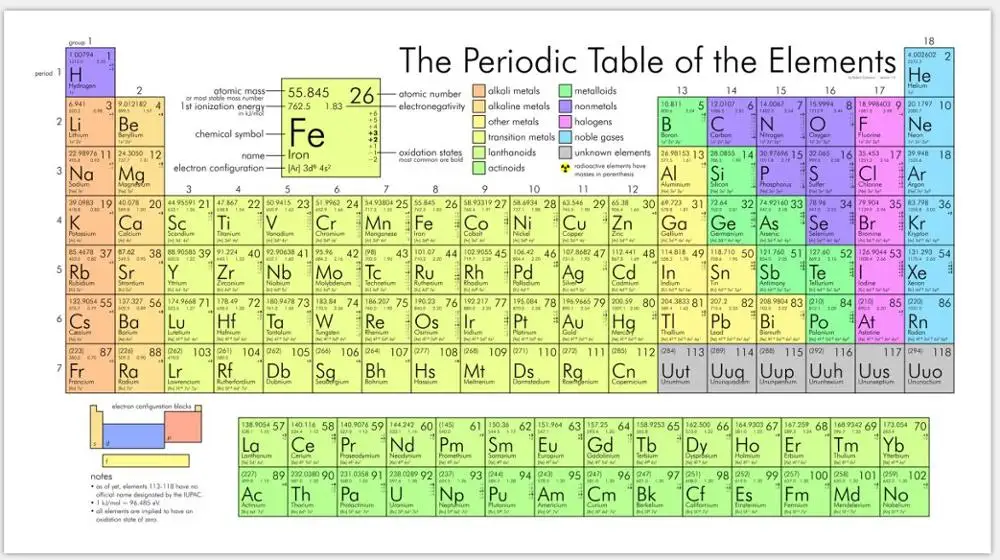 Карбонат магния также является продуктом поглощения углекислого газа и воды гидроксидом магния. Карбонат магния представляет собой неорганическое, основное, нерастворимое и гидратированное соединение. Он представляет собой легкий, белый, рассыпчатый, твердый, то есть без запаха. Его применения очень широко распространены: это антацид и слабительное; как удобрение; при производстве жаропрочных материалов; в косметике для повышения укрывистости и корректировки уровня pH; и даже является пищевой добавкой для предотвращения слеживания.
Карбонат магния также является продуктом поглощения углекислого газа и воды гидроксидом магния. Карбонат магния представляет собой неорганическое, основное, нерастворимое и гидратированное соединение. Он представляет собой легкий, белый, рассыпчатый, твердый, то есть без запаха. Его применения очень широко распространены: это антацид и слабительное; как удобрение; при производстве жаропрочных материалов; в косметике для повышения укрывистости и корректировки уровня pH; и даже является пищевой добавкой для предотвращения слеживания.
Фосфат
Фосфат магния , Mg 3 (PO 4 ) 2 , представляет собой соль магния и фосфата. Это медленно действующая разрыхлительная кислота, представляющая собой группу кислот, которые помогают образовывать химические разрыхлительные системы. Подумайте о свежей буханке хлеба – она рассыпчатая, легкая и воздушная. Без разрыхлителя газы в тесте никогда не будут выделяться, в результате чего хлеб будет удручающим. Сравните это с пищевой содой! Поэтому популярность фосфата магния в хлебопекарной промышленности растет, а это значит, что мы едим более вкусный хлеб и выпечку.
Сравните это с пищевой содой! Поэтому популярность фосфата магния в хлебопекарной промышленности растет, а это значит, что мы едим более вкусный хлеб и выпечку.
Этот минерал встречается в человеческих костях, рудах и семенах растений и представляет собой белый кристаллический порошок. Он растворим в растворах солей, а при взаимодействии с водой образует фосфорную кислоту и гидроксид магния. Применение фосфата магния выходит за рамки хлебобулочных изделий: он покрывает древесину, делая ее огнеупорной, и используется в качестве пищевой добавки для укрепления костей, борьбы с усталостью и регуляции мышечной функции.
Выделение магния
Как уже говорилось, магний является чрезвычайно распространенным металлом. Однако он никогда не встречается в чистом виде и должен быть отделен от его соединений. Есть несколько методов рафинирования магния, которые мы рассмотрим:
Электролиз
Чтобы извлечь магний из доломитовых и магнезитовых руд, они должны пройти электрохимический процесс. Сначала доломит измельчают и смешивают с морской водой. При нагревании этой смеси нерастворимый гидроксид магния отделяется и опускается на дно. Затем его отфильтровывают и смешивают с соляной кислотой с образованием хлорида магния. Затем это новое соединение высушивают и подвергают электролизу для высвобождения магния.
Сначала доломит измельчают и смешивают с морской водой. При нагревании этой смеси нерастворимый гидроксид магния отделяется и опускается на дно. Затем его отфильтровывают и смешивают с соляной кислотой с образованием хлорида магния. Затем это новое соединение высушивают и подвергают электролизу для высвобождения магния.
Процесс Pigeon
Доктор Ллойд изобрел процесс Pigeon для получения чистого металлического магния. Этот процесс является примером термического восстановления. Первым шагом является дробление доломитовых руд и их кальцинирование путем обжига при высоких температурах. При этом углерод высвобождается из соединения. Далее нужен восстановитель, ферросилиций; Его измельчают и смешивают с прокаленным доломитом. Затем этой смесью заполняют реторты или редукционные камеры. Наконец, реторту нагревают до тех пор, пока наверху не образуются коронки из неочищенных кристаллов металлического магния.
Степени окисления магния
Магний в своем элементарном состоянии имеет степень окисления 0. Однако соединения магния почти всегда находятся в степени окисления +2.
Однако соединения магния почти всегда находятся в степени окисления +2.
Свойства элемента Магний
- Магний Обозначение: Mg
- Температура плавления: 923 K; 650°С; 1202°F
- Температура кипения: 1363 K; 1090°С; 1994°F
- Плотность: 1,74 г/см 3
- Атомный вес: 24,305
- Атомный номер: 12
- Электроотрицательность: 1,31
- Классификация: Щелочной металл
- Естественное содержание в земной коре: 2%
- Конфигурация электронной оболочки: [Ne] 3s2
- Изотопы: Магний-24
- Магний содержится в минералах: 60 минералов, включая магнезит и доломит
- Токсичность: нетоксичен
Где я могу купить Магний?
Металлический магний можно приобрести на Amazon и в специализированных магазинах.
Магний (Mg) – Периодическая таблица
Магний представляет собой химический элемент периодической таблицы с химическим символом Mg и атомным номером 12 с атомным весом 24,304 u, классифицируется как щелочноземельный металл и входит в группу 2 (щелочноземельный металл). Магний твердый при комнатной температуре.
Магний твердый при комнатной температуре.
Натрий Периодическая таблица Алюминий
| Символ | Mg |
| Atomic number | 12 |
| Group | 2 (Alkaline earth metal) |
| Period | 3 |
| Block | s |
| Classification | Щелочноземельный металл |
| Внешний вид | |
| Цвет | Серебро |
| Number of protons | 12 p + |
| Number of neutrons | 12 n 0 |
| Number of electrons | 12 e – |
Из Википедии, свободной энциклопедии Магний — химический элемент с символом Mg и атомным номером 12. Это блестящее серое твердое вещество, имеющее близкое физическое сходство с другими пятью элементами во второй колонке (Группа 2, или щелочной земные металлы) периодической таблицы: каждый из них имеет одинаковую электронную конфигурацию в своей внешней электронной оболочке, производя подобную кристаллическую структуру. Магний является девятым по распространенности элементом во Вселенной.
Это блестящее серое твердое вещество, имеющее близкое физическое сходство с другими пятью элементами во второй колонке (Группа 2, или щелочной земные металлы) периодической таблицы: каждый из них имеет одинаковую электронную конфигурацию в своей внешней электронной оболочке, производя подобную кристаллическую структуру. Магний является девятым по распространенности элементом во Вселенной.
| Phase at STP | Solid |
| Density | 1.738 g/cm 3 |
| Atomic weight | 24.304 u |
| Melting point | 923 K 649.85 °C 1201.73 °F |
| Boiling point | 1363 K 1089.85 °C 1993.73 °F |
| Heat of vaporization | 127. |

 Часто применяют MgSO₄ (успокаивающее, противосудорожное, спазмолитическое средство) и MgCO₃ (легкое слабительное).
Часто применяют MgSO₄ (успокаивающее, противосудорожное, спазмолитическое средство) и MgCO₃ (легкое слабительное).