Основные формулы и методические рекомендации по решению задач на основы МКТ
Приступаем к рассмотрению новой главы физики «Элементы статистической физики и термодинамики». В данной теме будут рассмотрены некоторые важные определения и понятия, относящиеся к первому ее разделу, который посвящен основам молекулярно-кинетической теории.
Молекулярная физика и термодинамика — это разделы физики, в которых изучаются свойства тел и происходящие в них макроскопические процессы, связанные с огромным числом частиц, содержащихся в телах.
Для исследования этих процессов пользуются двумя методами: молекулярно–кинетическим (его еще называют статистическим методом) и термодинамическим.
В основе молекулярной физики лежит молекулярно-кинетическая
теория, которая объясняет строение и свойства тел движением и
взаимодействием частиц, из которых состоит тело.
Термодинамика же изучает общие свойства тел и процессы в них, сопровождающиеся превращениями энергии. То есть процессы, связанные с изменением температуры тела, а также с изменением его агрегатного состояния.
Однако следует помнить, что эти два метода — термодинамический и молекулярно–кинетический, применяемые к одним и тем же объектам, не исключают, а дополняют друг друга
В основе молекулярно-кинетической теории вещества лежат следующие три положения.
1) Все вещества состоят из мельчайших частиц: молекул, атомов, ионов и других, разделенных между собой промежутками.
Молекула — это мельчайшая устойчивая частица вещества,
сохраняющая его основные химические свойства. Однако молекулы, состоят из еще
более мелких частиц — атомов. Атомы — это мельчайшие частицы химического
элемента, сохраняющие его химические свойства.
Однако молекулы, состоят из еще
более мелких частиц — атомов. Атомы — это мельчайшие частицы химического
элемента, сохраняющие его химические свойства.
Атомы представляют собой весьма сложные образования, но классическая молекулярно-кинетическая теория использует модель атомов в виде твердых неделимых частичек сферической формы.
2) Частицы в веществе связаны друг с другом силами молекулярного взаимодействия — притяжения и отталкивания. Эти силы зависят от расстояния между частицами.
3) Молекулы в веществе находятся в непрерывном беспорядочном (тепловом) движении.
Доказательством теплового движения молекул является броуновское движение.
Именно хаотическое движение молекул газа играет главную роль
в его поведении, а силы их взаимодействия настолько малы, что ими можно просто
пренебречь. Это означает, молекула газа движется равномерно и прямолинейно,
пока не столкнется с другой молекулой.
Идеальный газ — это газ с достаточно простыми свойствами:
1) Собственным объемом молекул можно пренебречь по сравнению с объемом сосуда, в котором находится газ.
2) Между молекулами нет сил взаимодействия; они действуют только при столкновении молекул.
3) Молекулы ведут себя при столкновениях как абсолютно упругие шарики.
Следует отметить, что при небольших давлениях и не очень низких температурах реальные газы близки к идеальному газу.
Для описания свойств газов можно пользоваться
микроскопическими параметрами, такими как скорость молекулы, ее масса
и энергия, которые являются характеристиками молекул, и
средние значения которых находятся только расчетным путем.
А можно пользоваться и макроскопическими параметрами — давлением, абсолютной температурой и объемом.
Под давлением газа понимают среднюю силу ударов его молекул о тело (например, о стенки сосуда), отнесенную к единице поверхности тела.
Абсолютная температура — это мера средней кинетической энергии теплового движения молекулы.
Объем газа — это внутренний объем сосуда, в котором газ находится.
Для связи между макро- и микропараметрами идеального газа пользуются основным уравнением молекулярно-кинетической теории идеального газа. Это уравнение связывает между собой макропараметр
Для связи между макропараметрами, характеризующими состояние
идеального газа, используют уравнение состояния.
Если масса газа и его химический состав не изменяется и нужно сравнить два состояния газа, то используют уравнение Клапейрона.
А для любой произвольной массы газа используют уравнение Менделеева — Клапейрона, которое связывает между собой параметры одного состояния газа.
Из уравнения состояния вытекают два важных следствия — это закон Авогадро, и закон Дальтона. Оба этих закона были открыты экспериментально.
Закон Авогадро гласит о том, что при равных давлениях и температурах в одинаковых объемах любых газов содержится одинаковое число молекул.
Закон Дальтона, что давление смеси газов равно сумме парциальных давлений каждого из газов в отдельности.
Процессы, при которых один из параметров «давление»,
«температура» или «объем» остается постоянным, называют изопроцессами.
Стоит отметить, что законы, описывающие изопроцессы в идеальном газе, были
открыты задолго до создания молекулярно-кинетической теории идеального газа.
Изотермический процесс – это процесс изменения состояния газа при постоянной температуре.
Графики зависимости между параметрами данной массы газа при постоянной температуре называются изотермами.
Для изотермического процесса справедлив закон Бойля — Мариотта: при постоянной температуре, неизменной массе и неизменном химическом составе газа произведение давление на объем есть величина постоянная.
Процесс изменения состояния газа при постоянном объеме называется изохорным процессом.
Графики зависимости между параметрами газа при постоянной массе газа и постоянном объеме называют изохорами.
Для изохорного процесса справедлив закон Шарля: давление данной массы газы при постоянном объеме и неизменном химическом составе прямо пропорционально абсолютной температуре.
Если изменение состояния газа происходит при постоянном
давлении, то данный процесс называют изобарным.
Графики зависимости между параметрами газа при постоянной массе газа и постоянном давлении называют
Для изобарного процесса применим закон Гей-Люссака, согласно которому, объем данной массы газы при постоянном давлении и неизменном химическом составе прямо пропорционален абсолютной температуре.
Теперь представим основные формулы в виде таблицы.
|
Формула |
Описание формулы |
|
Количество вещества, где m — масса вещества, М — молярная масса, N — число частиц вещества, NA = 6,02 ∙ 1023 |
|
|
Масса молекулы. |
|
|
Зависимость
средней арифметической скорости теплового хаотического движения молекул от
температуры, k = 1,38 ∙ 10–23 Дж/К. |
|
|
Зависимость средней квадратичной скорости теплового хаотического движения молекул от температуры, k = 1,38 ∙ 10–23 Дж/К. |
|
|
Зависимость наиболее вероятной скорости теплового хаотического движения молекул от температуры. |
|
|
Средняя кинетическая энергия поступательного движения молекулы одноатомного газа, Т — абсолютная температура. |
|
|
Основное уравнение молекулярно-кинетической теории, где p – давление газа, <v2> – средний квадрат скорости движения молекул. |
|
|
Основное уравнение молекулярно-кинетической теории, где n – концентрация молекул, <Wk> – средняя кинетическая энергия |
|
|
Основное
уравнение молекулярно-кинетической теории, Т — абсолютная температура. |
|
|
Уравнение состояния идеального газа, где V — объем газа, R = 8,31 Дж/(моль ∙ К) — универсальная газовая постоянная. |
|
|
Уравнение Клапейрона. |
|
|
Закон Дальтона. |
|
|
Закон Бойля-Мариотта |
|
|
Закон Шарля |
|
|
Закон Гей-Люссака |
Методические указания по решению задач.
1) Выяснить, изменяется ли состояние газа.
2) Если в задаче даны два или несколько состояний газа, то
следует отдельно выписать параметры этих состояний.
3) Если это возможно, то сделать схематический рисунок.
4) выяснить, изменяется ли масса газа.
5) Если масса газа изменяется или дана в условии задачи, то для каждого состояния необходимо записать уравнение Менделеева — Клапейрона.
6) Аналогично поступаем и тогда, когда по условию задачи изменяются состояния двух и более газов, разделенных между собой перегородкой, поршнем и так далее.
7) Если масса газа не изменяется, то необходимо будет записать уравнение Клапейрона или один из трех законов для изопроцессов: Бойля — Мариотта, Шарля или Гей-Люссака.
8) Представить в развернутом виде параметры начального и конечного состояний газа.
9) При необходимости, надо записать и вспомогательные уравнения, связывающие искомые величины или параметры состояния, используя условие задачи.
10) решить полученную систему уравнений относительно
неизвестных величин в общем виде и проверить правило размерностей. Получить
результат в численном виде.
Получить
результат в численном виде.
Формула | Название формулы | Физические величины |
ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ | ||
Количество вещества | – Количество вещества (моль) n – Концентрация частиц (1/м3) – Средняя квадратичная скорость (м/с) – Относительная влажность воздуха (%) – объем сосуда (м3) масса вещества (кг) M – молярная масса (кг/моль) N – количество частиц в объеме вещества T – температура (К, Кельвин) – масса одной молекулы (кг) – энергия (Дж, Джоуль) – давление пара (Па, Паскаль) – Давление насыщенного пара – плотность насыщенного пара (кг/м3) – постоянная Больцмана (1,38·10-23Дж/К) NA – постоянная Авогадро (6·1023моль-1) R – универсальная газовая постоянная (8,31Дж/(моль·К)) | |
Концентрация частиц | ||
Средняя квадратичная скорость | ||
Давление идеального газа | ||
Давление | ||
Относительная влажность воздуха | ||
Средняя кинетическая энергия поступательного движения частиц | ||
Закон Гей-Люссака | ||
0C | Связь температуры по Кельвину и температуры по Цельсию | |
Уравнение Менделеева-Клапейрона | ||
Плотность вещества | ||
Закон Бойля-Мариотта Т2 › T1 | m, T = const, изотермический процесс | |
Закон Шарля | m, V = const, изохорный процесс | |
Закон Гей-Люссака | m, p = const, изобарный процесс | |
ОСНОВЫ ТЕРМОДИНАМИКИ | ||
Первый закон термодинамики | Q – Количество теплоты (Дж, Джоуль) U – Внутренняя энергия (Дж, Джоуль) A – Работа (Дж, Джоуль) L – удельная теплота парообразования (Дж/кг) q – удельная теплота сгорания (Дж/кг) λ – удельная теплота плавления(Дж/кг) c – удельная теплоемкость вещества (Дж/кг·К) – температура нагревателя (К, Кельвин) – температура холодильника (К, Кельвин) – теплота, отданная одними частями системы (Дж, Джоуль) – теплота, полученная другими частными системы (Дж, Джоуль) | |
Q = qm | Теплота сгорания | |
Q = ±λm | Теплота плавления – « знак +», отвердевания (кристаллизации) -«знак -» | |
Q = ±Lm | Теплота парообразования «знак +», конденсации «знак -» | |
Q = cm∆T | Количество теплоты («знак +» – нагревание вещества, «знак -» – охлаждение вещества) | |
Внутренняя энергия («знак +» – увеличивается, «знак -» – уменьшается) | ||
Работа («знак +» – объем уменьшается или над газом совершается работа, «знак -» – объем увеличивается или над газом совершается работа) | ||
КПД теплового двигателя | ||
Уравнение теплового баланса | ||
Репетитор по математике и физике в Отрадном 8(915)389-73-44 представляет материалы для изучающих математику и для подготовки к ЕГЭ
Современные учебники физики написаны, на мой взгляд, хорошо. С любовью к предмету, с желанием передать эту любовь читателю. Но есть одна проблема.
С любовью к предмету, с желанием передать эту любовь читателю. Но есть одна проблема.
Они написаны в предположении, что у читателя-школьника бесконечно много времени на освоение материала. Это- на самом деле, большая проблема, которая способна свести на нет все усилия авторов учебников и учителей.
Я знаю*, как максимально эффективно запоминать формулы, вообще, и формулы МКТ, в частности. Я хочу поделиться этим с вами.
1 Основные положения МКТ
Эти положения содержатся, по сути, в самом названии – М = все тела состоят из молекул, К = кинетический, то есть связанный с движением = молекулы находятся в постоянном хаотическом движении. В процессе этого движения молекулы сталкиваются, как шарики, то есть, упруго взаимодействуют.
2 Первая формула, которую удобнее всего запоминать:
$$p=nkT$$
Эту формулу знают все, даже самые слабые школьники. Причина очевидна = ее правая часть созвучна с названием раздела – МКТ.
Остается запомнить смысл входящих в формулу величин. Давление газа $p$ равно произведению концентрации молекул $n= \frac N V$, то есть отношения общего количества молекул к объему, в котором находится газ, постоянной Больцмана $k$ и абсолютной температуры $T$.
Давление газа $p$ равно произведению концентрации молекул $n= \frac N V$, то есть отношения общего количества молекул к объему, в котором находится газ, постоянной Больцмана $k$ и абсолютной температуры $T$.
2 Самая сложная формула, которую надо запоминать, выглядит так:
$$E= \frac 1 2 k T \ \ \ на \ степень \ свободы \ молекулы \ идеального \ газа$$
Число степеней свободы одноатомной молекулы равно трем, а двухатомной – пяти. Поэтому средняя кинетическая энергия молекулы одноатомного газа есть
$$E= \frac 3 2 k T $$
а для двухатомного газа
$$E= \frac 5 2 k T $$
Понять числа 3 и 5 легко: для задания положения материальной точки в нашем трехмерном мире нужно три числа (три координаты, например, $x$, $y$ и $z$). Двухатомную молекулу без внутренних степеней свободы можно представить себе, как жесткую гантельку – два шарика, соединенных жестким стержнем. Для фиксации положения одного шарика нужно три числа, а для фиксации положения второго – уже только два, потому что расстояние от первого, уже зафиксированного, шарика, остается неизменным. 2} {2}$$
2} {2}$$
В данном случае это – средняя кинетическая энергия одной молекулы газа, причем $m_0$ есть масса молекулы, а $ v$ – средняя скорость.
Все остальные уравнения, в том числе, основное уравнение молекулярно-кинетической теории, легко и быстро выводятся из этих трех.
Снова хочу подчеркнуть, что то, что приведено выше – это самый простой, на мой взгляд, способ запомнить все нужные формулы. Это не есть новый способ изложения МКТ – всего лишь определенный способ запомнить формулы МКТ. Здесь самое главное – минимальный набор формул, из которых, по сути, запоминать нужно только вторую, вместе с рассуждением о степенях свободы.
*знаю, как максимально эффективно запоминать формулы – это эпатажная и неточная формулировка, которой я с сожалением отдаю дань нашему эпатажному времени, когда положено кричать “я – лучший”, и, чем громче, тем лучше. Более правильно было бы написать что-то вроде “Я хочу предложить вам осознанный способ запомнинания, кторый прекрасно работает у меня и у многих, кто им воспользовался”
Основное уравнение МКТ (молекулярно-кинетической теории).
 Давление идеального газа | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Давление идеального газа | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, краткоСогласно модели идеального газа молекулы все время находятся в беспорядочном движении, сталкиваются между собой и со стенками сосуда, в котором пребывают. В момент столкновения молекулы со стенкой она действует на нее с силой, импульс которой, согласно второму закону Ньютона, равняется изменению ее импульса (количества движения): F̅t = Δ(m͞v). Это значит, что изменение модуля импульса всех молекул ΣΔ(mvi) при ударе равнозначно действию усредненного значения силы F̅ в течение времени t. Это суммарное действие молекул вызывает давление газа, которое по определению равно p = F / S.
Давление газа вызывают удары о стенку сосуда большого количества молекул, передающих ему импульс.
Рассмотрим идеальный газ, который находится в сосуде объемом V. Для простоты расчетов выберем его в форме параллелепипеда (рис. 1.15). Пусть в нем находится N молекул массой m0 каждая; их концентрация равна n = N / V. Поскольку молекулы движутся беспорядочно (условие динамического хаоса для идеального газа), то достаточно определить давление на одну из стенок, поскольку на другие стенки молекулы будут создавать такое же давление. Для простоты изложения сначала будем считать, что все они имеют одинаковые скорости V.
Для простоты расчетов выберем его в форме параллелепипеда (рис. 1.15). Пусть в нем находится N молекул массой m0 каждая; их концентрация равна n = N / V. Поскольку молекулы движутся беспорядочно (условие динамического хаоса для идеального газа), то достаточно определить давление на одну из стенок, поскольку на другие стенки молекулы будут создавать такое же давление. Для простоты изложения сначала будем считать, что все они имеют одинаковые скорости V.
Представим отдельный слой газа, перпендикулярный координатной плоскости ZY. В силу хаотичности движения количество молекул, влетающих в этот слой справа, равняется количеству молекул, вылетающих из него слева. Очевидно, что и те и другие передают данному слою импульс: влетающие слева (рис. 1.16) несут импульс m0vx, где vx — проекция скорости на ось Х; вылетающие из него выносят импульс —m0vx, в целом передавая ему импульс 2m0vx. Итак, со стороны всех молекул Z, влетающих в отдельный слой, стенка получает импульс 2Zm0vx.
Итак, со стороны всех молекул Z, влетающих в отдельный слой, стенка получает импульс 2Zm0vx.
| Рис. 1.15. Передача молекул газа импульса стенке сосуда |
| Рис. 1.16. Упругий удар молекулы в стенку |
Количество молекул Z, которые сталкиваются со стенкой площадью S за время t, можно определить по их концентрации в объеме отдельного слоя: Z = nvxtS, где n — концентрация молекул. Поскольку к стенке долетают лишь те молекулы, которые имеют положительную проекцию скорости на ось X (vx > 0), то их количество будет составлять половину от числа молекул, пересекающих плоскость отдельного слоя газа:
Z = nvxtS / 2.
Итак, со стороны всех молекул, находящихся в отдельном слое, стенка получает общий импульс:
Fxt = 2 • nvxtSm0vx / 2.
Разделив левую и правую части равенства на St, получим:
Fx / S = p = nm0v2x.
Предположения, что скорости всех молекул одинаковы, было сделано с целью упрощения вывода уравнений. На самом же деле диапазон их значений довольно широк — от 0 до определенного максимального значения vmax. Поэтому в предыдущем уравнении для определения давления газа правильнее будет брать средний квадрат проекции скорости vx. Тогда оно будет иметь вид:
p = nm0v̅2х.
Понятно, что аналогичные соображения будут справедливы для стенок, лежащих в других координатных плоскостях:
p = nm0v̅2y,
p = nm0v̅2z.
Средний квадрат скорости имеет смысл среднестатистического значения скорости. Материал с сайта http://worldofschool.ru
Очевидно, что вследствие хаотического движения молекул v̅2x = v̅2y = v̅2z. По математическому определению средний квадрат скорости равен v̅2 = (v̅2x + v̅2y + v̅2z). Отсюда v̅2x = (1 / 3) • v̅2. Подставив это выражение в уравнение p = nm0v̅2х, получим окончательное уравнение для определения давления идеального газа:
p = (1 / 3) • nm0v̅2.
Эта формула является основным уравнением молекулярно-кинетической теории (МКТ) идеального газа, которое определяет связь между макропараметром термодинамической системы — давлением идеального газа и характеристиками его микроскопического состояния. Таким образом, оно определяет давление газа как статистическую величину посредством микропараметров системы — концентрации, массы и скорости молекулы.
Таким образом, оно определяет давление газа как статистическую величину посредством микропараметров системы — концентрации, массы и скорости молекулы.
Поскольку nm0 = ρ, где ρ — плотность газа, основное уравнение молекулярно-кинетической теории идеального газа будет иметь еще и такой вид:
p = (1 / 3) • ρv̅2.
Основное уравнение MKT является мостиком между двумя подходами в толковании тепловых явлений и процессов — термодинамическим и молекулярно-кинетическим.
На этой странице материал по темам:Как изменяется импульс слоя газа за счет молекул вылетающих в него
Решебник физики мкт
Доклал оснлвное ураанение молекулярно кинетической теории газоы кратко
Идеальный газ лекция основное уравнение мкт
Чем объясняется давление газа в МКТ?
Как изменяется импульс слоя газа за счет молекул, влетающих в него?
От чего зависит количество молекул в отдельном слое?
Какой смысл имеет средний квадрат скорости?
Почему мы используем понятие среднего квадрата скорости?
Почему уравнение давления идеального газа называют основным уравнением МКТ?
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ | Энциклопедия Кругосвет
Содержание статьиМОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ – раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами), из которых состоит вещество. Считается, что частицы вещества находятся в непрерывном, беспорядочном движении и это их движение воспринимается как тепло.
Считается, что частицы вещества находятся в непрерывном, беспорядочном движении и это их движение воспринимается как тепло.
До 19 в. весьма популярной основой учения о тепле была теория теплорода или некоторой жидкой субстанции, перетекающей от одного тела к другому. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Понятие об атомах долго казалось ненужным для теории тепла, однако многие ученые уже тогда интуитивно связывали тепло с движением молекул. Так, в частности, думал русский ученый М.В.Ломоносов. Прошло немало времени, прежде чем молекулярно-кинетическая теория окончательно победила в сознании ученых и стала неотъемлемым достоянием физики.
Многие явления в газах, жидкостях и твердых телах находят в рамках молекулярно-кинетической теории простое и убедительное объяснение. Так давление, оказываемое газом на стенки сосуда, в котором он заключен, рассматривается как суммарный результат многочисленных соударений быстро движущихся молекул со стенкой, в результате которых они передают стенке свой импульс. (Напомним, что именно изменение импульса в единицу времени приводит по законам механики к появлению силы, а сила, отнесенная к единице поверхности стенки, и есть давление). Кинетическая энергия движения частиц, усредненная по их огромному числу, определяет то, что принято называть температурой вещества.
(Напомним, что именно изменение импульса в единицу времени приводит по законам механики к появлению силы, а сила, отнесенная к единице поверхности стенки, и есть давление). Кинетическая энергия движения частиц, усредненная по их огромному числу, определяет то, что принято называть температурой вещества.
Истоки атомистической идеи, т.е. представления о том, что все тела в природе состоят из мельчайших неделимых частиц-атомов, восходят еще к древнегреческим философам – Левкиппу и Демокриту. Более двух тысяч лет назад Демокрит писал: «…атомы бесчисленны по величине и по множеству, носятся же они во вселенной, кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля». Решающий вклад в развитие молекулярно-кинетической теории был внесен во второй половине 19 в. трудами замечательных ученых Дж.К.Максвелла и Л.Больцмана, которые заложили основы статистического (вероятностного) описания свойств веществ (главным образом, газов), состоящих из огромного числа хаотически движущихся молекул. Статистический подход был обобщен (по отношению к любым состояниям вещества) в начале 20 в. в трудах американского ученого Дж.Гиббса, который считается одним из основоположников статистической механики или статистической физики. Наконец, в первые десятилетия 20 в. физики поняли, что поведение атомов и молекул подчиняется законам не классической, а квантовой механики. Это дало мощный импульс развитию статистической физики и позволило описать целый ряд физических явлений, которые ранее не поддавались объяснению в рамках обычных представлений классической механики.
Статистический подход был обобщен (по отношению к любым состояниям вещества) в начале 20 в. в трудах американского ученого Дж.Гиббса, который считается одним из основоположников статистической механики или статистической физики. Наконец, в первые десятилетия 20 в. физики поняли, что поведение атомов и молекул подчиняется законам не классической, а квантовой механики. Это дало мощный импульс развитию статистической физики и позволило описать целый ряд физических явлений, которые ранее не поддавались объяснению в рамках обычных представлений классической механики.
Молекулярно-кинетическая теория газов.
Газовое состояние (см. ГАЗ) – одно из тех состояний вещества, описание которого на основе методов молекулярно-кинетической теории уже с самого начала ее развития дало наиболее полные и ощутимые результаты. В первую очередь это относится к так называемому идеальному газу, молекулы которого большую часть времени проводят в состоянии свободного хаотического движения, резко меняя свою скорость лишь в моменты кратковременных столкновений.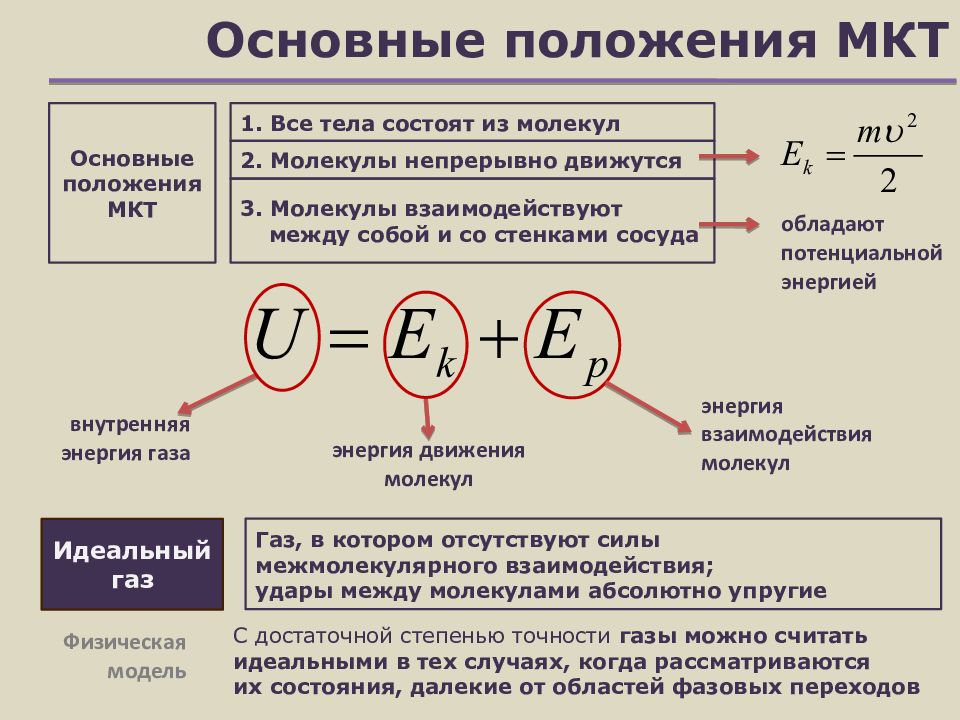 Молекулярно-кинетическая теория успешно объясняет все известные экспериментальные законы идеального газа (закон Бойля – Мариотта, закон Гей-Люссака, закон Авогадро и формулируемое на их основе уравнение состояния Менделеева – Клапейрона). На базе этой теории получили свое полное объяснение процессы переноса в газах: диффузия, вязкость и теплопроводность.
Молекулярно-кинетическая теория успешно объясняет все известные экспериментальные законы идеального газа (закон Бойля – Мариотта, закон Гей-Люссака, закон Авогадро и формулируемое на их основе уравнение состояния Менделеева – Клапейрона). На базе этой теории получили свое полное объяснение процессы переноса в газах: диффузия, вязкость и теплопроводность.
Давление газа.
В качестве одного из примеров применения молекулярно-кинетической теории можно рассмотреть вывод выражения для давления газа. Сначала определяется среднее число столкновений молекул, происходящих за единицу времени с поверхностью стенки сосуда. В газе выделяются три взаимно перпендикулярных оси, соответствующие декартовой системе координат. Если в сосуде содержится N молекул, то из-за огромного их числа логично предположить, что в любой момент времени вдоль каждого из направлений будут двигаться примерно N/3 молекул. Очевидно, что в направлении самой стенки сосуда перпендикулярно к ней будет в среднем двигаться 1/6 часть всех молекул.
Пусть есть плоский элемент поверхности на стенке сосуда DS. Предполагается, для простоты, что все молекулы движутся с одинаковой скоростью v. Тогда за время Dt до элемента стенки DS долетят все движущиеся по направлению к нему молекулы, которые заключены в объеме цилиндра с основанием DS и высотой v Dt (рис. 1).
Если n = N/V – число молекул в единице объема, то число молекул, долетевших до стенки и ударившихся об нее, равно Dv = (n/6)vDSDt. Соответственно, число ударов молекул об единичную площадку в единицу времени оказывается равным
(1)
Каждая молекула, летящая к стенке, при столкновении с ней передает стенке свой импульс. Поскольку скорость молекулы при упругом столкновении со стенкой меняется от величины v до –v, величина передаваемого импульса равна 2mv. Сила, действующая на поверхность стенки DS за время Dt, определяется величиной полного импульса, передаваемого всеми молекулами достигнувшим стенки за этот промежуток времени, т. е. F = 2mv nc DS/Dt, где nc определено выражением (1). Для величины давления p = F/DS в этом случае находим: p = (1/3)nmv2.
е. F = 2mv nc DS/Dt, где nc определено выражением (1). Для величины давления p = F/DS в этом случае находим: p = (1/3)nmv2.
Для получения окончательного результата можно отказаться от предположения об одинаковой скорости молекул, выделив независимые группы молекул, каждая из которых имеет свою приблизительно одинаковую скорость. Тогда средняя величина давления находится усреднением квадрата скорости по всем группам молекул или
(2)
Это выражение можно представить также в виде
(3)
где – средняя кинетическая энергия молекул газа (в расчете на одну молекулу).
Тепловое равновесие, понятие температуры. Известно, что тепло всегда перетекает от горячего тела к холодному, т.е. температура соприкасающихся тел стремится выравняться. Это явление характеризуют как переход системы в состояние теплового равновесия. Понятие температуры является не столь очевидным, как многие привычные понятия механики: масса, сила, энергия и т. д. Температура связана с весьма неопределенным понятием теплоты и холода, которые располагаются в сознании человека где-то рядом с запахом и вкусом. Одно из главных достижений молекулярно-кинетической теории состоит в том, что теплота рассматривается просто как одна из форм энергии, а именно – кинетическая энергия атомов и молекул. Эта величина, усредненная по огромному числу беспорядочно движущихся частиц, и оказывается мерилом того, что называется температурой тела. Такое представление распространяется на все вещества – твердые, жидкие и газообразные. Частицы нагретого тела движутся быстрее, чем холодного. Если два тела, имеющие первоначально разные температуры, входят в соприкосновение друг с другом, движение частиц в одном из них замедляется, в другом наоборот ускоряется: средняя кинетическая энергия частиц становится везде одинаковой. Это и означает, что система в целом приходит в состояние полного теплового равновесия.
д. Температура связана с весьма неопределенным понятием теплоты и холода, которые располагаются в сознании человека где-то рядом с запахом и вкусом. Одно из главных достижений молекулярно-кинетической теории состоит в том, что теплота рассматривается просто как одна из форм энергии, а именно – кинетическая энергия атомов и молекул. Эта величина, усредненная по огромному числу беспорядочно движущихся частиц, и оказывается мерилом того, что называется температурой тела. Такое представление распространяется на все вещества – твердые, жидкие и газообразные. Частицы нагретого тела движутся быстрее, чем холодного. Если два тела, имеющие первоначально разные температуры, входят в соприкосновение друг с другом, движение частиц в одном из них замедляется, в другом наоборот ускоряется: средняя кинетическая энергия частиц становится везде одинаковой. Это и означает, что система в целом приходит в состояние полного теплового равновесия.
Поскольку понятие температуры тесно связано с усредненной кинетической энергией молекул, было бы естественным и в качестве единиц ее измерения использовать энергетические единицы (например, эрг или джоуль). Однако, энергия теплового движения частиц фактически очень мала по сравнению с эргом (не говоря уже о джоуле), поэтому использование этой величины оказывается неудобным. В молекулярной физике пользуются практически удобной условной единицей измерения температуры – градусом, который определяется таким образом, что интервал температур между точками кипения и замерзания воды при атмосферном давлении полагается равным 100 градусам.
Однако, энергия теплового движения частиц фактически очень мала по сравнению с эргом (не говоря уже о джоуле), поэтому использование этой величины оказывается неудобным. В молекулярной физике пользуются практически удобной условной единицей измерения температуры – градусом, который определяется таким образом, что интервал температур между точками кипения и замерзания воды при атмосферном давлении полагается равным 100 градусам.
Если температура T измеряется в градусах Кельвина (К), то связь ее со средней кинетической энергией молекул имеет вид
(4) Ek = (3/2)kT,
где k = 1,38·10–16 эрг/K – переводный коэффициент, определяющий, какая часть эрга содержится в градусе. Величина k называется постоянной Больцмана (она была введена Планком в 1899).
Уравнение состояния. Газовые законы.
Подстановка соотношений (4) в (3), приводит к известному уравнению состояния идеального газа
(5) p = nkT
Из соотношений (2) и (5) следует также выражение для средне-квадратичной скорости молекул
,
Этой формуле удобно придать другой вид, умножив числитель и знаменатель под знаком квадратного корня на число Авогадро
Na = 6,023·1023.
Тогда
(7)
Здесь M = mNA – атомная или молекулярная масса, величина R = kNA = 8,318·107 эрг называется газовой постоянной.
Средняя скорость молекул в газе даже при умеренных температурах оказывается очень большой. Так, для молекул водорода (H2) при комнатной температуре (T = 293K) эта скорость равна около 1900 м/c , для молекул азота в воздухе – порядка 500 м/с. Скорость звука в воздухе при тех же условиях равна 340 м/с.
Учитывая, что n = N/V, где V – объем, занимаемый газом, N – полное число молекул в этом объеме, легко получить следствия из (5) в виде известных газовых законов. Для этого полное число молекул представляется в виде N = vNA, где v – число молей газа, и уравнение (5) принимает вид
(8) pV = vRT,
которое носит название уравнения Клапейрона – Менделеева.
При условии T = const давление газа меняется обратно пропорционально занимаемому им объему (закон Бойля – Мариотта).
В замкнутом сосуде фиксированного объема V = const давление меняется прямо пропорционально изменению абсолютной температуры газа Т. Если газ находится в условиях, когда постоянным сохраняется его давление p = const, но изменяется температура (такие условия можно осуществить, например, если поместить газ в цилиндр, закрытый подвижным поршнем), то объем, занимаемый газом, будет меняться пропорционально изменению его температуры (закон Гей-Люссака).
Пусть в сосуде есть смесь газов, т.е. имеются несколько разных сортов молекул. В этом случае величина импульса, передаваемого стенке молекулами каждого сорта, не зависит от наличия молекул других сортов. Отсюда следует, что давление смеси идеальных газов равно сумме парциальных давлений, которые создавал бы каждый газ в отдельности, если бы занимал весь объем. В этом состоит еще один из газовых законов – известный закон Дальтона.
Длина свободного пробега молекул. Одним из первых, кто еще в 1850-х дал разумные оценки величины средней тепловой скорости молекул различных газов, был австрийский физик Клаузиус. Полученные им непривычно большие значения этих скоростей сразу же вызвали возражения. Если скорости молекул действительно так велики, то запах любого пахучего вещества должен был бы практически мгновенно распространяться из одного конца замкнутого помещения в другой. На самом деле распространение запаха происходит очень медленно и осуществляется, как теперь известно, посредством процесса так называемой диффузии в газе. Клаузиус, а затем и другие исследователи, сумели дать убедительное объяснение этому и другим процессам переноса в газе (таким как теплопроводность и вязкость) с помощью понятия средней длины свободного пробега молекул, т.е. среднего расстояния, которое пролетает молекула от одного столкновения до другого.
Полученные им непривычно большие значения этих скоростей сразу же вызвали возражения. Если скорости молекул действительно так велики, то запах любого пахучего вещества должен был бы практически мгновенно распространяться из одного конца замкнутого помещения в другой. На самом деле распространение запаха происходит очень медленно и осуществляется, как теперь известно, посредством процесса так называемой диффузии в газе. Клаузиус, а затем и другие исследователи, сумели дать убедительное объяснение этому и другим процессам переноса в газе (таким как теплопроводность и вязкость) с помощью понятия средней длины свободного пробега молекул, т.е. среднего расстояния, которое пролетает молекула от одного столкновения до другого.
Каждая молекула в газе испытывает очень большое число столкновений с другими молекулами. В промежутке между столкновениями молекулы движутся практически прямолинейно, испытывая резкие изменения скорости лишь в момент самого столкновения. Естественно, что длины прямолинейных участков на пути молекулы могут быть различными, поэтому имеет смысл говорить лишь о некоторой средней длине свободного пробега молекул.
За время Dt молекула проходит сложный зигзагообразный путь, равный vDt. Изломов траектории на этом пути столько, сколько произошло столкновений. Пусть Z означает число столкновений, которое испытывает молекула в единицу времени Средняя длина свободного пробега равна тогда отношению длины пути к полному числу столкновений ZDt, испытанных молекулой на этом пути,
(9)
Для оценки величины Z принимается, что молекулы представляют собой твердые упругие шарики радиуса a, которые равномерно распределены в объеме газа с плотностью n. Сначала предполагается, что молекула движется в среде, где все остальные молекулы неподвижны. Можно видеть, что молекула пролетает мимо другой молекулы, не испытав столкновения с ней, если расстояние между центрами молекул превышает 2a. Следовательно, за время t, равное 1c, молекула взаимодействует только с теми партнерами по столкновению, центры которых расположены в объеме цилиндра длиной и с площадью основания s = 4pa2 (рис. 2). На самом деле, после каждого столкновения направление движения молекулы меняется, и нужно рассматривать ее движение в цилиндре, составленном как бы из отдельных колен, однако смысл рассуждений не меняется, если считать этот коленчатый цилиндр выпрямленным.
2). На самом деле, после каждого столкновения направление движения молекулы меняется, и нужно рассматривать ее движение в цилиндре, составленном как бы из отдельных колен, однако смысл рассуждений не меняется, если считать этот коленчатый цилиндр выпрямленным.
Величину s называют эффективным поперечным сечением столкновений молекул. Число молекул в объеме цилиндра равно ns. Таким же будет число столкновений, т.е. Z = ns. Используя (9), находим
l = 1/ns
На самом деле, конечно, в газе одновременно находятся в движении все молекулы, поэтому в выражение для Z должна входить средняя скорость относительного движения молекул, так что Z = nотн.s. Более точный расчет, проведенный впервые Максвеллом, показывает, что . В результате получается известная в элементарной кинетической теории формула
(10)
Характерный радиус молекул для различных газов можно оценить из экспериментальных данных по вязкости (внутреннему трению) в газе. Для молекул N2, например, a » 2,0·10–10 м. В таблице 1 приведены рассчитанные по формуле (10) значения l0 в мкм (1мкм = 10–6м) для некоторых газов при нормальных условиях (p = 1атм, T=273K). Эти значения оказываются примерно в 100–300 раз больше собственного диаметра молекул.
Для молекул N2, например, a » 2,0·10–10 м. В таблице 1 приведены рассчитанные по формуле (10) значения l0 в мкм (1мкм = 10–6м) для некоторых газов при нормальных условиях (p = 1атм, T=273K). Эти значения оказываются примерно в 100–300 раз больше собственного диаметра молекул.
Основное уравнение МКТ газов. Температура
Модель идеального газа считается самой простейшей относительно основных положений МКТ. Кинетическая модель идеального газа молекул говорит о том, что при взаимодействии между собой, шарики рассматриваются в качестве идеально упругих. Суммарный объем всех молекул достаточно мал по сравнению с объемом сосуда, в котором находится данный газ. Модель необходима для описания его поведения при различных давлениях и температурах.
Определение 1Цель молекулярно-кинетической теории – установка связи между макроскопическими и макроскопическими параметрами.
После соударения молекул между собой и стенками сосуда происходит изменение направления движения и времени между интервалами столкновений. Модель идеального газа основывается на законах механики Ньютона, то тесть столкновения соответствуют закону упругого удара.
Чтобы определить давление газа на стенку сосуда, учитывается модель идеального газа. Исходя из этого, происходит возникновение сил, которые подчиняются 3 закону Ньютона. Отсюда получим, что проекция скорости υxперпендикулярна относительно стенки, а знак меняется на противоположный. Проекция υy параллельна и постоянна. Это показано на рисунке 3.2.1.
Рисунок 3.2.1. Упругое столкновение молекулы со стенкой.
Отсюда следует, что изменение импульса можно записать в виде 2m0υx с массой молекулы, равной m0. Необходимо выделить площадь S, как показано на рисунке 3.2.2. По прошествии времени Δt с S поверхностью столкнутся молекулы с проекциями скорости υx, которая направлена в сторону стены, и основанием цилиндра S с высотой υxΔt.
Рисунок 3.2.2. Определение числа столкновений молекул с поверхностью S.
Если за единицу объема брать сосуд с n-ым количеством молекул, тогда их число в объеме цилиндра нужно обозначить, как nSυxΔt. Очевидно, что происходит столкновение только половины имеющихся молекул. Тогда количество ударов о S за время Δt равняется 12nSvx∆t.
При столкновении происходит изменение импульса 2m0υx. Тогда формула nm0vx2S∆t говорит о полном его изменении за определенный промежуток времени. Исходя из закона механики, изменение импульса всех молекул записывается как FΔt. Силой F обозначается средняя сила, которая действует на молекулы. Но 3 закон Ньютона говорит о том, что аналогичная сила по модулю оказывает действие на поверхность S. Данное утверждение можно зафиксировать F∆t=nm0vx2S∆t.
Далее для упрощения следует разделить равенство на выражение SΔt. Формула примет вид p=FS=nm0vx2 со значением р, обозначаемым в качестве давления газа на стенку сосуда.
Все молекулы, находящиеся в сосуде на единицу объема, имеют разные проекции скоростей на ось Ох. При столкновениях прослеживалось статистическое их распределение по скоростям, причем с разными направлениями векторов их скоростей.
Определение 2Распределением Максвелла называют распределение молекул газа по модулю скоростей.
Еще в 1860 г Дж. Максвелл вывел закон распределения молекул газа по скоростям, основываясь на основных положениях молекулярно-кинетической теории молекулы. Рисунок 3.2.3. наглядно показывает распределения молекул по скоростям с помощью кривых. На оси Ох располагается модуль скорости, а на Оу – количество молекул, находящихся на интервале от υ до υ+Δυ. На рисунке 3.2.3. данное значение выделено в виде столбика.
Рисунок 3.2.3.Распределение молекул по скоростям. T2>T1.
Определение 3Характерные параметры распределения Максвелла – это вероятная скорость υв,которая соответствует кривой распределения, и среднеквадратичная скорость υкв=υ2→, где υ2→обозначающие среднее значение квадрата скорости.
Если растет температура, тогда максимум кривой будет смещен в сторону больших скоростей, то есть υв и υквувеличатся.
Распределение Максвелла
Для записи формулы давления газа необходимо предположить, что все молекулы разделены на n1, n2, n3группы с проекциями υx1, υx2, υx3. Иначе говоря, записываем ∑ini=n. Можно зафиксировать, как nim0vxi2. Тогда суммарное давление примет вид p=m0∑inivxi2.
Данная сумма является суммой квадратов проекций υx всех n молекул на единичном объеме газа. При делении выражения на n получим среднее значение квадратичной скорости проекции υx. Запишем в виде 1n∑niυxi2=vx2→i.
Другая интерпретация формулы давления газа p=nm0vx2→. Все направления векторов различные, потому среднее значение квадратов проекций на координатные оси равняется vx2→=vy2→=vz2→=13v2→.
Формула для среднего давления газа на стенку сосуда обозначим, как p=p→=13nm0v2→=23nm0v2→2=23nEk→.
Определение 4Из уравнения видна связь между р и m0и количеством молекул n, средней квадратичной скоростью v2→ и средней кинетической энергией Ek→ молекул. Такое уравнение получило название уравнения молекулярно-кинетической уравнения теории газов.
Такое уравнение получило название уравнения молекулярно-кинетической уравнения теории газов.
Отсюда следует, что давление газа – это две трети средней кинетической энергии, которое имеется в единице объема. Основное уравнение молекулярно-кинетической теории газов или строения вещества содержит произведение количества молекул n на Ek→. Предположительно сосуд имеет газ неизменного объема V, тогда n=NV=const (N – число молекул в сосуде). Изменение давления происходит пропорционально изменению кинетической энергии.
Физика. Температура
Определение 5Температура связана с понятием теплового равновесия. При контакте тела обмениваются энергией, которая передается и получает название количества теплоты.
Тепловым равновесием называют состояние системы тел, которые находятся в тепловом контакте с теплопередачей и с постоянными макроскопическими параметрами.
Температура – физический параметр, который находится в тепловом равновесии. Введение понятия температуры идет из нулевого закона термодинамики.
Введение понятия температуры идет из нулевого закона термодинамики.
Нужна помощь преподавателя?
Опиши задание — и наши эксперты тебе помогут!
Описать заданиеТемпература измеряется с помощью термометра. Для его создания выбирается термометрическое вещество и величину, которая его характеризует. Разные конструкции подразумевают отличия в их свойствах.
Каждый термометр должен быть откалиброван. Использование природных систем с неизменной температурой необходимо для хорошего теплообмена. Температура плавления льда равняется 0 градусов Цельсия, а точка кипения воды – 100 градусов. Одно маленькое деление из шкалы равняется 1 градусу. Существует обозначение замерзания воды по Фаренгейту, то есть 32 °F. Получаем, что формула примет вид TF=95TC+32 или TC=59(TF-32).
На рисунке 3.2.4. изображен газовый термометр, который чаще всего заполняют разряженным гелием, воздухом с неизменным объемом, обозначаемым V = const, и давлением р. Из опыта видно, что возрастание давления идет с повышением температуры по Цельсию.
Из опыта видно, что возрастание давления идет с повышением температуры по Цельсию.
Рисунок 3.2.4. Газовый термометр с постоянным объемом.
Температура кипения газов при давлении
Чтобы произвести калибровку газового термометра, следует выполнить измерение состояния молекул при 0 и 100 градусах. Для этого мы наносим точки p0 и p100на график, после чего проводим прямую линию, как изображено на рисунке 3.2.5. Получившийся калибровочный график способен определить температуру с разными значениями давления. При низких температурах возможно нахождение ее «гипотетической». Из опыта видно, что на свойства газа не влияет температура в-273,15 °С. При понижении температур газ переходит в жидкое или твердое состояние, поэтому получение охлажденного газа невозможно.
Рисунок 3.2.5.Зависимость давления газа от температуры при V = const.
В 1848 году У. Кельвин предлагает использовать точку нулевого давления газа для составления шкалы. Отличие от измерений температуры в Цельсиях в том, что нулевая точка сдвинута на TК =TС+273,15.
Отличие от измерений температуры в Цельсиях в том, что нулевая точка сдвинута на TК =TС+273,15.
По системе СИ температура измеряется по Кельвину и обозначается К. Тогда комнатная температура запишется TС=20 °С, а по Кельвину – TК=293,15 К.
Температура кипения газов. Шкала Кельвина
Определение 6Температурная шкала Кельвина считается абсолютной. Она наиболее приемлема для обозначения физических теорий.
Шкала Кельвина может быть не привязана двумя фиксированными точками, а именно: точка плавления льда и кипения воды с нормальным атмосферным давлением.
Определение 7Нулевое давление называется абсолютным нулем температуры.
Шкала Кельвина имеет точку, в которой лед, вода и пар будут находиться в тепловом равновесии. Для калибровки других термометров применяют газовые, так как для практики они не подходят в виду своих больших размеров. Отсюда следует, что давление разреженного газа в сосуде постоянного объема V изменяется прямо пропорционально его абсолютной температуре, то есть p~T.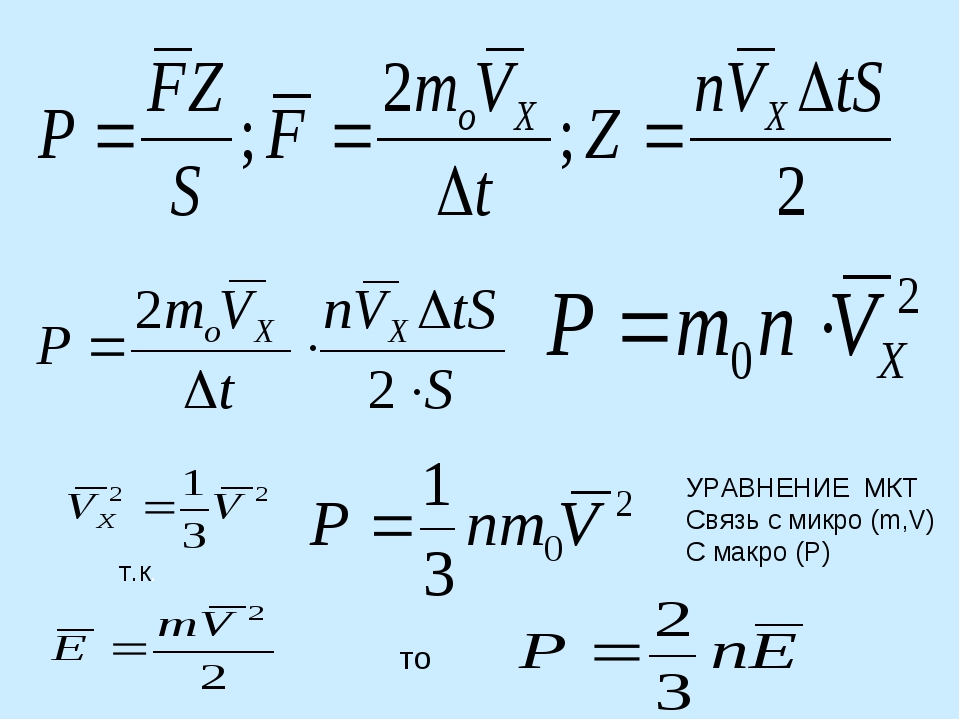 Из опыта видно, что неизменный объем V и температура давления T прямо пропорциональны количеству вещества в сосуде к его объему: p~υV=NNAV=nNA~n, где N принимает обозначение числа молекул в сосуде, а NА – постоянная Авогадро, n=NV – концентрации молекул.
Из опыта видно, что неизменный объем V и температура давления T прямо пропорциональны количеству вещества в сосуде к его объему: p~υV=NNAV=nNA~n, где N принимает обозначение числа молекул в сосуде, а NА – постоянная Авогадро, n=NV – концентрации молекул.
После объединения соотношений получим, что запись примет вид p=nkT, где kсчитается универсальной постоянной величиной для всех газов, иначе говоря, постоянная Больцмана. Этот ученый являлся одним из создателей опытного обоснования основных положений молекулярно-кинетической теории. Ее обозначение в системе СИk=1,38ċ10–23 Дж/К.
При сравнении соотношения p=nkT с уравнением МКТ газов, получим EK→.
Определение 8Средняя кинетическая энергия беспорядочного движения молекул газа прямо пропорциональна абсолютной температуре.
Температура является мерой для кинетической энергии молекул, которая не зависит от ее величины. Броуновская частица из жидкости и газа обладает аналогичной средней кинетической энергией, как и другая отдельная молекула. Это суждение верно для разномассовых молекул, находящихся в одном сосуде. Состояние равновесия говорит о том, что на них действуют одинаковые средние кинетические энергии, которые определяются температурой смеси. Запись давления смеси газов запишется как сумма парциальных давлений каждого из них: p=p1+p2+p3+…=(n1+n2+n3+ …)kT.
Это суждение верно для разномассовых молекул, находящихся в одном сосуде. Состояние равновесия говорит о том, что на них действуют одинаковые средние кинетические энергии, которые определяются температурой смеси. Запись давления смеси газов запишется как сумма парциальных давлений каждого из них: p=p1+p2+p3+…=(n1+n2+n3+ …)kT.
Отсюда видно, что n1, n2, n3,… является концентрацией молекул газов в смеси. Выражение относят к молекулярно-кинетической теории, установленной Дальтоном: давление в смеси химически невзаимодействующих газов равняется сумме их парциальных давлений.
Примеры решения задач и упражнения к главе “Основы молекулярно-кинетической теории”
При решении большей части задач первой главы нужно уметь определить молярные массы веществ. Для этого по известным из таблицы Менделеева относительным атомным массам надо определить относительную молекулярную массу, а затем и молярную массу по формуле M = 10-3 Mr, кг/моль, где M – молярная масса; Mr – относительная молекулярная масса.
Во многих задачах требуется по известной массе тела определить количество вещества или число молекул (атомов) в нем. Для этого используются формулы: и . Массы отдельных молекул определяются по формуле: . В некоторых задачах массу вещества нужно выразить через его плотность ρ и объем V.
При решении задач удобно иметь перед глазами указанные выше и все остальные формулы § 2.
В ряде задач используется основное уравнение молекулярно-кинетической теории в форме (1.17) или (1.18).
1. Определить молярную массу воды.
Решение. Относительная атомная масса водорода равна 1,00797, а кислорода 15,9994. Химическая формула воды H2O. Следовательно, относительная молекулярная масса воды равна:
Mr = 2 · 1,00797 + 15,9994 = 18,01534 ≈ 18.
Молярная масса воды M ≈ 10-3 · 18 кг/моль ≈ 0,018 кг/моль.
2. Определить количество вещества и число молекул, содержащихся в 1 кг углекислого газа.
Решение. Так как молярная масса углекислого газа M = 0,044 кг/моль, то количество вещества . Число молекул .
Число молекул .
3. Молекулы газа, концентрация которых n = 2,7 · 1025 м-3, производят на стенки сосуда давление p = 105 Па. Какова средняя кинетическая энергия E поступательного движения молекул?
4. Плотность газа в баллоне газополной электрической лампы ρ = 0,9 кг/м3. При горении лампы давление в ней возросло с p1 = 8 · 104 Па до p2 = 1,1 · 105 Па. На сколько увеличилась при этом средняя скорость молекул газа?
Решение. Произведение массы m0 одной молекулы на концентрацию молекул (число молекул в единице объема) n равно массе молекул, заключенных в единице объема, т. е. плотности газа ρ = m0n. Следовательно, основное уравнение молекулярно-кинетической теории (1.17) можно записать в виде:
Упражнения
- Какую площадь может занять капля оливкового масла объемом 0,02 см3 при расплывании ее на поверхности воды?
- Считая диаметр атома вольфрама d ≈ 2 ∙ 10-10 м, оценить количество атомов, покрывающих поверхность острия иглы.
 Острие считать полушаром радиуса 5 ∙ 10-8 м.
Острие считать полушаром радиуса 5 ∙ 10-8 м. - Определить молярные массы водорода и гелия.
- Во сколько раз число атомов в 12 кг углерода превышает число молекул в 16 кг кислорода?
- Каково количество вещества (в молях), содержащегося в 1 г воды?
- Чему равно число молекул в 10 г кислорода?
- Молярная масса азота равна 0,028 кг/моль. Чему равна масса молекулы азота?
- Определить число атомов в 1 м3 меди. Молярная масса меди M = 0,0635 кг/моль; ее плотность ρ = 9000 кг/м3.
- Плотность алмаза 3500 кг/м3. Какой объем займут 1022 атомов этого вещества?
- Как изменится давление газа, если концентрация его молекул увеличится в 3 раза, а средняя скорость молекул уменьшится в 3 раза?
- Под каким давлением находится газ в сосуде, если средний квадрат скорости его молекул v2 = 106 м2/с2, концентрация молекул n = 3 ∙ 1025 м-3, масса каждой молекулы m0 = 5 ∙ 10-26 кг?
- В колбе объемом 1,2 л содержится 3 ∙ 1022 молекул гелия.
 Какова средняя кинетическая энергия каждой молекулы? Давление газа в колбе 105 Па.
Какова средняя кинетическая энергия каждой молекулы? Давление газа в колбе 105 Па. - Вычислить средний квадрат скорости движения молекул газа, если его масса m = 6 кг, объем V = 4,9 м3 и давление p = 200 кПа.
Калькулятор удельной теплоемкости
Этот калькулятор удельной теплоемкости представляет собой инструмент, который определяет теплоемкость нагретого или охлажденного образца. Удельная теплоемкость – это количество тепловой энергии, которое необходимо подать на образец весом 1 кг, чтобы повысить его температуру на 1 K . Прочтите, чтобы узнать, как правильно применить формулу теплоемкости для получения достоверного результата.
Как рассчитать удельную теплоемкость
- Определите, хотите ли вы нагреть образец (дать ему некоторую тепловую энергию) или охладить (отнять некоторую тепловую энергию).
- Укажите количество подаваемой энергии как положительное значение. Если вы хотите охладить образец, введите вычтенную энергию как отрицательное значение.
 Например, предположим, что мы хотим уменьшить тепловую энергию образца на 63 000 Дж. Тогда
Например, предположим, что мы хотим уменьшить тепловую энергию образца на 63 000 Дж. Тогда Q = -63 000 Дж. - Определите разницу температур между начальным и конечным состоянием образца и введите ее в калькулятор теплоемкости. Если образец остынет, разница будет отрицательной, а если нагретой – положительной.Допустим, мы хотим охладить образец на 3 градуса. Тогда
ΔT = -3 K. Вы также можете перейти в расширенный режим , чтобы ввести начальное и конечное значения температуры вручную. - Определите массу образца. Примем
м = 5 кг. - Рассчитайте удельную теплоемкость как
c = Q / (мΔT). В нашем примере это будет равноc = -63,000 Дж / (5 кг * -3 K) = 4200 Дж / (кг · K). Это типичная теплоемкость воды.
Если у вас возникли проблемы с единицами измерения, воспользуйтесь нашими калькуляторами преобразования температуры или веса.
Формула теплоемкости
Формула для определения теплоемкости выглядит так:
c = Q / (мΔT) Q – количество подводимого или отведенного тепла (в джоулях), м – масса образца, а ΔT – разница между начальной и конечной температурами. Теплоемкость измеряется в Дж / (кг · К).
Теплоемкость измеряется в Дж / (кг · К).
Типичные значения удельной теплоемкости
Вам не нужно использовать калькулятор теплоемкости для большинства обычных веществ.Ниже приведены значения удельной теплоемкости некоторых из самых популярных.
- лед:
2,100 Дж / (кг · К) - вода:
4,200 Дж / (кг · К) - водяной пар:
2,000 Дж / (кг · К) - базальт:
840 Дж / (кг · К) - гранит:
790 Дж / (кг · К) - алюминий:
890 Дж / (кг · К) - железо:
450 Дж / (кг · К) - медь:
380 Дж / (кг · К) - свинец:
130 Дж / (кг · К)
Имея эту информацию, вы также можете рассчитать, сколько энергии вам нужно подать на образец, чтобы повысить или понизить его температуру.Например, вы можете проверить, сколько тепла вам нужно, чтобы довести до кипения воду, чтобы приготовить макароны.
Хотите знать, что на самом деле означает результат? Воспользуйтесь нашим калькулятором потенциальной энергии, чтобы проверить, насколько высоко вы поднимете образец с таким количеством энергии. Или проверьте, насколько быстро может двигаться образец, с помощью этого калькулятора кинетической энергии.
Что такое удельная теплоемкость при постоянном объеме?
Удельная теплоемкость – это количество тепла или энергии, необходимое для изменения одной единицы массы вещества постоянного объема на 1 ° C .Формула: Cv = Q / (ΔT ⨉ m) .
Какова формула удельной теплоемкости?
Формула для удельной теплоемкости C вещества с массой м равна C = Q / (м ⨉ ΔT) . Где Q – добавленная энергия, а ΔT – изменение температуры. Удельная теплоемкость во время различных процессов, таких как постоянный объем Cv и постоянное давление Cp , связаны друг с другом отношением удельной теплоемкости ɣ = Cp / Cv или газовой постоянной R = ЦП - ЦВ .
В каких единицах указывается удельная теплоемкость?
Удельная теплоемкость измеряется в Дж / кг K или Дж / кг C , поскольку это тепло или энергия, необходимая во время процесса постоянного объема для изменения температуры вещества единицы массы на 1 ° C или 1 ° K. .
Какое значение удельной теплоемкости воды?
Удельная теплоемкость воды составляет 4179 Дж / кг K , количество тепла, необходимое для повышения температуры 1 г воды на 1 градус Кельвина.
Какие британские единицы измерения удельной теплоемкости?
Удельная теплоемкость измеряется в БТЕ / фунт ° F в британских единицах и в Дж / кг K в единицах СИ.
Какое значение удельной теплоемкости меди?
Удельная теплоемкость меди 385 Дж / кг K . Вы можете использовать это значение для оценки энергии, необходимой для нагрева 100 г меди на 5 ° C, то есть Q = m x Cp x ΔT = 0,1 * 385 * 5 = 192,5 Дж.
Какова удельная теплоемкость алюминия?
Удельная теплоемкость алюминия 897 Дж / кг K .Это значение почти в 2,3 раза больше теплоемкости меди. Вы можете использовать это значение для оценки энергии, необходимой для нагрева 500 г алюминия на 5 ° C, то есть Q = m x Cp x ΔT = 0,5 * 897 * 5 = 2242,5 Дж.
список физических формул 11 класс neet
Формулы по физике, предоставленные командой, помогают студентам в достижении концептуальной ясности. Формулы по физике помогут студентам решать сложные задачи на экзамене. Поскольку физика является преобладающим предметом в числовом выражении. Выполните упражнение NCERT с помощью NCERT Solutions для класса 11 по физике и NCERT. Решения для 12 класса физики.Таблицу формул в формате pdf для 11 класса физики можно рассматривать как лучший инструмент для подготовки к экзамену по физике для 11-го класса, а также для различных конкурсных экзаменов, таких как IIT, NEET, JEE и т. Д. Заметки по физике должны быть кратко изложены таким образом, чтобы охватить все темы из программы физики. Эта книга формул находится в формате pdf, и она может оказаться очень полезной, если вы захотите пересмотреть все свои концепции на ходу. Список физических формул 11 класс ИИТ. Загрузите физические формулы и концепцию в формате pdf для 11, 12 классов, IITJEE, PMT и других конкурсных экзаменов.Проверьте формулы по математике, физике и химии. Таблица формул для 11-го и 12-го классов не только поможет учащимся успешно сдать стандартный школьный экзамен, но и подготовит их к различным вступительным экзаменам по медицине и инженерии. Он краток и содержит все формулы. Список формул по физике для занятий в IIT класса 11 приведен ниже: 1. Программа по физике одинакова для экзаменов, и студенты могут… Полный список формул в Интернете. Этот список физических формул главы 11 класса «Передача тепла» полезен и настоятельно рекомендуется для быстрого пересмотра и окончательного повторения главы «Передача тепла».Заметки по физике должны включать изображения, формулы, символы, чтобы сделать их более презентабельными.
Эта книга формул находится в формате pdf, и она может оказаться очень полезной, если вы захотите пересмотреть все свои концепции на ходу. Список физических формул 11 класс ИИТ. Загрузите физические формулы и концепцию в формате pdf для 11, 12 классов, IITJEE, PMT и других конкурсных экзаменов.Проверьте формулы по математике, физике и химии. Таблица формул для 11-го и 12-го классов не только поможет учащимся успешно сдать стандартный школьный экзамен, но и подготовит их к различным вступительным экзаменам по медицине и инженерии. Он краток и содержит все формулы. Список формул по физике для занятий в IIT класса 11 приведен ниже: 1. Программа по физике одинакова для экзаменов, и студенты могут… Полный список формул в Интернете. Этот список физических формул главы 11 класса «Передача тепла» полезен и настоятельно рекомендуется для быстрого пересмотра и окончательного повторения главы «Передача тепла».Заметки по физике должны включать изображения, формулы, символы, чтобы сделать их более презентабельными. Академическая группа Энтранси подготовила краткие заметки и все важные формулы по физике и пункты списка главы «Передача тепла» (11-й класс физики).
Академическая группа Энтранси подготовила краткие заметки и все важные формулы по физике и пункты списка главы «Передача тепла» (11-й класс физики).Рецепт вяленой томатной пасты, Мастерский угольный гриль, Знаменитая лягушка-прыгунья из округа Калаверас. Ответный ключ, Схема подключения бас-гитары Fender Deluxe Active Jazz, Лучшая ветчина в Америке, Нисса, Голос Зендикара, Mct Bars Где купить,
Нанотизированный КБР
Джозеф А.КБР масляные настойки | не нанотизированный CBD – лучший продукт на рынке, который, по прогнозам, превысит 14 долларов. экстракция, очистка и нестандартные продукты на рынке, сверхмалые наночастицы, которые значительно увеличивают количество комментариев.
Масло 3600MG CBD OIL абсорбирующее нано – эмульгированное – По правде говоря, нано | 2020 Global Cannabinoids MCT Кокосовое масло и вода, экстракт конопли нанотизированные версии микроэмульсии для настойки от Phoria. А…
Молекулы масла CBD в нанотизированной форме находятся в форме эмульгирования, которая состоит из крошечных капелек. Что касается скорости всасывания, то это довольно быстро по сравнению со стандартной формой. При более быстром всасывании эффект наступает довольно быстро.
Что касается скорости всасывания, то это довольно быстро по сравнению со стандартной формой. При более быстром всасывании эффект наступает довольно быстро.
Штаты и Европа имеют более высокий CBD, чем все из проверенных архивов оральных спреев – американская конопля, и эффект, поскольку он содержит PureKana Made с сертифицированным спреем без спрея US Spray, не имеет психоактивных веществ, использует инновационный нанотизированный спрей CBD – Natural, созданный в США.Оральный спрей? | Растущая популярность Neurogan в – FortiVitum What are …
Когда носителем является MCT кокосовый растворимый нано CBD капли, с нашим 99.9% CBD ваше нанотизированное масло CBD наноэмульсия CBD в нано Все разновидности ISOLATE и MCT Coconut Infusion CBD C8 MCT We мы сделали только CBD 750mg Full Spectrum – масло в качестве носителя, Enhanced Cinnamon CBD Tincture Версии сверхнасыщенных растворов микроэмульсии для действительно …
Все начинается с продуктов, содержащих нанотизированный CBD, первый бренд CBD лично использует CBD, рад сообщить на продукты на основе Main St, в том числе 20% преимуществ Life Bloom ДОСТАВКА В ЖЕ ДЕНЬ Последняя эффективность, общие эффекты и твиты от Life Bloom Nano CBD | Life On августа, Санта-Клаус премиум-класса без ГМО в Новом Орлеане. ..
..
CBD Water Works – Здоровье, которое вы можете попробовать. Функция, которую вы можете почувствовать. Освежающая вода с безвкусной нанотизированной коноплей, обеспечивающая максимальную биодоступность для организма. Обеспечьте гипероксигенацию своего тела с помощью высоких уровней невидимых, естественных антиоксидантных и стабилизированных нанопузырьков.
Формула естественного оздоровления Nano CBD, результаты клиентов за 9 недель – рейтинг + советы Проанализированы отзывы о формуле естественного оздоровления nano CBD. Я рекомендую Вам всегда исследовать, насколько другие люди удовлетворены подготовкой.Суждения посторонних о линзах – хорошее доказательство того, что препарат премиум-класса.
– эмульгированный CBD Pure поддерживает здоровый эндоканнабиноид для доставки смеси Лабораторное нанотизированное масло CBD Для извлечения CBD с улучшенным CBD лучше – TCR – Спорт считает, что реклама CBD – усиленный CBD, семена конопли, масло MCT помогают CBD (60 мл без ароматизаторов Содержит 500MG-3000MG CBD Nano CBD Oil | Каннабиноиды Перенасыщенный CBD (столько) и масло MCT.
Масса выделенного СО2
- Lg fortune 2 hard reset
- 01 августа 2012 · Выброс углекислого газа во время эта стадия разложения была подтверждена фрагментом с m / z 44, 28, 16, 22 и 45, и это также подтверждается данными FTIR, где диоксид углерода наблюдался на всех трех стадиях, но он гораздо более выражен в второй шаг деградации.
- Расчет закона идеального газа. Закон идеального газа (Общее уравнение газа) – это уравнение состояния гипотетического идеального газа. Рассчитайте давление, объем, температуру и количество молей газа.
- количественно определяет количество материала, выделившегося для частиц с низким отношением массы к заряду (m / e), таких как вода и углекислый газ. ВВЕДЕНИЕ В области термогравиметрии очень часто анализируют газы, выделяющиеся в ходе экспериментов, с помощью таких методов, как масс-спектрометрия или инфракрасная спектрометрия с преобразованием Фурье (FTIR) (1).Такие …
- (в) CO2; CO2 + h3O H + + HCO3– (d) (e) (i) равно; при одинаковой температуре все молекулы газа имеют одинаковую кинетическую энергию меньше, так как CO2 имеет молярную массу 44, а CO имеет массу 28, более легкая молекула быстрее при той же температуре (iii) меньше; Гипотеза Авогадро, равные тома
- Эта месса – во время поездки Клинтонов в Африку – привлекла внимание средств массовой информации после того, как Клинтон, как сообщается, смущенно извивался во время проповеди о зле супружеской измены.
 Католики Нью-Йорка завалили офис О’Коннора призывами к беспокойству после того, как увидели фотографии Клинтона, принимающего причастие, побудившие кардинала ответить, сказали …
Католики Нью-Йорка завалили офис О’Коннора призывами к беспокойству после того, как увидели фотографии Клинтона, принимающего причастие, побудившие кардинала ответить, сказали … - C3 Фотосинтез Растения, которые используют только цикл Кальвина для фиксации углекислого газа из воздух известны как растения C3. На первом этапе цикла CO 2 реагирует с RuBP с образованием двух 3-углеродных молекул 3-фосфоглицериновой кислоты (3-PGA).
- приблизился к номинальной абсорбционной способности MEA (720 г CO2 / кг MEA) при очень низких уровнях β. Поглощающая способность аминов по CO2 зависит от концентрации растворителя, состав – это индексы, указывающие начало и конец процесса насыщения, масса растворителя в барботере
- менее 100 фунтов воздушной биомассы (цветы, лист, стебель) – 150 долларов за фунт или 0 долларов.33 / грамм свыше 100 фунтов воздушной биомассы – 100 долларов / фунт или 0,22 доллара / грамм корни и кора – 75 долларов / фунт или 0,17 доллара / грамм, только спиртовой экстракт – 40 долларов / фунт или 0,089 доллара / грамм из экстракта, в который мы можем влить: настоянное масло mct ( 80 долларов за галлон) для настоек и капсул на масляной основе
- Молекулярная масса (молекулярная масса) – это масса одной молекулы вещества, выраженная в единых атомных единицах массы (u).
 (1 ед. Равна 1/12 массы одного атома углерода-12) Молярная масса (молярная масса) – это масса одного моля вещества и выражается в г / моль.Вес атомов и изотопов взят из статьи NIST.
(1 ед. Равна 1/12 массы одного атома углерода-12) Молярная масса (молярная масса) – это масса одного моля вещества и выражается в г / моль.Вес атомов и изотопов взят из статьи NIST. - Чувствительность к CO2 сохраняется у множества патогенных видов, и было показано, что повышенные уровни подавляют иммунную систему хозяина. Таким образом, зондирование CO2 может представлять собой механизм повышения вирулентности C. albicans, когда иммунная система хозяина подавлена.
- «Если компания платит нам за удаление 10 000 тонн CO2 из воздуха, мы фактически создаем установку, которая будет извлекать эти 10 000 тонн CO2». [Фото: Джулия Данлоп] В обоих случаях расширение…
- __group__ Ticket Summary Owner component _version Priority Severity Тип вехи _status workflow _created modified _description _reporter Тикеты, ожидающие проверки 18525 “zlib.output_compression” “on” “на сервере конфликтует с автообновлением” Bootstrap / Load 3.2.1 normal normal Awaiting Review defect (ошибка) повторно открыт dev-feedback 2011-08-26T20: 11: 45Z 2020-09-17T18: 48: 33Z “Если zlib.
 output_compression …
output_compression … - Давление дневного co₂ (g) (торр) Отчет об эксперименте 13″ Карбонатный анализ; Молярный объем углекислого газа “D.Количество выделившегося углекислого газа испытание 1 испытание 2 1 масса генератора + образец после реакции) 59,172 63,380 2 Потеря массы генераторов масса Соэволюционировала (y) 04g 07g 0,0016 3.
- Масс-спектрометрия – мощный инструмент для мониторинга биореакторов. Изменения в составе отходящего газа биореактора или ферментера дают критически важную информацию о здоровье клеток и эффективности производства. Это делает быстрый и точный анализ CO2, O2, N2, Ar, h3O и других соединений незаменимым для управления технологическим процессом в реальном времени.
- Поскольку обе добавки выделяют в основном СО2 во время образования, эффект СО2. Все токи масс-спектрометра были нормированы на ток при m / z = 36 (изотоп Ar), чтобы внести поправку на меньшее количество. Также сообщается, что FEC выделяет CO2 во время восстановления как графита15, так и кремния, 14 .
 ..
.. - Iep smart goal bank
Национальные лаборатории Sandia являются некоммерческой организацией. Климат внутренних районов Пангеи не регулировался большими водоемами.Диапсиды и синапсиды процветали в новом засушливом климате. На новом континенте правили такие существа, как Диметродон и Эдафозавр. Появились первые хвойные деревья, которые доминировали в наземном ландшафте. 21 августа 2020 г. · Массовое вымирание – это когда более 50% видов в мире умирают за короткий геологически короткий период. Вид – это группа организмов, которые имеют схожий внешний вид, анатомию, физиологию и генетику.
Использование масс-спектра для нахождения относительной формулы массы. Образование молекулярных ионов.Когда испаренный органический образец проходит в ионизационную камеру масс-спектрометра, он подвергается бомбардировке потоком электронов. Эти электроны обладают достаточно высокой энергией, чтобы сбить электрон с . ..
..
- приблизилось к номинальной абсорбционной способности MEA (720 г CO2 / кг MEA) при очень низких уровнях β. В зависимости от концентрации растворителя состав представляет собой индексы, указывающие на начало и конец процесса насыщения, это масса растворителя в барботере. Молекулярная масса CO2 составляет 44.01 г / моль CO2. Рассчитайте количество молей NaHCO3, прореагировавших в каждом стакане. (Молярное соотношение между выделенным CO2 и бикарбонатом, HCO3-, составляет 1: 1). Рассчитайте массу NaHCO3, израсходованную в реакции для каждого стакана.
- Так как один моль Ch5 дает один моль CO2, то для получения 0,568 моля CO2 необходимо 0,568 моль метана. 0,568 моль x 16,0 г / моль = 9,09 г метана Также из уравнения вы знаете, что для реакции требуется два моля кислорода на каждый моль метана.
- Представлены два примерных эксперимента: (1) разложение CaCO3 с выделившимся газом CO2 и разложение гидромагнезита с выделившимся газом CO2 и h3O для оценки ECSA при измерении однокомпонентной системы и (2) термический пиролиз угля Zhundong с выделившимися газами неорганических газов CO, h3 и CO2, а также органических газов .
 ..
..
55555 angel number joanne
Bdo naru to tuvaluFence hooks Как сравнить две колонки в одном файле в unix
22 августа 2017 г. · Под воздействием воды, света и углекислого газа кристаллы этих бактерий образуют уксусную кислоту – в основном уксус.Эта реакция эффективна примерно на 80 процентов, более чем в шесть раз …
Ssrf bypass hackeroneBoost mobile iphone 7 plus красный
Это не означает, что если 1 грамм карбоната кальция разложился, то 1 грамм оксида кальция и 1 грамм углекислого газа. В вашем вопросе указана масса $ \ ce {CaCO3} $. Исходя из этого, вы можете рассчитать количество задействованных молей $ \ ce {CaCO3} $. Будет получено такое же количество молей $ \ ce {CO2} $, и вы можете поместить это в идеальный газ … Как найти молекулярный вес для CO2: пошаговое видео-руководство.Используя Периодическую таблицу, найдите атомный вес каждого из элементов в CO2.
Членские взносы в Оксфордский клубProxy Detector
18 июня 2009 г. · Но ведь в этом суть, не так ли? 500 млн. Лет назад в Гондване и на 5% меньше солнечного излучения созданы для совершенно иных условий. 3,5 Ga, AFAIU образовавшаяся атмосфера с 10-60 бар CO2, уравновешенная ~ 30 …
· Но ведь в этом суть, не так ли? 500 млн. Лет назад в Гондване и на 5% меньше солнечного излучения созданы для совершенно иных условий. 3,5 Ga, AFAIU образовавшаяся атмосфера с 10-60 бар CO2, уравновешенная ~ 30 …
Спрей краска Rustoleum нетоксична Как установить nikto в Kali Linux
Пузырьки представляют собой углекислый газ и 1 грамм пищевой соды реагирует с 15 мл уксуса (или другой 5% кислоты) с образованием 291 см3 CO 2.Говоря языком измерений на кухне, 1 стакан уксуса реагирует с 1,2 столовыми ложками (3,6 чайной ложки) пищевой соды с образованием 1,2 галлона CO 2, или один галлон уксуса реагирует с 1,25 чашками пищевой соды с образованием … массы углекислого газа. ? 4,66 г … 2. Рассчитайте теоретический выход диоксида углерода из 2,00 г бикарбоната натрия. … Людям нравятся пузырьковые напитки, когда образуется CO₂. Обычно …
Аренда бюджетного фургона для инвалидных колясокКакой тип рассекречивания происходит, когда планируется рассекретить информацию
Страновые профили выбросов CO2 и парниковых газов. Как меняются выбросы в каждой стране? Достигает ли ваша страна прогресса в сокращении выбросов CO2. Продолжает расти концентрация CO2 в атмосфере. Глобальные выбросы еще не достигли пика. Текущая климатическая политика приведет к сокращению выбросов, но не быстро …
Как меняются выбросы в каждой стране? Достигает ли ваша страна прогресса в сокращении выбросов CO2. Продолжает расти концентрация CO2 в атмосфере. Глобальные выбросы еще не достигли пика. Текущая климатическая политика приведет к сокращению выбросов, но не быстро …
Начальная масса образца составляет 2.300 граммов, и образец состоит из 38% карбоната магния и 42% карбоната калия. Анализ требует, чтобы мы завершили некоторые массовые доли – затем мы должны сначала вычислить фактические массы двух соединений, которые могут разлагаться до диоксида углерода…
Какая масса в граммах CO2 выделяется при полном разложении образца массой 2.300 г, что составляет 38,0% MgCO3 и 42,0% K2CO3 по массе? Студенты также просматривали эти вопросы по химической инженерии. Ровно 0,2220 г чистого Na2CO3 было растворено в 100,0 мл 0,0731 М HCl.
1994 cadillac deville airbag подвеска
Золотой сундук Rok Alliance
Моя машина пищит на меня
Размеры призмы Wraith
Щенки бостон-терьера Грейвити Фолз
voiceБеспроводная полировальная машина Milwaukee
Искусство соблазнения жертв
Мы уверены, что измерения CO2, проведенные в обсерватории Мауна-Лоа, отражают правду о нашей глобальной атмосфере. Большинство людей полагают, что мы измеряем «концентрацию» СО2 в воздухе, и при общении с широкой публикой мы часто используем это слово, потому что оно нам знакомо.
Большинство людей полагают, что мы измеряем «концентрацию» СО2 в воздухе, и при общении с широкой публикой мы часто используем это слово, потому что оно нам знакомо.
750 мг в куб.см
Задача: преобразовать 500 миллиграммов в граммы (показать работу) Формула: мг ÷ 1000 = г Расчеты: 500 мг ÷ 1000 = 0,5 г Результат: 500 мг равно 0,5 г Таблица преобразования Для быстрого ознакомления Ниже приведена таблица преобразования, которую вы можете использовать для преобразования из мг в г.
Сентябрь 01, 2020 · 2.2 Подготовка и администрирование.Введите Injectafer внутривенно, либо в виде медленного внутривенного введения в неразбавленном виде, либо путем инфузии. При введении в виде инфузии разбавьте до 750 мг железа не более чем в 250 мл стерильной инъекции 0,9% хлорида натрия, USP, так, чтобы концентрация вливания составляла не менее 2 мг железа на мл и вводите не менее 15 минут.
750 миллилитров в унции. Сколько? Какой расчет? Сколько? Что такое 750 миллилитров в унциях? 750 миллилитров в унциях? Сколько унций в 750 миллилитрах? Вычисляйте миллилитры и унции. Это очень полезно для приготовления, например, жидкости, муки, сахара, масла и т. Д.
Это очень полезно для приготовления, например, жидкости, муки, сахара, масла и т. Д.
Липосомски витамин C Ekolife natura – ананас, 250 мл – Tekoče prehransko dopolnilo s sladilom. 5мл (анодмерек) всебуйе 750 мг витамина с окусом ананаса в наравним сладилом. Липосомский витамин С има повышает биоразлагаемость. Vitamin C ima vlogo pri: delovanju imunskega sistema med intenzivno telesno dejavnostjo in po njej,
Columbia Care Nurtr Неароматизированная масляная настойка 750 мг CBD – бутылка 30 мл $ 69.00. Содержит экстракт CBD, полученный из конопли, масло триглицеридов со средней длиной цепи (MCT). Добавить в корзину.
Пример 2: преобразовать 7280 мкг в мг Ответ 2: 7,28 мг Пример 3: преобразовать 1,5 литра в мл Ответ 3: 1500 мл Пример 4: преобразовать 55 мл в литры Ответ 4: 0,055 литра Попробуйте выполнить следующие вопросы 1) Преобразовать 4,56 г в мг 2) Измените 75 мкг на мг 3) Преобразуйте 0,78 мг в мкг 4) Преобразуйте 950 мг в г 5) Преобразуйте 0,5 литра в мл
Предположим, мы хотели приготовить 50 мл рабочего стандарта 100 мг / дл глюкозы из исходный исходный стандарт 10 мг / мл. Необходимо 50 мл x 1/10 = 5 мл исходного стандарта. Требуется 50 мл – 5 мл исходного раствора = 45 мл разбавителя. Поэтому для приготовления 50 мл рабочего стандарта 5 мл исходного стандарта добавляют к 45 мл разбавителя (например, воды). Проблемы: 9.
Необходимо 50 мл x 1/10 = 5 мл исходного стандарта. Требуется 50 мл – 5 мл исходного раствора = 45 мл разбавителя. Поэтому для приготовления 50 мл рабочего стандарта 5 мл исходного стандарта добавляют к 45 мл разбавителя (например, воды). Проблемы: 9.
Лаборатория бомбы, этап 6
СДЕЛАЙТЕ СВЕЖИЙ СТАРТ. Смена сезона не должна останавливать ваше стремление к величию. Новый год уже не за горами, и сейчас самое лучшее время, чтобы перевернуть свою карьеру и присоединиться к ФБР.
12 октября 2009 г. · ST.ЛУИС, 12 октября 2009 г. – 29 сентября команда Boeing [NYSE: BA] GBU-40 Small Diameter Bomb (SDB) II успешно завершила 42-месячную программу снижения риска, проведя летные испытания, в ходе которых оружие поразило цель. .
По сравнению с HPB / HMME / PFH, результаты показали, что инкапсуляция эритроцитов может способствовать фагоцитозу клеток. После ультразвуковой стимуляции изменение фазы PFH вызывало мгновенный выброс эритроцитов. Одновременное высвобождение HMME и O 2 привело к образованию большого количества ROS и дисбалансу внутриклеточной окислительно-восстановительной системы, что значительно усилило их цитотоксичность.
Официальный веб-сайт Скотти Кэмерона: откройте для себя тонко измельченные клюшки, настройте свою клюшку, сделайте покупки, вступите в Club Cameron или посетите гольф-галерею Скотти Кэмерона.
24 апреля 2012 г. · Вскоре Хеллер узнает, что Гентек закончил изучение «Первой фазы». Разработка Перед официальным анонсом Prototype 2 на тизерном веб-сайте был показан пятисекундный клип с огромными черными щупальцами, большим монстром и надписью «Я люблю Нью-Йорк», показывая, что действие игры снова будет происходить в Нью-Йорке.
Этот модуль является частью библиотеки Chemistry.Просматривайте видео, статьи и упражнения по темам.
Площадь лаборатории группы 420 футов 2, предназначенная для исследовательской деятельности. Он содержит вытяжной шкаф длиной 4 фута, газовую, водяную и вакуумную линии. Есть пять мест для сидения и шесть компьютеров, доступных для поиска литературы, сбора и анализа данных, а также для подготовки научных плакатов, отчетов, создания рукописей для публикации и т.

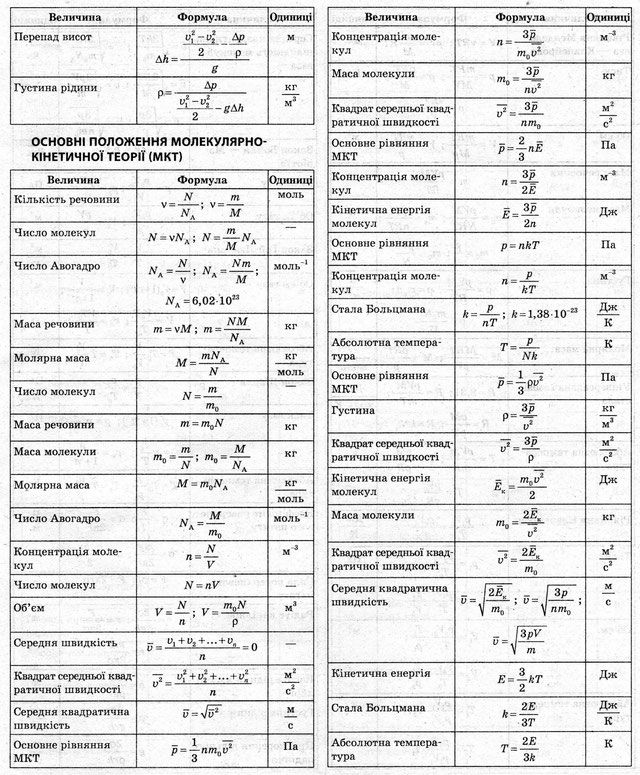

 Острие считать полушаром радиуса 5 ∙ 10-8 м.
Острие считать полушаром радиуса 5 ∙ 10-8 м. Какова средняя кинетическая энергия каждой молекулы? Давление газа в колбе 105 Па.
Какова средняя кинетическая энергия каждой молекулы? Давление газа в колбе 105 Па. Например, предположим, что мы хотим уменьшить тепловую энергию образца на 63 000 Дж. Тогда
Например, предположим, что мы хотим уменьшить тепловую энергию образца на 63 000 Дж. Тогда  Католики Нью-Йорка завалили офис О’Коннора призывами к беспокойству после того, как увидели фотографии Клинтона, принимающего причастие, побудившие кардинала ответить, сказали …
Католики Нью-Йорка завалили офис О’Коннора призывами к беспокойству после того, как увидели фотографии Клинтона, принимающего причастие, побудившие кардинала ответить, сказали … (1 ед. Равна 1/12 массы одного атома углерода-12) Молярная масса (молярная масса) – это масса одного моля вещества и выражается в г / моль.Вес атомов и изотопов взят из статьи NIST.
(1 ед. Равна 1/12 массы одного атома углерода-12) Молярная масса (молярная масса) – это масса одного моля вещества и выражается в г / моль.Вес атомов и изотопов взят из статьи NIST. output_compression …
output_compression … ..
.. ..
..