Нобелевская премия за двойку.
Химия в школе весьма сложный для большинства предмет. Тем более, знания самих учителей были актуальны лет 20—30 назад. С тех пор химики научились получать вещества, за которые любому из нас гарантированно поставили бы двойку. «Чердак» представляет хит-парад «неправильных» и «невозможных» с точки зрения школьной программы веществ.
Красный натрий, неправильная соль и агрессивный гелий
Российский химик Артем Оганов, руководящий лабораторией в МФТИ, судя по всему, станет главным символом «борьбы» со школьной программой. Разработанный им метод предсказания новых соединений USPEX позволяет создавать вещества, которые доведут до обморока любого учителя химии, если, конечно, он не читает «Чердак».
Взять, например, натрий — эталон металла. Мягкий, с серебристым блеском. Бурно реагирует даже с водой, любому окислителю легко отдает свой единственный электрон на внешней орбите. Когда метод Оганова предсказал, что при очень высоких давлениях это вещество станет прозрачным неметаллом, да еще и красного цвета, не то что школа — авторитетнейший журнал Nature отказался публиковать это предсказание. Правда, когда через несколько недель экспериментаторы таки получили удивительное вещество, журналу пришлось признать свою ошибку и опубликовать статью — теперь уже не только о предсказании, а заодно и о получении уникального вещества.
Правда, когда через несколько недель экспериментаторы таки получили удивительное вещество, журналу пришлось признать свою ошибку и опубликовать статью — теперь уже не только о предсказании, а заодно и о получении уникального вещества.
Оттуда же, из школьного учебника химии, хорошо известно, что «самая классическая» соль — это хлорид натрия, NaCl, она же поваренная соль. Один атом натрия в ее кристалле приходится на один атом хлора, и никак иначе: натрий полностью отдает электрон, хлор — забирает, получаются два иона, из которых и строится кристаллическая решетка. Других пропорций быть не может. По крайней мере, так казалось до прихода в химию Оганова. Он предсказал, а экспериментаторы подтвердили, что при давлениях в сотни тысяч атмосфер могут существовать совершенно «сумасшедшие» формулы хлорида натрия: NaCl_7, NaCl_3, Na_3Cl_2, Na_2Cl и Na_3Cl. Некоторые из них обладают совсем уникальными свойствами — в них есть двумерные слои атомов натрия, проводящие ток.
Но, пожалуй, жестче всех поиздевался над школьной химией один из студентов Оганова, Шао Донг, который решил доказать, что самый инертный, принципиально ни с чем не реагирующий элемент гелий вполне себе реакционноспособен — важно только правильно подобрать условия.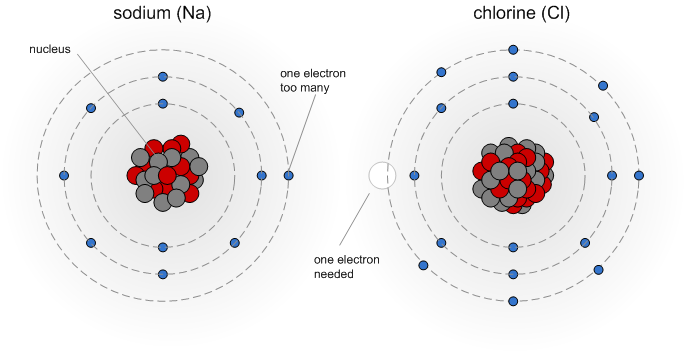 Если мы напишем любое соединение гелия в школьной контрольной, то двойка — это будет слишком много. А Донг при помощи метода USPEX просчитал почти всю таблицу Менделеева и доказал, что гелий может реагировать… с натрием! Образуется устойчивое соединение Na_2He. Правда, оно «живет» при давлениях больше миллиона атмосфер, но недавно химики получили соединение Na_2HeO, которое устойчиво и при куда меньшем давлении — всего 150 тысяч атмосфер. Подобные условия уже можно получить в промышленности. Соединение кислорода, гелия и натрия можно использовать для хранения и транспортировки гелия без утечек.
Если мы напишем любое соединение гелия в школьной контрольной, то двойка — это будет слишком много. А Донг при помощи метода USPEX просчитал почти всю таблицу Менделеева и доказал, что гелий может реагировать… с натрием! Образуется устойчивое соединение Na_2He. Правда, оно «живет» при давлениях больше миллиона атмосфер, но недавно химики получили соединение Na_2HeO, которое устойчиво и при куда меньшем давлении — всего 150 тысяч атмосфер. Подобные условия уже можно получить в промышленности. Соединение кислорода, гелия и натрия можно использовать для хранения и транспортировки гелия без утечек.
Молекулы без химических связей
Что такое молекула вообще? Это крошечный объект, в котором атомы особым образом соединены друг с другом. Эти соединения называются химическими связями. B школе мы учим разные типы связей — ковалентные (полярные и неполярные), ионные… Если сказать учителю, что можно соединить разные части молекул вообще без химической связи, «неуд» обеспечен. А между тем такие вещества существуют — химики получили их несколько десятилетий назад.
Во-первых, это карцеранды, которые впервые синтезировал нобелевский лауреат по химии 1987 года Дональд Крам. В названии чудится слово «карцер», и это не случайно: карцеранды — это тюрьма на одну молекулу. «Невозможные» вещества представляют собой большую молекулярную клетку, внутри которой находится, например, большой атом инертного газа или маленькая молекула. Она никак не связана с клеткой, но выбраться не может.
Во-вторых, это удивительные соединения под названием катенаны и ротаксаны. Первые представляют собой две или больше замкнутых в кольцо цепочки атомов, при этом кольца продеты друг в друга, подобно звеньям цепи. Собственно, «катена» (catena) по латыни и означает «цепь». Связи — нет, а разнять кольца не получается. В последние годы химики настолько наловчились получать эти вещества, что синтезировали олимпиадан. Да-да, в нем пять колец, сцепленных, как в символе олимпийского движения.
Модель катенана. Изображение: M Stone с сайта wikipedia.org
С ротаксанами все проще: они состоят из длинной цепочка атомов, которую продевают в такое же кольцо, как у катенанов, после чего на концы цепочки навешивают массивные группы атомов, которые не дают кольцу соскочить с оси. Такие колеса на палочке не досужие игры химиков-органиков, а детали будущих нанороботов размером с большую молекулу.
Такие колеса на палочке не досужие игры химиков-органиков, а детали будущих нанороботов размером с большую молекулу.
Непрямые банановые связи
С точки зрения классической химии, обычная химическая связь, особенно между атомами углерода, — прямая. Электроны, при помощи которых образуется связь, движутся вдоль линий, которые соединяют центры атомов. Это естественно и понятно на интуитивном уровне. Однако существует давным-давно известное вещество, когда-то популярный наркоз, которое нарушает «естественное» правило. Это циклопропан, в котором три атома углерода соединены в равносторонний треугольник, углы которого равны 60 градусам. Но с первых уроков органической химии нам вдалбливают, что угол между связями в углероде равен 109 градусов 28 минут! Получается, в циклопропане связи «стянуты» друг к другу, как согнутая в лук ветка дерева. И со связями у него та же история: траектории движения электронов выгибаются наружу от сторон треугольника, который образуется атомами углерода.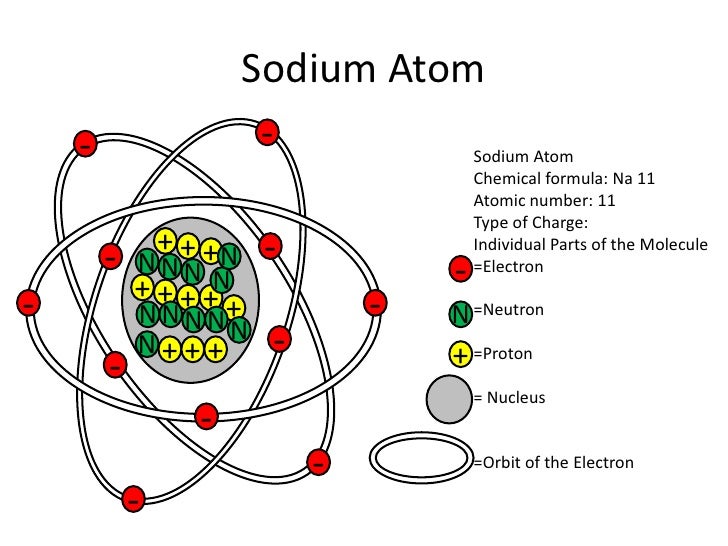 Снова получается натянутый лук. Хотя химики назвали такие связи не луковыми, а банановыми.
Снова получается натянутый лук. Хотя химики назвали такие связи не луковыми, а банановыми.
Плоский атом углерода
Когда мы приходим на урок органической химии, нам тут же рассказывают об уникальности атома углерода: его атомы могут соединяться друг с другом в длинные цепочки, а четыре связи, которые образует углерод, направлены к вершинам тетраэдра (мы уже говорили об этом в главе про банановые связи). Самый простенький тетраэдр — метан, CH_4, потом тетраэдры соединяются друг с другом, образуя все более сложные вещества вплоть до ДНК. Если на контрольной нарисовать атом углерода, в котором все четыре связи лежат в одной плоскости, образуя крест, пересдача вам гарантирована.
Между тем именно о таком атоме мечтали химики-органики десятилетиями. Они даже придумали гипотетическое вещество из девяти атомов углерода, которое назвали фенестран (от латинского «фенестра» (fenestra) — окно). Теория предсказывала, что центральный атом углерода в нем мог быть только плоским, но синтезировать фенестран в реальности не получалось. Однако органики — люди упрямые, и совсем недавно, в 2010 году, британским ученым (да, снова им!) удалось создать вещество с неприглядным названием дилитий-метандиид, в центре которого — тот самый плоский атом углерода. Правда, чтобы «расплющить» углерод, его пришлось связать с двумя атомами лития. Пока фенестраны в основном игрушка для органиков, хотя их можно использовать, например, для изучения экстремальных состояний атома углерода.
Однако органики — люди упрямые, и совсем недавно, в 2010 году, британским ученым (да, снова им!) удалось создать вещество с неприглядным названием дилитий-метандиид, в центре которого — тот самый плоский атом углерода. Правда, чтобы «расплющить» углерод, его пришлось связать с двумя атомами лития. Пока фенестраны в основном игрушка для органиков, хотя их можно использовать, например, для изучения экстремальных состояний атома углерода.
Четверная связь
Еще одно важное знание, вынесенное из курса органической химии, касается связей внутри молекул: они могут быть одинарными, двойными и тройными. Связей более высокого порядка не бывает — и точка. Если мы вспомним, что, например, сера бывает шестивалентной, и нарисуем шестерную связь S-S, то остракизм от учителя гарантирован. И в этом конкретном случае учитель, пожалуй, будет прав. Конкретно сера шестерную и даже четверную связи образовать не может. Но тем не менее связи высокой кратности бывают!
Например, в веществе с простой формулой [Re2Cl2]2- и сложным названием «октахлородиренат-анион». В этом ионе два атома рения связаны друг с другом именно четверной связью. Существуют четверные связи и в соединениях молибдена, вольфрама, хрома и ванадия. Так что даже в «простой» неорганической химии все не так однозначно.
В этом ионе два атома рения связаны друг с другом именно четверной связью. Существуют четверные связи и в соединениях молибдена, вольфрама, хрома и ванадия. Так что даже в «простой» неорганической химии все не так однозначно.
Это далеко не полный список «невозможных» с точки зрения школьной химии веществ. Более того, этот список пополняется каждый год, так что вскоре стоит ждать новых удивительных молекул, попирающих (а на самом деле подтверждающих) законы привычной химии.
Алексей Паевский
Российские химики открыли первое “настоящее” соединение гелия
https://ria.ru/20170206/1487292646.html
Российские химики открыли первое “настоящее” соединение гелия
Российские химики открыли первое “настоящее” соединение гелия – РИА Новости, 09.02.2017
Российские химики открыли первое “настоящее” соединение гелия
Российские и зарубежные химики заявляют о возможности существования двух стабильных соединений самого “ксенофобского” элемента – гелия, и экспериментально. .. РИА Новости, 06.02.2017
.. РИА Новости, 06.02.2017
2017-02-06T19:00
2017-02-06T19:00
2017-02-09T10:50
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/sharing/article/1487292646.jpg?14872921951486626609
долгопрудный
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2017
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
открытия – риа наука, долгопрудный, московский физико-технический институт
Открытия – РИА Наука, Наука, Долгопрудный, Московский физико-технический институт
МОСКВА, 6 фев – РИА Новости. Российские и зарубежные химики заявляют о возможности существования двух стабильных соединений самого “ксенофобского” элемента – гелия, и экспериментально подтвердили существования одного из них – гелида натрия, говорится в статье, опубликованной в журнале Nature Chemistry.
“Данное исследование демонстрирует, как совершенно неожиданные явления могут быть обнаружены с помощью самых современных теоретических и экспериментальных методов.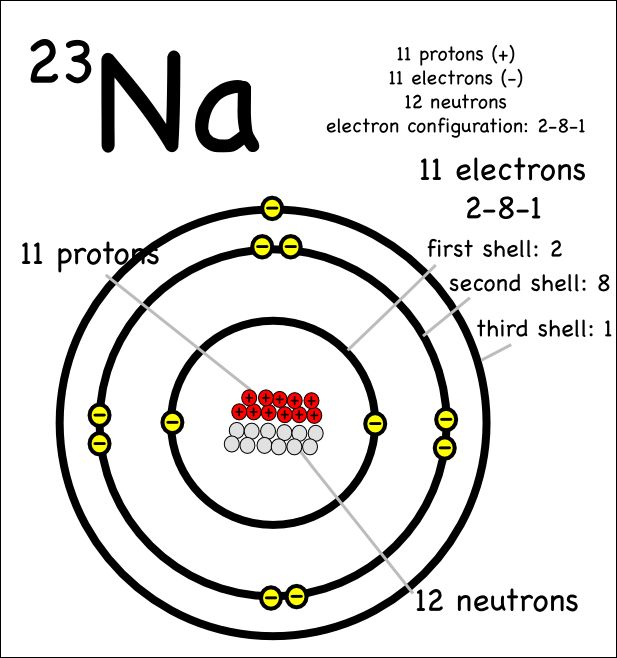 Наша работа в очередной раз иллюстрирует, насколько мало на сегодняшний день мы знаем о влиянии экстремальных условий на химию, и роль таких явлений на процессы внутри планет ещё предстоит объяснить”, — рассказывает Артем Оганов, профессор Сколтеха и Московского Физтеха в Долгопрудном.
Наша работа в очередной раз иллюстрирует, насколько мало на сегодняшний день мы знаем о влиянии экстремальных условий на химию, и роль таких явлений на процессы внутри планет ещё предстоит объяснить”, — рассказывает Артем Оганов, профессор Сколтеха и Московского Физтеха в Долгопрудном.
Тайны благородных газов
Первичная материя Вселенной, возникшая через несколько сотен миллионов лет после Большого Взрыва, состояла всего из трех элементов – водорода, гелия и следовых количеств лития. Гелий и сегодня является третьим по распространенности элементом мироздания, однако на Земле его встречается крайне мало, и запасы гелия на планете постоянно уменьшаются из-за того, что он улетучивается в космос.
5 февраля 2017, 10:25
Физик: гелий поможет России стать лидером в производстве нанопроводов
Отличительной чертой гелия и других элементов восьмой группы таблицы Менделеева, которых ученые называют “благородными газами”, является то, что они крайне неохотно – в случае ксенона и других тяжелых элементов – или в принципе, как неон, не способны вступать в химические реакции. Существует лишь несколько десятков соединений ксенона и криптона с фтором, кислородом и другими сильными окислителями, ноль соединений неона и одно соединение гелия, обнаруженное экспериментальным путем в 1925 году.
Существует лишь несколько десятков соединений ксенона и криптона с фтором, кислородом и другими сильными окислителями, ноль соединений неона и одно соединение гелия, обнаруженное экспериментальным путем в 1925 году.
Это соединение, объединение протона и гелия, не является настоящим химическим соединением в строгом смысле этого слова – гелий в данном случае не участвует в образовании химических связей, хотя и влияет на поведение атомов водорода, лишенных электрона. Как раньше предполагали химики, “молекулы” этого вещества должны были встречаться в межзвездной среде, однако за последние 90 лет астрономы так и не обнаружили их. Возможной причиной этого является то, что данный ион крайне нестабилен и разрушается при контакте с почти любой другой молекулой.
Артем Оганов и его команда задумались, могут ли соединения гелия существовать при экзотических условиях, о которых земные химики задумываются крайне редко – при сверхвысоких давлениях и температурах. Оганов и его коллеги достаточно давно изучают подобную “экзотическую” химию и даже разработали специальный алгоритм для поиска веществ, существующих в таких условиях.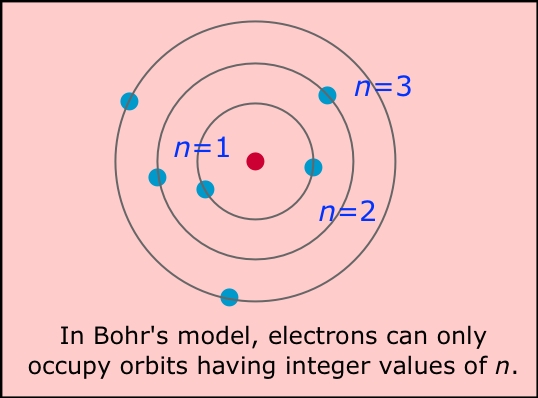 При его помощи они обнаружили, что в недрах газовых гигантов и некоторых других планет может существовать экзотическая ортоугольная кислота, “невозможные” версии обычной поваренной соли, и ряд других соединений, “нарушающих” законы классической химии.
При его помощи они обнаружили, что в недрах газовых гигантов и некоторых других планет может существовать экзотическая ортоугольная кислота, “невозможные” версии обычной поваренной соли, и ряд других соединений, “нарушающих” законы классической химии.
Используя эту же систему, USPEX, российские и зарубежные ученые обнаружили, что при сверхвысоких давлениях, превышающих атмосферное в 150 тысяч и миллион раз, существует сразу два стабильных соединения гелия – гелид натрия и оксигелид натрия. Первое соединение состоит из двух атомов натрия и одного атома гелия, а второе – из кислорода, гелия и двух атомов натрия.
19 декабря 2013, 23:33
Сверхвысокое давление заставило соль “нарушить” правила химииАмерикано-российские и европейские химики превратили обычную поваренную соль в химически “невозможное” соединение, молекулы которого организованы в экзотические структуры из разного числа атомов натрия и хлора.
Атом на алмазной наковальне
И то, и другое давление можно легко получить при помощи современных алмазных наковален, что и сделали коллеги Оганова под руководством другого россиянина — Александра Гончарова из Геофизической лаборатории в Вашингтоне. Как показали его опыты, гелид натрия формируется при давлении примерно в 1,1 миллиона атмосфер и остается стабильным как минимум до 10 миллионов атмосфер.
Как показали его опыты, гелид натрия формируется при давлении примерно в 1,1 миллиона атмосфер и остается стабильным как минимум до 10 миллионов атмосфер.
Что интересно, гелид натрия похож по своей структуре и свойствам на соли фтора, “соседа” гелия по периодической таблице. Каждый атом гелия в этой “соли” окружен восьмью атомами натрия, подобно тому, как устроен фторид кальция или любая другая соль плавиковой кислоты. Электроны в Na2He “притянуты” к атомам так сильно, что это соединение, в отличие от натрия, является изолятором. Подобные структуры ученые называют ионными кристаллами, так как электроны занимают в них роль и место отрицательно заряженных ионов.
1 сентября 2016, 14:14
МФТИ: недра Нептуна и Урана могут содержать “кислоту Гитлера”Химики из Московского физтеха и Сколтеха предполагают, что недра Урана и Нептуна могут содержать в себе прослойку из экзотической материи – ортоугольной кислоты, так называемой “кислоты Гитлера”.
“Открытое нами соединение весьма необычно: хотя атомы гелия напрямую не участвуют в химической связи, их присутствие фундаментально меняет химические взаимодействия между атомами натрия, способствуя сильной локализации валентных электронов, что делает полученный материал изолятором”, — поясняет Сяо Дун (Xiao Dong) из университета Нанканя в Тяньцзине (Китай).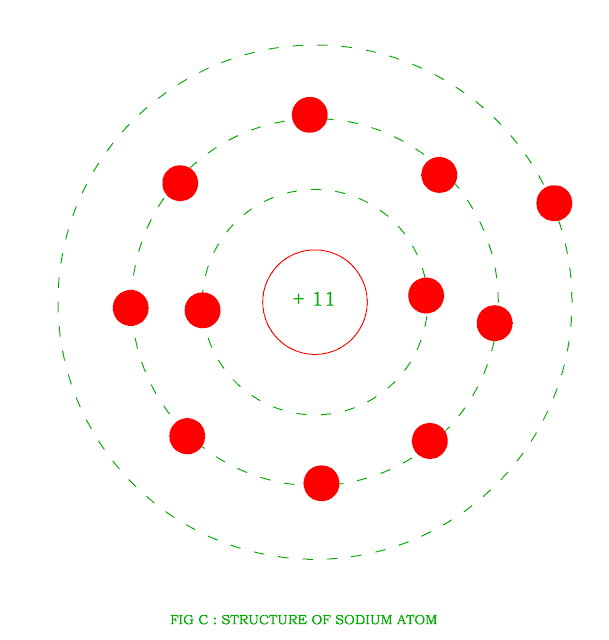
Другое соединение — Na2HeO — оказалось стабильным в диапазоне давлений от 0,15 до 1,1 миллиона атмосфер. Вещество также является ионным кристаллом и имеет схожее с Na2He строение, только роль отрицательно заряженных ионов в них играют не электроны, а атомы кислорода.
Что интересно, все остальные щелочные металлы, обладающие более высокой реактивностью, гораздо менее охотно образуют соединения с гелием при давлениях, превышающих атмосферное не более чем в 10 миллионов раз.
23 декабря 2015, 23:45
Российские ученые смоделировали недра экзопланет-суперземельГруппа специалистов из МФТИ попыталась выяснить, какие соединения могут образовывать кремний, кислород и магний при высоких давлениях. Ученые заявляют, что эти элементы являются основой химии Земли и планет земного типа.
Оганов и его коллеги связывают это с тем, что орбиты, по которым движутся электроны в атомах калия, рубидия и цезия, заметным образом меняются при повышении давления, чего с натрием, по пока не понятным причинам, не происходит. Как полагают ученые, гелид натрия и другие подобные вещества могут встречаться в ядрах некоторых планет, белых карликов и прочих звезд.
Как полагают ученые, гелид натрия и другие подобные вещества могут встречаться в ядрах некоторых планет, белых карликов и прочих звезд.
Натрий Модель Бора — Схема, шаги по рисованию
Натрий — химически активный металлический элемент. Он имеет атомный номер 11 и представлен символом Na. Он принадлежит к группе 1А периодической таблицы и, следовательно, является щелочным металлом. Он имеет серебристо-белый вид и существует в природе в виде минералов, таких как содалит, каменная соль, полевой шпат и т. д.
существенный элемент. Он также помогает поддерживать многие важные функции организма, такие как осмотическое равновесие, артериальное давление, объем крови и т. д.
Большинство из вас не знакомы с боровской моделью натрия. В этой статье я научу вас рисовать диаграмму Бора и объясню ее очень просто и элементарно.
Итак, приступим.
Модель Бора для натрия
Модель Бора-Резерфорда была дана в 1913 году после включения результатов Нила Бора в уже данную модель Бора.
Модель Бора представляет собой представление атомной структуры вместе со всеми атомными частицами в графической форме. Он иллюстрирует количество, а также расположение всех атомных видов внутри атома.
Чтобы понять модель атома Бора, мы должны сначала признать атомные частицы и их роль в атомной структуре. Термины, используемые в атомной модели Бора, приведены ниже:
• Ядро: Положительно заряженное тело, которое находится в центре атома, известно как ядро. Он состоит из положительно заряженных протонов и нейтральных нейтронов.
• Протоны: Это положительно заряженные частицы, находящиеся в ядре атома. Они были названы Эрнстом Резерфордом и обозначаются символом p + .
• Электроны: Это отрицательно заряженные частицы, вращающиеся вокруг ядра атома.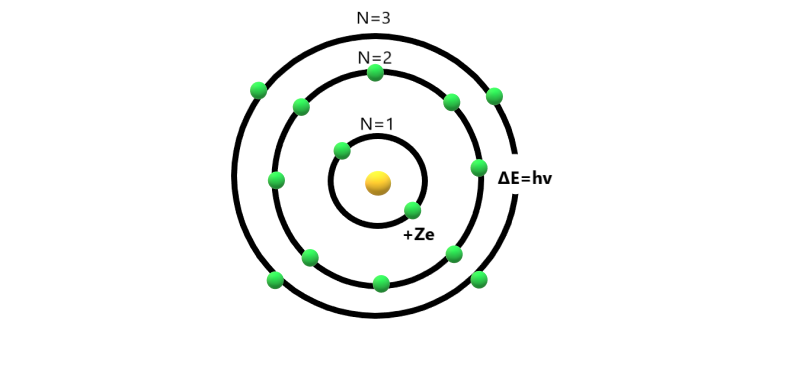 Модель Бора-Резерфорда постулирует, что электроны вращаются вокруг ядра по заданным круговым орбитам.
Модель Бора-Резерфорда постулирует, что электроны вращаются вокруг ядра по заданным круговым орбитам.
• Оболочка: Круговой путь электронов вокруг ядра называется оболочкой или орбитой. Это фиксированные дорожки, и количество электронов, которые могут разместиться на одной оболочке, также различаются.
Названия оболочек даются как K, L, M, N и т. д. или 1, 2, 3, 4, 5 и т. д., причем наименьший номер присваивается оболочке, расположенной ближе всего к ядру.
Согласно модели Бора-Резерфорда, оболочка, расположенная ближе всего к ядру, имеет минимальную энергию, и известно, что электроны, находящиеся в этой оболочке, находятся в основном состоянии. Электроны переходят на более высокие орбиты после поглощения определенного количества энергии.
Электроны, присутствующие во внешней оболочке ядра, обладают максимальной энергией и также известны как валентные электроны. Эти электроны принимают участие в образовании связей между различными атомами.
Атом натрия имеет 11 протонов, 12 нейтронов и 11 электронов. Электроны распределены в оболочках K, L и M вокруг ядра.
| Атом натрия | Значение |
| № протона | 11 |
| № нейтрона | 12 |
| Количество электронов | 11 |
| Количество снарядов | 3 |
| Количество электронов на первой (К) оболочке | 2 |
| Количество электронов во второй (L) оболочке | 8 |
| Количество электронов в третьей (М) оболочке | 1 |
| Количество валентных электронов | 1 |
Рисунок Бора Модель натрия
Натрий является щелочным металлом и принадлежит к группе 1A периодической таблицы: атомный номер натрия 11.
• Электронная конфигурация натрия 1s 2 2s 2 2p 6 3s 1 ..png?1464966794)
• Натрий обозначается символом Na.
• Атомная масса натрия 22,989.
Чтобы построить боровскую модель натрия, мы должны сначала выяснить число всех атомных частиц, присутствующих в атоме натрия.
Сначала определим количество протонов в атоме натрия.
Количество протонов всегда равно порядковому номеру атома.
В случае атома натрия атомный номер равен 11.
Следовательно, для атома натрия Число протонов = Атомный номер = 11
Теперь подсчитаем количество нейтронов, присутствующих в ядре атома натрия.
Формула для нахождения числа нейтронов в атоме выглядит следующим образом:
Количество нейтронов = Атомная масса (округление до ближайшего целого числа) – Количество протонов
Атомная масса натрий, как указано в таблице натрия, приведенной выше, составляет 22,989.
Теперь округлите эту цифру, чтобы получить ближайшее целое число.
Следовательно, атомная масса натрия может быть принята равной 23.
Теперь рассчитайте количество нейтронов по приведенной выше формуле:
Количество нейтронов в атоме натрия = 23 – 11 = 12 ядро атома состоит из нейтронов и протонов, мы можем нарисовать ядро атома натрия, используя приведенные выше данные.
На приведенном выше рисунке p + и n° обозначают соответственно положительно заряженные протоны и нейтральные нейтроны.
Теперь мы посчитаем количество электронов в атоме натрия.
Количество электронов также равно атомному номеру атома.
Следовательно, для атома натрия Число электронов = Атомный номер = 11
Это указывает на то, что в атоме натрия 11 электронов вращаются вокруг ядра. Теперь нам нужно разместить эти электроны вокруг ядра.
Максимальное количество электронов, допустимое в любой конкретной оболочке, определяется по следующей формуле:
Максимальное количество электронов в оболочке = 2n 2
Здесь n = количество оболочек
Теперь рассчитаем количество электронов для первой оболочки, т. е. K оболочки атома натрия:
е. K оболочки атома натрия:
Максимум число электронов в К-оболочке атома натрия = 2n 2 = 2 (1) 2 = 2
Таким образом, на К-оболочке может разместиться 2 электрона. После добавления оболочки K к ядру атома натрия его можно изобразить следующим образом:
Теперь мы рассчитаем количество электронов для второй оболочки, то есть L-оболочки атома натрия.
Максимальное число электронов в L-оболочке атома натрия = 2n 2 = 2 (2) 2 = 8
Таким образом, в L-оболочке атома натрия может разместиться 8 электронов.
Однако здесь следует отметить, что в любой оболочке, содержащей более 2 электронов (т. е. за исключением K-оболочки), первый из всех четырех электронов добавляется по часовой стрелке в точке 9.0° друг к другу.
После этого остальные электроны также добавляются в группу из четырех по часовой стрелке, хотя угол между электронами с каждым разом продолжает уменьшаться.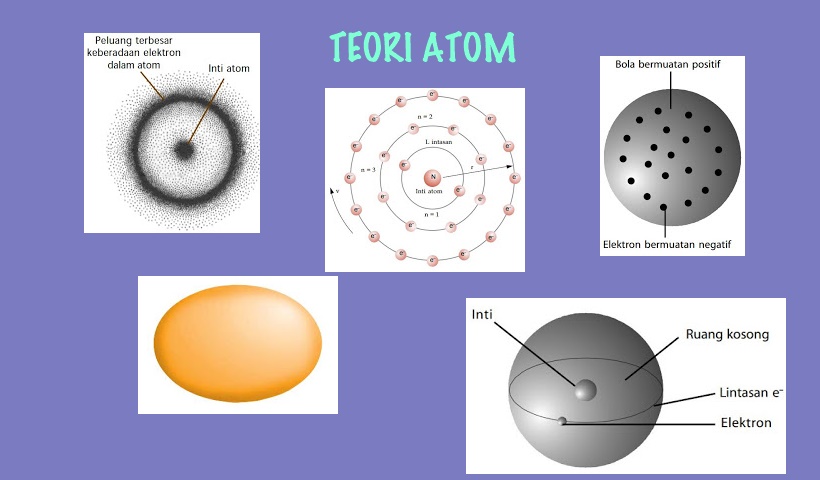
Итак, добавим первые четыре электрона на L-оболочку атома натрия, после чего она будет выглядеть следующим образом:
Теперь добавим оставшиеся четыре электрона на K-оболочку, опять же по часовой стрелке но под углом менее 90°.
Итак, атом натрия теперь выглядит так:
После этого у нас остался еще 1 электрон, который теперь будет размещен в М-оболочке.
Максимальное число электронов в М-оболочке атома натрия = 2n 2 = 2 (3) 2 = 18
Наконец, после добавления всех 11 электронов к ядру атома натрия можно нарисовано следующим образом:
Таким образом, окончательная Боровская модель атома натрия содержит 12 нейтронов и 11 протонов в ядре, и вокруг этого ядра вращается 12 электронов, из них 2 электрона в K-оболочке, 8 электронов в L-оболочке и 1 электрон в оболочке М.
Я приложил видео, чтобы объяснить то же самое. Посмотри.
youtube.com/embed/OEOer1tJEGY” frameborder=”0″ allowfullscreen=”allowfullscreen”>Связанная тема
Модель Бора Бора
Модель Бора Кремния
Получение структуры Льюиса натрия
Структура Льюиса атома представляет собой графическое изображение ядра вокруг его валентного электрона.
Здесь ядро представлено атомным символом атома, а точки вокруг ядра символизируют электроны. Это также известно как электронная точечная диаграмма.
Как видно из предыдущего раздела, атом натрия состоит из 1 валентного электрона. Таким образом, электронно-точечная структура натрия имеет вид:
Часто задаваемые вопросы (FAQ)
Вопрос: Является ли модель Бора абсолютно правильной?
Ответ: Не совсем правильно, но модель Бора правильно определяет многие характеристики атома.
Вопрос: Что не так с моделью Бора?
Ответ: Хотя с этой моделью может быть связано много сложностей, две основные проблемы заключаются в том, что она отлично работает для одноэлектронных атомов, таких как водород, но не так надежна для многоэлектронных атомов.
Кроме того, не учитываются подоболочки, а именно. s, p, d, f и т. д., когда речь идет о корпусе электронов.
Свойства натрия
Ниже приведены несколько важных свойств натрия:
• Натрий легко реагирует с водой с образованием гидроксида натрия и водорода.
• Он также реагирует с галогенидами металлов с образованием металлов и хлорида натрия.
• Температура кипения и плавления натрия составляет 883 °C и 97,5 °C соответственно.
• Плотность натрия 0,97 г/см 3 при 20 °C.
• Электроотрицательность натрия по шкале Полинга составляет 0,9.
Заключение
Согласно модели Бора, атом натрия состоит из 11 протонов, 11 электронов и 12 нейтронов.
Протоны и нейтроны присутствуют внутри ядра атома, благодаря чему оно приобретает положительный заряд.
Говорят, что электроны вращаются по определенной траектории вокруг ядра. Эти круговые пути известны как орбиты или оболочки.
Атомный номер атома всегда равен количеству протонов, а также количеству электронов в атоме.
Количество нейтронов в атоме определяется по формуле:
Количество нейтронов = Атомная масса (округление до целого числа) – Количество протонов
Электроны в атоме натрия расположены в 3 оболочках, а именно. K, L и M оболочки, содержащие 2, 8 и 1 электрон соответственно.
Максимальное количество электронов, которое может разместиться на оболочке, определяется формулой 2n 2 .
Модель Бора натрия. Как нарисовать диаграмму Бора для атома натрия (Na)
Главная > Химия > Модель Бора натрия протоны. Это ядро окружено трехэлектронными оболочками, называемыми K-оболочкой, L-оболочкой и М-оболочкой. Самая внешняя оболочка на диаграмме Бора натрия содержит только 1 электрон, который также называется валентным электроном.
| Name | Sodium Bohr Model |
| Number of neutrons | 12 |
| Number of protons | 11 |
| Количество электронов | 11 |
| Сумма электронных оболочек | 3 | 4 | 4 | 0023 Электрон в первой оболочке (K) | 2 |
| Электроны во второй оболочке (L) | 8 |
| 8 | |
Электрон. 1 1 | |
| Общее количество валентных электронов в натрии | 1 |
Модель Бора описывает визуальное представление малых электронов, вращающихся вокруг ядра. В нем использовались разные электронные оболочки, такие как K, L, M, N… и так далее. Эти оболочки содержат определенное количество электронов, электронная оболочка, ближайшая к ядру, имеет меньшую энергию, а электронная оболочка, наиболее удаленная от ядра, имеет большую энергию.
Диаграмма Бора очень интересна и легко рисуется. Здесь мы нарисуем диаграмму Бора атома натрия с помощью нескольких простых шагов.
Этапы рисования модели Бора атома натрия1. Найдите количество протонов, электронов и нейтронов в атоме натрия
Протоны — это положительно заряженные частицы, а нейтроны — незаряженные частицы. входят в состав ядер атомов. Электроны — это отрицательно заряженные частицы, вращающиеся вокруг ядра атома 9. 0003
0003
Чтобы узнать количество протонов, содержащихся в атоме, просто посмотрите на его атомный номер.
Если атомный номер атома 15, то и протон будет 15, если атомный номер 16, то и протон будет 16.
Итак, атомный номер натрия равен 11, следовательно протонов в атоме натрия тоже 11.
Теперь, чтобы определить количество нейтронов в атоме, используйте эту формулу.
⇒ Количество нейтронов в атоме 9.0024 = Атомная масса атома (округленная до ближайшего целого числа) – Количество протонов в атоме
Например, у атома 13,99 атомная масса и 6 протонов.
Затем, чтобы найти число нейтронов, округлите атомную массу почти до целого числа, таким образом, атомная масса 13,99 округлите до 14.
= (14 – 6 протонов) = 8 число нейтронов в атоме
Теперь Чтобы получить количество нейтронов в атоме натрия , посмотрите на его атомную массу, которая равна 22,9. 90 округляем до 23, а количество протонов в натрия равно 11.
90 округляем до 23, а количество протонов в натрия равно 11.
∴ Отсюда число нейтронов в атоме натрия = (23 – 11) = 12
Следует отметить, что электронов в нейтральном атоме равно числу протонов».
Итак, атом натрия нейтрален, следовательно, число его электронов будет равно числу протонов, которое, как мы уже обсуждали, равно 11 .
⇒ Количество электронов в натрии 9.0509 атом = 11
⇒ Количество протонов в атоме натрия = 11
⇒ Количество нейтронов в атоме натрия = 12
Читаем подробно – числа протонов, электронов, нейтроны?
2. Нарисуйте ядро атома
Ядро представляет собой плотную и маленькую область, содержащую количество протонов и нейтронов атома.
На этом шаге мы должны нарисовать маленький кружок, состоящий из числа протонов и числа нейтронов атома натрия.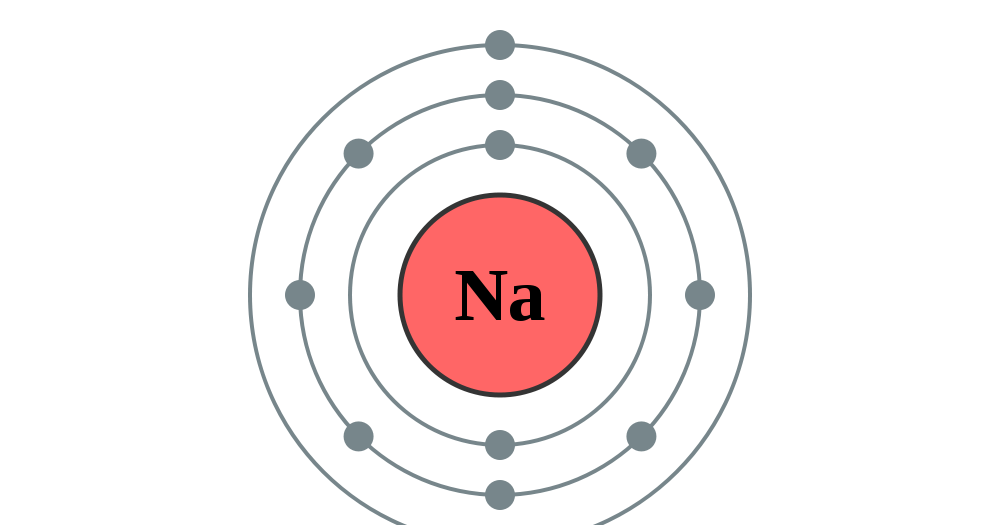
3. Нарисуйте первую электронную оболочку
«Электронную оболочку можно представить как орбиту, по которой следуют электроны вокруг ядра атома».
Первую электронную оболочку также называют К-оболочкой, это ближайшая к ядру атома оболочка, которая может содержать максимум два электрона.
Как мы знаем, у атома натрия всего 11 электронов. Итак, поместите два электрона из него, в первую оболочку, рядом друг с другом.
Мы успешно нарисовали первую оболочку атома натрия, которая может содержать 2 электрона. Так как атомы натрия имеют всего 11 электронов, то из 11 электронов мы использовали два электрона на первой оболочке.
∴ (11 – 2) = 9 электронов
Следовательно, у нас осталось 9 электронов, поместим их в следующие оболочки атома натрия.
4. Нарисуйте вторую электронную оболочку
Вторая оболочка, также называемая L-оболочкой, может содержать максимум 8 электронов. Эта оболочка рисуется после первой электронной оболочки.
Эта оболочка рисуется после первой электронной оболочки.
Во второй электронной оболочке электроны добавляются по одному, начиная с верхнего положения и затем двигаясь по часовой стрелке.
Во второй оболочке электроны добавляются по одному по часовой стрелке в положении часов – 12 часов, 3 часа, 6 часов, 9 часов.
После того, как вы разместите электроны по одному с каждой из четырех сторон (сверху – справа – снизу – слева), начните их спаривать или удваивать.
Итак, у нас осталось 9 электронов атома натрия, а 2-я оболочка может удерживать максимум 8 электронов.
Таким образом, поместите 8 электронов атома натрия во 2-ю электронную оболочку, начните с верхней позиции, размещайте электроны по одному и двигайтесь по часовой стрелке (сверху – справа – снизу – слева). И, наконец, соедините их.
Так как у атома натрия всего 11 электронов, и мы поместили 2 электрона на первую оболочку и 8 электронов на вторую оболочку, следовательно, у нас остался только 1 электрон больше.
Поместим его в следующую оболочку.
5. Нарисуйте третью электронную оболочку
Третья оболочка также называется М-оболочкой и способна удерживать до 18 электронов, но для элементов первых нескольких периодов третья оболочка удерживает только до 8 электронов.
«Можно считать, что третья оболочка содержит 8 или 18 электронов, но всего третья оболочка может содержать 18 электронов».
Для первых нескольких элементов, скажем, до атомного номера 20 в периодической таблице, третья оболочка содержит до 8 электронов.
⇒ Для атомного номера 20 или меньше 20 третья оболочка может содержать максимум 8 электронов.
⇒ Для атомного номера более 20, скажем, атомные номера 21, 22, 23, 24, 25, 26, 27 и т. д., третья оболочка заполнена более чем 8 электронами и до максимума 18 электронов.
Итак, у нас остался только 1 электрон атома натрия, просто поместите его в верхнее положение третьей оболочки.
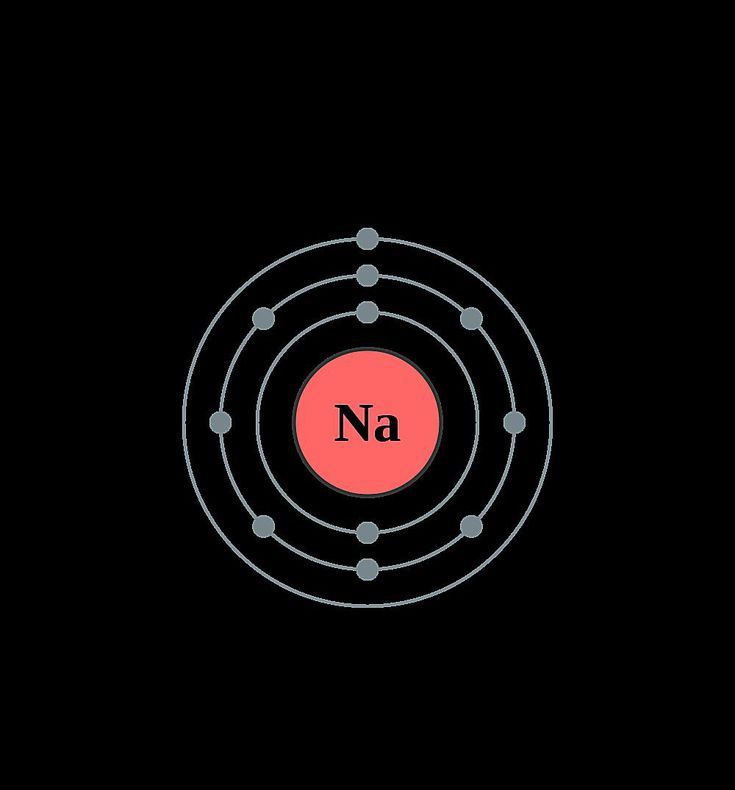
Вот и все, это наша модель Бора атома натрия , которая содержит 11 протонов и 12 нейтронов в области ядра, и 11 электронов вращаются вокруг ядра, два электрона на первой оболочке, восемь электронов на второй оболочке, и один электрон в третьей оболочке.
Читайте также:-
- Кислород Бор модель
- Бор модель
- Бериллий Бор модель
- Литий Бор модель
- Гелий Бор модель5 Nitrogen Bohr model
- Fluorine Bohr model
- Neon Bohr model
- Carbon Bohr model
- Magnesium Bohr model
- Silicon Bohr model
- Phosphorus Bohr model
- Sulfur Bohr model
- Chlorine Bohr model
- Argon Bohr model
- Алюминий Бор модель
- Калий Бор модель
- Кальций Бор модель
- Бром Бор модель
- Серебро Бор модель
- Мышьяк Бор модель
- Gold Bohr model
- Krypton Bohr model
- Iodine Bohr model
- Copper Bohr model
- Iron Bohr model
- Uranium Bohr model
- Nickel Bohr model
- Scandium Bohr model
- Titanium Bohr model
- Vanadium Bohr model
Найдите валентный электрон натрия по его диаграмме БораТакже проверьте: Модель Бора для каждого элемента Периодической таблицы
Валентные электроны находятся на внешней оболочке атома и могут принимать участие в образовании химической связи.
Эти электроны имеют большую энергию по сравнению с электронами внутренней оболочки.
Из диаграммы Бора атома мы можем легко найти количество валентных электронов в атоме, взглянув на его внешнюю оболочку.
Итак, нам нужно найти валентный электрон в атоме Натрия, для этого смотрим на его диаграмму Бора.
Диаграмма Бора для натрия имеет три электронных оболочки (K, L и M), внутренняя оболочка — это K-оболочка, а самая внешняя оболочка — это M-оболочка.
Следовательно, электроны, обнаруженные в М-оболочке атома натрия, являются его валентными электронами, поскольку это самая внешняя оболочка, также называемая валентной оболочкой.
М-оболочка или внешняя оболочка модели Бора натрия содержит только 1 электрон, поэтому число валентных электронов в атоме натрия также равно 1. Электронная точечная диаграмма, также называемая структурой Льюиса, представляет собой валентные электроны атомов. Как мы узнали из диаграммы Бора натрия, у него всего 1 валентный электрон. Итак, просто представьте 1-валентный электрон вокруг атома натрия в виде точки. « Электронная конфигурация – это распределение электронов атома или молекулы по атомным или молекулярным орбиталям» число 11 электронов. Из боровской модели натрия мы знаем, что 2 электрона находятся на К-оболочке, 8 электронов — на L-оболочке и 1 электрон — на М-оболочке. Итак, исходя из оболочки, электронная конфигурация атома натрия равна [2, 8, 1]. Или электронная конфигурация натрия: 1s 2 2s 2 2p 6 3s 1 3s 1 2s , так как он содержит в общей сложности 1 электрона на первой орбите , следующие два электрона на 2s-орбитали, следующие шесть электронов на 2p-орбитали, а оставшийся один электрон пойдет на 3s-орбиталь. S-орбиталь может содержать максимум 2 электрона, а P-орбиталь может содержать максимум 6 электронов. Читайте также:- Электронные оболочки, также называемые энергетическими уровнями. Вы можете найти количество электронных оболочек элемента, зная его номер периода в периодической таблице. Элементы или атомы в первом периоде таблицы Менделеева имеют один энергетический уровень или одну электронную оболочку, так же как элементы во втором периоде имеют два энергетических уровня или двухэлектронную оболочку и так далее… Итак, Атом натрия принадлежит к Самая внешняя оболочка, также называемая валентной оболочкой, содержит валентные электроны атома. Согласно диаграмме Бора натрия, внешняя оболочка представляет собой М-оболочку, которая содержит только 1 валентный электрон.
Часто задаваемые вопросы Сколько электронных оболочек содержит модель Бора натрия? 
Свойства натрия Какова внешняя оболочка диаграммы Бора атома натрия?
Резюме 

 Эти электроны имеют большую энергию по сравнению с электронами внутренней оболочки.
Эти электроны имеют большую энергию по сравнению с электронами внутренней оболочки.