Модели атома.
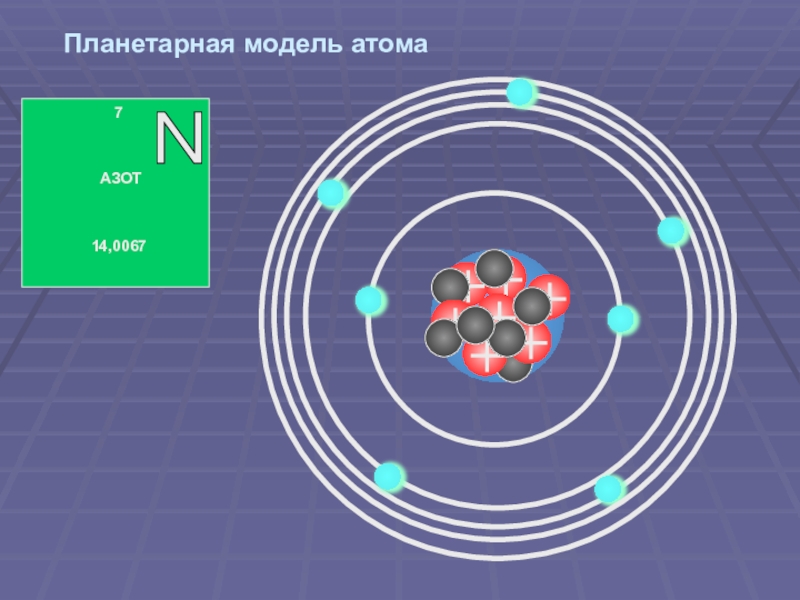
Модели атома
Рис. 1.4. Первые модели строения атома, а-модель «сливового пудинга» (Томсон, 1904 г.), согласно которой атом представляет собой положительно заряженную сферу с внедренными в нее электронами; б-ядерная модель атома (Резерфорд, 1911 г.), согласно которой положительно заряженное ядро окружено облаком электронов; в планетарная модель атома (Бор, 1913 г.), согласно которой электроны движутся вокруг ядра по круговым орбитам.
Следовательно, чем больше энергия кванта, тем выше частота излучения.
В 1905 г. Альберт Эйнштейн постулировал, что любое излучение состоит из дискретных частиц-квантов излучения, называемых фотонами. Он использовал это представление, чтобы объяснить, почему поверхность металлов, облучаемая светом, при определенных условиях испускает электроны (явление получило название фотоэлектрический эффект).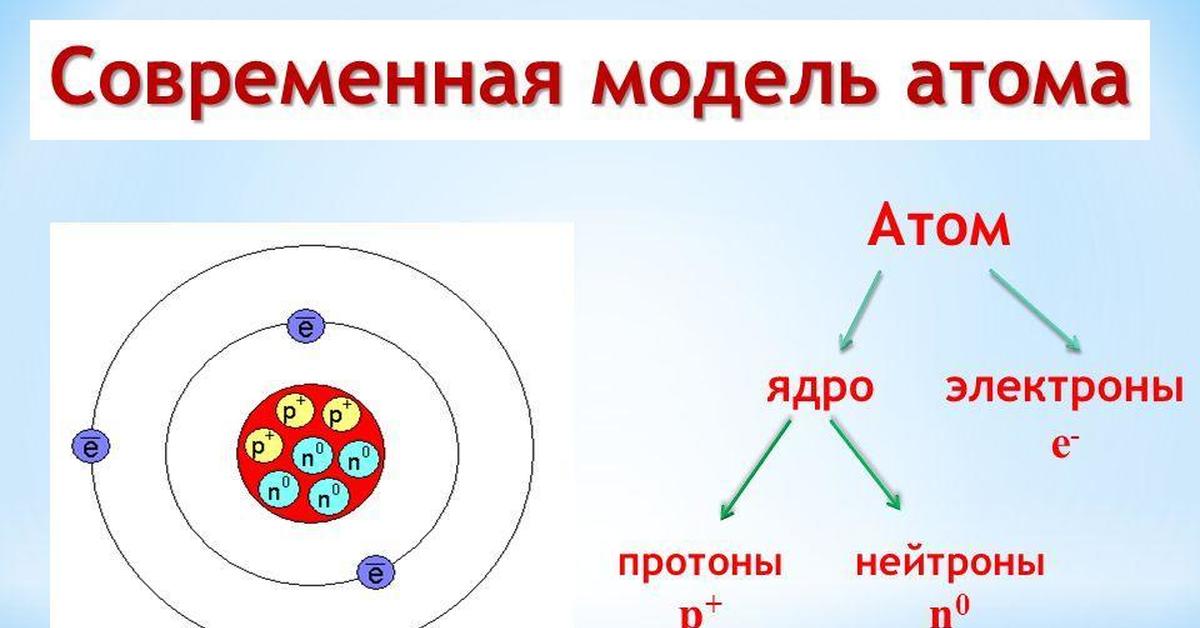
В результате возникло представление о двойственной природе (корпускулярно-вол-новом дуализме) света. Свет может проявлять свои волновые свойства, о чем свидетельствуют, например, его интерференция и дифракция, но может обладать и свойствами пучка частиц (корпускул), как это проявляется в фотоэлектрическом эффекте.
В 1924 г. Луи де Бройль распространил это представление о корпускулярно-волно-вом дуализме на электроны. Впоследствии было экспериментально установлено, что пучок электронов может создавать интерференционную либо дифракционную картину подобно пучку света. Это открытие привело к созданию квантовой механики. Квантовая механика основывалась на атомной модели Бора, а также на принципе запрета Паули (Вольфганг Паули, 1925 г.). Этот принцип точно предопределял расположение электронов на дискретных энергетических уровнях вокруг ядра.
В 1926 г. Эрвин Шредингер предложил для описания движения субатомных частиц свое знаменитое волновое уравнение. Вскоре после этого в 1927 г. был сформулирован принцип неопределенности Гейзенберга. Согласно этому принципу, положение и скорость субатомной частицы не поддаются одновременному определению с абсолютной точностью. В каждый момент времени точно можно определить лишь одно из этих двух свойств.
был сформулирован принцип неопределенности Гейзенберга. Согласно этому принципу, положение и скорость субатомной частицы не поддаются одновременному определению с абсолютной точностью. В каждый момент времени точно можно определить лишь одно из этих двух свойств.
В 1925 г. Вернер Гейзенберг использовал в своей теоретической работе по квантовой механике матричный математический метод. Кульминацией развития квантовой механики явилась работа Поля Дирака. Дирак развил матричную формулировку квантовой механики, и это позволило ему теоретически объяснить корпускулярно-вол-новой дуализм. Он показал, что в некоторых ситуациях интенсивность волны в какой-либо точке пространства эквивалентна плотности частиц в ней. В других ситуациях плотность частиц настолько низка, что можно вообще пренебречь их волновой природой. Такой подход позволил Дираку предсказать существование спина электрона, а также античастиц, таких, как позитрон. Работа Дирака ознаменовала новую эру в теории строения атома.
Оглавление:
Первые модели строения атома – Справочник химика 21
Атом давно перестал быть неделимым. После открытия естественной радиоактивности, катодных лучей и электронов были предложены первые модели строения атомов. Согласно модели первооткрывателя электрона Томсона (1904) атом представляет собой сферу положительного электричества одинаковой плотности пО всему объему диаметром порядка 0,1 нм. Электроны как бы плавают в этой сфере, нейтрализуя положительный заряд. Колебательное движение электронов возбуждает в пространстве электромагнитные волны. Экспериментальную проверку этих наглядных представлений предпринял английский физик Эрнест Резерфорд в-своих знаменитых опытах по рассеянию а-частиц (ядра атома гелия). Схема установки Резерфорда (1907) приведена на рис. 8. Радиоактивный препарат Р излучает а-частицы ( снаряды ) в виде узкого пучка, на пути движения которого ставится тонкая золотая фольга Ф. Регистрация а-частиц, прошедших через фольгу, производится микроскопом М на люминесцирующем экране Э по вспышке световых точек сцинтилляция).
В 1910 г. датский ученый Н.Бор, используя модель Резерфорда и теорию Планка, предложил модель строения атома водорода, согласно которой электроны двигаются вокруг ядра не по любым, а лишь по разрешенным орбитам, на которых электрон обладает определенными энергиями. При переходе электрона с одной орбиты на другую атом поглощает или испускает энергию в виде квантов. Каждая орбита имеет номер и (1, 2, 3, 4,. ..), который назвали главным квантовым числом. Бор вычислил радиусы орбит. Радиус первой орбиты был 5,29-10 м, радиус других орбит был равен [c.19]
Ядерная модель атома. Одна из первых моделей строения атома была предложена английским физиком Э. Резерфордом. В опытах по рассеянию а-частиц было показано, что почти вся масса атома сосредоточена в очень малом объеме — положительно заряженном ядре.
Магнитные свойства ферромагнитных материалов определяются магнитными свойствами многоэлектронного атома. Однако далеко не все материалы с многоэлектронными атомами обладают ферромагнитными свойствами. Строение атомов ферромагнитных материалов имеет ряд особенностей. Атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны, образующие электронные слои и оболочки. Число электронных слоев определяют главным квантовым числом, которое принимает целые значения 1, 2, 3,. .., п. Число оболочек в слое выражают орбитальным квантовым числом I и обозначают их буквами 8, р, планетарная модель атома железа, из которого видно, что в атоме содержится четыре электронных слоя.
Одну из первых моделей строения атома предложил английский-физик Дж. Дж. Томсон (1904 г.). Он предположил, что атом представляет собой положительно заряженную сферическую частицу, внутри которой распределены электроны, компенсирующие положительный заряд этой частицы. Электроны распределены равномерно и колеблются относительно своих равновесных положений, при химических реакциях электроны могут переходить от одних атомов-к другим с образованием заряженных частиц — ионов. Эта первая модель строения атома получила впоследствии название пудинга Томсона (электроны, вставленные в положительно заряженную сферу, выглядели наподобие изюминок в пудинге ).
Н.
 Бор в 1913 г. впервые четко сформулировал вывод, что классическая электродинамика недостаточна для описания систем атомного размера [42]. Этот вывод привел его к разработке квантовой теории строения атома водорода в качестве первого шага и далее — к построению формальных моделей атомов всех элементов периодической системы. Применив к атомной теории постоянную Планка, Бор сформулировал два основных постулата 1) атом может существовать, не излучая, в определенных стационарных состояниях, характеризующихся определенными
Бор в 1913 г. впервые четко сформулировал вывод, что классическая электродинамика недостаточна для описания систем атомного размера [42]. Этот вывод привел его к разработке квантовой теории строения атома водорода в качестве первого шага и далее — к построению формальных моделей атомов всех элементов периодической системы. Применив к атомной теории постоянную Планка, Бор сформулировал два основных постулата 1) атом может существовать, не излучая, в определенных стационарных состояниях, характеризующихся определенными Первым основополагающим достижением в области изучения внутреннего строения вещества было создание модели атома английским физиком Резерфордом (1911 г.). По Резерфорду атом состоит из ядра, окруженного электронной оболочкой. Выдающийся датский физик теоретик Вор использовал представления Резерфорда и созданную немецким физиком Плаиком (1900 г.) квантовую теорию для разработки в 1913 г. теории водородоподобного атома и первой квантовой модели атома модель атома Бора, см.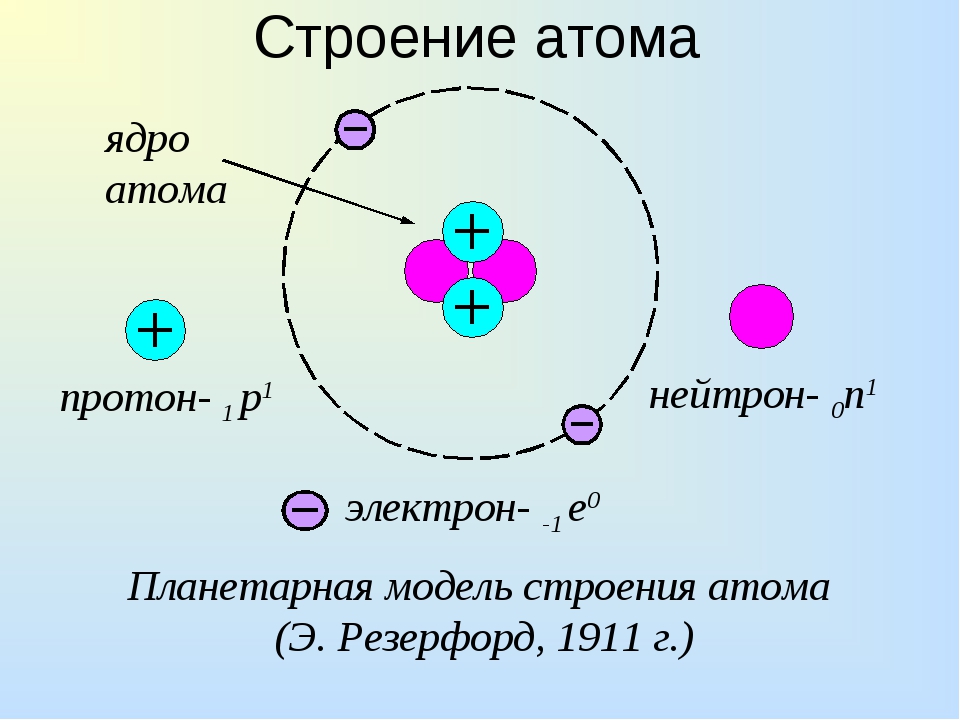
Атом элемента представляет собой одну из важнейших микрочастиц. Первые исследователи ее строения (Н.Бор, А. Зоммерфельд, 1912, 1913) положили в основу внутриатомной энергетики представления теории квант. Электромагнитное поле атомного ядра квантовано, т. е. имеет дискретное строение в самой природе структуры атома заложены определенные энергетические уровни. В соответствии с ними электрон, рассматриваемый как частица, согласно теории Бора, движется вокруг ядра по круговым или эллиптическим орбитам, напоминая движение планет вокруг Солнца.
Преимущество метода МО над методом валентных связей состоит очевидно в том, что в основе первого лежит модель, которая в известной степени правильно передает внутреннее строение химических соединений. Клементи следующим образом характеризует преимущества метода МО он использует расчетную методику, которая может быть апробирована на примерах атомов. Электронная теория молекул принципиально и практически должна быть применима к предельному случаю — атому. Электроны не меняют своей природы при переходе от атомов к молекулам И для описания различных [c.90]
Открытие субатомных частиц и первые модели атома. В 1897 г. Дж. Томсон (Англия) открыл электрон, а в 1909 г. Р. Малликен определил его заряд, который равен 1,6-10 Кл. Масса электрона составляет 9,1 М0 г. В 1904 г. Дж. Томсон предложил модель строения атома, согласно которой атом можно представить в виде положительно заряженной сферы с вкрапленными электронами. [c.17]
Масса электрона составляет 9,1 М0 г. В 1904 г. Дж. Томсон предложил модель строения атома, согласно которой атом можно представить в виде положительно заряженной сферы с вкрапленными электронами. [c.17]
Говоря о первоначальных атомных моделях, мы должны отметить весьма любопытное обстоятельство, на которое мало обращали внимание историки учения о строении вещества. Именно, еще в 1901 г. Ж. Перреп опубликовал работу Ядерно-планетарная структура атома [20]. Согласно Перрену, атом должен состоять из положительно заряженного ядра, окруженного отрицательными электронами, которые двигаются по определенным орбитам , со скоростями, соответствующими частотам световых волн . Иными словами, Перрен предвосхитил основные структурные моменты будущей резерфордовской модели атома. Однако идея Перрена оказалась явно не своевременной, она не нашла, да и не могла вызвать никакого резонанса. Во-первых, потому, что был совершенно неясен вопрос о носителе положительного заряда в атоме (никаких прямых или косвенных экспериментальных данных на сей счет не существовало) во-вторых, модель Перрена противоречила представлениям классической электродинамики (это противоречие имело место и в резерфордовской модели, но оно было своевременно преодолено Н. Бором, применившим к строению атомов планковскую гипотезу о квантах). [c.237]
Бором, применившим к строению атомов планковскую гипотезу о квантах). [c.237]
Для достаточно полного обзора экспериментального материала по конформациям органических молекул, по-видимому, не хватит объема даже большой книги. Поэтому имеет смысл обсудить лишь обш,ие принципы и основные закономерности, характеризующие конформационные особенности молекул различных классов. Рассмотренная в предыдущей главе механическая модель обладает достаточной общностью, чтобы на ее основе можно было бы понять конформации молекул самого разного химического строения. Но как бы ни было построено изложение, пропуск большого числа экспериментальных данных неизбежен. Во-первых, не во всех молекулах геометрия определяется взаимодействиями, описываемыми атом-атом потенциалами в металлоорганических соединениях, например, большую роль играют слабые взаимодействия типа координационных связей. Во-вторых, если включить в рассмотрение все молекулы, к которым приложимы общие принципы конформационного анализа, то изложение могло бы вырасти до непомерных размеров.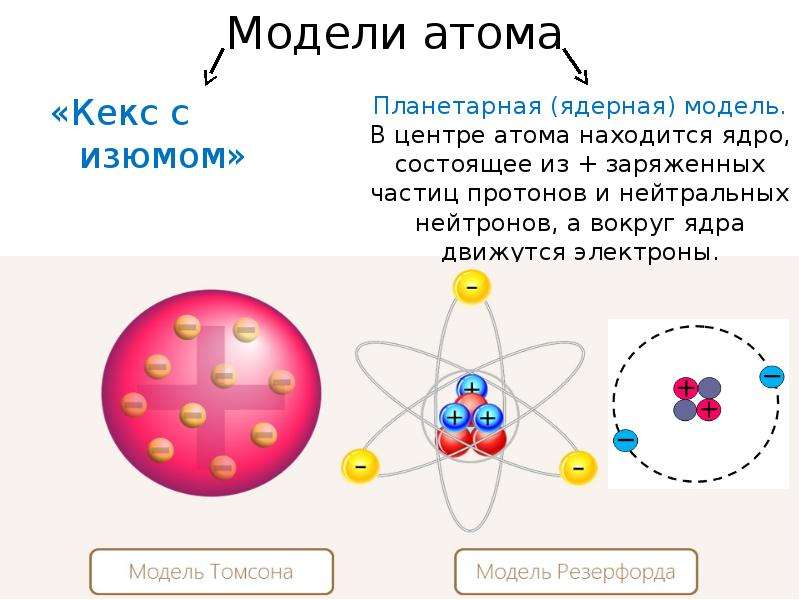 Поэтому за пределами нашего внимания остаются такие интересные органические системы, как стероиды, биологически активные молекулы типа ацетилхолина, никотина и некоторые другие. [c.146]
Поэтому за пределами нашего внимания остаются такие интересные органические системы, как стероиды, биологически активные молекулы типа ацетилхолина, никотина и некоторые другие. [c.146]
Строение хлорангидридов фосфиновых кислот (ЬХХХУП) доказано химическими и физическими способами [109, 706, 1035]. На основании данных хроматографии и спектров ПМР показано, что реакция этинилвиниловых эфиров, и тиоэфиров с пятихлористым фосфором в описанных условиях протекает стереоспецифично и приводит к образованию аддуктов, у которых атомы водорода при первом и втором атомах углерода находятся в транс-расположении. Ввиду того, что исходные этинилвиниловые эфиры и тиоэфиры имеют г г/с-конфигурацию, допускается, что цис — тракс-изомеризация происходит в ходе реакции присоединения пятихлористого фосфора [109]. Возможно, что реакция осуществляется путем электрофильной атаки РС14 [1037] на тройную связь с последующим переходом аниона хлора к третьему атому углерода внутри образовавшегося катиона.
 Последний стабилизован показанными на схеме электронными сдвигами и поэтому утратил геометрическую конфигурацию исходного бутенина. Атом хлора вступает в наиболее выгодное стерическое положение, что приводит к т >акс-расположению водородных атомов при 1,2-двойной связи. Высказанные соображения подтверждаются при построении атомной модели Бриглеба — Стюарда исследованных соединений, причем наиболее благоприятным является трйнс-размещение атома хлора и фосфонильной группы [c.308]
Последний стабилизован показанными на схеме электронными сдвигами и поэтому утратил геометрическую конфигурацию исходного бутенина. Атом хлора вступает в наиболее выгодное стерическое положение, что приводит к т >акс-расположению водородных атомов при 1,2-двойной связи. Высказанные соображения подтверждаются при построении атомной модели Бриглеба — Стюарда исследованных соединений, причем наиболее благоприятным является трйнс-размещение атома хлора и фосфонильной группы [c.308]Одна из первых моделей строения атома была предложена Дж. Томсоном в 1903 г. Атом представлялся как море положительного электричества с колеблющимися в нем электронами. Суммарный отрицательный заряд электронов электронейтрального атома приравнивался его суммарному положительному за-рядз. [c.38]
Томсон в 1904 г. математически разработал аналогичную модель атома. Его статья имеет очень выразительное заглавие О строении атома исследование устойчивости и периодов колебания совокупности корпускул, расположенных с равными интервалами по окружности круга с применением результатов к теории атомного строения [2]. Согласно Томсону, положительный заряд атома распределен равномерно по всему его объему, тогда как корпускулы (так Томсон называет электроны) занимают внутри атома некоторое определенное положение. Томсон показывает расчетом, что такая модель атома может быть устойчива лишь при расположении корпускул либо в серии концентрических колец (если корпускулы вынуждены двигаться в одной плоскости), либо в ряде концентрических сфер (если допустить, что они могут двигаться во всех направлениях). Стабильность кольца (или сферы) достигается только при определенном числе корпускул в них в этом случае атом не способен удерживать дополнительно ни положительный, ни отрицательный заряд. Распределив все атомы в ряд (следуя порядку увеличения числа корпускул), мы получим сначала систему, которая ведет себя подобно атому одновалентного электроположительного элемента следующая система ведет себя подобно атому двухвалентного электроположительного элемента, в то время как на другом конце ряда у нас имеется система, которая ведет себя подобно нульвалентному атому ей непосредственно предшествует система, которая ведет себя подобно атому одновалентного электроотрицательного элемента, тогда как ей в свою очередь предшествует система, ведущая себя подобно атому двухвалентного электроотрицательного элемента [там же, стр.
Согласно Томсону, положительный заряд атома распределен равномерно по всему его объему, тогда как корпускулы (так Томсон называет электроны) занимают внутри атома некоторое определенное положение. Томсон показывает расчетом, что такая модель атома может быть устойчива лишь при расположении корпускул либо в серии концентрических колец (если корпускулы вынуждены двигаться в одной плоскости), либо в ряде концентрических сфер (если допустить, что они могут двигаться во всех направлениях). Стабильность кольца (или сферы) достигается только при определенном числе корпускул в них в этом случае атом не способен удерживать дополнительно ни положительный, ни отрицательный заряд. Распределив все атомы в ряд (следуя порядку увеличения числа корпускул), мы получим сначала систему, которая ведет себя подобно атому одновалентного электроположительного элемента следующая система ведет себя подобно атому двухвалентного электроположительного элемента, в то время как на другом конце ряда у нас имеется система, которая ведет себя подобно нульвалентному атому ей непосредственно предшествует система, которая ведет себя подобно атому одновалентного электроотрицательного элемента, тогда как ей в свою очередь предшествует система, ведущая себя подобно атому двухвалентного электроотрицательного элемента [там же, стр.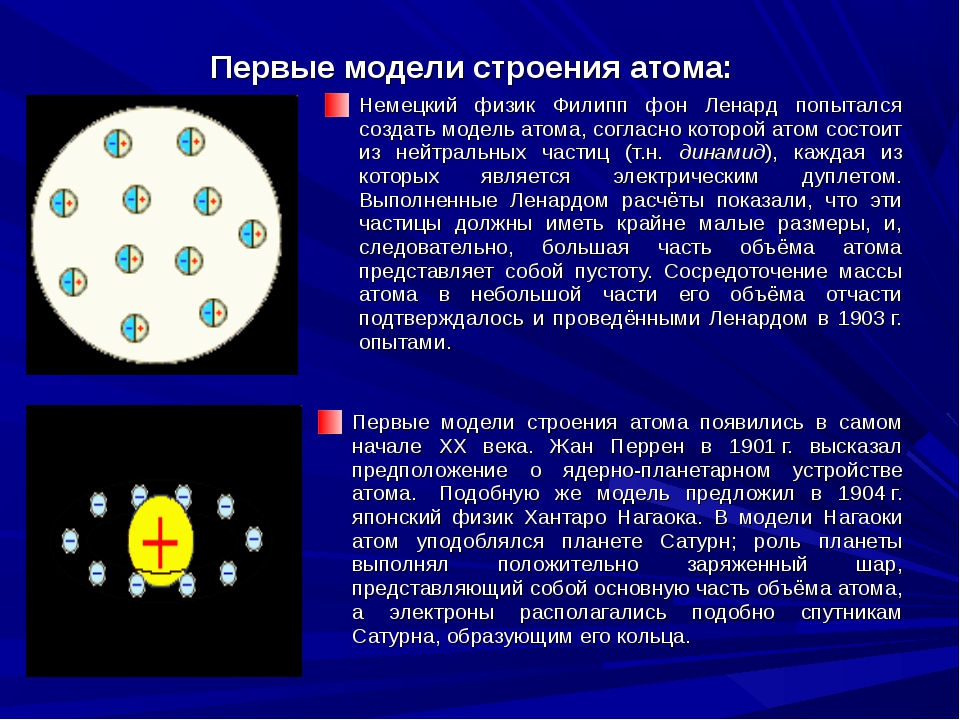 262]. С глубокой проницательностью Томсон проводит далее аналогию между таким накоплением корпускул и свойствами элементов в двух первых периодах от гелия до неона и от неона до аргона. [c.29]
262]. С глубокой проницательностью Томсон проводит далее аналогию между таким накоплением корпускул и свойствами элементов в двух первых периодах от гелия до неона и от неона до аргона. [c.29]
До 1912 г. выдвигались модели строения атома, которые были лишь частично удовлетворительными. Томсоновская модель, согласно которой атом должен быть похож на арбуз, представляла собой первую попытку как-то описать положение электронов в атоме, но эта модель не позволяла объяснить многие свойства атомов. Резерфорд выдвинул модель атома, предполагающую вращение электронов вокруг ядра по орбитам (рис. 5.2). Если обозначить заряд электрона q , а заряд протона (ядра атома водорода) массу электрона т и радиус орбиты г, то выполняется условие [c.68]
Как же расположены все эти частицы внутри атома Представляет ли атом беспорядочную смесь частиц или же строение его строго определенное Первая попытка ответить на этот вопрос была сделана Дж. Томсоном. Он предположил, что атом представляет собой миниатюрный шар, внутри которого равномерно распределено положительное электричество, а также расположены электроны.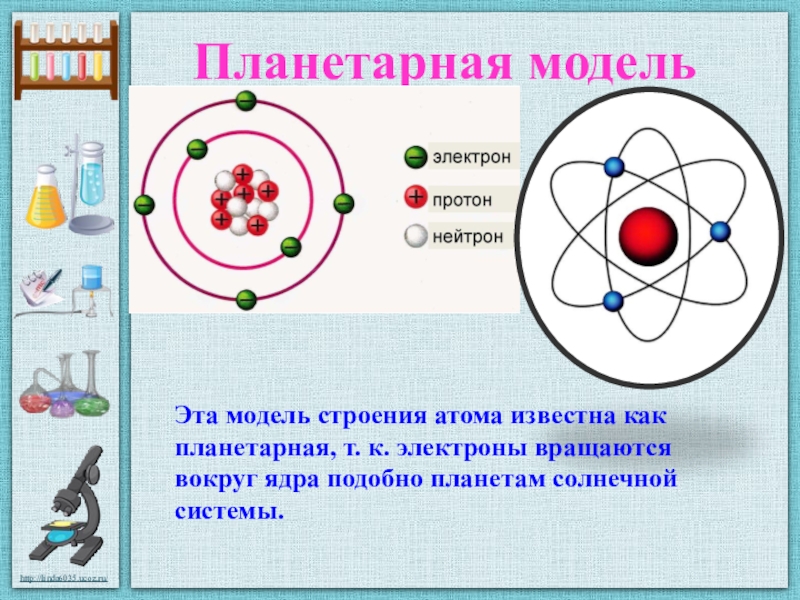 Эта модель, получившая название пудинга с изюмом , продержалась очень короткое время. [c.226]
Эта модель, получившая название пудинга с изюмом , продержалась очень короткое время. [c.226]
Модель атома водорода, предложенная Н. Бором (1913 г.), является первой попыткой количественного изображения строения и внутреннего механизма атома, поясняющая все экспериментальные данные, главным образом частоты линий испускаемых спектров. Атом водорода изображен в виде солнечной системы в миниатюре, в которой солнде представлено протоном с элементарным зарядом -fe, а планета — электроном с элементарным зарядом —е, вращающимся вокруг протона по круговой орбите радиуса г. Согласно закону Кулона, между этими двумя частицами развивается сила притяжения В своем дви- [c.57]
В общем, энергия деформации валентного угла столь незначительна, что отклонения порядка 0° могут быть вызваны уже тепловой энергией. Это означает, что даже столь высокосимметричные молекулы, как метан, постоянно обнаруживают относительно большие отклонения от симметричного положения равновесия.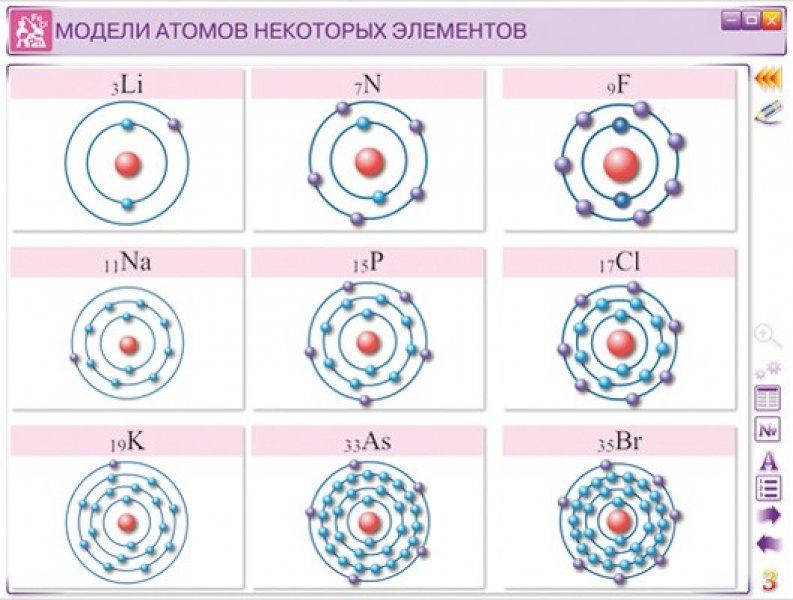 Однако это не может служить поводом для отказа от тетраэдрической модели атома углерода . Свойственное атому углерода стремление к регулярно-тетраэдрическому расположению при использовании его четырех связей, 5р -гибридизацию, следует рассматривать как основной принцип пространственного строения всех соединений углерода. Важнейшим и исторически первым доказательством этого служит явление оптической активности, изложению которой посвящен следуюищй раздел. [c.83]
Однако это не может служить поводом для отказа от тетраэдрической модели атома углерода . Свойственное атому углерода стремление к регулярно-тетраэдрическому расположению при использовании его четырех связей, 5р -гибридизацию, следует рассматривать как основной принцип пространственного строения всех соединений углерода. Важнейшим и исторически первым доказательством этого служит явление оптической активности, изложению которой посвящен следуюищй раздел. [c.83]
Модель атома водорода, предложенная Н. Бором (1913 г.), является первой попыткой количественного изображения строения и внутреннего механизма атома, поясняющая все экспериментальные данные, главным образом частоты линий испускаемых спектров. Атом водорода изображен в виде солнечной системы в миниатюре, в которой солнце представлено протоном с элементарным зарядом – -е, а планета — электроном с элементарным зарядом —е, вращающимся вокруг протона по круговой орбите радиуса г. Согласно закону Кулона, между этими двумя частицами развивается сила притяжения е 1г . В своем движении по орбите электрон остается в равновесии благодаря центробежной силе, которая долнша равняться силе притяжения между частицами, следовательно, [c.57]
В своем движении по орбите электрон остается в равновесии благодаря центробежной силе, которая долнша равняться силе притяжения между частицами, следовательно, [c.57]
Какие модели строения атома вы знаете?
Известно множество моделей строения атома. Кратко рассмотрим некоторые (наиболее известные) из них. В 1902 году У. Кельвином была предложена первая модель строения атома. Его рассматривали в форме шара, равномерно заряженного положительным электричеством. Внутри атома, согласно данной модели, неподвижно располагались электроны. В 1902 – 1903 годах Дж. Дж. Томсон усовершенствовал модель У. Кельвина. Он рассчитал, что самое благоприятное расположение электронов в положительно заряженном облаке будет в том случае, если электроны будут претерпевать движение по оболочкам. Данная модель существовала 9 лет в качестве единственно верной. Она позволила дать обоснование таким явлениям как: дисперсия, поляризация атомов, электропроводность металлов, но модель Кельвина-Томсона не могла ответить на вопрос: почему же атомы имеют такую большую устойчивость и могут существовать в свободном сколь угодно долгое время.
Резерфордом была опровергнута первая теория строения атома. В 1907 году он создал планетарную модель, согласно которой строение атома схоже со строением солнечной системы. В центре каждого атома химического элемента располагается положительно заряженное ядро, имеющее радиус приблизительно равный 10-10 м, вокруг которого подобно планетам по орбитам вращаются электроны. Практически вся масса атома сосредоточена в ядре. Данная модель не смогла объяснить все свойства атомов.
Следующим шагом с развитии учения о теориях строения атома является квантовая модель, предложенная Н. Бором. Она основывается на следующих постулатах:
1. Отрицательно заряженная частица – электрон вращается вокруг ядра лишь по строго определенным (стационарным) круговым орбитам.
2. Атомная система способна находиться только в определённых стационарных или квантовых состояниях, каждому из которых соответствует некоторая энергия Е (атом не излучает энергию в стационарных состояниях).
3. Испускание или поглощение энергии имеет место только в случае перехода атома из одного стационарного состояния (основного или возбужденного) в другое. Энергия данного кванта электромагнитного излучения при переходе из стационарного состояния с энергией Еm в состояние с энергией Еn определяется разностью энергий данного атома в двух квантовых состояниях:
Энергия данного кванта электромагнитного излучения при переходе из стационарного состояния с энергией Еm в состояние с энергией Еn определяется разностью энергий данного атома в двух квантовых состояниях:
∆Е = Еm – Еn = hν, где v – частота излучения, h = 6,62 ∙ 10-34 Дж ∙с – постоянная Планка.
Рассмотрим современную теорию строения атома. Ее основой является дополненная и усовершенствованная планетарная модель. В состав ядра атома химического элемента входят протоны (положительно заряженные частицы) и нейроны (не имеющие заряда частицы, но обладающие массой). Вокруг атомного ядра по неопределённым траекториям движутся отрицательно заряженные частицы – электроны.
Какую модель строения атома предложил резерфорд. Некоторые исторические и современные модели атома
Исторические модели1 атома отражают уровни знаний, соответствующие определённому периоду развития науки.
Первый этап развития моделей атома характеризовался отсутствием экспериментальных данных о его строении.
Объясняя явления микромира, учёные искали аналогии в макромире, опираясь на законы классической механики.
Дж. Дальтон – создатель химической атомистики (1803 г.), предполагал, что атомы одного и того же химического элемента представляют собой одинаковые шарообразные мельчайшие, а следовательно, неделимые частицы.
Французский физик Жан Батист Перрен (1901 г.) предложил модель, фактически предвосхитившую “планетарную” модель. Согласно этой модели в центре атома расположено положительно заряженное ядро, вокруг которого движутся по определённым орбитам, как планеты вокруг Солнца, отрицательно заряженные электроны. Модель Перрена не привлекла внимания учёных, так как давала только качественную, но не количественную характеристику атома (на рис. 7 это показано несоответствием заряда ядра атома числу электронов).
В 1902 г. английский физик Уильям Томсон (Кельвин) разработал представление об атоме как о положительно заряженной сферической частице, внутри которой совершают колебания (излучая и поглощая энергию) отрицательно заряженные электроны. Кельвин обратил внимание на то, что число электронов равно положительному заряду сферы, поэтому в целом атом не имеет электрического заряда (рис. 7).
Кельвин обратил внимание на то, что число электронов равно положительному заряду сферы, поэтому в целом атом не имеет электрического заряда (рис. 7).
Годом позже немецкий физик Филипп Ленард предложил модель, согласно которой атом – полая сфера, внутри которой находятся электрические диполи (динамиды). Объём, занимаемый этими диполями, значительно меньше объёма сферы, и основная часть атома оказывается незаполненной.
По представлениям японского физика Гонтаро (Хантаро) Нагаоки (1904 г.), в центре атома находится положительно заряженное ядро, а электроны движутся в пространстве вокруг ядра в плоских кольцах, напоминающих кольца планеты Сатурн (эта модель называлась “сатурнианским” атомом). Большинство учёных не обратили внимания на идеи Нагаоки, хотя они в какой-то мере перекликаются с современным представлением об атомной орбитали.
Ни одна из рассмотренных моделей (рис. 7) не объясняла, каким образом свойства химических элементов связаны со строением их атомов.
Рис. 7. Некоторые исторические модели атома
В 1907 г. Дж. Дж. Томсон предложил статическую модель строения атома, представлявшую атом как заряженную положительным электричеством шарообразную частицу, в которой равномерно распределены отрицательно заряженные электроны (модель “пудинга “, рис. 7).
Математические расчёты показали, что электроны в атоме должны находиться на концентрически расположенных кольцах. Томсон сделал весьма важный вывод: причина периодического изменения свойств химических элементов связана с особенностями электронного строения их атомов. Благодаря этому, модель атома Томсона была высоко оценена современниками. Однако она не объясняла некоторых явлений, например, рассеяния α-частиц при прохождении их через металлическую пластину.
На основании своих представлений об атоме Томсон вывел формулу для расчёта среднего отклонения α-частиц, и этот расчёт показал, что вероятность рассеяния таких частиц под большими углами близка к нулю. Однако экспериментально было доказано, что приблизительно одна из восьми тысяч падающих на золотую фольгу α-частиц отклоняется на угол больше 90°. Это противоречило модели Томсона, которая предполагала отклонения только на малые углы.
Однако экспериментально было доказано, что приблизительно одна из восьми тысяч падающих на золотую фольгу α-частиц отклоняется на угол больше 90°. Это противоречило модели Томсона, которая предполагала отклонения только на малые углы.
Эрнест Резерфорд, обобщая экспериментальные данные, в 1911 г. предложил “планетарную” (её иногда называют “ядерной”) модель строения атома, согласно которой 99,9 % массы атома и его положительный заряд сосредоточены в очень маленьком ядре, а отрицательно заряженныеэлектроны, число которых равно заряду ядра, вращаются вокруг него, подобно планетам Солнечной системы1 (рис. 7).
Резерфорд вместе со своими учениками поставил опыты, позволившие исследовать строение атома (рис. 8). На поверхность тонкой металлической (золотой) фольги 2 от источника радиоактивного излучения 1 направлялся поток положительно заряженных частиц (α-частицы). На их пути был установлен флуоресцирующий экран 3, позволяющий наблюдать за направлением дальнейшего движения α-частиц.
Рис. 8. Опыт Резерфорда
Было установлено, что большинство α-частиц проходило сквозь фольгу, практически не меняя своего направления. Лишь отдельные частицы (в среднем одна из десяти тысяч) отклонялись и летели почти в обратном направлении. Был сделан вывод, что бóльшая часть массы атома сосредоточена в положительно заряженном ядре, поэтому α-частицы так сильно отклоняются (рис. 9).
Рис. 9. Рассеивание α-частиц атомным ядром
Движущиеся в атоме электроны в соответствии с законами электромагнетизма должны излучать энергию и, теряя её, притягиваться к противоположно заряженному ядру и, следовательно, “падать” на него. Это должно приводить к исчезновению атома, но так как этого не происходило, был сделан вывод о неадекватности этой модели.
В начале XX века немецкими физиком Максом Планком и физиком-теоретиком Альбертом Эйнштейном была создана квантовая теория света. Согласно этой теории лучистая энергия, например свет, испускается и поглощается не непрерывно, а отдельными порциями (квантами). Причём величина кванта энергии неодинакова для разных излучений и пропорциональна частоте колебаний электромагнитной волны: Е = hν, гдеh – постоянная Планка, равная 6,6266·10 –34 Дж·с, ν – частота излучения. Эту энергию несут частицы света – фотоны .
Причём величина кванта энергии неодинакова для разных излучений и пропорциональна частоте колебаний электромагнитной волны: Е = hν, гдеh – постоянная Планка, равная 6,6266·10 –34 Дж·с, ν – частота излучения. Эту энергию несут частицы света – фотоны .
Пытаясь искусственно соединить законы классической механики и квантовой теории, датский физик Нильс Бор в 1913 г. дополнил модель атома Резерфорда двумя постулатами о скачкообразном (дискретном) изменении энергии электронов в атоме. Бор считал, что электрон в атоме водорода может находиться лишь на вполне определённых стационарных орбитах , радиусы которых относятся друг к другу как квадраты натуральных чисел (1 2: 2 2: 3 2: … : п 2 ). Электроны движутся вокруг атомного ядра по стационарным орбитам. Атом пребывает в устойчивом состоянии, не поглощая и не излучая энергию, – это первый постулат Бора. Согласно второму постулату излучение энергии происходит только при переходе электрона на более близкую к атомному ядру орбиту.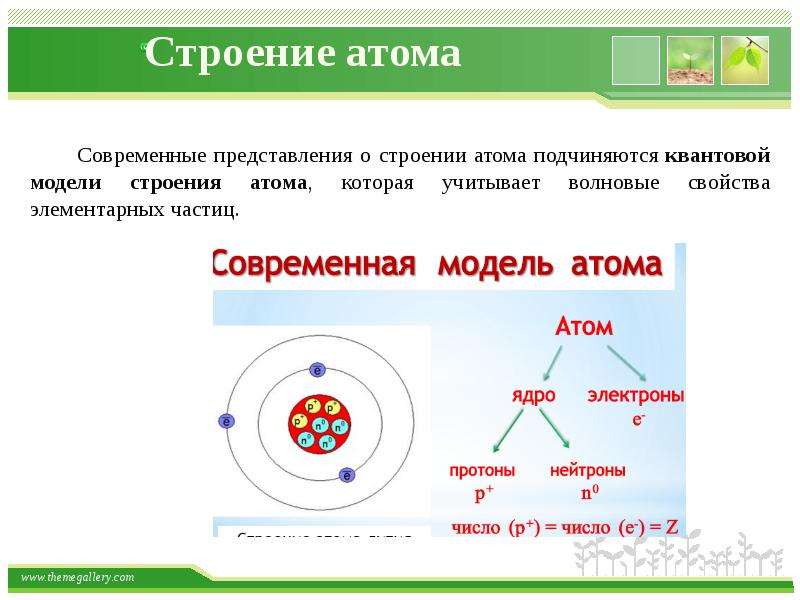 При переходе электрона на более отдалённую орбиту энергия атомом поглощается. Эта модель была усовершенствована в 1916 г. немецким физиком-теоретиком Арнольдом Зоммерфельдом, указавшим на движение электронов по эллиптическим орбитам .
При переходе электрона на более отдалённую орбиту энергия атомом поглощается. Эта модель была усовершенствована в 1916 г. немецким физиком-теоретиком Арнольдом Зоммерфельдом, указавшим на движение электронов по эллиптическим орбитам .
Планетарная модель, благодаря своей наглядности и постулатам Бора, долгое время использовалась для объяснения атомно-молекулярных явлений. Однако оказалось, что движение электрона в атоме, устойчивость и свойства атома, в отличие от движения планет и устойчивости Солнечной системы, нельзя описать законами классической механики. В основе этой механики лежат законы Ньютона, и предметом её изучения является движение макроскопических тел, совершаемое со скоростями, малыми по сравнению со скоростью света. Для описания строения атома необходимо применять представления квантовой (волновой) механики о двойственной корпускулярно-волновой природе микрочастиц, которые сформулировали в 1920-е годы физики-теоретики: француз Луи де Бройль, немцы Вернер Гейзенберг и Эрвин Шрёдингер, англичанин Поль Дирак и др.
В 1924 году Луи де Бройль выдвинул гипотезу о наличии у электрона волновых свойств (первый принцип квантовой механики) и предложил формулу для вычисления его длины волны. Стабильность атома объясняется тем, что электроны в нём движутся не по орбитам, а в неких областях пространства вокруг ядра, называемых атомными орбиталями. Электрон занимает практически весь объём атома и не может “упасть на ядро”, находящееся в его центре.
В 1926 году Шрёдингер, продолжая развитие идей Л. де Бройля о волновых свойствах электрона, эмпирически подобрал математическое уравнение, похожее на уравнение колебания струны, с помощью которого можно вычислять энергии связи электрона в атоме на разных энергетических уровнях. Это уравнение стало основным уравнением квантовой механики.
Открытие волновых свойств электрона показало, что распространение знаний о макромире на объекты микромира неправомерно. В 1927 г. Гейзенберг установил, что невозможно определить точное положение в пространстве электрона, имеющего определённую скорость, поэтому представления о движении электрона в атоме носят вероятностный характер (второй принцип квантовой механики).
Квантово-механическая модель атома (1926 г.) описывает состояние атома посредством математических функций и не имеет геометрического выражения (рис. 10). В такой модели не рассматриваются динамический характер устройства атома и вопрос о размере электрона как частицы. Считается, что электроны занимают определённые энергетические уровни и излучают или поглощают энергию при переходах на другие уровни. На рис. 10 энергетические уровни изображены схематически в виде концентрических колец, расположенных на разных расстояниях от атомного ядра. Стрелками показаны переходы электронов между энергетическими уровнями и излучение фотонов, сопровождающих эти переходы. Схема показана качественно и не отражает реальных расстояний между энергетическими уровнями, которые могут отличаться между собой в десятки раз.
В 1931 году американским учёным Гилбертом Уайтом впервые были предложены графическое представление атомных орбиталей и “орбитальная” модель атома (рис. 10). Модели атомных орбиталей используются для отражения понятия “электронная плотность” и демонстрации распределения отрицательного заряда вокруг ядра в атоме или системы атомных ядер в молекуле.
Рис. 10. Исторические и современные модели атома
В 1963 году американский художник, скульптор и инженер Кеннет Снельсон предложил “кольцегранную модель” электронных оболочек атома (рис. 10), которая объясняет количественное распределение электронов в атоме по устойчивым электронным оболочкам. Каждый электрон моделируется кольцевым магнитом (или замкнутым контуром с электрическим током, имеющим магнитный момент). Кольцевые магниты притягиваются друг к другу и образуют симметричные фигуры из колец – кольцегранники . Наличие у магнитов двух полюсов накладывает ограничение на возможные варианты сборки кольцегранников. Модели устойчивых электронных оболочек – это наиболее симметричные фигуры из колец, составленные с учётом наличия у них магнитных свойств.
Наличие у электрона спина (см. раздел 5) является одной их основных причин образования в атоме устойчивых электронных оболочек. Электроны образуют пары с противоположными спинами. Кольцегранная модель электронной пары, или заполненной атомной орбитали, – это два кольца, расположенных в параллельных плоскостях с противоположных сторон от атомного ядра. При расположении около ядра атома более одной пары электронов кольца-электроны вынужденно взаимно ориентируются, образуя электронную оболочку. При этом близко расположенные кольца имеют разные направления магнитных силовых линий, что обозначается разным цветом колец, изображающих электроны.
При расположении около ядра атома более одной пары электронов кольца-электроны вынужденно взаимно ориентируются, образуя электронную оболочку. При этом близко расположенные кольца имеют разные направления магнитных силовых линий, что обозначается разным цветом колец, изображающих электроны.
Модельный эксперимент показывает, что самой устойчивой из всех возможных кольцегранных моделей является модель из 8 колец. Геометрически модель образована таким образом, как будто атом в виде сферы поделили на 8 частей (трижды разделив пополам) и в каждую часть поместили по одному кольцу-электрону. В кольцегранных моделях используют кольца двух цветов: красного и синего, которые отражают положительное и отрицательное значение спина электрона.
“Волногранная модель” (рис. 10) похожа на “кольцегранную” с тем отличием, что каждый электрон атома представлен “волновым” кольцом, которое содержит целое число волн (как это было предложено Л. де Бройлем).
Взаимодействие электронов электронной оболочки на этой модели атома показано совпадением точек контакта синих и красных “волновых” колец с узлами стоячих волн.
Модели атома имеют право на существование и границы применения. Всякая модель атома – это приближение, отражающее в упрощённой форме определённую часть знаний об атоме. Но ни одна из моделей не отражает полностью свойств атома или его составляющих частиц.
Многие модели сегодня представляют только исторический интерес. При построении моделей объектов микромира учёные опирались на то, что можно непосредственно наблюдать. Так появились модели Перрена и Резерфорда (аналогия со строением Солнечной системы), Нагаоки (некое подобие планеты Сатурн), Томсона (“пудинг с изюмом”). Некоторые идеи были отброшены (динамичная модель Ленарда), к другим через некоторое время вновь обращались, но уже на новом, более высоком теоретическом уровне: модели Перрена и Кельвина получили развитие в моделях Резерфорда и Томсона. Представления о строении атома постоянно совершенствуются. Насколько точна современная – “квантово-механическая” модель – покажет время. Именно поэтому в верхней части спирали, символизирующей путь познания, нарисован вопросительный знак (рис. 7).
7).
Стали важным шагом в развитии физики. Огромное значение имела модель Резерфорда. Атом как система и частицы, его составляющие, был изучен более точно и подробно. Это привело к успешному становлению такой науки, как ядерная физика.
Античные представления о строении вещества
Предположение о том, что окружающие тела состоят из мельчайших частиц, были высказаны еще в античные времена. Мыслители того времени представляли атом в виде мельчайшей и неделимой частицы любого вещества. Они утверждали, что нет во Вселенной ничего меньшего по размеру, чем атом. Таких взглядов придерживались великие древнегреческие ученые и философы – Демокрит, Лукреций, Эпикур. Гипотезы этих мыслителей сегодня объединены под названием «античный атомизм».
Средневековые представления
Времена античности прошли, и в средние века также были ученые, которые высказывали различные предположения о строении веществ. Однако преобладание религиозных философских взглядов и власть церкви в тот период истории на корню пресекали любые попытки и стремления человеческого разума к материалистическим научным выводам и открытиям.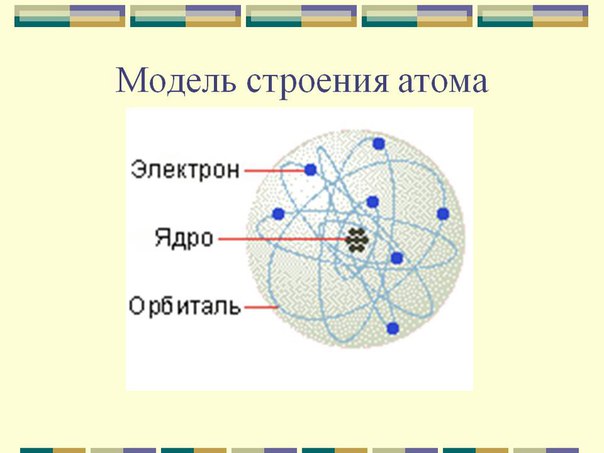 Как известно, средневековая инквизиция весьма недружелюбно вела себя с представителями научного мира того времени. Остается сказать, что у тогдашних светлых умов было пришедшее из античности представление о неделимости атома.
Как известно, средневековая инквизиция весьма недружелюбно вела себя с представителями научного мира того времени. Остается сказать, что у тогдашних светлых умов было пришедшее из античности представление о неделимости атома.
Исследования 18-19 веков
18 столетие было отмечено серьезными открытиями в области элементарного строения вещества. Во многом благодаря стараниям таких ученых, как Антуан Лавуазье, Михаил Ломоносов и Независимо друг от друга они сумели доказать, что атомы действительно существуют. Но вопрос об их внутреннем строении оставался открытым. Конец 18 века был отмечен таким знаменательным событием в научном мире, как открытие Д. И. Менделеевым периодической системы химических элементов. Это стало по-настоящему мощным прорывом того времени и приоткрыло завесу над пониманием того, что все атомы имеют единую природу, что они родственны друг другу. В дальнейшем, в 19 веке, еще одним важным шагом на пути к разгадке строения атома стало доказательство того, что в составе любого из них присутствует электрон.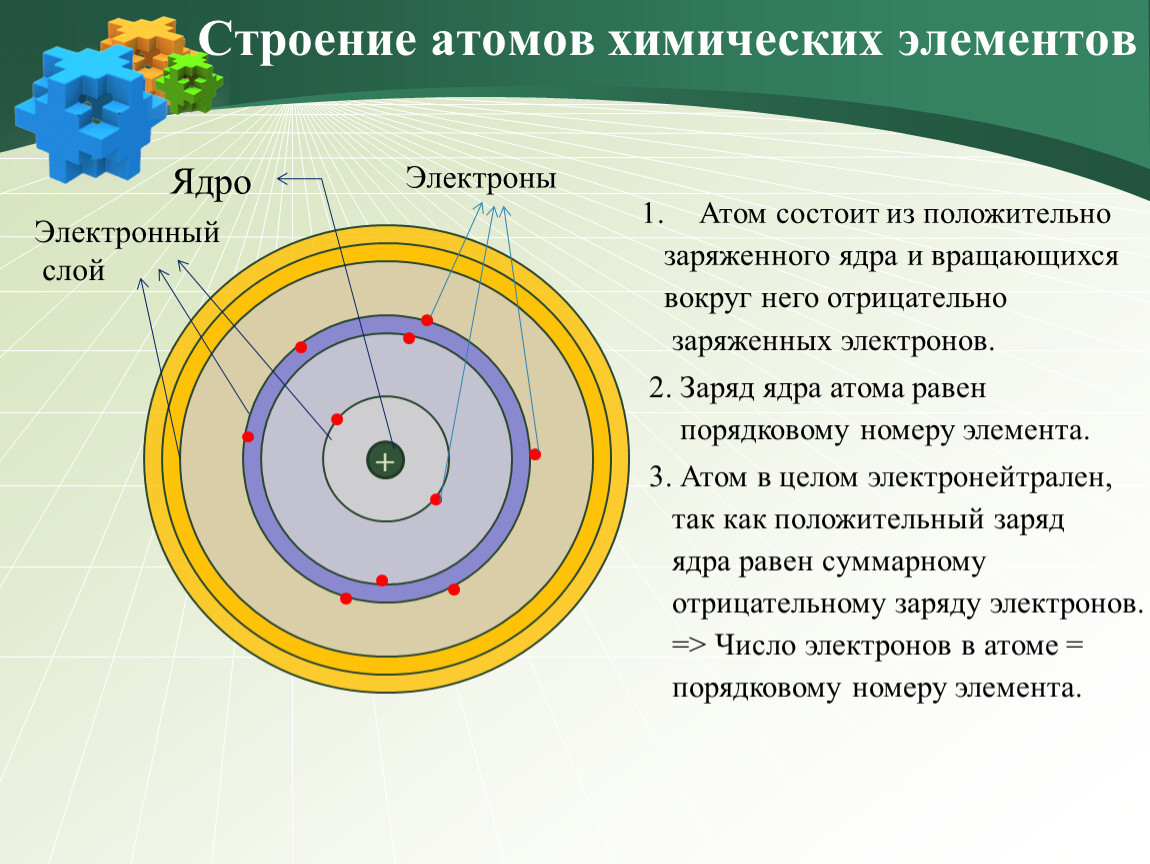 Работа ученых этого периода подготовила благодатную почву для открытий 20-го века.
Работа ученых этого периода подготовила благодатную почву для открытий 20-го века.
Эксперименты Томсона
Английский физик Джон Томсон в 1897 году доказал, что в состав атомов входят электроны с отрицательным зарядом. На этом этапе ложные представления о том, что атом – предел делимости любого вещества, были окончательно разрушены. Как же Томсон сумел доказать существование электронов? Ученый в своих опытах помещал в сильно разреженные газы электроды и пропускал электрический ток. В результате возникали катодные лучи. Томсон тщательно изучил их особенности и обнаружил, что они являются потоком заряженных частиц, которые движутся с огромной скоростью. Ученый сумел высчитать массу этих частиц и их заряд. Он также выяснил, что их нельзя преобразовать в нейтральные частицы, поскольку электрический заряд – это основа их природы. Так были Томсон является и создателем первой в мире модели строения атома. Согласно ей, атом – это сгусток положительно заряженной материи, в которой равномерно распределены отрицательно заряженные электроны. Такое строение объясняет общую нейтральность атомов, так как противоположные заряды уравновешивают друг друга. Опыты Джона Томсона стали неоценимо важными для дальнейшего изучения строения атома. Однако многие вопросы оставались без ответа.
Такое строение объясняет общую нейтральность атомов, так как противоположные заряды уравновешивают друг друга. Опыты Джона Томсона стали неоценимо важными для дальнейшего изучения строения атома. Однако многие вопросы оставались без ответа.
Исследования Резерфорда
Томсон открыл существование электронов, но он не сумел найти в атоме положительно заряженных частиц. исправил это недоразумение в 1911 году. Во время экспериментов, изучая активность альфа-частиц в газах, он обнаружил, что в атоме присутствуют частицы, положительно заряженные. Резерфорд увидел, что при прохождении лучей сквозь газ или через тонкую металлическую пластину происходит резкое отклонение незначительного количества частиц от траектории движения. Их буквально отбрасывало назад. Ученый догадался, что такое поведение объясняется столкновением с положительно заряженными частицами. Такие эксперименты позволили физику создать модель строения атома Резерфорда.
Планетарная модель
Теперь представления ученого несколько отличались от предположений, высказанных Джоном Томсоном. Разными стали и их модели атомов. позволил ему создать совершенно новую теорию в этой области. Открытия ученого имели решающее значение для дальнейшего развития физики. Модель Резерфорда описывает атом как ядро, расположенное в центре, и движущиеся вокруг него электроны. Ядро обладает положительным зарядом, а электроны – отрицательным. Модель атома по Резерфорду предполагала вращение электронов вокруг ядра по определенным траекториям – орбитам. Открытие ученого помогло объяснить причину отклонения альфа-частиц и стало толчком к развитию ядерной теории атома. В модели атома Резерфорда прослеживается аналогия с движением планет Солнечной системы вокруг Солнца. Это очень точное и яркое сравнение. Поэтому модель Резерфорда, атом в которой движется вокруг ядра по орбите, была названа планетарной.
Разными стали и их модели атомов. позволил ему создать совершенно новую теорию в этой области. Открытия ученого имели решающее значение для дальнейшего развития физики. Модель Резерфорда описывает атом как ядро, расположенное в центре, и движущиеся вокруг него электроны. Ядро обладает положительным зарядом, а электроны – отрицательным. Модель атома по Резерфорду предполагала вращение электронов вокруг ядра по определенным траекториям – орбитам. Открытие ученого помогло объяснить причину отклонения альфа-частиц и стало толчком к развитию ядерной теории атома. В модели атома Резерфорда прослеживается аналогия с движением планет Солнечной системы вокруг Солнца. Это очень точное и яркое сравнение. Поэтому модель Резерфорда, атом в которой движется вокруг ядра по орбите, была названа планетарной.
Работы Нильса Бора
Двумя годами позже датский физик Нильс Бор попытался объединить представления о строении атома с квантовыми свойствами светового потока. Ядерная модель атома Резерфорда была положена ученым в основу его новой теории. По предположению Бора, атомы вращаются вокруг ядра по круговым орбитам. Такая траектория движения приводит к ускорению электронов. Кроме того, кулоновское взаимодействие этих частиц с центром атома сопровождается созданием и расходованием энергии для поддержания пространственного электромагнитного поля, возникающего из-за движения электронов. При таких условиях отрицательно заряженные частицы должны когда-нибудь упасть на ядро. Но этого не происходит, что указывает на большую устойчивость атомов как систем. Нильс бор понял, что законы классической термодинамики, описанные уравнениями Максвелла, не работают во внутриатомных условиях. Поэтому ученый поставил перед собой задачу вывести новые закономерности, которые были бы справедливы в мире элементарных частиц.
По предположению Бора, атомы вращаются вокруг ядра по круговым орбитам. Такая траектория движения приводит к ускорению электронов. Кроме того, кулоновское взаимодействие этих частиц с центром атома сопровождается созданием и расходованием энергии для поддержания пространственного электромагнитного поля, возникающего из-за движения электронов. При таких условиях отрицательно заряженные частицы должны когда-нибудь упасть на ядро. Но этого не происходит, что указывает на большую устойчивость атомов как систем. Нильс бор понял, что законы классической термодинамики, описанные уравнениями Максвелла, не работают во внутриатомных условиях. Поэтому ученый поставил перед собой задачу вывести новые закономерности, которые были бы справедливы в мире элементарных частиц.
Постулаты Бора
Во многом благодаря тому, что существовала модель Резерфорда, атом и его составляющие были неплохо изучены, Нильс Бор смог подойти к созданию своих постулатов. Первый из них гласит о том, что атом имеет при которых он не изменяет свою энергию, а электроны при этом движутся по орбитам, не меняя своей траектории.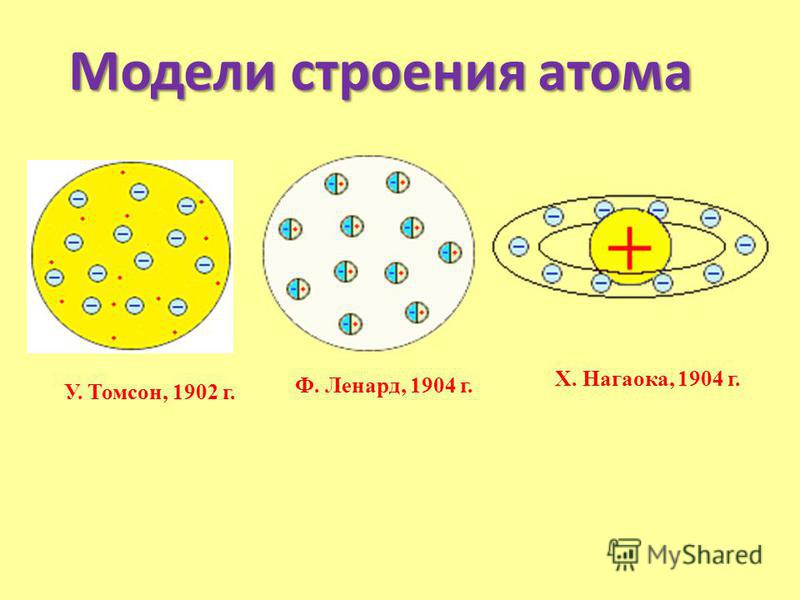 Согласно второму постулату, при переходе электрона с одной орбиты на другую происходит выделение или поглощение энергии. Она равна разности энергий предшествующего и последующего состояний атома. При этом, если электрон перепрыгивает на более близкую к ядру орбиту, то происходит излучение и наоборот. Несмотря на то что движение электронов мало напоминает орбитальную траекторию, расположенную строго по окружности, открытие Бора позволило получить великолепное объяснение существованию линейчатого спектра Приблизительно в это же время ученые-физики Герц и Франк, жившие в Германии, подтвердили учение Нильса Бора о существовании стационарных, стабильных состояний атома и возможность изменения значений атомной энергии.
Согласно второму постулату, при переходе электрона с одной орбиты на другую происходит выделение или поглощение энергии. Она равна разности энергий предшествующего и последующего состояний атома. При этом, если электрон перепрыгивает на более близкую к ядру орбиту, то происходит излучение и наоборот. Несмотря на то что движение электронов мало напоминает орбитальную траекторию, расположенную строго по окружности, открытие Бора позволило получить великолепное объяснение существованию линейчатого спектра Приблизительно в это же время ученые-физики Герц и Франк, жившие в Германии, подтвердили учение Нильса Бора о существовании стационарных, стабильных состояний атома и возможность изменения значений атомной энергии.
Сотрудничество двух ученых
Кстати, Резерфорд длительное время не мог определить Ученые Марсден и Гейгер попытались осуществить перепроверку утверждений Эрнеста Резерфорда и в результате подробных и тщательных экспериментов и расчетов пришли к выводу о том, что именно ядро является важнейшей характеристикой атома, и в нем сосредоточен весь его заряд.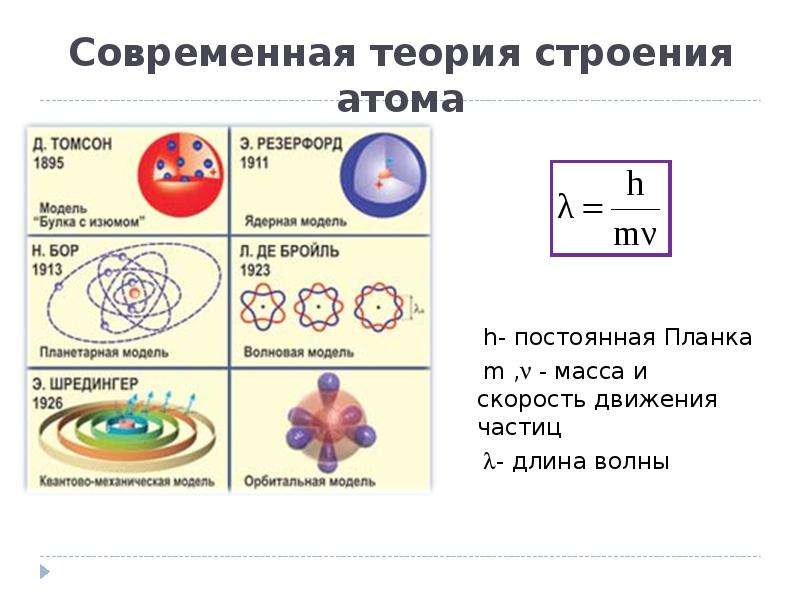 В дальнейшем было доказано, что значение заряда ядра численно равно порядковому номеру элемента в периодической системе элементов Д. И. Менделеева. Интересно, что Нильс Бор вскоре познакомился с Резерфордом и полностью согласился с его взглядами. В последующем ученые длительно работали вместе в одной лаборатории. Модель Резерфорда, атом как система, состоящая из элементарных заряженных частиц, – все это Нильс Бор посчитал справедливым и навсегда отложил в сторону свою электронную модель. Совместная научная деятельность ученых была очень успешной и принесла свои плоды. Каждый из них углубился в изучение свойств элементарных частиц и сделал значимые для науки открытия. Позже Резерфорд обнаружил и доказал возможность разложения ядра, но это уже тема другой статьи.
В дальнейшем было доказано, что значение заряда ядра численно равно порядковому номеру элемента в периодической системе элементов Д. И. Менделеева. Интересно, что Нильс Бор вскоре познакомился с Резерфордом и полностью согласился с его взглядами. В последующем ученые длительно работали вместе в одной лаборатории. Модель Резерфорда, атом как система, состоящая из элементарных заряженных частиц, – все это Нильс Бор посчитал справедливым и навсегда отложил в сторону свою электронную модель. Совместная научная деятельность ученых была очень успешной и принесла свои плоды. Каждый из них углубился в изучение свойств элементарных частиц и сделал значимые для науки открытия. Позже Резерфорд обнаружил и доказал возможность разложения ядра, но это уже тема другой статьи.
Древнегреческие и древнеиндийские учёные и философы считали, что все окружающие нас вещества состоят из мельчайших частиц, которые не делятся.
Они были уверены, что в мире не существует ничего, что было бы меньше этих частиц, которые они назвали атомами . И, действительно, впоследствии существование атомов было доказано такими известными учёными, как Антуан Лавуазье, Михаил Ломоносов, Джон Дальтон. Неделимым атом считали вплоть до конца XIX – начала ХХ века, когда выяснилось, что это не так.
Открытие электрона. Модель атома Томсона
Джозеф Джон Томсон
В 1897 г. английский физик Джозеф Джон Томсон, изучая экспериментально поведение катодных лучей в магнитном и электрическом полях, выяснил, что эти лучи представляют собой поток отрицательно заряженных частиц. Скорость движения этих частиц была ниже скорости света. Следовательно, они имели массу. Откуда же они появлялись? Учёный предположил, что эти частицы входят в состав атома. Он назвал их корпускулами . Позже они стали называться электронами . Так открытие электрона положило конец теории о неделимости атома.
Модель атома Томсона
Томсон предложил первую электронную модель атома. Согласно ей атом представляет собой шар, внутри которого находится заряженное вещество, положительный заряд которого равномерно распределён по всему объёму. А в это вещество, как изюминки в булочке, вкраплены электроны. В целом атом электрически нейтрален. Эту модель назвали “моделью сливового пудинга”.
Но модель Томсона оказалась неверной, что было доказано британским физиком сэром Эрнестом Резерфордом.
Опыт Резерфорда
Эрнест Резерфорд
Как же всё-таки устроен атом? На этот вопрос Резерфорд дал ответ после своего эксперимента, проведенного в 1909 г. совместно с немецким физиком Гансом Гейгером и новозеландским физиком Эрнстом Марсденом.
Опыт Резерфорда
Целью опыта было исследование атома с помощью альфа-частиц, сфокусированный пучок которых, летящий с огромной скоростью, направлялся на тончайшую золотую фольгу. За фольгой располагался люминесцентный экран. При столкновении с ним частиц возникали вспышки, которые можно было наблюдать в микроскоп.
При столкновении с ним частиц возникали вспышки, которые можно было наблюдать в микроскоп.
Если Томсон прав, и атом состоит из облака с электронами, то частицы должны были легко пролетать через фольгу, не отклоняясь. Так как масса альфа-частицы превышала массу электрона примерно в 8000 раз, то электрон не мог воздействовать на неё и отклонять её траекторию на большой угол, подобно тому, как камешек весом в 10 г не смог бы изменить траекторию движущегося автомобиля.
Но на практике всё оказалось по-другому. Большинство частиц действительно пролетало через фольгу, практически не отклоняясь или отклоняясь на небольшой угол. Но часть частиц отклонялась довольно значительно или даже отскакивала назад, словно на их пути возникало какое-то препятствие. Как сказал сам Резерфорд, это было так же невероятно, как если бы 15-дюймовый снаряд отскочил от куска папиросной бумаги.
Что же заставило некоторые альфа-частицы так сильно изменить направление движения? Учёный предположил, что причиной этому стала часть атома, сосредоточенная в очень малом объёме и имеющая положительный заряд. Её он назвал ядром атома .
Её он назвал ядром атома .
Планетарная модель атома Резерфорда
Модель атома Резерфорда
Резерфорд пришёл к выводу, что атом состоит из плотного положительно заряженного ядра, расположенного в центре атома, и электронов, имеющих отрицательный заряд. В ядре сосредоточена практически вся масса атома. В целом атом нейтрален. Положительный заряд ядра равен сумме отрицательных зарядов всех электронов атома. Но электроны не вкраплены в ядро, как в модели Томсона, а вращаются вокруг него подобно планетам, вращающимся вокруг Солнца. Вращение электронов происходит под действием кулоновской силы, действующей на них со стороны ядра. Скорость вращения электронов огромна. Над поверхностью ядра они образуют подобие облака. Каждый атом имеет своё электронное облако, заряженное отрицательно. По этой причине они не «слипаются», а отталкиваются друг от друга.
Из-за своей схожести с Солнечной системой модель Резерфорда была названа планетарной.
Почему атом существует
Однако модель атома Резерфорда не смогла объяснить, почему атом так устойчив. Ведь, согласно законам классической физики, электрон, вращаясь на орбите, движется с ускорением, следовательно, излучает электромагнитные волны и теряет энергию. В конце концов эта энергия должна иссякнуть, а электрон должен упасть на ядро. Если бы это было так, атом смог бы существовать всего лишь 10 -8 с. Но почему этого не происходит?
Ведь, согласно законам классической физики, электрон, вращаясь на орбите, движется с ускорением, следовательно, излучает электромагнитные волны и теряет энергию. В конце концов эта энергия должна иссякнуть, а электрон должен упасть на ядро. Если бы это было так, атом смог бы существовать всего лишь 10 -8 с. Но почему этого не происходит?
Причину этого явления позже объяснил датский физик Нильс Бор. Он предположил, что электроны в атоме двигаются только по фиксированным орбитам, которые называются «разрешёнными орбитами». Находясь на них, они не излучают энергию. А излучение или поглощение энергии происходит только при переходе электрона с одной разрешённой орбиты на другую. Если это переход с дальней орбиты на более близкую к ядру, то энергия излучается, и наоборот. Излучение происходит порциями, которые назвали квантами .
Хотя описанная Резерфордом модель не смогла объяснить устойчивость атома, она позволила значительно продвинуться вперёд в изучении его строения.
Планетарная модель атома
Планетарная модель атома: ядро (красное) и электроны (зелёные)
Планетарная модель атома , или модель Резерфорда , – историческая модель строения атома , которую предложил Эрнест Резерфорд в результате эксперимента с рассеянием альфа-частиц . По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны , – подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики . Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга » Джозефа Джона Томсона , которая постулирует, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома.
Новую модель строения атома Резерфорд предложил в 1911 году как вывод из эксперимента по рассеянию альфа-частиц на золотой фольге, проведённого под его руководством. При этом рассеянии неожиданно большое количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры и в нём сосредоточен значительный электрический заряд. Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10 -10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд пропорционален атомной массе.
При этом рассеянии неожиданно большое количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры и в нём сосредоточен значительный электрический заряд. Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10 -10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд пропорционален атомной массе.
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора , постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика .
Следующим шагом в развитии планетарной модели стала модель Бора , постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика .
Wikimedia Foundation . 2010 .
- Планетарий Эйсе Эйсинги
- Планетарная фантастика
Смотреть что такое “Планетарная модель атома” в других словарях:
планетарная модель атома – planetinis atomo modelis statusas T sritis fizika atitikmenys: angl. planetary atom model vok. Planetenmodell des Atoms, n rus. планетарная модель атома, f pranc. modèle planétaire de l’atome, m … Fizikos terminų žodynas
Боровская модель атома – Боровская модель водородоподобного атома (Z заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро … Википедия
Модель (в науке) – Модель (франц. modèle, итал. modello, от лат. modulus мера, мерило, образец, норма), 1) образец, служащий эталоном (стандартом) для серийного ли массового воспроизведения (М. автомобиля, М. одежды и т. п.), а также тип, марка какого либо… …
автомобиля, М. одежды и т. п.), а также тип, марка какого либо… …
Модель – I Модель (Model) Вальтер (24.1.1891, Гентин, Восточная Пруссия, 21.4.1945, близ Дуйсбурга), немецко фашистский генерал фельдмаршал (1944). В армии с 1909, участвовал в 1 й мировой войне 1914 18. С ноября 1940 командовал 3 й танковой… … Большая советская энциклопедия
СТРОЕНИЕ АТОМА – (см.) построен из элементарных частиц трёх видов (см.), (см.) и (см.), образующих устойчивую систему. Протон и нейтрон входят в состав атомного (см.), электроны образуют электронную оболочку. В ядре действуют силы (см.), благодаря которым… … Большая политехническая энциклопедия
Атом – У этого термина существуют и другие значения, см. Атом (значения). Атом гелия Атом (от др. греч … Википедия
Резерфорд Эрнест – (1871 1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член корреспондент РАН (1922) и почетный член АН СССР (1925). Родился в Новой Зеландии, после окончания… … Энциклопедический словарь
Родился в Новой Зеландии, после окончания… … Энциклопедический словарь
Άτομο
Корпускул – Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускулы – Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Книги
Лекция: Планетарная модель атома
Строение атома
Наиболее точный способ определения структуры любого вещества – это спектральный анализ. Излучение у каждого атома элемента исключительно индивидуальное. Однако, прежде, чем понять, каким образом происходит спектральный анализ, разберемся, какую структуру имеет атом любого элемента.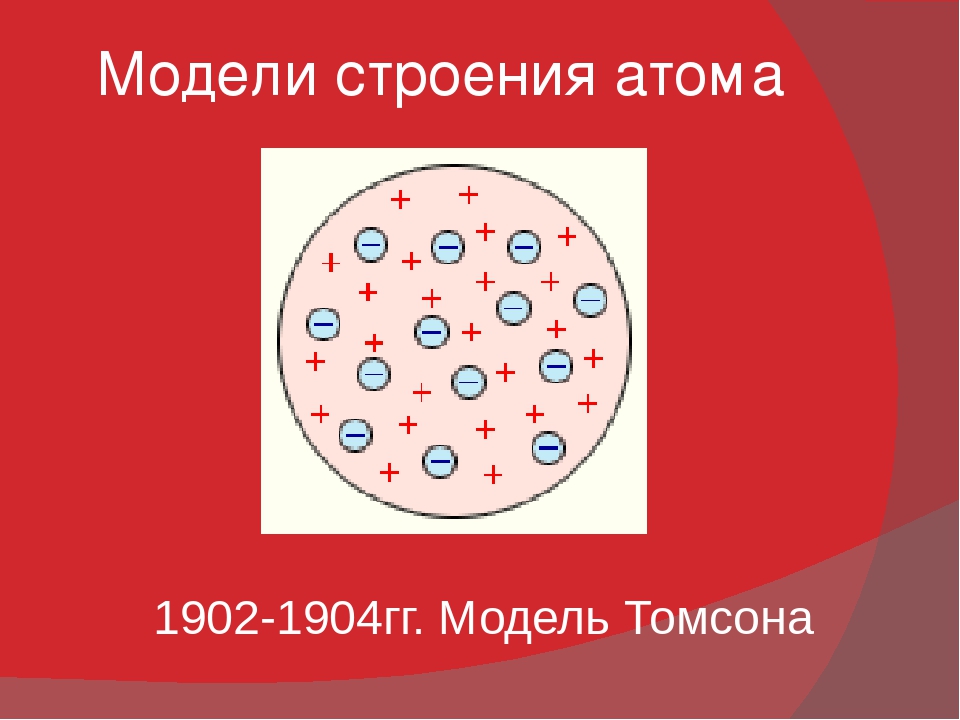
Первое предположение о строении атома было представлено Дж. Томсоном. Этот ученый длительное время занимался изучением атомов. Более того, именно ему принадлежит открытие электрона – за что он и получил Нобелевскую премию. Модель, что предложил Томсон, не имела ничего общего с действительностью, однако послужила достаточно сильным стимулом в изучении строения атома Резерфордом. Модель, предложенная Томсоном, называлась “пудингом с изюмом”.
Томсон считал, что атом является сплошным шаром, имеющим отрицательный электрический заряд. Для его компенсации в шар вкраплены электроны, как изюминки. В сумме заряд электронов совпадает с зарядом всего ядра, что делает атом нейтральным.
ВО время изучения строения атома выяснили, что все атомы в твердых телах совершают колебательные движения. А, как известно, любая двигающаяся частица излучает волны. Именно поэтому каждый атом имеет свой собственный спектр. Однако данные утверждения никак не вкладывались в модель Томсона.
Опыт Резерфорда
Чтобы подтвердить или опровергнуть модель Томсона, Резерфордом был предложен опыт, в результате которого происходила бомбардировка атома некоторого элемента альфа-частицами. В результате данного эксперимента было важно увидеть, как будет вести себя частица.
В результате данного эксперимента было важно увидеть, как будет вести себя частица.
Альфа частицы были открыты в результате радиоактивного распада радия. Их потоки представляли собой альфа-лучи, каждая частица которых имела положительный заряд. В результате многочисленных изучений было определено, что альфа-частица походит на атом гелия, в котором отсутствуют электроны. Используя нынешние знания, мы знаем, что альфа частица – это ядро гелия, в то время Резерфорд считал, что это были ионы гелия.
Каждая альфа-частица имела огромную энергию, в результате чего она могла лететь на рассматриваемые атомы с высокой скоростью. Поэтому основным результатом эксперимента являлось определение угла отклонения частицы.
Для проведения опыта Резерфорд использовал тонкую фольгу из золота. На нее он направлял высокоскоростные альфа-частицы. Он предполагал, что в результате данного эксперимента все частицы будут пролетать сквозь фольгу, причем с небольшими отклонениями. Однако, чтобы выяснить это наверняка, он поручил своим ученикам проверить, нет ли больших отклонений у данных частиц.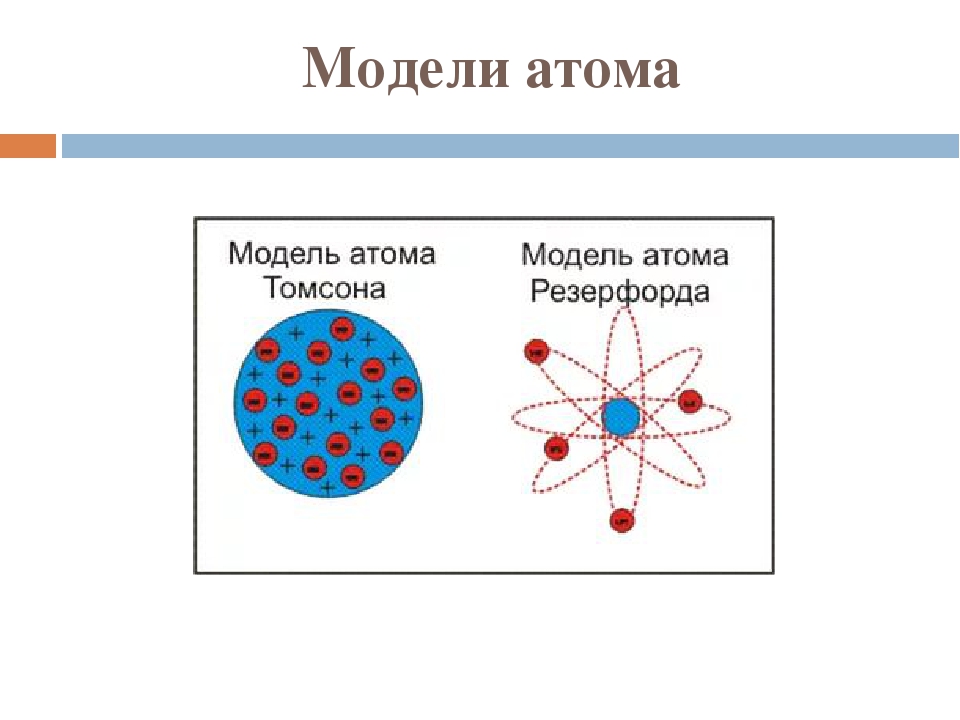
Результат эксперимента удивил абсолютно всех, ведь очень многие частицы не просто отклонились на достаточно большой угол – некоторые углы отклонения достигали более 90 градусов.
Данные результаты удивили абсолютно всех, Резерфорд говорил, что такое чувство, будто на пути снарядов был поставлен листок бумаги, который не дал альфа-частице проникнуть во внутрь, в результате чего, она повернулась обратно.
Если бы атом действительно был сплошным, то он должен был иметь некоторое электрическое поле, которое затормаживало частицу. Однако, сила поля была недостаточной, чтобы остановить её полностью, а уж тем более отбросить обратно. А это значит, что модель Томсона была опровергнута. Поэтому Резерфорд начал работать над новой моделью.
Модель Резерфорда
Чтобы получить такой результат эксперимента, необходимо сосредоточить положительный заряд в меньшем размере, в результате чего получится большее электрическое поле. По формуле потенциала поля можно определить необходимый размер положительной частицы, которая смогла бы оттолкнуть альфа-частицу в противоположном направлении. Радиус её должен быть порядка максимум 10 -15 м . Именно поэтому Резерфорд предложил планетарную модель атома.
Радиус её должен быть порядка максимум 10 -15 м . Именно поэтому Резерфорд предложил планетарную модель атома.
Данная модель названа так неспроста. Дело в том, что внутри атома имеется положительно заряженное ядро, подобное Солнцу в Солнечной системе. Вокруг ядра, как планеты вращаются электроны. Солнечная система устроена таким образом, что планеты притягиваются к Солнцу с помощью гравитационных сил, однако, они не падают на поверхность Солнца в результате имеющейся скорости, которая держит их на своей орбите. То же самое происходит и с электронами – кулоновские силы притягивают электроны к ядру, но за счет вращения они не падают на поверхность ядра.
Одно предположение Томсона оказалось абсолютно верно – суммарный заряд электронов соответствует заряду ядра. Однако в результате сильного взаимодействия электроны могут быть выбиты со своей орбиты, в результате чего заряд не компенсируется и атом превращается в положительно заряженный ион.
Очень важной информации относительно строения атома является то, что практически вся масса атома сосредоточена в ядре. Например, у атома водорода имеется всего один электрон, чья масса более, чем в полторы тысячи раз меньше, чем масса ядра.
Например, у атома водорода имеется всего один электрон, чья масса более, чем в полторы тысячи раз меньше, чем масса ядра.
Рекомендуем также
Основные сведения о строении атомов
Повторение темы “Введение”.
Строение атома
Атом – мельчайшая химически неделимая частица вещества.
В начале XX века была принята планетарная модель строения атома, предложенная Резерфордом, согласно которой вокруг очень малого по размерам положительно заряженного ядра движутся электроны, как планеты вокруг Солнца.
Рассмотрим строение атома.
Из курса физики вам известно, что вокруг положительного ядра находятся отрицательно заряженные частицы электроны – е– .
 В электронейтральном атоме число
электронов должно быть равно заряду ядра и, следовательно, порядковому номеру
элемента. Масса электрона очень мала и принимается равной нулю, таким образом,
масса атома сосредоточена в ядре, в котором расположены протоны – p+ и нейтроны – n0.
В электронейтральном атоме число
электронов должно быть равно заряду ядра и, следовательно, порядковому номеру
элемента. Масса электрона очень мала и принимается равной нулю, таким образом,
масса атома сосредоточена в ядре, в котором расположены протоны – p+ и нейтроны – n0.Итак, строение атома можно представить следующей схемой:
Задание. Определите состав атомов бора, углерода, фосфора, фтора и брома.
ОБРАЗЕЦ ВЫПОЛНЕНИЯ ЗАДАНИЯ на примере бора:
Устные рассуждения:
№ (порядковый
номер) = 5, следовательно: 5 p+
Ar(B) = 11, следовательно: 11 – 5 = 6 n0
№ (порядковый
номер) = 5, следовательно: 5 ē
http://www.youtube.com/watch?v=U6Oq4EBghIM
youtube.com/embed/U6Oq4EBghIM?rel=0&wmode=opaque” frameborder=”0″ allowfullscreen=”true”>
Ответьте на вопросы (устно):
1) Где сосредоточена масса атома? Почему?
2) Ядро имеет положительный заряд. Почему? Как определить его численное значение?
3) Электронные оболочки имеют отрицательный заряд. Почему? Как определить их численное значение?
4) Почему атом электронейтрален?
Выполните интерактивные задания.
1) Основные характеристики элементарных частиц.
2) Состав атомов некоторых ХЭ.
Строение атома. Модели Резерфорда и Бора реферат по естествознанию
Введение. Мысль о том, что вещество построено из мельчайших частиц, высказывалась еще древнегреческими учеными. Они-то и назвали эти частицы атомами (от греческого слова, означающего «неделимый»). Древние греки предполагали, что атомы имеют форму правильных многогранников: куба («атомы земли»), тетраэдра («атомы огня»), октаэдра («атомы воздуха»), икосаэдра («атомы воды»). Поэтому и состоящий из них мир неисчерпаемо богат в своих свойствах и качествах. Цепляясь друг за друга крючками и крючочками, атомы образуют твердые тела. Атомы воды гладкие и скользкие, поэтому она растекается и не имеет формы. Атомы вязких веществ обладают заусеницами. Воздух – это пустота, в которой носятся отдельные редкие атомы. Атомы огня острые и колючие, поэтому огонь жжется. Прошло почти более двадцати столетий, прежде чем были получены экспериментальные подтверждения идеи атомистического строения вещества. Представления о строении атома до Резерфорда. Развитие исследований радиоактивности излучения, с одной стороны, и квантовой теории – с другой, привели к созданию квантовой модели атома Резерфорда-Бора. Но созданию этой теории предшествовали попытки построить модель атома на основе представлений классической электродинамики и механики. В 1904 году появились публикации о строении атома, принадлежащие одна японскому физику Хантаро Нагаока (1865-1950), другая английскому физику Дж.
Поэтому и состоящий из них мир неисчерпаемо богат в своих свойствах и качествах. Цепляясь друг за друга крючками и крючочками, атомы образуют твердые тела. Атомы воды гладкие и скользкие, поэтому она растекается и не имеет формы. Атомы вязких веществ обладают заусеницами. Воздух – это пустота, в которой носятся отдельные редкие атомы. Атомы огня острые и колючие, поэтому огонь жжется. Прошло почти более двадцати столетий, прежде чем были получены экспериментальные подтверждения идеи атомистического строения вещества. Представления о строении атома до Резерфорда. Развитие исследований радиоактивности излучения, с одной стороны, и квантовой теории – с другой, привели к созданию квантовой модели атома Резерфорда-Бора. Но созданию этой теории предшествовали попытки построить модель атома на основе представлений классической электродинамики и механики. В 1904 году появились публикации о строении атома, принадлежащие одна японскому физику Хантаро Нагаока (1865-1950), другая английскому физику Дж. Дж. Томсону. Нагаока исходил из исследований Максвелла об устойчивости колец Сатурна и представил строение атома аналогичным строению солнечной системы: роль Солнца играет положительно заряженная часть атома, вокруг которой по установленным орбитам движутся «планеты» – электроны. При незначительных смещениях электроны возбуждают электромагнитные волны, периоды которых, по расчетам Нагаоки, того же порядка, что и частоты спектральных линий некоторых элементов. «Система состоит из большого числа частиц одинаковой массы, расположенных по кругу через равные угловые интервалы и взаимоотталкивающиеся с силой, обратно пропорциональной квадрату расстояния между ними; в центре круга помещается большая частица, которая притягивает другие частицы, образующие кольцо, по тому же закону». (Нагаока) В атоме Томсона положительное электричество «размазано» по сфере, в которую вкраплены, как изюм в пудинг, электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. При смещении из центра на электрон действует квазиупругая сила электростатического напряжения, под действием которой электрон совершает колебания.
Дж. Томсону. Нагаока исходил из исследований Максвелла об устойчивости колец Сатурна и представил строение атома аналогичным строению солнечной системы: роль Солнца играет положительно заряженная часть атома, вокруг которой по установленным орбитам движутся «планеты» – электроны. При незначительных смещениях электроны возбуждают электромагнитные волны, периоды которых, по расчетам Нагаоки, того же порядка, что и частоты спектральных линий некоторых элементов. «Система состоит из большого числа частиц одинаковой массы, расположенных по кругу через равные угловые интервалы и взаимоотталкивающиеся с силой, обратно пропорциональной квадрату расстояния между ними; в центре круга помещается большая частица, которая притягивает другие частицы, образующие кольцо, по тому же закону». (Нагаока) В атоме Томсона положительное электричество «размазано» по сфере, в которую вкраплены, как изюм в пудинг, электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. При смещении из центра на электрон действует квазиупругая сила электростатического напряжения, под действием которой электрон совершает колебания. Частота этих колебаний определяется радиусом сферы, зарядом и массой электрона, и если радиус сферы имеет порядок радиуса атома, частота этих колебаний совпадает с частотой колебания спектральной линии атома. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию Резерфорд, продолжая свою работу над магнитным детектором, вместе с тем заинтересовался исследованиями Томсона по электропроводимости газов. В 1896 году появляется совместная работа Томсона и Резерфорда «О прохождении электричества через газы, подвергнутые действию лучей Рентгена». В 1897 году выходит в свет заключительная статья Резерфорда «Магнитный детектор электрических волн и некоторые его применения». После этого он полностью сосредоточивает свои силы на исследовании нового разряда. В том же, 1897 году появляется его новая работа «Об электризации газов, подверженных действию рентгеновских лучей, и о поглощении рентгеновского излучения газами и парами».
Частота этих колебаний определяется радиусом сферы, зарядом и массой электрона, и если радиус сферы имеет порядок радиуса атома, частота этих колебаний совпадает с частотой колебания спектральной линии атома. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию Резерфорд, продолжая свою работу над магнитным детектором, вместе с тем заинтересовался исследованиями Томсона по электропроводимости газов. В 1896 году появляется совместная работа Томсона и Резерфорда «О прохождении электричества через газы, подвергнутые действию лучей Рентгена». В 1897 году выходит в свет заключительная статья Резерфорда «Магнитный детектор электрических волн и некоторые его применения». После этого он полностью сосредоточивает свои силы на исследовании нового разряда. В том же, 1897 году появляется его новая работа «Об электризации газов, подверженных действию рентгеновских лучей, и о поглощении рентгеновского излучения газами и парами». Вероятно, Резерфорд и Томсон вообще были одними из первых ученых, проявивших интерес к рентгеновским лучам и считавших открытие Рентгена исключительно важным и многообещающим. В воскресенье 1 марта 1896 года Анри Беккерель обнаружил, что уран непрерывно испускает проникающее излучение неизвестной природы, которая оказалась совершенно отличной от природы рентгеновских лучей. Тем самым он обнаружил существование радиоактивности, начавшее новую эпоху в истории науки и человечества. Сообщение об открытии Беккерелем радиоактивности произвело большой эффект в Кавендишской лаборатории, и Резерфорд решил немедленно заняться изучением этих загадочных лучей. Сначала ему казалось, что существует какая-то связь между урановыми и рентгеновскими лучами. Излучение урановых препаратов, как и рентгеновские лучи, производило ионизацию воздуха. Такое сходство в воздействии излучений на окружающую среду привело Резерфорда к мысли об опытном сравнении рентгеновских и беккерелевых лучей, что могло дать наиболее достоверные и точные сведения об их физических свойствах.
Вероятно, Резерфорд и Томсон вообще были одними из первых ученых, проявивших интерес к рентгеновским лучам и считавших открытие Рентгена исключительно важным и многообещающим. В воскресенье 1 марта 1896 года Анри Беккерель обнаружил, что уран непрерывно испускает проникающее излучение неизвестной природы, которая оказалась совершенно отличной от природы рентгеновских лучей. Тем самым он обнаружил существование радиоактивности, начавшее новую эпоху в истории науки и человечества. Сообщение об открытии Беккерелем радиоактивности произвело большой эффект в Кавендишской лаборатории, и Резерфорд решил немедленно заняться изучением этих загадочных лучей. Сначала ему казалось, что существует какая-то связь между урановыми и рентгеновскими лучами. Излучение урановых препаратов, как и рентгеновские лучи, производило ионизацию воздуха. Такое сходство в воздействии излучений на окружающую среду привело Резерфорда к мысли об опытном сравнении рентгеновских и беккерелевых лучей, что могло дать наиболее достоверные и точные сведения об их физических свойствах. Результатом этого явилась большая статья «Излучение урана и созданная им электропроводность». Опыты продолжались почти год. Они показали, что сходства между двумя исследовавшимися излучениями, несмотря на их одинаковое ионизирующее действие, нет. Резерфорд также смог убедиться также в том, что предположение Беккереля о сходстве урановых лучей со световыми ошибочно. Излучение урана вопреки заявлению Беккереля (правда, не подкрепленному опытами) не обнаружило свойств, характерных для света. Оно не подчинялось законам световой оптики: отражению, преломлению и поляризации. В результате этих работ Резерфорда были открыты F 06 1- частицы. Резерфорд поместил радиоактивный источник в магнитное поле и получил три вида излучений, испускаемых ураном: F 06 1-, F 06 2-частицы и F 06 7-лучи. Уже при проведении этих опытов Резерфорд предвидел, что F 06 1-частицы помогут исследовать структуру атома в качестве мощных инструментов для проникновения в атом. В сентябре 1898 года Резерфорд был приглашен в университет Мак-Гила в Монреале (Канада) в качестве профессора кафедры теоретической физики.
Результатом этого явилась большая статья «Излучение урана и созданная им электропроводность». Опыты продолжались почти год. Они показали, что сходства между двумя исследовавшимися излучениями, несмотря на их одинаковое ионизирующее действие, нет. Резерфорд также смог убедиться также в том, что предположение Беккереля о сходстве урановых лучей со световыми ошибочно. Излучение урана вопреки заявлению Беккереля (правда, не подкрепленному опытами) не обнаружило свойств, характерных для света. Оно не подчинялось законам световой оптики: отражению, преломлению и поляризации. В результате этих работ Резерфорда были открыты F 06 1- частицы. Резерфорд поместил радиоактивный источник в магнитное поле и получил три вида излучений, испускаемых ураном: F 06 1-, F 06 2-частицы и F 06 7-лучи. Уже при проведении этих опытов Резерфорд предвидел, что F 06 1-частицы помогут исследовать структуру атома в качестве мощных инструментов для проникновения в атом. В сентябре 1898 года Резерфорд был приглашен в университет Мак-Гила в Монреале (Канада) в качестве профессора кафедры теоретической физики. В Монреале он пробыл до 1907 года. Здесь он сделал фундаментальные открытия: им была открыта эманация теория и разгадана природа так называемой «индуцированной радиоактивности»; совместно с Содди он открыл радиоактивный распад и его закон. Здесь им была написана книга «Радиоактивность». В Монреале он начал тщательные исследования природы F 06 1- частиц, закончившееся уже в Манчестере полной разгадкой их природы. Здесь же он начал свои исследования по происхождению F 06 1-частиц через вещество. Огромный размах научной работы Резерфорда в Монреале принес ему славу первоклассного исследователя. Им было опубликовано как лично, так и совместно с другими учеными 66 статей, не считая книги «Радиоактивность». Он получает приглашение занять кафедру в Манчестере. 24 мая 1907 года Резерфорд вернулся в Европу. Начался новый период в его жизни. Почти немедленно по прибытии в Манчестер Резерфорд начал систематические исследования рассеяния F 06 1-частиц веществом. Он установил, что каждая F 06 1-частица, попадая на экран из сернистого цинка, создает вспышку света.
В Монреале он пробыл до 1907 года. Здесь он сделал фундаментальные открытия: им была открыта эманация теория и разгадана природа так называемой «индуцированной радиоактивности»; совместно с Содди он открыл радиоактивный распад и его закон. Здесь им была написана книга «Радиоактивность». В Монреале он начал тщательные исследования природы F 06 1- частиц, закончившееся уже в Манчестере полной разгадкой их природы. Здесь же он начал свои исследования по происхождению F 06 1-частиц через вещество. Огромный размах научной работы Резерфорда в Монреале принес ему славу первоклассного исследователя. Им было опубликовано как лично, так и совместно с другими учеными 66 статей, не считая книги «Радиоактивность». Он получает приглашение занять кафедру в Манчестере. 24 мая 1907 года Резерфорд вернулся в Европу. Начался новый период в его жизни. Почти немедленно по прибытии в Манчестер Резерфорд начал систематические исследования рассеяния F 06 1-частиц веществом. Он установил, что каждая F 06 1-частица, попадая на экран из сернистого цинка, создает вспышку света. Поэтому для исследования рассеяния F 06 1-частиц был сконструирован прибор, изображенный схематически на рис.1 (стр. 18). С помощью свинцового коллиматора выделялся узкий конус F 06 1- частиц из радиоактивного источника. Испытав рассеивание в золотой фольге, F 06 1-частицы ударялись затем в экран из сернистого цинка и регистрировались с помощью небольшого микроскопа, в который можно было наблюдать вспышки света. Вращая детектор, можно было изменять относительное число F 0 6 1-частиц, рассеянных под различными углами F 07 1. Прибор помещался внутри откачанной камеры с целью устранить косеканса» был проверен экспериментально Гейгером, и был найден справедливым в пределах экспериментальных ошибок. Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным F 0 B 1Ne. Заряд оказался пропорциональным атомному весу. «Точное значение заряда центрального ядра не было определено,–писал Резерфорд,–но для атома золота оно приблизительно равно 100 единицам заряда».
Поэтому для исследования рассеяния F 06 1-частиц был сконструирован прибор, изображенный схематически на рис.1 (стр. 18). С помощью свинцового коллиматора выделялся узкий конус F 06 1- частиц из радиоактивного источника. Испытав рассеивание в золотой фольге, F 06 1-частицы ударялись затем в экран из сернистого цинка и регистрировались с помощью небольшого микроскопа, в который можно было наблюдать вспышки света. Вращая детектор, можно было изменять относительное число F 0 6 1-частиц, рассеянных под различными углами F 07 1. Прибор помещался внутри откачанной камеры с целью устранить косеканса» был проверен экспериментально Гейгером, и был найден справедливым в пределах экспериментальных ошибок. Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным F 0 B 1Ne. Заряд оказался пропорциональным атомному весу. «Точное значение заряда центрального ядра не было определено,–писал Резерфорд,–но для атома золота оно приблизительно равно 100 единицам заряда». В 1913 году Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, подсчитывая рассеивание частиц по производимым ими сцинтиляционным вспышкам. «Это была трудная, кропотливая работа, – характеризовал Резерфорд работу своих сотрудников, – так как нужно было считать много тысяч частиц. Результаты Гейгера и Марсдена весьма близко согласуются с теорией». Из этих утомительных и кропотливых исследований и возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд еще в 1913 году считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу. Тем не менее классические модели строения атома страдали весьма глубокими недостатками. С их помощью никак не удавалось объяснить спектральные закономерности и устойчивость движения электронов внутри атома. Рано или поздно электроны в модели Резерфорда должны были прекратить движение, что прекращало существование атома.
В 1913 году Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, подсчитывая рассеивание частиц по производимым ими сцинтиляционным вспышкам. «Это была трудная, кропотливая работа, – характеризовал Резерфорд работу своих сотрудников, – так как нужно было считать много тысяч частиц. Результаты Гейгера и Марсдена весьма близко согласуются с теорией». Из этих утомительных и кропотливых исследований и возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным (Резерфорд еще в 1913 году считал знак заряда неопределенным) зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу. Тем не менее классические модели строения атома страдали весьма глубокими недостатками. С их помощью никак не удавалось объяснить спектральные закономерности и устойчивость движения электронов внутри атома. Рано или поздно электроны в модели Резерфорда должны были прекратить движение, что прекращало существование атома.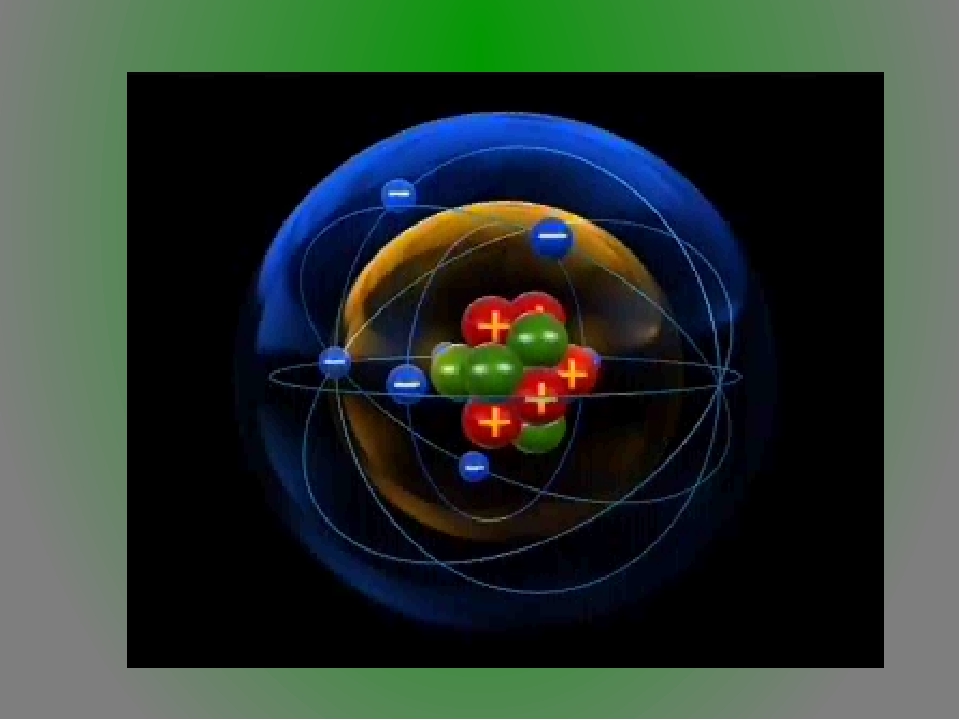 В действительности же атомы существовали, не обращая внимания на мрачные пророчества теории. Налицо было вопиющее противоречие между теорией и действительностью, причем противоречие на уровне самой исходной, самой бедной по содержанию – категорией существования. Спектральные закономерности еще можно было как-то надеяться вывести, представляя очень хитрым образом движение электронов вокруг ядра. Здесь же теория подрубалась под корень. Атом Бора. Идеи о непримиримости законов классической механики и электродинамики во всей их полноте к исследованию внутреннего строения атома высказывались и до Бора. Мысли о необходимости учета квантового характера излучения были также не новыми. Тем не менее именно Нильс Бор заслуженно считается пионером квантовой теории атома. Имена его предшественников на этом пути – Никольсона, Штарка, Бьеррума и других, на которых Бор не устает ссылаться в своих первых статьях, сейчас мало кому известны. Это можно объяснить тем, что упомянутые авторы достигали только частных результатов, не объединенных в сколько-нибудь стройную систему, которая могла бы служить программой целого круга исследований и допускала бы количественную проверку на опыте.
В действительности же атомы существовали, не обращая внимания на мрачные пророчества теории. Налицо было вопиющее противоречие между теорией и действительностью, причем противоречие на уровне самой исходной, самой бедной по содержанию – категорией существования. Спектральные закономерности еще можно было как-то надеяться вывести, представляя очень хитрым образом движение электронов вокруг ядра. Здесь же теория подрубалась под корень. Атом Бора. Идеи о непримиримости законов классической механики и электродинамики во всей их полноте к исследованию внутреннего строения атома высказывались и до Бора. Мысли о необходимости учета квантового характера излучения были также не новыми. Тем не менее именно Нильс Бор заслуженно считается пионером квантовой теории атома. Имена его предшественников на этом пути – Никольсона, Штарка, Бьеррума и других, на которых Бор не устает ссылаться в своих первых статьях, сейчас мало кому известны. Это можно объяснить тем, что упомянутые авторы достигали только частных результатов, не объединенных в сколько-нибудь стройную систему, которая могла бы служить программой целого круга исследований и допускала бы количественную проверку на опыте. Нильс Бор родился 7 октября 1885 года в семье профессора физиологии Копенгагенского университета Христиана Бора. В 1903 году Бор поступил в Копенгагенский университет. Еще в студенческие годы Бор выполнил конкурсную работу по поверхностному натяжению. Работа была удостоена золотой медали Датской Академии наук. В 1909 году, спустя два года после окончания Бором университета, эта работа – «Определение поверхностного натяжения воды методом колебания струи» – была опубликована в трудах Лондонского Королевского общества. Весной 1911 года состоялась защита докторской диссертации Бора на тему «Анализ электронной теории металла», в сентябре того же года Бор приехал на стажировку в Кембридж к Дж.Дж. Томсону. Томсон в это время занимался анализом положительных лучей. Им был разработан метод точного анализа – метод парабол, с помощью которого он впервые обнаружил у неона существование двух разновидностей атомов: с атомным весом 20 и 22. Продолжая эти исследования уже после войны, ученик Томсона Астон открыл изотопы многих стабильных элементов.
Нильс Бор родился 7 октября 1885 года в семье профессора физиологии Копенгагенского университета Христиана Бора. В 1903 году Бор поступил в Копенгагенский университет. Еще в студенческие годы Бор выполнил конкурсную работу по поверхностному натяжению. Работа была удостоена золотой медали Датской Академии наук. В 1909 году, спустя два года после окончания Бором университета, эта работа – «Определение поверхностного натяжения воды методом колебания струи» – была опубликована в трудах Лондонского Королевского общества. Весной 1911 года состоялась защита докторской диссертации Бора на тему «Анализ электронной теории металла», в сентябре того же года Бор приехал на стажировку в Кембридж к Дж.Дж. Томсону. Томсон в это время занимался анализом положительных лучей. Им был разработан метод точного анализа – метод парабол, с помощью которого он впервые обнаружил у неона существование двух разновидностей атомов: с атомным весом 20 и 22. Продолжая эти исследования уже после войны, ученик Томсона Астон открыл изотопы многих стабильных элементов. Исследования самого Томсона были обобщены им в монографии «Лучи положительного электричества и их применение к химическому анализу», вышедшей в 1913 году. Томсон поручил и Бору провести эксперимент с положительными лучами. Бор собрал вакуумную установку, однако дело дальше не пошло, и он начал готовить к изданию свою докторскую диссертацию. Томсон отнесся без внимания к работе Бора и не прочитал ее. В том же, 1911 году, когда Бор приехал в Кембридж, сотрудник Томсона Чарльз Томас Рис Вильсон (1869-1959) изобрел замечательный прибор, известный ныне под названием «камера Вильсона». Этот прибор позволяет видеть частицу по оставляемому ею туманному следу. Резерфорд, приехавший на традиционный ежегодный обед в Кембридж, в своей речи с энтузиазмом отозвался о приборе Вильсона и полученных первых результатах. Бор, который впервые увидел Кроме того, с моделью Резерфорда было не совместимо допущение о квазиупругом характере сил связи электрона с ядром, поскольку все силы взаимодействия между частями атома изменялись согласно закону Кулона обратно пропорционально квадрату расстояния.
Исследования самого Томсона были обобщены им в монографии «Лучи положительного электричества и их применение к химическому анализу», вышедшей в 1913 году. Томсон поручил и Бору провести эксперимент с положительными лучами. Бор собрал вакуумную установку, однако дело дальше не пошло, и он начал готовить к изданию свою докторскую диссертацию. Томсон отнесся без внимания к работе Бора и не прочитал ее. В том же, 1911 году, когда Бор приехал в Кембридж, сотрудник Томсона Чарльз Томас Рис Вильсон (1869-1959) изобрел замечательный прибор, известный ныне под названием «камера Вильсона». Этот прибор позволяет видеть частицу по оставляемому ею туманному следу. Резерфорд, приехавший на традиционный ежегодный обед в Кембридж, в своей речи с энтузиазмом отозвался о приборе Вильсона и полученных первых результатах. Бор, который впервые увидел Кроме того, с моделью Резерфорда было не совместимо допущение о квазиупругом характере сил связи электрона с ядром, поскольку все силы взаимодействия между частями атома изменялись согласно закону Кулона обратно пропорционально квадрату расстояния.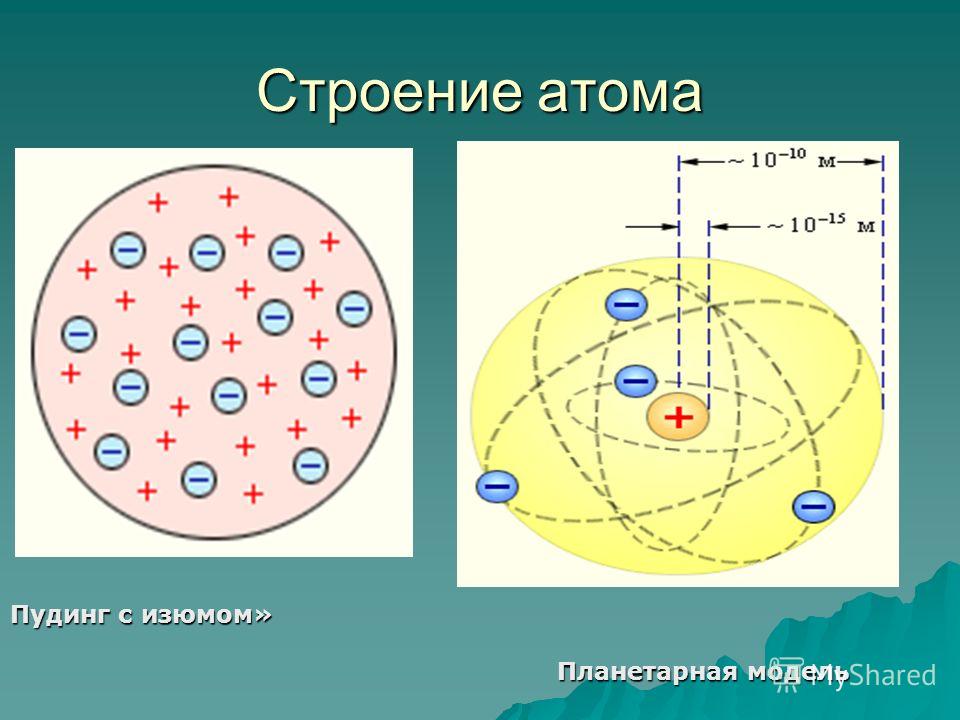 Модель Томсона, в которой электрон находился внутри положительно заряженного «ядра», допускала существование таких сил. Тем не менее, несмотря на все эти соображения, эксперимент убедительно говорил в пользу Резерфорда. Если бы физика целиком осталась на классических позициях, то ей вряд ли удалось бы достигнуть разрешения противоречий между опытом и «очевидными» физическими соображениями. Поэтому Нильс Бор утверждает: «Каким бы ни было изменение законов движения электронов, представляется необходимым ввести в эти законы величину, чуждую классической электродинамике, то есть постоянную Планка, или, как ее часто называют, элементарный квант действия. Благодаря введению этой величины вопрос об устойчивых конфигурациях электронов в атоме существенным образом изменяется, так как эта постоянная обладает такой размерностью и значением, что может в комбинации с зарядом и массой частиц определить длину требуемого порядка величины». Постоянная Планка символизировала в теории элементарное количество действия, которое было сложным по структуре выражением, что видно уже из ее размерности.
Модель Томсона, в которой электрон находился внутри положительно заряженного «ядра», допускала существование таких сил. Тем не менее, несмотря на все эти соображения, эксперимент убедительно говорил в пользу Резерфорда. Если бы физика целиком осталась на классических позициях, то ей вряд ли удалось бы достигнуть разрешения противоречий между опытом и «очевидными» физическими соображениями. Поэтому Нильс Бор утверждает: «Каким бы ни было изменение законов движения электронов, представляется необходимым ввести в эти законы величину, чуждую классической электродинамике, то есть постоянную Планка, или, как ее часто называют, элементарный квант действия. Благодаря введению этой величины вопрос об устойчивых конфигурациях электронов в атоме существенным образом изменяется, так как эта постоянная обладает такой размерностью и значением, что может в комбинации с зарядом и массой частиц определить длину требуемого порядка величины». Постоянная Планка символизировала в теории элементарное количество действия, которое было сложным по структуре выражением, что видно уже из ее размерности.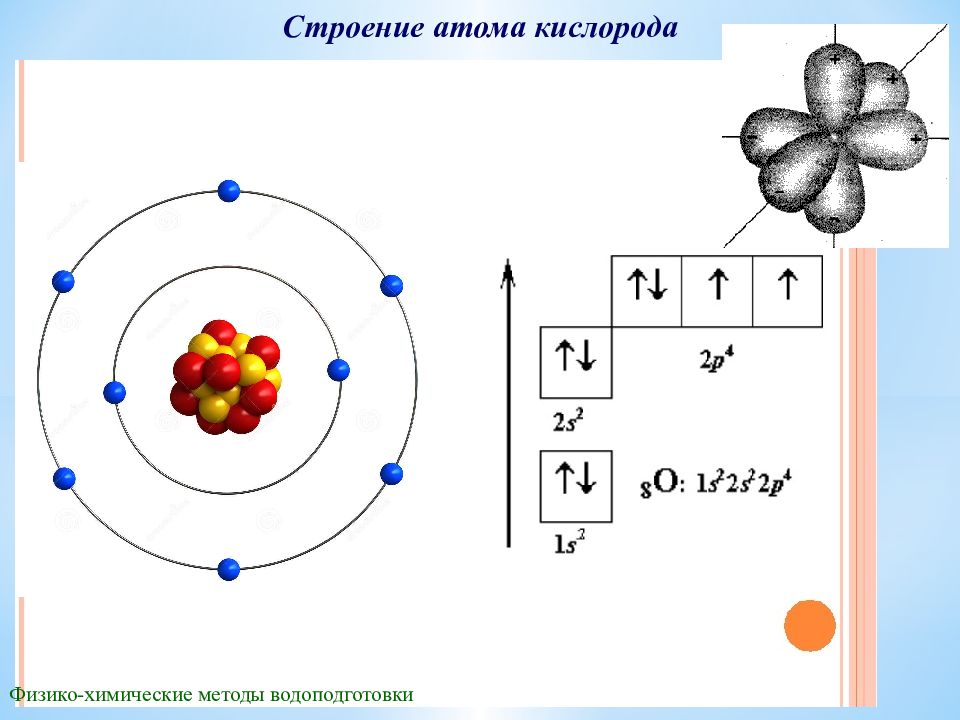 Элементарность действия имеет поэтому другой статус (чисто количественный) по сравнению с элементарностью свойств и отношений, которая носила преимущественно качественный характер. Действие (а вместе с ним и совпадающий с действием по размерности момент количества движения), если встать на точку зрения теории Планка, могло принимать только значения, кратные h. Это означало, что из непрерывного множества всех возможных с точки зрения классики орбит электронов – а были возможны орбиты любого радиуса – отбиралось дискретное множество орбит. Нильс Бор назвал их стационарными орбитами, соответствовавшими стационарным состояниям атома. Все возражения против модели Резерфорда, по словам Бора, можно устранить, если допустить, «(1) что динамическое равновесие систем в стационарных состояниях может обсуждаться с помощью обычной механики, в то время как переход систем между различными стационарными состояниями не может трактоваться на этой основе; (2) что последний процесс сопровождается испусканием гомогенного излучения, для которого соотношение между частотой и количеством испущенной энергии дается теорией Планка».
Элементарность действия имеет поэтому другой статус (чисто количественный) по сравнению с элементарностью свойств и отношений, которая носила преимущественно качественный характер. Действие (а вместе с ним и совпадающий с действием по размерности момент количества движения), если встать на точку зрения теории Планка, могло принимать только значения, кратные h. Это означало, что из непрерывного множества всех возможных с точки зрения классики орбит электронов – а были возможны орбиты любого радиуса – отбиралось дискретное множество орбит. Нильс Бор назвал их стационарными орбитами, соответствовавшими стационарным состояниям атома. Все возражения против модели Резерфорда, по словам Бора, можно устранить, если допустить, «(1) что динамическое равновесие систем в стационарных состояниях может обсуждаться с помощью обычной механики, в то время как переход систем между различными стационарными состояниями не может трактоваться на этой основе; (2) что последний процесс сопровождается испусканием гомогенного излучения, для которого соотношение между частотой и количеством испущенной энергии дается теорией Планка». Это и есть знаменитые постулаты Бора, вокруг которых вплоть до 1925 года концентрировалось развитие теоретической атомной физики. Итак, в модели Бора существовало строго определенное множество дозволенных орбит, выделенных квантовыми условиями. При этом каждая стационарная орбита была устойчивой по определению, и каждой стационарной орбите соответствовало определенное состояние атома. Вообще говоря, в любом стационарном состоянии атом мог находиться неограниченно долго, что ликвидировало единственность устойчивого состояния атома «самого по себе». Среди бесконечного множества стационарных состояний только одно – основное состояние – было абсолютно устойчивым в рамках модели. Для нахождения атома в других состояниях, устойчивых лишь относительно, существовала некоторая вероятность спонтанного перехода атома в другое, менее возбужденное состояние. Возможность таких спонтанных переходов была посторонней – в сторону уменьшения энергии состояния, уменьшения степени возбуждения атома. Спонтанно увеличивать свою энергию атом не мог.
Это и есть знаменитые постулаты Бора, вокруг которых вплоть до 1925 года концентрировалось развитие теоретической атомной физики. Итак, в модели Бора существовало строго определенное множество дозволенных орбит, выделенных квантовыми условиями. При этом каждая стационарная орбита была устойчивой по определению, и каждой стационарной орбите соответствовало определенное состояние атома. Вообще говоря, в любом стационарном состоянии атом мог находиться неограниченно долго, что ликвидировало единственность устойчивого состояния атома «самого по себе». Среди бесконечного множества стационарных состояний только одно – основное состояние – было абсолютно устойчивым в рамках модели. Для нахождения атома в других состояниях, устойчивых лишь относительно, существовала некоторая вероятность спонтанного перехода атома в другое, менее возбужденное состояние. Возможность таких спонтанных переходов была посторонней – в сторону уменьшения энергии состояния, уменьшения степени возбуждения атома. Спонтанно увеличивать свою энергию атом не мог. Это делало его гораздо менее «забывчивым». Одно только основное состояние «не помнило» о прошлом поведении атома. Для других же стационарных состояний сам факт их существования напоминал о прошлом поведении атома, который мог начать существовать в этом состоянии, только либо увеличив свою энергию под влиянием внешнего воздействия, либо уменьшить энергию в результате перехода из более возбужденного состояния – спонтанного или вынужденного. Находясь в любом состоянии, кроме основного, атом сохраняет в «снятом виде» отпечаток прошлого своего поведения. Опираясь на свои допущения, Бор выводит далее новые закономерности для спектра водорода, принимавшиеся ранее просто как эмпирический факт: формулу Бальмера и закон Ридберга-Ритца. Очень скоро известные опыты Франка и Герца, по словам одного из авторов, «так убедительно доказали представления Бора о стационарных состояниях атома и о появлении излучения при переходе из одного состояния в другое с определением частоты из уравнения h F 06 E=E1-E2 (где h– понимание квантовой теории».
Это делало его гораздо менее «забывчивым». Одно только основное состояние «не помнило» о прошлом поведении атома. Для других же стационарных состояний сам факт их существования напоминал о прошлом поведении атома, который мог начать существовать в этом состоянии, только либо увеличив свою энергию под влиянием внешнего воздействия, либо уменьшить энергию в результате перехода из более возбужденного состояния – спонтанного или вынужденного. Находясь в любом состоянии, кроме основного, атом сохраняет в «снятом виде» отпечаток прошлого своего поведения. Опираясь на свои допущения, Бор выводит далее новые закономерности для спектра водорода, принимавшиеся ранее просто как эмпирический факт: формулу Бальмера и закон Ридберга-Ритца. Очень скоро известные опыты Франка и Герца, по словам одного из авторов, «так убедительно доказали представления Бора о стационарных состояниях атома и о появлении излучения при переходе из одного состояния в другое с определением частоты из уравнения h F 06 E=E1-E2 (где h– понимание квантовой теории». Теория атома после открытия Зоммерфельда стала называться теорией Бора–Зоммерфельда. По возвращении в Копенгаген Бор обнаружил пакет со статьей Эренфеста, содержащей теорию адиабатических вариантов. Эта теория давала критерий квантующихся величин и до создания квантовой механики была единственной руководящей нитью при применении правил квантования, предвосхищавшей многие выводы, следующие из статьи Бора. К 1916 году теория Бора начала разрабатываться многими физиками. Была создана квантовая теория эффекта Зеемана и открытого в 1913 году Штарком (1874-1957) эффекта влияния электрического поля на спектры. «Область нашей работы, – писал Бор Резерфорду, – после получения статьи Эренфеста превратилась из страны с довольно малочисленным населением в донельзя перенаселенное государство». Продолжая развивать свои идеи, Бор сформулировал принцип соответствия (1918), означавший шаг вперед в ответе на вопросы, поставленные Резерфордом. Чрезвычайно существенно, что благодаря Бору Копенгаген превратился в центр теоретической физики.
Теория атома после открытия Зоммерфельда стала называться теорией Бора–Зоммерфельда. По возвращении в Копенгаген Бор обнаружил пакет со статьей Эренфеста, содержащей теорию адиабатических вариантов. Эта теория давала критерий квантующихся величин и до создания квантовой механики была единственной руководящей нитью при применении правил квантования, предвосхищавшей многие выводы, следующие из статьи Бора. К 1916 году теория Бора начала разрабатываться многими физиками. Была создана квантовая теория эффекта Зеемана и открытого в 1913 году Штарком (1874-1957) эффекта влияния электрического поля на спектры. «Область нашей работы, – писал Бор Резерфорду, – после получения статьи Эренфеста превратилась из страны с довольно малочисленным населением в донельзя перенаселенное государство». Продолжая развивать свои идеи, Бор сформулировал принцип соответствия (1918), означавший шаг вперед в ответе на вопросы, поставленные Резерфордом. Чрезвычайно существенно, что благодаря Бору Копенгаген превратился в центр теоретической физики. К Бору примкнул молодой физик, ставший его ассистентом, Гендрик Антон Крамерс (1894-1952). Бор создал институт теоретической физики, в организации которого ему деятельную поддержку оказывал Резерфорд. В 1922 году Бор получил Нобелевскую премию по физике. В прочитанном им 11 декабря 1922 года в Стокгольме нобелевском докладе он развернул картину состояния атомной теории к этому времени. Одним из наиболее существенных успехов теории было нахождение ключа к периодической системе элементов, которая объяснялась наличием электронных оболочек, окружающих ядра атомов. Огромная физическая интуиция позволила Бору, еще не зная принципа Паули и спина электрона, наметить правильную картину построения периодической системы, исправить ошибку химиков в классификации редких земель и предсказать существование нового элемента, который и был открыт Костером и Хевеши, давшими ему название гафний. Нильс Бор посвятил всю свою жизнь изучению свойств атома и его строения, 18 ноября 1962 года он неожиданно скончался.
К Бору примкнул молодой физик, ставший его ассистентом, Гендрик Антон Крамерс (1894-1952). Бор создал институт теоретической физики, в организации которого ему деятельную поддержку оказывал Резерфорд. В 1922 году Бор получил Нобелевскую премию по физике. В прочитанном им 11 декабря 1922 года в Стокгольме нобелевском докладе он развернул картину состояния атомной теории к этому времени. Одним из наиболее существенных успехов теории было нахождение ключа к периодической системе элементов, которая объяснялась наличием электронных оболочек, окружающих ядра атомов. Огромная физическая интуиция позволила Бору, еще не зная принципа Паули и спина электрона, наметить правильную картину построения периодической системы, исправить ошибку химиков в классификации редких земель и предсказать существование нового элемента, который и был открыт Костером и Хевеши, давшими ему название гафний. Нильс Бор посвятил всю свою жизнь изучению свойств атома и его строения, 18 ноября 1962 года он неожиданно скончался. Заключение. Таким образом, открытия Резерфорда и Бора являются фундаментальными и имеют огромное значение для современной физики и для всего человечества. История науки учит, что всякий раз, когда человечество овладевает очередной ступенькой лестницы, ведущей в глубь вещества, это приводит к открытию нового, еще более мощного вида энергии. Горение и взрыв связаны с перестройкой молекул. Внутриатомные процессы сопровождаются выделением в миллионы раз большей энергии. Еще большее выделение энергии происходит на уровне элементарных частиц. А что будет на следующих ступенях? Открытия Резерфорда и Бора доказали, что атом не есть неделимая частица, и дают возможность современной физике ответить на этот вопрос. Список использованной литературы: Алексеев И. С. Развитие представлений о структуре атома. М.,1975. Бор Нильс. Три статьи о спектрах и строении атомов. Москва-Петроград, Госиздат, 1922. Кедров Ф. Эрнест Резерфорд. М.: Атомиздат, 1965. Кудрявцев Л. С. Курс истории физики. М., 1982. Льоцци Марио.
Заключение. Таким образом, открытия Резерфорда и Бора являются фундаментальными и имеют огромное значение для современной физики и для всего человечества. История науки учит, что всякий раз, когда человечество овладевает очередной ступенькой лестницы, ведущей в глубь вещества, это приводит к открытию нового, еще более мощного вида энергии. Горение и взрыв связаны с перестройкой молекул. Внутриатомные процессы сопровождаются выделением в миллионы раз большей энергии. Еще большее выделение энергии происходит на уровне элементарных частиц. А что будет на следующих ступенях? Открытия Резерфорда и Бора доказали, что атом не есть неделимая частица, и дают возможность современной физике ответить на этот вопрос. Список использованной литературы: Алексеев И. С. Развитие представлений о структуре атома. М.,1975. Бор Нильс. Три статьи о спектрах и строении атомов. Москва-Петроград, Госиздат, 1922. Кедров Ф. Эрнест Резерфорд. М.: Атомиздат, 1965. Кудрявцев Л. С. Курс истории физики. М., 1982. Льоцци Марио. История физики. М., 1970. Мэрион Дж. Б. Физика и физический мир. М., 1975. Резерфорд Эрнест. Избранные научные труды. М., 1971.
История физики. М., 1970. Мэрион Дж. Б. Физика и физический мир. М., 1975. Резерфорд Эрнест. Избранные научные труды. М., 1971.
Сегмент A: Атомарные модели | Общественное вещание Грузии
анион – отрицательно заряженный ион.
атомный номер – количество протонов в ядре атома.
атомный радиус – расстояние от ядра атома до крайнего энергетического уровня.
средняя атомная масса – средневзвешенное значение всех изотопов этого элемента во Вселенной.
катион – положительно заряженный ион.
эффективный заряд ядра (Zsubeff) – суммарный положительный заряд, испытываемый валентными электронами ядра.
электрон – крошечная частица с отрицательным зарядом, находящаяся вне ядра атома.
электронная конфигурация – порядок расположения электронов в атоме.
электроотрицательность – способность атома притягивать дополнительные электроны.
энергетический подуровень – меньшая часть в пределах первичного энергетического уровня.
возбужденное состояние – атом, ион или молекула с электроном в более высоком, чем нормальный, энергетическом уровне, чем его основное состояние.
основное состояние – состояние с наименьшей энергией в пределах электронных орбиталей.
Правило Хунда – При размещении электронов на орбиталях равной энергии электроны не должны объединяться в пары до тех пор, пока каждая орбиталь с одинаковой энергией не содержит по одному электрону.
ion – атом с положительным или отрицательным зарядом.
энергия ионизации – количество энергии, необходимое для удаления одного валентного электрона из атома.
Изотоп – один и тот же элемент с разным количеством нейтронов.
модель – физическое, концептуальное или математическое представление реального явления, целью которого является объяснение и предсказание наблюдаемого явления.
орбиталь – область пространства вокруг ядра атома, где, вероятно, будет обнаружен электрон.
Принцип исключения Паули – когда орбиталь удерживает два электрона, многие электроны имеют противоположный спин.
квант – определенное количество энергии, которое может быть поглощено электроном, когда он переходит из основного состояния в возбужденное состояние, или высвобождено электроном, когда он падает из возбужденного состояния обратно в основное состояние.
субатомный – любая меньшая часть атома, например протон, нейтрон или электрон.
валентных электронов – электроны на внешнем энергетическом уровне любого атома.
валентная оболочка – крайний энергетический уровень электрона.
Разработка моделей атомов – Атомная структура – OCR Gateway – GCSE Combined Science Revision – OCR Gateway
0.0.0.1:0.1.0.$0.$1.$0″> Модель Дальтона (1803)Джон Далтон считал, что вся материя состоит из крошечных частиц, называемых атомами, которые он представлял в виде крошечных твердых шариков. Модель Дальтона включала следующие идеи:
- атомы не могут быть разбиты на что-либо более простое
- атомы данного элемента идентичны друг другу
- атомы разных элементов отличаются друг от друга
- во время химических реакций атомы перестраиваются в создавать разные вещества
Модель Томсона (1897)
J.Дж. Томсон открыл электрон. Атомы в целом нейтральны, поэтому в «модели сливового пудинга» Томсона:
Атомы в целом нейтральны, поэтому в «модели сливового пудинга» Томсона:
- атомов – это сферы с положительным зарядом
- электронов разбросаны внутри
Эксперимент Гейгера-Марсдена (1909-1911)
Ганс Гейгер и Эрнест Марсден протестировали модель сливового пудинга. Они направляли пучки положительно заряженных частиц на очень тонкую золотую фольгу. Согласно модели сливового пудинга, эти частицы должны были пройти прямо насквозь.Однако многие из них сменили направление. Эрнест Резерфорд объяснил эти результаты в своей «планетарной модели»:
- атомов имеют центральное положительно заряженное ядро с большей массой 6nrqi7300e.0.0.0.1:0.1.0.$0.$1.$9.$1″> электронов вращаются вокруг ядра, как планеты вокруг звезды
Модель Бора (1913)
Нильс Бор усовершенствовал модель Резерфорда. Используя математические идеи, он показал, что электроны занимают оболочки или энергетические уровни вокруг ядра.
атомных моделей | Chemistry Review [видео]
Привет, и добро пожаловать в этот обзор атомных моделей! Сегодня мы собираемся обсудить атомную модель и эксперименты, которые привели к ее разработке.Мы начнем еще с 400 г. до н.э., когда греческие философы постулировали, что материя состоит из небольших дискретных единиц. Затем мы перенесемся во времени в 1800-е годы и узнаем, как было получено современное описание атома. Давайте начнем!
Прежде чем мы начнем, нам нужно рассмотреть две вещи.
Первый. Проходя историю, попытайтесь представить, каково было жить в разные периоды времени.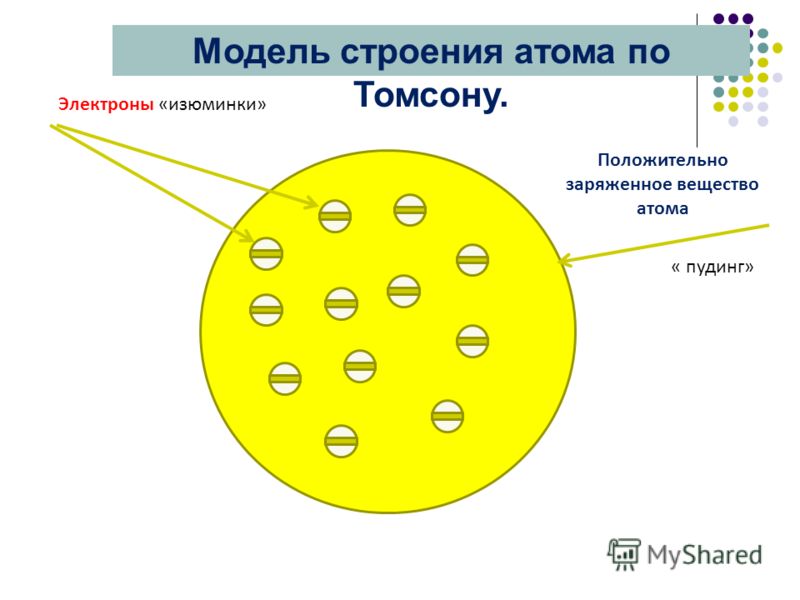 Что, если бы у вас не было смартфона, компьютера или каких-либо современных инструментов для исследования материи? Как бы вы вообще начали доказывать существование атома и описывать его субатомную структуру? Довольно невообразимо, правда? В свое время это были удивительные ученые.
Что, если бы у вас не было смартфона, компьютера или каких-либо современных инструментов для исследования материи? Как бы вы вообще начали доказывать существование атома и описывать его субатомную структуру? Довольно невообразимо, правда? В свое время это были удивительные ученые.
А второй. Хотя это были замечательные ученые, они действительно ошибались. Они провели эксперименты и пришли к выводам. Затем они выдвинули новые гипотезы, основанные на этих выводах, но не смогли их проверить или даже не осознавали, что их нужно проверять. Шло время, новые ученые изучили эти открытия, обнаружили несоответствия, провели новые эксперименты и пришли к новым выводам. Все это часть научного процесса, и это делает науку увлекательной. Так почему бы просто не игнорировать старые неправильные модели? Потому что важно отметить, что эти первые ученые действительно кое-что понимали правильно, и понимание того, что они ошибались, также может быть поучительным.И этот исторический взгляд на развитие атомной модели – отличный способ узнать о научном методе. Важно помнить, что вы должны попытаться мысленно обозначить, какие теории ошибочны. Иногда, просто услышав что-то, даже если вы знаете, что это неправильно, это останется в вашем мозгу как истина. Итак, постарайтесь быть осторожными и мысленно отметьте, какие части каждой теории были правильными, а какие нет!
Важно помнить, что вы должны попытаться мысленно обозначить, какие теории ошибочны. Иногда, просто услышав что-то, даже если вы знаете, что это неправильно, это останется в вашем мозгу как истина. Итак, постарайтесь быть осторожными и мысленно отметьте, какие части каждой теории были правильными, а какие нет!
Хорошо, давайте погрузимся в захватывающую историю атомной модели!
Демокрит
Мы начнем наш рассказ 2400 лет назад с греческого философа Демокрита.
Он рассуждал, что все материалы состоят из маленьких неразрезанных единиц. Он назвал их атомос , что означает «неделимый», отсюда мы и получили современное слово атом . Несколько замечаний о его работе: Демокрит был философом, а не ученым, и он не проводил физические эксперименты, как мы делаем сегодня. Вместо этого он провел скорее мысленный эксперимент. Он считал камень.
Эксперимент с камнем Демокрита
Если он сломает его пополам, каждая половина будет иметь одинаковые свойства. Если он сломает их пополам, четыре части также будут иметь те же свойства. Он экстраполировал этот процесс, рассуждая, что в конечном итоге он доберется до частицы, которую он больше не сможет разрезать, но которая будет иметь те же свойства, что и камень. Хотя он был на правильном пути, его идеи по этому поводу не были строго научными; например, он представлял горькие атомы острыми и заостренными, а сладкие атомы – круглыми и гладкими. Но учитывая, как давно это было, начало было неплохим.
Если он сломает их пополам, четыре части также будут иметь те же свойства. Он экстраполировал этот процесс, рассуждая, что в конечном итоге он доберется до частицы, которую он больше не сможет разрезать, но которая будет иметь те же свойства, что и камень. Хотя он был на правильном пути, его идеи по этому поводу не были строго научными; например, он представлял горькие атомы острыми и заостренными, а сладкие атомы – круглыми и гладкими. Но учитывая, как давно это было, начало было неплохим.
Потребовалось еще 2200 лет для первого большого прогресса в нашем понимании атомной модели.
Джон Далтон
Примерно в 1803 году Джон Далтон изложил то, что в то время было всеобъемлющей атомной теорией, предназначенной для объяснения всей материи и ее свойств. Дальтон собрал большую часть своих данных из экспериментов с газовой фазой и хорошо известен своим законом парциальных давлений.
Накануне его работы ученые установили закон сохранения массы и закон определенного состава. По сути, к тому времени, когда Дальтон сформулировал свою теорию модели атома, ученые установили, что общая масса остается постоянной во время химической реакции.Также было установлено, что любой образец материала содержит элементы в одном и том же соотношении, что, по сути, является истоком стехиометрии.
По сути, к тому времени, когда Дальтон сформулировал свою теорию модели атома, ученые установили, что общая масса остается постоянной во время химической реакции.Также было установлено, что любой образец материала содержит элементы в одном и том же соотношении, что, по сути, является истоком стехиометрии.
Основываясь на этих установленных законах и собственных экспериментах, Дальтон представил свою атомную теорию:
- Вся материя состоит из атомов, которые являются неделимыми единицами элемента, который не может быть создан или разрушен.
- Атомы элемента не могут быть преобразованы в другой элемент. Это был отказ от все еще популярной теории алхимии.
- Все атомы одного и того же элемента идентичны, имеют фиксированную, уникальную массу и свойства.
- В ходе химической реакции атомы рекомбинируют целыми числами с образованием новых соединений с фиксированными соотношениями каждого элемента.
Дальтон предполагал, что атом будет похож на бильярдный шар, полностью твердым и неделимым.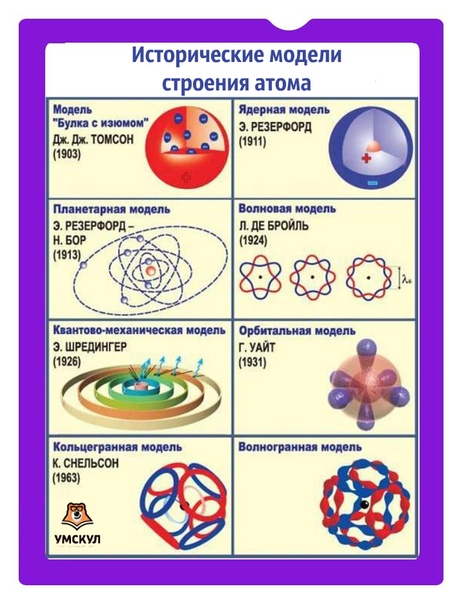 Хотя это объясняло, почему масса сохранялась во время химических реакций и как атомы перестраивались в целые единицы с образованием новых соединений, он не мог знать, что субатомные частицы существуют, а это означает, что теории Дальтона имели несколько недостатков и заблуждений.
Хотя это объясняло, почему масса сохранялась во время химических реакций и как атомы перестраивались в целые единицы с образованием новых соединений, он не мог знать, что субатомные частицы существуют, а это означает, что теории Дальтона имели несколько недостатков и заблуждений.
Во-первых, теперь мы знаем, что в ядерных реакциях атомы могут превращаться в разные элементы. Во-вторых, не все атомы одного и того же элемента имеют одинаковую массу, поскольку существуют разные изотопы. В-третьих, теория Дальтона не могла объяснить, почему атомы связаны наблюдаемыми способами и пропорциями. Такого уровня понимания не будет, пока не будет понятна субатомная структура. Но все же это была прочная основа для будущих ученых.
J. J. Thomson
Следующий большой шаг был сделан сто лет спустя, в 1897 г., когда J.Дж. Томсон открыл электрон и начал исследовать субатомную структуру. Он установил его существование в экспериментах на катодном луче, .
Я избавлю вас от действительно технических деталей катодного луча, но вкратце, это поток электронов, выброшенный из отрицательно заряженного катода и притянутый к положительно заряженному аноду, помещенному в вакуумную камеру.
Однако в начале 1900-х годов ученые горячо спорили, из чего состоит этот луч. Луч реагировал на электрические и магнитные поля, что привело их к выводу, что луч был отрицательно заряжен.Затем Томсон определил, что луч состоит из частиц, которые в 1000 раз легче атома водорода. Он рассуждал так: поскольку эти частицы были меньше атомов, но происходили из материалов, состоящих из атомов, эти атомы должны состоять из более мелких частиц! Томсон назвал эти частицы корпускул , название вскоре было заменено на электрон .
Plum Pudding Model
Кроме того, зная, что атомы нейтральны, Томсон пришел к выводу, что в атоме также должен быть положительный заряд.Без каких-либо экспериментальных доказательств он представлял атом как диффузную сферу положительного заряда со случайным образом распределенными внутри электронами. Он стал известен как сливовый пудинг , модель , названный в честь популярного английского десерта, в котором сливы запекают в пирог.
Это был огромный шаг вперед в понимании субатомной структуры, поскольку он установил существование субатомных частиц. Но очевидно, что без знания ядра Томсон не мог предсказать, что атомы в основном представляют собой пустое пространство, равно как и не мог предсказать конфигурацию электронов.
Физикам не потребовалось много времени, чтобы осветить внутреннее устройство атома.
Эрнест Резерфорд
Всего несколько лет спустя, в 1911 году, Эрнест Резерфорд и его коллеги Ганс Гейгер и Эрнест Марсден открыли ядро, стреляя в золотую фольгу альфа-частицами (высокоскоростными положительно заряженными ионами гелия). Вот основы этого эксперимента.
Они поместили тонкий лист золотой фольги перед источником излучения и в центре кольца, покрытого сульфидом цинка, которое вспыхнуло при ударе альфа-частицы.Таким образом, они могли отслеживать местоположение альфа-частиц после того, как они попали в золотую фольгу.
Поскольку у них не было причин полагать, что модель сливового пудинга ошибочна, они выдвинули гипотезу, что большая часть альфа-частиц будет проходить через атомы золота без каких-либо возмущений, предполагая, что положительный заряд был настолько рассеян, что не оттолкнул бы их.
Вместо этого они обнаружили, что, хотя большинство альфа-частиц действительно проходило прямо через атомы золота, небольшое их количество значительно отклонялось, а некоторые даже отражались прямо обратно к источнику излучения.
Это, конечно, совершенно не соответствовало модели сливового пудинга. Итак, Резерфорд предположил, что положительный заряд атома был сосредоточен в тяжелой массе в центре, в то время как остальная часть атома была в основном пустым пространством.
Это могло бы объяснить, почему некоторые альфа-частицы, которые не попали в положительный центр, прошли прямо через золотую фольгу, а другие частицы, которые действительно попали в положительный центр, значительно отклонились.
Планетарная модель
Резерфорд назвал центр массы ядром , а составляющие положительные частицы протонами – это было еще 20 лет, прежде чем Джеймс Чедвик открыл нейтрон.Хотя этот эксперимент установил, что атомы в основном представляют собой пустое пространство, он не предоставил никаких данных о том, как электроны располагаются вокруг ядра. Однако Резерфорд и его современные ученые поддержали теорию о том, что электроны вращают ядро таким же образом, как планеты вращаются вокруг Солнца в нашей солнечной системе; таким образом, это была «планетарная модель», генерирующая одну из наиболее популярных визуализаций субатомной структуры.
Однако Резерфорд и его современные ученые поддержали теорию о том, что электроны вращают ядро таким же образом, как планеты вращаются вокруг Солнца в нашей солнечной системе; таким образом, это была «планетарная модель», генерирующая одну из наиболее популярных визуализаций субатомной структуры.
Однако эта предложенная электронная конфигурация была проблематичной, поскольку классическая физика предсказывала, что ускоряющиеся электроны будут излучать электромагнитные волны, терять энергию и врезаться в ядро, делая все атомы нестабильными.
Всего два года спустя, Нильс Бор , работая с Резерфордом, проигнорировал некоторых сторонников классического электромагнетизма и включил новую развивающуюся теорию квантовой механики в атомную модель. Он предположил, что электроны вращаются вокруг ядра, но только на определенных радиусах с определенными энергиями.
Эта модель оказалась успешной в предсказании дискретного излучения света водородом, а это означает, что вместо того, чтобы испускать непрерывный световой поток, атомы водорода излучают только световые волны определенной длины. Эти длины волн оказались точной энергией, необходимой для возбуждения электронов между различными уровнями водородной модели Бора.
Эти длины волн оказались точной энергией, необходимой для возбуждения электронов между различными уровнями водородной модели Бора.
К сожалению, модель Бора не смогла предсказать спектр излучения гелия, следующего простейшего атома. Оказывается, в то время как полуклассический / полуквантовый подход Бора работал для одноэлектронных систем, он не мог иметь дело с многоэлектронными системами и, по сути, неправильно концептуализировал электроны.
Это произошло с зарождением современной квантовой механики в 1924 году.
Атомная модель Шредингера
Луи де Бройль предположил, что все движущиеся частицы демонстрируют волнообразное поведение. Это поведение становится более выраженным для более мелких частиц, поэтому важно для электронов (но не настолько для человека). Это привело Эрвина Шредингера к визуализации электронов не как частиц, вращающихся вокруг ядра, а как волн. Таким образом, электроны были распределены в трехмерном пространстве вокруг ядра, а не в единой точечной массе. Модель Шредингера, пожалуй, самая абстрактная из всех атомных моделей, поскольку она определяет, где электрон, вероятно, будет находиться вокруг ядра, а не где он находится точно.
Модель Шредингера, пожалуй, самая абстрактная из всех атомных моделей, поскольку она определяет, где электрон, вероятно, будет находиться вокруг ядра, а не где он находится точно.
Многие из этих идей противоречат тому, что мы наблюдаем в повседневной жизни, и могут показаться странными. Даже ученые того времени восприняли эти идеи с некоторым недоверием. Но математические решения уравнения Шредингера, известные как волновые функции, дают точные экспериментальные результаты с исключительной точностью, поэтому квантовая механика была принята.
Представление Шредингера об атоме было широко принято и подтверждено, но, вероятно, это не конец нашей истории. Все эти ученые на протяжении всей истории думали, что у них есть правильное описание атома, но оказалось, что они ошибались.Так что есть шанс, что впереди нас еще ждут прорывы.
Обзор
Прежде чем мы продолжим, давайте рассмотрим несколько вопросов для обзора, чтобы увидеть, что вы запомнили.
1. Мысленный эксперимент Демокрита с атомной моделью включал разбивание камня пополам, разрушение этих половинок пополам и продолжение процесса. Каким, по его мнению, был бы конечный результат этого процесса?
Мысленный эксперимент Демокрита с атомной моделью включал разбивание камня пополам, разрушение этих половинок пополам и продолжение процесса. Каким, по его мнению, был бы конечный результат этого процесса?
- У вас никогда не закончится материя, которую можно разделить, поэтому вы будете разбивать скалу на всю вечность.
- В конечном итоге вы получите частицу, которую вы больше не сможете разрезать, но которая будет иметь те же свойства, что и исходный камень.
- В конечном итоге вы получите частицу, которая будет иметь другие свойства, чем исходный камень.
Правильный ответ – B.
2. Какая частица, хорошо известная сегодня, была открыта в экспериментах с электронно-лучевыми лучами Дж. Дж. Томсона?
- Электрон
- Протон
- Ядро
После обсуждения того, из чего состоит катодный луч, Томсон определил, что этот луч состоит из частиц, которые в 1000 раз легче водорода. атом.Первоначально он называл их корпускулами, а позже название было изменено на «электрон».
атом.Первоначально он называл их корпускулами, а позже название было изменено на «электрон».
3. Каковы были результаты экспериментов Резерфорда, в которых он поразил тонкий лист золотой фольги альфа-частицами?
- Альфа-частицы прошли сквозь золотую фольгу, не подвергаясь воздействию
- Большая часть альфа-частиц была отклонена золотой фольгой, но некоторые прошли сквозь нее
- Большинство альфа-частиц прошли через золотую фольгу, но некоторые были отклонены.
Резерфорд первоначально предположил, что большая часть альфа-частиц будет проходить через атомы золота без каких-либо возмущений. Однако они обнаружили, что, хотя большинство альфа-частиц действительно проходило прямо через атомы золота, небольшое их количество значительно отклонялось после столкновения с ядром.
Вот и все! Спасибо за просмотр и удачной учебы!
Хронология атомных моделей. Знаете ли вы, что в атомной модели есть… | by IntLink Education
Знаете ли вы, что атомная модель менялась в течение длительного периода времени?
По мере развития научных знаний ученые узнают больше, и их представления об атомной модели меняются.
.
Это история о том, как атомная модель меняется, когда появляются новые свидетельства.
Вот график некоторых из основных идей.
Хронология атомных моделей
- Атомная модель (1808)
- Пудинговая модель (1904)
- Ядерная модель (1911)
- Планетарная модель (1913)
- Квантовая механическая модель (с 1926 года по настоящее время)
Атомная модель: Джон Дальтон
- Материя состоит из небольших неделимых атомов.
- Атомы нельзя разделить, создать или уничтожить.
2.1 Атомы одного и того же элемента обладают одинаковыми свойствами.
2.2 Атомы разных элементов обладают разными свойствами.
3. Атомы различных элементов могут образовывать соединения.
Сливовый пудинг модель: J.J. Thomson
- Атом электрически нейтрален. Это бесплатно.
- В атоме положительные и отрицательные заряды равны.
- Атом состоит из сферы положительных зарядов с внедренным в нее отрицательно заряженным электроном.

Ядерная модель: Эрнест Резерфорд
- Атомы – это в основном пустое пространство.
- Большая часть массы сосредоточена в центре атома. Это крошечное плотное положительно заряженное ядро называется ядром.
- Электроны находятся вне ядра.
Модель планеты: Нильс Бор
- Электроны вращаются вокруг ядра по орбитам, которые имеют определенный размер и энергию.
- Энергия орбиты зависит от ее размера. Самая низкая энергия находится на самой маленькой орбите.
- Электроны находятся на орбитах. Они перемещаются между каждой оболочкой, когда набирают или теряют энергию.
- Набирая энергию, электроны уходят на более дальнюю орбиту от ядра. Теряя энергию, электроны переходят на более близкую орбиту от ядра.
Квантовая механическая модель: Эрвин Шредингер
- Электроны не движутся вокруг ядра по орбитам.
- Электроны существуют на определенных уровнях энергии в виде облака.

- Электронное облако – это область отрицательных зарядов, которая окружает ядро.
- Орбиталь: область с высокой вероятностью содержания электронов.
==========
Facebook: https://www.facebook.com/IntLink.Education/
Twitter: https://twitter.com/Intlink3
Атомные модели | Encyclopedia.com
Ранняя теория атома
Открытие электрона
Первые атомные модели
Открытие протона
Открытие нейтрона
Двойственная природа материи
Боровская модель атома
современная модель атома
Ресурсы
Атом определяется как наименьшая часть элемента, которая сохраняет химические свойства этого элемента.О существовании атомов впервые заговорили еще в 400 г. до н.э., когда греческие философы обсуждали, можно ли разделить вещество на бесконечно меньшие части или в конечном итоге будет достигнута мельчайшая неделимая частица. Около 450 г. до н.э. греческий философ Демокрит предположил, что вся материя состоит из маленьких неделимых частиц, названных atomos (что означает неделимые). Его идеи были встречены большой критикой, и только в начале 1800-х годов атомная теория полностью утвердилась в научной мысли.
Его идеи были встречены большой критикой, и только в начале 1800-х годов атомная теория полностью утвердилась в научной мысли.
Атомные модели берут начало в ранней теории атома. Закон сохранения массы, закон определенных пропорций и закон множественных пропорций предоставили модели поведения химических реакций, но эти законы нельзя было объяснить. В 1808 году Джон Дальтон (1766–1844) предложил свою атомную теорию, которая послужила объяснением этих явлений. Его теория состоит из пяти постулатов. Первый постулат утверждает, что вся материя состоит из атомов. Во-вторых, все атомы данного элемента абсолютно одинаковы по структуре и свойствам.В-третьих, атомы не могут быть далее разделены, созданы или уничтожены. В-четвертых, атомы разных элементов объединяются в соединения. Наконец, химические реакции включают объединение, разделение и перегруппировку атомов. Эти пять постулатов не только объяснили законы сохранения массы, определенных пропорций и множественных пропорций, но также послужили основой для изучения и развития различных атомных моделей.
Не вся атомная теория Дальтона выдержала проверку временем.Эволюция атомной модели привела к открытию, что атомы делятся на более мелкие частицы и что не все атомы данного элемента в точности одинаковы. В конце 1800-х годов ученые обнаружили, что атомы состоят из трех субатомных частиц, называемых протонами, нейтронами и электронами. Протоны и нейтроны расположены в центральной области атома, называемой ядром, а электроны занимают пространство, окружающее ядро. Число и расположение каждой из этих частиц в атоме определяют химические свойства элемента.Атомы одного и того же элемента могут различаться по количеству нейтронов (называемых изотопами), а также по количеству электронов (называемых ионами). Число протонов определяет химическую идентичность элемента. Открытие этих субатомных частиц, наряду с атомной теорией Дальтона, положило начало развитию нескольких атомных моделей. Достижения современной физики позволили ученым найти большое количество субатомных частиц, включая кварки, которые являются фундаментальными субатомными частицами, которые образуют протоны и нейтроны.
Открытие первой субатомной частицы, электрона, стало результатом экспериментов, связанных с воздействием электричества на материю. В конце 1800-х годов электронно-лучевая трубка была разработана и использовалась в нескольких исследованиях. Электронно-лучевая трубка – это частично вакуумированная стеклянная трубка, содержащая газ под низким давлением. На одном конце трубки расположен катод, а на другом – анод. Катод и анод подключены к источнику напряжения. Источник напряжения создает ток, который может проходить через застрявший внутри газ.Ранние эксперименты показали, что ток заставляет поверхность трубки прямо напротив катода светиться. Было высказано предположение, что поток частиц, исходящий от катода и движущийся к аноду, вызывает свечение. Этот поток частиц был назван катодным лучом. Когда лопаточное колесо было помещено в трубку, оно катилось от катода к аноду, что показало, что частицы, составляющие катодный луч, имеют массу. Под воздействием магнитного поля катодный луч отклонялся так же, как электрический ток, имеющий отрицательный заряд. Таким образом, был сделан вывод, что частицы, составляющие катодный луч, имеют не только массу, но и отрицательный заряд.
Таким образом, был сделан вывод, что частицы, составляющие катодный луч, имеют не только массу, но и отрицательный заряд.
Английский физик Джозеф Джон Томсон (1856–1940) подтвердил эти открытия в 1897 году. Томсон провел серию экспериментов, в которых он смог определить отношение заряда частиц, составляющих катодный луч, к их массе путем измерения отклонение лучей при изменении магнитного и электрического полей. Томпсон провел те же эксперименты, используя разные металлы для катода и анода, а также разные газы внутри трубки.Его эксперименты показали, что величину отклонения можно предсказать математически. Томсон обнаружил, что отношение заряда к массе всегда было одинаковым, независимо от используемых материалов. Затем он пришел к выводу, что все катодные лучи состоят из одних и тех же частиц, которые позже был назван электронами другим английским физиком, Дж. Джонстоном Стони (1826–1911).
Американский физик Роберт А. Милликен (1868–1953) из Чикагского университета провел эксперименты, которые еще раз подтвердили результаты Томсона. В ходе своих экспериментов с «масляной каплей» в 1909 году он обнаружил, что масса одного электрона составляет примерно одну двухтысячную массы атома водорода. В экспериментах он использовал рентгеновские лучи, чтобы придать каплям масла отрицательный заряд. Затем он распылил эти капли через аппарат, позволив им упасть между двумя электрически заряженными пластинами. Он изменил заряд на двух пластинах и измерил, как это изменение повлияло на скорость падения капель. Используя эти данные, он подсчитал, что заряд каждой капли масла каждый раз был кратен одному и тому же числу, и пришел к выводу, что это должен быть заряд одного электрона.Используя это число и отношение заряда к массе Томпсона, он смог вычислить массу одного электрона. Он рассудил, что, поскольку катодные лучи демонстрируют одинаковое отклонение для любого используемого газа, электроны должны присутствовать в атомах всех элементов. Поскольку электроны имеют отрицательный заряд, а все атомы электрически нейтральны, в атоме также должен быть положительный заряд.
В ходе своих экспериментов с «масляной каплей» в 1909 году он обнаружил, что масса одного электрона составляет примерно одну двухтысячную массы атома водорода. В экспериментах он использовал рентгеновские лучи, чтобы придать каплям масла отрицательный заряд. Затем он распылил эти капли через аппарат, позволив им упасть между двумя электрически заряженными пластинами. Он изменил заряд на двух пластинах и измерил, как это изменение повлияло на скорость падения капель. Используя эти данные, он подсчитал, что заряд каждой капли масла каждый раз был кратен одному и тому же числу, и пришел к выводу, что это должен быть заряд одного электрона.Используя это число и отношение заряда к массе Томпсона, он смог вычислить массу одного электрона. Он рассудил, что, поскольку катодные лучи демонстрируют одинаковое отклонение для любого используемого газа, электроны должны присутствовать в атомах всех элементов. Поскольку электроны имеют отрицательный заряд, а все атомы электрически нейтральны, в атоме также должен быть положительный заряд.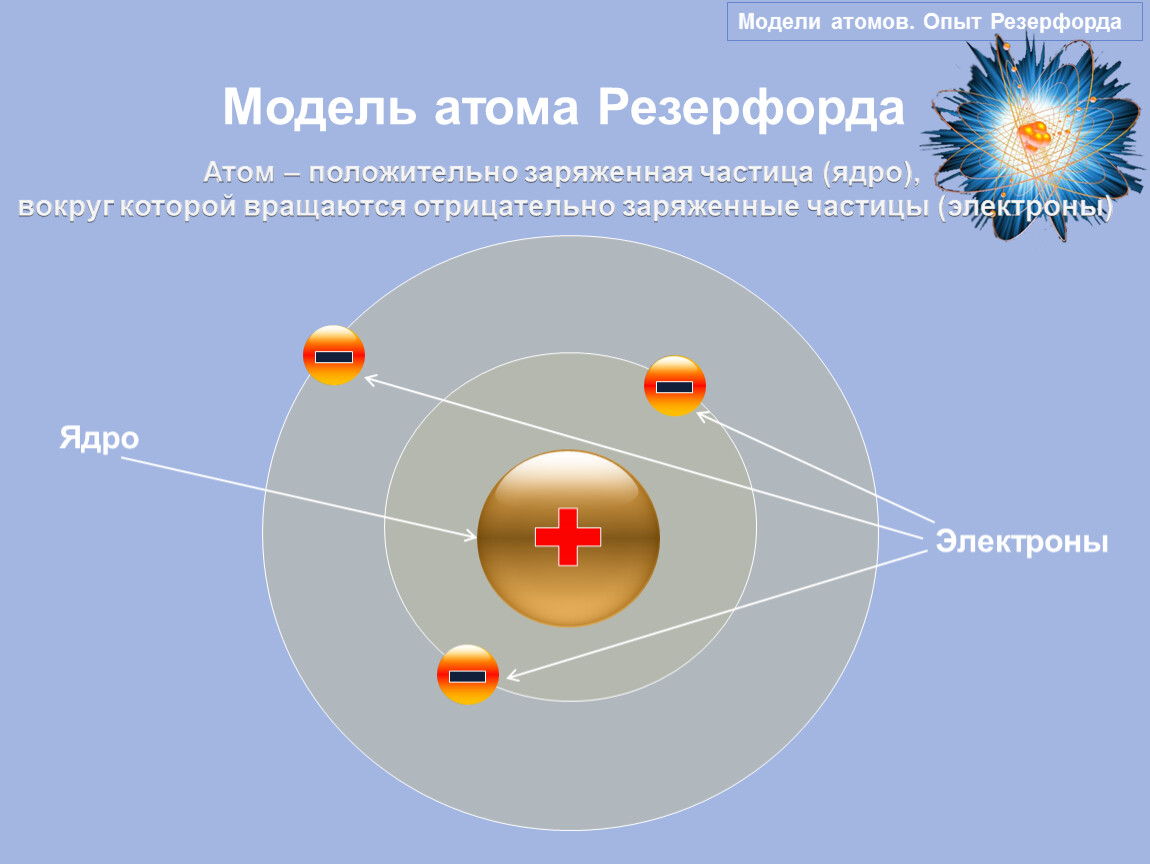 Кроме того, поскольку масса электрона намного меньше массы всего атома, в атоме должны присутствовать другие частицы, составляющие большую часть его массы.Эти результаты были первыми, показавшими, что атомы действительно делимы, и легли в основу первой атомной модели.
Кроме того, поскольку масса электрона намного меньше массы всего атома, в атоме должны присутствовать другие частицы, составляющие большую часть его массы.Эти результаты были первыми, показавшими, что атомы действительно делимы, и легли в основу первой атомной модели.
Томсон использовал эти результаты, чтобы сформулировать свою модель атома «сливового пудинга» между 1903–1907 годами. Эта модель была адаптацией аналогичной модели, впервые предложенной лордом Кельвином (1824–1907) в 1902 году. Согласно этой модели отрицательно заряженные электроны атома находятся в положительно заряженном материале, как сливы в сливовом пудинге. Если бы один из электронов сместился, он вернется в исходное положение.Это дало стабильную модель нейтрального атома. Примерно в то же время японский физик Хантаро Нагоака разработал «сатурнианскую» модель атома. В 1904 году Нагаока предположил, что атом похож на планету Сатурн. Сама планета была областью положительного заряда, вокруг которой вращались кольца электронов. Согласно этой модели, атом был нестабильным, потому что электроны, движущиеся кольцами вокруг положительного заряда, постепенно теряли бы энергию и в конечном итоге попадали в центральную область.
Согласно этой модели, атом был нестабильным, потому что электроны, движущиеся кольцами вокруг положительного заряда, постепенно теряли бы энергию и в конечном итоге попадали в центральную область.
Модель «сливового пудинга» Томсона завоевала признание «сатурнианской» модели Нагаока, но была принята всего на несколько лет.В 1911 году новозеландский ученый Эрнест Резерфорд (1871–1937) предложил свою атомную модель, основанную на своих знаменитых экспериментах с золотой фольгой. Вместе со своими коллегами Хансом Гейгером (1882–1945) и Эрнестом Мардсеном Резерфорд направил поток альфа-частиц на тонкий лист золотой фольги. Альфа-частицы имеют положительный заряд (+2) и примерно в четыре раза массивнее атома водорода. Их гипотеза заключалась в том, что альфа-частицы будут проходить через золотую фольгу с минимальным отклонением, поскольку масса и заряд равномерно распределены по всему атому, как это было предложено Томсоном.Данные не соответствовали этому предположению.
Некоторые альфа-частицы отклонялись на большие углы при прохождении через золотую фольгу. Что еще более удивительно, примерно одна из 8000 частиц отклонялась прямо к источнику. По словам Резерфорда, это было «как если бы вы выпустили 15-дюймовый (38-сантиметровый) артиллерийский снаряд по куску папиросной бумаги, а он вернулся и попал в вас». Он предположил, что отклоненные альфа-частицы должны были контактировать с плотно упакованным положительным зарядом.Он назвал эту область положительного заряда ядром. Ядро окружено пустым пространством, в котором электроны кружили, как планеты вокруг Солнца. Эти эксперименты показали, что у атома есть крошечное ядро. Несмотря на свой минимальный размер, ядро содержало большую часть массы атома.
Что еще более удивительно, примерно одна из 8000 частиц отклонялась прямо к источнику. По словам Резерфорда, это было «как если бы вы выпустили 15-дюймовый (38-сантиметровый) артиллерийский снаряд по куску папиросной бумаги, а он вернулся и попал в вас». Он предположил, что отклоненные альфа-частицы должны были контактировать с плотно упакованным положительным зарядом.Он назвал эту область положительного заряда ядром. Ядро окружено пустым пространством, в котором электроны кружили, как планеты вокруг Солнца. Эти эксперименты показали, что у атома есть крошечное ядро. Несмотря на свой минимальный размер, ядро содержало большую часть массы атома.
Эта модель не получила широкого распространения среди физиков, потому что было трудно объяснить, как такая маленькая часть атома может нести большую часть массы. Он также предположил, что заряд ядра определяет свойства атома, что не согласуется с периодической таблицей элементов Дмитрия Менделеева.По мнению Менделеева, его свойства определяет атомная масса элемента, а не заряд ядра. Более того, он не объяснял, что удерживало отрицательно заряженные электроны от падения в положительно заряженное ядро.
Более того, он не объяснял, что удерживало отрицательно заряженные электроны от падения в положительно заряженное ядро.
Английский ученый Генри Гвин Джеффрис Мозли (1887–1915) вскоре раскрыл тайну ядерного заряда, определяющего свойства атома. Мозли обнаружил в 1913 году, что каждый элемент содержит уникальный положительный заряд в своем ядре. Ядро атома должно содержать положительно заряженные частицы, называемые протонами.Следовательно, количество заряда или количество протонов в его ядре определяет идентичность элемента. Число протонов в ядре называется атомным номером. Мозли утверждал, что периодическая таблица должна быть организована в порядке увеличения атомного номера, а не увеличения атомной массы. Такое расположение позволило составить полную таблицу Менделеева с правильными предсказаниями того, где новые элементы еще не были обнаружены.
Открытие протона привело к другой загадке.Было известно, что масса атома водорода больше, чем масса протона и электрона, сложенные вместе. Ученые искали источник недостающей массы, предполагая, что в ядре атома должна существовать другая частица, которая также вносит вклад в массу атома. Эта частица должна быть нейтральной по заряду, поскольку положительно заряженные протоны нейтрализуют заряд отрицательно заряженных электронов, а атом в целом нейтрален. Поскольку он электрически нейтрален, обнаружение этой недостающей частицы было проблематичным.Эта третья частица была обнаружена примерно через 30 лет после открытия электрона.
Ученые искали источник недостающей массы, предполагая, что в ядре атома должна существовать другая частица, которая также вносит вклад в массу атома. Эта частица должна быть нейтральной по заряду, поскольку положительно заряженные протоны нейтрализуют заряд отрицательно заряженных электронов, а атом в целом нейтрален. Поскольку он электрически нейтрален, обнаружение этой недостающей частицы было проблематичным.Эта третья частица была обнаружена примерно через 30 лет после открытия электрона.
Ирен Жолио-Кюри (1897–1956) провела эксперименты, в которых она бомбардировала образец бериллия альфа-частицами. В результате этих экспериментов был получен новый пучок с более высокой проникающей способностью, чем пучок альфа-частиц. В 1932 году британский ученый Джеймс Чедвик (1891–1974) обнаружил, что этот новый пучок состоит из частиц примерно такой же массы, как и протоны. Кроме того, магнитные или электрические поля не могли отклонить этот луч.Чедвик пришел к выводу, что пучок должен состоять из нейтральных частиц примерно того же размера, что и протоны, которые он назвал нейтронами. Нейтроны вместе с протонами составляют ядро атома и составляют большую часть его массы. Электроны расположены в пустом пространстве, окружающем атом, которое составляет большую часть его объема. Масса электрона ничтожна по сравнению с массой протонов и нейтронов.
Нейтроны вместе с протонами составляют ядро атома и составляют большую часть его массы. Электроны расположены в пустом пространстве, окружающем атом, которое составляет большую часть его объема. Масса электрона ничтожна по сравнению с массой протонов и нейтронов.
Даже после открытия протона атомная модель Резерфорда все еще не объясняла, как электроны могут иметь стабильные орбиты вокруг ядра.Разработка математической постоянной немецким физиком Максом Планком (1858–1947) послужила основой для следующей модели атома. Планк разработал свою постоянную в 1900 году, объясняя, как свет испускается горячими объектами. Он предположил, что электромагнитное излучение может быть связано только с определенным количеством энергии, которое он назвал квантами. Энергия, потерянная или полученная атомом, должна происходить в кванте, который можно рассматривать как «пакет», содержащий минимальное количество энергии. Он описал связь между квантом энергии и частотой испускаемого излучения математически уравнением E = hλ (где E – энергия в джоулях одного кванта излучения, а λ – частота излучения). Буква h символизирует постоянную Планка.
Буква h символизирует постоянную Планка.
В 1905 году Альберт Эйнштейн (1879-1955) разработал теорию, согласно которой свет имеет двойную природу. Свет действует не только как волна, но и как частица. Каждая частица света имеет связанный с ней квант энергии, который называется фотоном. Энергию фотона можно выразить с помощью уравнения Планка. Гипотеза Эйнштейна помогла объяснить свет, излучаемый при пропускании тока через газ в электронно-лучевой трубке. Говорят, что атом с наименьшей возможной потенциальной энергией находится в основном состоянии.Когда ток проходит через газ при низком давлении, потенциальная энергия атомов увеличивается. Говорят, что атом, имеющий более высокую потенциальную энергию, чем его основное состояние, находится в возбужденном состоянии. Атом в возбужденном состоянии нестабилен и вернется в основное состояние. Когда это происходит, он испускает потерянную энергию в виде электромагнитного излучения (фотона). Когда электрический ток проходит через элементарный газ, излучается свет характерного цвета.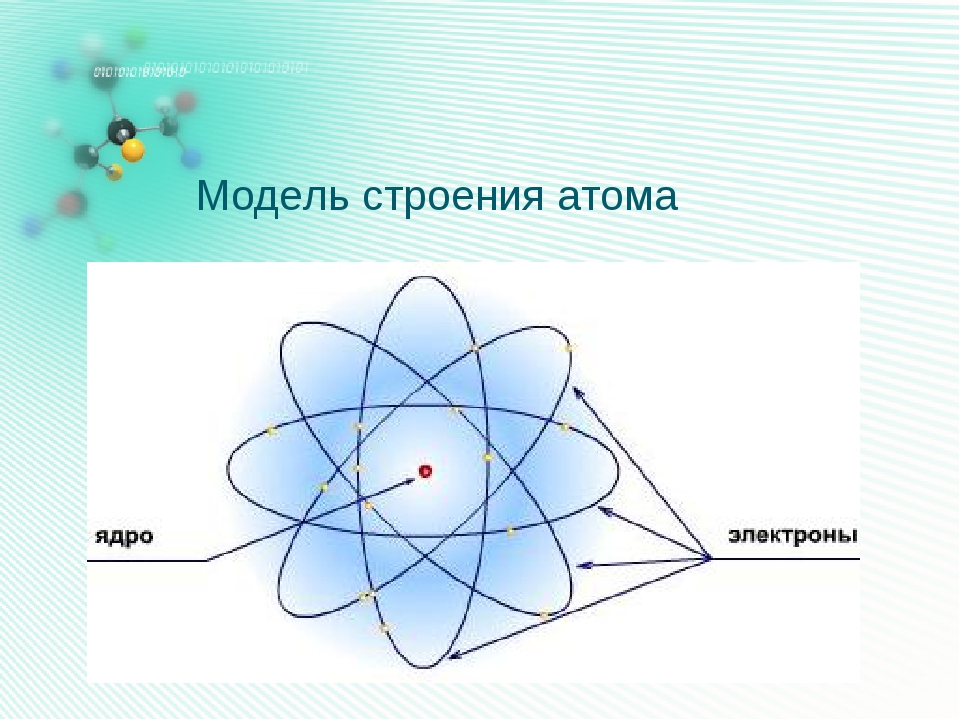 Этот свет может проходить через призму, где он разделяется на различные световые полосы с определенными длинами волн.Эти полосы известны как линейчатый спектр излучения этого элемента. Спектр линейного излучения водорода был первым, который был описан математически. Теперь перед учеными стояла задача разработать модель атома, которая могла бы объяснить это математическое соотношение.
Этот свет может проходить через призму, где он разделяется на различные световые полосы с определенными длинами волн.Эти полосы известны как линейчатый спектр излучения этого элемента. Спектр линейного излучения водорода был первым, который был описан математически. Теперь перед учеными стояла задача разработать модель атома, которая могла бы объяснить это математическое соотношение.
В 1913 году датский теоретик Нильс Бор (1885–1962) разработал квантованную оболочечную модель атома. Бор модифицировал модель Резерфорда, предположив, что электроны вращаются вокруг ядра в определенных областях с фиксированным размером и энергией.Энергия электрона зависит от размера орбиты. Электроны на самых маленьких орбитах имеют наименьшую энергию. Атом устойчив, когда его электроны занимают орбиты с минимально возможной энергией. Энергия электрона увеличивается по мере того, как он перемещается по орбитам все дальше и дальше от ядра.
Эти орбиты можно рассматривать как ступеньки лестницы.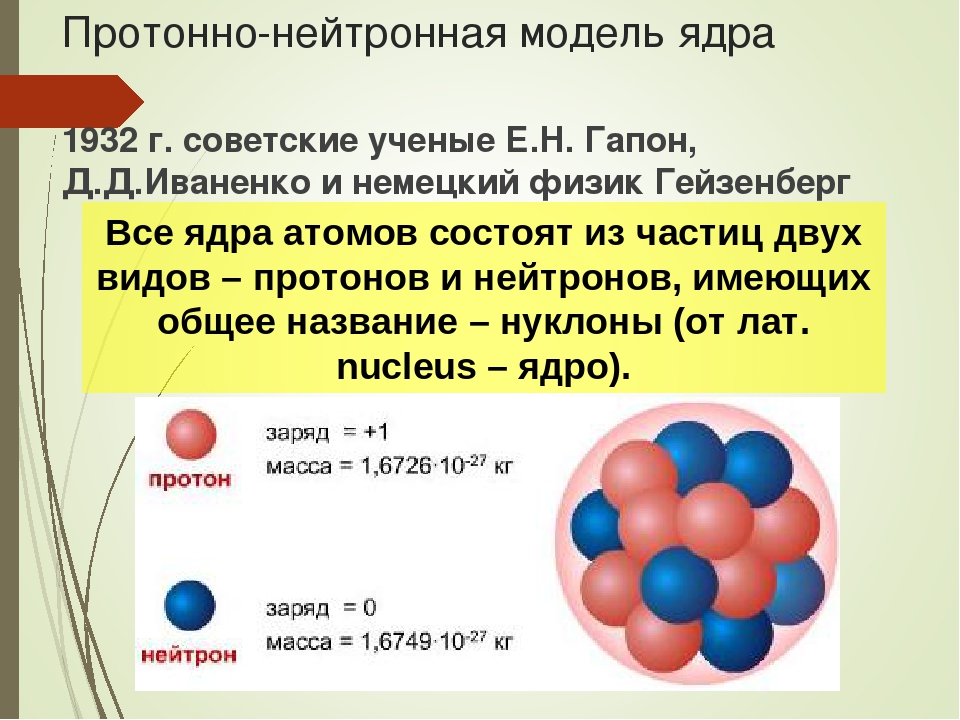 Когда человек поднимается по лестнице, он ступает на ту или иную ступеньку, но не между ступенями, потому что человек не может стоять в воздухе. Точно так же электроны атома могут занимать ту или иную орбиту, но не могут находиться между орбитами.Находясь на орбите, электрон имеет фиксированное количество энергии. Электрон набирает или теряет энергию, перемещаясь на новую орбиту, дальше от ядра или ближе к нему.
Когда человек поднимается по лестнице, он ступает на ту или иную ступеньку, но не между ступенями, потому что человек не может стоять в воздухе. Точно так же электроны атома могут занимать ту или иную орбиту, но не могут находиться между орбитами.Находясь на орбите, электрон имеет фиксированное количество энергии. Электрон набирает или теряет энергию, перемещаясь на новую орбиту, дальше от ядра или ближе к нему.
Когда электрон переходит из возбужденного состояния в основное, излучается фотон с определенной энергией. Энергия фотона равна разнице энергий между двумя орбитами. Энергия каждого фотона соответствует определенной частоте излучения, заданной уравнением Планка, E = hλ. Бор смог вычислить энергию электрона в атоме водорода, измерив длины волн света, излучаемого в его линейчатом спектре излучения.Атомная модель Бора была очень стабильной, потому что электрон не мог потерять больше энергии, чем на самой маленькой орбите. Одна из основных проблем модели Бора заключалась в том, что она не могла объяснить свойства атомов с более чем одним электроном, и к началу 1920-х годов начались поиски новой модели атома.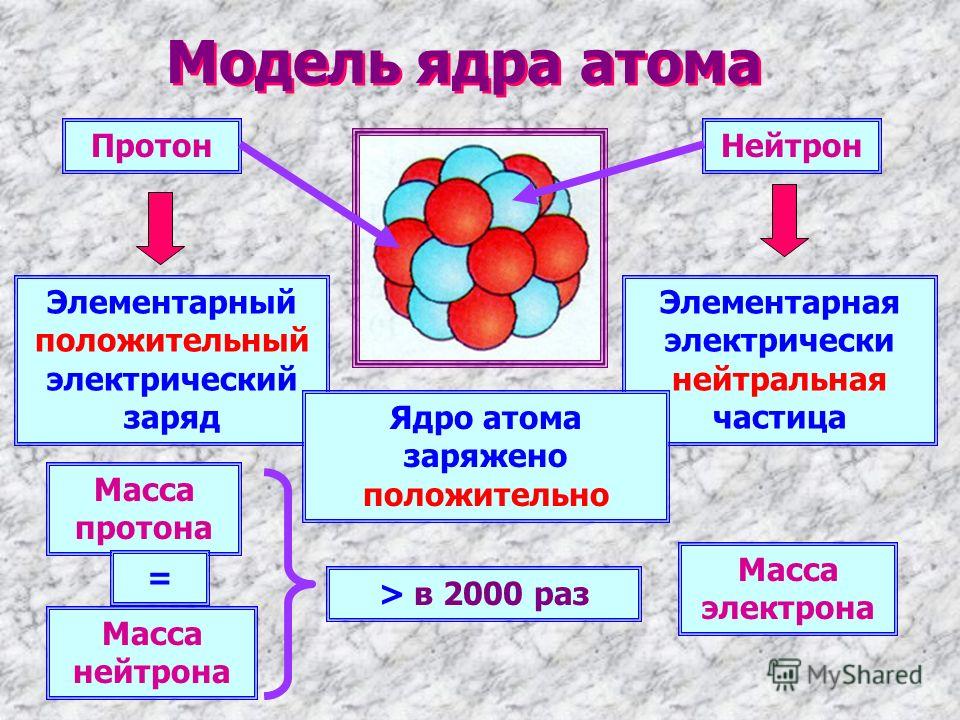
Развитие квантовой механики легло в основу современной теории атома. В 1922 году американский физик Артур Х. Комптон (1892–1962) провел эксперименты по рассеянию рентгеновских лучей, которые подтвердили и развили теорию Эйнштейна о двойственной природе света.В 1923 году французский физик Луи-Виктор де Бройль (1892–1987) расширил эту теорию, предположив, что вся материя, а также излучение, ведут себя как частица и волна. До этого времени ученые рассматривали материю и энергию как отдельные явления, подчиняющиеся разным законам.
Предложение Бройля не было подтверждено экспериментальными или математическими данными до 1926 года, когда австрийский физик Эрвин Шредингер (1887–1961) разработал свое математическое волновое уравнение. Шредингер предположил, что электроны тоже ведут себя как волны.Его волновое уравнение можно было использовать для определения частоты электронов, а затем уравнение Планка можно было использовать для определения соответствующей энергии. Уравнение Шредингера дает гораздо более точное описание местоположения и энергии электрона, чем модель Бора. Его также можно использовать для атомов с более чем одним электроном. Кроме того, с помощью его уравнения можно было решить только волны определенных частот. Это продемонстрировало, что для электронов в атоме возможны только определенные энергии.Дальнейшие эксперименты показали, что Бройль был прав в своем утверждении, что материя может вести себя как волны, поскольку электроны дифрагируют и проявляют интерференцию.
Его также можно использовать для атомов с более чем одним электроном. Кроме того, с помощью его уравнения можно было решить только волны определенных частот. Это продемонстрировало, что для электронов в атоме возможны только определенные энергии.Дальнейшие эксперименты показали, что Бройль был прав в своем утверждении, что материя может вести себя как волны, поскольку электроны дифрагируют и проявляют интерференцию.
В 1927 году немецкий физик Вернер Гейзенберг (1901–1976) разработал то, что сейчас известно как принцип неопределенности Гейзенберга. Эта гипотеза утверждает, что положение и скорость электрона или любой движущейся частицы не могут быть известны одновременно. Это означало, что решения волнового уравнения Шредингера, известные как волновые функции, могли описывать только вероятность нахождения электрона на заданной орбите.Следовательно, электроны не расположены на дискретных орбитах, как предполагалось в модели Бора, а вместо этого занимают более туманную область, называемую орбиталью. Орбиталь указывает на вероятное расположение электронов в атоме, а не на определенный путь, по которому они следуют. Вероятное расположение электронов на орбитали описывается серией чисел, называемых квантовыми числами.
Орбиталь указывает на вероятное расположение электронов в атоме, а не на определенный путь, по которому они следуют. Вероятное расположение электронов на орбитали описывается серией чисел, называемых квантовыми числами.
Квантовая модель атома использует четыре квантовых числа для описания расположения электронов в атоме, подобно тому, как адрес описывает расположение домов на улице.Такое расположение известно как электронная конфигурация. Атомы каждого элемента имеют свою собственную отличную электронную конфигурацию. Электронная конфигурация атома в основном состоянии представляет собой расположение электронов в атоме с самой низкой энергией. Размещение электронов в определенной конфигурации основано на трех принципах. Первый, принцип Ауфбау, гласит, что электрон будет занимать орбиталь с наименьшей возможной энергией. Принцип исключения Паули гласит, что каждый электрон в атоме имеет свой собственный набор из четырех квантовых чисел.Никакие два электрона в атоме не будут иметь одинаковый набор.
Наконец, правило Хунда гласит, что даже если каждая орбиталь может содержать два электрона, электроны будут занимать орбитали, так что существует максимальное количество орбиталей только с одним электроном. Правило Хунда, разработанное немецким ученым Фридрихом Хундом (1896–1997), позволяет ученым предсказывать порядок, в котором электроны заполняют суборбитальные оболочки атома.
Правило Хунда основано на принципе Ауфбау, который гласит, что электроны добавляются к самому низкому доступному энергетическому уровню атома.Вокруг каждого атомного ядра электроны занимают энергетические уровни, называемые оболочками. Каждая оболочка имеет сферическую s-орбиталь, и, начиная со второй оболочки, орбитали ( p, d, f и т. Д.) И суборбитали (например, 2 px , 2 py , 2 pz ) с различный размер, форма и ориентация (т. е. направление в пространстве).
Хотя каждая суборбиталь может содержать два электрона, все электроны несут отрицательные заряды, и, поскольку заряды отталкиваются, электроны отталкиваются друг от друга.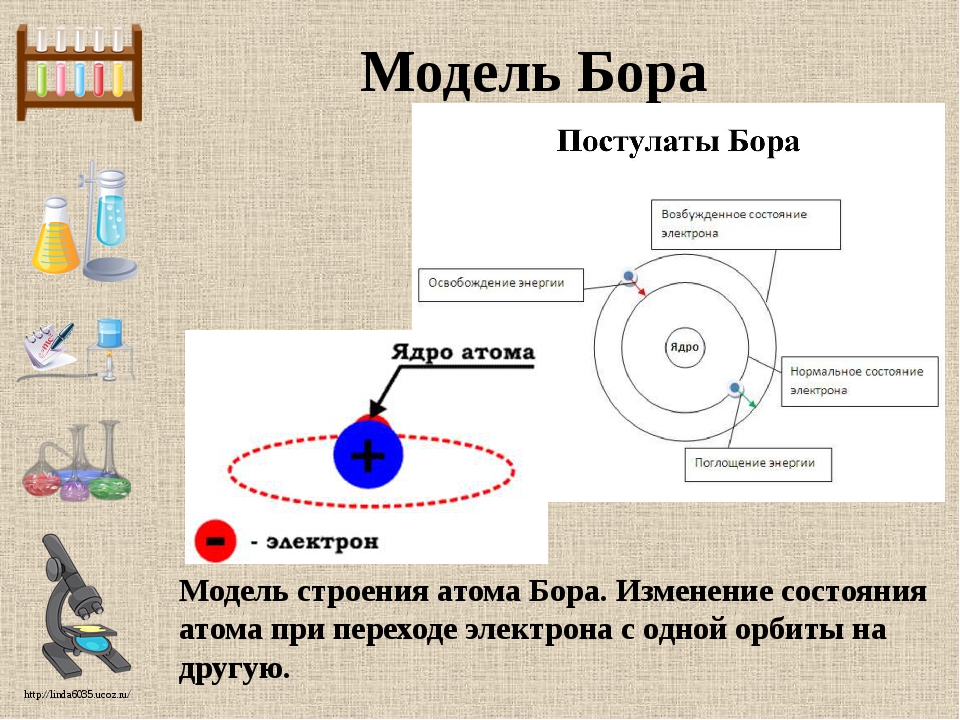 В соответствии с правилом Хунда, электроны располагаются как можно дальше друг от друга, занимая все доступные свободные суборбитали, прежде чем объединиться в пару с другим электроном. Все неспаренные электроны имеют одно и то же спиновое квантовое число (представленное на диаграммах конфигурации электронов стрелками, направленными вверх или вниз).
В соответствии с правилом Хунда, электроны располагаются как можно дальше друг от друга, занимая все доступные свободные суборбитали, прежде чем объединиться в пару с другим электроном. Все неспаренные электроны имеют одно и то же спиновое квантовое число (представленное на диаграммах конфигурации электронов стрелками, направленными вверх или вниз).
В соответствии с принципом исключения Паули, который гласит, что каждый электрон должен иметь свой собственный уникальный набор квантовых чисел, определяющих его энергию, и поскольку все электроны имеют спин 1/2, каждая суборбиталь может содержать только до двух электронов. если их вращения парные +1/2 с –1 / 2.На схемах электронной конфигурации спаренные электроны с противоположными спинами представлены парными стрелками, указывающими вверх и вниз.
Хотя правило Хунда точно предсказывает электронную конфигурацию большинства элементов, существуют исключения, особенно когда атомы и ионы имеют возможность получить дополнительную стабильность, заполнив s оболочки или наполовину заполненные d или f орбитали.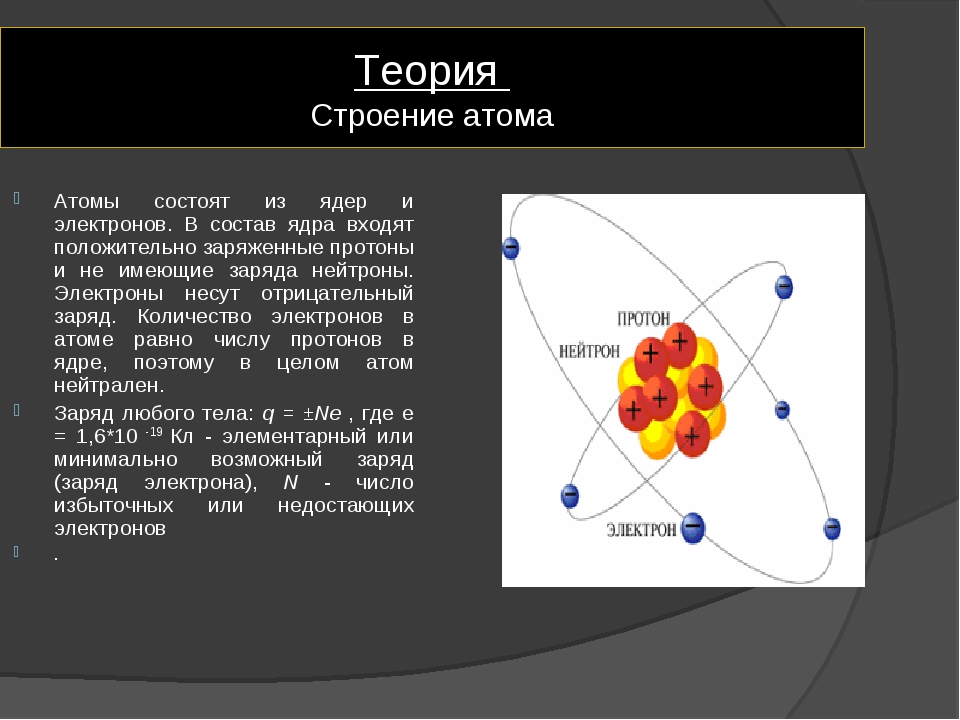
В 1928 году английский физик П. А. М. Дирак (1902–1984) сформулировал новое уравнение для описания электрона.Уравнение Шредингера не допускало принципов относительности и могло использоваться только для описания движения частиц, которые медленнее скорости света. Поскольку электроны движутся с гораздо большей скоростью, Дирак ввел четыре новые волновые функции для описания поведения электронов. Эти функции описывают электроны в различных состояниях. Два состояния соответствовали ориентации их спинов в атоме, но два других не могли быть объяснены. В 1932 году американский физик Карл Дэвид Андерсон (1905–1991) открыл позитрон, который объяснил два загадочных состояния, описанных Дираком.
См. Также Атомная спектроскопия; Атомный вес; Электромагнитный спектр; Детекторы частиц; Квантовая механика.
КЛЮЧЕВЫЕ ТЕРМИНЫ
Альфа-частица – два протона и два нейтрона, связанные вместе и испускаемые ядром во время некоторых видов радиоактивного распада.
Анод – положительно заряженный электрод.
Катод – отрицательно заряженный электрод.
Электромагнитное излучение — Энергия фотонов, обладающая свойствами как частиц, так и волн.Основные диапазоны длин волн от коротких до длинных: космические, ультрафиолетовые, видимые или «световые», инфракрасные и радио.
Закон сохранения массы – Масса не создается и не разрушается во время обычных химических или физических реакций.
Закон определенных пропорций – Химическое соединение содержит одни и те же элементы в точно таких же массовых пропорциях, независимо от размера образца или источника соединения.
Закон множественных пропорций – Если два или более различных соединения состоят из одних и тех же двух элементов, то отношение масс второго элемента в сочетании с определенной массой первого элемента всегда является отношением малых целых чисел. .
Позитрон – положительно заряженная частица, имеющая ту же массу и величину заряда, что и электрон.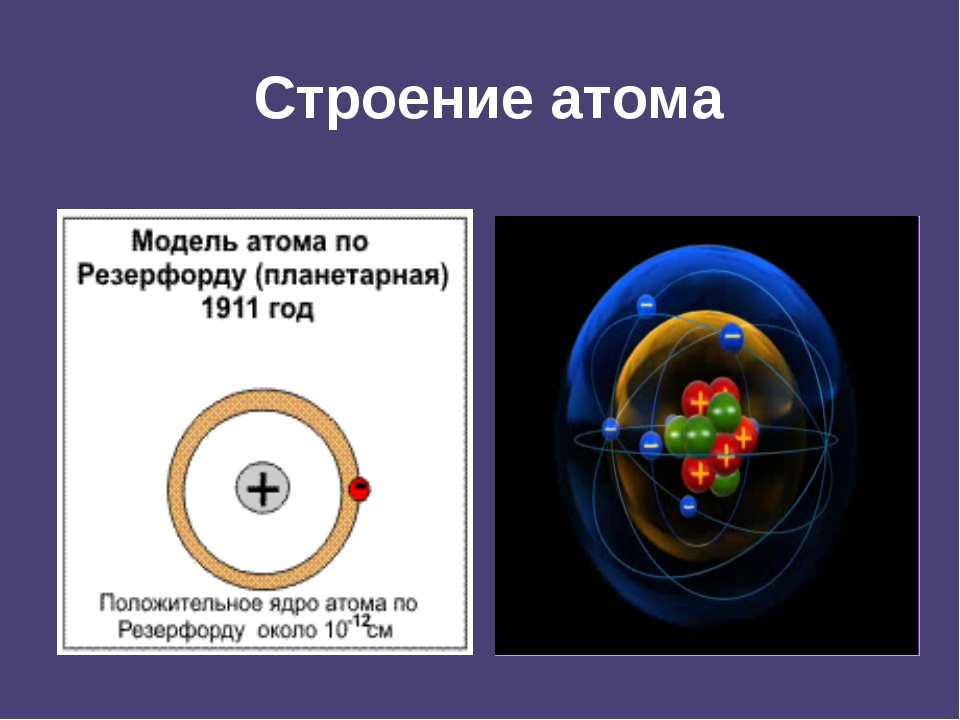
Потенциальная энергия — Сохраненная энергия.
Кварки – Считается, что это самые фундаментальные единицы протонов и нейтронов.
Субатомная частица —Элементарная частица меньше атома. Протоны, нейтроны и электроны являются примерами субатомных частиц.
КНИГИ
Браун, Теодор Э., и другие. Химия: центральные науки . 10-е изд. Аппер-Сэдл-Ривер, Нью-Джерси: Прентис-Холл, 2005.
Кук, Норман Д. Модели атомного ядра . Нью-Йорк: Springer, 2006.
Хейлброн, Дж. Л. Эрнест Резерфорд и взрыв атомов . Нью-Йорк: Oxford University Press, 2003.
Lodge, Оливер. Атомы и лучи: введение в современные взгляды на структуру атома и излучение . Кила, MT: Kessinger Publishing, 2003.
OTHER
Группа данных по частицам.Национальная лаборатория Лоуренса Беркли
. «Приключение частиц: основы материи и силы»  ).
).
К. Ли Лернер
Дженнифер МакГрат
Как возникли различные атомные модели?
От эпохи древнегреческой философии до современной квантовой механики теория атома претерпела множество обновлений, каждое из которых было революционным для своего времени.
Наше понимание природы вещей вокруг нас постоянно меняется. То, что сейчас кажется довольно очевидным, могло не существовать столетие назад или могло устареть в ближайшие десятилетия. Прекрасным примером того, как наука со временем совершенствовалась, была эволюция теории атома.
Давайте начнем с старых добрых времен, когда наука не основывалась на доказательствах, а больше походила на форму философии; люди верили, что все состоит всего из четырех элементов – воды, огня, земли и воздуха.Представьте, насколько легко было бы тогда химия!
Демокрит
Около 400 г. до н.э. греческий философ по имени Демокрит выдвинул теорию о том, что все в мире состоит из крошечных неразрушимых частиц, названных «атомос», что означает «неразрезанный». Он считал, что свойства материалов зависят от типа атома, из которого они сделаны. Например, кислые или острые на вкус вещи были сделаны из частиц с заостренными краями, сладкие – из более округлых и гладких атомов, а металлы – из твердых атомов.Если не считать этого неправильного толкования формы, Демокрит был в значительной степени на правильном пути в отношении атомного состава, определяющего свойства вещества.
Однако эта теория была в значительной степени дискредитирована Аристотелем, первоначальным общественным деятелем, который считал, что все на планете состоит из четырех элементов: земли, огня, воды и воздуха.
Джон Далтон
Следующая остановка в постоянно меняющейся теории атома была сделана почти 2000 лет спустя британским химиком и энтузиастом метеорологии по имени Джон Далтон.Он проводил эксперименты, в которых смешивал два газа и наблюдал за их поведением. Большинство газов, которые он тестировал, существовали независимо, не беспокоясь о присутствии других. Однако он обнаружил нечто иное, когда оксиду азота позволили взаимодействовать с атмосферным кислородом. 36 мер чистого азотистого газа прореагировали на 100 мер воздуха, дав 80 мер нового газа, который не был ни азотистым, ни кислородсодержащим.
Это вызвало его любопытство, поэтому он провел тот же эксперимент с разными объемами газа.Он заметил, что газы реагируют друг с другом только в фиксированном соотношении, что привело к закону множественных пропорций и теории атомизма.
Дальтон предположил, что все в этом мире состоит из атомов – крошечных неразрушимых твердых сфер, уникальных для каждого элемента. Атомы разных элементов объединяются в разные соединения и перегруппировываются в ходе химических реакций. Даже по прошествии 200 лет часть этой концепции остается верной.
Атомы разных элементов объединяются в разные соединения и перегруппировываются в ходе химических реакций. Даже по прошествии 200 лет часть этой концепции остается верной.
J.J Thompson
До конца 19 века атомы представлялись как неделимые частицы; Первым, кто нарушил это представление, был английский физик Дж.Дж. Томпсон и его верная электронно-лучевая трубка. Внутри вакуумной стеклянной трубки видимый пучок частиц или катодных лучей генерировался путем приложения высокого напряжения к металлическим электродам. Поток частиц, образовавшихся из металла, отклонялся от отрицательного заряда и стремился к положительному.
Повторив этот эксперимент несколько раз с другими металлами, он придумал первую модель атома. Его знаменитая модель сливового пудинга описывала атом как частицу, состоящую из положительно заряженной массы (пудинг) с крошечными отрицательными зарядами, встроенными в нее (например, сливы).
Модель катодно-лучевой трубки и сливового пудинга (Фото предоставлено Wikimedia commons)
Эрнест Резерфорд
После некоторого первоначального сопротивления эта модель стала довольно популярной в научном мире, но уроженец Новой Зеландии Эрнест Резерфорд не был убежден. В начале 1900-х годов радиоактивность была в моде, и Резерфорд открыл альфа, бета и гамма-лучи во время своей работы по радиоактивному распаду. Он хотел разработать метод получения альфа-частиц и использовать его для исследования структуры атома.
В начале 1900-х годов радиоактивность была в моде, и Резерфорд открыл альфа, бета и гамма-лучи во время своей работы по радиоактивному распаду. Он хотел разработать метод получения альфа-частиц и использовать его для исследования структуры атома.
Он сделал то, что делал каждый физик в то время – он поставил эксперимент. Эксперимент с золотой фольгой, также известный как эксперимент Гейгера-Марсдена, состоял из тонкого листа золотой фольги с круглым экраном, покрытым сульфидом цинка за ним, который вспыхивал каждый раз, когда на него попадала альфа-частица. Резерфорд ожидал, что частицы вылетают из фольги и ударяются о экран позади нее. Хотя большинство частиц действительно вели себя так, как ожидалось, некоторые из них отклонялись на угол более 90 градусов.
Эксперимент Гейгера-Марсдена с золотой фольгой (Фото: Kurzon / Wikimedia commons)
Опираясь на свои наблюдения, он придумал новую атомную модель, которая опровергала предыдущую. Он предложил атомную структуру, в которой большая часть массы атома была сосредоточена в положительно заряженном центре (который он позже назвал ядром, латинское слово «орех»), вокруг которого электроны вращались, как планеты вокруг Солнца.
Нильс Бор
Спустя год после публикации атомной теории Резерфорда Нильс Бор обнаружил несоответствие в этой модели.Если бы электроны вращались вокруг положительно заряженного центра, в какой-то момент эти электроны потеряли бы свою энергию и коллапсировали бы в ядро, сделав атомы нестабильными. Однако это оказалось не так, поскольку большинство атомов оказались довольно стабильными (кроме радиоактивных).
Именно здесь на сцену выходит квантовая физика. Бор использовал концепцию квантованной энергии, чтобы предположить, что электроны движутся вокруг ядра по фиксированным орбитам или оболочкам. Оболочки, расположенные ближе к ядру, имеют меньшую энергию, а самые дальние – самые высокие.Если электрон прыгает на более низкую энергетическую орбиту, он выделяет дополнительную энергию в виде излучения, тем самым поддерживая стабильность атома.
Несмотря на то, что модель Бора не верна для сложных многоэлектронных систем, эта модель по-прежнему остается наиболее популярным представлением атомной структуры в большинстве учебников.
(Фото: Kurzon / Wikimedia commons)
Модель Шредингера
Как бы мы ни старались, невозможно избежать сложностей квантовой механики.С установлением квантового поведения таких объектов, как электроны, стало совершенно ясно, что атомная модель Бора не удовлетворяет принципу неопределенности Гейзенберга. Согласно принципу неопределенности, невозможно узнать точное положение и траекторию электронов в атоме, а это означает, что они не могут существовать на фиксированных орбитах, как предполагал Бор.
Объединив концепцию дуальности волна-частица и принцип неопределенности, Эрвин Шредингер предложил квантово-механическую модель атома.В этой модели электроны не вращаются вокруг ядра по круговым орбитам, а скорее как электронные облака на атомной орбитали – области внутри атома, где вероятность найти электрон наиболее высока. Он также сформулировал волновые уравнения Шредингера, которые помогут нам точно рассчитать энергию уровней электронов в атоме. Эта новая и улучшенная модель атома не говорит нам, где находится электрон, но где он может быть .
Развитие моделей атома на протяжении многих лет (Фото предоставлено IlluScientia / Wikimedia commons)
Человечество всегда задавало большие вопросы: что составляет мир вокруг нас? И почему разные материалы ведут себя по-разному?
Каждый шаг в эволюции атомной теории приближал нас к пониманию секретов субатомных частиц, которые управляют нашим ярким и живым миром.И все же… всегда есть чему поучиться!
5 различных моделей атома – теории, схемы и структура атома
Атом – самая маленькая частица каждого элемента. Слово атом произошло от греческого слова Atomos, что означает неделимый. Атомы состоят из электронов, протонов и нейтронов. Протоны и нейтроны находятся в ядре атома, а электроны вращаются вокруг ядра. Атомы всегда имеют равное количество протонов и электронов, а количество нейтронов и протонов также обычно одинаково.Протоны и нейтроны удерживаются вместе в ядре с помощью сильной силы, называемой сильной ядерной силой.
Строение атомов – недавнее открытие.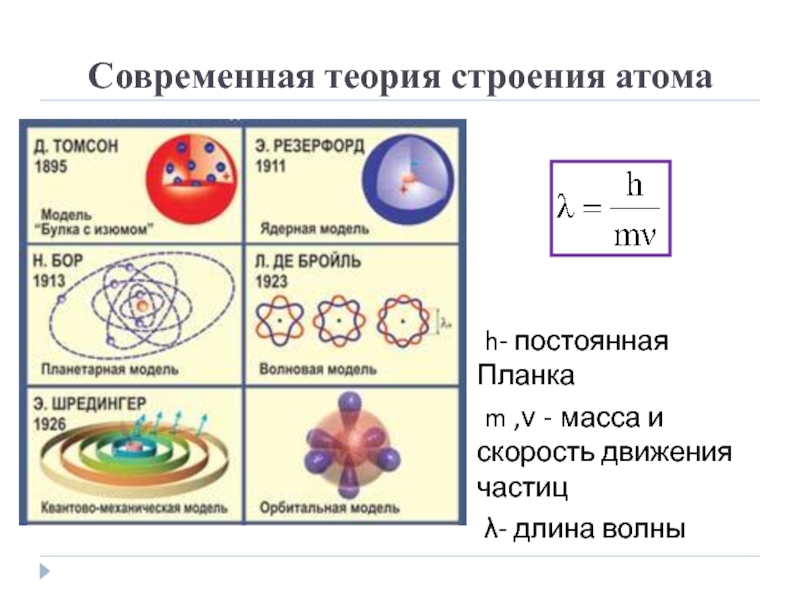 Различные модели атомов были постулированы и отвергнуты до того, как была открыта правильная. В этой статье мы изучим самые известные атомные модели, которые были постулированы и отвергнуты до тех пор, пока не была принята окончательная.
Различные модели атомов были постулированы и отвергнуты до того, как была открыта правильная. В этой статье мы изучим самые известные атомные модели, которые были постулированы и отвергнуты до тех пор, пока не была принята окончательная.
Проверьте развитие периодической таблицы здесь.
Модель атома Дальтона- Дальтон выдвинул очень известную теорию, которая гласила:
- Материя состоит из очень маленьких частиц, известных как атомы.
- Атомы неделимы (неразделимы) и не могут быть уничтожены химическими реакциями.
- Все атомы элемента имеют одинаковые химические свойства и массу.
Однако эта теория имела некоторые ограничения и недостатки.
Недостатки теории Дальтона:- Дальтон сказал, что атомы одного и того же элемента похожи во всех отношениях, а атомы разных элементов различны во всех отношениях.
- Другие ученые обнаружили, что атомы состоят из электронных протонов и нейтронов.

- Томсон предложил теорию, в соответствии с которой он определил атомы подобными рождественскому пудингу.
- Он заявил, что атомы состоят из положительно заряженной сферы, в которую встроены электроны.
- Он также сказал, что отрицательный и положительный заряды равны по величине, поэтому атом в целом электрически нейтрален.
- Не удалось объяснить, как положительный заряд удерживается на электроне внутри атома.
- Он также не смог объяснить причины устойчивости атома.
Здесь вы узнаете все о решениях, их компонентах, типах и свойствах.
Модель атома Резерфорда- Резерфорд использовал эксперимент по рассеянию α-частиц на листе золота.
- Он заметил, что большая часть α– частиц прошла через золотую фольгу, не отклоняясь.
- Некоторые α – частицы отклонялись на малые углы, а некоторые – почти на 180 °.

- На основе этого эксперимента Резерфорд заявил, что в атоме есть положительно заряженный сферический центр, называемый ядром, и почти вся масса атома (имеющего радиус 10-10 м) упакована в ядро (имеющее радиус 10–15 м).
- Теория утверждает, что размер ядра очень мал по сравнению с размером атома.
- Он заявил, что электроны вращаются вокруг ядра по четко определенной траектории, называемой «орбитой».
- В ходе этого эксперимента мы пришли к выводу, что модель J.Дж. Томсон предположил, что это не может быть правильным, потому что, согласно его модели, атом не является полым. Положительный заряд атома равномерно распределен по объему. Если это так, то большинство альфа-частиц должно быть рассеяно из-за силы отталкивания между положительно заряженным ядром и альфа-частицами.
- Но мы получаем прямо противоположный результат. Большинство альфа-частиц проходят через золотую фольгу без отклонения, что позволяет нам понять, что весь положительный заряд плотно сосредоточен в центре атома, и это согласие поддерживало гипотезу ядра, предложенную ядерной моделью Резерфорда.

- В нем говорится, что весь положительный заряд сильно сжат и сконцентрирован в центре атома, и все электроны будут вращаться вокруг них, как планеты вращаются вокруг Солнца.
- Позже из-за некоторых проблем, таких как стабильность ядра, была принята модель Бора.
Подробнее об адсорбции читайте здесь.
Теория Нила Бора- Бор использовал концепцию квантования и выдвинул следующие положения своей теории.
- Электроны вращаются по своим орбитам, не теряя энергии.
- Электрон перемещается из более низкого состояния в более высокое, набирая энергию, и переходит из состояний с более высокой энергией в состояния с более низкой энергией, теряя энергию.
- Самый низкий уровень энергии электрона называется основным состоянием.
- Уровни энергии представлены целым числом, известным как квантовое число. Эти квантовые числа начинаются с n = 1, 2, 3,… .. и им присвоены как K, L, M, N,…. Снаряды.
- Модель Бора не могла определить влияние магнитного поля и электрического поля на спектры атомов.

- Модель атома Бора сделала правильные предсказания для атомов меньшего размера, таких как водород, но плохие спектральные предсказания были получены при рассмотрении более крупных атомов.
Ознакомьтесь с более важными темами химии здесь.
Итак, это все о различных моделях атома. Попрактикуйтесь в том же в нашем бесплатном приложении Testbook. Скачать сейчас!
Часто задаваемые вопросы по различным атомным моделямQ.1 Что такое 4 атомные модели?
Отв.1 Модель атома Дальтона, Модель атома Дж. Дж. Томсона, Модель атома Резерфорда и Теория атома Нила Бора.
Q.2 Какая модель атома самая точная?
Ans.2 Атомная модель Нила Бора является наиболее точной атомной моделью.
Q.3 Какой была первая атомная модель?
Ans.3 Модель атома Дальтона была первой атомной моделью.