Молекулярная масса и молекулярная формула газа
Задача 2. При сжигании 5,6 л газа было получено 16,8 л СО, н 13,5 г НаО. 1 л газа при н. у. имеет массу 1, 875 г. Какова молекулярная формула газа [c.180]Найти молекулярную формулу соединения бора с водородом, если масса 1 л этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2 % (масс.). [c.27]
Чтобы найти истинную молекулярную формулу газа, необходимо вычислить его молярную массу. [c.417]
При сжигании 5,6 л газа получили 16,8 л двуокиси углерода и 13,5 г воды. 1 л этого газа имеет массу 1,875 г (условия нормальные). Какова молекулярная формула газа [c.311]
В формуле 1 Т= 1з Ыти Р, — газовая постоянная Т — температура N — число Авогадро т — масса молекуль и — скорость движения молекул газа. Проанализируйте эту формулу. Как зависит скорость молекул от молекулярной массы и температуры Пользуясь формулой, выведите соотношение, позволяющее судить об изменении скорости молекул при повышении температуры на некоторое число градусов. Во сколько раз возрастает скорость молекул газа при увеличении температуры в 2 раза Как изменится скорость молекул газа при увеличении температуры на 10° Как изменится скорость молекул газа при увеличении температуры на 100° Введите в формулу кинетическую энергию поступательного движения одной молекулы е = — и получите формулу для энергии 1 моль молекул
Выведите молекулярную формулу газа, при сжигании которого объемом 28 мл получили оксид углерода (IV) объемом 84 мл (н. у.) и воду массой 67,7 мг. Относительная плотность газа по водороду равна 21.
Анализ образца неизвестного газа показал, что он содержит только серу и кислород. Этот газ вытекает через маленькое отверстие в вакуум за 28,3 с, тогда как точно такое же количество молекул О2 проходит через то же отверстие за 20,0 с. Определите молекулярную массу и формулу неизвестного газа. [c.163]
Образец газа объемом 1,12 л при О С и давлении 0,500 атм имеет массу 0,400 г. Этот газ содержит 25,0 вес.% водорода и 75,0 вес.% углерода. Чему равна молекулярная масса газа Каковы его эмпирическая и молекулярная формулы [c.160]
Для расчета вязкости индивидуальных углеводородных газов применяется формула ц=7 (6,6— —2,25 lg М) 10- , где (А — динамическая вязкость, Па-с Т — температура, К М — молекулярная масса. На рис. 1.4 приведены данные о вязкости газообразных алканов, а на рис. 1.5 — различных газов (воздух, кислород, оксиды азота и углерода, сероводород, во-
Как видно из формул (IX. 120)—(IX. 124), для расчета термодинамических функций идеального двухатомного газа при заданных 7 и У необходимо знать следующие молекулярные характеристики молекулярную массу газа М., момент инерции молекулы /, число симметрии молекулы а, частоту колебаний V, вырождение основного электронного уровня Ро- Вообще говоря, требуются также сведения о первых возбужденных электронных состояниях. Если энергия возбужде-
Формулы (3.6 и 3.7) имеют преимущество перед формулами (3.2 и 3.3), так как учитывают разницу в молекулярной массе и температуре газа в оборудовании при его испытании на плотность и в рабочем состоянии. [c.45]
Решение, Сначала находят плотность и молекулярную массу серосодержащих компонентов газа, а по формулам компонентов — число атомов серы в них. [c.32]
Если состав газовой смеси выражен в массовых долях отдельных газов, то среднюю молекулярную массу вычисляют по формуле [c.19]
Плотность продуктов принята по практическим данным [49]. Молекулярная масса газа определена по формуле [48] М = = 22,4р. (3.10)
Приведенные выше расчетные формулы получены в предположении о постоянстве молекулярной массы и теплоемкости газа. В рамках рассмотренной схемы учет зависимости л(с, Т) и ср с, Т) не сопряжен с принципиальными трудностями. Он сводится к совместному решению уравнения состояния р = р(с, Т), уравнений (2-29), (2-30) и уравнений (2-31), (2-32), которые в данном случае принимают вид [c.37]
Джон Дальтон — выдающийся английский химик и физик. Ему принадлежат основополагающие работы по химической атомистике. Приняв атомную массу водорода за единицу, впервые составил таблицу относительных атомных масс” Определил относительные молекулярные массы воды, оксидов углерода и азота, аммиака и серной кислоты. Ввел в химии символы химических элементов и формулы соединений, которые впоследствии были заменены современными. По формулам рассчитывал состав веществ. Открыл законы кратных отношений, парциальных давлений газов и зависимости растворения газов от их парциального давления.
Чтобы применить эти уравнения для определения молекулярного веса газа, надо установить опытным путем массу данного объема газа, измеренного при заданных физических условиях, а затем рассчитать его плотность по формуле (2). [c.8]
Полученное значение является приближенным, так как измерение скорости истечения газов осуществляется с определенными погрешностями. Поскольку эмпирической формуле неизвестного газа СН соответствует формульная масса 13,02 г, нетрудно видеть, что истинная молекулярная масса этого газа должна в шесть раз превышать его формульную массу и, стало быть, равна 6 – 13,02 = 78,12, откуда следует, что молекулярная формула газа-С Нб-
Задача построения согласованной таблицы атомных масс оказалась не из легких, и сам Дальтон пошел по неверному пути. Порочный круг рассуждений, включающих предполагаемые атомные массы и предполагаемые молекулярные формулы, удалось разорвать лишь в 1860 г., когда Канниццаро обратился к гипотезе Авогадро, высказанной последним еще в 1811 г., но игнорировавшейся в течение 50 лет. Согласно гипотезе Авогадро, при одинаковых температуре и давлении в равных объемах любых газов содержится равное число молекул. Поскольку из этого следует, что плотность газа пропорциональна его молекулярной массе, гипотеза Авогадро открывала способ установления стандартной шкалы атомных масс, которы.м пользуются до настоящего времени. Тем самым была заложена количественная основа современной химии.
Критическую температуру (в °С) для жидких нефтепродуктов находят по графикам на рис. 1.12, а для нефтяных газов — на рис. 1.13 в зависимости от их молекулярной массы. Критическое давление Ркр рассчитыв
Грамм молекула газа — Знаешь как
Содержание статьи
Грамм молекула любого вещества в твердом, жидком или газообразном состоянии представляет собой некоторое количество вещества, занимающее в пространстве определенный объем. Другими словами, грамм-молекула имеет не только вес, но и объем. Этот объем довольно легко рассчитать, пользуясь для этого формулой
P = V · d
где Р — вес, в данном случае вес грамм-молекулы (М), V— объем грамм-молекулы, а а d- удельный вес, или плотность. Для твердых тел мы выражаем объем в граммах на 1 см3, а для газообразных — в граммах на 1 л. Исходя из этой формулы, нетрудно определить объем грамм-молекулы: V = M : d ; М — легко-узнать, подсчитав молекулярный вес вещества, ad — воспользовавшись таблицей плотностей. Будем рассматривать объем при нормальных условиях (температура 0° и давление 760 мм рт. ст.).
Из приведенных в табл. 2 данных видно, что грамм-молекулярные объемы газов равны между собой: грамм-молекула любого газа при нормальных условиях занимает объем 22,4 л.
• Запишите эту цифру в тетрадь и хорошо запомните.
Чем же это объясняется? Оказывается, у газов промежутки между молекулами настолько велики, что величина молекул по сравнению с этими расстояниями ничтожна, и мы ею можем пренебречь. Таким образом, измеряя объем, мы фактически измеряем объем суммы промежутков между молекулами.
Таблица 1. Грамм-молекулярные объемы и плотность жидкостей и твердых веществ
Грамм-молекулярные объемы и плотность жидкостей и твердых веществ
Таблица 2. Грамм-молекулярные объемы и плотность газов
Что касается расстояния между молекулами, то оно зависит только от условий (температуры и давления) и совершенно не зависит от природы газа и размеров его молекул, поэтому при одинаковых условиях мы получаем одинаковые объемы.
Отсюда напрашивается следующий вывод: при одинаковых условиях грамм-молекулы любых газов занимают равные объемы.
• Запишите этот вывод в тетрадь.
Полученные результаты логически подводят нас к следующему: так как в грамм-молекуле любого вещества содержится одинаковое число молекул,а грамм-молекулы газов занимают одинаковые объемы при одних и тех же условиях, можно сделать следующий вывод: в равных объемах газов при одинаковых условиях содержится одно и то же число молекул. Этот вывод был сделан в 1811 г. итальянским химиком Авогадро и поэтому получил название закона Авогадро.
• Запишите формулировку закона в тетрадь.
■ 1. Как вычислить объем грамм-молекулы твердого вещества для жидкости? (См. Ответ)
3. Что такое «нормальные условия»?
4. Почему объемы грамм-молекул газов при одинаковых условиях равны?
5. Чему равен объем грамм-молекулы любого газа при нормальных условиях?
6. Как формулируется закон Авогадро? (См. Ответ)
2. Расчеты по химическим формулам с использованием объема грамм-молекулы газа
Зная, что объемы грамм-молекул газов при одинаковых условиях равны, легко высчитать объем любого количества газа, что иногда гораздо важнее, чем знание его веса.
Пример 1. Какой объем займут 6 г водорода Н2 при нормальных условиях? | |
Решение: Так как грамм-молекула любого газа, а значит, и водорода при нормальных условиях занимает объем 22,4 л, а 1 моль водорода Н2 — это 2 г, то 2 г Н2 занимают объем, равный (при нормальных условиях) 22,4 л, а 6 г Н2 займут объем х л. Составим пропорцию: 2 : 6 = 22,4 : х x = (6 · 22,4) : 2 = 67,2 л. Ответ: 6 г водорода при нормальных условиях занимают объем 67,2 л. | |
Пример 2. Сколько весят 5,6 л двуокиси углерода СО2? | |
Решение: Исходим снова из того, что грамм-молекула любого газа при нормальных условиях занимает объем 22,4 л и прежде всего высчитываем, чему равна грамм-молекула СО2. Она рав на: 22 + 16 · 2 = 44 гг 44 г СО2 занимают объем 22,4 л, а х г СО2 — объем 5,6 л. Составим и решим пропорцию: 44 : х = 22,4 : 5,6; х = (44 · 5,6) : 22,4 = 11 г СО2 Ответ: 5,6 л двуокиси углерода весят 11 г. | |
■ 7. Рассчитайте, сколько весит 1 л следующих газов: (См. Ответ)
а) азота N2; б) аммиака Nh4; в) хлора Сl2; г) окиси углерода СО.
8. Определите, какой объем займет 1 г каждого газа из перечислен-
ных в вопросе 7.
9. Сколько весит 1 м3 газовой смеси, состоящей на 50% из хлора Сl2 и на 50% из кислорода 02?
10. Сколько весит смесь 2 л азота N2 и 3 л кислорода 02?
11. Вычислите вес 1 л воздуха, допуская, что он состоит на 79% из азота N2 и на 21% из кислорода О2. (См. Ответ)
3. Расчеты по уравнениям реакций с использованием объема грамм-молекулы газа
Часто приходится определять объем газа, вступающего в реакцию или образующегося в результате реакции.
Пример 1. Какой объем СО2 получится при разложении 200 г известняка СаСО3 (условия нормальные)? | |
Дано: 200 г СаСО3 | Решение: Уравнение реакции разложения следующее: СаСО3 = СаО + СО2. Здесь подсчеты грамм-молекул несколько изменят свою обычную форму. Для СаСО3, так как это твердое вещество, грамм-молекулу вычисляют, как и всегда, исходя из атомных весов элементов. Что касается двуокиси углерода, то в задаче требуется определить ее объем, поэтому мы будем брать для подсчета не вес грамм-молекулы СО2, а ее объем, который, как известно, при нормальных условиях равен 22,4 л. Таким образом, наше уравнение будет выглядеть так: CaCO3 : 100г = СаО + СО2 : 22,4 л. Итак, из 100 г СаСО3 можно получить 22,4 л (1 моль) СО2, а из 200 г СаСО3 — х л СО2. Отсюда: x = (22,2 · 200) : 22,4 = 11,2 л Н2. Ответ: из 200 г известняка можно получить 44,8 л двуокиси углерода. |
Пример 2. Какой объем водорода Н2 потребуется для реакции с 5,6 л кислорода при получении воды? | |
Решение: (2Н2 : 44,8 л) + (О2 : 22,4 л) = 2Н2О Здесь оба вещества — данное и искомое — газы, поэтому их количество должно быть выражено в объемах. Далее рассуждаем, как обычно: на 44,8 л Н2 расходуется 22,4 л О2, а на х л Н2 — 5,6 л О2. Отсюда x = (5,6 · 44,8) : 22,4 = 11,2 л Н2. Ответ. Для реакции потребуется 11,2 л водорода. | |
■ 12. Какой объем водорода Н2 может быть вытеснен из соляной кислоты 130 г цинка (нормальные условия)? (См. Ответ)
13. Какой объем хлористого водорода НСl получится при взаимодействии 67,2 л водорода Н2 с хлором Сl2 (нормальные условия)?
14. При восстановлении окиси меди водородом образовалось 8 г меди. Какой объем водорода израсходовался на реакцию (нормальные условия)?
15. Сероводород h3S сгорает по уравнению:
2h3S + 3O2 = 2SO2 + 2Н2O
Вычислите объем кислорода и двуокиси серы, если сгорает 5 молей сероводорода (нормальные условия).
16. Какой объем двуокиси углерода израсходуется на взаимодействие с 37 г гидроокиси кальция Са(ОН)2, если в результате реакции образуется карбонат СаСO3 (нормальные условия)? (См. Ответ)
4. Абсолютная и относительная плотность газов. Определение молекулярного веса газов по абсолютной и относительной плотности
Понятие об абсолютной и относительной плотности газов непосредственно вытекает из уже рассмотренного нами материала об объеме грамм-молекулы газа.
Абсолютная плотность (или удельный вес) газа — это вес 1л газа. Ее легко определить по формуле:
где М — грамм-молекулярный вес газа, а V — объем грамм-молекулы газа, равный при нормальных условиях 22,4 л.
Следовательно,
Зная молекулярный вес, можно найти абсолютную плотность. По этой же формуле, если известна абсолютная плотность, можно определить молекулярный вес по формуле М = 22,4m · d (нормальные условия).
Относительная плотность — это отвлеченное число, показывающее, во сколько раз один газ тяжелее (или легче) другого (при одинаковых условиях).
Определить это можно, сравнивая вес 1 л одного газа (d1) и 1 л другого газа (d2), т. е. сравнивая абсолютные плотности этих газов.
Формула относительной плотности будет выглядеть как отношение абсолютной плотности одного газа к абсолютной плотности другого газа:
но так как
а
то
Фактически относительная плотность представляет собой отношение молекулярных весов двух газов. При обозначении относительной плотности справа внизу ставится химический знак того газа, с которым сравнивается молекулярный вес искомого газа. Например, если ставится dH, это значит, что данная относительная плотность показывает, во сколько раз молекулярный вес искомого газа больше молекулярного веса водорода. Если стоит dB, это значит, что молекулярный вес искомого газа сравнивается со средним молекулярным весом воздуха, который равен 29 у. е.
Исходя из формулы относительной плотности
можно определить любую из трех величин, если известны остальные. Например, можно найти молекулярный вес газа по формуле:
M1 = dотн. · М2
■ 17. Что такое абсолютная плотность? (См. Ответ)
18. Как можно определить молекулярный вес, пользуясь абсолютной плотностью?
19. Что такое относительная плотность?
20. Выведите формулу относительной плотности.
21. Как определить молекулярный вес газа, если известна его относительная плотность? (См. Ответ)
5. Расчеты с учетом понятий об абсолютной и относительной плотности газов. Нахождение молекулярного веса и формулы газа
Если известна абсолютная плотность газа, то по выведенной нами выше формуле абсолютной плотности можно легко найти его молекулярный вес.
Пример 1. Каков молекулярный вес газа, если его абсолютная плотность равна 3,21 г/л? | |
Дано: dнорм. = 3,21 г/л | Решение: dнорм. = M : 22,4 ; M = dнорм. · 22,4 М = 3,21 · 22,4 = 71,9 г. Здесь 71,9 — грамм-молекула газа в граммах, а 71,9 — молекулярный вес газа в углеродных единицах. Ответ: молекулярный вес газа 71,9 у.е. |
Если известно, что искомый газ представляет собой простое вещество, то легко узнать его формулу, так как известно, что большинство газов (кроме инертных) имеют молекулы, состоящие из двух атомов.
Пример 2. Какова формула газа, вес 1 л которого равен 1,25 г? | |
Дано: dнорм. = 1,25 г/л | Решение: Находим вес грамм-молекулы по формуле М = dнорм. · 22,4 = 1,25 · 22,4 = 28 г. Грамм-молекула газа — 28 г. Молекулярный вес 28 у.е. Поскольку молекула двухатомна, один атом весит 28 : 2 = 14 у.е. Если обратиться к таблице атомных весов, то можно убедиться, что 14 — это атомный вес азота. Следовательно, формула искомого газа N2. Если газ представляет собой сложное вещество, то для нахождения его формулы нужно знать, помимо плотности, процентное содержание составляющих его элементов. |
Пример 3. Определив формулу газа, если его абсолютная плотность равна 2,019 г/л, а процентный состав: С — 81,8% и Н — 18,1%. | |
Дано: dнорм. = 2,019 г /л С = 81,8% Н = 18,1% | Решение: Сначала находим по известной нам формуле молекулярный вес газа: Молекулярный вес равен 45 у.е. М = 22,4 · d = 22,4 · 2,019 = 45,2 г. Теперь определим, сколько углеродных единиц приходится на углерод. Для этого вес всей молекулы мы принимаем за 100% .45 у. е. — 100%. х » —81,8%. отсюда 45 : x = 100 : 81.8; x = (81,8 · 45) : 100 = 36 у.е. Поскольку атомный вес углерода равен 12 у.е., можно высчитать, сколько в молекуле атомов углерода. 36 : 12 = 3 (атома). Так же находим число атомов водорода: 45 у. е. — 100% х » -18,1%. x = (45 · 18,1) : 100 = 8 у.е. Зная,что атомный вес водорода 1 у. е., высчитываем число атомов водорода: 8 : 1 = 8 (атомов) Следовательно, формула газаС3Н8. Этот газ—органическое вещество — пропан. Можно найти молекулярный вес, пользуясь и относительной плотностью. |
Можно найти молекулярный вес, пользуясь и относительной плотностью.
Пример 4. Найти молекулярный вес газа, если его плотность по водороду равна 16. | |
Решение: М = dH · MH Молекулярный вес Н2 равен 2 у.е. М = 16 · 2 = 32 у. е. | |
Пример 5. Определите, во сколько раз хлор тяжелее воздуха.
Решение: молекулярный вес хлора равен 35,5 · 2 = 71. Средний молекулярный вес воздуха равен 29.
dотн. = MCl2 : MB = 71 : 29 = 2,4
Ответ: хлор тяжелее воздуха в 2,4 раза.
■ 22. Вычислите молекулярный вес газа, если вес газа равен 1,696 г. (См. Ответ)
23. Какова формула газа, если известно, что его абсолютная плотность 1,25 г/л, а состав следующий: углерода C ∼43%, кислорода 0 ∼ 57%.
24. Какова формула газа, если его плотность по водороду равна 15, а состав следующий: углерода 80%, водорода 20%.
25. Какие из перечисленных ниже газов тяжелее воздуха: сероводород h3S, фтор F2, двуокись углерода СO2, аммиак Nh4, аргон Аr? (См. Ответ)
43
42 44
znaesh-kak.com
Определение молекулярного веса газообразных веществ — Знаешь как
На законе Авогадро основан важнейший метод определения молекулярных весов газообразных веществ. Но прежде чем говорить об этом методе, следует напомнить, в каких единицах выражаются молекулярные и атомные веса.
При вычислениях атомных весов первоначально принимали за единицу вес атома водорода, как самого легкого элемента, и по отношению к нему вычисляли атомные веса других элементов. Но так как для большинства элементов атомные веса определяются из их кислородных соединений, то фактически вычисления производились по отношению к атомному весу кислорода, который считался равным 16. Отношение между атомными весами кислорода и водорода принималось равным 16:1. Впоследствии более точные исследования показали, что это отношение равно 15,88 : 1, или 16 : 1,008. Следовательно, если считать атомный вес водорода равным 1, атомный вес кислорода будет 15,88. Из практических соображений было решено оставить для кислорода атомный вес 16, приняв для водорода атомный вес 1,008.Таким образом, в настоящее время единицей веса атомов является 1/16часть веса атома кислорода. Эта единица получила название«кислородной един ицы». Вес атома водорода равен 1,008 кислородной единицы, вес атома серы — 32,06 кислородной единицы и т, д.
Атомным весом элемента называется вес его атома, выраженный в кислородных единицах.
Так как вес молекулы любого вещества равен сумме весов образующих ее атомов, то понятно, что молекулярные веса должны выражаться в тех же единицах, что и атомные веса. Например, вес молекулы водорода, состоящей из двух атомов, равен 2,016 кислородной единицы; вес молекулы кислорода, также состоящей из двух атомов, равен 32 кислородным единицам; вес молекулы воды, содержащей два атома водорода и один атом кислорода, равен 16 + 2,016=18,016 кислородной единицы и т. д. Молекулярным весом простого или сложного вещества называется вес его молекулы, выраженный в кислородных единицах.Посмотрим теперь, как определяются молекулярные веса газообразных веществ.
По закону Авогадро, равные объемы газов, взятых при одинаковом давлении и одинаковой температуре, содержат равное число молекул. Отсюда следует, что веса равных объемов двух газов должны относиться друг к другу, как их молекулярные веса.
Возьмем например, по одному литру двух различных газов. Пусть в каждом из них содержится по N молекул. Обозначим вес литра первого газа через g, а второго через g1. Молекулярные веса газов обозначим соответственно через М и M1. Так как вес литра газа равен сумме весов находящихся в нем молекул, тоg = N•M и g1=N•M1 Разделив первое равенство на второе, получим: (1)
Отношение веса данного газа к весу того же объема другого газа, взятого при той же температуре и том же давлении, называется плотностью первого газа по второму. Например, 1 луглекислого газа весит 1,98 г, а 1 л водорода при тех же условиях 0,09 г, откуда плотность углекислого газа по водороду будет 1,98:0,09 = 22.
Обозначив плотность газа буквой D, перепишем уравнение (1):
откуда
M = D•M1 (2)
Молекулярный вес газа равен его плотности по отношению к другому газу, умноженной на молекулярный вес второго газа.
Очень часто плотности различных газов определяют по отношению к водороду как самому легкому из всех тазов. Так как молекулярный вес самого водорода равен 2,016, то в этом случае формула для расчета молекулярных весов принимает вид:
М = 2,016 • D
или, если округлить молекулярный вес водорода до 2:
М = 2 • D
Вычисляя, например, по этой формуле молекулярный вес углекислого газа, плотность которого по водороду, как указано выше, равняется 22, находим:
М = 2 • 22 = 44
Нередко также вычисляют молекулярный вес газа, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же мы можем говорить о среднем молекулярномвесе воздуха, определяемом из плотности воздуха по водороду. Найденный таким путем молекулярный вес воздуха равен 29.
Обозначив плотность исследуемого газа по воздуху через D1получим следующую формулу для вычисления молекулярных весов:
М = 29•D1
Число 29 полезно запомнить, так как его часто применяют при расчетах.
Практически определение молекулярного веса сводится к измерению веса и объема некоторого количества исследуемого газа и последующему вычислению его плотности, после чего молекулярный вес находят прямопо формуле. Плотность газа может быть вычислена по отношению к любому другому газу, молекулярный вес которого и вес единицы объема известны. Но так как в справочниках указываются веса газов при нормальных условиях, а на опыте обычно приходится измерять вес и объем исследуемого газа при других условиях, то для вычисления плотности газа нужно предварительно привести измеренный объем газа к нормальным условиям (0° и 760 мм давления).
Приведение к нормальным условиям производится на основании уравнения, объединяющего газовые законы Бойля-Мариотта и Геи-Люссака:
где р и υ — соответственно давление и объем газа в условиях опыта; Р0—нормальное давление; υ0— объем газа при нормальных условиях; Т — абсолютная температура газа.
Определяя из этого уравнения υ0, получаем формулу для вычисления объема газа при 0° и 760 мм давления:
Пример расчета молекулярного веса
Из опыта найдено, что 380 мл газа при температуре 27° и давлении 800 мм рт. ст. весят 0,455 г. Определить молекулярный вес газа, если известно, что 1 л воздуха при нормальных условиях весит 1,293 г.
Приводим найденный объем газа к нормальным условиям. Получаем:
Определяем теперь вес 1 л этого газа (g) при нормальных условиях:
Так как 1 л воздуха весит 1,293 г, то плотность нашего газа по воздуху
а молекулярный вес
М = 29 • 0,97 ≈ 28
Заметим, что для определения молекулярного веса газа указанным способом совершенно не требуется знать химический состав газа, надо знать только его плотность.
Вы читаете, статья на тему Определение молекулярного веса
znaesh-kak.com
Молярная масса газа, формула и примеры
Молярная масса газа
Молярную массу обычно выражают в г/моль, реже в кг/кмоль. Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональная массе соответствующей структурной единицы, т.е. относительной атомной массе данного вещества (Mr):
M = κ × Mr,
где κ – коэффициент пропорциональности, одинаковый для всех веществ. Относительная молекулярная масса – величина безразмерная. Её вычисляют, используя относительные атомные массы химических элементов, указанных в Периодической системе Д.И. Менделеева.
Молекулярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества, а затем вычисляют массу 22,4 л этого вещества при тех же условиях.
Для достижения данной цели (вычисление молярной массы) возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона):
pV = mRT / M,
где p – давление газа (Па), V – объем газа (м3), m – масса вещества (г), M – молярная масса вещества (г/моль), Т – абсолютная температура (К), R – универсальная газовая постоянная равная 8,314 Дж/(моль×К).
Молярную массу газа можно рассчитать, как произведение его плотности по отношению к любому другому газу на молекулярную массу последнего. Под плотностью понимают отношение массу определенного объема данного газа к массе такого же объема другого газа (при одинаковых температуре и давлении), молекулярная масса которого известна.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Формула сернистого газа в химии
Определение и формула сернистого газа
Растворимость оксида серы (IV) в воде весьма велика (при обычных условиях около 40 объемов SO2 на один объем воды). Водный раствор диоксида серы называется сернистой кислотой.
Химическая формула сернистого газа
Химическая формула сернистого газа – SO2. Она показывает, что в составе молекулы этого сложного вещества находится один атом серы (Ar = 32 а.е.м.) и два атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу сернистого газа:
Mr(SO2) = Ar(S) + 2×Ar(O) = 32 + 2×16 = 32 + 32 = 64
Структурная (графическая) формула сернистого газа
Более наглядной является структурная (графическая) формула сернистого газа. Она показывает то, как связаны атомы между собой внутри молекулы. Строение молекулы SO2 (рис. 1) аналогично строению молекулы озона O3 (OO2), но молекула отличается высокой термической устойчивостью.
Рис. 1. Строение молекулы сернистого газа с указанием валентных углов между связями и длин химических связей.
Электронные формулы
Электронные формулы, показывающие распределение электронов в атоме по энергетическим подуровням принято изображать только для отдельных химических элементов, однако для сернистого газа можно представить и такую формулу:
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Физический справочник / / Физика для самых маленьких. Шпаргалки. Школа. / / Молекулярная физика. Основные положения МКТ. Основные понятия и формулы. Свойства идеального газа. Основное уравнение МКТ. Температура. Уравнение состояния идеального газа. Уравнение Менделеева-Клайперона. Газовые законы – изотерма, изобара, изохора
| |||||
dpva.ru
Раздел 4
53
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ
ФЕДЕРАЦИИ
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ И КАДРОВОЙ ПОЛИТИКИ
Федеральное государственное образовательное учреждение
Высшего профессионального образования
“Саратовский государственный аграрный университет
имени Н.И. Вавилова”
ХИМИЯ
Методическое руководство
к лабораторным работам
для студентов очной и заочной форм обучения
инженерных специальностей.
Часть вторая
Саратов 2004
Химия: Методическое руководство к лабораторным работам для студентов очной и заочной форм обучения инженерных специальностей. Часть вторая / Сост. Н.Л. Акмаева, А.А. Кольцов, Е.И. Хомяков, Н.Ф. Горбачева; Сарат. гос. аграрный ун-т им. Н.И. Вавилова. Саратов, 2004.
В четвертом разделе (авт. доцент Акмаева Н. Л.) даны основные понятия химии, молярная масса, молекулярная масса, моль, молярный объём, основные газовые законы. Приведена методика определения молекулярной массы газа. Даны вопросы для самоконтроля и задачи для самостоятельной работы.
В пятом разделе (авт. доцент Хомяков Е. И.) даны основные представления о растворах, методах приготовления растворов, способах выражения концентрации растворов. Приведена методика определения концентрации раствора щелочи методом титрования. Даны вопросы для самоконтроля и задачи для самостоятельной работы.
В шестом разделе (авт. доцент Кольцов А. А.) представлены общетеоретические вопросы, касающиеся жесткости воды, методах определения и устранения её. Даны методики определения временной и общей жесткости. Приведены вопросы для самоконтроля и задачи для самостоятельного выполнения.
В седьмом разделе (авт. доцент Горбачева Н. Ф.) кратко изложены теоретические вопросы, касающиеся понятия степени окисления, сущности окислительно-восстановительных реакций и закономерностей их протекания; приведена методика количественного определения восстановителя методом перманганатометрии; предложены вопросы для самоконтроля, задачи и упражнения для самостоятельного решения.
Определение молекулярной массы газа.
Цель работы:усвоить понятия: химический элемент, простое и сложное вещество, молярная масса, молекулярная масса, моль и молярный объем, ознакомиться с газовыми законами. Освоить экспериментальный метод определения молярной массы газа с применением уравнения Менделеева – Клапейрона при расчете молярной массы газа.
Теоретическая часть.
Химический элемент – это определенный вид атомов с положительным одинаковым зарядом ядра. В результате соединения атомов одного и того же элемента образуется простое вещество.
Соединение атомов различных элементов приводит к образованию сложных веществ.
Химическая формула выражает качественный и количественный состав соединения (СО2, N2, HCl).
Массы атомов и молекул чрезвычайно малы и неудобны для расчетов.
Масса самого легкого атома – атома водорода ma(Н)= 1,674 ∙10-27 кг, а масса углерода ma(С)=1,993 ∙10-26 кг.
За атомную единицу массы (а. е. м.) принята 1/12 часть массы атома изотопа 126С,
1 а.е.м.=1/12 ∙
ma(С)
=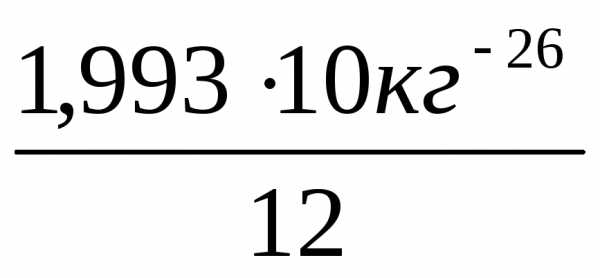 =1,667∙10-27кг
=1,667∙10-27кг
В химии для удобства пользуются не абсолютными значениями масс атомов элементов (ma), а относительными массами (Аr). Относительной атомной массой (Аr) химического элемента называется отношение массы
его атома к 1/12
массы атома изотопа углерода 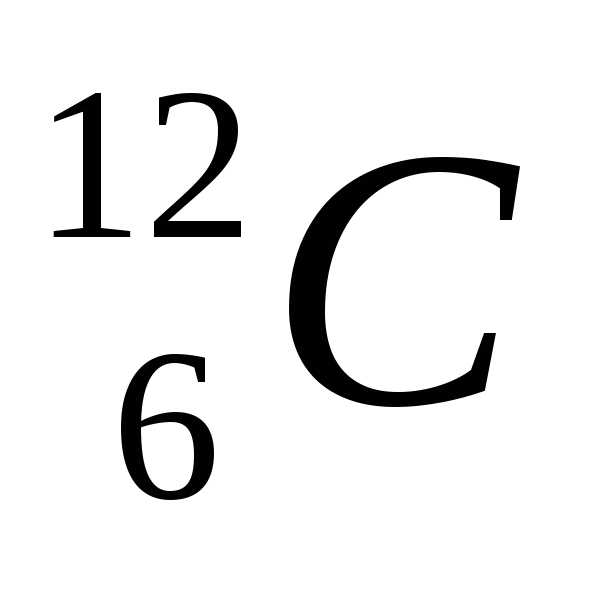
В соответствии с этим:
Ar (H)
= =1,0079– величина
безразмерная.
=1,0079– величина
безразмерная.
Относительной
молекулярной массой (Mr) вещества называется отношение массы
его молекулы к 1/12 массы атома изотопа
углерода 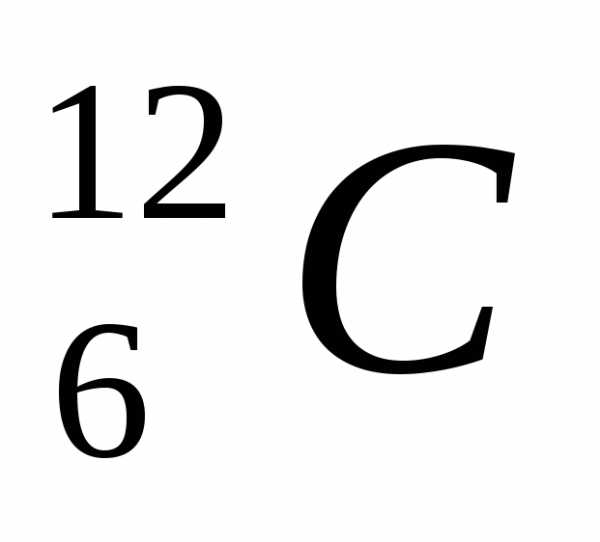 .
Молекулярная масса равна сумме атомных
масс всех элементов, входящих в соединение
с учетом числа атомов каждого элемента
в формуле.
.
Молекулярная масса равна сумме атомных
масс всех элементов, входящих в соединение
с учетом числа атомов каждого элемента
в формуле.
Например:
Mr (H2SO4) = 2 ∙1,008 + 32,06 + 15,99 ∙ 4 = 98,23
Mr=98,23
Mr (H2O) = 2 ∙ Ar (H) + Ar (O) =2 ∙ 1,0079+15,99 = 18,0058
Единицей измерения количества вещества (ν) в CИ является моль.
Моль –
это количество вещества, содержащее
столько же молекул атомов, ионов,
электронов и др. структурных единиц,
сколько атомов содержится в 0,012 кг
изотопа углерода .
.
Например 1 моль СО2 содержит:
1 моль молекул СО2;
1 моль атомов С;
2 моль атомов О;
22 моль электронов;
3 моль атомных ядер.
Число атомов (N) углерода в 0,012 кг углерода легко определить, зная массу одного атома углерода (1,993∙10-26кг).


Это число называется постоянной Авогадро и обозначается (NА ). Масса 1 моль вещества, выраженная в единицах массы, называетсямолярной массой(М) и равна отношению массыmэтого вещества к его количеству:
 [кг/моль или
г/моль]
[кг/моль или
г/моль]
Масса 1 моль вещества в граммах численно равна его относительной молекулярной массе.
Например:
М (H2SO4) = 98 г/моль,
Mr(H2SO4) = 98
Газовые законы.
Газовое состояние характеризуется тем, что молекулы (атомы) газа свободно движутся в объеме больше, чем объем самих частиц. Слабое межмолекулярное взаимодействие обуславливает малую плотность газов, стремление к бесконечному расширению и способность оказывать давление на стенки сосудов препятствующие этому стремлению
При малых давлениях и высоких температурах все газы ведут себя приблизительно одинаково.
Газ называется идеальным, если размеры молекул газа столь малы, что их собственным объемом можно пренебречь. Средние расстояния между молекулами велики по сравнению с размерами молекул, а силы межмолекулярного взаимодействия малы.
Для идеального газа нетрудно установить связь между давлением, температурой и объёмом.
Состояние газа характеризуется давлением, объемом, температурой.
В международной системе единиц (СИ):
Единицей объема (V) является м3, допускаются внесистемные единицы литр (л), миллилитр (мл).
1м 3= 1000л, 1л = 1000мл (см3)
Температура (Т) измеряется в Кельвинах (Т = 273 + t0 C)
Давление (Р) измеряется в Па, кПа. Соотношение между единицами различных систем:
1атм=760мм рт.ст.=101325Па =101,325кПа = 1,0133∙105Н/м2.
Сравнивать объемы газов можно только при одинаковых (равных) условиях. Обычно ими являются:
температура Т0= 273К (00С), и
давление Р0= 101,325кПа (760 мм рт.ст., 1атм.)
Эти условия состояния газа называют нормальными условиями(н.у.). Объем газа при нормальных условиях обозначается V0.
studfiles.net
