Искусственный интеллект – угроза или помощник для человечества?
- Ксения Гогитидзе
- Би-би-си, Лондон
Автор фото, Thinkstock
Подпись к фото,Симбиоз человека и машины – один из путей развития человечества
Умные машины научились блефовать, обыгрывать профессионалов в шахматы или Го, переводить и распознавать человеческий голос. Каждую неделю мы узнаем о все новых подвигах компьютерных программ, уже умеющих ставить медицинские диагнозы, рисовать не хуже Рембрандта, петь или генерировать текст. Стоит ли человеку опасаться искусственного интеллекта?
По-настоящему “горячей” тема искусственного интеллекта (ИИ/AI) стала в последние несколько лет. Ученые связывают это с бурным развитием нейронных сетей (одно из направлений исследований в области искусственного интеллекта), которое, в свою очередь, стало возможным с появлением мощных компьютеров.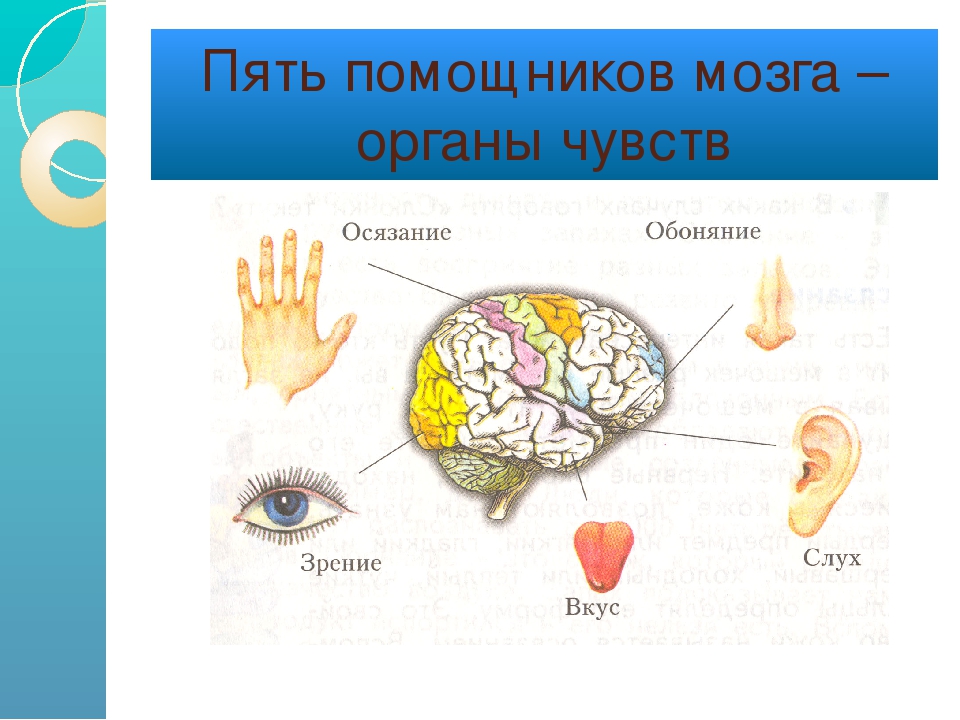
“С начала 2010-х годов под влиянием впечатляющих успехов, полученных в результате применения многослойных нейронных сетей (в первую очередь сверточных и рекуррентных), эта область привлекла серьезное внимание как со стороны ученых и инженеров, так и со стороны инвесторов”, – комментирует автор одной из российских шахматных программ, специалист по методам машинного обучения Сергей Марков.
Ученое сообщество может спорить о сроках появления умных машин, но сходится в одном: развитие технологий окажет безусловное влияние на общество, экономику и отношения между людьми в будущем. Уже сейчас раздаются призывы обдумать этические принципы разработки искусственного интеллекта, удостоверившись в том, что искусственный интеллект развивается в безопасном для людей направлении.
Экономический эффект и влияние на рынок труда
Научная фантастика и Голливуд сформировали представление об “искусственном интеллекте” как о следующей форме жизни на планете, которая поработит человечество в Матрице или организует ему ядерный Судный день. Выживших добьет Терминатор.
Выживших добьет Терминатор.
Автор фото, Getty Images
Подпись к фото,Умрет ли человечество от Skynet?
В действительности, несмотря на последние достижения в области искусственного интеллекта, до появления разумных машиносуществ еще далеко, признают ученые и специалисты. И те, и другие, впрочем, советуют на некоторые аспекты обратить внимание уже сейчас.
По оценкам исследовательской организации McKinsey Global Institute, в ближайшие десять лет новые технологии радикально изменят рынок труда на планете, что позволит сэкономить порядка 50 трлн долларов.
Изменения коснутся сотен миллионов рабочих мест. Люди все больше и больше будут перекладывать часть своих служебных заданий и многие рутинные задачи на машину, что позволит им сосредоточиться на творческой работе.
“С некоторой точки зрения у человечества в целом есть важная и интересная задача – развиваться каждому конкретному индивидууму гораздо быстрее, чем человечество развивает системы искусственного интеллекта”, – считает эксперт, директор по распространению технологий “Яндекса” Григорий Бакунов.
Но вместе с автоматизацией неминуемо пострадают менее квалифицированные кадры, и уже сейчас необходимо задуматься, как их защитить, переучить и подготовить к новой жизни.
Пострадать, как показывает практика, могут не только синие воротнички, но и работники умственного труда. Несколько дней назад Goldman Sachs заменил команду из 600 трейдеров на двух человек и автоматизированные программы алгоритмического трейдинга, для обслуживания которых были наняты 200 разработчиков-программистов.
Автор фото, Thinkstock
Подпись к фото,Многие задачи вскоре станут по силам роботизированным системам, которые последовательно начнут заменять людей
Искусственный интеллект сам по себе не тождественен автоматизации процессов, но развитие ИИ приведет к тому, что все больше задач будет по силам компьютерной программе.
Среди вариантов решения проблемы вытеснения человека машиной на рынке труда, как указывает Аллисон Дютман, координатор программ Foresight Institute – некоммерческой организации, базирующейся в Силиконовой долине для продвижения новых технологий, – введение понятия “универсальный базовый доход”, который бы получал каждый житель вне зависимости от уровня дохода и занятости. Подобный доход финансировался бы за счет так называемого инновационного налога Land Value Tax, введение которого сейчас активно обсуждается в Силиконовой долине.
Подобный доход финансировался бы за счет так называемого инновационного налога Land Value Tax, введение которого сейчас активно обсуждается в Силиконовой долине.
Личность ли искусственный интеллект?
Является ли роботизированная система личностью? Может ли умный компьютер голосовать? Какого он пола? Отношения человека и умной машины уже сейчас обсуждают депутаты Европарламента, задаваясь вопросом, следует ли наделять будущих роботом статусом “электронной личности”.
Как указывает Дютман, люди нехотя делятся правами с теми, кто им непонятен, а значит будут сопротивляться “очеловечиванию” ИИ.
Автор фото, AFP
Подпись к фото,Человека и машину разделяет главное – способность думать
“Принимая во внимание, как долго человечество шло к тому, чтобы наделить равными правами всех людей, вне зависимости от цвета их кожи, расы или гендера, можно уже сейчас предположить, что и машины они не сходу не признают равными.
Вместе с этическими появляются и юридические тонкости: кто возьмет на себя ответственность в случае аварии беспилотного автомобиля или поломки умного медицинского устройства – и нравственные вопросы: стоит ли развивать беспилотное оружие, способное действовать без ведома человека?
Третья этическая головоломка обсуждается чаще других и волнует человечество гораздо больше: что теоретически может сделать с человечеством суперинтеллект, настоящая умная машина?
Научить ИИ этике
Специалисты в области развития ИИ признают: пусть не в ближайшие 20-30 лет, но человечество все же доживет до появления настоящего искусственного интеллекта, который будет умнее своего создателя.
“Последний бастион будет взят тогда, когда будет создан так называемый “сильный ИИ” (Strong AI, Artificial General Intelligence), то есть такой ИИ, который будет способен решать неопределенно широкий спектр интеллектуальных задач”, – говорит Сергей Марков.
А главное, такой ИИ сможет самостоятельно думать.
Исследованием угроз, которые таит ИИ, а также этическими проблемами, связанными с новыми технологиями, занимаются многие институты, в числе которых организация Future of Life Institute (Институт будущего жизни), Foresight Institute, Future of Humanity Institute, OpenAI и другие.
Решение Аллисон Дютман из Foresight Institute – дать компьютеру прочитать всю научную литературу, научные статьи, поднимающие вопрос об этике, и сделать эту информацию основой для его будущих решений.
Что такое Нейронные сети и какое у них будущее?
Большинство экспертов связывают прогресс в развитии ИИ с развитием нейронных сетей.
Нейронные сети – это одно из направлений исследований в области искусственного интеллекта, основанное на моделировании биологических процессов, которые происходят в человеческом мозгу.
Именно им мы обязаны появлению впечатляющих результатов в распознавании речи и изображений, постановке медицинских диагнозов, переводе текста и создании изображений, генерации речи и музыкальной композиции.
Автор фото, iStock
Подпись к фото,Именно с развитием нейронных систем связывают ученые развитие искусственного интеллекта
На сегодня, как признают специалисты, нейронные сети признаны одним из лучших алгоритмов машинного обучения, а решения на их основе показывают на данный момент самые выдающиеся результаты.
И это несмотря на то, что современные нейронные сети устроены в полторы тысячи раз проще, чем головной мозг крысы.
“Пока что создаваемые нами нейронные сети относительно невелики по сравнению, скажем, с нейронной сетью человеческого мозга и, кроме того, они представляют собой весьма упрощенный аналог естественных нейронных сетей. Поэтому пока что при помощи нейронных сетей мы решаем в основном сугубо прикладные задачи”, – рассказывает Сергей Марков.
Сейчас создаются специализированные процессоры для обучения таких сетей (так называемые нейроморфические процессоры), которые позволят увеличить скорость вычислений на несколько порядков.
Разработчики не просто заняты сейчас увеличением количества нейронов в сети, но и изменением конструкции сетей. “Сложные системы конфигурации сетей – то, с чем сейчас производится наибольшее число экспериментов”, – рассказывает Григорий Бакунов.
Автор фото, iStock
Подпись к фото,“Умных” помощников человека в ближайшее время станет больше – микросенсоры в стене, сенсор размером с пуговицу, оповещающий человека в случае опасности
А тот факт, что такие системы стали сравнительно доступными большому числу рядовых разработчиков, привел к появлению стартапов, экспериментирующих с нейронными сетями, например Prisma (приложение позволяет обрабатывать фотографии, превращая их в стилизации картин известных художников) и Mubert (онлайн-композитор электронной музыки).
Что нас ждет в ближайшее время
Как прогнозирует профессор Университетского колледжа Лондона и Principal Scientist Nokia Bell Labs Ник Лейн, человека будут окружать еще больше “умных вещей”. Они станут компактнее и эффективнее.
Они станут компактнее и эффективнее.
Профессор приводит такой пример: если раньше встроенный в стену сенсор мог лишь осознавать, что кто-то прошел мимо, то в будущем он будет не только знать, кто конкретно прошел, но и как ведет себя человек, не нуждается ли в чем, не представляет ли он угрозу для себя или окружающих.
Сенсор размером с пуговицу сможет оповещать человека в случае опасности.
С профессором согласен и Григорий Бакунов из “Яндекса”: “В ближайшее время нас ждет бум развития узких искусственных интеллектов, которые помогают решать какую-то одну довольно простую задачу, но которую они будут решать даже лучше, чем человек”.
Автор фото, iStock
Подпись к фото,Все больше появляется этических вопросов, связанных с развитием ИИ
Система распознавания голоса, например, уже сейчас распознает некоторые голосовые команды и адреса лучше, чем человек.
“Наиболее вероятным путем развития нашей цивилизации является путь синтеза человека и машины: палка, одежда, автомобиль, мобильный телефон, кардиостимулятор или кохлеарный имплантат – по мере развития наши инструменты все более и более напоминают продолжение наших тел. Уже завтра машины смогут получать от человека мысленные команды, воспринимать мысленно формируемые визуальные образы, передавать информацию непосредственно в мозг – такие проекты уже сейчас существуют за стенами наиболее продвинутых технологических лабораторий”, – подытоживает Сергей Марков.
Уже завтра машины смогут получать от человека мысленные команды, воспринимать мысленно формируемые визуальные образы, передавать информацию непосредственно в мозг – такие проекты уже сейчас существуют за стенами наиболее продвинутых технологических лабораторий”, – подытоживает Сергей Марков.
Журналисты пока еще нужны?
Газета Financial Times в прошлом году провела довольно рискованный эксперимент, одновременно поставив задачу написать текст своему профильному корреспонденту и умной программе по имени Эмма. Обе статьи затем должен был прочитать редактор Financial Times и угадать, за какой из двух заметок стоит журналист, а за какой компьютер.
Перед этим своеобразным “краш-тестом” корреспондент Financial Times признавалась: “Я думаю, программа точно справится с задачей быстрее меня. Но, надеюсь, я все-таки сделаю это лучше”.
Так и случилось: Эмма действительно оказалась быстрее – программа сгенерировала текст на основе статистики об уровне безработицы в Британии за 12 минут. Журналистке потребовалось 35 минут. И, как она сама впоследствии признавалась, Эмма превзошла ее ожидания. Программа не только умело обращалась с фактами, но и поставила новость в контекст, предположив, как возможный “брексит” (дело было в мае 2016 года, до референдума о выходе Британии из ЕС) может изменить ситуацию.
Журналистке потребовалось 35 минут. И, как она сама впоследствии признавалась, Эмма превзошла ее ожидания. Программа не только умело обращалась с фактами, но и поставила новость в контекст, предположив, как возможный “брексит” (дело было в мае 2016 года, до референдума о выходе Британии из ЕС) может изменить ситуацию.
Автор фото, Thinkstock
Подпись к фото,Заменят ли людей роботизированные системы? Лет 50 у человечества в запасе есть, успокаивают специалисты
Но кое-что Эмма сделала все же хуже журналистки. “Статья Эммы была написана немного более корявым языком. Но главное, в ней было очень много цифр, – признавался редактор FT. – А, пожалуй, главное, что мы тут пытаемся делать, так это выбирать только действительно важные цифры”.
Эмма – продукт стартапа Stealth. В компании говорят, что у Эммы есть команда живых помощников, но утверждают, что все, что она пишет или делает, – продукт исключительно ее “мозгов”.
И все-таки – надо ли бояться ИИ?
Многие, если не все специалисты, задействованные на сегодняшний день в разработке систем искусственного интеллекта, охотно признают, что ИИ не скоро сделает людей ненужными. Именно потому, что искусственный интеллект еще не настолько умен. Главное, чего ему на сегодняшний день не хватает, – автономной возможности думать.
Именно потому, что искусственный интеллект еще не настолько умен. Главное, чего ему на сегодняшний день не хватает, – автономной возможности думать.
“Сейчас бояться ИИ ни в каком виде не стоит. Можно подождать лет 30-40, пока действительно какие-то радикальные изменения произойдут”, – считает Бакунов.
Но кое-что уже происходит: понемногу стирается грань между работой или задачей, выполненной человеком, и задачей, выполненной машиной. Как объясняют специалисты, уже сейчас порой бывает сложно понять, кто сидит внутри системы – человек или машина.
“Нет критериев, когда мы сможем понять, что внутри машины зародилось сознание”, – задается вопросом Бакунов.
Человек станет скрепкой?
Известный адепт алармистской точки зрения, в рамках которой ужасы, описанные в Терминаторе, могут стать реальностью, – философ Ник Бостром – придерживается мнения, что достигший интеллектуального уровня человека ИИ способен будет уничтожить человечество.
Автор фото, Getty Images
Подпись к фото,Станет ли описанное в фильме нашей повседневной реальностью?
Бостром объясняет на примере скрепок: вы ставите перед искусственным интеллектом задачу делать скрепки, как можно больше и лучше. ИИ в какой-то момент понимает, что человек представляет угрозу, потому что может выключить компьютер, что будет противоречить задаче делать как можно больше скрепок. В случае, если человек не представляет угрозу, ИИ решает, что человеческие тела состоят из атомов, которые можно использовать для производства отличных скрепок. Итог – компьютер изведет человечество на скрепки.
Такой сценарий многим кажется преувеличением. По мнению Сергея Маркова, например, “высокая эффективность выполнения нелепой цели несовместима с нелепостью этой цели – грубо говоря, ИИ, способный переделать весь мир в скрепки, будет неизбежно достаточно умен для того, чтобы отказаться от такой цели”.
Искусственный интеллект как золотая рыбка
Британский специалист в области искусственного интеллекта, профессор когнитивной науки в Университете Сассекса Маргарет Боден относится к утверждениям о скором пришествии умных машин скептически.
Автор фото, Getty Images
Подпись к фото,В мае 1997 года компьютер Deep Blue II впервые выиграл матч у Гарри Каспарова
Профессор приводит пример “золотой рыбки”, когда в обмен на свободу рыбак загадывает три желания. Одно из желаний – вернуть сына с войны, второе – 50 тысяч долларов и третье – возможность наутро загадать еще одно желание.
В тот же вечер в дом рыбака постучали. Сына вернули с войны – в гробу. Рыбак получил страховку в 50 тысяч долларов.
“Замените в этой притче рыбку на ИИ, и все станет ясно – объясняет Боден. – Ах, да, на следующий день рыбак воспользовался третьим желанием и – отменил предыдущие два”.
Возможен ли перенос сознания в машину?
Сергей Марков:
“Если говорить о возможности полного переноса сознания, то современными предшественниками такой технологии будущего являются проекты, подобные Blue Brain, направленные на создание действующих электронных аналогов мозга, а также проекты, направленные на создание интерфейсов мозг-машина (BCI) – аппараты для протезирования потерянного зрения, слуха, замены утраченных конечностей, даже частей мозга.
Автор фото, Science Photo Library
Подпись к фото,Цель специалистов в области ИИ – создать “сильный искусственный интеллект”, который был бы способен решать широкий спектр задач
Очень интересным и перспективным направлением является оптогенетика (в принципе для сопряжения мозга и машины можно менять не только машины, но и саму нервную ткань, создавая в ней искусственные фоторецепторы).
Когда будет решен широкий спектр инженерных задач в рамках таких частных проектов, я думаю, что задача переноса сознания станет вполне разрешимой. Уже сейчас мечтатели предлагают гипотетические схемы для осуществления подобного проекта.
Например, Ян Корчмарюк, предложивший в свое время название “сеттлеретика” для направления исследований, связанных с переносом сознания, считает, что наиболее перспективной схемой является использование специализированных нанороботов, внедряемых в нейроны человеческого мозга. Впрочем, для успешного воплощения подобной схемы необходимо решить целый ряд сложных инженерных проблем”.
Наш мозг – помощник или враг?
Время Чтения: 3 мин.С каждым днем я не перестаю восхищаться, насколько удивительно Бог создал человека. Творец наградил человека удивительными возможностями.
Пожалуй, самым удивительным и малоизведанным является мозг человека. Сегодня я наблюдаю, как большинство людей не понимают этого, и поэтому не могут правильно использовать свой мозг. Чтобы разобраться в этой ситуации, давайте детальнее рассмотрим, как происходит работа нашего мозга.
Все начинается в нашем разуме
В результате получения различной информации от пяти органов чувств (слух, зрение, осязание, обоняние и вкус) в нашем разуме возникают различные мысли. Исходя из прошлого опыта, эти мысли могут еще подкрепляться эмоциями. Все это определяет наше отношение и реакцию на полученную информацию.
Дальше происходит мыслительный процесс. И вот тут очень важно сортировать наши мысли. Думая и представляя себе что-то, мы изменяем наш мозг. Управляя нашими реакциями на обстоятельства, мы формируем наш мозг.
Бог создал человека настроенным на любовь и благо. Если полученная информация вызывает у вас негативные эмоции, старайтесь отсеивать их или переводить в позитивные. Старайтесь всегда находить хорошее, даже в самой плохой ситуации. Ваши вера, надежда и мечты очень сильно влияют на работу головного мозга. Держите ваши мысли в чистоте. Мы получаем то, во что мы верим!
Каждое утро в результате нейрогенезиса в нашем мозге рождаются новые нервные клетки. Это строительный материал, который формирует нейронные связи и включает мозг для достижения результата. То, о чем мы больше всего думаем, больше всего и растет. Если концентрироваться на плохом, то ткань мозга разрушается, а если на хорошем, то ткань мозга оздоравливается. Мозг обладает удивительной пожизненной способностью перестраиваться, в ответ лишь на мыслительную деятельность.
Представьте человека, который всегда думает о плохом. Точно как в том анекдоте:
Бесплатный мастер-класс «КОУЧ — ПРОФЕССИЯ БУДУЩЕГО».
При регистрации бонус Чек лист 7 Шагов самокоучинга!
Мужик в троллейбусе едет и думает: «Жена — стерва, друзья — подонки, начальник — дебил, работа — дрянь, жизнь — г@вно».
За спиной мужика стоит ангел, записывает в блокнот и думает: «Какие странные желания, а главное — одни и те же каждый день! Но ничего не поделаешь, надо исполнять…»
У этого человека в жизни будет случаться масса негативных последствий. Сам того не понимая, он программирует свой мозг не неудачу.
Есть еще другая ситуация, когда вам необходимо сделать что-то новое, чего вы еще никогда не делали. Ваш мозг начинает вам рисовать различные варианты того, что может произойти. Иногда мы представляем неудачи, ставим себе какие-то рамки, придумываем, что о нас могут подумать или какой итог может быть в той или иной ситуации. Мы никогда с точностью не угадаем, что произойдет на самом деле.
Так как в человеке самый сильный инстинкт – это инстинкт самосохранения, то мозг будет всячески ограничивать вас от любых действий.
Для того чтобы сделать ваш мозг главным оружием в достижении любого результата, всегда необходимо свои мысли подкреплять действиями. Возможность не обладает силой действия. Только осуществив на деле, вы придаете возможности силу воплощения. Частота действий улучшает обучаемость и формирует прочные нейронные связи.
Мы всегда ощущаем воздействия извне, но мы не обязаны поддаваться этим воздействиям. Мы не властны над обстоятельствами и событиями, но властны над своими отношениями к ним. В Библии написано, что Бог не дает нам испытаний, которые мы не можем вынести.
Еще я знаю, что всегда после испытаний приходят благословения. Также в Библии Бог говорит: «Претерпевший же до конца, спасется!». Это значит, что, только пройдя до конца, вы получите желаемый результат. Никогда не останавливайтесь и не сдавайтесь! Размышляйте и визуализируйте о желаемом результате, подкрепляйте действиями, не соглашайтесь на худшее, чем вы себе наметили. Обогащайте свое мастерство новыми навыками. Счастье, здравый ум и здоровье нужно постоянно добывать.
Никогда не останавливайтесь и не сдавайтесь! Размышляйте и визуализируйте о желаемом результате, подкрепляйте действиями, не соглашайтесь на худшее, чем вы себе наметили. Обогащайте свое мастерство новыми навыками. Счастье, здравый ум и здоровье нужно постоянно добывать.
Действуйте. Развивайтесь. Совершенствуйтесь. Пределов нет, кроме тех, которые мы ставим себе сами!
Не пропускай самые интересные публикации для личностного роста. Подписывайся на нас в той социальной сети, которую любишь больше всего: Instagram, Facebook, Telegram.
Чем кормить свой мозг | Главный портал МПГУ
Чтобы мозг работал хорошо, важно, чтобы его сосуды как можно дольше оставались эластичными, через кровь поступало достаточное количество кислорода и питательных микроэлементов, а межнейронные соединения работали без перебоев. Как этого добиться? Ученые давно доказали связь между питанием и функциональными возможностями мозга.
Так как же добиться совершенно нового уровня работы мозга, которая позволит использовать все свои возможности? Врачи рекомендуют включить в свой рацион определенные продукты.
Важную роль в регуляции работы гормональной функции гипофиза играет серотонин. Он же является одним из нейромедиаторов, что отвечают за хорошее настроение. Снижению этого вещества в мозге сопутствуют тяжелые мигрени, частые затяжные депрессии и навязчивые расстройства. Пополнить запас серотонина легко: он содержится в черном шоколаде, бобовых (фасоль, горох, чечевица, соя), томатах, финиках и инжире.
Активное участие при контроле организмом уровня глюкозы в крови принимает хром. Его недостаток может привести к ухудшению настроения, проблемам с памятью и депрессивным состояниям. Чтобы этого избежать, налегайте на помидоры, брокколи, груши и финики.
Правильное проведение импульсов по нервным волокнам обеспечивает магний. Он отвечает запроцессы концентрации и запоминания, обеспечивает спокойствие в стрессовых ситуациях. Магнием богаты каши, черный хлеб и грецкие орехи.
Незаменимый помощник в борьбе с плохим настроением и немотивированной агрессией
 Она является важным элементом, препятствует забывчивости и даже способна предотвратить развитие болезни Альцгеймера. Содержится фолиевая кислота в сырых зеленых овощах (салате, капусте, шпинате), зерновых и бобовых, а также в некоторых цитрусовых и меде.
Она является важным элементом, препятствует забывчивости и даже способна предотвратить развитие болезни Альцгеймера. Содержится фолиевая кислота в сырых зеленых овощах (салате, капусте, шпинате), зерновых и бобовых, а также в некоторых цитрусовых и меде.Жирные кислоты омега-3 входят в состав клеток нервной системы, а точнее в оболочку нейронов. Они отвечают за способности в обучении, запоминании и классификации информации, замедляют процессы старения. Кислоты омега-3 содержат рыба, морские водоросли, грецкие орехи, льняное и соевое масла. Кроме того, в рыбе много жирных кислот омега-6, фолиевой кислоты, витаминов Е и В6.
Не стоит забывать о продуктах, богатых антиоксидантами – витаминами С, Е, ß-каротином, танином и флавоноидами. Эти элементы улучшают способности к обучению, полезны для сосудов головного мозга, так как увеличивают приток крови. В основном они содержатся в овощах (фасоли и артишоках), фруктах (смородине, винограде, гранате, чернике, клюкве), а также в орехах и специях./137033401-56a795f15f9b58b7d0ebee9c.jpg) В эту группу еще можно записать шоколад, красное вино и зеленый чай.
В эту группу еще можно записать шоколад, красное вино и зеленый чай.
Холин – еще один важный элемент тканей головного мозга. Он отвечает за понижение уровня холестерина на стенках сосудов, стимулирует работу сердца, помогает при передаче нервно-мышечных импульсов. С его помощью осуществляется профилактика атеросклероза, он понижает риски заболевания Альцгеймера, активизирует работу мозга, в частности процессы памяти. Недавно было открыто прямое участие холина в процессах восстановления нервных клеток. Содержится этот элемент в зеленых листовых овощах (капусте, шпинате), яичном желтке, рисовой каше и овсянке.
Информация с сайта dni.ru
Ученые создали чип, напоминающий клетки мозга — Российская газета
Всего 10 квадратных миллиметров составляет размер чипа, напоминающего по своей структуре клетки человеческого мозга, сообщает научное издание Scientific Reports.
Ученые калифорнийского университета создали устройство, которое может самостоятельно обучаться и придумывать различные модели поведения, а в будущем станет основой по-настоящему мыслящих машин. При этом существующие на сегодняшний день умные системы становятся более доступными и все чаще используются не только в бизнесе и государственном управлении, но и в технических решениях для простых пользователей.
При этом существующие на сегодняшний день умные системы становятся более доступными и все чаще используются не только в бизнесе и государственном управлении, но и в технических решениях для простых пользователей.
Умный взгляд
Большинство обладателей смартфонов уже знакомы с искусственным интеллектом, ведь в их гаджетах он контролирует некоторые важные процессы. Один из них – режим фото- и видеосъемки. Смартфон с помощью специальной подсистемы понимает, какие объекты расположены перед объективом и насколько они удалены, а также определяет время суток и степень освещенности. Если владелец гаджета перевел программу камеры в режим “Авто”, то искусственный интеллект сделает снимок за него, подобрав оптимальные технические условия: выберет наиболее подходящий объектив (при наличии нескольких), диафрагму выставит такую, чтобы кадр был не пересвечен или затемнен, включит режим HDR, который из нескольких фотографий соберет один улучшенный снимок.
Смартфоны во многом помогают своим владельцам, но скоро будут ими повелевать
– Искусственный интеллект – дорогое удовольствие, ведь ему требуются мозги из дополнительных чипов, – пояснил продавец-консультант одной из сетей бытовой техники и электроники Николай Косолапов. – Раньше производители пытались решить вопрос только на уровне программ, но такие устройства получались “задумчивыми”. Поэтому под интеллектуальные задачи начали создавать дополнительные аппаратные блоки. Сегодня большинство смартфонов ими обладают, но наиболее комфортно искусственный интеллект работает на самых быстрых и, как правило, самых дорогих моделях.
– Раньше производители пытались решить вопрос только на уровне программ, но такие устройства получались “задумчивыми”. Поэтому под интеллектуальные задачи начали создавать дополнительные аппаратные блоки. Сегодня большинство смартфонов ими обладают, но наиболее комфортно искусственный интеллект работает на самых быстрых и, как правило, самых дорогих моделях.
Особенно важна производительность, когда задача перед устройством ставится сложная. Так, например, во второй половине прошлого года компания Dahua Technology выпустила камеры наблюдения с модулем искусственного интеллекта на борту. Мощный чип позволяет им не только захватывать лица людей, но и быстро определять детали, например пол человека, его возраст и даже настроение. По мнению экспертов сферы IT, такие решения уже скоро станут применяться не только в специализированной технике, которая призвана обеспечить безопасность предприятий и государственных организаций, но и в быту.
Заботливый парень
В современных смартфонах искусственный интеллект берет на себя функции хранителя и консультанта. В частности, он анализирует, как пользователь работает со своим гаджетом: какие приложения запускает чаще, какие настройки больше предпочитает и где в момент использования той или иной программы он находится. В дальнейшем вся эта информация сопоставляется и анализируется. Итогом этой работы становятся рекомендации, которые позволяют увеличить время работы устройства, а также очистить его от вредных или бесполезных приложений. Искусственный интеллект позволяет улучшить одну из основных функций смартфона – передачу голоса своего хозяина. Прислушиваясь к разговорам, он выделяет голос на фоне посторонних звуков и усиливает его, а ненужные шумы, наоборот, приглушает.
В частности, он анализирует, как пользователь работает со своим гаджетом: какие приложения запускает чаще, какие настройки больше предпочитает и где в момент использования той или иной программы он находится. В дальнейшем вся эта информация сопоставляется и анализируется. Итогом этой работы становятся рекомендации, которые позволяют увеличить время работы устройства, а также очистить его от вредных или бесполезных приложений. Искусственный интеллект позволяет улучшить одну из основных функций смартфона – передачу голоса своего хозяина. Прислушиваясь к разговорам, он выделяет голос на фоне посторонних звуков и усиливает его, а ненужные шумы, наоборот, приглушает.
Важным отличием искусственного интеллекта от его более ранних предшественников, которые также были призваны облегчить жизнь людей, является тот факт, что эти программы способны к самообучению без участия разработчика. Умный переводчик от Google в вашем смартфоне использует самообучающиеся системы для 41 языка, включая русский. Алгоритмы позволяют значительно повысить качество перевода текстов определенного рода. Так, если перевод требуется медику или работнику финансовой сферы, то со временем помощник обрастет необходимой лексикой и сможет переводить речь своего хозяина более точно.
Алгоритмы позволяют значительно повысить качество перевода текстов определенного рода. Так, если перевод требуется медику или работнику финансовой сферы, то со временем помощник обрастет необходимой лексикой и сможет переводить речь своего хозяина более точно.
Не человек, а улыбнется
Технологии искусственного интеллекта постоянно совершенствуются. Так, в Пермском классическом университете (ПГНИУ) команда математиков и психологов создала модель принятия роботом альтернативных решений на основе эмоциональной памяти.
– Зачем искусственному интеллекту эмоции? – говорит декан механико-математического факультета ПГНИУ, кандидат технических наук Андрей Кузнецов. – Человеку приятней общаться не с бездушной машиной, а с себе подобным существом.
По словам ученого, для моделирования поведения искусственного интеллекта использовались исследования психологов о том, какие функции у человека выполняют эмоции и как влияют на его память. Завершенная разработка может применяться при проектировании персональных роботов, а также новых голосовых помощников на мобильных устройствах, способных вести со своим хозяином осмысленный диалог.
Почему люди глупеют и как с этим бороться
«Технологии развиваются столь стремительно, что человек чувствует себя растерянным, не успевая адаптироваться к этим изменениям. Некоторые говорят, что в прошлом мир уже переживал подобные радикальные трансформации – например, с распространением автомобилей, радио, поэтому волноваться не о чем», – такими словами Герман Греф открыл деловой завтрак Сбербанка на Всемирном экономическом форуме в Давосе. Он предложил гостям с помощью голосования высказать свое мнение по этому вопросу.
«Нынешняя трансформация беспрецедентна по скорости и глубине» – так считают 76% участников завтрака, среди которых было много международных и российских экспертов, специалистов, топ-менеджеров, финансистов. «Не отличается от предыдущих» – считают 23%, а 1% полагает, что она «менее масштабна, чем в прошлые времена».
Сегодня технологические изменения ведут к трем важным негативным последствиям для человека, отметил Греф: перегруженность информацией, растущий выбор и растущая неопределенность, потеря частной жизни (privacy). Выступающие рассмотрели с разных сторон влияние этой трансформации на человека.
Выступающие рассмотрели с разных сторон влияние этой трансформации на человека.
Вначале о проблемах цифровой зависимости рассказал Андрей Курпатов, возглавляющий в Сбербанке лабораторию нейронаук и поведения человека. (Курпатов известен как автор и ведущий ток-шоу о человеческой психологии «Доктор Курпатов», которое выходило на «Первом канале».)
«Мы – то, что мы едим, в том числе в области информации», – начал Курпатов и показал картинку статьи в научном журнале (сплошной текст) и Instagram Ким Кардашьян. «На что вы прежде всего смотрите?» – спросил он. И пояснил: «Не стыдитесь. Мозг работает так, что из экономии он выбирает те задачи, что попроще». В медиасекторе это хорошо понимают, поэтому мы наблюдаем эскалацию примитивного контента. Мы переходим из галактики Гутенберга в галактику Цукерберга, где нет системного и аналитического мышления, образно описал Курпатов.
Приведя данные из последних исследований о том, как работает мозг, Курпатов отметил: когда контент потребляется постоянно, часть мозга, связанная с мышлением, впадает в спячку (или даже не формируется в процессе взросления человека, который идет до 25 лет). Чтобы мозг начал всерьез думать, нужно 23 минуты (без прерывания), а опросы показывают, что человек отрывается на телефон каждые 15 минут; он не успевает сосредоточиться, чтобы начать думать.
Чтобы мозг начал всерьез думать, нужно 23 минуты (без прерывания), а опросы показывают, что человек отрывается на телефон каждые 15 минут; он не успевает сосредоточиться, чтобы начать думать.
Это ведет к цифровому аутизму, отметил Курпатов. В жизни человек все меньше общается лицом к лицу с другими людьми, заменяя это общением в соцсетях и потреблением цифрового контента. Из-за этого теряются навыки коммуникации в реальной жизни, человек перестает понимать проблемы других людей, растут отчуждение и непонимание. И если человек проводит в телефоне больше 2,5–3 часов в день, резко возрастают депрессивные мысли, социальная настороженность, агрессия.
Кроме того, снижается способность к обучению, отметил Курпатов. Это подтвердила Нгейр Вудс, ректор Школы управления Блаватника при Оксфордском университете: «Если студент выбирает, что делать – купить пару туфель на Amazon или слушать лекцию, он и ничего не узнает и туфли выберет не такие хорошие». Кроме того, озвученная Курпатовым потеря способности разбираться и анализировать ведет к тому, что и в соцсетях человек прежде всего соглашается с той публикацией, которая подтверждает уже сложившуюся у него точку зрения, что еще больше ухудшает ситуацию, отметила Вудс.
Снижение функциональности мозга ведет к тому, что перестает работать видение будущего, человек теряет способность задумываться о том, что ему делать, как поступать, строить образы будущего, добавил Курпатов. Теряется способность анализировать, люди становятся нетерпимы к своим неудачам, это подрывает их способность адаптироваться к жизни и добиваться успеха.
Курпатов также привел результаты исследований, показывающие зависимость работы мозга от того, где находится телефон – рядом или далеко (есть ли возможность заглянуть в него). Когда телефон рядом, это провоцирует желание взять его, что отражается на деятельности мозга. Вывод – «когда телефон рядом, то глупеешь».
Бороться с этим можно тремя способами, считает он: нужно самоосознание; нужно соблюдать цифровую гигиену; улучшать и увеличивать количество социальных связей в реальной жизни.
Вопрос «что делать» рассмотрел и Джейкоб Френкел, председатель совета директоров JPMorgan Chase International, – но с другой точки зрения. Регулировать нужно не развитие технологий, не изобретение инструментов (ограничения в этой области будут мешать развитию), регулировать нужно использование технологий.
Регулировать нужно не развитие технологий, не изобретение инструментов (ограничения в этой области будут мешать развитию), регулировать нужно использование технологий.
Любая активность в мире – это межотраслевой феномен, отметил он и привел такой пример. Если инженеры изобрели двигатель, который позволяет автомобилю ездить со скоростью в несколько раз большей, чем у имеющихся машин, и этот автомобиль выпустили на дорогу и произошло множество ДТП, то это не проблема двигателя и инженеров. Сначала нужно было изменить систему, потому что дороги слишком узки.
«Искусственный интеллект выглядит так не по-человечески… – улыбнулся Френкел. – Хорошо, давайте сначала будем работать с дополненной реальностью – ведь это просто дополнение к тому, что у нас уже есть».
О силе ошибок (способность анализировать которые, по Курпатову, теряют молодые люди) говорил Рэй Далио, основатель крупнейшего хедж-фонда в мире Bridgewater Associates (активы под управлением – более $160 млрд). «Боль + рефлексия = прогресс», – привел он формулу успеха. «После того как боль проходит, ты больше знаешь о реальности», – сказал он, приведя в пример свои мысли о том, что фондовый рынок будет рушиться после долгового кризиса в развивающихся странах в 1982 г. В реальности это было дно для фондового рынка и лучший момент для покупки акций – и эта история, по словам Далио, многому его научила.
«Боль + рефлексия = прогресс», – привел он формулу успеха. «После того как боль проходит, ты больше знаешь о реальности», – сказал он, приведя в пример свои мысли о том, что фондовый рынок будет рушиться после долгового кризиса в развивающихся странах в 1982 г. В реальности это было дно для фондового рынка и лучший момент для покупки акций – и эта история, по словам Далио, многому его научила.
Хотя он и не перестал совершать ошибки. Но, чтобы это случалось реже, нужно сформулировать критерии, которым следовать в проблемной и неоднозначной ситуации, а также не зацикливаться на собственном мнении. «Когда сам принимаешь решения, то просто лишь принимаешь их. Пусть рядом будет кто-то, кто знает эти критерии и может указать на них», – посоветовал Далио. Кроме того, «интеллектуально ты хочешь знать, в чем твои ошибки, но эмоционально, подсознательно это сложно», сказал он и добавил, обращаясь к кому-то из присутствующих: «Вы хотите услышать, что я на самом деле о вас думаю?»
Любую мысль, которую может подумать мозг, можно переложить в алгоритм, а если взять не один мозг и переложить различные мнения на алгоритм в соответствии с заданными критериями, создаешь коллективный процесс принятие решения. Когда начинаешь сомневаться, обращаешься к этому алгоритму и там учитываются разные мнения, ты больше не ограничен собственным решением. «Абсолютно устаревший подход – быть ограниченным внутри собственного мозга и не привлекать коллективное мышление», – подвел итог Далио.
Когда начинаешь сомневаться, обращаешься к этому алгоритму и там учитываются разные мнения, ты больше не ограничен собственным решением. «Абсолютно устаревший подход – быть ограниченным внутри собственного мозга и не привлекать коллективное мышление», – подвел итог Далио.
Эти вопросы, поднятые на экономическом форуме, связаны скорее не с экономикой, а с образованием, однако они очень важны для развития людей, суммировал Греф. Но дело не только в учениках, «главная проблема в России – учителя: кто учит наших детей?». У многих учителей, даже обладающих хорошими знаниями, нет коммуникативных навыков, помогающих обучению, отметил Греф, добавив, что в том числе и по этой причине Сбербанк активно занимается образовательными проектами.
Эволюция мозга
- Все более интенсивный информационный поток ставит новые вызовы перед нашим мозгом, который сформировался еще в пещере кроманьонца 40 тысяч лет назад.
- Мы все больше слышим об искусственном интеллекте: он заменяет банковских и страховых работников, помогает принять решение о выдаче кредита, водит грузовики.

- В последнее время возникает новая антропология, новые способы взаимодействия человека и машины.
- Несмотря на развитие технологий, пока нет ответа на вопрос, можно ли без ущерба для человека объединить мозг с машиной и передать ей часть функций.
Сергей Медведев: Каждый день мы все больше слышим об искусственном интеллекте. Он заменяет банковских и страховых работников, помогает принять решение о выдаче кредита, водит грузовики. Но что такое искусственный интеллект? Является он продолжением или отрицанием человека? Что такое вообще компьютер – продолжение эволюции человека? И можно ли соединить человека с компьютером? Подробности в сюжете нашего корреспондента
Светлана Осипова: Создание робота-помощника, способного заменять человека, – не только реальность, это необходимость. Ученые утверждают, что человеку нужна помощь искусственного интеллекта. Информация в мире цифровых технологий появляется и изменяется в десятки раз быстрее, чем наш мозг может ее воспринимать.
Информация в мире цифровых технологий появляется и изменяется в десятки раз быстрее, чем наш мозг может ее воспринимать.
Мозг не может справиться с большим объемом данных, зато это может сделать машина. Поэтому современные ученые предлагают совместить естественный и искусственный интеллект, иными словами, подключить “умную” систему к мозгу человека, чтобы творческие задачи оставались за человеком, а память и быстродействие – за машиной. Ученые уже разработали нейроинтерфейс – систему, которая приспособлена для обмена информацией между мозгом и компьютером.
Существуют и сервисы, которые структурируют потоки информации: они используются, например, в банках. Специалисты утверждают, что 90% банков при принятии решения о выдаче кредита используют машины: именно сервис, руководствуясь заданной программой, определяет, какие заявки на кредит можно одобрить. Но пока это только внешняя система, не связанная непосредственно с мозгом человека, не влияющая на его работу. И, несмотря на развитие технологий, пока нет ответа на вопрос, можно ли без ущерба для человека объединить мозг с машиной и передать ей часть функций.
Сергей Медведев: У нас в гостях психофизиолог Александр Каплан, доктор биологических наук, профессор МГУ, и протоиерей Кирилл Копейкин, кандидат физико-математических наук, директор Научно-богословского центра междисциплинарных исследований Санкт-Петербургского государственного университета.
Как я понимаю, можно представить некую иерархию мозгов – мозг обезьяны, мозг человека, мозг крысы и мозг мыши: они разные. Видимо, человеческий мозг по количеству нейронов на вершине этой иерархии. Но продолжается ли его развитие?
Александр Каплан: Биологический взгляд: мозг – это обычный орган. Он возник и развивался в ходе эволюции. Но это не обычный орган, а тот, который принимает, обрабатывает, анализирует информацию и прогнозирует поведение существа в реалиях пространства. В этом смысле действительно в какой-то момент, когда человек стал разумным, то есть когда он мог менять среду под себя, ему не нужно было меняться телом, исчез один из движущих факторов эволюции. И второе – человек стал социальным. Каждый человек, как бы он ни был способен к тем или иным делам, был ценен для этого общества, потому что распределение труда предполагало, что каждый будет заниматься каким-то своим делом. Поэтому принцип “выживает сильнейший” или “слабейшие исчезают из эволюции” – такого нет. Где-то 50–40 тысяч лет назад эволюция для мозга фактически остановилась: мы сейчас такие, как нас подготовила жизнь в пещерах Кроманьона.
И второе – человек стал социальным. Каждый человек, как бы он ни был способен к тем или иным делам, был ценен для этого общества, потому что распределение труда предполагало, что каждый будет заниматься каким-то своим делом. Поэтому принцип “выживает сильнейший” или “слабейшие исчезают из эволюции” – такого нет. Где-то 50–40 тысяч лет назад эволюция для мозга фактически остановилась: мы сейчас такие, как нас подготовила жизнь в пещерах Кроманьона.
Сергей Медведев: То есть мозг сформировался уже у кроманьонцев в том виде, с тем же количеством нейронов – 86 миллиардов?
Потенциала мозга вполне достаточно, чтобы охватить все дальнейшее пространство культурной эволюции
Александр Каплан: Да, и с тем же самым потенциалом. Эти пещерные люди, кстати, могли многое: учиться, охотиться в непростых условиях, обрабатывать материалы…
Кирилл Копейкин: Сейчас эволюция происходит в культуре. Ведь ребенок рождается не вполне человеком, он становится человеком только по культуре. Известно, что дети-Маугли, когда их удается вернуть в человеческую среду, не становятся людьми – это невозможно.
Ведь ребенок рождается не вполне человеком, он становится человеком только по культуре. Известно, что дети-Маугли, когда их удается вернуть в человеческую среду, не становятся людьми – это невозможно.
Сергей Медведев: Но мозг человека продолжает развиваться, скажем, под влиянием внешних факторов? Развивается он сам по себе или это заложено в некоей программе, некоей первоначальной интенции человека?
Кирилл Копейкин: Сложно сказать. Насколько я понимаю, того потенциала, который есть у мозга, достаточно для того, чтобы эволюция происходила в культуре, и мозг осваивал весь расширяющийся и углубляющийся массив культуры.
Александр Каплан: Мы живем в обществе, в культурном пространстве, поэтому содержимое мозга, несомненно, эволюционирует вместе с тем, что происходит вокруг. Здесь, мне кажется, потенциала мозга вполне достаточно, чтобы охватить все дальнейшее пространство культурной эволюции.
Сергей Медведев: А если построить машину времени, проехать на 50 тысяч лет назад, взять ничего не подозревающего кроманьонца, сунуть в современность, обучить его, напичкать всей современной информацией, он будет нормальным адекватным человеком?
Александр Каплан: У только что родившегося ребенка еще нет содержания, он не наполнен той культурологической информацией, тем переживанием жизни, которое придет к нему со временем. Этот ребенок почти как чистый лист, его можно переносить из эпохи в эпоху, и он будет учиться точно так же, как мы: сядет за парту и выучится.
Этот ребенок почти как чистый лист, его можно переносить из эпохи в эпоху, и он будет учиться точно так же, как мы: сядет за парту и выучится.
Сергей Медведев: Есть гипотеза, что человек рождается с голым сознанием, и что мы в него вложим, то и будет, нет никакой генетической памяти.
Кирилл Копейкин: Все-таки не вполне голым: какая-то предрасположенность есть.
Александр Каплан: Ребенок рождается с мозгом, в котором анатомически очень мало связей, то есть очень много нейронов, но они практически не связаны между собой. Накопление массы связей, взаимоотношение между нейронами происходит по ходу его жизни. Фактически внешняя среда лепит этот мозг, выстраивает его под содержание, которым он насыщается.
Сергей Медведев: В какой момент появляется сознание?
Александр Каплан: Самый сложный вопрос для современной науки – что такое сознание? Мне кажется, что эта субстанция появляется с момента первых проблесков осознания себя. Животные тоже в какой-то мере познают этот мир, иначе они не выжили бы. Они подхватывают какие-то закономерности природы: мы говорим, что это условные и безусловные рефлексы. Но в этом круге познания отсутствует познание самого себя. Человек – первое существо, которое обратило свое внимание в познании мира на самого себя. Возникает некое сознание, знание о себе. Очевидно, что эта возможность есть только у человека – возможность понимания речи, языка.
Животные тоже в какой-то мере познают этот мир, иначе они не выжили бы. Они подхватывают какие-то закономерности природы: мы говорим, что это условные и безусловные рефлексы. Но в этом круге познания отсутствует познание самого себя. Человек – первое существо, которое обратило свое внимание в познании мира на самого себя. Возникает некое сознание, знание о себе. Очевидно, что эта возможность есть только у человека – возможность понимания речи, языка.
Кирилл Копейкин: С точки зрения библейской традиции, принципиальное отличие человека от всего остального мира животных заключается не в том, что он умнее, у него больше нейронов, а в том, что он может вступать в личное общение с личным богом. И человек формируется только в этих личностных отношениях. Сегодня мы все привыкли, что являемся личностями по определению, мы говорим о правах личности, но вообще-то понятие личности появилось только в европейской культуре, только в контексте христианской традиции, когда стало возможно ощущение личной встречи с богом.
Сергей Медведев: Есть сознание, есть личность, но есть и совершенно фантастический цифровой поток. Растет количество психических, неврологических заболеваний. Мозг в том виде, в котором он возник для кроманьонцев 50 тысяч лет назад, не справляется с цифровым потоком?
Александр Каплан: Мы говорили о том, справится ли мозг с дальнейшей культурологической эволюцией в этом мире. Там нет особых сомнений, потому что есть достаточная мощность для того, чтобы впитывать в себя, менять в себе что-то. А здесь совершенно другая ситуация. Внешняя нагрузка, совершенно неестественная для мозга человека, увеличивается. Мультимедийные цифровые потоки совершенно не предполагались в той самой пещерной жизни, где человек фактически наращивал себя духовно. Сейчас это действительно большая проблема для человека, он сам создает информацию в неимоверных количествах, подчиняется ей. Мозг не может выдерживать такие нагрузки. Действительно, сильно растет число неврологических и невротических расстройств.
Сергей Медведев: Какой из этого выход? Должен измениться сам мозг, или мозгу нужны какие-то костыли, помощники?
Александр Каплан: Здесь трудно принять какое-то решение, но интуитивное решение может быть – все-таки немножко умерить наш пыл относительно выработки все новых и новых потоков информации, разработки устройств, которыми она проецируется на мозг человека. Может быть, это избыточно, может быть, это не надобность человека, а надобность бизнес-структур, которые используют такие потоки для продвижения товаров и идей. Поэтому первым делом надо посмотреть, насколько мы правильно пользуемся информационными каналами и потоками в этом мире.
Второе: возможно, существует еще некоторый период, когда мы можем помогать мозгу. Ему вполне можно помогать фармакологически, лекарствами, которые никак не вредны для организма, ему можно помогать всякого рода гаджетами, вычислительными устройствами, подсоединяя к нему эти устройства и помогая делать больше вычислений, больше запоминать. Нося с собой телефоны, мы уже помогаем себе: там записано много информации.
Нося с собой телефоны, мы уже помогаем себе: там записано много информации.
Сергей Медведев: Как богословие смотрит на интернет? Это еще одно свидетельство расширения человека, одна из частей замысла бога о человеке?
Кирилл Копейкин: Нам дана большая свобода, а как мы ею пользуемся – это выбор. Есть проблема великого молчания Вселенной. Если Вселенная существует практически 14 миллиардов лет, если много экзопланет, похожих на Землю, то возникает вопрос: а почему мы не слышим никаких сигналов? Астроном Владимир Ляпунов из Московского университета говорит, что это просто свидетельство кризиса нашей цивилизации, мы не понимаем чего-то принципиального о мире.
Похоже, на самом деле решение этой проблемы заключается в том, что эти цивилизации, которые, я думаю, есть, они просто не технологические. Наступит момент, когда технологическая фаза цивилизации закончится, и мы начнем пользоваться теми ресурсами, которые у нас есть, но которыми мы сейчас просто не владеем, теми же ресурсами мозга. Если сейчас объединить все компьютеры Земли, все равно не получится создать человеческий мозг, не хватит ресурса. У каждого из нас в голове есть ресурс, который превышает все возможности Земли, а мы им не пользуемся, просто не знаем, как это делать. Я думаю, проблема в том, чтобы научиться использовать ресурсы мозга и нашей психики, которые мы до сих пор не используем.
Если сейчас объединить все компьютеры Земли, все равно не получится создать человеческий мозг, не хватит ресурса. У каждого из нас в голове есть ресурс, который превышает все возможности Земли, а мы им не пользуемся, просто не знаем, как это делать. Я думаю, проблема в том, чтобы научиться использовать ресурсы мозга и нашей психики, которые мы до сих пор не используем.
Александр Каплан: Вы имеете в виду, что остались какие-то таинственные свойства психики, например, владение гравитацией, передача мыслей на расстоянии?
Кирилл Копейкин: Мы этого просто не знаем. Про нашу психику мы знаем гораздо меньше, чем про тело и мозг. Есть такой замечательный американский физик Андрей Линде, он еще в книжке 1991 года говорил о том, что, возможно, описание Вселенной неполно без включения туда психической реальности. И понять проблему рождения и смерти Вселенной невозможно, не учитывая сознание, которое имеет, по всей вероятности, космическое измерение.
Если объединить все компьютеры Земли, все равно не получится создать человеческий мозг, не хватит ресурса
Сегодня физики, рассуждая о том, как устроен мир, приходят к выводу, что, похоже, картина мира, которая больше всего соответствует реальности, – это панпсихизм. Элементарные микрообъекты, из которых устроен мир, ведут себя так, как если бы они обладали психикой. Простейший пример: мы в квантовой механике пытаемся измерить состояние микрообъекта. Микрообъект ведет себя очень странно, это напоминает следующую картину: представьте себе, у вас дома поставили видеокамеру, и в данный момент вы не знаете, смотрит в нее кто-то или нет. Вы начинаете вести себя по-другому, когда понимаете. И точно так же электрон, протон или нейтрон начинает вести себя по-другому, как только мы создаем условия, в которых можем померить… А отсюда следует очень важный вывод даже на обыденном уровне: если я понимаю, что мир психичен, – это значит, что я своим состоянием души притягиваю к себе определенные ситуации.
Сергей Медведев: Вы допускаете существование внеземных цивилизаций? А как же избранный народ: Земля была избрана, явление Бога осуществилось на этой планете, в одном народе, а затем уже во всех?
Кирилл Копейкин: Насколько я понимаю, библейское откровение обращено не ко всей Вселенной, а только к землянам.
Сергей Медведев: Искусственный интеллект – это продолжение эволюции человека, часть эволюции человеческого мозга?
Александр Каплан: Хочу сразу заметить, что искусственного интеллекта не существует.
Сергей Медведев: Остановимся на компьютере.
Александр Каплан: Речь идет об информационно-аналитических возможностях электроники, электронно-вычислительных машин и так далее. Они запоминают, очень быстро обрабатывают информацию, могут подготавливать решения. Это нормальная ситуация, человек издревле обращается за какими-то рекомендациями к человеку, который знает больше него. Какая разница, к кому я обращусь – к Гуглу или к этому человеку? Разница будет только в том, кому я больше доверяю. Так что здесь нет какой-то необычности в использовании электронно-вычислительных средств для принятия решений. Другое дело, что, как объяснял еще Норберт Винер в 60-х годах прошлого века, ответственность человека сильно возрастает с изобретением и разработкой новых электронно-вычислительных средств, так как действительно слишком много решений передается этим средствам. Здесь уже от человека зависит, какие решения он передаст на реализацию вычислительным средствам. Может быть, здесь нужно поставить какие-то границы.
Какая разница, к кому я обращусь – к Гуглу или к этому человеку? Разница будет только в том, кому я больше доверяю. Так что здесь нет какой-то необычности в использовании электронно-вычислительных средств для принятия решений. Другое дело, что, как объяснял еще Норберт Винер в 60-х годах прошлого века, ответственность человека сильно возрастает с изобретением и разработкой новых электронно-вычислительных средств, так как действительно слишком много решений передается этим средствам. Здесь уже от человека зависит, какие решения он передаст на реализацию вычислительным средствам. Может быть, здесь нужно поставить какие-то границы.
Сергей Медведев: Как я понимаю, искусственный интеллект уже во многом сильнее человека? Он выигрывает в шахматы, в го.
Кирилл Копейкин: Это же не интеллект – это просто алгоритм. Мы поняли, как осуществляются некие простейшие логические операции, мы делегируем их компьютеру, но он не думает в обычном смысле слова. Никто не знает, что такое сознание, поэтому мы не можем дать техническое задание на изготовление искусственного сознания, искусственного интеллекта. Но мы научились некоторые достаточно простые логические операции осуществлять в металле, в компьютере, и там просто работают алгоритмы. Сейчас, когда появились нейросети, это более сложные алгоритмы. Посмотрите, например, как плохо работают компьютерные переводчики: они хорошо переводят только один пласт текста – технические задания, а вот художественные тексты абсолютно непереводимы при помощи компьютера.
Никто не знает, что такое сознание, поэтому мы не можем дать техническое задание на изготовление искусственного сознания, искусственного интеллекта. Но мы научились некоторые достаточно простые логические операции осуществлять в металле, в компьютере, и там просто работают алгоритмы. Сейчас, когда появились нейросети, это более сложные алгоритмы. Посмотрите, например, как плохо работают компьютерные переводчики: они хорошо переводят только один пласт текста – технические задания, а вот художественные тексты абсолютно непереводимы при помощи компьютера.
Сергей Медведев: Природу сознания нельзя свести к каким-то простым алгоритмическим вещам? Это же все просчитываемо – количество нейронов, количество связей между ними. Сознание – это просто некая сумма транзакций между отдельными клетками?
Александр КапланАлександр Каплан: Если вы используете слово “интеллект” для машин и для мозга человека, то мы сразу согласимся, что это какой-то другой интеллект. Естественный интеллект обладает одним уникальным свойством, которое никогда не воспроизвести в электронике – он развивается в ходе жизни по мере возникновения и реализации каких-то потребностей, не только материальных, но и духовных. В каждом человеке как бы нарождается отдельно внутренняя психическая или духовная среда, то, чего не было при рождении. Это сумма его ощущений, опыта, обращений к себе, к своей совести. Может быть, здесь где-то отголосок если не религиозного, то прагматического понимания бога как внутреннего вопроса к себе: правильно ли ты делаешь, добро это или зло.
Естественный интеллект обладает одним уникальным свойством, которое никогда не воспроизвести в электронике – он развивается в ходе жизни по мере возникновения и реализации каких-то потребностей, не только материальных, но и духовных. В каждом человеке как бы нарождается отдельно внутренняя психическая или духовная среда, то, чего не было при рождении. Это сумма его ощущений, опыта, обращений к себе, к своей совести. Может быть, здесь где-то отголосок если не религиозного, то прагматического понимания бога как внутреннего вопроса к себе: правильно ли ты делаешь, добро это или зло.
Вот эта вся интеракция с внешним миром – откуда она возьмется у искусственного интеллекта, как бы хорошо его ни программировали лучшие программисты? Там интеллект – это расчетная вещь, реализация тех или иных алгоритмов, которые задали программисты. Например, надо выиграть, обыграть человека в го – никакой проблемы нет, нужно придумать оптимальные алгоритмы перебора конечной задачи. Естественно, мощное вычислительное устройство, которое обладает огромной памятью и бешеной производительностью, перебором возьмет любого человека. Но если спросить у этой машины какое-нибудь творческое решение, попросить ее сделать какое-то открытие, она не знает, куда ей обратиться, и перебором это не возьмешь. А вот человек знает, куда обратиться – к этому внутреннему содержанию, которое многократно отразило закономерности и свойства этого мира. Без алгоритмического расчета достаточно получить подсказки от этого внутреннего содержимого, и вы сделаете открытие.
Но если спросить у этой машины какое-нибудь творческое решение, попросить ее сделать какое-то открытие, она не знает, куда ей обратиться, и перебором это не возьмешь. А вот человек знает, куда обратиться – к этому внутреннему содержанию, которое многократно отразило закономерности и свойства этого мира. Без алгоритмического расчета достаточно получить подсказки от этого внутреннего содержимого, и вы сделаете открытие.
Сергей Медведев: Есть некое несводимое, невербализуемое, недискурсивное внутреннее содержание. Откуда же оно взялось? От внешней среды, от наших реакций, от нашего накопленного генетического опыта, от первого прикосновения матери, от тумана над рекой, от первого поцелуя, от чтения романа Достоевского? Это же все абсолютно просчитываемые вещи. Теоретически их же тоже можно заложить в машину.
Александр Каплан: Как же вы заложите любовь одного человека к другому алгоритмически? Это чувственная информация, вы ее реализуете в голове в виде каких-то ощущений, впечатлений, внутренней памяти, отголосков мыслей, разговоров. Вот как сплетено наше внутреннее содержание. Духовность – это то, что наполняет нас, помимо слепого расчета.
Вот как сплетено наше внутреннее содержание. Духовность – это то, что наполняет нас, помимо слепого расчета.
Сергей Медведев: По-вашему, чем отличается человеческое сознание от искусственного интеллекта?
Кирилл Копейкин: Всем. В ХХ веке был такой замечательный физик Вольфганг Паули, один из создателей квантовой механики, лауреат Нобелевской премии. Он рассуждал примерно так же, как и вы: сознание – это просто рациональная вещь, воздействуют внешние факторы. В возрасте около 30 лет он пережил очень серьезный экзистенциальный кризис, связанный с личными событиями. Ему вдруг стали сниться чудовищные сны, кошмары – это как бы разрушало его картину мира: этого не должно быть… По совету своего отца, который был хорошо знаком с Карлом Густавом Юнгом, он обратился к Юнгу за помощью, и тот действительно ему помог. Картина мира Паули после этого кризиса и анализа, который он прошел у Юнга, совершенно рухнула: он понял, что наряду с сознанием есть колоссальный слой бессознательного, того, что Юнг называл коллективным бессознательным, с которым мы приходим в мир.
Задачи, о которых говорил Александр Яковлевич, в значительной мере приходят оттуда. Эти задачи уже поставлены перед нами в этой жизни, но мы их не осознаем. И это бессознательное очень сильно воздействует на нас. Есть такие императивы, которые повелевают нам что-то делать – это не может быть только рационализировано. Когда Паули осознал всю грандиозность этого слоя бессознательного, его колоссальное влияние на нашу психику и сознание, он понял, что на самом деле нужно просто радикально изменить картину миру. Он говорил, что если в физике XIX века понятие реальности казалось самоочевидным, то сейчас главная задача заключается в том, чтобы создать новое понятие реальности, в которую входила бы психика, в которой есть и сознательная, и бессознательная компонента. Ему это не удалось, он рано умер.
Сергей Медведев: Я понимаю, что подсознательное и бессознательное – это то, что отличает человека от машины. Но ведь Фрейд исследовал структуру подсознания, он смотрел, какие травмы и детские переживания формируют наше подсознательное.
Кирилл Копейкин: У Фрейда и Юнга совершенно разные позиции. Фрейд считал, что наше бессознательное – это то, что вытеснено из сознания, а Юнг говорил о существовании коллективного бессознательного, с которым мы уже приходим в этот мир (это что-то вроде генотипа). Я не могу влиять на свои гены, они в значительной степени обуславливают мою жизнь, и точно так же это коллективное бессознательное, из которого вырастает моя субъективная психика, в значительной степени обуславливает мои цели. Я вырос в обычной советской семье инженеров, это были совершенно не религиозные люди, они не были учеными, но у меня с детства была какая-то установка, что нужно познать истину, причем она обязательно должна иметь сакральное религиозное измерение.
Подсознательное и бессознательное – это то, что отличает человека от машины
Сергей Медведев: Какие мы будем применять технологии для взаимодействия машины с мозгом? Пока это только смартфон, запрос и так далее. Александр, вы работаете в лаборатории нейрофизиологии биологического факультета, у вас есть какие-то продвинутые нейроинтерфейсы. Насколько они уже перешли от экспериментальных к реальным возможностям?
Александр, вы работаете в лаборатории нейрофизиологии биологического факультета, у вас есть какие-то продвинутые нейроинтерфейсы. Насколько они уже перешли от экспериментальных к реальным возможностям?
Александр Каплан: Уровень разработки нейроинтерфейсов в мире и у нас в стране сейчас примерно одинаков. Но этот уровень заключается в том, что мы можем догадываться о каких-то очень примитивных, начальных намерениях человека. Например, я хочу сжать правую руку – мы можем об этом догадаться с вероятностью 0,85, регистрируя электрическую активность с кожной поверхности головы (это то, что называется электроэнцефалограммой). Если просверлить дырочки и вставить электроды вглубь мозга, получается более точно, можно получить эффективность 100%. Но мы же понимаем, что это невозможно делать для здорового человека – это все делается по медицинским показаниям по ходу каких-то медицинских операций. Кое-какой контакт с мозгом действительно можно установить. Например, человек не может говорить после инсульта, но мы можем догадаться, какая буква интересует его в данный момент, если демонстрировать полный набор букв и печатать эту букву на экране. Но это же примитивный контакт, даже и не контакт – это подсматривание того, что происходит на кожной поверхности головы в электрических потенциалах, когда человек задумывает букву.
Но это же примитивный контакт, даже и не контакт – это подсматривание того, что происходит на кожной поверхности головы в электрических потенциалах, когда человек задумывает букву.
Информационный контакт с мозгом, как мне кажется, практически неосуществим: много нервных клеток, мы не знаем, где эти входы и выходы. Чтобы подключиться, нужен не один электрод, а тысячи, может быть, миллион контактов. Поэтому я не вижу никаких теоретических шансов информационным образом подключиться к мозгу.
Сергей Медведев: В этом есть какой-то прогресс?
Александр Каплан: Мы занимаемся этой проблемой в России почти 15 лет. Мы можем считать эмоциональный фон, но положительный он или отрицательный и чем вызван этот повышенный эмоциональный фон… Это все равно, что прочитать мысли. Возможно некоторое упрощенное оперирование ячейками памяти машины. Раз уж мы сейчас оперируем буквами на экране, иконками можем входить в интернет, сделали это устройство в интернете для людей, которые не могут говорить, значит, мы уже можем оперировать ячейками памяти. В ячейках памяти расположено и то, что нужно запомнить, и процедуры, которые нужно проделать над этими ячейками. Оперируя этими ячейками, можно постепенно более-менее освоить прямой контакт с машиной, но это будет даже более примитивно, чем работа на клавиатуре.
В ячейках памяти расположено и то, что нужно запомнить, и процедуры, которые нужно проделать над этими ячейками. Оперируя этими ячейками, можно постепенно более-менее освоить прямой контакт с машиной, но это будет даже более примитивно, чем работа на клавиатуре.
Сергей Медведев: Мне кажется, большая часть вопроса – контакт человека с облаком, с цифровой оболочкой. Облако – это часть сознания, о котором мы говорили? Может быть, это ноосфера Вернадского, цифровая оболочка Земли?
Кирилл Копейкин: Не зная, что такое сознание, можем ли мы сказать, что это часть сознания? Несомненно, это часть культуры. Культура принимает какие-то новые необычные формы, которых раньше не было, поэтому цифровая среда действительно становится для нас необходимой. Как для слепого палочка, которой он ощупывает дорогу, становится его органом, он чувствует ее как продолжение себя, так и здесь мы очень тесно связаны с этой средой. Когда мы говорим “нейроинтерфейс”, здесь на самом деле ложь в самом названии, потому что мы слушаем очень слабый интегральный сигнал. Это еще не интерфейс в строгом смысле слова.
Это еще не интерфейс в строгом смысле слова.
Александр Каплан: Вопрос о том, входит ли в сознание цифровое облако, – это очень глубокий вопрос. Конечно, само цифровое облако – часть культуры, но мы не можем в своем намерении оперировать элементами этого облака. Значит, оно фактически неоперабельно нами, мы его учитываем только по запросу. А вот так посидеть, поразмышлять, как мы делаем со всем содержимым мозга, – мы никак не можем подключить туда это облако. В пространстве мозга мы не используем эту информацию ежесекундно. В этом большая проблема отторжения знаний во внешний мир. Школьники теперь не хотят знать что-то, они хотят обратиться к облаку, чтобы в какой-то момент узнать это, когда будет нужно. А это означает, что культурное пространство, которым пользуется память человека, сужается внутри себя.
Кирилл Копейкин: Один из смыслов библейского утверждения о том, что человек создан по образу и подобию бога: мы в своем внутреннем мире являемся для него богом, мы делаем в нем все, что угодно. Я являюсь абсолютным властелином своего внутреннего мира. Особенно явно это видно в математике: я создаю объекты, они там лежат. Поэтому у многих математиков возникает ощущение, что математика существует в какой-то отдельной идеальной реальности. С этим внешним облаком такого нет, поэтому оно не является частью нашего сознания.
Я являюсь абсолютным властелином своего внутреннего мира. Особенно явно это видно в математике: я создаю объекты, они там лежат. Поэтому у многих математиков возникает ощущение, что математика существует в какой-то отдельной идеальной реальности. С этим внешним облаком такого нет, поэтому оно не является частью нашего сознания.
Сергей Медведев: Для меня совершенно очевидно, что возникает новая антропология, новые способы взаимодействия человека и машины, соответственно, возникают и вопросы, которые нужно решать при помощи философии, теологии и далеко не только рациональными методами.
Влияние никотина на центральную нервную систему
От никотина страдает интеллект человека, многим без сигареты становятся не под силу умственные задачи, снижается память, ослабевает логическое мышление. Действуя на ЦНС как наркотик, никотин делает человека полностью зависимым от вредной привычки.
Нервная система человека — сложная структура, обеспечивающая правильное функционирование всего организма. Основной её функцией является получение и обработка информации, поступающей из внешнего мира и изнутри организма, передача информации о состоянии организма в мозг, координация произвольных движений тела, регулировка его непроизвольных функций — дыхания, пищеварения, сердцебиения, поддержания температуры тела и прочих. Учитывая все это, можно себе представить, как сильно влияет никотин и курение на нервную систему человека.
Основной её функцией является получение и обработка информации, поступающей из внешнего мира и изнутри организма, передача информации о состоянии организма в мозг, координация произвольных движений тела, регулировка его непроизвольных функций — дыхания, пищеварения, сердцебиения, поддержания температуры тела и прочих. Учитывая все это, можно себе представить, как сильно влияет никотин и курение на нервную систему человека.
Анатомически нервная система человека разделяется на центральную и периферическую нервные системы — ЦНС и ПНС. Центральная нервная система — это тандем головного и спинного мозга. Нервные центры, содержащиеся в больших полушариях головного мозга, составляют интеллектуальную основу человека, обеспечивают его личность, сознание, понимание. ПНС обеспечивает обоюдную связь ЦНС со всеми органами и системами организма.
Непроизвольные функции организма контролируются вегетативной (автономной) нервной системой, её структуры находятся и в ЦНС, и в ПНС.
Никотин и нервная система
Никотин — нейротоксический яд, нарушающий гармоничное протекание электрохимических процессов нервной системы и вызывающий отмирание нейронов. При возникновении табачной зависимости происходит привыкание организма именно к никотину.
Изначально, никотин оказывает на нервную систему возбуждающее действие, однако скоро этот эффект сменяется угнетением за счёт сужения сосудов. В процессе курения никотин становится для мозга своеобразным стимулятором, ускоряя проведение нервных импульсов, но затем мозговые процессы сильно тормозятся, срабатывает потребность мозга в отдыхе. По мере привыкания мозг сам начинает требовать «дозу», не желая работать самостоятельно, без допинга. При невозможности покурить у человека наблюдается беспокойство, сильная раздражительность, отсутствие внимательности и сосредоточенности.
Курящие люди чаще подвержены переутомлению нервной системы и неврастении. Формируется порочный круг: курильщик, который много работает, начинает курить больше и чаще, чтобы подстегнуть организм, и получает ещё большее переутомление. Такие люди могут наблюдать у себя расстройство памяти, нарушение сна, головную боль, частую смену настроения, снижение работоспособности. Неврит, радикулит, полиневрит — эти заболевания ПНС также нередки у «злостных» курильщиков.
Формируется порочный круг: курильщик, который много работает, начинает курить больше и чаще, чтобы подстегнуть организм, и получает ещё большее переутомление. Такие люди могут наблюдать у себя расстройство памяти, нарушение сна, головную боль, частую смену настроения, снижение работоспособности. Неврит, радикулит, полиневрит — эти заболевания ПНС также нередки у «злостных» курильщиков.
Курение пагубно сказывается и на вегетативной нервной системе, ухудшая работу внутренних органов — расстраивается деятельность сердечно-сосудистой системы, нарушается функционирование органов пищеварения.
Органы чувств также получают свою «порцию» никотинового влияния. При длительном чрезмерном курении возможны такие нарушения, как снижение остроты зрения, нарушение слуха, вкуса, обоняния.
Однако, по последним исследованиям проводимых в США, доказано, что никотин стимулирует когнитивные способности. Также не стоит путать вред курения, и влияние, оказываемое чистым никотином.
От воздействия никотина страдает интеллектуальная деятельность человека, многим без сигареты становятся не под силу умственные задачи, снижается память, ослабевает логическое мышление. Действуя на ЦНС как наркотик, никотин делает человека слабовольным, полностью зависимым от вредной привычки.
Как защитить нервную систему от воздействия никотина
Необходимо много двигаться, мышечная активность оказывает благоприятное воздействие как на работу головного мозга, так и на проводимость в нервных волокнах, кроме того, улучшенное кровообращение скажется положительно и на нервной системе.
Интеллектуальная деятельность задействует все компоненты нервной системы, поэтому разгадывайте кроссворды, больше читайте, составляйте рукописные тексты.
Правильно питайтесь, чтобы организм получал все необходимые минералы и микроэлементы. И, конечно же, откажитесь от курения. Помните, что правильное функционирование организма, и, соответственно, качественная и полноценная жизнь невозможны при нарушении работы нервной системы.
Маленький помощник мозга
Крошечный белок отвечает за наш главный орган – мозг. Что с нами происходит, если протеин отсутствует?
Мозг – потрясающий орган. Эта жирная серая капля не только является центром обучения, памяти и контроля над телом, но и может частично лечить себя.
Мы ежедневно подвергаем свое тело воздействию вредной окружающей среды, и наш генетический материал, ДНК, принимает на себя свою долю износа.
Солнечные лучи и многие вещества, которые мы едим, пьем или дышим, могут повредить нашу ДНК в ущерб нашему телу и мозгу.
Повреждение может привести к раку или некрозу – гибели клеток.
Доктор и постдок Ингве Сейерстед (частное фото)
Мы не можем перестать есть или дышать, поэтому хорошо, что мозг знает, как позаботиться о себе.
Норвежская группа медицинских исследователей недавно обнаружила, что небольшой белок по имени Neil3 является личным доктором мозга.
Как железо ржавчина
Когда ДНК стволовых клеток в головном мозге повреждена, Neil3 приступает к ремонту.
«Neil3, по-видимому, является белком, который несет основную ответственность за восстановление особых окислительных повреждений ДНК. И это работает не только со стволовыми клетками, – говорит Ингве Сейерстед.
Сейерстед – врач и постдок Института клинической медицины Университета Осло.
Окислительное повреждение – это повреждение клеток кислородом, что-то вроде ржавчины железа.
И стволовые клетки необходимо поддерживать в здоровом состоянии.
«Мы полагаемся на наши стволовые клетки всю нашу жизнь, чтобы поддерживать способность учиться и сохранять память», – говорит Зейерстед.
Исследовательская группа хотела выяснить, что произойдет, если удалить Neil3.
Это потребовало использования подопытных животных, в данном случае генетически модифицированных мышей, рожденных без этого репаративного белка.
Бесстрашные мыши
Исследователи ожидали, что мыши, у которых отсутствует репаративный белок, будут больше повреждены ДНК и, следовательно, более склонны к таким болезням, как рак.
«Но мы этого не обнаружили», – говорит врач.
Произошло нечто совершенно иное.
«Генетически модифицированные мыши обладали более слабой памятью и в целом вели себя довольно некритично», – говорит Зейерстед.
Мыши не боялись того, чем обычно должны быть, например, блуждания по открытой местности или исследования новых мест.
«Было неожиданно, что отсутствие репарации ДНК привело к изменению поведения», – говорит исследователь.
Сейерстед и его коллеги обнаружили, что стволовые клетки, в которых отсутствовал Neil3, перестали производить новые нервные клетки.
«Вкратце, мы думаем, что это причина измененного поведения мышей. Без обновления нервных клеток человек страдает такими нарушениями, как способность к обучению », – говорит Зейерстед.
Сейерстед и его коллеги будут использовать свое открытие в дальнейших исследованиях, включая исследования болезни Альцгеймера.
Ремонт, сдерживающий болезнь Альцгеймера
Около 15 процентов людей старше 80 лет страдают от болезни Альцгеймера, и очень мало что можно сделать для ее лечения.
Мы знаем, что болезнь Альцгеймера снижает способность рассуждать, изменяет нашу личность и истощает память, но не совсем понятно, почему это происходит.
«Было установлено, что люди с болезнью Альцгеймера и Паркинсона имеют повышенные уровни окислительного повреждения ДНК».
«Таким образом, предполагается, что восстановление ДНК играет важную роль в этих заболеваниях, и это то, чем мы будем заниматься», – говорит Зейерстед.
Он добавляет, что функция Neil3 и стволовых клеток также жизненно важна после травмы головного мозга, и они будут исследовать роль небольшого количества белка после инсульта.
—————————
Прочтите норвежскую версию этой статьи на сайте forskning.no
Переводил: Гленн Остлинг
Связанное содержание
Можем ли мы винить мозг?
Француз в течение многих лет вел совершенно нормальную жизнь, но позже сканирование мозга показало, что его череп был почти полым. Нейробиологи используют это как крайний пример того, насколько ошибочной может быть привязка изображений мозга к поведению.
Нейробиологи используют это как крайний пример того, насколько ошибочной может быть привязка изображений мозга к поведению.
Депрессия может повредить мозг
Люди, страдающие депрессией, рискуют, что их мозг сузится и останется меньше после того, как болезнь пройдет. Это открытие дает новые знания о мозге и новое понимание того, как работают антидепрессанты.
Улучшенная визуализация повреждений головного мозга повышает эффективность лечения
Более качественные изображения поврежденного мозга улучшают лечение и способствуют распространению знаний – в том числе и о здоровом мозге.
«Вспомогательные» клетки мозга становятся токсичными при травмах и заболеваниях
Звездообразные клетки, называемые астроцитами, часто характеризующиеся как «вспомогательные» клетки, могут способствовать повреждению, вызванному травмой или болезнью головного мозга, превращаясь в токсичные и разрушающие нейроны, согласно результатам исследования опубликовано в среду в журнале Nature .
Астроциты – это один из трех типов глиальных или ненейрональных клеток, наиболее распространенных в головном мозге.Они широко рассматриваются как опорные клетки, которые питают нейроны и заполняют пространство между ними, но становится все более очевидным, что они играют и другие важные роли в нормальном, здоровом функционировании мозга. Они могут синтезировать нейротрансмиттеры для передачи сигналов между глиальными клетками и формировать сети, регулирующие активность нейронов.
Астроциты также могут по-разному реагировать на травмы головного мозга и болезни. Например, после повреждения нервов они образуют рубцовую ткань, которая может способствовать регенерации поврежденных волокон.Но они также вызывают широкий спектр неврологических и психических заболеваний.
Новые данные показывают, что при определенных условиях астроциты могут переходить в высокотоксичное состояние и убивать другие типы клеток мозга. Но, дав свежий взгляд на процесс нейродегенерации, они могут в конечном итоге привести к новым методам лечения широкого спектра заболеваний.
Результаты нового исследования основаны на более ранней работе лаборатории нейробиолога Бена Барреса в Стэнфордском университете, которая изолировала реактивные астроциты от мышей с экспериментально индуцированным инсультом и воспалением мозга и использовала технологию чипов ДНК для создания генетических профилей клеток.Эти исследования показали, что инсульт и воспаление вызвали преобразование астроцитов в два реактивных типа клеток: клетки A1, которые увеличивают производство молекул иммунной системы, называемых белками комплемента, и клетки A2, которые экспрессируют высокие уровни белков факторов роста, способствующих выживанию. клеток мозга и образование связей между ними.
Белки комплемента прикрепляются к синапсам мозга, «маркируя» их для разрушения микроглией – резидентными иммунными клетками мозга – что привело исследователей к гипотезе о том, что астроциты A1 могут быть вредными.
В исследовании Nature , проведенном нейробиологом из Стэнфорда Шейном Лидделу, научным сотрудником лаборатории Барреса, исследователи вызвали воспаление мозга у нормальных, здоровых мышей, а также у животных с генной инженерией, лишенных микроглиальных клеток. Затем они исследовали астроциты в обеих группах животных. У нормальных мышей воспаление вызвало образование астроцитов A1. У животных, созданных с помощью генной инженерии, такой реакции не наблюдалось, что позволяет предположить, что клетки микроглии индуцируют развитие этих астроцитов.
Затем они исследовали астроциты в обеих группах животных. У нормальных мышей воспаление вызвало образование астроцитов A1. У животных, созданных с помощью генной инженерии, такой реакции не наблюдалось, что позволяет предположить, что клетки микроглии индуцируют развитие этих астроцитов.
Чтобы дополнительно проверить эту идею, они вырастили микроглию в чашках Петри, обработали их химическим веществом, активирующим воспалительную реакцию, а затем перенесли питательную среду в другую чашку Петри, содержащую астроциты. Это индуцировало образование астроцитов A1, тогда как ростовая среда из неактивированной микроглии – нет.
Дальнейшие эксперименты показали, что активированная микроглия секретирует коктейль из трех химических веществ иммунной системы, называемых цитокинами – интерлейкин-1 альфа (Il-1α), фактор некроза опухоли (TNF) и компонент комплемента 1, подкомпонент q (C1q).Добавление всех трех молекул к культурам астроцитов генерировало астроциты A1, но антитела, нейтрализующие любой из них, блокировали этот эффект. Подтверждая это, исследователи также обнаружили, что три разных штамма мышей, созданных с помощью генной инженерии, у каждой из которых отсутствует один из генов цитокинов, обладают значительно сниженной способностью генерировать астроциты A1.
Подтверждая это, исследователи также обнаружили, что три разных штамма мышей, созданных с помощью генной инженерии, у каждой из которых отсутствует один из генов цитокинов, обладают значительно сниженной способностью генерировать астроциты A1.
В здоровом мозге астроциты образуют сети, которые жизненно важны для образования связей – синапсов – между нейронами, а также регулируют сигналы, которые передаются через эти синапсы.Однако в ситуациях травм и болезней они могут способствовать восстановлению мозга, поглощая и удаляя мертвые клетки и другой клеточный мусор посредством процесса, называемого фагоцитозом.
Чтобы определить, сохраняют ли астроциты A1 строительную или репаративную функции, Лидделу и его коллеги вырастили ганглиозные клетки сетчатки, которые образуют зрительный нерв, вместе с астроцитами A1 или неактивированными астроцитами. Чашки Петри с добавленными к ним астроцитами A1 содержали примерно на 50% меньше синаптических связей по сравнению с чашками с неактивированными. А остальные синапсы были значительно слабее, давая меньшие и менее частые сигналы, чем в чашках, содержащих неактивированные астроциты.
А остальные синапсы были значительно слабее, давая меньшие и менее частые сигналы, чем в чашках, содержащих неактивированные астроциты.
Исследователи также обнаружили, что высокие концентрации среды для роста астроцитов A1 убивают различные типы нейронов, а также другой тип глиальных клеток, олигодендроциты, которые синтезируют изолирующую оболочку или миелин на длинных проволочных волокнах нейронов. Астроциты A1 также обладают заметно сниженной способностью поглощать клеточный мусор по сравнению с неактивированными.
При введении мышам с раздробленными зрительными нервами вместо того, чтобы защищать их, астроциты A1 убивали ганглиозные клетки сетчатки с поврежденными волокнами. Однако этого удалось предотвратить путем инъекции антицитокиновых антител, и этого не произошло у мутантных мышей, лишенных двух или трех генов цитокинов.
Получается, что астроциты и микроглия – соучастники преступления. Микроглия представляет собой систему наблюдения, которая отслеживает состояние тканей головного мозга, обеспечивая соответствующую реакцию на травму. Новые результаты показывают, что они используют цитокины для передачи сигналов астроцитам и преобразования их из состояния, которое способствует выживанию нейронов, в состояние, которое является высокотоксичным. «Это очень интересные и захватывающие наблюдения», – говорит молекулярный физиолог Франк Кирхофф из Саарского университета в Германии, который не принимал участия в новом исследовании. «Астроциты обычно считаются хорошими парнями, но здесь у нас есть убедительные доказательства четко определенного механизма их вклада в различные типы патологий.”
Новые результаты показывают, что они используют цитокины для передачи сигналов астроцитам и преобразования их из состояния, которое способствует выживанию нейронов, в состояние, которое является высокотоксичным. «Это очень интересные и захватывающие наблюдения», – говорит молекулярный физиолог Франк Кирхофф из Саарского университета в Германии, который не принимал участия в новом исследовании. «Астроциты обычно считаются хорошими парнями, но здесь у нас есть убедительные доказательства четко определенного механизма их вклада в различные типы патологий.”
Чтобы выяснить, может ли этот процесс способствовать нейродегенерации, Лидделу и его коллеги исследовали посмертную ткань мозга пациентов с болезнями Альцгеймера, Хантингтона и Паркинсона, а также рассеянным склерозом и боковым амиотрофическим склерозом. Все образцы ткани, которые они исследовали, содержали большое количество астроцитов A1, что позволяет предположить, что клетки могут управлять нейродегенерацией. Это открытие потенциально может указать на новый путь лечения этих заболеваний. «Мы не можем просто нацеливаться на все астроциты, потому что такой подход тупой силы также удалит нереактивные», – говорит Лидделоу.«Результаты предполагают регулируемую и специфическую реакцию астроцитов, которая, вероятно, будет зависеть от времени и контекста, поэтому мы должны быть осторожны при разработке лекарств, которые борются только с определенным типом реактивности».
«Мы не можем просто нацеливаться на все астроциты, потому что такой подход тупой силы также удалит нереактивные», – говорит Лидделоу.«Результаты предполагают регулируемую и специфическую реакцию астроцитов, которая, вероятно, будет зависеть от времени и контекста, поэтому мы должны быть осторожны при разработке лекарств, которые борются только с определенным типом реактивности».
Лидделу и его коллеги пытаются определить токсический сигнал, который выделяют астроциты A1. «Это предоставит массу информации о том, почему нейроны умирают при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, и почему демиелинизация аксонов происходит при таких заболеваниях, как рассеянный склероз.«Поиск способов регулирования этого сигнала может намекнуть на идеи лечения этих заболеваний.
Как «клетки-помощники» мозга могут способствовать шизофрении
Новое исследование на мышах предполагает, что проблемы с «клетками-помощниками» мозга могут способствовать развитию шизофрении.
Исследование было сосредоточено на глиальных клетках, которые обеспечивают поддержку нейронов, передающих “сигналы” в головном мозге. Например, глиальные клетки помогают организовать связи между нейронами и производить миелин, который действует как изоляция нервных волокон мозга.
Чтобы выяснить, способствуют ли глиальные клетки развитию шизофрении, исследователи сначала взяли образцы клеток кожи у людей, которые заболели шизофренией в детстве, до 13 лет.
Затем ученые использовали метод перепрограммирования этих клеток кожи, чтобы превратить их в клетки. так называемые индуцированные плюрипотентные стволовые клетки (ИПСК), которые могут стать клетками любого типа в организме. Затем исследователи манипулировали iPSC, чтобы они превратились в глиальные клетки-предшественники или клетки в организме, которые дают начало глиальным клеткам.[10 фактов о мозге, которых вы не знали]
Исследователи трансплантировали глиальные клетки-предшественники в мозг молодых мышей. Это привело к появлению «химерных» мышей, то есть у них были обычные мышиные нейроны, но глиальные клетки-предшественники человека.
Исследование показало, что глиальные клетки больных шизофренией были крайне дисфункциональными; например, клетки не дали достаточного количества клеток, продуцирующих миелин, поэтому, по словам исследователей, передача между нейронами была нарушена.Кроме того, тип глиальных клеток, называемых астроцитами, не созрел должным образом и не мог полностью поддерживать нейроны.
Мыши с этими дефектными клетками также проявляли антисоциальное и тревожное поведение, подобное поведению людей с шизофренией, говорят исследователи.
«Результаты этого исследования доказывают, что дисфункция глиальных клеток может быть основой детской шизофрении», – сказал доктор Стив Голдман, содиректор Центра трансляционной нейромедицины при Медицинском центре Университета Рочестера и ведущий автор книги. исследования, говорится в заявлении.
Однако, поскольку исследование проводилось на мышах, необходимы дополнительные исследования, чтобы определить, наблюдаются ли те же эффекты и у людей.
Но авторы сказали, что химерные мыши, которые были созданы в этом исследовании, могут быть использованы в будущем для тестирования новых методов лечения шизофрении и, таким образом, ускорения процесса поиска новых методов лечения этого заболевания. Кроме того, исследование выявило химический дисбаланс, который нарушает коммуникацию между клетками мозга, и этот дисбаланс может стать целью для новых методов лечения, говорят авторы.
Исследование было опубликовано 20 июля в журнале Cell Stem Cell.
Оригинальная статья о Live Science .
Школа Помощника | Высшее хорошее
К тому времени, когда я (Джеймс) достиг года на первом курсе колледжа, я был глубоко разочарован миром, который видел вокруг себя. Я вырос, веря в Супермена, в «правду, справедливость и американский образ жизни», но это были 1960-е.Убийство президента Кеннеди тремя годами ранее положило конец Камелоту, как для меня, так и для многих в моем поколении. Гибель ни в чем не повинных людей во Вьетнаме разрушила мою веру в благосклонность внешней политики США. А здесь, в Стране Свободы, тысячи людей боролись за основные гражданские права.
Специализация в области психологии, которая, как я думал, будет исследованием того, что движет людьми, превратилась в прослушивание сухих академических лекций о поведении крыс в лабиринтах.Я задавался вопросом, какое отношение к чему-либо в моей жизни имеют стандартные отклонения обучения в статистике. В философии Камю и Сартр обрели большой смысл и быстро привели меня к моему собственному экзистенциальному кризису. В конце концов я решил, что жизнь вообще не имеет смысла и, должно быть, была плохой шуткой какого-то Высшего Разума с причудливым чувством юмора.
© nickstangerЯ становился все более и более подавленным. В течение нескольких месяцев я направлял каждый разговор на свою мрачную перспективу.Друзья начали держаться на расстоянии, не желая быть сбитыми с толку своим задумчивым философским товарищем. Контркультура становилась все более привлекательной и давала некоторую надежду – мир, любовь и Битлз, – но внутри я все еще не мог найти ничего, что делало бы жизнь достойной того, чтобы жить.
Рекламное объявление ИксMeet the Greater Good Toolkit
От GGSC на вашу книжную полку: 30 научно обоснованных инструментов для благополучия.
Однажды, когда я обедал в кафетерии Куинс-колледжа, произошло нечто, что направило меня в новом направлении.Когда я сидел там один, под темным облаком, я начал оглядываться на толпу людей в комнате, некоторые искренне разговаривали друг с другом, некоторые бродили вокруг и выглядели немного потерянными. Вместо того чтобы впадать в свою обычную привычку сравнивать себя с ними или думать о том, насколько я изолирован от всех, я стал просто смотреть на них, пока они занимались своими делами. Внезапно все они показались мне в основном порядочными людьми, просто изо всех сил старающимися найти свой путь в этом мире. Это было похоже на превращение калейдоскопа в совершенно другую конфигурацию, и с этой точки зрения
Я понял, что все, чего они хотят, – это быть счастливыми – и мне казалось, что все они имеют на это право.
Не знаю почему, но в этот момент меня осенило философское озарение. Единственное, что могло бы придать жизни смысл любому, – это принести счастье другим. Это было бы благородным делом в неблагородном мире. Я почувствовал мгновенный подъем чего-то внутри, когда этот маленький луч света пробился сквозь мое вечное облако. Я вышла из кафетерия с подпрыгиванием в шаге, которого не было в течение долгого времени.
Эти мысли преследовали меня в течение следующих нескольких недель, и их правильность продолжала расти.Я думаю, что где-то внутри я знал, что если бы я мог помогать другим обрести счастье, я бы сам был счастливее – это было бы большим скачком для того циника, которым я стал.
С того дня в кафетерии я снова и снова видел, как это понимание подтверждается – как в научных исследованиях, так и на собственном опыте преподавания «Пробуждающей радости», живого и онлайн-курса, который я разработал семь лет назад. Конечно, хотя некоторые люди действительно находят счастье и удовлетворение для себя, нам не нужно очень сильно смотреть, чтобы увидеть страдания в мире вокруг нас.Но вместо того, чтобы защищаться от этой всепроникающей реальности, я понял, что ответ на нее состраданием и заботой ведет к еще более глубокому уровню благополучия и радостной, полноценной жизни.
Эгоистичный альтруизм
Когда нами движет истинный дух щедрости, мы приносим пользу не меньше тех, кто получает. Священник-иезуит Энтони де Мелло говорит об этом так: «Благотворительность – это на самом деле личный интерес, маскирующийся под форму альтруизма. … Я доставляю себе удовольствие доставлять удовольствие другим.В том же ключе Далай-лама игриво называет работу на благо других «эгоистичным альтруизмом».
Но не верьте их словам: исследования в области нейробиологии и психологии предоставили научные доказательства того, что помощь другим приносит вам счастье. Считайте:
Согласно критериям «Сравнительного исследования социального капитала сообщества», проводимого исследователями из Гарвардского университета, те, кто жертвовал своим временем или деньгами, «на 42 процента больше были счастливы», чем те, кто не жертвовал.
Психологи определили типичное состояние эйфории у тех, кто занимается благотворительностью. Они называют это «кайф помощника», и он основан на теории, согласно которой в мозгу вырабатываются эндорфины, которые обеспечивают легкую версию «кайфа» морфина.
Исследования Национального института здоровья показали, что та же область мозга, которая активируется в ответ на еду или секс (а именно, удовольствие), загорается, когда участники исследования думают о том, чтобы отдать деньги на благотворительность.
Исследование, проведенное в Университете Эмори, показало, что помощь другим влияет на ту же часть мозга, что и получение вознаграждения или получение удовольствия.
Хотя преимущества, которые мы получаем от сострадания, явно уходят корнями в нашу биологию, есть также способы, которыми мы можем систематически углублять наше сострадание с помощью формальных практик. Как учитель медитации, я не удивился, узнав, что современные исследования нейробиологии показывают, что сфокусированная медитация является одним из самых прямых способов активировать и укрепить те области мозга, которые усиливают эмпатию.
В своей лаборатории в Университете Висконсина Ричард Дэвидсон провел обширное исследование влияния медитации сострадания на мозг студентов-добровольцев, которые выполняли практику в течение одной недели, а также буддийских монахов, которые выполняли такую практику тысячи часов. медитация. В этом особом виде практики медитирующий полностью сосредотачивается на чувстве любящей доброты и сострадания ко всем существам. В своей книге «Тренируйте свой разум, измените свой мозг» Шэрон Бегли сообщает о результатах функционального МРТ-сканирования мозга, которое Дэвидсон провел у участников одного из своих исследований:
Во время генерации чистого сострадания мозг всех субъектов, как опытных медитирующих, так и новичков, проявлял активность в областях, ответственных за отслеживание эмоций, планирование движений и положительные эмоции, такие как счастье.Области, отслеживающие, что такое «я», а что «другое», стали тише, как если бы во время медитации сострадания испытуемые. . . открыли свои умы и сердца другим.
Я видел исследования Дэвидсона, подтвержденные опытом моих студентов. Одна из этих учениц, Стефани, рассказала мне, как медитация изменила ее точку зрения. «Вместо того, чтобы так увлекаться тем, что насчет меня? вы делаете еще немного А что насчет вас? и это меняет все », – сказала она. Но она также обнаружила, что этот сдвиг не заставил ее пренебрегать собственными потребностями или впадать в чужую боль.Вместо этого она обнаружила, что
Когда вы настраиваетесь на чужие страдания и посылаете им сочувственные мысли, вместо того, чтобы истощать вас, это на самом деле наполняет вас большей энергией. Вы, кажется, устраняете заблуждение своего маленького ума и заменяете его чем-то гораздо более обширным и ярким. Под всей болтовней в вашем уме есть базовая доброта, к которой вы прикасаетесь, более глубокая и глубокая. Когда вы отпускаете страх, вы наполняетесь добротой и сладостью своего заботливого сердца.
Сострадание
Но практика сострадания не должна ограничиваться формальной медитацией. В течение дня, когда вы видите, что кому-то тяжело, вы можете подключиться к этому месту заботы внутри себя и посылать мысли сочувствия. Или вы можете пойти дальше, когда меньше всего этого ожидаете.
Рассмотрим историю весны. К тринадцати годам Спринг уже была на пути к неприятностям. Из-за того, что ее отец был вне поля зрения, дома было тяжело, и в школе было не намного лучше.Однажды ее поймали на краже. Ей повезло, что ей приказали только выполнять общественные работы. Ее мать отправила ее волонтером в местную церковь, которая хорошо известна своими щедрыми и успешными программами социального обслуживания. Там Весна оказалась в новом мире во многих отношениях. Она подавала еду бездомным, бок о бок с бывшими наркоманами и проститутками, которые теперь были чистыми и трезвыми. К своему удивлению, она говорит: «Я чувствовала всю эту любовь, и это было прекрасно».
Самый первый обед, который она подала обездоленным и бездомным, стал для нее настоящим переживанием.«Я подошла к холодильнику и увидела пачки и пачки хот-догов, стопки и стопки хлеба, которые выглядели очень старыми, и эти гигантские банки свинины и фасоли», – говорит она. «Я помню, как подумал:« Это обед? »
Был холодный день, и Весна начала интересоваться, появится ли кто-нибудь. Фактически, когда пришло время служить, она выглянула в дверь и увидела сотни людей в очереди, которая казалась бесконечной. Когда они проходили через очередь, «Я заметил, что все выглядят такими грустными», – говорит Спринг.«Они все опустили головы». Сначала повар велел ей дать каждому по два хот-дога, два куска хлеба и две ложки фасоли. Через некоторое время, когда люди продолжали прибывать, а очередь продолжалась, насколько было видно, повар объявил: «Один хот-дог, один кусок хлеба, одна мерная ложка фасоли».
Я начал испытывать чувство отчаяния, когда люди продолжали проходить, держа своих детей, в рваной одежде, с растрепанными волосами и в надежде хоть немного поесть. Вскоре снова вышел повар и сказал: «Половина хот-дога, половина хлеба.«А потом у нас закончилась еда, и в очереди было еще больше людей.
Весна долго наблюдала, как люди расходятся, еще голодные. Позже, после того, как она помогла убраться, она вышла на улицу и села на тротуар перед церковью.
Я начал рыдать, думая, что это неправильно. Больше всего меня поразило то, насколько я заботился. Я заботился обо всех этих людях, которых даже не знал. Я заботился о детях. Меня волновало, что у них не было еды, что было холодно, и куда они пойдут? Я просто рыдала и рыдала.Я никогда раньше не чувствовал себя так.
Несмотря на то, что она привыкла видеть бездомных в своем районе, общение лицом к лицу с таким количеством нуждающихся оказало на нее сильное влияние. Весна говорит, что после этого она изменилась. «Все это затронуло что-то глубоко внутри меня».
Весна прошла через глубокую встречу со страданием, которая является своего рода посвящением на путь сострадания. Нелегко держать сердце открытым перед лицом страданий. Нам часто хочется убежать от такой боли.Я думаю, что даже этот импульс доказывает, что нам не все равно. Мы чувствуем страдания других, и это часто бывает болезненно, потому что мы не знаем, что делать. Иногда то, с чем мы сталкиваемся, может быть настолько подавляющим, что оставаться рядом с ним может показаться невозможным. Но когда вы больше не можете закрывать глаза на боль и осознаете, насколько глубоко вы заботитесь, это пробуждает сострадательное сердце.
Тич Нхат Хан, буддийский учитель и активист, подчеркивает, что сострадание не останавливается на том, чтобы позволить нашим сердцам почувствовать страдания других.«Сострадание – это глагол», – подчеркивает он. Сострадание и действие идут рука об руку.
Действительно, на тех же снимках МРТ монахов, медитирующих на сострадание, исследователь нейробиологии Ричард Дэвидсон обнаружил, что участки мозга, отвечающие за планирование действий, также загораются. В книге «Тренируй свой ум, измени свой мозг» Шэрон Бегли цитирует Дэвидсона, сообщающего о своих результатах Далай-ламе:
Это была новая и неожиданная находка. . . Нет физической активности; они [медитирующие монахи] сидят неподвижно.Одно из толкований этого состоит в том, что это может отражать порождение предрасположенности действовать перед лицом страдания. Это придает реальный смысл фразе «движимые состраданием».
Мы не только запрограммированы на сострадание, мы, кажется, запрограммированы на сострадание. Когда мы видим страдание и чувствуем сострадание, естественно желание что-то сделать в ответ.
Спринг, которой сейчас за двадцать, считается пионером в предоставлении практик медитации на основе осознанности молодежи и цветным сообществам в Центре медитации Ист-Бэй в Окленде, Калифорния, который она соучредила и где она преподает.Она также преподавала йогу и медитацию для молодых людей в детском саду. Когда-то сама была проблемным подростком, она понимает опыт тех, кто попадает туда, и может ответить без осуждения и без дистанцирования от их страданий. Потребность и боль, которые она увидела в тот день, когда она подавала обед бездомным и обездоленным, открыли ей богатые награды в виде сострадания.
Вызов всех Бодхисаттв
Буддийские учения используют термин, охватывающий все эти качества сострадания и альтруизма: Бодхисаттва.Это древнее санскритское слово означает существо, которое движется к просветлению, и конкретно относится к тем, кто стремится к этой высокой цели с целью освобождения всех существ от страданий.
Идея освобождения всех существ от страданий звучит как натяжка. Но работать на благо других может каждый из нас. Поэтому мне нравится называть тех, кто вдохновлен этим видением облегчения страданий и увеличения счастья, «обучающимися бодхисаттвами». Они делают все, что в их силах, и в процессе узнают, насколько полезно и полезно выражать свое заботливое сердце.
Когда мы становимся обучающимися бодхисаттвами, мы встаем на путь к жизни, которая наполнена смыслом и приносит удовлетворение. Моя юная подруга по имени Алин – живое тому доказательство. Она занималась защитой окружающей среды и развитием общества в таких странах, как Сенегал, Перу, Румыния и Украина. Тем не менее, несмотря на всю свою работу, она все еще является свидетелем душераздирающих разрушений. «В Сибири 60 процентов вырубок в ранее нетронутом регионе, где я жила, незаконны», – сказала она мне. «Я видел грузовики и грузовики с бревнами, идущие в Китай.Это было действительно больно ».
Тем не менее, независимо от того, со сколькими проблемами Алин сталкивалась в своей работе по всему миру, она говорит, что будет продолжать выполнять такого рода услуги до конца своей жизни.
Я думаю, что хотеть служить – это очень человеческое дело. Он чем-то питает душу. Если люди выглядят честно, жизнь в соответствии со своими ценностями имеет большее значение, чем деньги. Если вы не согласны со своими ценностями, это вас съедает. Когда вы есть, что-то в вас растет и оживает. У каждого из нас есть собственная скрытая цель внутри, и нам нужно раскрыть ее и дать ей крылья.Служение – это одна из вещей, которая помогает нам соприкоснуться с самой естественной и истинной частью нас самих.
Как показывает нейробиологическое исследование медитации сострадания Ричарда Дэвидсона, естественной реакцией на то, чтобы увидеть кого-то в беде, является импульс помочь. Мы заботимся о страданиях других. И мы чувствуем себя хорошо, когда избавляемся от страданий. Независимо от того, участвуем ли мы в сострадании, становимся свидетелями героических поступков в кино или читаем о благородных поступках, заботливая реакция на страдания других поднимает нас.По словам Алин, осознание того, что она вносит положительный вклад в жизнь людей, – «одно из лучших чувств, которые я когда-либо испытывал».
Глатирамера ацетат-специфические Т-клетки в головном мозге экспрессируют Т-хелперы 2/3 цитокинов и нейротрофический фактор головного мозга in situ
Реферат
Способность лекарства модулировать патологический процесс в органе-мишени имеет решающее значение для его терапевтического действия. Глатирамера ацетат (GA, копаксон, сополимер 1), препарат, одобренный для лечения рассеянного склероза, индуцирует регуляторные Т-хелперные 2/3 клетки, которые проникают в ЦНС.Здесь мы исследовали, могут ли эти GA-специфические Т-клетки функционировать как супрессорные клетки с терапевтическим потенциалом в органе-мишени за счет экспрессии in situ Т-хелперов 2/3 цитокинов и нейротрофических факторов. GA-специфические клетки и их in situ экспрессия была обнаружена на уровне ткани всего мозга с использованием двухэтапной системы двойного мечения: ( i ) мечение GA-специфических Т-клеток с последующим их адоптивным перенос и ( ii ) обнаружение секретируемых факторов в головном мозге иммуногистологическими методами.GA-специфические Т-клетки в ЦНС продемонстрировали интенсивную экспрессию нейротрофического фактора головного мозга и двух противовоспалительных цитокинов, ИЛ-10 и трансформирующего фактора роста β. Не наблюдалось экспрессии воспалительного цитокина IFN-γ. Этот паттерн экспрессии проявлялся в головном мозге нормальных и экспериментальных мышей, индуцированных аутоиммунным энцефаломиелитом, которым адоптивно переносились GA-специфические клетки, но не у контрольных мышей. Кроме того, инфильтрация индуцированных GA клеток в мозг привела к случайной экспрессии IL-10 и трансформации фактора роста β резидентными астроцитами и микроглией.Способность инфильтрирующих GA-специфических клеток экспрессировать противовоспалительные цитокины и нейротрофический фактор в органе, в котором происходят патологические процессы, напрямую коррелирует с терапевтической активностью GA при экспериментальном аутоиммунном энцефаломиелите / рассеянном склерозе.
Было показано, что нейротрофические факторы и противовоспалительные цитокины играют решающую роль в модуляции рассеянного склероза (MS) и его экспериментальной модели, экспериментального аутоиммунного энцефаломиелита (EAE) (1-3).Тем не менее, доступная информация об их выражении в ЦНС ограничена. Различные современные методы лечения рассеянного склероза пытаются вмешаться в патологические процессы посредством иммунного вмешательства и активации этих регуляторных веществ. Однако, хотя периферический эффект этих методов лечения широко изучен, имеется мало информации об их влиянии на целевой орган, а именно на мозг. Изучение заболеваний ЦНС особенно сложно, потому что доступность иммунных факторов и регуляторных клеток строго контролируется гематоэнцефалическим барьером, составляющим особую и уникальную микросреду.
Глатирамера ацетат (GA, копаксон, сополимер 1), препарат, одобренный для лечения рассеянного склероза, оказывает заметное подавляющее действие на EAE, индуцированную различными энцефалитогенами у нескольких видов (4). Ранее мы продемонстрировали, что терапевтический эффект GA опосредуется регуляторными клетками, которые подавляют заболевание и секретируют большое количество противовоспалительных цитокинов T-хелперов (Th) 2/3 (5). Эти индуцированные GA клетки-супрессоры перекрестно реагируют с аутоантигенным основным белком миелина, секретируя цитокины Th3 / 3, и вызывают стороннее подавление процессов, опосредованных другими энцефалитогенами (6).GA-специфические клетки Th3 / 3 были обнаружены на периферии, в селезенках и лимфатических узлах экспериментальных животных, а также в мононуклеарных клетках периферической крови людей, получавших GA, что позволяет предположить, что эти клетки участвуют в терапевтическом эффекте, индуцированном GA на Также МС (5–7). Более того, мы недавно продемонстрировали, что GA-специфические регуляторные клетки, индуцированные на периферии либо путем инъекции, либо пероральным лечением GA, проходят гематоэнцефалический барьер и накапливаются в ЦНС. Это проявилось в их выделении из мозга мышей, подвергшихся активной сенсибилизации, получавших GA, и в локализации GA-специфических клеток в головном мозге после их пассивного переноса на периферию (8, 9).
Хотя присутствие GA-специфических клеток Th3 в ЦНС было подтверждено, их способность фактически секретировать цитокины Th3 и вызывать терапевтический эффект in situ не была проверена. Некоторая оговорка относительно способности Т-клеток секретировать цитокины Th3 в ЦНС возникла после обнаружения того, что окружающая среда ЦНС вызывает смещение в сторону пути Th2 и что клетки Th3, специфичные для основного белка миелина, могут усугублять ЕАЕ (6, 10). Следовательно, было важно выяснить, действительно ли GA-специфические клетки, накапливающиеся в головном мозге, функционируют как клетки-супрессоры в пораженном органе и секретируют противовоспалительные цитокины in situ .
Недавно было продемонстрировано, что GA-специфические клетки как мышиного, так и человеческого происхождения также секретируют мощный нейротрофический фактор головного мозга (BDNF) (3, 11), который вызывает разрастание аксонов, ремиелинизацию, регенерацию и восстановление дегенерирующих нейронов ( 12, 13). Тем не менее, эта секреция BDNF была обнаружена только в периферических линиях Т-клеток in vitro , но не в органе-мишени. Экспрессия BDNF специфичными для GA клетками в ЦНС может указывать на то, что активность GA не ограничивается противовоспалительным действием, но также генерирует фактические процессы нейрозащиты и регенерации.В этом исследовании мы исследовали, действительно ли GA-индуцированные Т-клетки, проникающие в мозг, действуют как регуляторные клетки, продуцируя цитокины Th3 / 3 и нейротрофический фактор. Мы хотим сообщить, что действительно цитокины IL-10, трансформирующий фактор роста β (TGF-β) и BDNF экспрессируются GA-индуцированными клетками in situ .
Материалы и методы
Мыши. (SJL / JxBALB / c) самок мышей F1 в возрасте 10–16 недель были приобретены в лаборатории Джексона.
Глатирамер ацетат. GA состоит из ацетатных солей синтетических полипептидов, содержащих четыре аминокислоты: l-аланин, l-глутамат, l-лизин и l-тирозин (4). GA из партии № 2429 со средней молекулярной массой 7300 был получен от Teva Pharmaceutical Industries (Петах-Тиква, Израиль) и использовался на протяжении всего исследования.
Т-клеток. GA-специфические клетки из двух линий Т-клеток, полученных из селезенки мышей, которые получали ежедневные инъекции (2 мг / день, 10 инъекций) или получали (250 мкг / день, восемь приемов пищи) GA, соответственно, использовались на протяжении всего исследования. эта учеба.Клетки были отобраны in vitro путем повторения воздействий GA (50 мкг / мл) на облученные клетки селезенки с последующим размножением в среде фактора роста Т-клеток. Эти клетки были охарактеризованы как регуляторные клетки Th3, которые могут подавлять EAE in vivo (5, 6).
Маркировка Т-клеток. GA-специфические клетки окрашивали либо флуоресцентным светом Hoechst 33342-blue (Molecular Probes), либо флуоресцентным PKh36-красным (Sigma), которые встраиваются в ядро клетки или на клеточную мембрану, соответственно, в соответствии с инструкциями производителя.Оба метода окрашивания по существу не влияли на биологическую активность клеток, что продемонстрировано сравнением пролиферации и секреции цитокинов меченых клеток с немечеными клетками и способностью меченых клеток предотвращать ЕАЕ.
Приемный перевод. Активированные предварительно меченые GA-специфические Т-клетки (30 × 10 6 на мышь) инъецировали в брюшину нормальных мышей или мышей, индуцированных EAE, через 3 дня после индукции заболевания гомогенатом всего спинного мозга (5 мг в полном адъюванте Фрейнда) и инъекция токсина коклюша (0.2 мкг на мышь). Мозг иссекали через 7 дней после инъекции клеток, потому что наши предыдущие исследования показали, что это время является оптимальным для накопления GA-специфических клеток, в отличие от неспецифических контролей (8, 9).
Иммуноцитохимия. Контрольных мышей, индуцированных EAE, которым вводили GA-специфические Т-клетки, и нормальных мышей анестезировали и перфузировали 2,5% параформальдегидом. Мозг делали на срезы (20 мкм) с помощью криостата или выдвижного микротома. Срезы предварительно инкубировали в PBS с 20% лошадиной сывороткой и 0.05% сапонина (Sigma) в течение 1 ч, затем инкубировали в течение ночи со следующими первичными антителами: куриные анти-BDNF (Promega), козьи анти-IL-10 (Santa Cruz Biotechnology), кроличьи анти-TGF-β (Santa Cruz Biotechnology) , крысиный анти-IFN-γ (BioSource International, Камарилло, Калифорния) или мышиный антиглиальный фибриллярный кислый белок (GFAP; Pharmingen), 1–10 мкг / мл, разведенный в PBS с 2% лошадиной сывороткой и 0,05% сапонином. Второй этап антител выполняли путем мечения Cy2- или Cy3-конъюгированными ослиными анти-куриными, ослиными анти-козьими, ослиными анти-кроличьими антителами, ослиными анти-крысиными или ослиными антимышиными антителами (Jackson ImmunoResearch), 1: 250, в течение 20 мин. .Дополнительные контроли инкубировали только с вторичным антителом. Срезы клеток, меченных Hoechst, исследовали с помощью флуоресцентного микроскопа (Nikon Eclipse E600). Срезы клеток, меченных PKh36, исследовали с помощью конфокального микроскопа (Axiovert 100M, Zeiss). Фотографии были сделаны с использованием программы Spot. Изображения обрабатывались в программе Photoshop (Adobe Systems, Маунтин-Вью, Калифорния). Большинство представленных фотографий сделано у мышей, индуцированных EAE, которым инъецировали предварительно меченые GA-специфические клетки.
Результаты
Наличие флуоресцентно-меченных адоптивно переносимых GA-специфических Т-клеток в головном мозге. Обилие флуоресцентно предварительно меченных GA-специфических клеток наблюдали в срезах мозга с адоптивно перенесенными GA-специфическими Т-клетками у нормальных мышей и особенно в мозге мышей, индуцированных EAE, через 7 дней после их инъекции на периферию. GA-специфические клетки были видны в желудочках, в частности, в сосудистом сплетении (рис. 1 D ) и в ткани, окружающей желудочки (рис. 1 A ). Вокруг кровеносных сосудов было замечено множество скоплений клеток, что указывает на периваскулярную инфильтрацию в головной мозг (рис.1 G ). Отдельные или сгруппированные клетки проникли в различные области мозга, включая кору, таламус, базальные ганглии и гиппокамп. Срезы головного мозга, содержащие проникающие флуоресцентно меченые GA-специфические Т-клетки, и контрольные срезы мозга от вызванных EAE или нормальных мышей были иммуногистохимически окрашены на экспрессию нейротрофического фактора BDNF, цитокинов Th3 IL-10 и TGF-β и Th2 цитокин IFN-γ. Изображения были взяты из различных областей таламуса и коры, в основном из латеродорсального ядра таламуса, вентрального заднемедиального таламического ядра, вентрального заднебокового ядра таламуса и соматосенсорной коры.
Рис.1.Иммуногистохимический анализ экспрессии BDNF в GA-специфических клетках головного мозга. Активированные меченые GA-специфические клетки вводили в брюшину либо при EAE-индуцированном ( A – C , G – J и M – O ) или нормальном ( D – ). F ) мышей. Через 7 дней мышам перфузировали и срезы мозга (20 мкм) окрашивали иммуноцитохимически на экспрессию BDNF. ( A – C ) Область, окружающая боковой желудочек.( D – F ) Сосудистое сплетение в боковом желудочке. ( G – I ) Периваскулярная инфильтрация в коре головного мозга. ( J ) Перекрывающиеся изображения увеличенных Hoechst-меченных, специфичных для GA клеток и их секреции BDNF в коре головного мозга. ( M – O ) Увеличенные изображения отдельных GA-специфичных PK-меченых клеток в коре головного мозга. Контроли демонстрируют экспрессию BDNF в соответствующих областях мозга мыши, индуцированной EAE ( K ) и нормальной мыши ( L ).(Шкала: A – F , K и L , 100 мкм; G – I , 20 мкм; J и M – O , 10 мкм. )
БДНФ. Как показано на рис. 1, адоптивно перенесенные GA-специфические клетки, которые были накоплены в головном мозге (рис. 1 A, D, G и M ), экспрессировали BDNF in situ (рис. 1 B). , E, H и N ). Этот результат был подтвержден колокализацией соответствующих полей (рис.1 C, F, I и O ). Кроме того, окрашивание клеток GA в ЦНС антителами к BDNF было также продемонстрировано на одноклеточном уровне в клетках, меченных Hoechst (рис. 1 J ) и PK (рис. 1 M – O ). . GA-специфические клетки, экспрессирующие BDNF, наблюдались в различных областях мозга, в основном в ткани, окружающей желудочки (рис. 1 A – C ) и в периваскулярных манжетах (рис. 1 G – I ). Иммуноокрашивание BDNF локализовано как в цитоплазме, так и в мембране клеток (рис.1 J и N ). В отличие от сильной экспрессии BDNF в головном мозге, содержащем GA-специфические клетки, только краевое окрашивание BDNF наблюдалось в ЦНС контрольных мышей, индуцированных EAE (рис. 1 K ) и у нормальных (рис. 1 L ) мышей. в который не вводили никаких GA-специфических клеток.
Ил-10. На рис.2 показано, что GA-специфические клетки в головном мозге (рис.2 A, D и L ) продемонстрировали интенсивное окрашивание антителами против IL-10 (рис.2 B, E и M ), что подтверждается совместной локализацией соответствующих полей (рис. 2 C, F и N ). Эта экспрессия in situ IL-10 клетками GA была четко продемонстрирована на уровне отдельных клеток в меченных Hoechst (рис. 2 G – I ) и PK (рис. 2 L – ). N ) ячеек. IL-10 экспрессировался как в цитоплазме, так и в мембране клеток (рис. 2 H и M ).
Фиг.2.Иммуногистохимический анализ экспрессии IL-10 GA-специфическими клетками в мозге мышей, индуцированных EAE. ( A – F ) Периваскулярная инфильтрация в таламусе. ( G – I ) Увеличенные изображения отдельных клеток таламуса. ( L – N ) Отдельные клетки коры. ( O – R ) Неперекрывающееся распределение экспрессирующих IL-10, GA-меченных клеток и дополнительная популяция клеток, экспрессирующих IL-10 и GFAP, в ткани, окружающей боковой желудочек.Контроли демонстрируют экспрессию IL-10 в соответствующих областях мозга мыши, индуцированной EAE ( J ) и нормальной мыши ( K ). (Шкала: A – C , 50 мкм; D – F , 20 мкм; G – I и L – N , 10 мкм; J , K и O – R , 100 мкм.)
Кластеры меченных GA клеток, экспрессирующих IL-10, были многочисленны в различных областях мозга.Более того, немеченые клетки внутри и поблизости от этих кластеров также экспрессировали высокие уровни IL-10 (фиг. 2 B, C, E и F ). Эти немеченые IL-10-положительные клетки имели удлиненную астроцитоподобную морфологию, соответствующую активированной микроглии. Тройное окрашивание слайдов, содержащих GA-специфические клетки (рис. 2 O ), на IL-10 (рис. 2 P ) и GFAP, компонент филаментов астроцитов (рис. 2 Q ), подтвердило фенотип астроцитов. этих соседних ячеек (рис.2 R ). Таким образом, экспрессия IL-10 была очевидна не только в меченых GA-специфических клетках, которые мигрировали в мозг, но также и в окружающих резидентных клетках ЦНС.
Интенсивная секреция IL-10 наблюдалась только в головном мозге с адоптивно перенесенными клетками GA, тогда как контрольные мыши экспрессировали уровни IL-10 от низких до умеренных. Экспрессия IL-10 в мозге мышей, индуцированных EAE (фиг. 2 J ), была немного выше, чем наблюдаемая в мозге нормальных мышей (фиг. 2 K ).Умеренная экспрессия IL-10, по-видимому, связана с областями инфильтрированных клеток и периваскулярных манжет.
TGF- β. Подобный феномен наблюдался в отношении TGF-β, как показано на рис. 3. Адаптивно перенесенные GA-специфические клетки в головном мозге проявляли интенсивную экспрессию TGF-β (рис. 3 A – D и G – L ), с сильным цитоплазматическим и мембранным окрашиванием отдельных клеток (рис. 3 D и H ).Картина окрашивания была аналогична картине, наблюдаемой для IL-10, включая положительное окрашивание окружающих удлиненных клеток морфологии астроцитов, что было подтверждено тройным мечением GFAP (фиг. 3 J – M ). Эти окружающие резидентные клетки-свидетели демонстрировали аналогичную или даже более высокую интенсивность экспрессии TGF-β по сравнению с окрашиванием популяции GA-специфичных клеток (фиг. 3 D ).
Рис.3.Иммуногистохимический анализ экспрессии TGF-β GA-специфическими клетками в мозге мышей, индуцированных EAE.( A – D ) Периваскулярная инфильтрация в коре головного мозга. ( G – I ) Трехмерная реконструкция PK-меченых клеток в таламусе с помощью конфокального сканирующего микроскопа. ( J – M ) Неперекрывающееся распределение TGF-β-экспрессирующих GA-меченых клеток и дополнительная популяция клеток, экспрессирующих TGF-β и GFAP, в ткани, окружающей кровеносный сосуд. Контроли демонстрируют TGF-β в соответствующей области мозга мыши, индуцированной EAE ( E ), и нормальной мыши ( F ) в коре головного мозга.(Шкала: A – C , 50 мкм; D , 20 мкм; E , F и M – P , 100 мкм; G – L , 10 мкм.)
В отличие от сильной секреции TGF-β в головном мозге с адоптивно перенесенными клетками GA, контрольные мыши экспрессировали низкие или умеренные уровни TGF-β, которые были выше в мозге мышей, индуцированных EAE (рис. 3 E ), чем у мышей. нормальных мышей (рис. 3 F ).
IFN- γ.Представленные до сих пор результаты относятся к Th3-родственным цитокинам. Представляло интерес проверить характер экспрессии цитокина Th2, такого как IFN-γ. Как показано на фиг.4, GA-специфические клетки, которые были накоплены в головном мозге (фиг.4 A и D ), не экспрессировали IFN-γ in situ (фиг.4 B и E ). Невозможно было обнаружить какой-либо IFN-γ в головном мозге мышей, которым вводили клетки, меченные GA, ни при EAE-индуцированном (рис. 4 A – C ), ни в норме (рис.4 D – F ) мышей. С другой стороны, интенсивное окрашивание на IFN-γ было обнаружено в соответствующих областях мозга мышей, индуцированных EAE, которым не вводили GA-специфические клетки (фиг. 4 G и H ). Это окрашивание было намного выше, чем у нормальных мышей (рис. 4 I ).
Рис.4.Отсутствие экспрессии IFN-γ в GA-специфических клетках головного мозга. Клетки коры мышей, индуцированных EAE ( A – C ) и нормальной мыши ( D – F ).Экспрессия IFN-γ в соответствующих срезах мозга контролей: мыши, индуцированной EAE ( G и H ), и нормальной мыши ( I ). (Шкала: A – F и H , 40 мкм; G и I , 100 мкм.)
Обсуждение
Иммуномодулирующие методы лечения патологий ЦНС широко изучаются и используются в клинической практике в течение нескольких лет. Однако понимание того пути, по которому они фактически действуют в органе-мишени, отстало.Таким образом, известно, что нейротрофические факторы и противовоспалительные цитокины играют решающую роль в модуляции MS и EAE (1–3, 12–15), но информация об их экспрессии в ЦНС ограничена. В настоящем исследовании мы проверили, приводит ли лечение препаратом GA к секреции нейротрофического фактора и противовоспалительных цитокинов in situ через специфические клетки Th3 / 3, которые проникают в мозг. Чтобы отследить небольшое количество факторов, секретируемых определенным подмножеством Т-клеток на уровне ткани всего мозга, мы использовали подход двойной метки, при котором предварительно меченые специфические Т-клетки были адоптивно перенесены, а их экспрессия цитокинов / нейротрофических факторов впоследствии была иммуногистологически. обнаружен.
Как ясно продемонстрировано, GA-специфические клетки в головном мозге проявляют интенсивную экспрессию нейротрофического фактора BDNF (рис. 1) и двух противовоспалительных цитокинов, IL-10 (рис. 2) и TGF-β (рис. 3), но никаких следов воспалительного цитокина IFN-γ (рис. 4). Эта экспрессия была четко подтверждена на уровне отдельной клетки путем мечения двумя разными красителями, то есть Hoechst и PKh36, которые встраиваются в разные клеточные локусы (ядро и мембрану соответственно), что указывает на то, что эти результаты не отражают артефакт, вызванный путем окрашивания клеток.Было заявлено, что из-за своей способности связывать клеточную ДНК, маркировка Hoechst подавляет активность лимфоцитов и взаимодействует с клетками-свидетелями (16). Мы не наблюдали этих явлений, что продемонстрировано сравнением пролиферации и секреции цитокинов меченых клеток с немечеными клетками и способностью меченых клеток предотвращать ЕАЕ (8). Тем не менее, чтобы подтвердить специфичность окрашивания, мы использовали, кроме того, жизненно важную процедуру мечения с помощью красителя, вставляющего мембрану PKh36. Параллельные результаты были получены с обоими методами окрашивания.
BDNF, IL-10 и TGF-β проявляли цитоплазматическую, а также мембранную экспрессию. Положительно окрашенные GA-специфические клетки были обнаружены в различных областях головного мозга, включая кору, таламус, базальные ганглии и гиппокамп, в основном в тканях, окружающих желудочки, и в периваскулярных зонах. Они были обнаружены в мозге нормальных мышей и мышей, индуцированных EAE, после адоптивного переноса GA-специфических клеток. В обоих случаях интенсивность окрашивания на уровне отдельных клеток была одинаковой.Тем не менее, общая экспрессия на уровне всей ткани была значительно выше у мышей, индуцированных EAE, потому что в мозге этих мышей присутствовало гораздо больше GA-специфических клеток, чем в мозге нормальных мышей. Разница в инфильтрации клеток может быть результатом повреждения гематоэнцефалического барьера, вызванного инъекцией коклюшного токсина во время индукции EAE, и разрушения, характерного для процесса болезни. В любом случае, во время патологического процесса проявлялась обширная экспрессия этих модулирующих веществ GA-специфическими клетками ЦНС.Т-клетки из линий, индуцированных пероральной иммунизацией или ежедневными инъекциями GA, продемонстрировали сходные паттерны проникновения в ЦНС и экспрессии всех тестируемых факторов.
Интенсивное окрашивание антителами к BDNF, IL-10 и TGF-β было обнаружено только в мозге мышей, которым вводили GA-специфические клетки. У контрольных мышей было отмечено лишь слабое окрашивание. Интересно, что окрашивание BDNF в мозге мышей, индуцированных EAE, было маргинальным и сходным с окрашиванием нормальных мышей (рис. 1 K и L ), тогда как экспрессия IL-10 и TGF-β в мозге EAE -индуцированные мыши были несколько выше, чем в мозге нормальных мышей (рис.2 J и K и 3 E и F ). Этот результат согласуется с другими исследованиями, которые продемонстрировали активацию этих цитокинов во время болезни (1, 2, 14, 15). В отличие от экспрессии цитокинов Th3 / 3, которая была увеличена лишь незначительно в мозге мышей, индуцированных EAE, значительное увеличение экспрессии IFN-γ наблюдалось в мозге мышей, индуцированных EAE (рис. 4 G и H ) по сравнению с нормальными мышами (рис. 4 I ).Это открытие подтверждает наши предыдущие результаты, указывая на то, что лимфоциты, выделенные из мозга мышей, вызванных EAE, секретируют высокие уровни IFN-γ (8, 9). Примечательно, что это увеличение IFN-γ не проявлялось в лимфоцитах мозга мышей, индуцированных EAE, получавших GA (8, 9), ни в соответствующих срезах мозга мышей, вызванных EAE, которым вводили GA-специфические клетки (рис. 4). В ). В обоих случаях уровни IFN-γ были такими же, как у нормальных мышей. IFN-γ является основным эффекторным цитокином Th2, который в целом считается вовлеченным в патологические процессы EAE и MS (1).Следовательно, значимость подавления этого воспалительного цитокина в органе-мишени, индуцированного лекарственным средством GA от MS.
В настоящее время консенсус состоит в том, что активированные Т-клетки любой специфичности пересекают гематоэнцефалический барьер и проникают в ЦНС (18), но после этого Т-клетки, которые не способны распознавать свой специфический антиген в ЦНС, снижаются до исходного уровня. Способность Т-клеток, индуцированных ГК, сохраняться в ЦНС при полном отсутствии клеток с различной специфичностью, была ранее показана и объяснена их перекрестной реактивностью с миелиновым антигеном основным белком миелина (8, 9).Настоящее исследование демонстрирует, что GA-специфические клетки не только накапливаются в головном мозге, но фактически функционируют в больном органе как регуляторные клетки за счет секреции Th3 / 3 и нейротрофического фактора. Особый интерес представляет открытие, что IL-10 и TGF-β экспрессируются не только клетками, меченными GA, но также и немечеными клетками в непосредственной близости от них (фиг. 2 C и F и 3 D ). Эти окружающие клетки-свидетели имеют удлиненную астроцитоподобную морфологию, соответствующую активированной микроглии.Окрашивание GFAP, компонента филаментов астроцитов, подтвердило астроцитарную природу этих клеток (фиг. 2 O – R и 3 J – M ). Глиальные клетки демонстрировали аналогичную или даже более высокую интенсивность экспрессии IL-10 и TGF-β по сравнению с окрашиванием специфической популяции GA. Такое распространение положительного окрашивания могло быть результатом либо подлинной секреции IL-10 и TGF-β астроцитами, которые были активированы цитокинами, секретируемыми из GA-специфических клеток, либо связыванием IL-10 и TGF-β, секретируемых GA-специфические клетки к их специфическим рецепторам на этих астроцитах (17, 19).В обоих случаях это распространение Th3 / 3 предполагает наблюдаемый терапевтический эффект GA на резидентные клетки ЦНС.
IL-10 является мощным регуляторным цитокином аутоиммунитета, который ингибирует Th2-клетки и активацию макрофагов в дополнение к своей эффекторной многофункциональной терапевтической реактивности (1, 2, 14). Более того, IL-10 может модулировать ответы глиальных клеток, ингибируя MHC класса II, NO и экспрессию хемокинов (19). TGF-β подавляет цитотоксический Т-клеточный ответ, выработку фактора некроза опухоли α, IFN-γ и факторов, способствующих повреждению миелина, таких как лизосомальные ферменты и промежуточные соединения азота (15).Способность инфильтрирующих GA клеток экспрессировать и индуцировать экспрессию этих мощных модулирующих цитокинов, в том числе посторонними клетками ЦНС, подтверждает терапевтическую активность GA. Кроме того, мощный нейротрофический фактор BDNF, экспрессируемый GA-специфическими клетками in situ , является ключевым регулятором развития нейронов, который поддерживает выживание нейронов и регулирует высвобождение нейротрансмиттеров и рост дендритов (12, 13). BDNF может спасать поврежденные или дегенерирующие нейроны и вызывать разрастание аксонов, ремиелинизацию и регенерацию (20).Полноразмерный рецептор BDNF, рецептор тирозинкиназы B, был обнаружен в нейронах вблизи бляшек MS и в реактивных астроцитах при поражениях MS (21). Таким образом, BDNF, секретируемый инфильтрирующими GA клетками, может фактически функционировать в ткани-мишени MS / EAE. Таким образом, экспрессия BDNF, IL-10 и TGF-β GA-специфическими клетками в ЦНС напрямую связывает терапевтическую активность GA при MS / EAE и его иммуномодулирующий эффект in situ , а именно супрессию противовоспалительного свидетеля и нейропротекция, вызванная GA-специфическими Т-клетками в головном мозге.
Благодарности
Это исследование было частично поддержано грантами Teva Pharmaceutical Industries (Израиль) и Терри и доктором Клодом Остер, а также специальным фондом Семейного фонда Юджина Эпплбаума (Блумфилд-Хиллз, Мичиган).
Сноски
↵ ‡ Кому следует адресовать корреспонденцию. Эл. Почта: michael.sela {at} weizmann.ac.il.
Сокращения: GA, глатирамера ацетат; BDNF, нейротрофический фактор головного мозга; TGF-β, трансформирующий фактор роста β; Рассеянный склероз; EAE, экспериментальный аутоиммунный энцефаломиелит; GFAP, глиальный фибриллярный кислый белок; Т, хелпер.
- Авторские права © 2003, Национальная академия наук
Т-хелперные клетки 17.1 связаны с активностью рассеянного склероза: перспективы раннего вмешательства | Мозг
Абстракция
CD4, экспрессирующие интерлейкин-17 + Т-хелперные 17 (Th27) клетки считаются критическими регуляторами активности рассеянного склероза. Однако, в зависимости от вида и провоспалительной среды, клетки Th27 являются функционально гетерогенными и состоят из субпопуляций, которые по-разному продуцируют интерлейкин-17, интерферон-гамма и фактор, стимулирующий колонии макрофагов гранулоцитов.В текущем исследовании мы изучили различные эффекторные фенотипы клеток Th27 человека и их корреляцию с активностью заболевания у пациентов с рассеянным склерозом. Популяции T-хелперов памяти, одно- и дважды положительные по CC-хемокиновому рецептору 6 (CCR6) и CXC-хемокиновому рецептору 3 (CXCR3), были функционально оценены в крови и / или спинномозговой жидкости у 59 пациентов с клинически изолированным синдромом, 35 нелеченных пациентов и 24 пациента, получавших натализумаб, с ремиттирующим рассеянным склерозом и девять пациентов с рассеянным склерозом в конечной стадии.В группе с клинически изолированным синдромом у 23 пациентов был второй приступ в течение 1 года, а у 26 пациентов не было последующих приступов в течение периода наблюдения> 5 лет. Низкие частоты T-хелперов 1 (Th2) -подобных Th27 (CCR6 + CXCR3 + ), а не Th27 (CCR6 + CXCR3 –) популяций эффекторной памяти в крови, тесно связанные с быстрой диагностикой клинически определенного рассеянный склероз. В спинномозговой жидкости у пациентов с клинически изолированным синдромом и у пациентов с ремиттирующим рассеянным склерозом Th2-подобные эффекторные клетки памяти Th27 были в изобилии и показали повышенную продукцию интерферона-гамма и колониестимулирующего фактора гранулоцитарных макрофагов по сравнению с парными CCR6 + и CCR6 – CD8 + Популяции Т-клеток и их эквиваленты в крови после кратковременного культивирования.Их местное обогащение было подтверждено ex vivo с использованием спинномозговой жидкости и суспензий одноклеточных клеток головного мозга. Из всех провоспалительных Т-хелперов, проанализированных в крови с ремиттирующим рассеянным склерозом, Th2-подобная субпопуляция Th27 Т-хелпер 17.1 (Th27.1; CCR6 + CXCR3 + CCR4 –) экспрессировал самый высокий очень поздний антиген- 4 уровня и выборочно накапливались у пациентов, получавших натализумаб, у которых не было клинических рецидивов. Этого не было обнаружено у пациентов, у которых во время лечения натализумабом возникли рецидивы.Повышенная способность клеток Th27.1 проникать в центральную нервную систему подтверждается их преобладанием в спинномозговой жидкости пациентов с ранним рассеянным склерозом и их преимущественной трансмиграцией через эндотелиальные слои мозга человека. Эти результаты показывают доминирующий вклад Th2-подобных субпопуляций Th27, в частности клеток Th27.1, в клиническую активность заболевания и дают веское обоснование для более специфического и раннего использования Т-клеточно-направленной терапии при рассеянном склерозе.
Введение
Рассеянный склероз опосредуется переносом эффекторных Т-клеток с периферии в ЦНС, чтобы вызвать локальное воспаление, демиелинизацию и нейродегенерацию (Dendrou et al. , 2015). Хотя текущее лечение, направленное на Т-клетки, снижает активность заболевания, оно часто вызывает серьезные осложнения и не предотвращает прогрессирование заболевания при рассеянном склерозе (Ransohoff et al. , 2015). Для повышения эффективности лечения и управления рисками необходимо более глубокое понимание эффекторных Т-клеток человека во время развития рассеянного склероза.В самых ранних клинических проявлениях рассеянного склероза, клинически изолированного синдрома (CIS), повышенная периферическая активация Т-лимфоцитов CD4 + связана с возникновением второго приступа (Corvol et al. , 2008). Однако были получены существенные знания о конкретных функциях Т-хелперов (Th) человека, а точная природа провоспалительных подмножеств Т-хелперов, участвующих в рассеянном склерозе, до конца не изучена.
Известно, что клетки Th2 и Th27 являются энцефалитогенными, но используют разные пути трансмиграции для проникновения в ЦНС.При экспериментальном аутоиммунном энцефаломиелите клетки Th2 преимущественно мигрируют в спинной мозг, тогда как клетки Th27 в основном инфильтрируют головной мозг (Stromnes et al. , 2008). Этому способствует их дифференциальная экспрессия провоспалительных цитокинов, хемокиновых рецепторов и интегринов (Bauer et al. , 2009; Reboldi et al. , 2009; Larochelle et al. , 2011). Интерлейкин-17 (IL-17) и C-C хемокиновый рецептор 6 (CCR6) являются ключевыми детерминантами трансмиграции Th27 через гематоэнцефалический барьер (Kebir et al., 2007; Ребольди и др. , 2009 г.). IL-17 обычно рассматривается как сигнатурный цитокин, продуцируемый CCR6-положительными клетками Th27. Однако это сильно недооценивает эффекторную функцию Th27, поскольку субпопуляции также (совместно) продуцируют гамма-интерферон (IFN-γ) и фактор, стимулирующий колонии макрофагов гранулоцитов (GM-CSF). Наряду с IL-17, IFN-γ и GM-CSF сильно продуцируются миелин-специфическими CCR6-положительными Т-хелперами при рассеянном склерозе (Cao et al. , 2015). Полифункциональность Th27 по-разному регулируется у разных видов, что отражается в антагонистической регуляции экспрессии IL-17 и GM-CSF у человека по сравнению с мышиными Т-хелперами (El-Behi et al., 2011; Noster et al. , 2014 г .; Патерка и др. , 2016). В частности, GM-CSF, продуцируемый Т-хелперами, играет важную роль в возникновении рассеянного склероза (Codarri et al. , 2011; Hartmann et al. , 2014).
Поверхностная экспрессия другого хемокинового рецептора, CXCR3, определяет клетки Th27 с Th2-подобными особенностями (Acosta-Rodriguez et al. , 2007). Экспрессия CCR6 и CXCR3 на Т-клетках CD4 + контролируется факторами транскрипции RORγt и T-bet, соответственно, которые изначально были связаны с двойной продукцией IL-17 / IFN-γ (Acosta-Rodriguez et al., 2007). Однако недавние открытия демонстрируют более гетерогенные профили экспрессии IL-17, IFN-γ и GM-CSF в клетках Th27 в зависимости от воспалительной среды (Duhen and Campbell, 2014). Помимо CCR6 и CXCR3, также наличие очень позднего антигена-4 интегрина α4β1 (VLA-4), который в большом количестве присутствует на клетках Th27 при рассеянном склерозе CSF (Brucklacher-Waldert et al. , 2009), определяет трансмиграцию Т-клеток. мощности. Натализумаб, моноклональное антитело против VLA-4, в настоящее время является одним из наиболее эффективных методов лечения рассеянного склероза, но рецидивы все еще встречаются через 1 год примерно у одной трети пролеченных пациентов (Polman et al., 2006). Понимание того, какие различные провоспалительные подгруппы Т-хелперов нацелены на натализумаб, поможет лучше предсказать ответ на лечение при рассеянном склерозе (Prosperini et al. , 2012).
Здесь образцы крови и спинномозговой жидкости из CIS и пациентов с ремиттирующим склерозом (RRMS), не получавших лечения и получавших натализумаб, оценивались на распределение, фенотип памяти, активацию и провоспалительную способность субпопуляций Th27. Мы обнаружили, что эффекторные клетки Th27, продуцирующие IFN-γ- / GM-CSF (CCR6 + CXCR3 + ), но не продуцирующие IL-17 (CCR6 + CXCR3 –), являются ключевыми регуляторами рассеянного склероза. начало.Th2-подобная субпопуляция Th27, названная Th27.1 (CCR6 + CXCR3 + CCR4 –), избирательно нацеливается натализумабом у пациентов с рассеянным склерозом, у которых не было клинических рецидивов. Эта работа поддерживает разработку и раннее использование терапевтических стратегий против клеток Th27.1 для предотвращения рецидивов рассеянного склероза.
Материалы и методы
Пациенты
Характеристики пациентов и контрольной группы в скрининговых когортах приведены в таблице 1.Основные экспериментальные результаты были подтверждены с использованием дополнительных когорт (дополнительная таблица 1). Все пациенты с CIS и RRMS, а также контрольная группа были включены в Erasmus MC (Роттердам, Нидерланды), который является национальным специализированным центром для пациентов с рассеянным склерозом (MS Center ErasMS). Весь первичный материал был собран в период с 2007 по 2017 год.
Таблица 1Характеристики пациентов и контрольных групп в скрининговых когортах
| Кровь, ex vivo . | ||||||
|---|---|---|---|---|---|---|
| Когорта . | НС . | СНГ-СНГ . | CIS-CDMS . | RRMS, без обработки a . | RRMS, обработка NAT a . | |
| Пациенты, n | 19 | 16 | 16 | 18 | 17 b | |
| Пол, женский, n (%) | 11 (69) | 13 (81) | 15 (83) | 12 (71) | ||
| Возраст в годах, медиана (IQR) c | 45 (35–49) | 36 ( 27–40) | 33 (28–37) | 46 (37–50) | 38 (30–46) d | |
| Время наблюдения в годах, медиана (IQR) | NA | 6.8 (6,2–7,3) | 4,1 (3,1–5,7) | NA | NA | |
| Длительность заболевания в месяцах, медиана (IQR) e | NA | 2,0 (1,3–3,1) | 2,0 (1,2–3,0) | 120 (48–193) | 92 (48–160) d | |
| ≥9 поражений на T 2 -взвешенных изображений на исходном уровне, n (%) | NA | 3 (19) | 10 (63) | NA | NA | |
| CSF / мозг, ex vivo | CSF, TCC | |||||
| Ранний MS | Поздний MS | Поздний NDC | Ранний MS | Поздний MS | ||
| Пациенты ) | 4 (4) | 5 (5) | 2 (2) | 10 (4) | 7 (7) г | |
| Пол, женский n (%) | 2 (50) | 5 (100) | 1 (50) | 10 (100) | 5 (71) | |
| Возраст в годах, медиана (IQR) c | 32 (18–41) | 62 (44–72) | 78 (NA) | 33 (23–38) | 70 (60–82) | |
| Время наблюдения в годах, медиана (IQR) | 0.3 (0,3–0,5) | NA | NA | 1,5 (0,6–5,5) | NA | |
| Длительность заболевания в месяцах, медиана (IQR) e | 3,8 (2,7–5,2) | NA | NA | 3,8 (1,0–22,4) | NA | |
| PMD в часах, медиана (IQR) | NA | 8,5 (8,4–9,2) | 6,1 (NA) | NA | 8,6 8.3–9.3) | |
| pH CSF, медиана (IQR) | NA | 6.3 (6,3–6,7) | 6,5 (NA) | NA | 6,5 (6,3–6,7) | |
| Кровь, ex vivo . | ||||||
|---|---|---|---|---|---|---|
| Когорта . | НС . | СНГ-СНГ . | CIS-CDMS . | RRMS, без обработки a . | RRMS, обработка NAT a . | |
| Пациенты, n | 19 | 16 | 16 | 18 | 17 b | |
| Пол, женский, n (%) | 11 (69) | 13 (81) | 15 (83) | 12 (71) | ||
| Возраст в годах, медиана (IQR) c | 45 (35–49) | 36 ( 27–40) | 33 (28–37) | 46 (37–50) | 38 (30–46) d | |
| Время наблюдения в годах, медиана (IQR) | NA | 6.8 (6,2–7,3) | 4,1 (3,1–5,7) | NA | NA | |
| Длительность заболевания в месяцах, медиана (IQR) e | NA | 2,0 (1,3–3,1) | 2,0 (1,2–3,0) | 120 (48–193) | 92 (48–160) d | |
| ≥9 поражений на T 2 -взвешенных изображений на исходном уровне, n (%) | NA | 3 (19) | 10 (63) | NA | NA | |
| CSF / мозг, ex vivo | CSF, TCC | |||||
| Ранний MS | Поздний MS | Поздний NDC | Ранний MS | Поздний MS | ||
| Пациенты ) | 4 (4) | 5 (5) | 2 (2) | 10 (4) | 7 (7) г | |
| Пол, женский n (%) | 2 (50) | 5 (100) | 1 (50) | 10 (100) | 5 (71) | |
| Возраст в годах, медиана (IQR) c | 32 (18–41) | 62 (44–72) | 78 (NA) | 33 (23–38) | 70 (60–82) | |
| Время наблюдения в годах, медиана (IQR) | 0.3 (0,3–0,5) | NA | NA | 1,5 (0,6–5,5) | NA | |
| Длительность заболевания в месяцах, медиана (IQR) e | 3,8 (2,7–5,2) | NA | NA | 3,8 (1,0–22,4) | NA | |
| PMD в часах, медиана (IQR) | NA | 8,5 (8,4–9,2) | 6,1 (NA) | NA | 8,6 8.3–9.3) | |
| pH CSF, медиана (IQR) | NA | 6.3 (6,3–6,7) | 6,5 (NA) | NA | 6,5 (6,3–6,7) | |
Характеристики пациентов и контрольных групп в скрининговых группах
| Кровь, ex vivo . | ||||||
|---|---|---|---|---|---|---|
| Когорта . | НС . | СНГ-СНГ . | CIS-CDMS . | RRMS, без обработки a . | RRMS, обработка NAT a . | |
| Пациенты, n | 19 | 16 | 16 | 18 | 17 b | |
| Пол, женский, n (%) | 11 (69) | 13 (81) | 15 (83) | 12 (71) | ||
| Возраст в годах, медиана (IQR) c | 45 (35–49) | 36 ( 27–40) | 33 (28–37) | 46 (37–50) | 38 (30–46) d | |
| Время наблюдения в годах, медиана (IQR) | NA | 6.8 (6,2–7,3) | 4,1 (3,1–5,7) | NA | NA | |
| Длительность заболевания в месяцах, медиана (IQR) e | NA | 2,0 (1,3–3,1) | 2,0 (1,2–3,0) | 120 (48–193) | 92 (48–160) d | |
| ≥9 поражений на T 2 -взвешенных изображений на исходном уровне, n (%) | NA | 3 (19) | 10 (63) | NA | NA | |
| CSF / мозг, ex vivo | CSF, TCC | |||||
| Ранний MS | Поздний MS | Поздний NDC | Ранний MS | Поздний MS | ||
| Пациенты ) | 4 (4) | 5 (5) | 2 (2) | 10 (4) | 7 (7) г | |
| Пол, женский n (%) | 2 (50) | 5 (100) | 1 (50) | 10 (100) | 5 (71) | |
| Возраст в годах, медиана (IQR) c | 32 (18–41) | 62 (44–72) | 78 (NA) | 33 (23–38) | 70 (60–82) | |
| Время наблюдения в годах, медиана (IQR) | 0.3 (0,3–0,5) | NA | NA | 1,5 (0,6–5,5) | NA | |
| Длительность заболевания в месяцах, медиана (IQR) e | 3,8 (2,7–5,2) | NA | NA | 3,8 (1,0–22,4) | NA | |
| PMD в часах, медиана (IQR) | NA | 8,5 (8,4–9,2) | 6,1 (NA) | NA | 8,6 8.3–9.3) | |
| pH CSF, медиана (IQR) | NA | 6.3 (6,3–6,7) | 6,5 (NA) | NA | 6,5 (6,3–6,7) | |
| Кровь, ex vivo . | ||||||
|---|---|---|---|---|---|---|
| Когорта . | НС . | СНГ-СНГ . | CIS-CDMS . | RRMS, без обработки a . | RRMS, обработка NAT a . | |
| Пациенты, n | 19 | 16 | 16 | 18 | 17 b | |
| Пол, женский, n (%) | 11 (69) | 13 (81) | 15 (83) | 12 (71) | ||
| Возраст в годах, медиана (IQR) c | 45 (35–49) | 36 ( 27–40) | 33 (28–37) | 46 (37–50) | 38 (30–46) d | |
| Время наблюдения в годах, медиана (IQR) | NA | 6.8 (6,2–7,3) | 4,1 (3,1–5,7) | NA | NA | |
| Длительность заболевания в месяцах, медиана (IQR) e | NA | 2,0 (1,3–3,1) | 2,0 (1,2–3,0) | 120 (48–193) | 92 (48–160) d | |
| ≥9 поражений на T 2 -взвешенных изображений на исходном уровне, n (%) | NA | 3 (19) | 10 (63) | NA | NA | |
| CSF / мозг, ex vivo | CSF, TCC | |||||
| Ранний MS | Поздний MS | Поздний NDC | Ранний MS | Поздний MS | ||
| Пациенты ) | 4 (4) | 5 (5) | 2 (2) | 10 (4) | 7 (7) г | |
| Пол, женский n (%) | 2 (50) | 5 (100) | 1 (50) | 10 (100) | 5 (71) | |
| Возраст в годах, медиана (IQR) c | 32 (18–41) | 62 (44–72) | 78 (NA) | 33 (23–38) | 70 (60–82) | |
| Время наблюдения в годах, медиана (IQR) | 0.3 (0,3–0,5) | NA | NA | 1,5 (0,6–5,5) | NA | |
| Длительность заболевания в месяцах, медиана (IQR) e | 3,8 (2,7–5,2) | NA | NA | 3,8 (1,0–22,4) | NA | |
| PMD в часах, медиана (IQR) | NA | 8,5 (8,4–9,2) | 6,1 (NA) | NA | 8,6 8.3–9.3) | |
| pH CSF, медиана (IQR) | NA | 6.3 (6,3–6,7) | 6,5 (NA) | NA | 6,5 (6,3–6,7) | |
Для анализа крови мы отобрали 23 пациента с CIS, у которых не было повторного клинического приступа как минимум 5 лет наблюдения (CIS-CIS) и 26 пациентов CIS, у которых был диагностирован клинически определенный рассеянный склероз (CDMS) в течение 1 года после CIS (CIS-CDMS) из нашей предполагаемой когорты. Ни один из этих пациентов не проходил лечение модифицирующими заболевание терапиями до или во время отбора проб.CIS был определен как первый клинический приступ демиелинизации ЦНС (Miller et al. , 2012). Диагноз CDMS был поставлен, когда у пациента было два приступа с клиническими признаками двух отдельных поражений в соответствии с критериями Позера (Poser et al. , 1983). Рецидив определялся как подострое ухудшение существующих симптомов или появление новых симптомов после не менее 30 дней улучшения или стабилизации заболевания (Schumacher et al. , 1965). Показатели утомляемости были получены во время первого приступа с использованием шкалы тяжести усталости Круппа, которую вводили самостоятельно, как показано ранее (Runia et al., 2015). Уровни анти-EBNA1 IgG определяли в плазме с использованием хорошо проверенного хемилюминесцентного анализа и анализатора (Liaison XL; оба Diasorin) в соответствии с инструкциями производителей в нашем местном справочном центре по вирусной диагностике (Erasmus MC).
Пациентам с RRMS был поставлен диагноз в соответствии с критериями McDonald 2010 (Polman et al. , 2011). Анализы Т-хелперов крови были выполнены у 31 пациента с RRMS, ранее не получавшего лечения, а также у 24 пациентов с RRMS до начала и после 6 и 12 месяцев терапии натализумабом.Среднее время между последним клиническим приступом и первым введением натализумаба составило 2,8 месяца [межквартильный размах (IQR): 1,7–6,3]. Семнадцать из этих пациентов (70,8%) получали терапию, модифицирующую заболевание, до начала приема натализумаба (14 – IFN-β, один – диметилфумаратом и финголимодом, один – глатирамера ацетатом и один – митоксантроном).
ЦСЖ с парными образцами крови и без них был получен от 14 пациентов с ранней стадией рассеянного склероза (ErasMS) и девяти пациентов с поздней стадией рассеянного склероза (Нидерланды Brain Bank, Амстердам).В группе с ранней стадией рассеянного склероза у 10 пациентов был CIS на момент люмбальной пункции, а у четырех пациентов был диагностирован RRMS в течение 6 месяцев до отбора образцов. Среднее время между взятием образцов и последним клиническим приступом составило 2,8 месяца (IQR: 1,3–5,8). Дополнительные вскрытые ткани головного мозга были получены от пяти пациентов с поздней стадией рассеянного склероза и двух контрольных субъектов без деменции (Нидерландский банк мозга). Все протоколы исследования были одобрены комитетом по медицинской этике Erasmus MC (Роттердам) и VUmc (Амстердам, Нидерланды).Письменное информированное согласие было получено от всех включенных пациентов и контрольной группы.
Выделение мононуклеарных клеток из крови, спинномозговой жидкости и ткани головного мозга
Кровь пациентов и подобранных контролей собирали с использованием пробирок Vacutainer CPT (BD Biosciences), содержащих гепарин натрия. Мононуклеарные клетки периферической крови выделяли в соответствии с инструкциями производителя. После центрифугирования клетки помещали в RPMI1640 (Lonza), содержащую 40% фетальной телячьей сыворотки и 20% диметилсульфоксида (Sigma-Aldrich), и хранили в жидком азоте до дальнейшего использования.Избыток спинномозговой жидкости у пациентов с ранней стадией рассеянного склероза был получен с помощью люмбальной пункции в диагностических целях. Образцы крови и спинномозговой жидкости у пациентов с поздней стадией рассеянного склероза были взяты вскрытие путем пункции сердца и дренажа желудочков, соответственно. Пробирки для сбора с CSF центрифугировали 10 мин при 500 g . Парную кровь и кровь из лейкоцитарной пленки разбавляли фосфатно-солевым буфером (PBS), после чего мононуклеарные клетки выделяли центрифугированием в градиенте плотности с использованием Ficoll® Paque Plus (GE Healthcare).Фракции CSF и мононуклеарных клеток крови ресуспендировали в RPMI 1640, содержащем 10% инактивированной нагреванием сыворотку AB человека (Sanquin) и 1% Pen / Strep (Lonza), и оставляли при 37 ° C до дальнейшего использования. Образцы ткани головного мозга обрабатывали и получали суспензии отдельных клеток, как описано ранее (van Nierop et al. , 2017).
Краткосрочные культуры ЦСЖ и Т-клеток крови
Кратковременное культивирование Т-клеток, происходящих из CSF, требовалось для получения достаточного количества клеток для сортировки клеток с активацией флуоресценции (FACS) и окрашивания внутриклеточных цитокинов интересующих подмножеств Т-хелперов.ЦСЖ и Т-клетки крови культивировали, как описано ранее (van Nierop et al. , 2016). Короче говоря, фракции мононуклеарных клеток обрабатывали в течение 13-15 дней γ-облученными фидерными клетками (10 × 10 6 мононуклеарных клеток периферической крови и 10 6 EBV – линий B-клеток HAL-02 и RS-411) , фитогемагглютинин-L (1 нг / мл; Sigma-Aldrich), IL-2 (25 Ед / мл; Erasmus MC) и IL-15 (12,5 нг / мкл; Miltenyi Biotec) в RPMI1640, содержащем l-глутамин (Lonza), 1% Pen / Strep и 10% инактивированной нагреванием сыворотки AB человека.ИЛ-2 и ИЛ-15 добавляли каждые 3-4 дня. Посмертные образцы спинномозговой жидкости рестимулировали с использованием того же протокола.
Антитела и проточная цитометрия
Многоцветный проточный цитометрический анализ был выполнен с использованием следующих меченных флуорохромом моноклональных антител против человека: CD3 BV785 (SK7), CD8 FITC (SK1), CD45RA APC-H7 (HI100), HLA-DR FITC и BB515 (G46-6) , VLA-4 BV711 и APC (9F10), CD45RO PerCP-Cy5.5 (UCHL1), CD25 BV605 и APC-R700 (2A3), CD226 BB515 (DX11), MCAM PerCP-Cy5.5 (P1h22), PSGL-1 APC (KPL-1), GM-CSF BV421 и PE-CF594 (BVD2-21C11) (все BD Biosciences), CD4 BV510 (OKT4), CD38 BV711 и PerCP-Cy5.5 (HIT2 ), CXCR3 BV421, PE-Cy7 и APC (G025H7), CCR6 PE (G034E3), CCR7 PE-CF594 (150503), CCR4 PE-Cy7 и PE-Dazzle (L291h5), CD161 BV605 (HP-3G10), IFN- γ BV421 и BV711 (4S.B3) и IL-17A APC (BL168) (все BioLegend). Клетки окрашивали в течение 30 минут при 4 ° C, измеряли с помощью проточного цитометра LSRII-Fortessa и анализировали с использованием программного обеспечения FACSDiva 6.1.2 (оба BD Biosciences).Th2, Th27 и Th2-подобные клетки Th27 были определены на основе маркеров CCR6 и CXCR3 с использованием и без использования CCR4. Для анализов без CCR4 общее количество CD4 + Т-клеток было разделено на CCR6 – CXCR3 + (Th2), CCR6 + CXCR3 – (Th27) и CCR6 + CXCR3 + как Th27) подмножества. В каждой подгруппе Т-хелперов анализировали соотношение клеток эффекторной памяти (CCR7 – CD45RA – ) и центральной памяти (CCR7 – CD45RA + ).CCR4 использовался в качестве маркера для распознавания CCR6 – CXCR3 + CCR4 – (Th2), CCR6 + CXCR3 – CCR4 + (Th27), CCR6 3 + CXR + – субпопуляции (Th27.1) и CCR6 + CXCR3 + CCR4 + [Th27 double-positive (DP)] (Paulissen et al. , 2015).
Окрашивание внутриклеточных цитокинов
Th2 (CCR6 – CXCR3 + ), Th27 (CCR6 + CXCR3 – ), Th2-подобный Th27 (CCR6 + CXCR3 + ), а также CCR6 – + CD8 + Т-клетки были отсортированы из пулов памяти Т-клеток крови и ЦСЖ (CD3 + CD25 – / int CD45RO + CD45RA –) с использованием сортировщика клеток BD FACSAria TM III.Перед выделением подмножеств Т-хелперов памяти из лейкоцитов клетки CD4 + очищали из фракции мононуклеарных клеток с использованием микрогранул CD4 и autoMACS Pro Separator (оба Miltenyi Biotec). Клетки стимулировали форбол 12-миристат 13-ацетат (PMA; 1: 2000) и иономицин (1: 500; оба Sigma-Aldrich) в течение 5 часов. GolgiStop ™ (1: 1500; BD Biosciences) добавляли в течение последних 2,5 часов стимуляции. Стимулированные клетки фиксировали и повышали проницаемость с использованием набора BD Cytofix / CytopermTM (BD Biosciences) в соответствии с предоставленным протоколом и окрашивали на IFN-γ, GM-CSF и IL-17A в одной пробирке.
Выделение РНК и количественная ПЦР
Отсортированные субпопуляции Т-клеток промывали PBS и ресуспендировали в растворе для лизиса РНК с 1% 2-ME. Тотальную РНК экстрагировали с использованием набора для очистки общей РНК GenElute ™ (Sigma-Aldrich) и обрабатывали ДНКазой I (Invitrogen). Комплементарную ДНК синтезировали из общей РНК с использованием реакционной смеси, содержащей трис-аминометан (200 мМ), KCl (500 мМ), MgCl 2 (0,2 М; Sigma-Aldrich), DTT (100 мМ; Invitrogen), случайные гексамеры ( 50 мкМ; Invitrogen), праймер олиго (dT) 15 (100 мкг / мл; Promega), смесь dNTP (10 мМ; Promega), RNAsin® (40 Ед / мкл; Promega) и SuperScript ™ II (200 Ед / мкл; Invitrogen).После инкубации при 42 ° C в течение 50 минут и инактивации при 99 ° C в течение 3 минут кДНК разводили и хранили при -20 ° C до использования. Для количественной ПЦР к TaqMan® Universal PCR Master Mix добавляли 0,2 мкМ прямой и обратный праймер (Sigma-Aldrich), зонд 10 мкМ (Universal Probe Library; Roche Applied Science) и разбавленную кДНК. Экспрессию целевого гена измеряли с использованием оптимальных анализов праймеров / зондов и TaqMan® 7900HT (Applied Biosystems). Мы использовали следующий протокол термического цикла: 2 мин при 50 ° C и 10 мин при 95 ° C, затем 40 циклов по 15 с при 95 ° C и 1 мин при 60 ° C.Значения CT анализировали с помощью программного обеспечения SDS 2.4.1 (Applied Biosystems). Уровни экспрессии генов-мишеней нормализовали с использованием 18S рРНК в качестве эталона. Последовательности праймеров представлены в дополнительной таблице 2.
Анализы трансмиграции Т-клеток
CD4 + CD25 – / int Т-клетки памяти, истощенные из наивных популяций (CCR7 + CD45RA + ), были отсортированы с помощью FACS и добавлены в количестве 2 × 10 5 клеток / лунку в трансвелл с размером пор 3 мкм тарелки (Corning).Миграцию субпопуляций Th27 в среду или CXCL10 (900 нг / мл; R&D Systems) анализировали после 3 ч инкубации при 37 ° C с использованием FACS. Для оценки трансэндотелиальной миграции субпопуляций Th27 эксперименты по миграции были выполнены через конфлюэнтные монослои эндотелиальных клеток головного мозга человека (линия клеток hCMEC / D3) (Weksler et al. , 2005) на покрытых коллагеном планшете Transwell® с размером пор 5 мкм. , как описано ранее (Lopes Pinheiro et al. , 2016). В этой системе 5 × 10 5 Т-хелперных клеток памяти добавляли на лунку и миграцию оценивали через 4 часа.
Статистический анализ
Статистический анализ проводился с использованием программного обеспечения Graphpad Prism, версия 5.04. Мы использовали двусторонний U-критерий Манна-Уитни для сравнения двух независимых групп и знаковый ранговый критерий Уилкоксона для сопоставленных пар для сравнения выборок одних и тех же людей. Корреляции были проверены с использованием ранга Спирмена. Модель логистической регрессии использовалась для корректировки измерений МРТ в многомерном анализе. Экспериментальные данные представлены в виде среднего значения и стандартной ошибки среднего. P – значения <0,05 считались значимыми.
Результаты
Низкая частота Th2-подобных Th27, а не Th27 эффекторных клеток в крови CIS ассоциируется с быстрым началом рассеянного склероза
Для поиска подмножеств провоспалительных Т-хелперов, которые критически важны для ранней диагностики CDMS, мы использовали мононуклеарные клетки периферической крови во время CIS от пациентов того же возраста и пола, которые оставались монофазными в течение как минимум 5 лет (CIS-CIS , n = 16) и от пациентов, у которых случился второй приступ в течение 1 года (CIS-CDMS, n = 16; Таблица 1).Проточный цитометрический анализ CD4 + Т-клеток показал снижение частоты Th2-подобных Th27 (CCR6 + CXCR3 + ) в группе CIS-CDMS по сравнению с группой CIS-CIS (медиана: 5,9% против 11,2%, P = 0,011; рис. 1А). После корректировки нагрузки поражения на МРТ на исходном уровне с использованием модели логистической регрессии ассоциация остается значимой (OR: 0,78 на процентное увеличение Th2-подобного Th27; P = 0,026). В CIS-CDMS для Th2-подобного Th27 было обнаружено дополнительное снижение соотношений эффекторной памяти (EM) к центральной памяти (CM) (среднее значение: 0.30 против 0,50, P = 0,005; Рис. 1Б). Аналогичное, но менее сильное снижение наблюдалось для Th2 (CCR6 – CXCR3 + ; 10,0% против 12,5%, P = 0,070 и среднее отношение EM / CM: 0,21 против 0,29, P = 0,021). Частоты и отношения EM / CM для Th27 (CCR6 + CXCR3 – ) не различались между CIS-CIS и CIS-CDMS (рис. 1A и B). Распределение подгруппы Т-хелперов у пациентов с CIS не изменилось после стратификации для лечения метилпреднизолоном в течение последних 3 месяцев до отбора образцов (данные не показаны).Наконец, Th2-подобные Th27 отношения EM / CM в крови CIS обратно коррелировали с титрами анти-EBNA1 IgG ( P = 0,013; рис. 1C) и усталостью ( P = 0,001; рис. 1D), о которых сообщалось как независимые прогностические маркеры для ранней диагностики CDMS (Lunemann et al. , 2010; Runia et al. , 2015).
Рисунок 1
Уменьшение Th2-подобных эффекторных клеток Th27 в крови пациентов с CIS с коротким временем до CDMS. пациентов с CIS были отобраны на основании анализа крови в течение 4 месяцев после постановки диагноза и времени между CIS и CDMS.Пациентам с CIS-CDMS был поставлен диагноз CDMS в течение 1 года ( n = 16; закрашенные столбцы), в то время как у пациентов с CIS-CIS диагноз CDMS не был диагностирован в течение как минимум 5 лет ( n = 16; заштрихованные столбцы ). CD4 + Т-клетки в крови сравнивали для ( A ) Th2 (CCR6 – CXCR3 + ), Th27 (CCR6 + CXCR3 – ) и Th2-подобных Th27 (CCR6 + ). CXCR3 + ) распределения клеток, а также ( B ) эффекторной памяти (EM; CCR7 – CD45RA – ) в центральную память (CM; CCR7 + CD45RA – ) соотношения клеток в каждом из эти подмножества, как определено с помощью проточной цитометрии.Соотношения Th2-подобного эффектора Th27 и центральных клеток памяти коррелировали с сообщенными предикторами раннего перехода CIS в CDMS, титром анти-EBNA1 IgG в крови ( C ) и шкалой тяжести усталости (FSS; D ). * P <0,05; ** P <0,01.
Рисунок 1
Уменьшение Th2-подобных эффекторных клеток Th27 в крови пациентов с CIS с коротким временем до CDMS. пациентов с CIS были отобраны на основании анализа крови в течение 4 месяцев после постановки диагноза и времени между CIS и CDMS.Пациентам с CIS-CDMS был поставлен диагноз CDMS в течение 1 года ( n = 16; закрашенные столбцы), в то время как у пациентов с CIS-CIS диагноз CDMS не был диагностирован в течение как минимум 5 лет ( n = 16; заштрихованные столбцы ). CD4 + Т-клетки в крови сравнивали для ( A ) Th2 (CCR6 – CXCR3 + ), Th27 (CCR6 + CXCR3 – ) и Th2-подобных Th27 (CCR6 + ). CXCR3 + ) распределения клеток, а также ( B ) эффекторной памяти (EM; CCR7 – CD45RA – ) в центральную память (CM; CCR7 + CD45RA – ) соотношения клеток в каждом из эти подмножества, как определено с помощью проточной цитометрии.Соотношения Th2-подобного эффектора Th27 и центральных клеток памяти коррелировали с сообщенными предикторами раннего перехода CIS в CDMS, титром анти-EBNA1 IgG в крови ( C ) и шкалой тяжести усталости (FSS; D ). * P <0,05; ** P <0,01.
Популяции эффекторов высокоактивированных Th2-подобных клеток Th27 уменьшаются в крови после диагностики рассеянного склероза
Чтобы убедиться, что эти селективные различия в подмножествах Т-хелперов связаны с диагнозом рассеянного склероза, мы исследовали общую частоту эффекторной памяти Th2 в крови и эффекторных клеток Th2-типа Th2 в крови у пациентов с RRMS, ранее не получавших лечения ( n = 18, Таблица 1 ), и здоровые контрольные группы соответствующего возраста / пола ( n = 19).Сильно сниженные частоты были обнаружены для обеих этих подгрупп в RRMS (медиана: 1,1% и 0,7%) по сравнению с CIS-CIS (1,9%, P < 0,001 и 2,8%, P < 0,0001, соответственно) и здоровой контрольной группой ( 2,8%, P < 0,001 и 3,3%, P < 0,0001, соответственно; рис. 2A). Эти частоты существенно не различались между группами RRMS и CIS-CDMS (1,0% и 1,3% соответственно). При RRMS значительная часть Th2-подобных клеток Th27 в крови была положительной как по CD38, так и по HLA-DR (рис.2B), что указывает на высокоактивированный фенотип после диагностики рассеянного склероза. Этого не наблюдалось для клеток Th2 (рис. 2B). Эти данные предполагают, что Th2-подобные эффекторные клетки Th27 избирательно активируются на периферии и рекрутируются в ЦНС во время начала рассеянного склероза.
Рисунок 2
Th2-подобные эффекторные клетки Th27 сильно активированы и меньше присутствуют в крови после диагностики рассеянного склероза. ( A ) Th2 и Th2-подобные Th27 частоты эффекторной памяти (EM) в CD4 + Т-клетках из CIS-CIS ( n = 14) и CIS-CDMS ( n = 16), а также RRMS ( n = 18) и здоровый контроль, соответствующий возрасту и полу (HC; n = 19) крови.( B ) Высокоактивированные фракции Th2 и Th2-подобных Th27 клеток крови у пациентов CIS-CIS ( n = 14), CIS-CDMS ( n = 16) и RRMS ( n = 18) пациентов как а также HC ( n = 19), что определяется совместной экспрессией маркеров поздней активации Т-клеток HLA-DR и CD38. * P <0,05; ** P <0,01; *** P <0,001; **** П <0,0001.
Рисунок 2
Th2-подобные эффекторные клетки Th27 сильно активированы и меньше присутствуют в крови после диагностики рассеянного склероза. ( A ) Th2 и Th2-подобные Th27 частоты эффекторной памяти (EM) в CD4 + Т-клетках из CIS-CIS ( n = 14) и CIS-CDMS ( n = 16), а также RRMS ( n = 18) и здоровый контроль, соответствующий возрасту и полу (HC; n = 19) крови. ( B ) Высокоактивированные фракции Th2 и Th2-подобных Th27 клеток крови у пациентов CIS-CIS ( n = 14), CIS-CDMS ( n = 16) и RRMS ( n = 18) пациентов как а также HC ( n = 19), что определяется совместной экспрессией маркеров поздней активации Т-клеток HLA-DR и CD38.* P <0,05; ** P <0,01; *** P <0,001; **** П <0,0001.
Преобладающая экспрессия T-bet, RORγt, IFN-γ и GM-CSF, но не IL-17A, активированными Th2-подобными клетками Th27 в крови
CCR6 человека + CD4 + Т-клетки являются не только сильными продуцентами IL-17, но также экспрессируют IFN-γ и GM-CSF (Cao et al. , 2015; Paulissen et al. , 2015 ). Чтобы изучить, как эти провоспалительные цитокины совместно регулируются в наших фенотипически определенных Th2-подобных клетках Th27 (CCR6 + CXCR3 + ), T-bet и RORγt, а также IFN-γ, GM-CSF и IL Экспрессию -17A сравнивали с парными популяциями Th2 (CCR6 – CXCR3 + ) и Th27 (CCR6 + CXCR3 – ) от здоровых доноров крови.Th2-подобный Th27 экспрессировал мРНК TBX21 / T-bet и RORC / RORγt на более высоких уровнях, чем Th2 ( P = 0,016 и P = 0,004) и Th27 ( P = 0,008 и P ). = 0,039 соответственно; рис. 3А). Уровни мРНК IFNG / IFN-γ были одинаковыми между Th2 и Th2-подобным Th27, тогда как уровни мРНК CSF2 / GM-CSF в Th2-подобном Th27 были выше, чем в Th2 ( P = 0,008) и Th27 ( P = 0,020). Th2-подобные клетки Th27 лишь умеренно экспрессировали мРНК IL17A (рис.3Б). Различия в экспрессии IFN-γ, GM-CSF и IL-17A были подтверждены на уровне белка (фиг. 3C). Процент GM-CSF-позитивных клеток был в 2-3 раза выше в Th2-подобном Th27, чем в Th2 и Th27. IL-17A-положительные клетки были в ~ 4 раза меньше присутствовали в Th2-подобном Th27 по сравнению с Th27. На уровне отдельных клеток IFN-γ в основном коэкспрессировался с GM-CSF, а не с IL-17A в Th2-подобных клетках Th27 (фиг. 3D). Эти цитокиновые профили были одинаковыми для субпопуляций Т-хелперов из крови CIS и RRMS (данные не показаны). Экспрессия TNF была сопоставима между Th2, Th27 и Th2-подобными подгруппами Th27 (фиг. 3B). CD226 был выше, тогда как CD25 и FoxP3 были ниже экспрессированы Th2-подобным Th27 по сравнению с Th27 (рис. 3A и дополнительная таблица 3), что поддерживало их провоспалительный потенциал (Lozano et al. , 2013; Gagliani et al. др. , 2015). Th2-подобные клетки Th27 также обнаруживают устойчивую экспрессию CD161 (дополнительная таблица 3), отражая фенотип ex-Th27 (Annunziato et al. , 2013).
Рисунок 3
Th2-подобные клетки крови Th27 преимущественно экспрессируют T-bet и RORγt и являются продуцентами с высоким содержанием IFN-γ и GM-CSF, но с низким содержанием IL-17A. Для оценки экспрессии генов TBX21 , RORC и FOXP3 ( A ), а также IFNG , CSF2 , IL17A и TNF использовали Баффи от девяти здоровых доноров крови. ( B ) в отсортированных популяциях памяти Th2 (CCR6 – CXCR3 + ), Th27 (CCR6 + CXCR3 – ) и Th2-подобных Th27 (CCR6 + CXCR3 + ).Клетки стимулировали PMA и иономицином, и уровни мРНК измеряли с помощью количественной ПЦР. ( C ) Проточно-цитометрический анализ внутриклеточной экспрессии IFN-γ, GM-CSF и IL-17A в стимулированных PMA и иономицином Th2, Th27 и Th2-подобных Th27 клетках памяти от одних и тех же доноров крови ( n = 7 ). ( D ) Типичные точечные диаграммы и количественная оценка коэкспрессии IFN-γ с GM-CSF и IL-17A в Th2-подобных клетках памяти Th27 ( n = 7). * P <0.05; ** P <0,01.
Рисунок 3
Th2-подобные клетки крови Th27 преимущественно экспрессируют T-bet и RORγt и являются продуцентами с высоким содержанием IFN-γ и GM-CSF, но с низким уровнем IL-17A. Для оценки экспрессии генов TBX21 , RORC и FOXP3 ( A ), а также IFNG , CSF2 , IL17A и TNF использовали Баффи от девяти здоровых доноров крови. ( B ) в отсортированных популяциях памяти Th2 (CCR6 – CXCR3 + ), Th27 (CCR6 + CXCR3 – ) и Th2-подобных Th27 (CCR6 + CXCR3 + ).Клетки стимулировали PMA и иономицином, и уровни мРНК измеряли с помощью количественной ПЦР. ( C ) Проточно-цитометрический анализ внутриклеточной экспрессии IFN-γ, GM-CSF и IL-17A в стимулированных PMA и иономицином Th2, Th27 и Th2-подобных Th27 клетках памяти от одних и тех же доноров крови ( n = 7 ). ( D ) Типичные точечные диаграммы и количественная оценка коэкспрессии IFN-γ с GM-CSF и IL-17A в Th2-подобных клетках памяти Th27 ( n = 7). * P <0.05; ** P <0,01.
Провоспалительные Th2-подобные клетки Th27 в большом количестве присутствуют в культурах Т-клеток спинномозговой жидкости пациентов с рассеянным склерозом
Для изучения местной провоспалительной способности Th2-подобных клеток Th27 при раннем рассеянном склерозе, CSF ( n = 10) и парных кровяных ( n = 4) субпопуляциях Т-клеток от пациентов с ранней стадией рассеянного склероза (Таблица 1) были проанализированы после кратковременного культивирования. Th2 и Th2-подобные Th27 были основными популяциями в пуле Т-клеток CSF CD4 + (рис.4А). Доля Th2-подобного Th27 была выше, чем доля Th2 ( P = 0,020) и их эквивалентов в крови (увеличение в 2-3 раза; рис. 4B). Сходные результаты были получены с отношениями EM / CM, которые были высокими для обеих подгрупп, но наиболее заметными в Th2-подобных клетках Th27 в CSF (фиг. 4C). В общем пуле Т-клеток CSF Th2-подобные клетки Th27 были обогащены и совместно продуцировали больше IFN-γ и GM-CSF по сравнению с CCR6 – и CCR6 + CD8 + Т-клетками и парными аналогами крови ( Инжир.4D – G). Процент IFN-γ-положительных клеток увеличивался в Th2-подобном Th27 CSF по сравнению с Th2 (фиг. 4E). Обогащение Th2-подобного Th27 в спинномозговой жидкости по сравнению с кровью (рис. 4A и B) также было обнаружено в культурах Т-клеток от пациентов с поздней стадией рассеянного склероза ( n = 7, P = 0,016; Таблица 1 и Рис. . 4H), предполагая, что Th2-подобное рекрутирование Th27 в ЦНС также происходит на более поздних стадиях заболевания.
Рисунок 4
Распространенность провоспалительных Th2-подобных клеток Th27 в CIS и CSF при рассеянном склерозе по сравнению с культурами Т-клеток крови. ( A – D ) Присутствие Th2-подобных субпопуляций Th27 (CCR6 + CXCR3 + ) в краткосрочных культурах Т-клеток CSF от 10 пациентов с ранней стадией рассеянного склероза (CIS, n = 7; RRMS, n = 3). Th2-подобный Th27 в CSF сравнивали с Th2-клетками и их эквивалентами в крови для определения процентного содержания в общем пуле Т-лимфоцитов CD4 + ( A и B ) и для соотношений эффекторной памяти (EM) и центральной памяти (CM). ( C ) от тех же пациентов.Аналогичные анализы были выполнены для Th2-подобного Th27 в CSF и как CCR6 –, так и CCR6 + CD8 + субнаборов Т-клеток в общем пуле Т-клеток ( D ). Эти субпопуляции Т-клеток разделяли, стимулировали PMA и иономицином и оценивали внутриклеточную экспрессию ( E ) IFN-γ, ( F ) GM-CSF и ( G ) IFN-γ с помощью GM-CSF. Для каждого анализа сравнивали субпопуляции Th2-подобных Th27 между парными культурами ЦСЖ и Т-клеток крови. ( H ) Частоты Th2-подобных Th27 в культурах Т-клеток из парной крови и спинномозговой жидкости пациентов с поздней стадией рассеянного склероза ( n = 7).* P <0,05; ** P <0,01.
Рисунок 4
Распространенность провоспалительных Th2-подобных клеток Th27 в CIS и CSF при рассеянном склерозе по сравнению с культурами Т-клеток крови. ( A – D ) Присутствие Th2-подобных субпопуляций Th27 (CCR6 + CXCR3 + ) в краткосрочных культурах Т-клеток CSF от 10 пациентов с ранней стадией рассеянного склероза (CIS, n = 7; RRMS, n = 3). Th2-подобный Th27 в CSF сравнивали с Th2-клетками и их эквивалентами в крови для определения процентного содержания в общем пуле Т-лимфоцитов CD4 + ( A и B ) и для соотношений эффекторной памяти (EM) и центральной памяти (CM). ( C ) от тех же пациентов.Аналогичные анализы были выполнены для Th2-подобного Th27 в CSF и как CCR6 –, так и CCR6 + CD8 + субнаборов Т-клеток в общем пуле Т-клеток ( D ). Эти субпопуляции Т-клеток разделяли, стимулировали PMA и иономицином и оценивали внутриклеточную экспрессию ( E ) IFN-γ, ( F ) GM-CSF и ( G ) IFN-γ с помощью GM-CSF. Для каждого анализа сравнивали субпопуляции Th2-подобных Th27 между парными культурами ЦСЖ и Т-клеток крови. ( H ) Частоты Th2-подобных Th27 в культурах Т-клеток из парной крови и спинномозговой жидкости пациентов с поздней стадией рассеянного склероза ( n = 7).* P <0,05; ** P <0,01.
Ex vivo Th2-подобные клетки Th27 обогащаются в ЦНС и накапливаются в крови после лечения натализумабомЧтобы подтвердить их включение в ЦНС, мы сравнили ex vivo Th2 и Th2-подобные частоты Th27 в одноклеточных суспензиях 10 тканей головного мозга и парных образцах спинномозговой жидкости и крови пяти пациентов с поздней стадией рассеянного склероза (Таблица 1, Рис. 5A и B). Th2 и Th2-подобные клетки Th27 были чрезмерно представлены, в то время как клетки Th27 практически не наблюдались в тканях мозга и спинномозговой жидкости при рассеянном склерозе, в отличие от крови.Обогащение Th2-подобным Th27 также было обнаружено в спинномозговой жидкости, но было меньше в тканях мозга двух контрольных групп без деменции (рис. 5B), что позволяет предположить, что усиленная инфильтрация Th2-подобных Th27 клеток в паренхиму головного мозга связана с рассеянным склерозом. (Кебир и др. , 2009; Кунис и др. , 2013; Джонсон и др. , 2016).
Рисунок 5
Th2-подобный набор Th27 в ЦНС и нацеливание натализумабом у пациентов с рассеянным склерозом. ( A ) Наличие Th2 (CCR6 – CXCR3 + ), Th27 (CCR6 + CXCR3 –) и Th2-подобных Th27 (CCR6 + CXCR3 + ) в отдельных ячейках клеточные суспензии из ткани головного мозга, спинномозговой жидкости и крови пациента с рассеянным склерозом, как определено FACS. ( B ) Th2-подобные частоты Th27 в 10 тканях головного мозга и в парных образцах спинномозговой жидкости и крови от пяти различных пациентов с рассеянным склерозом (закрашенные фигуры). Аналогичные анализы были выполнены для двух контрольных субъектов без деменции (NDC; открытые формы).Каждая форма представляет другого донора. Для Th2-подобных клеток Th27 в крови рассеянного склероза частота ( n = 14; C ), активация ( n = 14; D ), а также провоспалительная способность ( n = 6; E и F ) определяли до и через 6 месяцев после лечения натализумабом. Активацию Т-клеток оценивали по поверхностной экспрессии как HLA-DR, так и CD38. Для определения их провоспалительной способности Th2-подобные клетки памяти Th27 выделяли из крови до и после лечения, стимулировали PMA и иономицином и окрашивали на внутриклеточный IFN-γ и GM-CSF.* P <0,05; ** P <0,01.
Рисунок 5
Th2-подобный набор Th27 в ЦНС и нацеливание натализумабом у пациентов с рассеянным склерозом. ( A ) Наличие Th2 (CCR6 – CXCR3 + ), Th27 (CCR6 + CXCR3 –) и Th2-подобных Th27 (CCR6 + CXCR3 + ) в отдельных ячейках клеточные суспензии из ткани головного мозга, спинномозговой жидкости и крови пациента с рассеянным склерозом, как определено FACS.( B ) Th2-подобные частоты Th27 в 10 тканях головного мозга и в парных образцах спинномозговой жидкости и крови от пяти различных пациентов с рассеянным склерозом (закрашенные фигуры). Аналогичные анализы были выполнены для двух контрольных субъектов без деменции (NDC; открытые формы). Каждая форма представляет другого донора. Для Th2-подобных клеток Th27 в крови рассеянного склероза частота ( n = 14; C ), активация ( n = 14; D ), а также провоспалительная способность ( n = 6; E и F ) определяли до и через 6 месяцев после лечения натализумабом.Активацию Т-клеток оценивали по поверхностной экспрессии как HLA-DR, так и CD38. Для определения их провоспалительной способности Th2-подобные клетки памяти Th27 выделяли из крови до и после лечения, стимулировали PMA и иономицином и окрашивали на внутриклеточный IFN-γ и GM-CSF. * P <0,05; ** P <0,01.
Помимо хемокиновых рецепторов и провоспалительных цитокинов (Reboldi et al. , 2009; Larochelle et al. , 2011), молекулы адгезии играют ключевую роль в миграции периферических Т-хелперных клеток в ЦНС, включая VLA-4, MCAM и PSGL-1 (Schneider-Hohendorf et al., 2014). Интересно, что VLA-4, но не MCAM или PSGL-1, был наиболее распространенным на Th2-подобных клетках Th27 (дополнительная таблица 3). У пациентов с RRMS ( n = 14) пропорции Th2-подобного Th27 в крови были повышены после 6 месяцев лечения натализумабом (моноклональные антитела против VLA-4; медиана до и после лечения: 7,7% против 10,4%, P = 0,006; рис. 5C и таблица 1). Th2-подобные клетки Th27 не показали различий в соотношении EM / CM (данные не показаны), но их состояние активации (см.также рис.2B) значительно снизилось после терапии натализумабом (рис. 5D). Th2-подобный Th27 показал повышенную способность продуцировать IFN-γ и GM-CSF в образцах крови после обработки, а не до обработки (рис. 5E и F). Эти результаты показывают, что эффекты натализумаба при рассеянном склерозе связаны с накоплением Th2-подобных клеток Th27 в крови.
Нацеливание натализумабом на клетки VLA-4
high Th27.1 у пациентов с рассеянным склерозом, которые отвечают на лечениеЧтобы оценить избирательность эффектов натализумаба на провоспалительные популяции Т-хелперов у пациентов с рассеянным склерозом, CCR4 был включен в качестве поверхностного маркера в наши панели проточной цитометрии для подразделения Th2-подобного Th27 на недавно описанный патогенный Th27.1 (IFN-γ высокий GM-CSF высокий IL-17 низкий ) и Th27 DP (IFN-γ низкий GM-CSF низкий IL-17 внутри ) субпопуляции (Рамеш et al. , 2014; Паулиссен и др. , 2015). Частота Th27.1 (CCR6 + CXCR3 + CCR4 – ) была значительно увеличена в образцах крови RRMS после 6 и 12 месяцев лечения (медиана: 5,3% и 6,1%) по сравнению с предварительной обработкой (3,7%; n). = 14, оба P = 0.0002; Таблица 1; Рис. 6A и B). Не было обнаружено значимых различий в Th2 (CCR6 – CXCR3 + CCR4 – ), Th27 (CCR6 + CXCR3 – CCR4 + ) и Th27 DP (CCR6 + CXCR3 + ) ячеек (рис. 6А и Б). Важно отметить, что это накопление Th27.1 было наиболее выражено у пациентов, получавших натализумаб, у которых не было клинических рецидивов ( n = 9; до лечения, 3,8% по сравнению с 6 месяцами после лечения, 6.5% и 12 месяцев после лечения – 6,8%; P = 0,008 и P = 0,004 соответственно). По сравнению с пациентами, у которых были рецидивы во время лечения ( n = 5; до лечения, 3,2% по сравнению с 6 месяцами после лечения, 4,0% и через 12 месяцев после лечения, 4,1%; рис. 6C). Накопление клеток Th27.1 в крови пациентов, ответивших на лечение, было подтверждено с использованием второй когорты (дополнительная таблица 1 и дополнительный рисунок 1A).
Рисунок 6
Выборочное накопление Th27.1 у пациентов с рассеянным склерозом, леченных натализумабом, у которых не было клинических рецидивов. Используя CCR4 в качестве дополнительного маркера, Th2-подобные клетки Th27 были подразделены на Th27.1 (CCR6 + CXCR3 + CCR4 –) и Th27 DP (CCR6 + CXCR3 + CCR13 + ). подгруппы и проанализированы у пациентов с RRMS, получавших натализумаб, с помощью проточной цитометрии ( A ). Th2 (CCR6 – CXCR3 + CCR4 – ), Th27 (CCR6 + CXCR3 – CCR4 + ), Th27.1 и Th27 DP отслеживали в образцах крови до и через 6 и 12 месяцев после лечения ( n = 14; B ). Пропорции Th27.1 оценивались отдельно в безрецидивной ( n = 9) и рецидивирующей ( n = 5) группах лечения ( C ). Уровни поверхностной экспрессии VLA-4 определяли в этих субпопуляциях Т-хелперов до ( D ), а также через 6 и 12 месяцев после обработки ( E ) натализумабом. * P <0,05; ** P <0.01; *** P <0,001. MFI = средняя интенсивность флуоресценции; Tx = лечение.
Рисунок 6
Избирательное накопление клеток Th27.1 у пациентов с рассеянным склерозом, получавших натализумаб, у которых не было клинических рецидивов. Используя CCR4 в качестве дополнительного маркера, Th2-подобные клетки Th27 были подразделены на Th27.1 (CCR6 + CXCR3 + CCR4 –) и Th27 DP (CCR6 + CXCR3 + CCR13 + ). подгруппы и проанализированы у пациентов с RRMS, получавших натализумаб, с помощью проточной цитометрии ( A ).Th2 (CCR6 – CXCR3 + CCR4 – ), Th27 (CCR6 + CXCR3 – CCR4 + ), Th27.1 и Th27 DP-клетки наблюдались до и в течение 6 и 12 месяцев. образцы крови после лечения ( n = 14; B ). Пропорции Th27.1 оценивались отдельно в безрецидивной ( n = 9) и рецидивирующей ( n = 5) группах лечения ( C ). Уровни поверхностной экспрессии VLA-4 определяли в этих субпопуляциях Т-хелперов до ( D ), а также через 6 и 12 месяцев после обработки ( E ) натализумабом.* P <0,05; ** P <0,01; *** P <0,001. MFI = средняя интенсивность флуоресценции; Tx = лечение.
В предварительно обработанной RRMS крови поверхностная экспрессия VLA-4 на Th27.1 (средний MFI: 2603) была самой высокой из всех проанализированных провоспалительных подгрупп Т-хелперов, включая Th2 (MFI: 1328, P = 0,001), Th27 (MFI: 1255, P = 0,0001) и Th27 DP (MFI: 2038, P = 0,002; рис. 6D и дополнительный рис. 1B). После лечения натализумабом уровень VLA-4 снижался во всех проанализированных подгруппах, но это было наиболее заметно для Th27.1 (среднее снижение: через 6 месяцев после лечения, 56%, через 12 месяцев после лечения, 58%) по сравнению с Th2 (через 6 месяцев после лечения, 52%, P = 0,038; через 12 месяцев после лечения, 54%, P = 0,005), Th27 (через 6 месяцев после лечения, 37%, P = 0,003; через 12 месяцев после лечения, 38%, P = 0,0009) и Th27 DP (через 6 месяцев после лечения). лечение, 49%, P = 0,002; 12 месяцев после лечения, 50%, P = 0,002; Рис. 6E). Это указывает на то, что клетки Th27.1 преимущественно нацелены на лечение натализумабом, предотвращая их трансмиграцию в ЦНС пациентов с рассеянным склерозом.
Патогенные клетки Th27.1 обладают превосходной способностью к трансмиграции в ЦНС при раннем рассеянном склерозе
Для дальнейшего изучения потенциала трансмиграции Th27.1 в ЦНС при рассеянном склерозе мы выполнили различные анализы трансмиграции in vitro и с использованием общих фракций Т-хелперных клеток памяти. Th27.1 был основной субпопуляцией Th27, мигрирующей через фильтры трансвелл к медиатору воспаления CXCL10 (Sorensen et al. , 2001) (рис.7A и B). Не наблюдалось миграции только в сторону среды (данные не показаны). В частности, клетки Th27.1 действительно демонстрировали спонтанную трансмиграцию через эндотелиальные слои мозга человека (hCMEC / D3), которая усиливалась в условиях привлечения CXCL10 (фиг. 7C и D).
Рисунок 7
Повышенный потенциал трансмиграции клеток Th27.1 в ЦНС и их рекрутирование в спинномозговую жидкость при раннем рассеянном склерозе. Всего Т-хелперных клеток памяти были отсортированы из здоровой крови и использованы для оценки in vitro трансмиграционной способности Th27, Th27.1 и Th27 DP через мембраны трансвеллеров ( A и B ; n = 6) и монослои эндотелиальных клеток головного мозга человека (BEC; C и D , n = 4) в направлении CXCL10. Каждый эксперимент проводился в пяти повторностях. Распределение субпопуляции Th27 оценивали до («контроль») и после миграции к среде или CXCL10 с использованием FACS. ( E и F ) Ex vivo Частоты DP Th27, Th27.1 и Th27 CCR6 + Т-хелперных клеток в парной спинномозговой жидкости и крови четырех пациентов с ранним рассеянным склерозом.( G ) Присутствие клеток Th27.1 в образцах крови 21 CIS-CIS, 26 CIS-CDMS и 13 ранее не получавших лечения пациентов с RRMS, а также 12 здоровых контролей (HC), как определено FACS. * P <0,05.
Рисунок 7
Повышенный потенциал трансмиграции клеток Th27.1 в ЦНС и их рекрутирование в спинномозговую жидкость при раннем рассеянном склерозе. Всего Т-хелперных клеток памяти были отсортированы из здоровой крови и использованы для оценки in vitro трансмиграционной способности Th27, Th27.1 и Th27 DP через мембраны трансвеллеров ( A и B ; n = 6) и монослои эндотелиальных клеток головного мозга человека (BEC; C и D , n = 4) в направлении CXCL10. Каждый эксперимент проводился в пяти повторностях. Распределение субпопуляции Th27 оценивали до («контроль») и после миграции к среде или CXCL10 с использованием FACS. ( E и F ) Ex vivo Частоты DP Th27, Th27.1 и Th27 CCR6 + Т-хелперных клеток в парной спинномозговой жидкости и крови четырех пациентов с ранним рассеянным склерозом.( G ) Присутствие клеток Th27.1 в образцах крови 21 CIS-CIS, 26 CIS-CDMS и 13 ранее не получавших лечения пациентов с RRMS, а также 12 здоровых контролей (HC), как определено FACS. * P <0,05.
Кроме того, анализ проточной цитометрии ex vivo выявил обогащение Th27.1 по сравнению с Th27 и Th27 DP клетками в спинномозговой жидкости по сравнению с парными образцами крови четырех пациентов с ранней стадией рассеянного склероза (три CIS и один RRMS; Таблица 1, Рис. 7E и F). Последовательно понижал Th27.1 частоты были обнаружены в крови у 26 пациентов CIS-CDMS по сравнению с 21 пациентом CIS-CIS ( P = 0,019), а также у 13 пациентов с RRMS по сравнению с 12 подобранными здоровыми контрольными пациентами ( P = 0,031; рис. 7G и дополнительная таблица 1). Как Th27.1, так и Th27 DP-клеток были в большом количестве в спинномозговой жидкости по сравнению с кровью пациентов с поздней стадией рассеянного склероза (дополнительный рисунок 2).
Наконец, чтобы подтвердить, что Th27.1 является отдельной провоспалительной субпопуляцией Th27, мы оценили экспрессию ключевых регуляторов дифференцировки и патогенности Th27.Наряду с VLA-4 (см. Также рис. 6D), CD161, CD226, ABCB1 (MDR1), IL23R , STAT4 , FCMR (TOSO) и GZMB (гранзим B; все активированы), а также CD25 и , BATF (с пониженной регуляцией) были дискриминационными маркерами для Th27.1 (дополнительная таблица 3 и дополнительный рисунок 3). Обильная экспрессия T-bet, RORγt, IFN-γ и GM-CSF в клетках Th27.1 (дополнительный рисунок 4) подтвердила ярко выраженные особенности Th2 этого подмножества Th27 (Paulissen et al., 2015).
В совокупности эти данные демонстрируют склонность клеток Th27.1 рекрутировать в ЦНС и опосредовать активность заболевания при раннем рассеянном склерозе.
Обсуждение
В этом исследовании мы демонстрируем, что экспрессирующие IFN-γ и GM-CSF Th2-подобные клетки Th27 (CCR6 + CXCR3 + ) избирательно связаны с ранней активностью заболевания у пациентов с рассеянным склерозом. Во время начала заболевания высокоактивированные и эффекторные Th2-подобные Th2-клетки памяти заметно уменьшаются в периферической крови и представляют собой основную популяцию провоспалительных Т-клеток в спинномозговой жидкости.Это местное рекрутирование, по-видимому, было преимущественно нацелено на лечение натализумабом для предотвращения последующих рецидивов рассеянного склероза, поскольку Th2-подобная субпопуляция Th27, названная Th27.1, и никакие другие субпопуляции Т-хелперов, преимущественно накапливались в крови пациентов без рецидива. Текущая работа обеспечивает глубокое понимание провоспалительной способности отдельных субпопуляций CCR6 + T-хелперов в течение рассеянного склероза (Cao et al. , 2015) и предлагает новые возможности для точной настройки одобренных в настоящее время Т-клеточное лечение пациентов с рассеянным склерозом.
Использование CCR6 и CXCR3 в качестве различающих маркеров для клеток Th27 не только отражает их провоспалительное состояние, но также их способность мигрировать в местные воспалительные участки. Предыдущие исследования клеток Th27 при экспериментальном аутоиммунном энцефаломиелите и рассеянном склерозе в основном были сосредоточены на однократной экспрессии CCR6 (Cao et al. , 2015) или IL-17, который повышается в крови и в дальнейшем активируется в спинномозговой жидкости во время рецидива ( Brucklacher-Waldert et al., 2009 г.). Здесь мы продемонстрировали, что дополнительная экспрессия CXCR3 подразделяет человеческий CCR6 + Th27 на высокие (CXCR3 – ) и низкие (CXCR3 + ) продуценты IL-17A. В этих продуцентах IL-17 с низким содержанием , которые были чрезмерно представлены в CSF ранней стадии рассеянного склероза по сравнению с культурами Т-клеток крови, GM-CSF является основным провоспалительным цитокином, экспрессируемым вместе с IFN-γ. Вероятно, это вызвано их повышенным уровнем T-bet, а не RORγt, как ранее сообщалось для Т-хелперных клеток человека (Noster et al., 2014). Связь Th2-подобного Th27 (T-bet-зависимого) и не Th27 (RORγt-зависимого) с коротким временем до диагностики CDMS подтверждается экспрессией T-bet, а не RORγt в CD4 + T-клетках во время быстрое начало рассеянного склероза (Basdeo et al. , 2016). Th2-подобные клетки Th27 также были высокоактивированы после диагностики рассеянного склероза, что связано с важной ролью активации Т-клеток CD4 + в прогрессировании CIS (Corvol et al. , 2008).Это предполагает, что во время развития рассеянного склероза потеря регуляторной функции Т (Kleinewietfeld and Hafler, 2014) приводит к активации периферических Th2-подобных субпопуляций Th27, которые инфильтрируют ЦНС, опосредуя местное воспаление. В самом деле, Т-хелперы памяти пациентов с рецидивирующим рассеянным склерозом были более способны дифференцироваться в Th2-подобные клетки Th27, хотя и совместно продуцируют IFN-γ и IL-17 (Kebir et al. , 2009). Эти Т-хелперные клетки культивировали в присутствии IL-23, вызывая экспрессию RORγt, а затем и IL-17 (Noster et al., 2014). В нашем подходе, основанном на CCR6 и CXCR3, мы определили профили провоспалительных цитокинов Th27 и Th2-подобных популяций Th27 непосредственно из крови. Это может объяснить, почему мы идентифицировали IFN-γ / GM-CSF-, а не IL-17-продуцирующие клетки Th27, как наиболее провоспалительную подгруппу при раннем рассеянном склерозе, а также согласуются с минимальным влиянием IL-17 и сильным влиянием GM-CSF при индукции экспериментального аутоиммунного энцефаломиелита (Пономарев и др. , 2007; Хаак и др., 2009 г .; Codarri et al. , 2011). Для надлежащего анализа продукции цитокинов Th2-подобными клетками Th27 в CSF нам пришлось добавить IL-2 к краткосрочным культурам Т-клеток, индуцируя экспрессию GM-CSF (Noster et al. , 2014). Th2-подобные подмножества Th27 совместно продуцируют больше IFN-γ и GM-CSF, чем другие подмножества Т-клеток в CSF и их аналоги в крови. Наше открытие, что провоспалительные Th2-подобные клетки Th27 и особенно Th27.1 были высоко обогащены ЦСЖ пациентов с ранней стадией рассеянного склероза, согласуется с их пониженной частотой в крови (это исследование) и повышенным содержанием CD4 в ЦСЖ до Отношение CD14 у пациентов с CIS с коротким временем до CDMS (Nemecek et al., 2016). В соответствии с данными in situ и наблюдений в ткани головного мозга с рассеянным склерозом (Kebir et al. , 2009), небольшая фракция Th2-подобных Th27 и Th27.1 клеток крови и спинномозговой жидкости действительно продуцирует IFN-γ и IL-17. , но это было значительно меньше, чем их совместное производство IFN-γ и GM-CSF. Помимо Th27.1, клетки Th27 DP (IL-17 int ) также были обогащены в спинномозговой жидкости пациентов с поздней стадией рассеянного склероза, что позволяет предположить, что локальная продукция IL-17 в основном участвует в прогрессировании заболевания.Тем не менее, преобладание Th2-подобных клеток Th27 в спинномозговой жидкости при рассеянном склерозе и тканях мозга, наблюдаемое в этом исследовании, соответствует недавним открытиям, согласно которым воспаление ЦНС при рассеянном склерозе в значительной степени опосредуется инфильтрацией IFN-γ, а не IL-17-продуцирующих T клетки-помощники (Кунис и др. , 2013; Джонсон и др. , 2016; Хайбуллин и др. , 2017).
Th2-подобные клетки Th27 содержат несколько особенностей, способствующих их избирательному проникновению в ЦНС, хотя нельзя полностью исключить локальную пластичность Th27 (Korn and Kallies, 2017).Th2-подобные клетки Th27 продуцируют высокие уровни IFN-γ, вызывая экспрессию CXCL10 эндотелиальными клетками, способствуя опосредованной CXCR3 миграции в ЦНС (Kunis et al. , 2013; Paroni et al. , 2017), и тем самым активность рассеянного склероза (Mahad et al. , 2002), что подтверждается нашими результатами трансмиграции in vitro, и ex vivo, . Дополнительная экспрессия GM-CSF этой подгруппой может дополнительно нарушать регуляцию гематоэнцефалического барьера, как описано для моноцитов (Vogel et al., 2015). До экстравазации клетки Th27 используют отдельные молекулы, участвующие в катании и адгезии к эндотелиальным клеткам, которые активируются провоспалительными цитокинами и хемокинами (Engelhardt and Ransohoff, 2012; Larochelle et al. , 2012; Schneider). -Hohendorf и др. , 2014). Одной из этих молекул является α4β1-интегрин VLA-4, на который натализумаб нацелен, чтобы вызвать сильное сокращение лимфоцитов в спинномозговой жидкости при рассеянном склерозе (Stuve et al., 2006). В дополнение к предыдущей работе (Kivisakk et al. , 2009) мы теперь показываем, что только определенная Th2-подобная субпопуляция Th27, названная Th27.1, накапливается в крови пациентов с рассеянным склерозом, которые клинически реагируют на лечение натализумабом. Таким образом, эти избирательные эффекты могут быть полезны для прогнозирования отсутствия активности рассеянного склероза (Prosperini et al. , 2012) и понимания потенциальных летальных отскоков рассеянного склероза, которые возникают у пациентов, которые должны прекратить это лечение из-за повышенного риска прогрессирующего мультифокального склероза. лейкоэнцефалопатия (ПМЛ) (Sorensen et al., 2014 г .; Ларошель и др. , 2017). Рецидивы рассеянного склероза характеризуются быстрым притоком провоспалительных клеток в ЦНС, вызывая чрезмерное воспаление, потенциально приводящее к воспалительному синдрому восстановления иммунной системы (ВСВИ) ПМЛ (Tan et al. , 2011). Хотя это еще не доказано, заметное накопление Th27.1 в крови рассеянного склероза, леченной натализумабом, выдвигает их трансмиграцию в ЦНС как критический процесс во время этих осложнений.Из всех провоспалительных подмножеств Т-хелперов, определенных CCR6, CXCR3 и CCR4, Th27.1 выявил самые высокие уровни поверхностной экспрессии VLA-4 в крови при рассеянном склерозе, что объясняет их ограниченное нацеливание натализумабом. В соответствии с нашими результатами, уровни VLA-4 оказались выше на Th27, чем на Th2-клетках у пациентов с рассеянным склерозом, вероятно, опосредуя их доставку в ЦНС (Brucklacher-Waldert et al. , 2009). Однако, когда мы сравнивали отдельные субпопуляции Th27, т.е.е. CCR6 + Th27 (CXCR3 – CCR4 + ; IL-17 высокий ), Th27 DP (CXCR3 + CCR4 + ; IL-17 dim ) и Th27.112 (CXCR3 ) CCR4 – ; IL-17 low ) (Paulissen et al. , 2015), поверхностная экспрессия VLA-4, по-видимому, обратно пропорциональна их способности продуцировать IL-17, как это также описано для мышей (Rothhammer и др. , 2011). Преобладающая экспрессия VLA-4 на клетках Th27.1 тесно связана с зависимостью Т-хелперных клеток, продуцирующих IFN-γ, а не IL-17, от этого интегрина для их проникновения в ЦНС во время экспериментального аутоиммунного энцефаломиелита (Baron et al., 1993; Rothhammer et al. , 2011). Однако молекулы адгезии, отличные от VLA-4, должны быть приняты во внимание для альтернативных маршрутов трансмиграции провоспалительных клеток Th27 (Engelhardt and Ransohoff, 2012), особенно с учетом эффектов отскока после прекращения приема натализумаба при рассеянном склерозе.
Это поперечное исследование демонстрирует, что более точная оценка рецепторов на поверхности хемокинов, провоспалительных цитокинов и молекул адгезии необходима для лучшего понимания вклада Th2 и Th27 человека в рассеянный склероз и другие аутоиммунные и нейровоспалительные заболевания.Основываясь на экспрессии CCR6 / CXCR3, IFN-γ / GM-CSF и VLA-4, мы идентифицируем Th2-подобный Th27 как клинически значимую популяцию Т-лимфоцитов CD4 + во время начала заболевания и лечения пациентов с рассеянным склерозом. Дальнейшая работа по локализации и антигенной специфичности этих подмножеств в поражениях головного мозга человека будет иметь решающее значение для определения их местного воздействия на миелин и потерю аксонов при рассеянном склерозе. Выраженная ассоциация Th2-подобных клеток Th27, в частности Th27.1, с активностью при рассеянном склерозе предполагает возможность более специфической терапии, нацеленной на Т-клетки, и призывает к дальнейшей оценке использования натализумаба на ранних этапах развития рассеянного склероза. (Николас и др., 2014).
Финансирование
Эта работа стала возможной при поддержке голландского исследовательского фонда MS (15-490d MS). Благодарим Фонд Забаваса за дополнительную финансовую поддержку (G2015 / 137).
Дополнительные материалы
Дополнительные материалы доступны по адресу Brain онлайн.
Сокращения
CDMS
клинически определенный рассеянный склероз
CIS
клинически изолированный синдром
GM-CSF
гранулоцитный макрофаг 9704 9704 9705000 RRM 9705
Аббревиатуры
Список литературы
Acosta-Rodriguez
EV
,Rivino
L
,Geginat
J
,Jarrossay
D
,Gattorno
et al.
Поверхностный фенотип и антигенная специфичность Т-хелперных клеток памяти, продуцирующих интерлейкин 17 человека
.Nat Immunol
2007
;8
:639
–46
.Annunziato
F
,Cosmi
L
,Liotta
F
,Maggi
E
,Romagnani
S
.Основные характеристики Т-хелперных 17 клеток человека
.Ann N Y Acad Sci
2013
;1284
:66
–70
.Baron
JL
,Madri
JA
,Ruddle
NH
,Hashim
G
,Janeway
CA
Jr. требуется для их попадания в паренхиму головного мозга.J Exp Med
1993
;177
:57
–68
.Basdeo
SA
,Келли
S
,О’Коннелл
K
,Tubridy
N
,McGuigan
C
,000000 FletcherFletcher
Повышенная экспрессия Tbet в CD4 (+) Т-клетках у пациентов с клинически изолированным синдромом с высоким риском конверсии в клинически определенный MS
.Springerplus
2016
;5
:779
.Bauer
M
,Brakebusch
C
,Coisne
C
,Sixt
M
,Wekerle
H
,Engelhardt и др. 9000
Интегрины бета1 дифференциально контролируют экстравазацию субпопуляций воспалительных клеток в ЦНС во время аутоиммунитета
.Proc Natl Acad Sci USA
2009
;106
:1920
–5
.Brucklacher-Waldert
V
,Stuerner
K
,Kolster
M
,Wolthausen
J
,Tolosa
E
.Фенотипическая и функциональная характеристика клеток Т-хелперов 17 при рассеянном склерозе
.Мозг
2009
;132 (Pt 12)
:3329
–41
.Cao
Y
,Товары
BA
,Raddassi
K
,Nepom
GT
,Kwok
WW
,Love et al.
, Love et al.
Функциональные воспалительные профили отличают миелин-реактивные Т-клетки от пациентов с рассеянным склерозом
.Sci Transl Med
2015
;7
:287ra74
.Codarri
L
,Gyulveszi
G
,Tosevski
V
,Hesske
L
,Fontana
A 9000 и др.
RORgammat стимулирует выработку цитокина GM-CSF в хелперных Т-клетках, который необходим для эффекторной фазы аутоиммунного нейровоспаления
.Nat Immunol
2011
;12
:560
–7
.Corvol
JC
,Pelletier
D
,Henry
RG
,Caillier
SJ
,Wang
J
,Pappas 9, et al.
Отмена покоя Т-клеток характеризует пациентов с высоким риском рассеянного склероза после начального неврологического события
.Proc Natl Acad Sci USA
2008
;105
:11839
–44
.Dendrou
CA
,Fugger
L
,Friese
MA
.Иммунопатология рассеянного склероза
.Nat Rev Immunol
2015
;15
:545
–58
.Duhen
T
,Campbell
DJ
.IL-1beta способствует дифференцировке полифункциональных клеток CCR6 + CXCR3 + Th2 / 17 человека, которые специфичны для патогенных и комменсальных микробов
.J Immunol
2014
;193
:120
–9
.Эль-Бехи
M
,Ciric
B
,Dai
H
,Yan
Y
,Cullimore
M
,Safavi
Энцефалитогенность клеток T (H) 17 зависит от индуцированной IL-1 и IL-23 продукции цитокина GM-CSF
.Nat Immunol
2011
;12
:568
–75
.Энгельгардт
B
,Ransohoff
RM
.Захватить, ползти, пересечь: код Т-клеток для преодоления гематоэнцефалического барьера
.Trends Immunol
2012
;33
:579
–89
.Gagliani
N
,Amezcua Vesely
MC
,Iseppon
A
,Brockmann
L
,Xu
H
,,Клетки Th27 трансдифференцируются в регуляторные Т-клетки во время разрешения воспаления
.Природа
2015
;523
:221
–5
.Haak
S
,Croxford
AL
,Kreymborg
K
,Heppner
FL
,Pouly
S
,000 и др.IL-17A и IL-17F не вносят жизненно важный вклад в аутоиммунное нейровоспаление у мышей
.J Clin Invest
2009
;119
:61
–9
.Hartmann
FJ
,Khademi
M
,Aram
J
,Ammann
S
,Kockum
I
, и др., Константинеску 9000Связанный с рассеянным склерозом полиморфизм IL2RA контролирует продукцию GM-CSF в TH-клетках человека
.Нац Коммуна
2014
;5
:5056
.Johnson
MC
,Pierson
ER
,Spieker
AJ
,Nielsen
AS
,Posso
S
,000 и др.Отчетливые сигнатуры Т-клеток определяют подгруппы пациентов с рассеянным склерозом
.Neurol Neuroimmunol Neuroinflamm
2016
;3
:e278
.Кебир
H
,Иферган
I
,Альварес
JI
,Бернар
M
,Пуарье
J
,и др.
,Arbor
Предпочтительное привлечение экспрессирующих интерферон-гамма клеток Th27 при рассеянном склерозе
.Ann Neurol
2009
;66
:390
–402
.Kebir
H
,Kreymborg
K
,Ifergan
I
,Dodelet-Devillers
A
,Cayrol
R
et al.,Лимфоциты Th27 человека способствуют разрушению гематоэнцефалического барьера и воспалению центральной нервной системы
.Nat Med
2007
;13
:1173
–5
.Хайбуллин
T
,Иванова
V
,Мартынова
E
,Черепнев
G
,Хабиров
F
, и др.Granatov4
Повышенный уровень провоспалительных цитокинов в спинномозговой жидкости больных рассеянным склерозом
.Фронт Иммунол
2017
;8
:531
.Kivisakk
P
,Healy
BC
,Viglietta
V
,Quintana
FJ
,Hootstein
MA
er, WeinЛечение натализумабом связано с периферической секвестрацией провоспалительных Т-клеток
.Неврология
2009
;72
:1922
–30
.Kleinewietfeld
M
,Hafler
DA
.Регуляторные Т-клетки при аутоиммунном нейровоспалении
.Immunol Rev
2014
;259
:231
–44
.Korn
T
,Kallies
A
.Т-клеточные ответы в центральной нервной системе
.Nat Rev Immunol
2017
;17
:179
–94
.Kunis
G
,Baruch
K
,Rosenzweig
N
,Kertser
A
,Miller
O
,000 и др.000 BerkutzIFN-гамма-зависимая активация сосудистого сплетения головного мозга для иммунного надзора и восстановления ЦНС
.Мозг
2013
;136 (Pt 11)
:3427
–40
.Ларошель
C
,Альварес
JI
,Прат
A
.Как иммунные клетки преодолевают гематоэнцефалический барьер при рассеянном склерозе?
FEBS Lett
2011
;585
:3770
–80
.Larochelle
C
,Cayrol
R
,Kebir
H
,Alvarez
JI
,Lecuyer
MA
, Ifergan и др.Молекула адгезии клеток меланомы идентифицирует энцефалитогенные Т-лимфоциты и способствует их привлечению к центральной нервной системе
.Мозг
2012
;135 (Pt 10)
:2906
–24
.Larochelle
C
,Metz
I
,Lecuyer
MA
,Terouz
S
,Roger
M
,Arbor N
, и др.Иммунологическая и патологическая характеристика фатальной рикошетной активности МС после отмены натализумаба
.Mult Scler
2017
;23
:72
–81
.Lopes Pinheiro
MA
,Kamermans
A
,Garcia-Vallejo
JJ
,van Het Hof
B
,Wierts
000
,L
, и другие.Интернализация и презентация миелиновых антигенов эндотелием головного мозга определяет миграцию антиген-специфических Т-клеток
.Элиф
2016
;5
:e13149
.Lozano
E
,Joller
N
,Cao
Y
,Kuchroo
VK
,Hafler
DA
.Взаимодействие CD226 / CD155 регулирует провоспалительный (Th2 / Th27) / противовоспалительный (Th3) баланс у людей
.J Immunol
2013
;191
:3673
–80
.Lunemann
JD
,Tintore
M
,Messmer
B
,Strowig
T
,Rovira
A
, и др.Повышенные иммунные ответы ядерного антигена-1, кодируемые вирусом Эпштейна-Барра, предсказывают превращение в рассеянный склероз
.Ann Neurol
2010
;67
:159
–69
.Mahad
DJ
,Howell
SJ
,Woodroofe
MN
.Экспрессия хемокинов в спинномозговой жидкости и корреляция с клинической активностью заболевания у пациентов с рассеянным склерозом
.J Neurol Neurosurg Psychiatry
2002
;72
:498
–502
.Миллер
DH
,Мангольд
DT
,Ciccarelli
O
.Клинически изолированные синдромы
.Ланцет нейрол
2012
;11
:157
–69
.Nemecek
A
,Zimmermann
H
,Rubenthaler
J
,Fleischer
V
,Paterka
M
и др.,, LuessПроточно-цитометрический анализ соотношения Т-лимфоциты / моноциты при клинически изолированном синдроме выявляет пациентов с риском быстрого прогрессирования заболевания
.Mult Scler
2016
;22
:483
–93
.Николас
JA
,Racke
MK
,Imitola
J
,Boster
AL
.Натализумаб первой линии при рассеянном склерозе: обоснование, выбор пациентов, преимущества и риски
.Ther Adv Chronic Dis
2014
;5
:62
–8
.Noster
R
,Riedel
R
,Mashreghi
MF
,Radbruch
H
,Harms
L
,и др. Haftmann
Экспрессия IL-17 и GM-CSF антагонистически регулируется Т-хелперами человека
.Sci Transl Med
2014
;6
:241ra80
.Paroni
M
,Мальтийский
V
,De Simone
M
,Ranzani
V
,Larghi
P
,000 и др.000 FenoglioРаспознавание вирусных и аутоантигенов центральными клетками памяти Th2 и Th2 / Th27 у пациентов с рассеянным склерозом выявляет различные роли в иммунном надзоре и рецидивах
.J Allergy Clin Immunol
2017
;140
:797
–808
.Патерка
M
,Сиффрин
V
,Voss
JO
,Werr
J
,Hoppmann
N
,Gollan 9000
Роль привратника антиген-представляющих CD11c + клеток головного мозга в нейровоспалении
.EMBO J
2016
;35
:89
–101
.Paulissen
SM
,van Hamburg
JP
,Dankers
W
,Lubberts
E
.Роль и модуляция популяций клеток CCR6 + Th27 при ревматоидном артрите
.Цитокин
2015
;74
:43
–53
.Polman
CH
,O’Connor
PW
,Havrdova
E
,Hutchinson
M
,Kappos
L
,0004Рандомизированное плацебо-контролируемое исследование натализумаба при рецидивирующем рассеянном склерозе
.N Engl J Med
2006
;354
:899
–910
.Polman
CH
,Reingold
SC
,Banwell
B
,Clanet
M
,Cohen
JA
,Filipp4 et al.
Диагностические критерии рассеянного склероза: редакция 2010 г. критериев Макдональда
.Ann Neurol
2011
;69
:292
–302
.Пономарев
ED
,Шрайвер
LP
,Maresz
K
,Pedras-Vasconcelos
J
,Verthelyi
D
000 BПроизводство GM-CSF аутореактивными Т-клетками необходимо для активации микроглиальных клеток и начала экспериментального аутоиммунного энцефаломиелита
.J Immunol
2007
;178
:39
–48
.Poser
CM
,Paty
DW
,Scheinberg
L
,McDonald
WI
,Davis
FA
,Ebers
GC GCНовые диагностические критерии рассеянного склероза: руководство по протоколам исследований
.Ann Neurol
1983
;13
:227
–31
.Prosperini
L
,Gianni
C
,Barletta
V
,Mancinelli
C
,Fubelli
F
и др. BorriПредикторы отсутствия активности заболевания у пролеченных натализумабом пациентов с рассеянным склерозом
.J Neurol Sci
2012
;323
:104
–12
.Рамеш
R
,Кожая
L
,McKevitt
K
,Djuretic
IM
,Carlson
TJ
и др.Провоспалительные клетки Th27 человека избирательно экспрессируют Р-гликопротеин и невосприимчивы к глюкокортикоидам
.J Exp Med
2014
;211
:89
–104
.Ransohoff
RM
,Hafler
DA
,Lucchinetti
CF
.Рассеянный склероз-тихая революция
.Nat Rev Neurol
2015
;11
:134
–42
.Reboldi
A
,Coisne
C
,Baumjohann
D
,Benvenuto
F
,Bottinelli
D
, и др.,Регулируемое рецептором 6 C-C хемокинов проникновение клеток TH-17 в ЦНС через сосудистое сплетение необходимо для инициации EAE
.Nat Immunol
2009
;10
:514
–23
.Rothhammer
V
,Heink
S
,Petermann
F
,Srivastava
R
,Claussen
MC
, и др. 9000 Передачалимфоцитов Th27 в центральную нервную систему независимо от экспрессии интегрина альфа4 во время EAE
.J Exp Med
2011
;208
:2465
–76
.Runia
TF
,Jafari
N
,Siepman
DA
,Hintzen
RQ
.Усталость во время CIS является независимым предиктором последующего диагноза рассеянного склероза
.J Neurol Neurosurg Psychiatry
2015
;86
:543
–6
.Schneider-Hohendorf
T
,Rossaint
J
,Mohan
H
,Обвалка
D
,Breuer
J
,Kuhlmann
,Kuhlmann
Блокада VLA-4 способствует дифференциальным путям проникновения в ЦНС человека, включая скатывание PSGL-1 Т-клеток и MCAM-адгезию клеток Th27
.J Exp Med
2014
;211
:1833
–46
.Schumacher
GA
,Beebe
G
,Kibler
RF
,Kurland
LT
,Kurtzke
JF
,McDowell
и др.McDowell
Проблемы экспериментальных исследований терапии рассеянного склероза: отчет комиссии по оценке экспериментальных исследований терапии рассеянного склероза
.Ann N Y Acad Sci
1965
;122
:552
–68
.Sorensen
PS
,Koch-Henriksen
N
,Petersen
T
,Ravnborg
M
,Oturai
A
0004.Рецидив или возврат клинических рецидивов после прекращения терапии натализумабом у пациентов с высокоактивным РС
.J Neurol
2014
;261
:1170
–7
.Sorensen
TL
,Sellebjerg
F
,Jensen
CV
,Strieter
RM
,Ransohoff
RM
.Хемокины CXCL10 и CCL2: дифференциальное участие в интратекальном воспалении при рассеянном склерозе
.евро J Neurol
2001
;8
:665
–72
.Stromnes
IM
,Cerretti
LM
,Liggitt
D
,Harris
RA
,Goverman
JM
.Дифференциальная регуляция аутоиммунитета центральной нервной системы клетками T (H) 1 и T (H) 17
.Nat Med
2008
;14
:337
–42
.Stuve
O
,Marra
CM
,Jerome
KR
,Cook
L
,Cravens
PD
,Cepok
и др.Иммунное наблюдение за пациентами с рассеянным склерозом, получавшими натализумаб
.Ann Neurol
2006
;59
:743
–7
.Tan
IL
,McArthur
JC
,Clifford
DB
,Major
EO
,Nath
A
.Воспалительный синдром восстановления иммунитета при натализумаб-ассоциированном ПМЛ
.Неврология
2011
;77
:1061
–7
.фургон Nierop
GP
,Mautner
J
,Mitterreiter
JG
,Hintzen
RQ
,Verjans
GM
.Интратекальные CD8 Т-клетки пациентов с рассеянным склерозом распознают литические белки вируса Эпштейна-Барра
.Mult Scler
2016
;22
:279
–91
.van Nierop
GP
,van Luijn
MM
,Michels
SS
,Melief
MJ
,Janssen
M
, и др. LangerakФенотипическая и функциональная характеристика Т-клеток в поражениях белого вещества у пациентов с рассеянным склерозом
.Acta Neuropathol
2017
;134
:383
–401
.Vogel
DY
,Kooij
G
,Heijnen
PD
,Breur
M
,Peferoen
LA
, и др.van der
GM-CSF способствует миграции человеческих моноцитов через гематоэнцефалический барьер
.евро J Immunol
2015
;45
:1808
–19
.Weksler
BB
,Subileau
EA
,Perriere
N
,Charneau
P
,Holloway
K
,Leveque и др. 9000
Специфические свойства гематоэнцефалического барьера линии эндотелиальных клеток головного мозга взрослого человека
.FASEB J
2005
;19
:1872
–4
.Заметки автора
© Автор (ы) (2018).Опубликовано Oxford University Press от имени Гарантов Мозга. Все права защищены. Для получения разрешения обращайтесь по электронной почте: [email protected]
Почему давать полезно для здоровья – Cleveland Clinic
Все мы знаем, что благотворительность помогает другим, будь то волонтерство в организациях, эмоциональная поддержка окружающих или благотворительность. Но знаете ли вы, что теплое и нечеткое чувство, которое вы испытываете, помогая другим, на самом деле полезно для вас?
Клиника Кливленда – некоммерческий академический медицинский центр.Реклама на нашем сайте помогает поддерживать нашу миссию. Мы не поддерживаем продукты или услуги, не принадлежащие Cleveland Clinic. Политика
Исследования показывают, что пожертвования действительно могут улучшить ваше физическое и психическое здоровье. (Хорошие новости в современном мире, где многие люди страдают от эмоциональных осложнений глобальной пандемии.)
От волонтерства в столовой до сбора денег для конкретной благотворительной организации – пожертвования могут включать в себя следующие преимущества для здоровья:
- Пониженное артериальное давление.
- Повышенная самооценка.
- Меньше депрессии.
- Пониженный уровень стресса.
- Более длительный срок службы.
- Больше счастья и удовлетворения.
«Я помню, как дал своей дочери доллар на подарок на каникулах в начальной школе», – вспоминает психолог Скотт Беа, психолог. «Когда она вернулась домой, ей не терпелось сделать нам подарок, который она выбрала. Фактически, она настояла на том, чтобы мы открыли его немедленно ».
В удовольствии дарить подарки есть что-то, что заставляет нас чувствовать себя хорошо, но на самом деле это подтверждается наукой.
Исследования показывают, что у людей, которые оказывают социальную поддержку другим, артериальное давление ниже, чем у людей, которые этого не делают. Поддерживающее взаимодействие с другими также помогает людям оправиться от коронарных событий.
Исследователи также говорят, что люди, которые посвящают свое время помощи другим через участие в сообществе и в организации, обладают большей самооценкой, меньшей депрессией и более низким уровнем стресса, чем те, кто этого не делает.
Отдавая, вы можете жить дольше
Согласно одному исследованию, люди в возрасте 55 лет и старше, которые добровольно работали в двух или более организациях, имели на 44% меньше шансов умереть за пятилетний период, чем те, кто не был волонтером, – даже с учетом многих других факторов, включая возраст, физические упражнения. , общее состояние здоровья и вредные привычки, такие как курение.
Другое исследование выявило схожее количество пожилых людей, которые помогали друзьям, родственникам и соседям или оказывали эмоциональную поддержку своим супругам, по сравнению с теми, кто этого не делал.
Чувствовать себя счастливее
Биологически отдача может создавать «теплое сияние», активируя области мозга, связанные с удовольствием, связью с другими людьми и доверием. Это причина, по которой вы испытываете волнение, когда собираетесь сделать кому-то подарок (и почему вы чувствуете себя рядом с ним во время этого), или почему вы чувствуете себя счастливыми, возвращаясь с работы волонтером.
Есть свидетельства того, что во время подарочного поведения люди выделяют в нашем мозгу химические вещества, дающие хорошее самочувствие, такие как серотонин (химическое вещество, влияющее на настроение), дофамин (химическое вещество, улучшающее самочувствие) и окситоцин (химическое вещество, способствующее состраданию и укреплению связи). ).
Если вы посмотрите на функциональные МРТ субъектов, раздающих пожертвования в различные благотворительные организации, ученые обнаружили, что пожертвования стимулируют мезолимбический путь, который является центром вознаграждения в мозге, высвобождая эндорфины и создавая то, что известно как «кайф помощника».”
И, как и другие максимумы, этот тоже вызывает привыкание. Так что идите вперед и обратитесь к нуждающемуся, решите, каким благотворительным организациям вы хотите пожертвовать, и определите возможности для возвращения в свое сообщество. Ваше психическое и физическое здоровье будет вам благодарно, равно как и люди, которым вы помогаете.

