УМОЛЯЯЯЮ,ПОМОГИТЕ, ОЧЕНЬ СРОЧНОО На рисунке изображена модель электр… – Учеба и наука
выполните следующие задания: 1) определите химический элемент, атом которого имеет такое электронное строение; 2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент; 3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
При исследовании болотной воды в ней были обнаружены следующие ионы: Nh5+, S2-, NO3-. Для проведения качественного анализа к этой воде добавили раствор соляной кислоты.
- Какое изменение наблюдается при проведении описанного опыта? (Концентрация веществ достаточна для проведения анализа).
- Запишите сокращённое ионное уравнение протекающей химической реакции.
Дана схема окислительно-восстановительной реакции:
1) Составьте электронный баланс этой реакции;
2) Укажите окислитель и восстановитель;
3) Расставьте коэффициенты и запишите получившееся уравнение реакции.
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Из приведённого перечня выберите вещества, которые соответствуют указанным в таблице классам/группам органических соединений. Запишите в таблицу номера, под которыми указаны эти соединения.
Ароматический углеводород
Альдегид
В предложенные схемы химических реакций впишите структурные формулы пропущенных веществ, выбрав их из приведённого перечня веществ в задании 11. Расставьте коэффициенты в полученных схемах.
Пропионовая кислота является типичным представителем карбоновых кислот. Её применяют для получения лекарственных препаратов и душистых веществ, в качестве консерванта в пищевой промышленности. В лабораторных условиях пропионовую кислоту можно получить в соответствии с приведённой схемой превращений:
Впишите в заданную схему превращений структурную формулу вещества Х, выбрав его из предложенного перечня веществ в задании 11.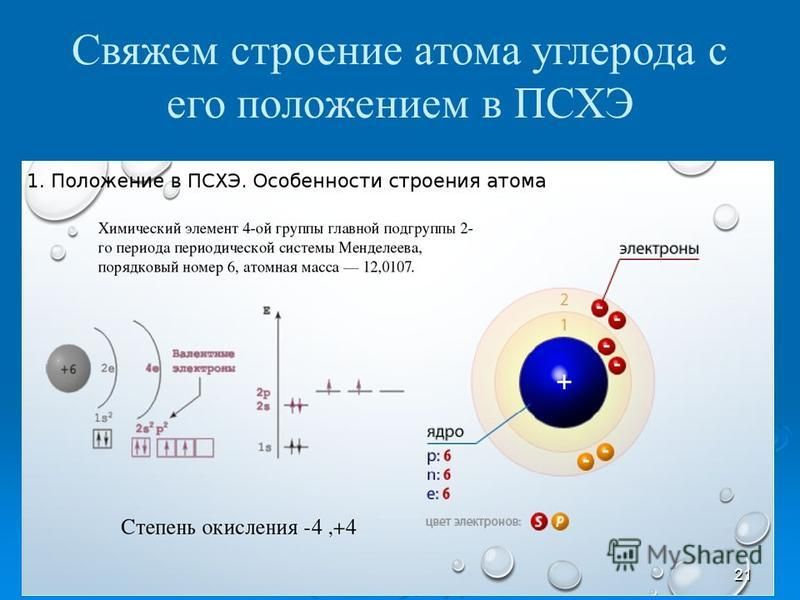 Запишите уравнения двух реакций, с помощью которых можно осуществить эти превращения. При написании уравнений реакций используйте структурные формулы органических веществ.
Запишите уравнения двух реакций, с помощью которых можно осуществить эти превращения. При написании уравнений реакций используйте структурные формулы органических веществ.
Одним из важных понятий в экологии и химии является «предельно допустимая концентрация» (ПДК). ПДК — это такая концентрация вредного вещества в окружающей среде, присутствуя в которой постоянно, данное вещество не оказывает в течение всей жизни прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не снижает работоспособности человека, не ухудшает его самочувствия и условий жизни.
ПДК хлора в воде плавательных бассейнов составляет 0,5 мг/м3.
Для хлорирования воды в дачном бассейне глубиной 1,0 м, шириной 1,5 м и длиной 2 м использовали 3,0 мг хлора. Определите и подтвердите расчётами, превышает ли концентрация хлора в воде данного бассейна значение ПДК. Предложите способ, позволяющий снизить концентрацию хлора в воде
 Массовая доля кислоты в электролите составляет 30%, остальное — дистиллированная вода. Рассчитайте массу серной кислоты и массу дистиллированной воды, которые взяты для приготовления 3 кг такого электролита. Запишите подробное решение задачи.
Массовая доля кислоты в электролите составляет 30%, остальное — дистиллированная вода. Рассчитайте массу серной кислоты и массу дистиллированной воды, которые взяты для приготовления 3 кг такого электролита. Запишите подробное решение задачи.Итоговая контрольная работа по химии | Тест по химии (8 класс) на тему:
Итоговая контрольная работа по химии за курс 8 класса
Вариант 1
- На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
2. Периодическая система химических элементов Д. И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах увеличиваются.
Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах увеличиваются.
Учитывая эти закономерности, расположите в порядке увеличения радиусов атомов следующие элементы: N, Р, Mg, Si Запишите обозначения элементов в нужной последовательности.
3. В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Характерные свойства веществ
Молекулярного строения | Ионного строения |
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — в расплавах и растворах проводят электрический ток |
Используя данную информацию, определите, какое строение имеют вещества угарный газ и хлорид алюминия.
1) угарный газ; 2) хлорид алюминия.
4. Сахароза применяется в пищевой промышленности, чаще всего для изготовления кондитерских изделий из сиропа- концентрированного раствора сахарозы. При упаривании 400 г 50%-ного раствора сахарозы получено 250 г раствора. Какова массовая доля сахарозы в нём? (Запишите число с точностью до десятых).
5. Напишите уравнения реакций разложения, схемы которых:
а) Mg + h4PO4 –> Мg3(PO4)2 + h3;
б) Al + O2 –>Al2O3 ;
в) KClO3 + P –> P2O5 + KCl;
Итоговая контрольная работа по химии за курс 8 класса
Вариант 2
- На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
- Периодическая система химических элементов Д. И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах увеличиваются.
Учитывая эти закономерности, расположите в порядке увеличения радиусов атомов следующие элементы: O, Al, Ga, P, S. Запишите обозначения элементов в нужной последовательности.
- В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Характерные свойства веществ
Молекулярного строения | Ионного строения |
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — в расплавах и растворах проводят электрический ток |
Используя данную информацию, определите, какое строение имеют вещества водороди соль нитрат калия Запишите ответ в отведённом месте:
1) водород; 2) соль нитрат калия
- Концентрированные солевые растворы часто советуются врачами для полоскания носоглотки при разных заболеваниях.
 Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Какова масса выпаренной при этом воды? (Запишите число с точностью до десятых).
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Какова масса выпаренной при этом воды? (Запишите число с точностью до десятых).
5. Напишите уравнения реакций разложения, схемы которых:
а) NaHCO3 –> Na2CO3 + CO2 + h3O
б) HI –> h3 + I2
в) KClO3 –> KCl + O2
Итоговая контрольная работа по химии за курс 8 класса
Вариант 3
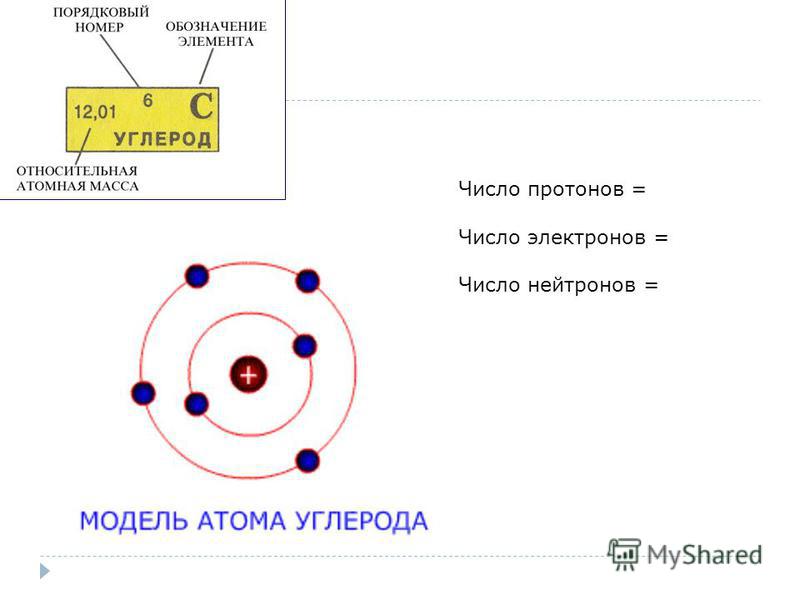
1. На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
2. Известно, что с увеличением порядкового номера элемента в периодах металлические свойства атомов уменьшаются, а в группах увеличиваются. Расположите в порядке увеличения металлических свойств, следующие элементы: N, Na, Mg, K. Запишите обозначения элементов в нужной последовательности.
Расположите в порядке увеличения металлических свойств, следующие элементы: N, Na, Mg, K. Запишите обозначения элементов в нужной последовательности.
3. В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Характерные свойства веществ
Молекулярного строения | Ионного строения |
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — в расплавах и растворах проводят электрический ток |
Используя данную информацию, определите, какое строение имеют вещества вода и графит.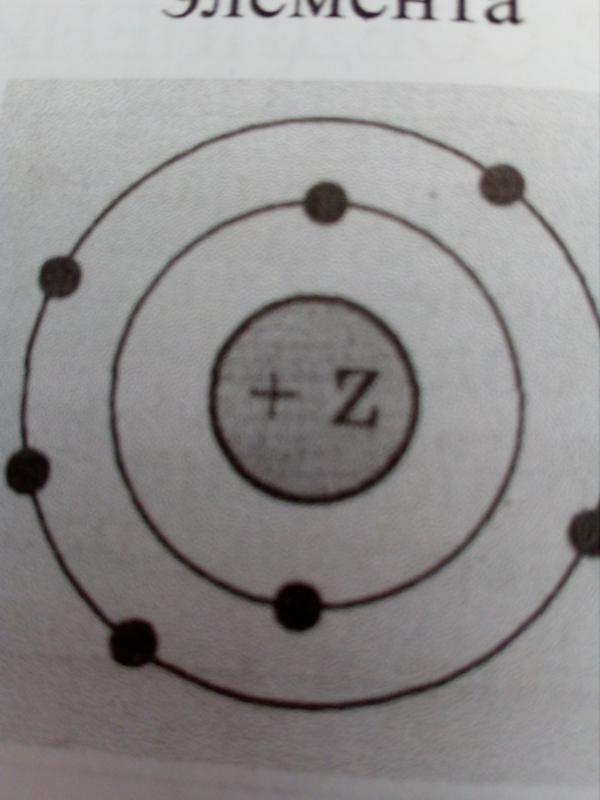
1) вода; 2) графит
4. Концентрированные солевые растворы часто советуются врачами для полоскания носоглотки при разных заболеваниях. Чему равна массовая доля соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг 15%-ного раствора этой соли? (Запишите число с точностью до десятых).
5. Напишите уравнения реакций разложения, схемы которых:
а) Al(OH)3 –> Al2O3 + h3O
б) Nh4 –> h3 + N2
в) KMnO4 –> K2MnO4 + MnO2 + O2
Итоговая контрольная работа по химии за курс 8 класса
Вариант 4
- На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
2. Известно, что с увеличением порядкового номера элемента в периодах металлические свойства атомов уменьшаются, а в группах увеличиваются. Расположите в порядке увеличения металлических свойств, следующие элементы: F, He, Si, S. Запишите обозначения элементов в нужной последовательности.
3. В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Характерные свойства веществ
Молекулярного строения | Ионного строения |
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — в расплавах и растворах проводят электрический ток |
Используя данную информацию, определите, какое строение имеют вещества сероводород и оксид натрия.
1) оксид натрия; 2) сероводород
4. Концентрированные солевые растворы часто советуются врачами для полоскания носоглотки при разных заболеваниях. Из 600 г 10%-го раствора соли необходимо приготовить 12%-й раствор. Сколько грамм требуется выпарить воды? (Ответ укажите с точностью до целых).
5. Напишите уравнения реакций разложения, схемы которых:
а) KHSO3 –> K2SO3 +SO2 + h3O
б) Nh5NO2 –> N2 + h3O
в) PbO2 –> PbO + O2
Атомная модель: определение и различные атомные модели
Атомная модель , которая менялась с течением времени, — это модель, используемая для описания структуры и состава атома. Атом как компонент Вселенной был предметом обширного изучения, чтобы понять, как атомы составляют Вселенную.
Концепция атома
Концепция атома принадлежит греческому философу Демокриту. Он заявил, что вся материя состоит из неделимых частиц, называемых атомами, окруженных пустым пространством. Были и другие теории, пока наше современное представление об атоме не было сформулировано в XIX веке. ом и 20 веками.
ом и 20 веками.
Состав атома
В классической модели атом состоит из более мелких частиц с электрическим зарядом, известных как электроны и протоны. В атоме также есть третий, нейтральный тип частиц, известный как нейтроны. Атомные модели стремятся понять, как эти частицы составляют атом. Классический состав атома следующий:
| Частица | Протон | Электрон | Neutron |
| Элементный заряд | +1 | -1 | 0 |
| Символ | P | E | N |
Какие пять моделей атома?
Существует пять основных моделей атома, которые были предложены с течением времени, каждая из которых связана с пониманием атома в то время. Модели: атомная модель Дальтона, атомная модель Томсона, атомная модель Резерфорда, атомная модель Бора и квантовая модель атома.
Модели: атомная модель Дальтона, атомная модель Томсона, атомная модель Резерфорда, атомная модель Бора и квантовая модель атома.
Модель атома Дальтона
Джон Дальтон был английским ученым, предложившим первую современную модель атома. Он предположил, что вся материя состоит из неделимых атомов. Вот некоторые из свойств, которые Дальтон связывал с атомом:
- Все атомы одного и того же элемента имеют одинаковую массу.
- Атомы не могут делиться на более мелкие частицы.
- Когда происходит любая химическая реакция, атомы перестраиваются.
- Молекулы состоят из нескольких видов атомов каждого отдельного элемента, а химические соединения имеют разное соотношение элементов.
Рисунок 1. Модель атома Дальтона предполагала, что атомы неделимы и различны для каждого элемента. Источник: Мануэль Р. Камачо, StudySmarter.
Модель атома Томсона
С открытием электрона британским ученым Дж. Дж. Томсоном стало ясно, что атом состоит из еще более мелких частиц, ответственных за перемещение электрического заряда.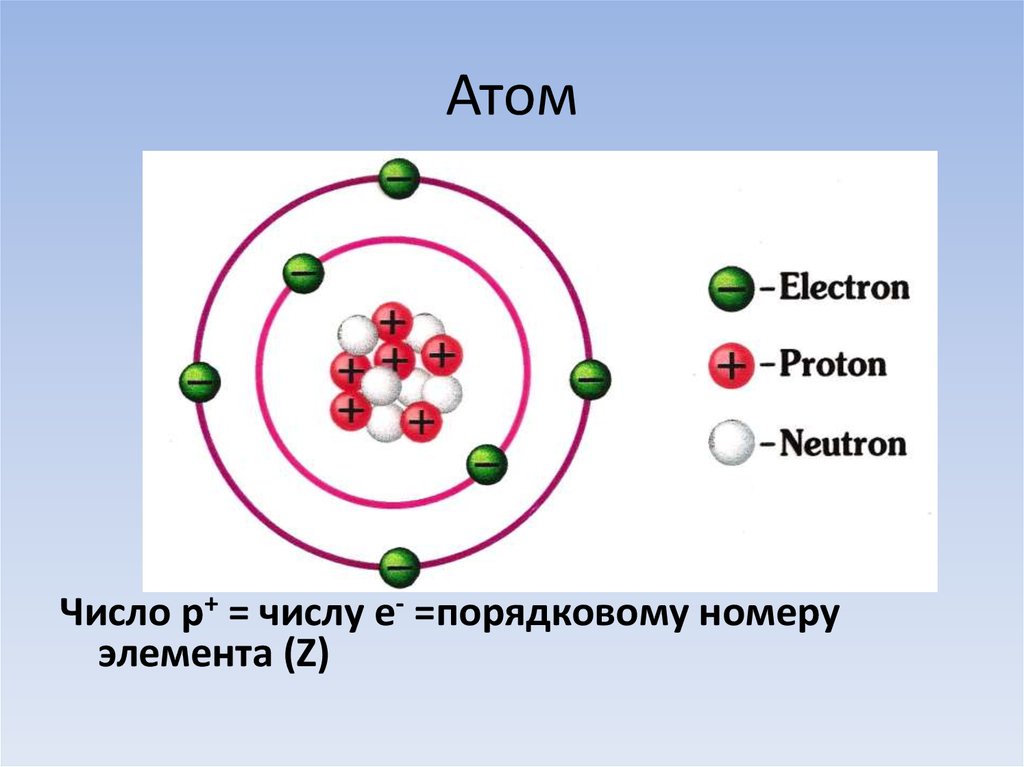
Ученые во времена Томсона считали, что атомы по существу нейтральны. Томсон предположил, что атомы имеют маленькие отрицательные частицы, плавающие над жидкостью с положительным зарядом. Эта модель также известна как модель сливового пудинга.
Рисунок 2. Модель атома Томсона предлагала суп, заряженный положительно, с электронами, плавающими сверху. Источник: Мануэль Р. Камачо, StudySmarter.
Модель атома Резерфорда
Новозеландский ученый Эрнест Резерфорд разработал несколько экспериментов вместе с немецким ученым Гансом Гейгером. Эксперименты, проведенные студентом по имени Эрнест Марсден, обстреливали частицами тонкую фольгу из золота.
Если бы атом представлял собой твердую каплю, состоящую из положительно заряженных частиц с несколькими электронами наверху, как предполагалось в атомной модели Томсона, то большая часть вспыхнувших частиц не достигла бы другой стороны фольги. Однако эксперимент показал, что Томсон ошибался. Атом был почти пуст внутри, так как немногие частицы, вылетающие из фольги, попадали в ядра атомов.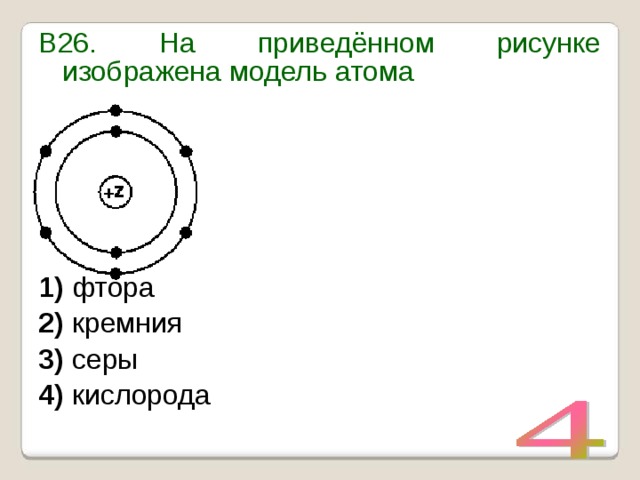
Резерфорд предположил, что атом содержит ядра со всеми положительными зарядами, сосредоточенными в центре. В модели электроны вращались вокруг центра.
Рис. 3. Модель атома Резерфорда предполагала, что электроны движутся вокруг ядра по орбитам. Источник: Мануэль Р. Камачо, StudySmarter.
Модель атома Бора
Модель Резерфорда не получила полного признания. Зная, что движущиеся заряды выделяют энергию в виде электромагнитного излучения, электроны должны терять свою кинетическую энергию. Потеряв свою кинетическую энергию, электроны должны падать на ядро, притягиваемое электростатической силой. Несоответствия в атомной модели Резерфорда побудили датского ученого Нильса Бора предложить новую модель.
Модель атома Бора была похожа на модель Резерфорда. Разница между ними касается вопроса о том, как движутся электроны. Согласно Бору, электроны могут двигаться только по определенным орбитам, в зависимости от их энергетического уровня, и они могут двигаться вверх и вниз по орбитам, высвобождая или поглощая энергию. Правила, предложенные Бором, таковы:
Правила, предложенные Бором, таковы:
- Электроны могут занимать определенные орбиты в зависимости от их энергетического уровня.
- Каждая орбита имеет определенный уровень энергии.
- При прыжках между орбитами энергия должна поглощаться или выделяться электронами.
- Энергия, испускаемая в виде излучения, может быть рассчитана по разнице энергетических уровней между орбитами. Говорят, что эта энергия квантуется.
Рисунок 4. Модель атома Бора предполагала, что электроны движутся вокруг атома по орбитам, а также перескакивают на разные орбиты в зависимости от их энергетического уровня. Энергия каждого уровня имеет фиксированное значение, и электроны прыгают вверх и вниз, поглощая или испуская излучение. Источник: Мануэль Р. Камачо, StudySmarter.
Модель Бора может объяснить атом водорода, электрон которого уникален тем, что не взаимодействует с другими электронами, вращающимися вокруг атома. Однако он не смог объяснить более сложные элементы или эффекты.
Квантовая модель атома
Квантовая модель атома на сегодняшний день является наиболее подробной моделью того, как устроен атом и как он работает. Он был разработан при участии Эрвина Шредингера, Вернера Карла Гейзенберга и Луи де Бройля. Эта модель является расширением модели Бора за счет добавления концепции корпускулярно-волнового дуализма и способна объяснить более сложные атомы, чем водород.
Квантовая модель предполагает, что материя может вести себя как волны и что электроны движутся вокруг атома по орбиталям . Орбиталь — это область, в которой существует более высокая вероятность движения электрона. В этой модели электроны не могут быть точно расположены, а орбитали определяются как облака вероятности.
Рис. 5. Атом с четырьмя орбиталями, т. е. облаками, в которых могут находиться электроны. Источник: Мануэль Р. Камачо, StudySmarter.
Атомная модель — основные выводы
- Модель атома прошла различные этапы развития с различным пониманием структуры и состава атома.

- Греческий философ Демокрит понимал, что вся материя состоит из одних и тех же маленьких объектов, называемых атомами.
- Модель Дальтона предполагает, что химические реакции являются результатом перегруппировки атомов, составляющих объект.
- Последующие модели атома, такие как модели, предложенные Томсоном и Резерфордом, изменили наши представления о заряде атома, поскольку они включали электрические заряды и описывали, как они распределяются в атоме.
- Модель Бора и квантовая модель атома изменили наше представление о природе атома и о том, как в нем взаимодействуют электроны. В модели Бора электроны перемещаются между орбитами в зависимости от их энергетических уровней. Квантовая модель ввела неопределенность в том смысле, что считается, что электроны движутся в определенных областях, и мы не можем определить их положение за пределами вероятности их существования в определенном положении.
Атомная структура: модель Бора
Обновлено: 26-07-2021
Органическая химия I Для чайников
Исследовать книгу Купить на Amazon
В настоящее время используются две модели строения атома: модель Бора и квантово-механическая модель.
Модель полезна, поскольку помогает понять, что наблюдается в природе. Нет ничего необычного в том, что более одной модели представляют и помогают людям понять конкретную тему.
Вы когда-нибудь покупали цветные кристаллы для своего камина, чтобы сделать пламя разных цветов? Или вы когда-нибудь смотрели фейерверк и задавались вопросом, откуда берутся цвета?Цвет исходит от разных элементов. Если посыпать огонь поваренной солью, получится желтый цвет. Соли, содержащие медь, дают зеленовато-голубое пламя. И если вы посмотрите на пламя через спектроскоп
Нильс Бор, датский ученый, объяснил этот линейчатый спектр при разработке модели атома:
Модель Бора показывает, что электроны в атомах находятся на орбитах с разной энергией вокруг ядра (представьте, что планеты вращаются вокруг Солнца).

Бор использовал термин энергетических уровней (или оболочек ) для описания этих орбит различной энергии. Он сказал, что энергия электрона
Энергетический уровень, который обычно занимает электрон, называется его 9-м уровнем.0159 основное состояние . Но он может перейти на более энергетический, менее стабильный уровень или оболочку, поглощая энергию. Это менее стабильное состояние с более высокой энергией называется возбужденным состоянием электрона .
После возбуждения электрон может вернуться в исходное основное состояние, высвобождая поглощенную им энергию, как показано на диаграмме ниже.
Иногда энергия, выделяемая электронами, занимает часть


 Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Какова масса выпаренной при этом воды? (Запишите число с точностью до десятых).
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Какова масса выпаренной при этом воды? (Запишите число с точностью до десятых).

