8 класс. Химия. Электронная оболочка атома – Электронная оболочка атома
Комментарии преподавателяСостояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
Рис. 1. Бор Нильс Хендрих Давид (1885–1962)
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями.
Правила распределения электронов
Ядро находится в центре атома каждого элемента, а электроны, образующие электронную оболочку, размещаются вокруг ядра слоями.
Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент.
Например, натрий Na – элемент 3-го периода, значит, его электронная оболочка включает 3 энергетических уровня. В атоме брома Br – 4 энергетических уровня, т. к. бром расположен в 4-м периоде (Рис. 2).
Модель атома натрия: Модель атома брома:
Рис. 2. Модели строения электронных оболочек атомов натрия и брома
Максимальное число электронов на энергетическом уровне рассчитывается по формуле: 2n2, где n – номер энергетического уровня.
Таким образом, максимальное число электронов на:
1 слое – 2
2 слое – 8
3 слое – 18 и т. д.
У элементов главных подгрупп номер группы, к которой относится элемент, равен числу внешних электронов атома.
Внешними называют электроны последнего электронного слоя.
Например, в атоме натрия – 1 внешний электрон (т. к. это элемент IА подгруппы). В атоме брома – 7 электронов на последнем электронном слое (это элемент VIIА подгруппы).
Строение электронных оболочек элементов 1–3 периодов
В атоме водорода заряд ядра равен +1, и этот заряд нейтрализуется единственным электроном (Рис. 3).
Рис. 3. Схема строения атома водорода
Следующий за водородом элемент – гелий, тоже элемент 1-го периода. Следовательно, в атоме гелия 1 энергетический уровень, на котором размещаются два электрона (Рис. 4). Это максимально возможное число электронов для первого энергетического уровня.
Рис 4. Схема строения атома гелия
Элемент № 3 – это литий. В атоме лития 2 электронных слоя, т. к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое –1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (Рис. 5).
Рис. 5. Схемы строения атомов лития и бериллия
Аналогично можно изобразить схемы строения атомов остальных элементов второго периода (Рис. 6).
Рис. 6. Схемы строения атомов некоторых элементов второго периода
В атоме последнего элемента второго периода – неона – последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя). Неон – инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
После неона следует элемент 3-го периода – натрий. В атоме натрия – 3 электронных слоя, на которых расположены 11 электронов (Рис. 7).
Na
Рис. 7. Схема строения атома натрия
Натрий находится в 1 группе, его валентность в соединениях равна I, как и у лития. Это связано с тем, что на внешнем электронном слое атомов натрия и лития находится 1 электрон.
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.
Строение атомов остальных элементов третьего периода можно представить по аналогии со строением атомов элементов 2-го периода.
Строение электронных оболочек элементов 4 периода
Четвертый период включает в себя 18 элементов, среди них есть элементы как главной (А), так и побочной (В) подгрупп. Особенностью строения атомов элементов побочных подгрупп является то, что у них последовательно заполняются предвнешние (внутренние), а не внешние электронные слои.
Четвертый период начинается с калия. Калий – щелочной металл, проявляющий в соединениях валентность I. Это вполне согласуется со следующим строением его атома. Как элемент 4-го периода, атом калия имеет 4 электронных слоя. На последнем (четвертом) электронном слое калия находится 1 электрон, общее количество электронов в атоме калия равно 19 (порядковому номеру этого элемента) (Рис. 8).
Рис. 8. Схема строения атома калия
За калием следует кальций. У атома кальция на внешнем электронном слое будут располагаться 2 электрона, как и у бериллия с магнием (они тоже являются элементами II А подгруппы).
Следующий за кальцием элемент – скандий. Это элемент побочной (В) подгруппы. Все элементы побочных подгрупп – это металлы. Особенностью строения их атомов является наличие не более 2-х электронов на последнем электронном слое, т. е. последовательно заполняться электронами будет предпоследний электронный слой.
Так, для скандия можно представить следующую модель строения атома (Рис.
Рис. 9. Схема строения атома скандия
Такое распределение электронов возможно, т. к. на третьем слое максимально допустимое количество электронов – 18, т. е. восемь электронов на 3-м слое – это устойчивое, но не завершенное состояние слоя.
У десяти элементов побочных подгрупп 4-го периода от скандия до цинка последовательно заполняется третий электронный слой.
Схему строения атома цинка можно представить так: на внешнем электронном слое – два электрона, на предвнешнем – 18 (Рис. 10).
Рис. 10. Схема строения атома цинка
Следующие за цинком элементы относятся к элементам главной подгруппы: галлий, германий и т. д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
Подведение итога урока
На этом уроке вы узнали, как устроена электронная оболочка атома и как объяснить явление периодичности.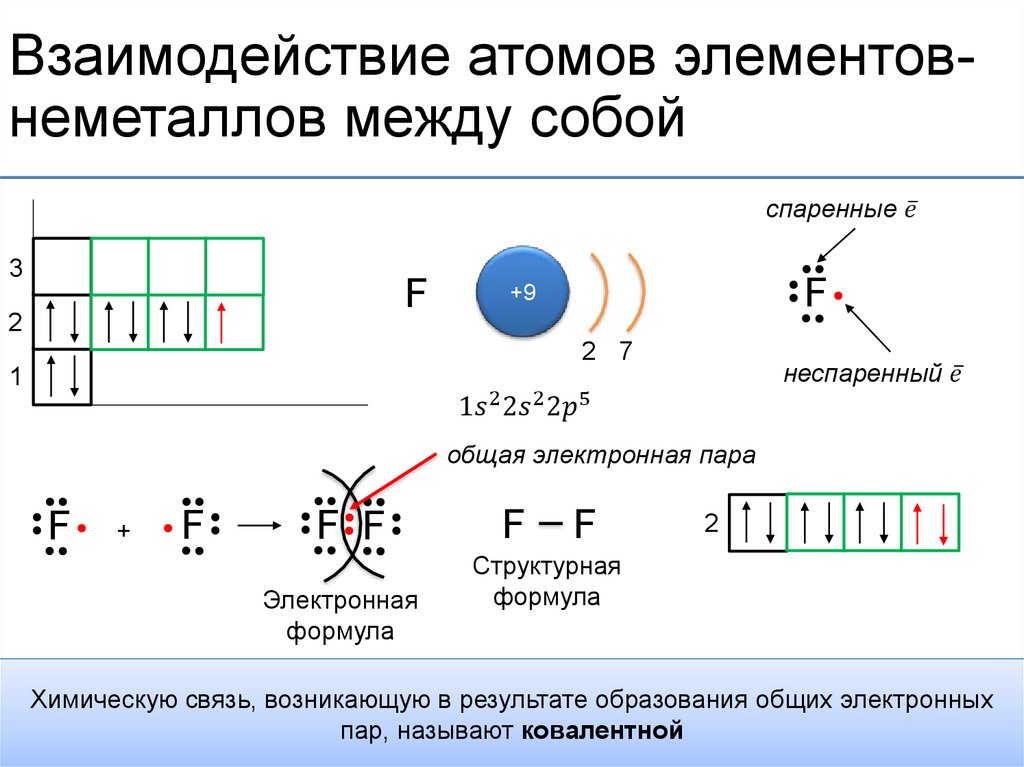 Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Источники
http://www.youtube.com/watch?t=7&v=xgPDyORYV_Q
http://www.youtube.com/watch?v=RNu0Ql4Htjg
http://www.youtube.com/watch?v=8h3nw8m3x6k
заставка http://www.youtube.com/watch?v=z0Muwg71Rmc
источник презентации – http://www.myshared.ru/slide/834600/#
Конспект http://interneturok.ru/ru/school/chemistry/8-klass
основные сведения о строении атома. химический элемент
Содержание
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е =+11Na+ 1s22s22p63s
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора обраузется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома
Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому аргона.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s 2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s 2p
7. Электронная формула фтора:
8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s 2p 3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s 2p 3s 3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p1 1s 2s 2p 3s 3p
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s 2s 2p 3s 3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s 2p 3s 3p
13. Электронная формула хлора:
14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s 2p 3s 3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s 2p
16. Электронная формула бериллия в возбуждённом состоянии:
Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s 2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s
Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня
Строение атома
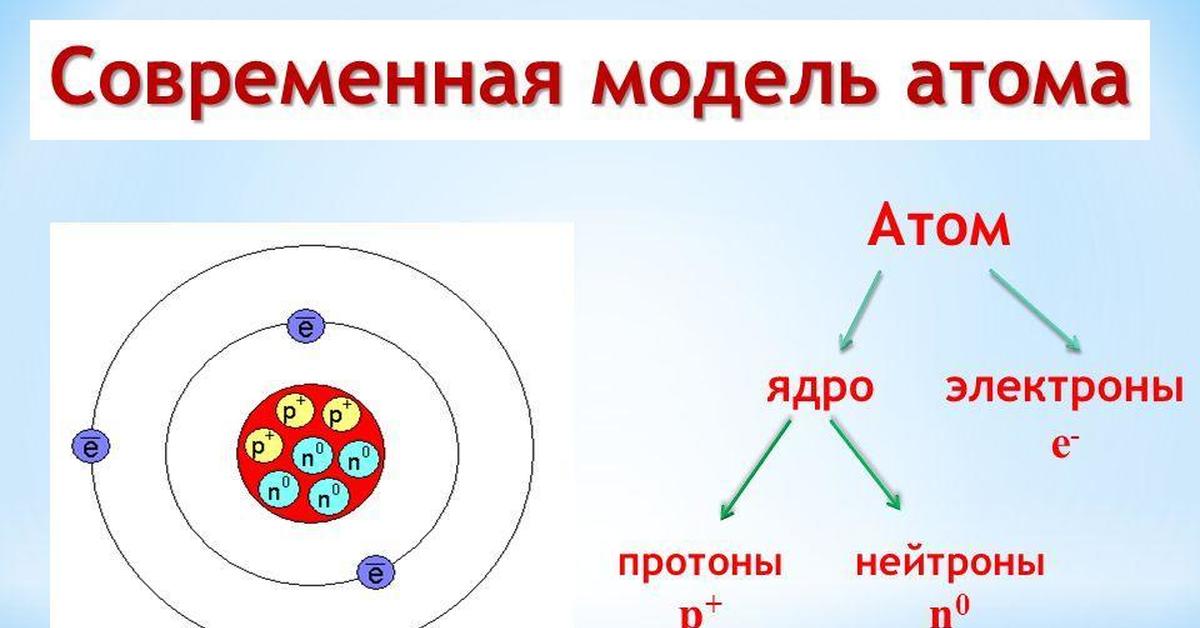
Атом (от греческого atomos — неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойств вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (количество нейтронов может быть равно или чуть больше или меньше, чем протонов). Протоны и нейтроны называют нуклонами, то есть частицами ядра. Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома в основном определяется массой его ядра, поскольку масса электрона примерно в 1836 раз меньше массы протона и нейтрона и в расчётах редко учитывается.
В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (количество нейтронов может быть равно или чуть больше или меньше, чем протонов). Протоны и нейтроны называют нуклонами, то есть частицами ядра. Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома в основном определяется массой его ядра, поскольку масса электрона примерно в 1836 раз меньше массы протона и нейтрона и в расчётах редко учитывается. Точное количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A—Z).
Точное количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A—Z).
Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N), называется нуклидом (это могут быть как разные элементы с одинаковым общим количеством нуклонов (изобары) или нейтронов (изотоны), так и один химический элемент — одно количество протонов, но разное количество нейтронов (изомеры)).
| элементарная частица | заряд (условные единицы) | заряд (Кл) | масса (а.е.м.) | масса (г) |
|---|---|---|---|---|
| протон | +1 | 1,6·10×10-19 | 1 | 1,7·10×10-24 |
| нейтрон | 1 | 1,7·10×10-24 | ||
| электрон | -1 | -1,6·10×10-19 | 9,1·10×10-28 |
Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объёмом атома, то ядро условно принимается материальной точкой, покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
Энергия атомного ядра
После того, как нейтроны были открыты, ядерная физика, а также химия и технологии сделали огромный шаг вперед. Перед человеком открылся новый, практически неисчерпаемый и в то же время опасный источник энергии.
Начало ядерной эры человечество ощутило на себе в 1945 году, когда США испытало в действии разрушительную первую ядерную бомбу «Тринити», сбросив ее на японские города Хиросима и Нагасаки.
Первое использование ядерной энергии в мирных целях следует отнести к середине 50-х годов XX века, когда в 1953 году был построен первый ядерный реактор, который заменил дизельный двигатель на американской подводной лодке «Наутилус».
Открытие электрона
До 1897 года человечество считало атом неделимым, когда британский физик Джозеф Джон Томсон открыл электрон в своих экспериментах с катодными лучами. Прибор, который использовал Томсон, представлял собой герметичную трубку из стекла, в которую были помещены два катода, и был выкачан воздух. Ученый обнаружил, что испускаемые катодные лучи отклоняются от пути своего распространения, если на них воздействовать электрическим полем. В итоге ученый установил, что образующие эти лучи частицы должны иметь отрицательный заряд. Впоследствии эти частицы получили название электроны.
Прибор, который использовал Томсон, представлял собой герметичную трубку из стекла, в которую были помещены два катода, и был выкачан воздух. Ученый обнаружил, что испускаемые катодные лучи отклоняются от пути своего распространения, если на них воздействовать электрическим полем. В итоге ученый установил, что образующие эти лучи частицы должны иметь отрицательный заряд. Впоследствии эти частицы получили название электроны.
Альфа излучение
- излучаются: два протона и два нейтрона
- проникающая способность: низкая
- облучение от источника: до 10 см
- скорость излучения: 20 000 км/с
- ионизация: 30 000 пар ионов на 1 см пробега
- биологическое действие радиации: высокое
Альфа (α) излучение возникает при распаде нестабильных изотопов элементов.
Альфа излучение — это излучение тяжелых, положительно заряженных альфа частиц, которыми являются ядра атомов гелия (два нейтрона и два протона). Альфа частицы излучаются при распаде более сложных ядер, например, при распаде атомов урана, радия, тория.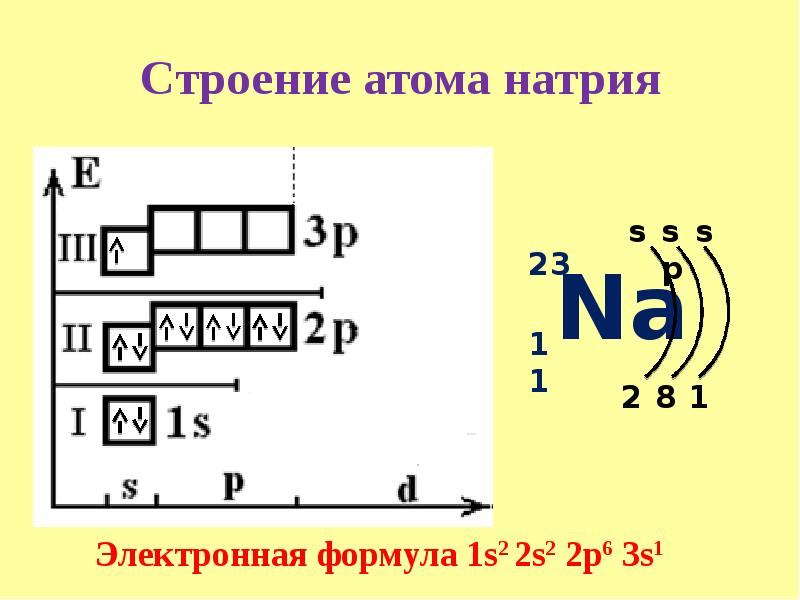
Альфа частицы обладают большой массой и излучаются с относительно невысокой скоростью в среднем 20 тыс. км/с, что примерно в 15 раз меньше скорости света. Поскольку альфа частицы очень тяжелые, то при контакте с веществом, частицы сталкиваются с молекулами этого вещества, начинают с ними взаимодействовать, теряя свою энергию и поэтому проникающая способность данных частиц не велика и их способен задержать даже простой лист бумаги.
Однако альфа частицы несут в себе большую энергию и при взаимодействии с веществом вызывают его значительную ионизацию. А в клетках живого организма, помимо ионизации, альфа излучение разрушает ткани, приводя к различным повреждениям живых клеток.
Из всех видов радиационного излучения, альфа излучение обладает наименьшей проникающей способностью, но последствия облучения живых тканей данным видом радиации наиболее тяжелые и значительные по сравнению с другими видами излучения.
Облучение радиацией в виде альфа излучения может произойти при попадании радиоактивных элементов внутрь организма, например, с воздухом, водой или пищей, а также через порезы или ранения. Попадая в организм, данные радиоактивные элементы разносятся током крови по организму, накапливаются в тканях и органах, оказывая на них мощное энергетическое воздействие. Поскольку некоторые виды радиоактивных изотопов, излучающих альфа радиацию, имеют продолжительный срок жизни, то попадая внутрь организма, они способны вызвать в клетках серьезные изменения и привести к перерождению тканей и мутациям.
Попадая в организм, данные радиоактивные элементы разносятся током крови по организму, накапливаются в тканях и органах, оказывая на них мощное энергетическое воздействие. Поскольку некоторые виды радиоактивных изотопов, излучающих альфа радиацию, имеют продолжительный срок жизни, то попадая внутрь организма, они способны вызвать в клетках серьезные изменения и привести к перерождению тканей и мутациям.
Радиоактивные изотопы фактически не выводятся с организма самостоятельно, поэтому попадая внутрь организма, они будут облучать ткани изнутри на протяжении многих лет, пока не приведут к серьезным изменениям. Организм человека не способен нейтрализовать, переработать, усвоить или утилизировать, большинство радиоактивных изотопов, попавших внутрь организма.
Атом и его строение
Над тем, как устроено вещество, люди размышляли с глубокой древности. Античные греческие ученые предполагали, что вещества состоят из мельчайших, невидимых глазу частиц разной формы, которые соединяются друг с другом при помощи различных крючков и присосок. Слово «атом» в переводе с греческого означает «неделимый». Так ли это? Действительно ли атом неделим? Существование атома было доказано лишь в XIX веке путем эксперимента. Установлено, что атом содержит еще более мелкие по размеру частицы. Атом состоит из ядра и электронов, находящихся в околоядерном пространстве. В ядре сосредоточена практически вся масса атома. Вклад электронов в массу атома крайне мал. Масса электрона составляет 9,1 · 10−31 кг.
Слово «атом» в переводе с греческого означает «неделимый». Так ли это? Действительно ли атом неделим? Существование атома было доказано лишь в XIX веке путем эксперимента. Установлено, что атом содержит еще более мелкие по размеру частицы. Атом состоит из ядра и электронов, находящихся в околоядерном пространстве. В ядре сосредоточена практически вся масса атома. Вклад электронов в массу атома крайне мал. Масса электрона составляет 9,1 · 10−31 кг.
Каждый электрон заряжен отрицательно, условно его заряд принимают равным –1. Символ, которым принято обозначать электрон – ē. Электроны движутся вокруг ядра, перемещаясь по сложным траекториям. Ядро атома состоит из двух типов частиц: протонов и нейтронов. Протоны обозначают буквой р, а нейтроны – n.
В целом атом электронейтрален, то есть его заряд равен нулю. С учетом электронейтральности атома, количество электронов в атоме всегда совпадает с количеством протонов. С учетом того, что в ядре только протоны заряжены (нейтроны заряда не имеют), и заряд каждого протона +1, ядро имеет заряд. Заряд ядра определяется количеством протонов, и всегда имеет знак + Заряд ядра обозначают символом Z (протонное число) Как определить количество электронов и протонов в атоме? На приведена схема строения атома водорода. Видно, что атом водорода состоит из одного отрицательно заряженного электрона и положительно заряженного ядра, состоящего из одного протона.
Заряд ядра определяется количеством протонов, и всегда имеет знак + Заряд ядра обозначают символом Z (протонное число) Как определить количество электронов и протонов в атоме? На приведена схема строения атома водорода. Видно, что атом водорода состоит из одного отрицательно заряженного электрона и положительно заряженного ядра, состоящего из одного протона.
Количество электронов и протонов в атоме химического элемента совпадает с его порядковым номером Рассмотрим другой пример. Определим количество электронов, протонов и заряд ядра для атома кислорода. Порядковый номер кислорода – 8.
Значит, в его атоме содержится 8 электронов, 8 протонов, заряд ядра +8. Как определить количество нейтронов?
В начале параграфа уже упоминалось, что практически вся масса атома сосредоточена в его ядре. В свою очередь ядро состоит из протонов и нейтронов. Относительная атомная масса элемента, записанная в Периодической Системе, приблизительно равна сумма масс протонов и нейтронов, поскольку масса электронов очень мала. Сумму масс протонов и нейтронов, равную округленной атомной массе химического элемента, называют массовым (нуклонным) числом и обозначают А. Определим количество нейтронов в атоме кислорода.
Сумму масс протонов и нейтронов, равную округленной атомной массе химического элемента, называют массовым (нуклонным) числом и обозначают А. Определим количество нейтронов в атоме кислорода.
Относительная атомная масса кислорода с учетом округления равна 16. Вычтем количество протонов: 16 – 8 = 8. В атоме кислорода 8 нейтронов.
С учетом вышесказанного можем записать несколько простых выражений:
- количество электронов равно количеству протонов ē = p;
- заряд ядра равен количеству протонов и имеет знак +, Z = p
Атом – мельчайшая частица вещества, состоящая из ядра и электронов, движущихся в околоядерном пространстве Протоны и нейтроны имеют общее название – нуклоны (от лат. nucleus – «ядро»).
Термином нуклид обозначают атом с определённым порядковым номером Z и массовым числом А, т.е. с определённым набором протонов и нейтронов. Нуклиды с одним и тем же атомным номером, но с разными массовыми числами называются изотопными нуклидами или просто изотопами (от греч. «изос» – «равный» и «топос» – «место»).
«изос» – «равный» и «топос» – «место»).
Другими словами, в ядрах всех изотопов данного элемента содержится одинаковое число протонов, но разное число нейтронов. Нуклиды обозначают символом элемента и массовым
- числом: 12С, 14N, 16O
- другая форма записи: углерод-12, азот-14, кислород-16
Если массовое число не указывать, то подразумеваются все природные изотопы данного элемента. Иногда указывают и атомный номер элемента, но это не обязательно, поскольку символ элемента однозначно связан с определённым Z.
Так, для атомов водорода Z = 1, для азота Z = 7, для кислорода Z = 8 и т.д. Разных нуклидов значительно больше, чем элементов. Например, в природе найдены три изотопа водорода – нуклиды 1Н, 2Н (другое обозначение D – дейтерий) и 3Н (или Т – тритий), три изотопа углерода (12С, 13С и 14С), четыре – серы, пять – кальция, шесть – селена, семь – молибдена, восемь – кадмия, девять – ксенона и десять – олова (это рекорд).
Есть и элементы одиночки, представленные всего одним нуклидом: 9Ве, 19F, 23Na, 27Al, 31P и др. Некоторые природные нуклиды нестабильны: со временем они распадаются; это – радионуклиды.
Некоторые природные нуклиды нестабильны: со временем они распадаются; это – радионуклиды.
Электроны и электричество
Электричество – это поток электронов через проводник, обычно в виде проволоки, этот поток называется электрическим током.
Чтобы этот поток произошел, электроны должны разорвать свою атомную связь (электричество – это поток электронов, а не их поток с ядрами, с которыми они связаны). Разрыв атомной связи между электроном и его ядром требует ввода энергии, которая заставляет электрон преодолевать электромагнитную силу, сдерживающую его, и таким образом свободно течь.
Проводящий материал
Все формы материи содержат электроны, однако в некоторых материалах они более свободно связаны с их ядрами. Эти материалы (известные как проводники или металлы) требуют очень мало энергии для создания электрического тока, потому что слабо связанные электроны требуют гораздо меньше энергии для преодоления электромагнитной силы, удерживающей их на месте.
Что генерирует поток электронов?
Поток электронов можно генерировать различными способами, но основные из них следующие:
- Электрические генераторы – это устройства, использующие принцип электромагнитной индукции.
 Электромагнитная индукция это процесс перемещения проводника через магнитное поле с целью создания электронного потока. Требуется только относительное движение проводника и магнитного поля, что означает, что магнитное поле может двигаться, пока проводник неподвижен. Когда электроны в проводнике проходят через магнитное поле (если поле достаточно сильное, а относительная скорость проводников через поле достаточно быстрая), то связи с их ядрами будут разорваны и будет индуцирован поток. Для того чтобы вызвать высокий уровень электронного потока, необходимо большое количество энергии для создания относительной скорости между проводником и магнитами.
Электромагнитная индукция это процесс перемещения проводника через магнитное поле с целью создания электронного потока. Требуется только относительное движение проводника и магнитного поля, что означает, что магнитное поле может двигаться, пока проводник неподвижен. Когда электроны в проводнике проходят через магнитное поле (если поле достаточно сильное, а относительная скорость проводников через поле достаточно быстрая), то связи с их ядрами будут разорваны и будет индуцирован поток. Для того чтобы вызвать высокий уровень электронного потока, необходимо большое количество энергии для создания относительной скорости между проводником и магнитами. - Химические реакции внутри батарей также создают электродвижущую силу, заставляющую электроны течь по цепи.
- Фотоны (энергия света) также могут вызывать поток электронов, когда они сталкиваются с фотоэлектрической ячейкой расположенной в солнечной панели.
Таким образом, структура или состав атома определяет принадлежность к тому или иному химическому элементу.
РТМ — прибор будущего
Современные ученые могут увидеть на мониторе компьютера атомные частички вещества, а также двигать их по поверхности, используя специальный инструмент, который носит название растровый туннельный микроскоп (РТМ).
Это компьютеризированный
инструмент с наконечником, который очень осторожно движется возле поверхности материала. Когда наконечник движется, электроны перемещаются сквозь зазор между наконечником и поверхностью
Хотя материал выглядит совершенно гладким, на самом деле он неровный на атомном уровне. Компьютер делает карту поверхности вещества, создавая образ его частичек, и ученые, таким образом, могут увидеть свойства атома.
Открытие протона
Ученик Дж. Дж. Томсона, новозеландский физик Эрнест Резерфорд, считается ученым, открывшим протон. Он в начале XX века предложил планетарную модель строения атома, в которой основная масса находится в центре. К такой гипотезе Резерфорд пришел после анализа экспериментов, в которых ученые Ганс Гейгер и Эрнест Марсден бомбардировали альфа-частицами пластинку из золота.
В 1918 году Резерфорд провел самостоятельно эксперименты по взаимодействию альфа-частиц с азотом. В этих экспериментах ученый наблюдал испускание ядер атома водорода и пришел к заключению, что они являются «кирпичиками» для всех других ядер. Так Резерфорд открыл протон. Впоследствии было установлено, что ядерная масса значительно превосходила суммарную массу всех протонов атома, поэтому Резерфорд предположил, что в ядре атома существует еще некоторая тяжелая частица, не обладающая зарядом. Этой частицей стал нейтрон, который был открыт позже.
Порядковый номер атома и атомная масса элемента
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Из чего состоит атом?
Составляют ядро атома элементарные частицы – нейтроны и протоны, а по замкнутым орбиталям вокруг атомного ядра движутся электроны.
Что такое нейтрон?
Нейтрон (n) представляет собой элементарную нейтральную частицу, относительная масса которой составляет 1,00866 атомной единицы массы (а.е.м.).
Что такое протон?
Протон (р) представляет собой элементарную частицу, относительная масса которой составляет 1,00728 атомной единицы массы, положительным зарядом +1 и спином 1/2. Протон ( переводится с греческого как основной, первый) относится к барионам. В ядре атома число протонов равно порядковому номеру химического элемента в Периодической системе Д.И. Менделеева.
Что такое электрон?
Электрон ( е–) представляет собой элементарную частицу, масса которой составляет 0,00055 а.е.м.; условный заряд электрона: — 1. Количество электронов в атоме равняется заряду ядра атома (соответствует порядковому номеру химического элемента в Периодической системе Менделеева).
Вокруг ядра электроны двигаются по орбиталям, которые строго определены и образуется электронное облако.
Область пространства вокруг атомного ядра, где с вероятностью более 90% присутствуют электроны, определяет форму электронного облака.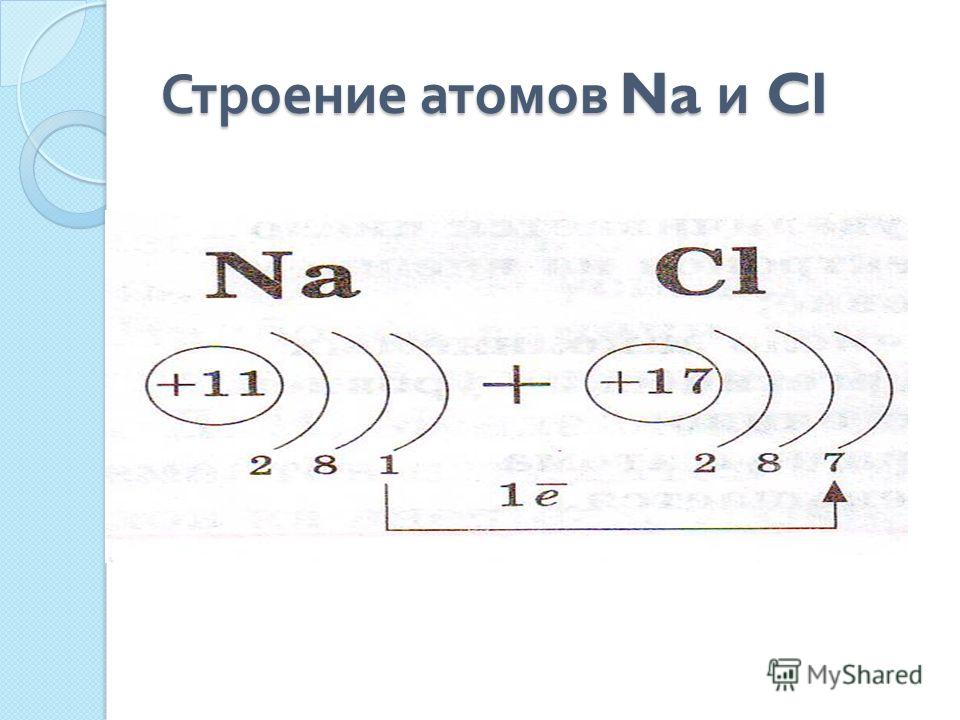
Электронное облако р-электрона по внешнему виду напоминает гантель; на трех р-орбиталях по максимуму могут находиться лишь шесть электронов.
Электронное облако s-электрона представляет собой сферу; на s-энергетическом подуровне максимальное количество электронов, которые могут там находиться – это 2.
Изображают орбитали в виде квадрата, снизу или сверху него прописывают значения главного и побочного квантовых чисел, которые описывают эту орбиталь.
Данная запись носит название графическая электронная формула. Она выглядит следующим образом:
С помощью стрелок в данной формуле обозначают электрон. Направление стрелки соответствует направлению спина – это собственный магнитный момент электрона. Электроны, имеющие противоположные спины (на картинке это направленные в противоположные стороны стрелочки), получили название спаренные.
Электронные конфигурации атомов элементов можно представить в виде формул, в которых:
- Указывают символы подуровня;
- Степень у символа показывает число электронов данного подуровня;
- Коэффициент, стоящий перед символом подуровня обозначает его принадлежность к данному уровню.

Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s 2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s 2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s 2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s 2p 3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s 2p3s 3p4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K 4s1 4s
У кальция 4s-подуровень заполнен:
+20Ca 4s2 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc 3d14s2 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti 3d24s2 4s 3d
+23V 3d34s2 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
Электронная конфигурация хрома такая:
+24Cr 3d54s1 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбителей. Этот эффект так и называется — провал или проскок электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn 3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu 3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn 3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам.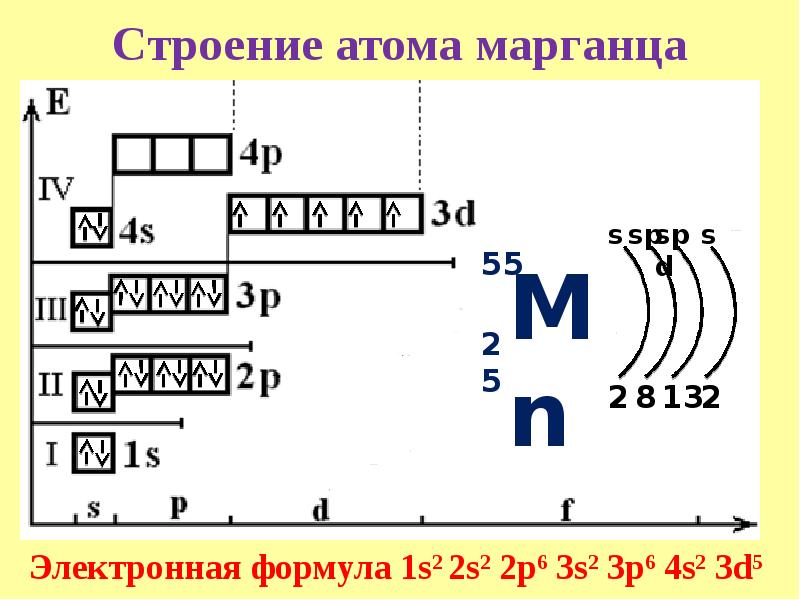 Например, электронная формула галлия:
Например, электронная формула галлия:
+31Ga 3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно и проверить себя в Интернете.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны. Например, у меди (3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвоват ьв образовании химической связи. Например, у хрома (+24Cr 3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Правило Хунда
Существует правило Хунда, в соответствии с которым электроны располагаются на однотипных орбиталях одного энергетического уровня так, чтобы совокупный спин был максимально возможным. Это означает, что, когда энергетический подуровень заполняется, каждый электрон сначала занимает отдельную ячейку, и лишь потом запускается процесс их соединения.
Изображение электронной формулы Азота в графическом виде
Изображение электронной формулы Кислорода в графическом виде
Изображение электронной формулы Неона в графическом виде
К примеру, у атома азота все р-электроны будут занимать отдельные ячейки, а у кислорода начнется их спаривание, которое завершится в полной мере у неона.
Помогла ли вам статья?
Задать вопрос
Пишите ваши рекомендации и задавайте вопросы в комментариях
Нарисуйте диаграммы, изображающие атомные структуры следующих элементов: a атом натрия b ион хлорида c автомобиль…
Перейти к
- Упражнение 4А
- Упражнение 4Б
- Упражнение 4С
- Упражнение 4D
- Упражнение 4Е
- Глава 1.
 Язык химии
Язык химии - Глава 2 Химические изменения и реакции
- Глава 3 Вода
- Глава 4. Атомная структура и химическая связь
- Глава 5 Периодическая таблица
- Глава 6 Изучение первого элемента водорода
- Глава 7 Изучение газовых законов
- Глава 8.
 Загрязнение атмосферы
Загрязнение атмосферы
Главная > Селина Солюшнс Класс 9 Химия > Глава 4 – Глава 4 Атомная структура и химическая связь > Упражнение 4С > Вопрос 3
Вопрос 3 Упражнение 4C
Начертите схемы атомной структуры следующих
(a) атома натрия (b) иона хлорида
(c) атома углерода (d) оксида.
Ответ:
Стенограмма видео
“привет всем добро пожаловать к лидеру обучение я гури ваш научный руководитель сегодня вопрос нарисовать схемы представляет собой атомную структуру следующий ион хлорида натрия и атом углерода и ион оксида так что здесь вы можете увидеть некоторые диаграммы было показано так что для первого это атом натрия его конфигурация два восемь один так на первой оболочке два электрона ты можешь видеть следующая оболочка, восемь один два три четыре пять шесть семь восемь хорошо и в самой внешней ячейке это будет один следующий за хлором так это схемы которые были показаны для соответствующих ионы и атомы c1 для атома углерода следующий для кислорода я для большего количества таких видео, пожалуйста, подпишитесь обучение лидера и за любые сомнения оставьте комментарий, спасибо ты”
Связанные вопросы
**а) Что такое инертные элементы?****б) Почему они существуют в виде одноатомных молекул?****в) Что такое.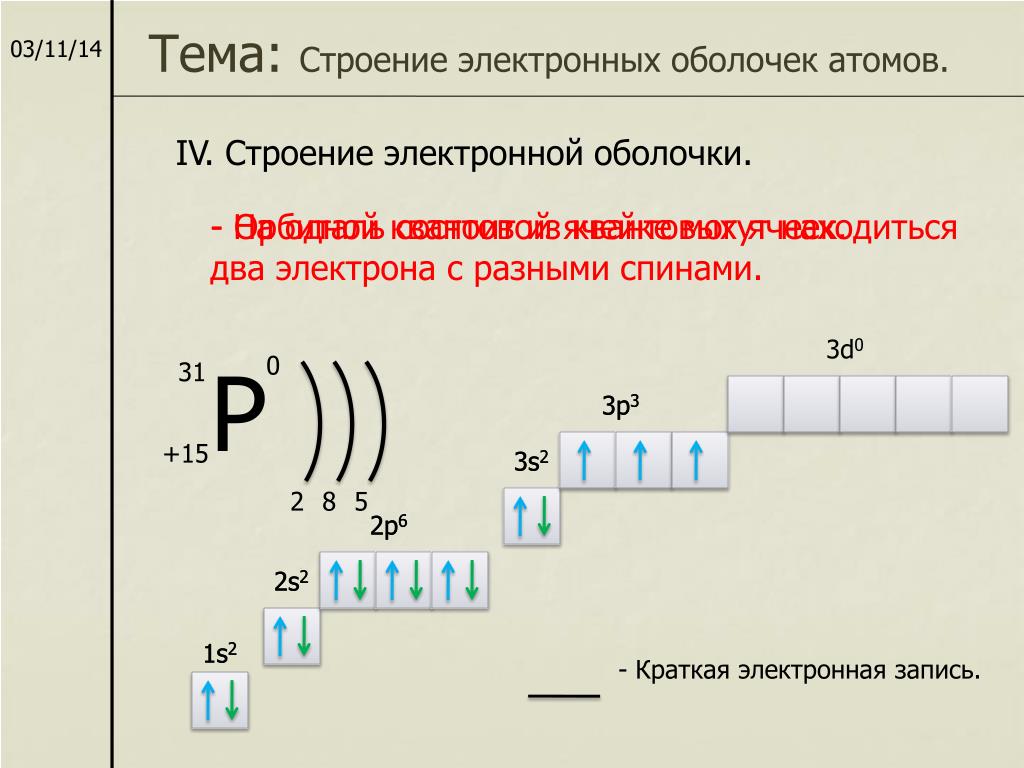 ..
..
** В чем различаются три изотопа водорода? Дайте их структуры**
**Элементы X, Y и Z имеют атомные номера 6, 9 и 12 соответственно. Какой из них :****(a) формирует…
**Элемент X имеет электронную конфигурацию 2, 8, 18, 8, 1. Без идентификации X****a) Предсказать si…
**Из символа 𝑯𝒆 𝟐 𝟒****для элемента гелий запишите массовое число и атомный номер…
******(а) Сравните атомы этих изотопов по отношению к:****(i) составу их ядер…
Фейсбук WhatsApp
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнение 4A
Упражнение 4B
Упражнение 4C
Упражнение 4D
Упражнение 4E
Главы
Глава 1 Язык Химии
Глава 2.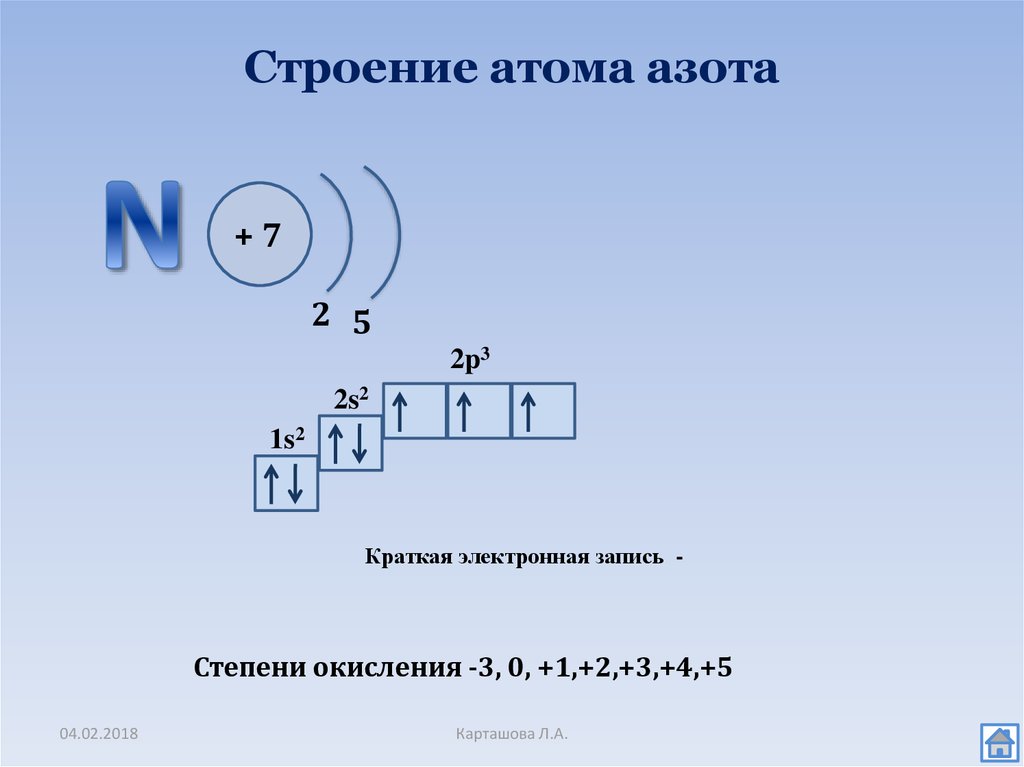 Химические превращения и реакции
Химические превращения и реакции
Глава 3. Вода
Глава 4. Атомная структура и химическая связь 8 Атмосферное загрязнение
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
Электронно-точечные диаграммы Льюиса | Introductory Chemistry – 1st Canadian Edition
Цель обучения
1. Нарисуйте электронно-точечную диаграмму Льюиса для атома или одноатомного иона.
Практически во всех случаях химические связи образуются при взаимодействии валентных электронов в атомах. Чтобы облегчить наше понимание того, как взаимодействуют валентные электроны, был бы полезен простой способ представления этих валентных электронов.
Электронная точечная диаграмма Льюиса (или электронная точечная диаграмма, или диаграмма Льюиса, или структура Льюиса) представляет собой представление валентных электронов атома, в котором используются точки вокруг символа элемента. Количество точек равно количеству валентных электронов в атоме. Эти точки располагаются справа и слева, сверху и снизу от символа, причем не более двух точек на стороне. (Не имеет значения, в каком порядке используются положения.) Например, электронная точечная диаграмма Льюиса для водорода просто
Количество точек равно количеству валентных электронов в атоме. Эти точки располагаются справа и слева, сверху и снизу от символа, причем не более двух точек на стороне. (Не имеет значения, в каком порядке используются положения.) Например, электронная точечная диаграмма Льюиса для водорода просто
Поскольку сторона не важна, электронная точечная диаграмма Льюиса также может быть изображена следующим образом:
Электронная точечная диаграмма гелия с двумя валентными электронами выглядит следующим образом:
Поместив два электрона вместе на одну и ту же С другой стороны, мы подчеркиваем тот факт, что оба этих электрона находятся в подоболочке 1 s ; это общее соглашение, которое мы примем, хотя позже будут исключения. Следующий атом, литий, имеет электронную конфигурацию 1 s 2 2 s 1 , поэтому на валентной оболочке у него только один электрон. Его электронная точечная диаграмма похожа на диаграмму водорода, за исключением того, что используется символ лития:
Бериллий имеет два валентных электрона в своей оболочке 2 s , поэтому его электронная точечная диаграмма похожа на диаграмму гелия:
Следующий атом — бор .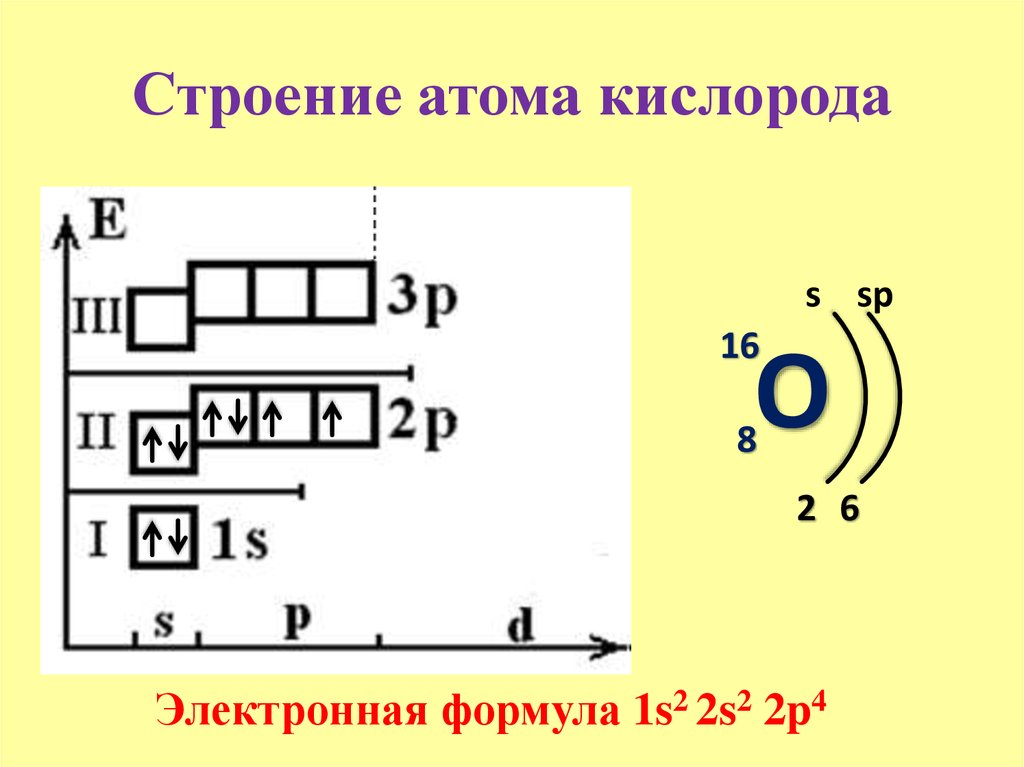 Его валентная электронная оболочка равна 2 s 2 2 p 1 , поэтому у него три валентных электрона. Третий электрон пойдет с другой стороны символа:
Его валентная электронная оболочка равна 2 s 2 2 p 1 , поэтому у него три валентных электрона. Третий электрон пойдет с другой стороны символа:
Опять же, не имеет значения, с какой стороны от символа расположены точки электронов.
У углерода четыре валентных электрона: два в подоболочке 2 s и два в подоболочке 2 p . Как обычно, мы нарисуем две точки вместе на одной стороне, чтобы обозначить 2 s электронов. Однако условно мы рисуем точки для двух p электронов с разных сторон. Таким образом, электронная точечная диаграмма углерода выглядит следующим образом:
Для азота, который имеет три p электрона, мы ставим по одной точке на каждой из трех оставшихся сторон: другая сторона символа. При удвоении электронов следите за тем, чтобы на стороне было не более двух электронов.
Фтор и неон имеют семь и восемь точек соответственно:
Со следующим элементом, натрием, процесс начинается с одного электрона, потому что натрий имеет единственный электрон в своей оболочке с наибольшим номером, н = 3 ракушки. Просматривая периодическую таблицу, мы видим, что электронно-точечные диаграммы атомов Льюиса никогда не будут иметь более восьми точек вокруг символа атома.
Просматривая периодическую таблицу, мы видим, что электронно-точечные диаграммы атомов Льюиса никогда не будут иметь более восьми точек вокруг символа атома.
Пример 1
Что представляет собой электронная точечная диаграмма Льюиса для каждого элемента?
- алюминий
- селен
Раствор
Конфигурация валентного электрона алюминия: 3 s 2 3 p 1 . Таким образом, у него будет три точки вокруг символа алюминия, две из которых попарно обозначают 3 9.0137 с электронов:
Валентная электронная конфигурация селена: 4 s 2 4 p 4 . В оболочке с наибольшим номером, n = 4, имеется шесть электронов. Его электронная точечная диаграмма выглядит следующим образом:
Проверь себя
Что представляет собой электронная точечная диаграмма Льюиса для каждого элемента?
- фосфор
- аргон
Ответ
Для атомов с частично заполненными подоболочками d или f эти электроны обычно не указываются на электронных точечных диаграммах Льюиса. Например, электронная точечная диаграмма для железа (конфигурация валентной оболочки 4 s 2 3 d 6 ) выглядит следующим образом: они имеют одинаковую электронную конфигурацию валентной оболочки. Таким образом, электронные точечные диаграммы для первого столбца элементов таковы:
Например, электронная точечная диаграмма для железа (конфигурация валентной оболочки 4 s 2 3 d 6 ) выглядит следующим образом: они имеют одинаковую электронную конфигурацию валентной оболочки. Таким образом, электронные точечные диаграммы для первого столбца элементов таковы:
Одноатомные ионы – это атомы, которые либо потеряли (для катионов), либо приобрели (для анионов) электроны. Электронно-точечные диаграммы для ионов такие же, как и для атомов, за исключением того, что некоторые электроны были удалены для катионов, а некоторые электроны добавлены для анионов. Таким образом, сравнивая электронные конфигурации и электронные точечные диаграммы для атома Na и иона Na + , мы отмечаем, что атом Na имеет один валентный электрон на своей диаграмме Льюиса, в то время как ион Na + потерял эту одну валентность. электрон:
Технически валентная оболочка иона Na + теперь представляет собой оболочку n = 2, в которой восемь электронов. Так почему бы нам не поставить восемь точек вокруг Na + ? Условно, когда мы показываем электронные точечные диаграммы для ионов, мы показываем исходную валентную оболочку атома, которая в данном случае является оболочкой n = 3 и пустой в ионе Na + .
Так почему бы нам не поставить восемь точек вокруг Na + ? Условно, когда мы показываем электронные точечные диаграммы для ионов, мы показываем исходную валентную оболочку атома, которая в данном случае является оболочкой n = 3 и пустой в ионе Na + .
При создании катионов электроны сначала теряются из оболочки с наибольшим номером , не обязательно из последней заполненной подоболочки. Например, при переходе от нейтрального атома Fe к атому Fe 2+ атом Fe сначала теряет два 4 s электронов, а не 3 d электронов, несмотря на то, что подоболочка 3 d заполняется последней. Таким образом, у нас есть
Анионы имеют дополнительные электроны по сравнению с исходным атомом. Вот сравнение атома Cl с ионом Cl − :
Пример 2
Какова электронная точечная диаграмма Льюиса для каждого иона?
- Ca 2+
- О 2-
Раствор
Потеряв два исходных валентных электрона, электронная точечная диаграмма Льюиса представляет собой просто Ca 2+ .


