Таблица Менделеева online – Ne
Ne
10
8
2
20.179±1
2s22p6
Неон
| Относительная электроотрицательность (по Полингу): | |
| Температура плавления: | -248,67°C |
| Температура кипения: | -246,048°C |
| Теплопроводность: | 0 |
| Плотность: | 0,0008999 г/см3 |
| Открыт: | Вильям Рамзай, М. Траверс |
| Цвет в твёрдом состоянии: | Бесцветный |
| Тип: | Благородный газ |
| Орбитали: | 1s22s22p6 |
| Электронная формула: |
Ne – 1s2 2s2 2p6 Ne – [He] 2s2 2p6 |
| Валентность: | 0 |
| Степени окисления: | 0 |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 21,564 В 40,962 В 63,45 В |
Электропроводность в тв. фазе: фазе: |
|
| Ковалентный радиус: | 0,71 Å |
| Атомный объем: | 16,7 см3/моль |
| Атомный радиус: | 0,51 Å |
| Теплота распада: | 0,3317 КДж/моль |
| Теплота парообразования: | 1,7326 КДж/моль |
| Кристаллическая структура: | Гранецентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре каждой грани |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
Избыток массы (кэВ) |
Период полураспада (T1/2) |
Спин и чётность |
Распространённость изотопа в природе (%) |
|---|---|---|---|---|---|---|---|
| 16Ne | 10 | 6 | 16,025761(22) | 23996(20) | 9 зс | 0+ | |
| 17Ne | 10 | 7 | 17,017672(29) | 16461(27) | 109,2(6) мс | 1/2− | |
| 18Ne | 10 | 8 | 18,0057082(3) | 5317,17(28) | 1,672(8) с | 0+ | |
| 19 |
10 | 9 | 19,0018802(3) | 1751,44(29) | 17,296(5) с | 1/2+ | |
| 20Ne | 10 | 10 | 19,9924401754(19) | -7041,9313(18) | Стабильный | 0+ | 90,48(3) |
| 21Ne | 10 | 11 | 20,99384668(4) | -5731,78(4) | Стабильный | 3/2+ | 0,27(1) |
| 22Ne | 10 | 12 | 21,991385114(19) | -8024,715(18) | Стабильный | 0+ | 9,25(3) |
| 23Ne | 10 | 13 | 22,99446690(11) | -5154,05(10) | 37,24(12) с | 5/2+ | |
| 24Ne | 10 | 14 | 23,9936108(4) | -5951,5(4) | 3,38(2) мин | 0+ | |
| 25Ne | 10 | 15 | 24,997737(28) | -2108(26) | 602(8) мс | (3/2)+ | |
| 26Ne | 10 | 16 | 26,000461(29) | 430(27) | 197(1) мс | 0+ | |
| 27Ne | 10 | 17 | 27,007590(120) | 7070(110) | 32(2) мс | 3/2+# | |
| 28Ne | 10 | 18 | 28,012070(160) | 11240(150) | 18,3(22) мс | 0+ | |
| 29Ne | 10 | 19 | 29,019390(290) | 18060(270) | 15,6(5) мс | 3/2+# | |
| 30Ne | 10 | 30,024800(610) | 23100(570) | 5,8(2) мс | 0+ | ||
| 31Ne | 10 | 21 | 31,033110(970)# | 30840(900)# | 3,4(8) мс | 7/2−# | |
| 32Ne | 10 | 22 | 32,040020(860)# | 37280(800)# | 3,5(9) мс | 0+ | |
| 33Ne | 10 | 23 | 33,049380(860)# | 46000(800)# | < 260 нс | 7/2−# | |
| 34Ne | 10 | 24 | 34,057030(870)# | 53120(810)# | 1# мс | 0+ |
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
58.693
29
Cu
63.546
30
Zn
65. 38
38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195. 084
084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
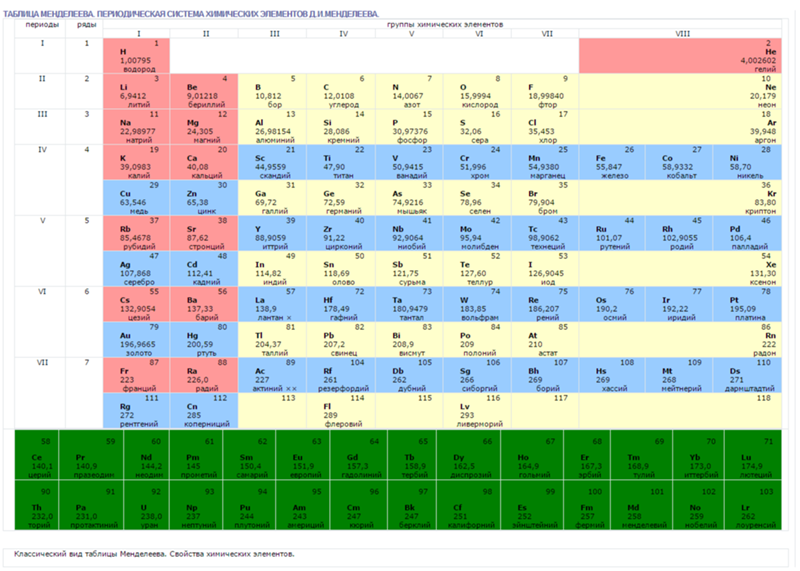
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree. ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Благородный неон | Периодическая таблица неоновых элементов
Элементы
- Сообщение от Кларис Чан
08 Июль
Введение в неон
Элемент неон , символ Ne , представляет собой благородный газ, который в стандартных условиях не имеет цвета и запаха. В присутствии электрического тока неоновый газ светится знакомым ярким красно-оранжевым цветом. Неон не реагирует.
Десять удивительных фактов о неоне
- Неон имеет самый узкий спектр жидкого состояния среди всех элементов. Элемент существует в жидкой форме в диапазоне всего 2,5 ℃.

- Это второй по легкости благородный газ, на первом месте гелий.
- Несмотря на то, что неон довольно редко встречается на Земле, он является четвертым по распространенности элементом во Вселенной. Он составляет 18 частей на миллион воздуха.
- Неоновая вывеска — самое известное применение элемента. Первый был сделан Жоржем Клодом в 1910 и дебютировал на выставке Paris Expo. Если вы видите неоновую вывеску не красновато-оранжевого цвета, газ внутри не неоновый!
- Неон имеет примерно две трети плотности воздуха. Таким образом, неоновый шар будет плавать, но подниматься медленнее, чем гелиевый, потому что гелий легче.
- Дыхание неона сделает ваш голос более высоким, но не так сильно, как гелий.
- Название неон происходит от греческого слова «неос», означающего «новый».
- Жидкий неон используется в качестве криогенного хладагента, а также для замораживания трупов (жутко!).
- Гелий и неон – единственные элементы, которые не образуют соединений с другими элементами, хотя ионы и лиганды были образованы.

- Неон имеет 3 стабильных изотопа, встречающихся в природе, и еще 17 радиоактивных изотопов.
Неон в периодической таблице
Элемент неон с атомным символом Ne является благородным газом в группе 18 периодической таблицы . Как и другие благородные газы, он имеет полную внешнюю оболочку с 8 валентными электронами и его электронную конфигурацию [He]2s 9.0051 2 2 шт. 6 . Он расположен в p-блоке во втором периоде. Атомный номер неона равен 10.
Охлаждающая способность неона
В своей жидкой форме неон используется в качестве криогенного хладагента, а это означает, что это жидкость, которая используется в процессе охлаждения объектов при температуре ниже 150 К. Охлаждающая способность неона очень высока. высокая. Его охлаждающая способность (на единицу объема) в 40 раз больше, чем у жидкого гелия, и более чем в 3 раза больше, чем у жидкого водорода. Свойства неона как благородного (и, следовательно, инертного) газа позволяют ему не реагировать и не смешиваться с другими элементами. Эти свойства, а также очень низкая температура кипения делают его эффективным для использования в качестве хладагента.
Эти свойства, а также очень низкая температура кипения делают его эффективным для использования в качестве хладагента.
Редкость неона
Как в жидкой, так и в газообразной форме неон очень редок и поэтому дорог на Земле. Он очень легкий, имеет высокое давление паров при низких температурах и не вступает в реакцию. Эти свойства предотвращают попадание неона в ловушку при формировании Земли из облаков пыли. Неон составляет 0,00182% атмосферы Земли. Напротив, неон является четвертым по распространенности элементом во Вселенной.
Применение неона в современном мире
Для чего используется неон?
Помимо использования в качестве криогенного хладагента, неон в основном используется в различных источниках света, включая вывески и лазеры.
Неоновые огни и вывески
Возможно, самое известное применение неона, характерные красно-оранжевые неоновые огни, были изобретены в 1910 году. Стеклянные трубки, содержащие атомы неона, вытягивают различные формы и буквы. Прохождение электрического тока через трубку возбуждает электроны внешней оболочки, заставляя их подпрыгивать на один энергетический уровень. Когда атомы в конце концов возвращаются к своему первоначальному энергетическому уровню, они высвобождают энергию в виде красно-оранжевого света.
Прохождение электрического тока через трубку возбуждает электроны внешней оболочки, заставляя их подпрыгивать на один энергетический уровень. Когда атомы в конце концов возвращаются к своему первоначальному энергетическому уровню, они высвобождают энергию в виде красно-оранжевого света.
Гелий-неоновые лазеры
По механизму, аналогичному неоновым вывескам, электрические токи возбуждают атомы гелия и неона в газоразрядных трубках. Столкновения между атомами передают и высвобождают энергию. Это усиливает свет внутри трубки и производит лазер. He-Ne лазеры излучают ярко-красный свет с длиной волны 632,8 нанометров (нм).
История неона
Когда и как был открыт неон?
Британские химики Уильям Рамсей и Моррис Трэверс открыли элемент неон в 189 г.8. В своем эксперименте Рамзи кипятил образец жидкого воздуха и улавливал газы по мере их испарения. Этот процесс называется фракционной перегонкой. После идентификации и исключения азота, кислорода и аргона Рамзи открыл криптон.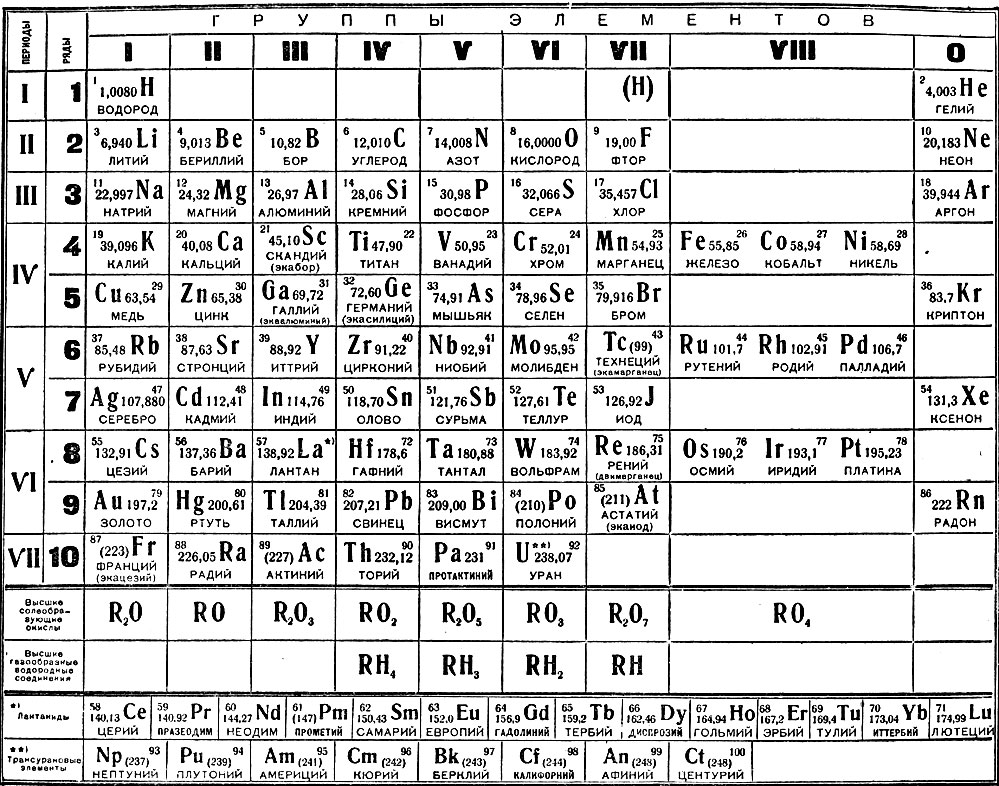 Позже он открыл другой газ, излучавший красно-оранжевый свет при спектроскопическом разряде. Этим элементом оказался неон. Он был назван в честь греческого слова neos , что означает «новый».
Позже он открыл другой газ, излучавший красно-оранжевый свет при спектроскопическом разряде. Этим элементом оказался неон. Он был назван в честь греческого слова neos , что означает «новый».
Neon Reactions
Поскольку это благородный газ, неон стабилен с полным октетом электронов. Неон — инертный газ, не вступающий в реакцию ни с какими другими элементами.
Соединения неона
Элемент не является реакционноспособным, но есть несколько исключений, таких как несколько молекулярных ионов и эксимеров. Эксимеры (сокращение от «возбужденный димер») представляют собой короткоживущие димерные молекулы. Один из атомов эксимеров должен иметь полный октет электронов. Некоторые примеры включают молекулы Ван-дер-Ваальса (например, LiNe), лиганды (например, Cr(CO) 5 Ne) и ионы (например: NeH + ). И молекулы Ван-дер-Ваальса, и лиганды имеют относительно слабые связи.
Изоляция неона
Точно так же, как химик Уильям Рамсей открыл этот элемент, ученые могут выделить неон. Из-за чрезвычайно низкой температуры кипения элемента при контакте жидкого воздуха с активированным углем неон и водород поглощаются из жидкого воздуха. Затем добавление кислорода к активированному углю и поглощенным им газам превращает водород в воду, изолируя неоновый элемент.
Из-за чрезвычайно низкой температуры кипения элемента при контакте жидкого воздуха с активированным углем неон и водород поглощаются из жидкого воздуха. Затем добавление кислорода к активированному углю и поглощенным им газам превращает водород в воду, изолируя неоновый элемент.
Степень окисления неона
Поскольку это благородный газ, степень окисления неона равна нулю.
Физические свойства NEON
- Символ: NE
- Печащая температура: -248,6 O C
- Точка кипячения: -246 O C
- Плотность: 0,000825 G/CM 3
- . 63.55u
- Атомный номер: 29
- Электроотрицательность: н/д
- Классификация: благородный газ
- Естественное содержание неона в земной коре: 3*10 -7 %
- Конфигурация электронных оболочек 2 2p 6
- Изотопы: неон-20, неон-21, неон-22
- Содержится в минералах: нет
- Токсичность: нетоксичен
Где купить неон?
Вы можете купить неон онлайн.
Ne Информация об элементе Neon: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура неона
Твердотельная структура неона Face Centered Cubic .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|
| 442,9 пм | 442,9 пм | 442,9 пм |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | Gamma |
|---|---|---|
| π/2 | π/2 | π/2 |
. y i , z i ), измеренные от опорной точки решетки.
y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
| Space Group Name | Fm_ 3m | |
| Oxidation States | Space Group Number | 225 |
| Crystal Structure | Face Centered Cubic |
Neon Atomic and Orbital Properties
Атомы неона имеют 10 электронов и структуру электронной оболочки [2, 8] с символом атомного термина (квантовые числа) 1 С 0 .
| Atomic Number | 10 |
| Number of Electrons (with no charge) | 10 |
| Number of Protons | 10 |
| Mass Number | 20 |
| Number нейтронов | 10 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8 |
| Электронная конфигурация | [He] 2s2 2p6 |
| Valence Electrons | 2s2 2p6 |
| Valence (Valency) | 0 |
| Main Oxidation States | – |
| Oxidation States | |
| Atomic Символ термина (квантовые числа) | 1 S 0 |
Боровская модель атома неона — количество электронов на уровне энергии
Электронная конфигурация неона0163
Сокращенная электронная конфигурация неона
Сокращенная электронная конфигурация атома нейтрального неона в основном состоянии: [He] 2s2 2p6.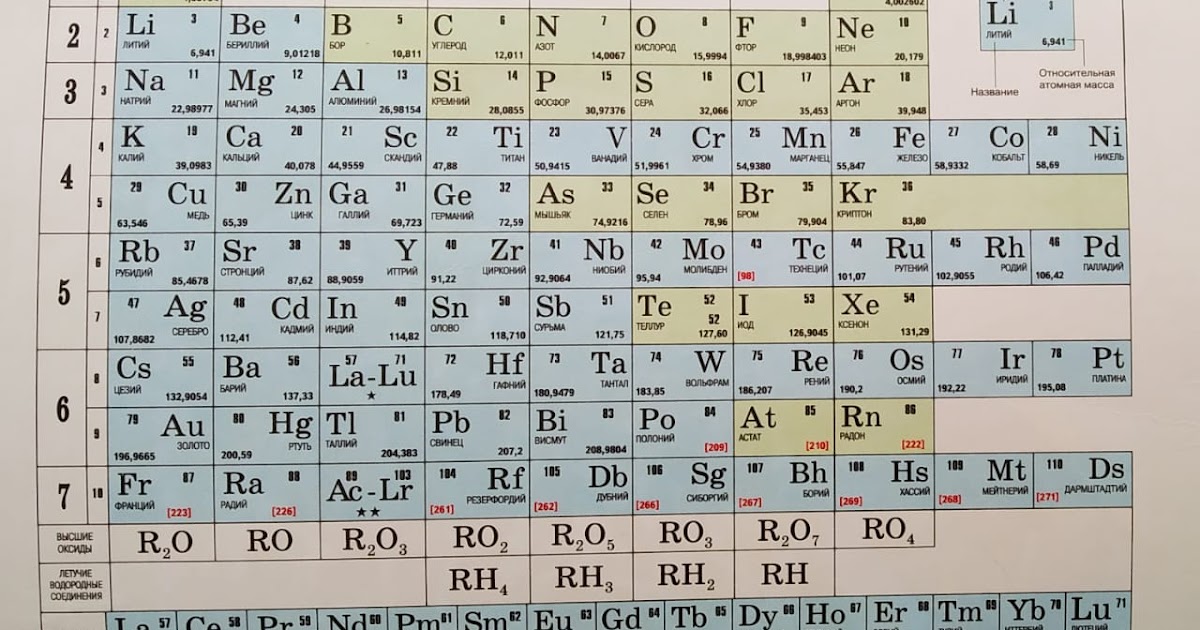 Часть конфигурации неона, эквивалентная благородному газу предшествующего периода, обозначается аббревиатурой [He]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 2s2 2p6, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации неона, эквивалентная благородному газу предшествующего периода, обозначается аббревиатурой [He]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 2s2 2p6, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального неона
Полная электронная конфигурация основного состояния атома неона, Полная электронная конфигурация
1s2 2s2 2p6
Электроны заполнены на атомных орбиталях в порядке, определяемом принципом Ауфбау, принципом исключения Паули и Правило Хунда.

Атомная структура неона
Атомный радиус неона составляет 38 пм, а его ковалентный радиус равен 69 пм.
| Расчетный атомный радиус | 38 пм (0,38 Å) |
| Atomic Radius Empirical | 160 pm (1.6 Å) |
| Atomic Volume | 22.42 cm3/mol |
| Covalent Radius | 69 pm (0.69 Å) |
| Van der Waals Radius | 154 pm |
| Neutron Cross Section | 0.04 |
| Neutron Mass Absorption | 0.0006 |
Atomic Spectrum of Neon
Химические свойства неона: Энергия ионизации неона и сродство к электрону
Сродство к электрону неона составляет 0 кДж/моль.
| Valence | 0 |
| Electronegativity | – |
| ElectronAffinity | 0 kJ/mol |
Ionization Energy of Neon
Refer to table below for Ionization energies of Neon
| Энергия ионизации номер | Enthalpy – kJ/mol |
|---|---|
| 1st | 2080. 7 7 |
| 2nd | 3952.3 |
| 3rd | 6122 |
| 4th | 9371 |
| 5th | 12177 |
| 6th | 15238 |
| 7th | 19999 |
| 8th | 23069.5 |
| 9th | 115379.5 |
| 10th | 131432 |
Neon Physical Properties
Refer to below table for Neon Physical Properties
| Density | 0.0009 g/cm3 |
| Molar Volume | 22.42 cm3/mol |
Упругие свойства
| Модуль Юнга | – |
| Модуль сдвига | – |
Hardness of Neon – Tests to Measure of Hardness of Element
| Mohs Hardness | – |
| Vickers Hardness | – |
| Твердость по Бринеллю | – |
Неон Электрические свойства
Неон является проводником электричества. Обратитесь к таблице ниже для получения информации об электрических свойствах Neon 9.0003
Обратитесь к таблице ниже для получения информации об электрических свойствах Neon 9.0003
| Electrical Conductivity | – |
| Resistivity | – |
| Superconducting Point | – |
Neon Heat and Conduction Properties
| Thermal Conductivity | 0.0491 W/( м K) |
| Тепловое расширение | – |
Магнитные свойства неона
| Магнитный тип | Diamagnetic |
| Curie Point | – |
| Mass Magnetic Susceptibility | -4.1e-9 m3/kg |
| Molar Magnetic Susceptibility | -8.27e-11 m3/mol |
| Магнитная восприимчивость | -3,69E -9 |
Оптические свойства Neon
.0067
НЕОН ТЕРМОВЫЕ СЕВИТИ – ЭНТАЛИЙ И ТЕРМОДИКА СЛ. | ||
| кипящая точка | 27,07 K (-246,08 ° C, -410,94399999999996 ° F) | – |
Enthalpies of Neon
| Heat of Fusion | 0.34 kJ/mol |
| Heat of Vaporization | 1.75 kJ/mol |
| Heat of Combustion | – |
Изотопы неона – Ядерные свойства неона
Неон состоит из 19 изотопов, содержащих от 16 до 34 нуклонов. Неон имеет 3 стабильных природных изотопа.
Изотопы неона – Встречающиеся в природе стабильные изотопы: 20Ne, 21Ne, 22Ne.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode |
|---|---|---|---|---|---|---|
| 16Ne | 10 | 6 | 16 | Synthetic | ||
| 17Ne | 10 | 7 | 17 | Синтетика | ||
| 18Ne | 10 | 8 | 18 | Synthetic | ||
| 19Ne | 10 | 9 | 19 | Synthetic | ||
| 20Ne | 10 | 10 | 20 | 90. |


 Таблицы ниже для термических свойств. 248,59 ° C, -415,462 ° F)
Таблицы ниже для термических свойств. 248,59 ° C, -415,462 ° F)