Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Никель как химический элемент таблицы Менделеева
Н Никель является химическим элементом таблицы Менделеева с атомным номером 28 и условным обозначением Ni. Никель представляет собой серебристо-белый блестящий металл с золотистым оттенком.
Содержание
- Как был открыт Никель;
- Где и как добывают Никель;
- Распространенность Никеля;
- Применение Никеля;
- Интересные факты
История никеля как химического элемента начинается сравнительно недавно. Дело в том, что никель очень похож на серебро и осознанное применение никеля началось относительно недавно. Ключевое слово в предыдущей фразе «осознанное», так как анализы археологов показывают, что изделия из никеля можно отследить вплоть до 3500 года до Нашей Эры. Древнекитайские тексты указывают на то, что медноникелевый сплав (купферникель) был довольно популярен начиная приблизительно с 1700 по 1500 год до Нашей Эры. В те времена ее называли «белая медь». Такие правители Агафокл Дикайос(190 — 180 год до Нашей Эры), Евтидем II(180 год до Нашей Эры) чеканили монеты именно из этого сплава.
Дело в том, что никель очень похож на серебро и осознанное применение никеля началось относительно недавно. Ключевое слово в предыдущей фразе «осознанное», так как анализы археологов показывают, что изделия из никеля можно отследить вплоть до 3500 года до Нашей Эры. Древнекитайские тексты указывают на то, что медноникелевый сплав (купферникель) был довольно популярен начиная приблизительно с 1700 по 1500 год до Нашей Эры. В те времена ее называли «белая медь». Такие правители Агафокл Дикайос(190 — 180 год до Нашей Эры), Евтидем II(180 год до Нашей Эры) чеканили монеты именно из этого сплава.
Открытие самого химического элемента произошло только в 1751 году. В этом году шведский химик и минеролог Аксель Фредерик Кронштедт обнаружил ранее неизвестный металл в купферникеле. Аксель назвал этот элемент в честь горного духа Никеля. Купферникель долгое время был единственным источником никеля на Земле, пока не открыли рудники кобальта, где никель является побочным продуктом производства.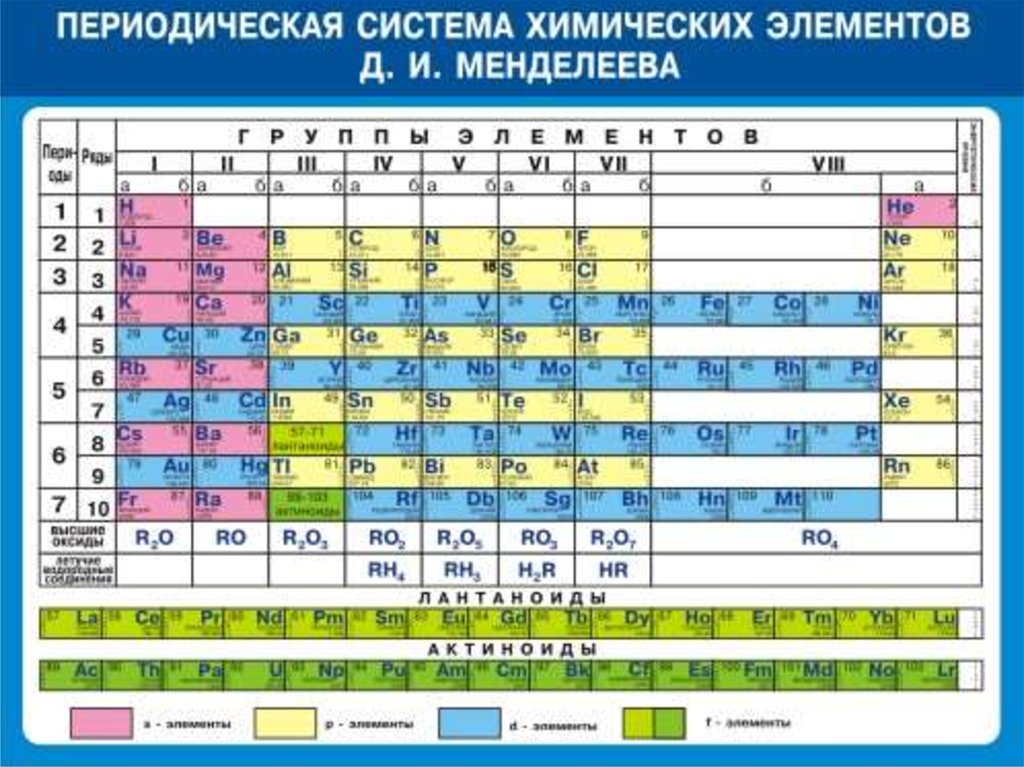 Это событие произошло около 1824 года. Первая крупномасштабная плавка никеля началась в Норвегии в 1848 году из пирротина. Далее начали открывать и осваивать новые источники никеля. В том числе и в России была обнаружена и освоена никелевая шахта. Добыча никеля началась в Норильске в 1883 году.
Это событие произошло около 1824 года. Первая крупномасштабная плавка никеля началась в Норвегии в 1848 году из пирротина. Далее начали открывать и осваивать новые источники никеля. В том числе и в России была обнаружена и освоена никелевая шахта. Добыча никеля началась в Норильске в 1883 году.
Ежегодная мировая добыча никеля составляет около 2,3 млн тонн. Ведущими странами-производителями являются Индонезия, Филиппины, Россия, Австралия и Канада. Причем на Индонезию, Филиппины и Россию приходится около половины мировой добычи — 560, 340 и 210 тысяч тонн соответственно. Крупнейшими месторождениями, за вычетом РФ, в Европе является Финляндия и Греция. По предварительным оценкам у этих двух стран запасы никеля составляют более 130 миллионов тонн.
Сам никель добывают из никельсодержащей руды обычным методом обжига и восстановления. После этого процесса получается элемент чистотой порядка 75%. Во многих случаях изготовления нержавеющей стали такой чистоты никеля достаточно. Современных методов обработки никелевой руды достаточно много. При этом даже в некоторых случаях процент чистоты элемента увеличивается.
Современных методов обработки никелевой руды достаточно много. При этом даже в некоторых случаях процент чистоты элемента увеличивается.
Общая картина получения чистого никеля выглядит следующим образом. Сульфидная руда обрабатывается пирометаллургическими методами для получения штейна, который является промежуточным звеном при получении никеля. Никелевый штейн обрабатывается по методу Шеррита-Гордона, который заключается в первоначальном удалении меди с помощью сероводорода. Оставшееся соединение кобальта и никеля разделяется растворителем. В ходе этих операций получается никель чистотой свыше 99%.
Мировая цена на никель очень не стабильна и зависит от многих факторов. К примеру, в 2007 году стоимость тонны никеля оценивалась в 52 300 американских долларов. В 2017 году стоимость такой же массы оценивалась в 11 000$.
Распространенность НикеляРаспространенность такого химического элемента как никель является довольно неоднозначной. Содержание никеля в земной коре составляет около 0,008%.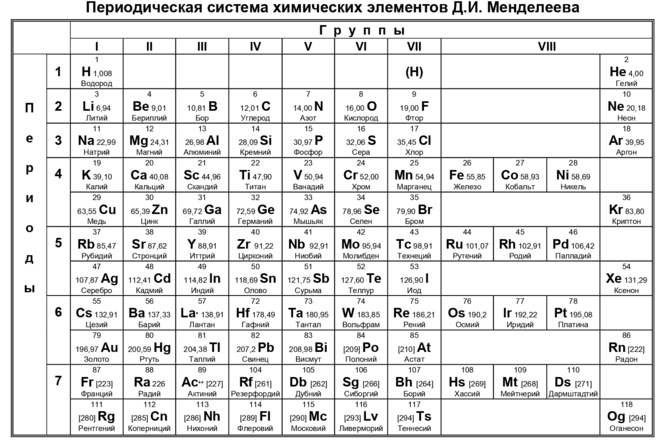 Основываясь на геохимических и геофизических данных предполагается, что большая часть никеля содержится в ядре Земли. Там он образует железно-никелевые сплавы при огромной температуре и его массовая доля составляет около 5%. В металлической (элементарной) форме никель встречается очень редко. На сегодняшний день по всему миру насчитывается только 50 мест. Эти месторождения принадлежат таким странам как Россия, США, Китай, Канада и Австралия.
Основываясь на геохимических и геофизических данных предполагается, что большая часть никеля содержится в ядре Земли. Там он образует железно-никелевые сплавы при огромной температуре и его массовая доля составляет около 5%. В металлической (элементарной) форме никель встречается очень редко. На сегодняшний день по всему миру насчитывается только 50 мест. Эти месторождения принадлежат таким странам как Россия, США, Китай, Канада и Австралия.
Большая часть производства никеля основана на сульфидных рудах и никельсодержащих минералах. К сульфидным рудам относят пентландит и никелевый магнитный гравий. В пентландите массовая доля никеля может достигать 35%. Вообще, чтобы добывать никель было экономически выгодно его содержание в источнике(минерале или руде) должно превышать 0,5%.
К латеритным никельсодержащим рудам относятся латерит, гарнерит, непуит и вилемсит. Особенно важными никельсодержащими минералами являются миллерит и никелит. В этих минералах содержание никеля может составлять свыше 60%. Правда эти минералы являются довольно редкими. На сегодняшний день современной науке известно окодо 200 никельсодержащих минералов. Самым редкими из них являются бунсенит, хеазлвудит и аваруит. Самое высокое содержание никеля в бунсените — 78,8%, а в хеазлвудите и аваруите по 73% и 72% соответственно.
Правда эти минералы являются довольно редкими. На сегодняшний день современной науке известно окодо 200 никельсодержащих минералов. Самым редкими из них являются бунсенит, хеазлвудит и аваруит. Самое высокое содержание никеля в бунсените — 78,8%, а в хеазлвудите и аваруите по 73% и 72% соответственно.
Применение никеля на сегодняшний день является не самым широким. В процентном соотношении их можно разделить на следующие подгруппы. 68% никеля расходуется на производство нержавеющих сталей. 10% расходуется на производство цветных сплавов. 9% приходится на изготовление гальванических покрытий. 7% тратится ежегодно на производство легированных сталей. 3% расходуется на литейное производство и оставшиеся 4% на другие нужды, в том числе и на производство батарей.
Никель используется во многих специфических и узнаваемых промышленных и потребительских товарах. В пример можно привести алникомагниты, монеты, заряжаемые батареи, гитарные струны и исполнительные элементы микрофонов.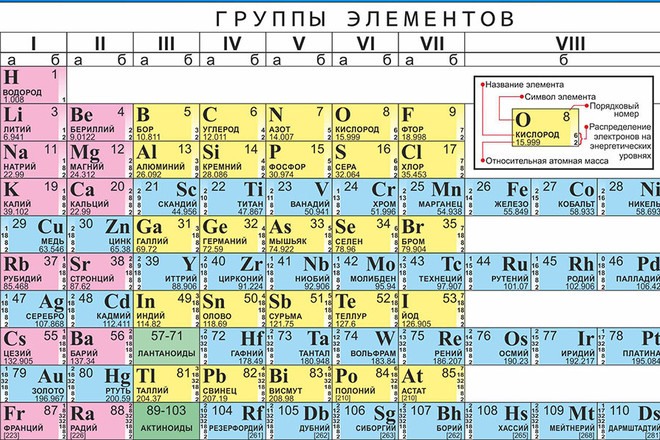 Так же никель используется в качестве гальванических покрытий на сантехнике и специальных сплавах, таких как пермаллой, элинвар и инвар. Еще одним практическим применением никеля является окрашивание стекла в зеленый цвет.
Так же никель используется в качестве гальванических покрытий на сантехнике и специальных сплавах, таких как пермаллой, элинвар и инвар. Еще одним практическим применением никеля является окрашивание стекла в зеленый цвет.
Никель преимущественно является легированным металлом, и его основное применение — в никелевых сталях и никелевых чугунах, в которых он обычно увеличивает предел прочности на разрыв, ударную вязкость и предел упругости. Он широко используется во многих других сплавах, в том числе никелевых латунях и бронзах, а также в сплавах с медью, хромом, алюминием, свинцом, кобальтом, серебром и золотом. Никелевая пена или никелевая сетка используется в газодиффузионных электродах для щелочных топливных элементов.
Интересные фактыИнтересных фактоа связанных с никелем достаточно много. В первую очередь стоит отметить тот факт, что никель является довольно аллергенным веществом. У людей с повышенной чувствительностью возможно возникновение никелевой аллергии. Около 10% от всех новорожденных детей имеют повышенную чувствительность к никелю. За 2008 год Американское сообщество контактного дерматита признало никель аллергеном года. В ученом мире существует довольно много интересных теорий. Одной из таких является то, что никель выделившийся в результате извержения вулканов способствовал росту количества бактерий Methanosarcina. Этот вид бактерий способен вырабатывать метан и в результате извержений вулканов «Сибирской ловушки» в этой местности погибли все анаэробные организмы. Количество этих бактерий увеличилось на столько, что производимый ими метан попросту вытеснил кислород.
Около 10% от всех новорожденных детей имеют повышенную чувствительность к никелю. За 2008 год Американское сообщество контактного дерматита признало никель аллергеном года. В ученом мире существует довольно много интересных теорий. Одной из таких является то, что никель выделившийся в результате извержения вулканов способствовал росту количества бактерий Methanosarcina. Этот вид бактерий способен вырабатывать метан и в результате извержений вулканов «Сибирской ловушки» в этой местности погибли все анаэробные организмы. Количество этих бактерий увеличилось на столько, что производимый ими метан попросту вытеснил кислород.
Никель (Ni) – Периодическая таблица
| Из Википедии, свободной энциклопедии Никель — химический элемент с символом Ni и атомным номером 28. Это серебристо-белый блестящий металл с легким золотистым оттенком . Никель относится к переходным металлам, тверд и пластичен. Подробнее в Википедии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Никель в периодической таблице | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Символ | Ni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number | 28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Element category | Transition Metal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | Твердое тело | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность | 9,0026 9,02608 g/cm 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic weight | 58. 6934 u 6934 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1728 K 1454.85 °C 2650.73 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3003 K 2729.85 °C 4945.73 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Atomic properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity (Pauling Scale) | 1.91 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron affinity | 111.65 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, −1, 0, +1, +2, +3, +4 (a mildly basic oxide) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Electron configuration | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration (shorthand) | [ AR] 3d 8 4S 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | 1S 2 2S 2 2P 6 3S 2 3P 7 6 3S 2 3P 7 0084 3d 8 4s 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 16, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
History | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovered | 1751 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovered by | Аксель Фредрик Кронстедт | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Никель (Ni) – Атомный номер 28
Произносится
NIK-l
Никель (Ni) представляет собой металл с серебристо-белым атомным номером 2 в таблице Менделеева.
 Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет символ Ni.
Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет символ Ni.Никель содержится в земной коре в небольших количествах, как правило, в минеральных породах и более крупных обломках железоникелевых метеоритов. Предполагается, что ядро Земли, содержащее железо, также содержит некоторые компоненты никеля с самых первых дней Большого взрыва. Никель был впервые выделен Акселем Фредриком Кронстедтом, который первоначально считал, что это медь, вместо этого он произвел белый металл, который назвал в честь немецкого спирта Никель. Никель, как железо и кобальт, обладает магнитными свойствами. Никель имеет широкий спектр применения. Он в основном используется в производстве нержавеющей стали из-за его коррозионно-стойких свойств. Он также широко используется для изготовления монет по всему миру. Он находится в группе 10 и имеет температуру плавления 1455°C и точку кипения 2730°C, являясь твердым металлом при комнатной температуре.
Загрузите никель в виде изображения для печати и с полным масштабированием
Загрузите его бесплатно здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления никеля?
Никель имеет температуру плавления 1453°C, что означает, что при 1453°C он превратится в жидкость.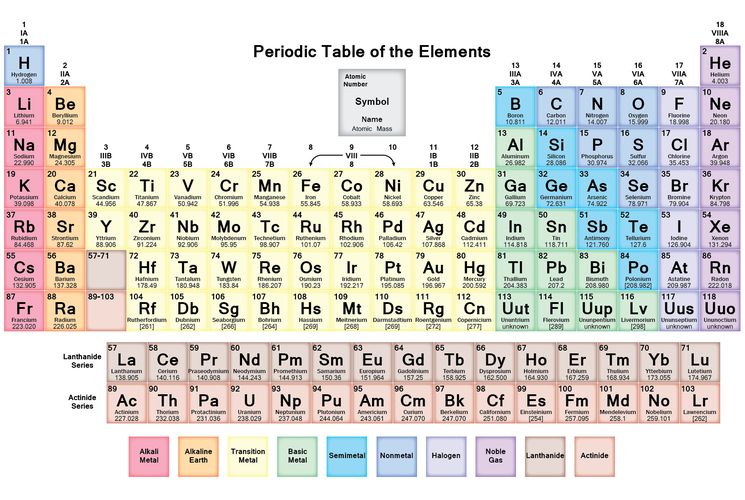
Какова температура кипения никеля?
Никель имеет температуру кипения 2913°C, что означает, что при 2913°C он превратится в газ.
Что такое электроотрицательность никеля?
Электроотрицательность никеля равна 1,91. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Открыт
Акселем Кронштедтом
Дата открытия
1751
Что такое Теплота испарения никеля?
Никель имеет теплоту парообразования 370,4 кДж/моль.
Использование
Используется в гальванике и металлических сплавах из-за его устойчивости к коррозии. Также в никель-кадмиевых батареях; как катализатор и за монеты.
Источники
В основном встречается в пентландитовой [(Ni,Fe)9S8] руде. Металл получают путем нагревания руды в доменной печи, в которой сера заменяется кислородом. Затем оксиды обрабатывают кислотой, которая реагирует с железом, а не с никелем.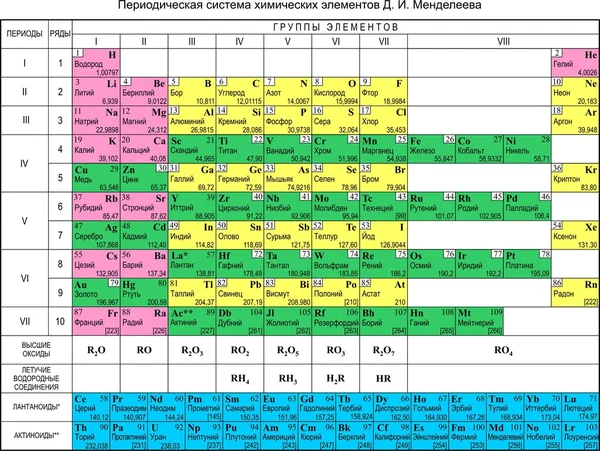
Об авторе
Натан М
Автор
Натан имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Citation
“Nickel” Published on Dec 30, 2019. https://breakingatom.com/elements/nickel
28
Protons
28
Electrons
31
Neutrons
Element Symbol
Ni
Атомный вес
58,693
Атомный номер
28
СОСТОЯНИЕ
SOLID
ПЕРЕДАНА
UNTONKNITY
1453
° C
1111111111 2
1453
° C
11111111111119
1453
° C
9
1453
° C
1453
° C 9001
2913
Unknown
°C
Heat of Vaporization
370.

 0005
0005