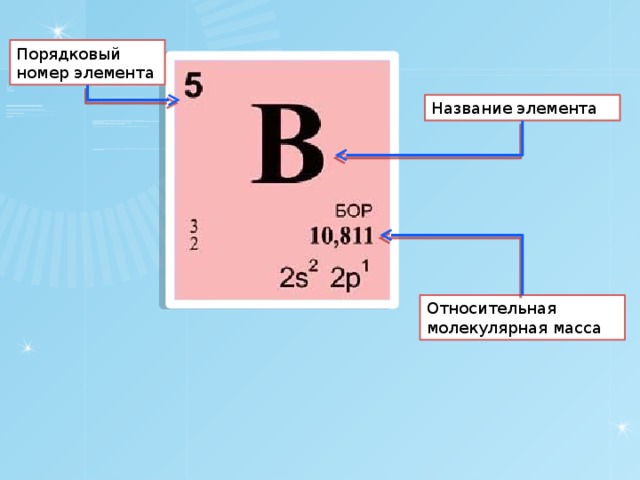
Атом
Атом
Atom
Атом – наименьшая
составная часть вещества, сохраняющая его химические свойства. Атом состоит
из тяжелого положительно заряженного ядра, имеющего размер ~10–13 см и электронов, образующих электронные оболочки атома. Размеры атомов определяются
размерами их электронных оболочек и составляют ~10–8 см. В обычных
условиях атомы электронейтральны — число электронов в атоме равно числу
протонов в атомном ядре. Заряд ядра определяет порядковый номер атома в
Периодической системе элементов Д.И. Менделеева. Так как масса электрона
в ~2000 раз меньше массы протона или нейтрона, масса атома примерно равна
сумме масс нейтронов и протонов, образующих атомное ядро. Простейшим атомом
является атом водорода, состоящий из одного протона и одного электрона.
При одном и том же числе протонов в ядре, оно может содержать различное
число нейтронов. Такие ядра называются изотопами. Однако различие в числе
нейтронов в ядре практически не сказывается на химических свойствах атомов.
Для атомов, содержащих несколько электронов необходимо наряду с кулоновским
взаимодействием электронов с ядром учитывать также взаимодействие электронов
между собой. Для описания состояний отдельных электронов в атоме используется
приближение самосогласованного поля, при котором считается, что каждый электрон
находится в центрально симметричном потенциальном поле, обусловленном его
кулоновским взаимодействием с ядром и всеми другими электронами.
Однако различие в числе
нейтронов в ядре практически не сказывается на химических свойствах атомов.
Для атомов, содержащих несколько электронов необходимо наряду с кулоновским
взаимодействием электронов с ядром учитывать также взаимодействие электронов
между собой. Для описания состояний отдельных электронов в атоме используется
приближение самосогласованного поля, при котором считается, что каждый электрон
находится в центрально симметричном потенциальном поле, обусловленном его
кулоновским взаимодействием с ядром и всеми другими электронами.
 .., ±1, ±0 и проекции спинового
момента ms электрона, принимающей 2s+1 = 2 (s = 1/2) значения
ms = ±1/2. Таким образом, кратность вырождения N уровня с определенными
значениями квантовых чисел n и l равна N = (2s+1)(2l+1) = 2(2l+1). Совокупность
2(2l+1) состояний с данными n и l образует
.., ±1, ±0 и проекции спинового
момента ms электрона, принимающей 2s+1 = 2 (s = 1/2) значения
ms = ±1/2. Таким образом, кратность вырождения N уровня с определенными
значениями квантовых чисел n и l равна N = (2s+1)(2l+1) = 2(2l+1). Совокупность
2(2l+1) состояний с данными n и l образует Замкнутая s оболочка (l=0) содержит 2 электрона
N = (2s+1)(2l+1) = (2·(1/2)+1)(2·0+1) = 2.
Замкнутая р оболочка (l=1) содержит 6 электронов
N = (2s+1)(2l+1) = (2·(1/2+1)(2·1+1) = 6.
Замкнутая d оболочка содержит 10 электронов.
Все электроны с заданным квантовым числом n образуют электронный
слой, содержащий 2n Максимальное число электронов в K, L, M, N-слоях приведено
в таблице.
Максимальное число электронов в K, L, M, N-слоях приведено
в таблице.
Максимальное число электронов K, L, M, N-слоях
| K-слой | L-слой | M-слой | N-слой |
| n = 1 | n = 2 | n = 3 | n = 4 |
| l = 0 | l = 0, 1 | l = 0, 1, 2 | l = 0, 1, 2, 3 |
| 2 электрона | 2 + 6 = 8 электронов | 2 + 6 + 10 = 18 электронов | 2 + 6 + 10 + 14 = 32 электрона |
Наиболее близко к ядру расположен К-слой, затем L-слой и т.д. При заданном
значении n сначала заполняются состояния с l = 0, затем l = 1, l = 2 и т. д.
д.
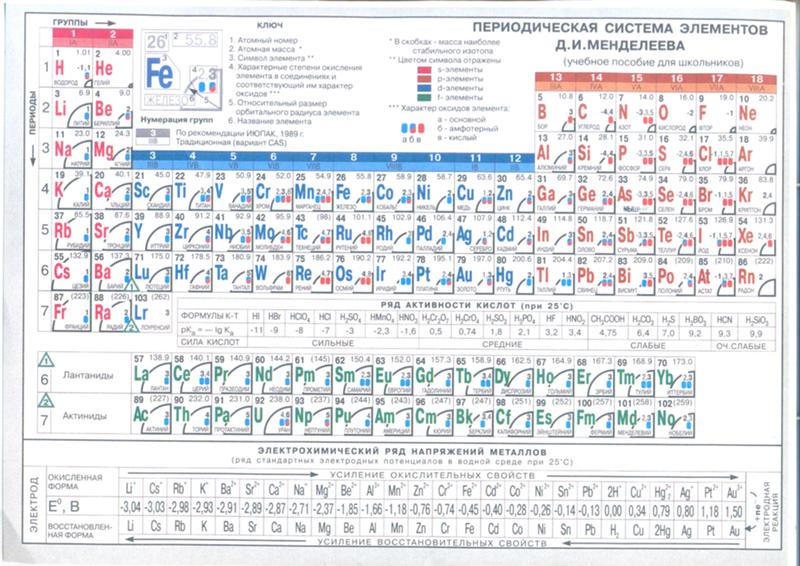
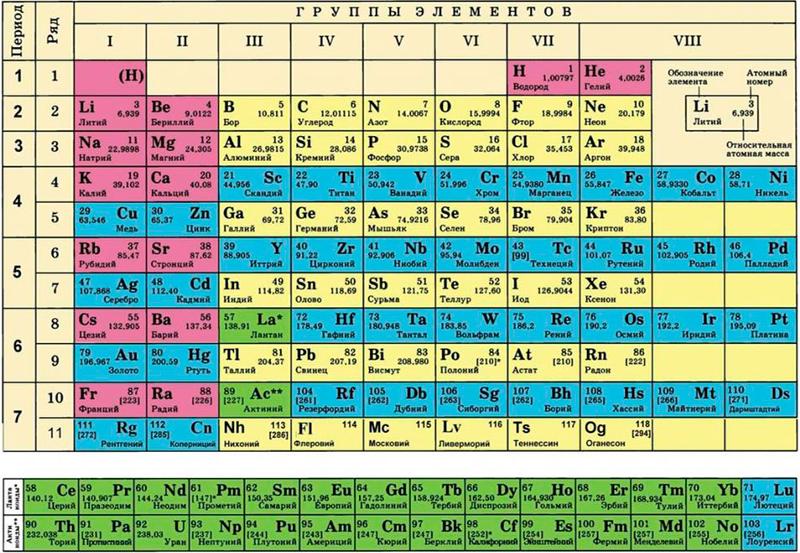
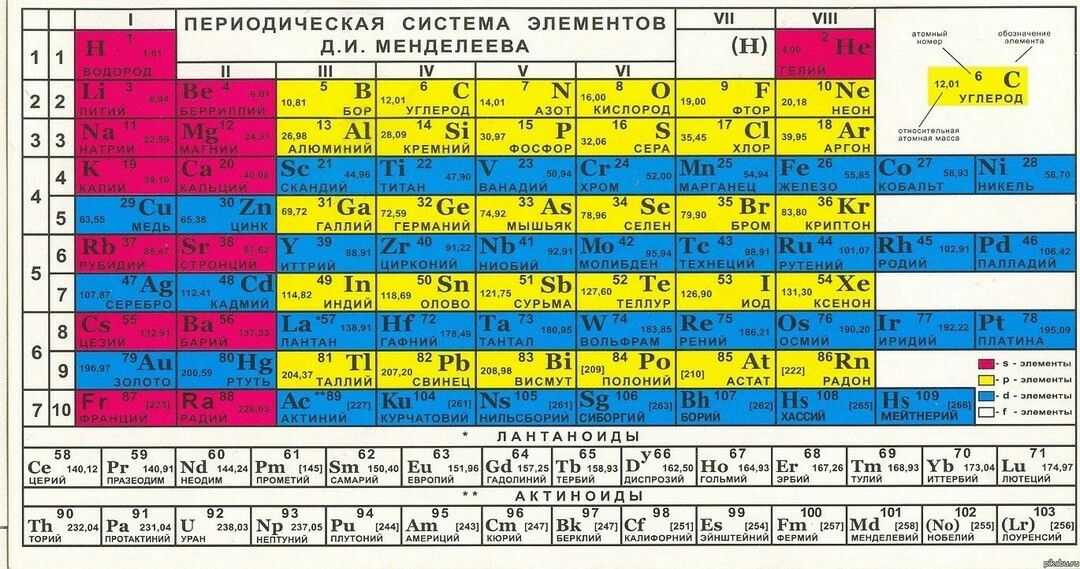
Последовательное заполнение электронных слоев объясняет Периодический
закон элементов, открытый Д.И. Менделеевым. Периоды в Периодической системе
Д.И. Менделеева соответствуют последовательному заполнению оболочек. Для
элементов 1 периода происходит заполнение оболочки 1s. Для элементов 2 и
3 периодов — заполнение оболочек 2s, 2p, 3s, 3p, 3d. Однако по мере увеличения
числа электронов (заряда ядра Z) такой порядок заполнения нарушается из-за
конкуренции близких по энергии связи электронов. Справедливо следующее правило:
чем меньше l, тем сильнее волновая функция проникает в область, экранируемую
облаком внутренних электронов. В результате этого при заданном значении
n энергия электронов возрастает с увеличением l (рис.).
Правило Маделунга. Из двух оболочек ниже по энергии располагается та, для которой величина n = l оказывается наименьшей. Если для двух оболочек значения сумм n = l совпадают, то ниже по энергии лежит оболочка с меньшим значением n. |
| Рис. Относительное расположение электронных оболочек атомов (не в масштабе). Справа указан заряд Z ядра атома, с которого начинается заполнение указанной подоболочки. |
Распределение электронов в атоме по оболочкам определяет
его электронную конфигурацию. Так, например, электронная конфигурация атома 27Al, имеющего 13 электронов, записывается в виде 1s2 2s2 2p6 3s2 3p1. Последовательно
выписываются электронные оболочки, начиная от ближайшей к ядру. Верхний
индекс указывает число электронов на данной оболочке. Последовательность
заполнения электронами различных атомных оболочек приведена в таблице П2
(Приложение).
Для каждой электронной конфигурации можно построить определённое количество термов (состояний), характеризующихся определёнными значениями полного орбитального момента
полного спинового момента
и полного момента количества движения
всех электронов данного атома.
Электростатическое и спин-орбитальное взаимодействия электронов атома
приводят к тому, что терм расщепляется на несколько состояний – мультиплет,
число компонентов которого определяется числом возможных ориентаций векторов
и
в пространстве,
т.е. числом возможных значений квантового числа j.
L = | 0 | 1 | 2 | 4 | 5 | |
S | P | D | F | G | H |
Сверху слева от этого символа указывается величина 2s+1, а справа внизу
значение полного момента J.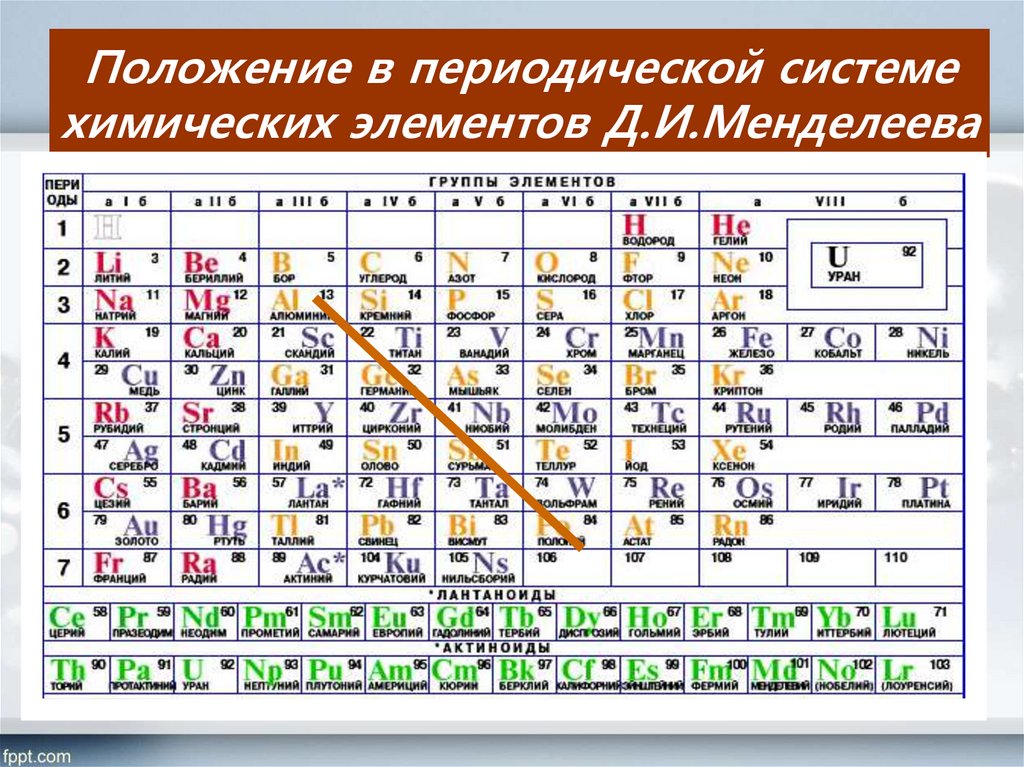
Конкуренция спин-орбитального и электростатического взаимодействий определяет порядок сложения орбитальных и спиновых моментов. В том случае, когда электростатическое взаимодействие много больше спин-орбитального, орбитальные моменты отдельных электронов складываются в полный орбитальный момент L. Спиновые моменты отдельных электронов складываются в полный спиновый момент S.
= + .
Такая схема связи называется L–S связью. В основном она реализуется для
основных состояний лёгких ядер.
Для определения основного терма данной конфигурации используют эмпирические правила Хундта.

Ниже по энергии лежит терм, у которого мультиплетность является максимальной.
При равенстве мультиплетностей нескольких термов минимальной энергией обладает терм с максимальным значением суммарного орбитального момента конфигурации.
Если атомная подоболочка заполнена менее, чем наполовину, наименьшую энергию имеет состояние с минимальным значением J, если атомная оболочка заполнена более, чем наполовину, то наименьшую энергию имеет состояние с максимальным J.
Наряду с электронной конфигурацией, соответствующей наибольшей энергии связи всех электронов атома, при возбуждении одного или нескольких электронов образуются возбуждённые электронные конфигурации. Переходы между различными термами атома образуют спектр возбуждённых состояний атома.
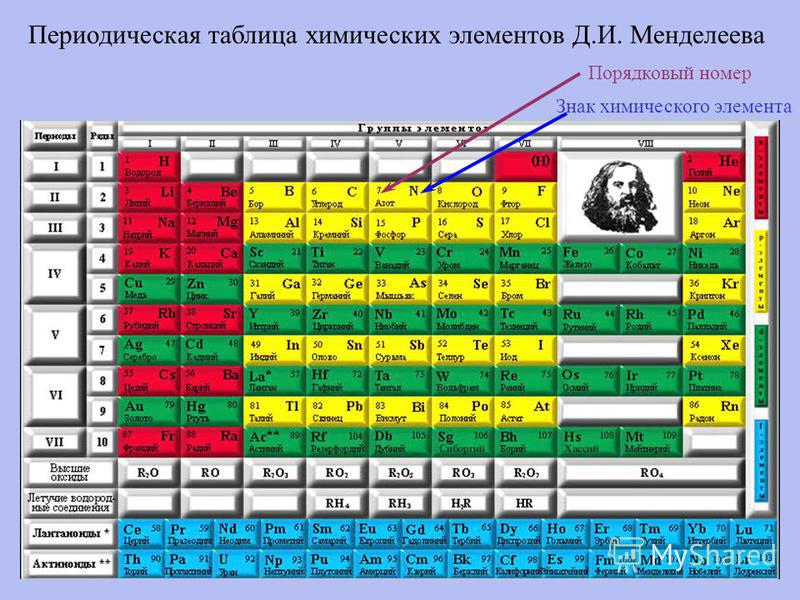
ЕГЭ. Периодический закон и Периодическая система химических элементов Д.
 И. Менделеева. Строение атома 11 класс
И. Менделеева. Строение атома 11 классТема 2: Строение атома. Периодический закон
Урок 4: ЕГЭ. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение атома
- Видео
- Тренажер
- Теория
Заметили ошибку?
Задания с выбором ответов
|
Вопрос |
Комментарий |
|
А1. Из каких частиц состоит атомное ядро?
|
Атом – это электронейтральная частица, состоящая из протонов, нейтронов и электронов. Протоны и нейтроны входят в состав ядра атома, а электроны вращаются вокруг. Правильный ответ 2. |
|
А2. Что такое изотопы?
|
Изотопы – это атомы одного химического элемента. У них одинаковое число электронов и протонов в атоме, но разное число нейтронов и поэтому разная масса. Правильный ответ 3. |
|
А3. Что называется химическим элементом?
|
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Правильный ответ 1. |
|
А4. Какая частица состоит из 8 протонов, 10 нейтронов и 8 электронов?
|
Находим в периодической системе элемент № 8. Это кислород. Прибавив к 8 протонам 10 нейтронов, получим массу атома 18. Это 18О. Правильный ответ 2. |
|
А5. Электронная формула атома химического элемента – 1s22s22p63s23p4. Укажите знак элемента и формулу его высшего оксида.
|
Нужно просуммировать количество электронов, которое равно количеству протонов.
Правильный ответ 3. |
|
А6. Наиболее сильно выражены металлические свойства у:
|
Чем левее и ниже элемент расположен в Периодической системе, тем ярче выражены его металлические свойства. Все приведенные элементы, кроме фосфора, находятся в 6 группе. Фосфор – это типичный неметалл. Теллур (Те) находится ниже всех в группе. Правильный ответ 4. |
|
А7. Число электронов в атоме равно:
|
Атом – это электронейтральная частица, поэтому число электронов равно числу протонов. Правильный ответ 2. |
|
А8. К р-элементам относится:
|
Al находится в III-A группе. Электронное строение внешнего энергетического уровня …3s23p1. Правильный ответ 4. |
|
А9. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
По группе сверху вниз атомные радиусы увеличиваются, а по периоду слева направо – уменьшаются.
Правильный ответ 2. |
|
А10. Химический элемент расположен в IV периоде I-A группе.
|
Это 19К. Сумма электронов в ряду должна быть равна 19.
Правильный ответ 3. |
|
А11. Бром – это элемент
|
Бром – это галоген, элемент главной подгруппы VII группы.
Правильный ответ 3. |
|
А12. Элементу с зарядом ядра +12 соответствует высший оксид:
|
По заряду ядра находим этот элемент в Периодической системе.
Правильный ответ 1. |
|
А13. Электроное строение внешнего энергeтического уровня атома кремния: 1. …2s22p2 2. …3s23p2 3. …2s22p4 4. …3s23p4 |
Кремний находится в 3-ем периоде, поэтому у него три энергетических уровня. Не учитываем варианты с цифрой 2. Так как Si – в IV группе, то валентных электронов 4. Только во втором варианте сумма электрона равна 4.
Правильный ответ 2. |
Задания на соответствие
Задания с кратким ответом
В3. Химический элемент железо представлен в природе несколькими изотопами: 54Fe, 56Fe, 57Fe, 58Fe. Определить, сколько протонов содержат атомы всех этих изотопов.
Определить, сколько протонов содержат атомы всех этих изотопов.
При обозначении изотопов вверху пишется массовое число, т. е. сумма масс протонов и нейтронов. Для определения числа протонов нужно посмотреть положение железа в Периодической системе. Порядковый номер железа – 26, значит, ядро атома железа содержит 26 протонов.
Правильный ответ 26.
В4. Определить, сколько нейтронов содержит ядро атома изотопа неона-22.
Для определения числа нейтронов нужно посмотреть положение неона в Периодической системе. Порядковый номер неона – 10. Это количество протонов. Вычитаем из массового числа количество протонов, получаем число нейтронов. Это 12.
Правильный ответ 12.
В5. Какой заряд ядра имеют изотопы химического элемента фтора?
Порядковый номер фтора – 9. Значит, заряд его ядра будет равен +9.
Правильный ответ +9
В6. Ядро атома одного из изотопов калия содержит 21 нейтрон. Определить массовое число данного изотопа.
Определить массовое число данного изотопа.
Массовое число равно сумме количества нейтронов и протонов. Нужно сложить число протонов (19) и число нейтронов (21).
Правильный ответ 40.
В7. Определить число нейтронов в ядре атома фосфора -31.
Вычитаем из массового числа (31) его порядковый номер (15) получаем число нейтронов. Это 16.
Правильный ответ 16.
В8. Под номерами 1-3 в колонке слева приведены ряды химических элементов. Укажите, какими буквами в колонке справа обозначены закономерности, на основе которых составлен каждый из этих рядов.
|
1. Na, Mg, Al, Si, P, S, Cl |
А) Электроотрицательность уменьшается |
|
2. F, O, N, Cl |
Б) Изменяется характер химических свойств высших оксидов: основные свойства ослабевают, кислотные усиливаются |
|
3. |
В) Неметалличность свойств простых веществ, образованных химическими элементами, усиливается |
|
|
Г) Степени окисления атомов химических элементов в соединении с кислородом увеличиваются |
|
|
Д) Степени окисления атомов химических элементов в соединении с водородом увеличиваются |
|
|
Е) Радиусы атомов увеличиваются |
|
|
Ж) Степень окисления атомов в высших оксидах одинакова |
Комментарий к В8. При решении этого задания нужно вспомнить таблицу, которая приводилась в предыдущем уроке.
Закономерности изменения периодических свойств приведены в Табл.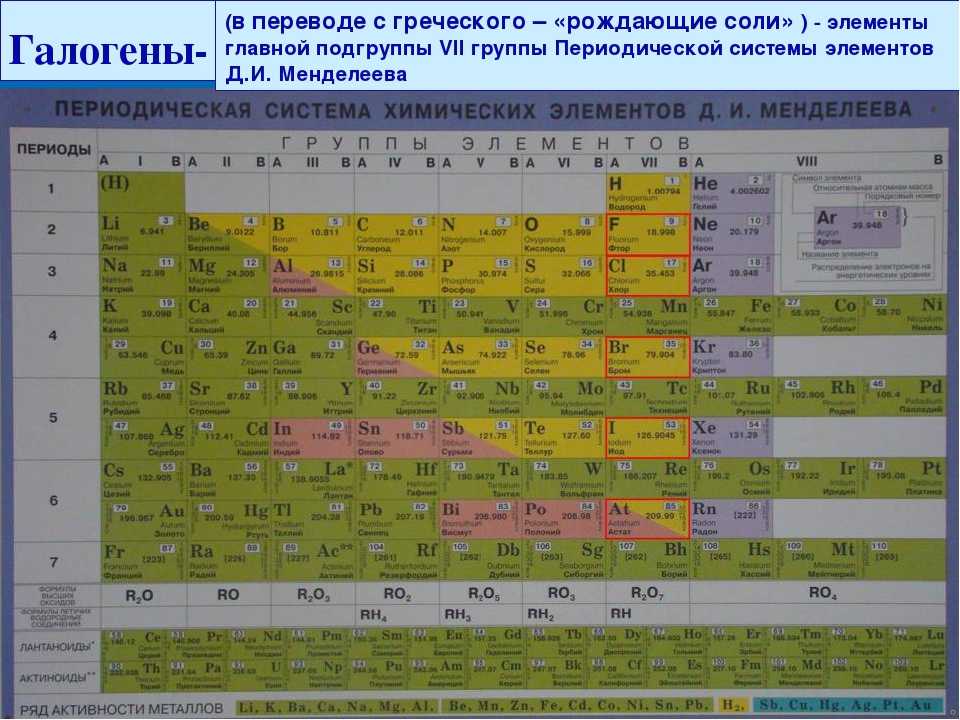 1.
1.
|
Параметр |
По группе вниз |
По периоду вправо |
|
Заряд ядра |
Увеличивается |
Увеличивается |
|
Число валентных электронов |
Не меняется |
Увеличивается |
|
Число энергетических уровней |
Увеличивается |
Не меняется |
|
Радиус атома |
Увеличивается |
Уменьшается |
|
Электроотрицательность |
Уменьшается |
Увеличивается |
|
Металлические свойства |
Увеличиваются |
Уменьшаются |
|
Степень окисления в высшем оксиде |
Не меняется |
Увеличивается |
|
Степень окисления в водородных соединениях (для элементов IV-VII групп) |
Не меняется |
Увеличивается |
Табл. 1.
1.
Представленные в вопросе элементы находятся либо в одном периоде, либо в одной группе.
- Na, Mg, Al, Si, P, S, Cl соответствуют варианты Б, В, Г
- F, O, N, Cl не соответствуют ни один из вариантов
- Be, Mg, Ca, Sr, Ba соответствуют варианты А, Е, Ж
Правильный ответ 1-Б В Г; 2-; 3-А Е Ж.
Задания с развернутым ответом
|
Вопрос |
Комментарий |
|
С1. Опишите химические свойства элемента с порядковым номером 23 по его положению в Периодической системе. |
Элемент № 23 – это ванадий V. Это металл, т. к. он находится в побочной подгруппе V группы, в 4-ом периоде. Его электронная конфигурация: 1s22s22p63s23p64s23d3. Летучих водородных соединений не образует. Высший оксид V2O5 – кислотный оксид. Как металл отдает свои валентные электроны. |
|
С2. Элемент образует высший оксид состава ЭО3. В летучем водородном соединении массовая доля водорода составляет 5,88 %. Рассчитайте относительную атомную массу элемента и назовите его. |
По формуле высшего оксида понятно, что элемент находится в VI группе. Формула водородного соединения – Н2Э. Массовая доля равна отношению массы элемента к суммарной массе соединения. Пусть атомная масса элемента будет Х. Тогда , отсюда Х = 200 : 5,88 – 2 = 32. Значит этот элемент – сера S. |
Подведение итога урока
На уроке были рассмотрены задачи ЕГЭ по теме «Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома». Мы научились характеризовать общие свойства химических элементов и их соединений на основе положения в химической системе Д. И. Менделеева.
Список литературы
- Рудзитис Г.
 Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. - Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Учебно-тренировочные материалы для подготовки к единому государственному экзамену. Химия / Каверина А. А., Добротин Д. Ю., Медведев Ю. Н., Корощенко А. С. – М.: Интеллект- Центр, 2011.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Официальный информационный портал Единого Государственного Экзамена (Источник)
- Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «Химик» (Источник)
Домашнее задание
- №№ 1-3 (с. 7) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.
 Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. - Какие закономерности наблюдают в изменении атомных радиусов в периодах слева направо и при переходе от одного периода к другому?
- Высший оксид состава RO3 образует элемент с электронной конфигурацией внешнего электронного слоя: 1) ns2np1; 2) ns2np3; 3) ns2np4; 4) ns2np6. Назовите этот элемент.
Заметили ошибку?
Расскажите нам об ошибке, и мы ее исправим.Видеоурок: ЕГЭ. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение атома по предмету Химия за 11 класс.
Химический элемент или элемент — это тип атома, отличающийся своим атомным номером; то есть по количеству протонов в его ядре. Этот термин также используется для обозначения чистого химического вещества, состоящего из атомов с одинаковым количеством протонов. Типичными примерами элементов являются водород, азот и углерод. Всего по состоянию на 2007 г. наблюдалось 117 элементов, из них 94 встречаются в природе на Земле. Элементы с атомным номером больше 82 (висмут и выше) по своей природе нестабильны и подвергаются радиоактивному распаду. Элементы 43 и 61 (технеций и прометий) также не имеют стабильных изотопов и распадаются. Элементы до атомного номера 94, не имеющие стабильных ядер, тем не менее, встречаются в природе и образуются в результате естественного распада урана и тория. [2] Все химические вещества состоят из этих элементов. Новые элементы время от времени открывают как продукты искусственных ядерных реакций. Дополнительные рекомендуемые знания
ИсторияТермин «элементы» ( stoicheia ) впервые был использован греческим философом Платоном примерно в 360 г. до н. э. в его диалоге «Тимей», который включает обсуждение состава неорганических и органических тел и представляет собой рудиментарный трактат по химии. Платон предполагал, что мельчайшая частица каждого элемента соответствует одному из правильных многогранников: тетраэдру (огонь), октаэдру (воздух), икосаэдру (вода) и кубу (земля). [3]
Добавляя к четырем элементам греческого философа Эмпедокла, примерно в 350 г.
Основываясь на этой теории, в c. В 790 году арабский химик Джабир ибн-Хайян (Гебер) постулировал, что металлы образовались из двух элементов: серы, «горящего камня», характеризующего принцип горючести, и ртути, содержащей идеализированный принцип металлических свойств. [5] Вскоре после этого это превратилось в арабскую концепцию трех принципов: сера дает воспламеняемость или горение, ртуть дает летучесть и стабильность, а соль придает твердость. В 1524 году швейцарский химик Парацельс принял теорию четырех элементов Аристотеля, но рассудил, что они появляются в телах как три принципа Гебера. Парацельс считал эти принципы фундаментальными и обосновывал их, обращаясь к описанию того, как дерево горит в огне. В 1669 году немецкий врач и химик Иоганн Бехер опубликовал свою книгу Physica Subterranea. Модифицируя идеи Парацельса, он утверждал, что составными частями тел являются воздух, вода и три типа земли: terra fluida , ртутный элемент, который способствует текучести и изменчивости; terra lapida , отвердитель, придающий плавкость или связующее качество; и terra pinguis , жировой элемент, придающий материальному веществу его маслянистые и горючие свойства. [6] Эти три земли соответствуют трем принципам Гебера. Кусок дерева, например, по Бехеру, состоит из ясеня и терра пингвина; когда древесина сгорает, terra pinguis высвобождается, оставляя пепел. Другими словами, при горении жирная земля сгорает. В 1661 году Роберт Бойль показал, что существует больше, чем четыре классических элемента, как предполагали древние. [7] Первый современный список химических элементов был дан Антуаном Лавуазье в 1789 г. Elements of Chemistry , который содержал тридцать три элемента, в том числе легкие и калорийные. К 1818 году Йонс Якоб Берцелиус определил атомный вес сорока пяти из сорока девяти принятых элементов. В 1869 году в знаменитой периодической таблице Менделеева, показанной ниже, было шестьдесят шесть элементов.
От Бойля до начала 20 века элемент определялся как чистое вещество, которое нельзя разложить на более простое вещество. [7] Иными словами, химический элемент не может быть преобразован в другие химические элементы с помощью химических процессов. В 1913 Генри Мозли обнаружил, что физической основой атомного номера атома является его ядерный заряд, что в конечном итоге привело к нынешнему определению. Текущее определение также позволяет избежать некоторых неясностей, связанных с изотопами и аллотропами. К 1919 году было известно семьдесят два элемента. [8] В 1955 году был открыт элемент 101, названный менделевием в честь Менделеева, который первым расположил элементы в периодическом порядке. В октябре 2006 г. было сообщено о синтезе 118-го элемента; однако элемент 117 еще не создан в лаборатории. ОписаниеСамыми легкими элементами являются водород и гелий, оба образовались в результате нуклеосинтеза Большого взрыва в течение первых 20 минут существования Вселенной [9] в соотношении примерно 3:1 по массе (примерно 12:1 по количеству атомов). Почти все другие элементы, обнаруженные в природе, в том числе некоторые дополнительные водород и гелий, созданные с тех пор, были получены с помощью различных естественных или (иногда) искусственных методов нуклеосинтеза, включая иногда такие действия, как ядерное деление. По состоянию на 2006 год известно 117 элементов (в данном контексте «известный» означает наблюдаемый достаточно хорошо, даже по нескольким продуктам распада, чтобы его можно было отличить от любого другого элемента). Остальные 22 элемента, не обнаруженные на Земле или в астрономических спектрах, были получены искусственно. Все исключительно искусственно полученные элементы радиоактивны с очень коротким периодом полураспада; если какие-либо атомы этих элементов присутствовали при формировании Земли, они, весьма вероятно, уже распались, а если и присутствовали в новых, то в количествах, слишком малых, чтобы их можно было заметить. Технеций был первым якобы не встречающимся в природе элементом, который был синтезирован в 1937, хотя следовые количества технеция с тех пор были обнаружены в природе, и этот элемент, возможно, был обнаружен естественным путем в 1925 году. Доступны списки элементов по названию, по символу, по атомному номеру, по плотности, по температуре плавления и температуре кипения, а также по энергиям ионизации элементов. Наиболее удобное представление элементов — периодическая таблица, в которой элементы со схожими химическими свойствами сгруппированы вместе. Атомный номерАтомный номер элемента, Z , равен количеству протонов, которое определяет элемент. Например, все атомы углерода содержат в своем ядре 6 протонов; поэтому атомный номер «Z» углерода равен 6. Атомы углерода могут иметь разное количество нейтронов, которые известны как изотопы элемента. Количество протонов в ядре атома также определяет его электрический заряд, который, в свою очередь, определяет электроны атома в его неионизированном состоянии. Это, в свою очередь (с помощью принципа запрета Паули) определяет различные химические свойства атома. Атомная массаМассовое число элемента, A , представляет собой число нуклонов (протонов и нейтронов) в атомном ядре. Различные изотопы данного элемента отличаются своими массовыми числами, которые обычно записываются в виде супериндекса в левой части атомного символа (например, 238 U). Относительная атомная масса элемента представляет собой среднее значение атомных масс всех изотопов химического элемента, обнаруженных в определенной среде, взвешенное по содержанию изотопов, относительно единицы атомной массы (u). Это число может быть дробью, которая не близка к целому числу из-за процесса усреднения. С другой стороны, атомная масса чистого изотопа весьма близка к его массовому числу. Изотопы Изотопы — это атомы одного и того же элемента (то есть с одинаковым числом протонов в атомном ядре), но имеющие различных чисел нейтронов. Большинство встречающихся в природе элементов имеют более одного изотопа. Так, например, существуют три основных изотопа углерода. Все атомы углерода имеют в ядре 6 протонов, но могут иметь 6, 7 или 8 нейтронов. Все три изотопа углерода имеют одинаковые химические свойства. Но у них разные ядерные свойства. В этом примере углерод-12 и углерод-13 являются стабильными атомами, а углерод-14 нестабилен; он слегка радиоактивен и со временем распадается на другие элементы. Как и углерод, некоторые изотопы различных элементов радиоактивны и распадаются на другие элементы при излучении альфа- или бета-частиц. Для некоторых элементов все их изотопы являются радиоактивными изотопами: в частности, элементами без стабильных изотопов являются технеций (атомный номер 43), прометий (атомный номер 61) и все наблюдаемые элементы с атомными номерами больше 82. Аллотропы Некоторые элементы можно найти в виде нескольких элементарных веществ, известных как аллотропы, которые различаются по своей структуре и свойствам. Стандартное состояниеСтандартное состояние или эталонное состояние элемента определяется как его термодинамически наиболее стабильное состояние при давлении 1 бар при заданной температуре (обычно при 298,15 К). В термохимии элемент определяется как имеющий нулевую энтальпию образования в стандартном состоянии. Например, эталонным состоянием углерода является графит, потому что он более стабилен, чем другие аллотропы. Номенклатура Названия элементов предшествуют атомной теории вещества, хотя в то время не было известно, какие химические вещества являются элементами, а какие соединениями. Когда стало известно, существующие имена ( , например, золото, ртуть, железо) сохранялись в большинстве стран, и возникли национальные различия в названиях элементов либо из-за удобства, либо из-за лингвистических тонкостей, либо из-за национализма. Но для международной торговли официальные названия химических элементов, как древних, так и недавних, определяются Международным союзом теоретической и прикладной химии, который принял решение о своего рода международном английском языке. Эта организация недавно предписала, чтобы «алюминий» и «цезий» заменяли американское написание «алюминий» и «цезий», а американское «сера» — вместо британского «сера». Однако химические вещества, которые можно продавать оптом во многих странах, по-прежнему имеют национальные названия, и нельзя ожидать, что те химические вещества, которые не используют латинский алфавит, будут использовать название ИЮПАК. Согласно ИЮПАК, полное название элемента не пишется с заглавной буквы, даже если оно происходит от имени собственного, такого как элементы калифорний или эйнштейний (если только оно не будет писаться с заглавной буквы по какому-либо другому правилу). Во второй половине двадцатого века физические лаборатории получили возможность производить ядра химических элементов, период полураспада которых слишком мал, чтобы их можно было сохранить в сколько-нибудь заметных количествах. Они также названы IUPAC, который обычно принимает имя, выбранное первооткрывателем. Это может привести к спорному вопросу о том, какая исследовательская группа на самом деле открыла элемент, вопросу, который на значительное время задержал присвоение названий элементам с атомным номером 104 и выше. (См. Споры об именах элементов). Предшественниками таких споров были националистические названия элементов в конце девятнадцатого века. Например, лютеций был назван в честь Парижа, Франция. Немцы не хотели уступать права на название французам, часто называя его cassiopeium . Британский первооткрыватель ниобия первоначально назвал его колумбием, в отношении Нового Света. Химические символы
Конкретные химические элементыДо того, как химия стала наукой, алхимики разработали тайные символы как для металлов, так и для обычных соединений. Однако они использовались в качестве сокращений на диаграммах или процедурах; не существовало представления об объединении атомов в молекулы. С его достижениями в атомной теории материи Джон Дальтон разработал свои собственные более простые символы, основанные на кругах, которые должны были использоваться для изображения молекул. Текущая система химических обозначений была изобретена Берцелиусом. В этой типографской системе химические символы не используются как простые аббревиатуры — хотя каждый из них состоит из букв латинского алфавита — это символы, предназначенные для использования людьми всех языков и алфавитов. Химические символы понимаются на международном уровне, когда названия элементов могут нуждаться в переводе. Иногда есть различия; например, немцы использовали «J» вместо «I» для обозначения йода, чтобы этот символ нельзя было спутать с римской цифрой. Первая буква химического символа всегда заглавная, как и в предыдущих примерах, а последующие буквы, если они есть, всегда строчные (строчные). Общие химические символыИмеются также символы для ряда химических элементов, для сравнительных формул. Это одна заглавная буква в длину, и буквы зарезервированы, поэтому их нельзя использовать для имен конкретных элементов. Например, «X» используется для обозначения вариабельной группы среди класса соединений (хотя обычно это галоген), а «R» используется для обозначения радикала, что означает структуру соединения, такую как углеводородная цепь. Буква «Q» зарезервирована для «тепла» в химической реакции. «Y» также часто используется как общий химический символ, хотя он также является символом иттрия. «Z» также часто используется в качестве общей группы переменных. «L» используется для обозначения общего лиганда в неорганической и металлоорганической химии. «М» также часто используется вместо обычного металла. Изотопные символы Три основных изотопа элемента водорода часто записывают как H для протия, D для дейтерия и T для трития. Это делается для того, чтобы их было проще использовать в химических уравнениях, поскольку это заменяет необходимость записывать массовое число для каждого атома. D 2 O (тяжелая вода) Вместо того, чтобы писать так: ²H 2 O Изобилие
На ранних стадиях Большого взрыва нуклеосинтез ядер водорода привел к образованию изотопов водорода и гелия, а также очень незначительных количеств (порядка 10 -10 ) лития и бериллия. Более тяжелые элементы не производились. В результате первоначальное содержание атомов составляло примерно 75% 1 H, 25% 4 He и 0,01% дейтерия. [12] Последующее обогащение галактических ореолов произошло за счет звездного нуклеосинтеза и нуклеосинтеза сверхновой. [13] Однако межгалактическое пространство все еще может близко походить на изначальное изобилие, если только оно не было обогащено каким-либо образом. В следующей таблице показаны десять наиболее распространенных элементов в нашей галактике (оценка спектроскопическая), измеренная в частях на миллион по массе.
Недавно открытые элементы Первым открытым трансурановым элементом (элемент с атомным номером больше 92) был нептуний в 1940 году. Химическая информация
| |||||||||||||||||||||||||||||||||
Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Химический_элемент». Список авторов есть в Википедии. Он использует материал из статьи Википедии «Химический_элемент». Список авторов есть в Википедии. |
Определение элементов — химия для старших классов
Все ресурсы по химии для старших классов
6 диагностических тестов 143 практических теста Вопрос дня Карточки Learn by Concept
High School Chemistry Help » Элементы и соединения » Элементы и атомы » Идентификация элементов
Что из следующего определяет идентичность элемента?
Возможные ответы:
Количество электронов
Количество электронных оболочек
Количество нейтронов
Количество протонов
Номер нуклеонов
Правильный ответ:
9005 № . Правильный ответ: № . Пояснение: Идентичность элемента определяется количеством протонов. Нельзя изменить количество протонов, не изменив идентичность элемента. При добавлении протона атомный номер увеличивается на единицу и изменяется идентичность элемента.
Нельзя изменить количество протонов, не изменив идентичность элемента. При добавлении протона атомный номер увеличивается на единицу и изменяется идентичность элемента.
Количество нейтронов может быть изменено для создания изотопов. Количество электронов может быть изменено для создания ионов.
Сообщить об ошибке
Какой элемент может содержать семь протонов, восемь нейтронов и семь электронов?
Возможные ответы:
Углерод
Кислород
Азот
В зависимости от изотопа и ионизации любой из них может иметь заданную конфигурацию
Фтор
90:50563Азот
Пояснение:
Элемент определяется количеством протонов. Изменение количества нейтронов изменит изотоп элемента, а изменение количества электронов создаст ион, но изменение количества протонов изменит идентичность самого элемента. Азот имеет атомный номер семь и является единственным элементом, который может иметь семь протонов.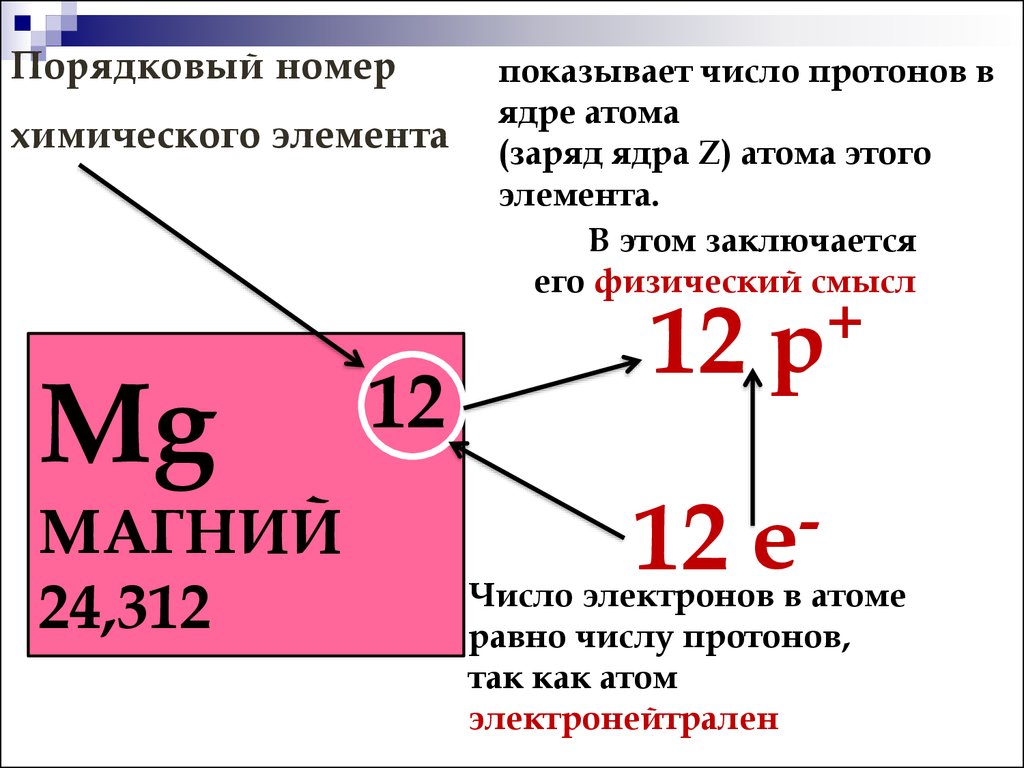 Данная конфигурация предназначена для изотопа азота. Поскольку нейтронов восемь, этот атом будет для азота-15.
Данная конфигурация предназначена для изотопа азота. Поскольку нейтронов восемь, этот атом будет для азота-15.
Сообщить об ошибке
Какая из следующих молекул состоит только из одного элемента?
Возможные ответы:
Правильный ответ:
Пояснение:
Элементы показаны в периодической таблице. Соединения образуются, когда один или несколько элементов объединяются в молекулу. Наименьшая единица элемента — это атом, а наименьшая единица соединения — молекула.
Из предложенных вариантов ответа только удовлетворяет критериям вопроса. Это формула молекулы газообразного брома, состоящей из двух атомов брома.
— ион натрия, представляющий один атом натрия, который потерял электрон, чтобы получить положительный заряд. Хотя он содержит только один элемент, это не молекула. представляет собой один атом углерода, а также не представляет собой молекулу.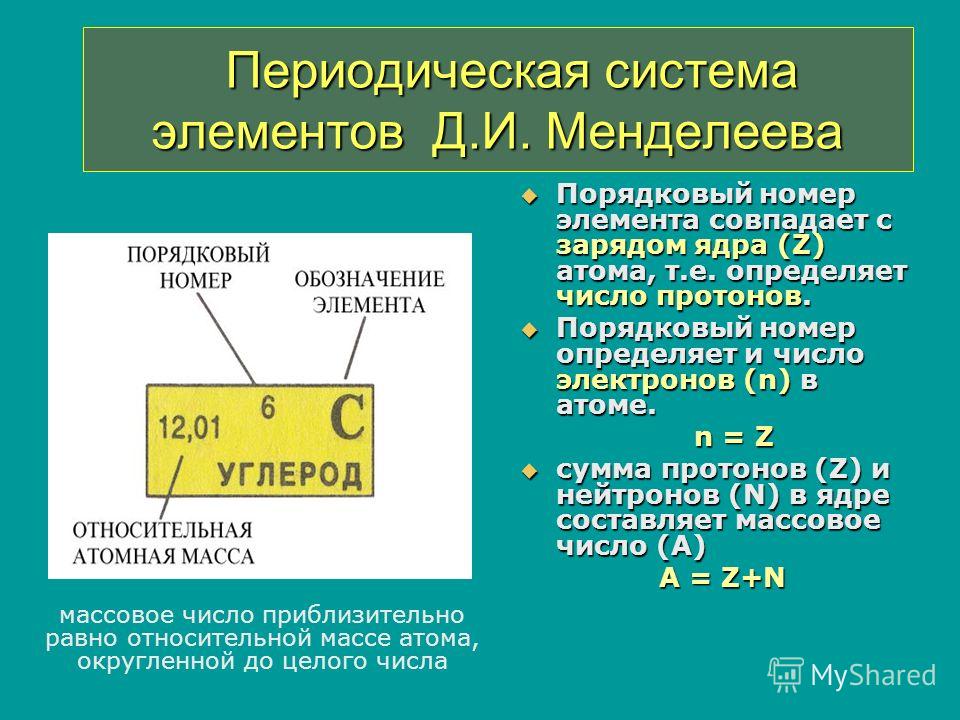
— это формула соляной кислоты и формула воды. Оба этих соединения состоят из молекул, но соляная кислота содержит атомы как водорода, так и хлора, а вода содержит и водород, и кислород.
Сообщить об ошибке
Можно ли образовать соединение только из одного элемента?
Возможные ответы:
Нет; соединение должно содержать несколько элементов
Да; соединения и элементы являются синонимами
Да; вода представляет собой соединение, состоящее только из одного элемента
Да; бензольные кольца содержат только углерод
Да; двухатомные газы – это соединения, состоящие только из одного элемента
Правильный ответ:
Да; двухатомные газы – это соединения, состоящие только из одного элемента
Пояснение:
Элементы определяются количеством протонов в данном атоме, а атом является наименьшей единицей элемента. Напротив, соединение определяется идентичностью и организацией нескольких атомов, при этом наименьшая единица соединения представляет собой молекулу.
Напротив, соединение определяется идентичностью и организацией нескольких атомов, при этом наименьшая единица соединения представляет собой молекулу.
Некоторые соединения содержат только один элемент, например двухатомные газы или графит. Бензольные кольца состоят из углерода и водорода, а молекулы воды содержат водород и кислород.
Сообщить об ошибке
Какие из следующих атомарных свойств, если они известны, раскрывают идентичность элемента?
Возможные ответы:
Число электронов
Число протонов
Несколько из этих ответов могут позволить нам идентифицировать данный атом
Масса атома
Верно
ответ:
Количество протонов
Объяснение:
Есть два свойства, которые можно использовать для идентификации элемента: атомный номер или количество протонов в атоме.
Количество нейтронов и количество электронов часто равно количеству протонов, но может варьироваться в зависимости от рассматриваемого атома.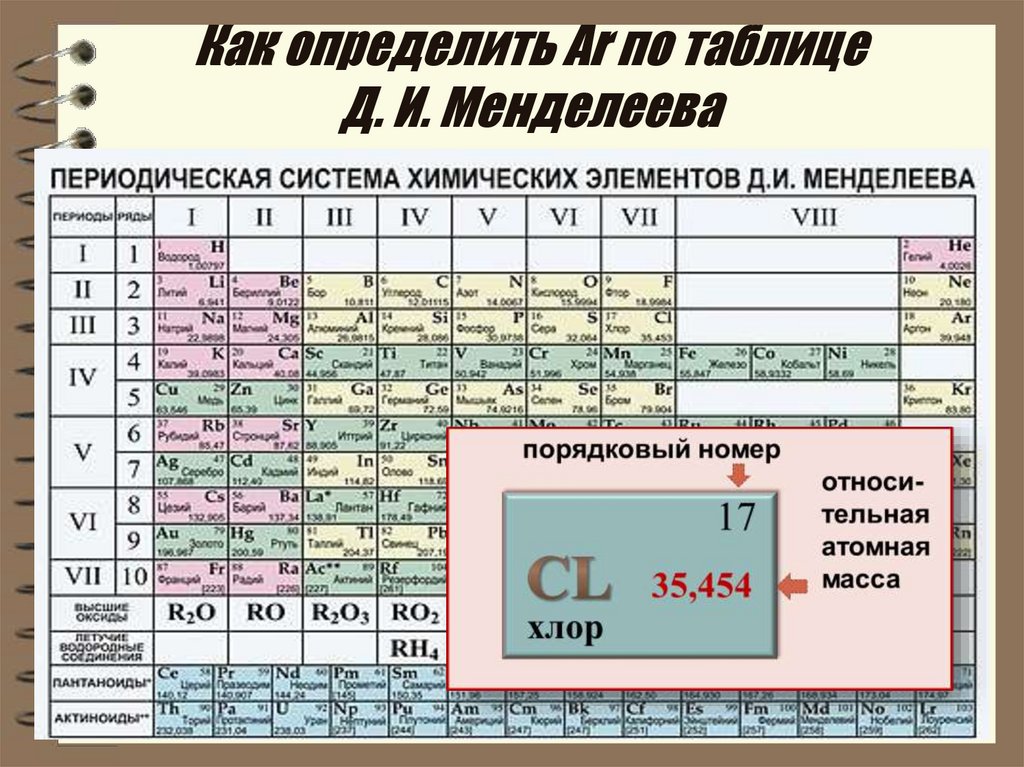 Различные ионы и изотопы изменят количество нейтронов и электронов, что сделает эти свойства ненадежными идентификаторами. Точно так же атомная масса будет варьироваться в зависимости от количества присутствующих нейтронов и не может использоваться для установления атомной идентичности.
Различные ионы и изотопы изменят количество нейтронов и электронов, что сделает эти свойства ненадежными идентификаторами. Точно так же атомная масса будет варьироваться в зависимости от количества присутствующих нейтронов и не может использоваться для установления атомной идентичности.
Сообщить об ошибке
Какие из следующих меток фаз используются для всех двухатомных элементов?
Возможные ответы:
(r)
(L)
(G)
(S)
(AQ)
Правильный ответ:
(G)
. Объяснение:
Двухатомные элементы обычно называют двухатомными газами, потому что всякий раз, когда они существуют сами по себе, они связываются друг с другом (отсюда и индекс «2»). Каждый раз, когда двухатомные элементы имеют этот нижний индекс «2», они имеют метку газовой (g) фазы. Например, .
Сообщить об ошибке
Какой химический символ обозначает калий?
Возможные ответы:
K
Pt
P
Na
Po
Правильный ответ:32
Объяснение:
Символ калия происходит от латинского слова, обозначающего калий, kalium . Вот почему химический символ калия — .
Сообщить об ошибке
Какой элемент также имеет латинское название, ferrum?
Возможные ответы:
Золото
Железо
Платина
Свинец
Медь
Правильный ответ:32 Железо
32
Объяснение:
Железо на латыни — ferrum, поэтому химический символ железа из-за его латинского названия.
Сообщить об ошибке
Какой элемент имеет 42 протона?
Возможные ответы:
Молибден
Технеций
Золото
Ниобий
Ртуть
Правильный ответ:
Молибден
Пояснение:
Помните, количество протонов равно атомному номеру элемента. Посмотрите в периодическую таблицу и найдите элемент с атомным номером 42, он соответствует молибдену.
Посмотрите в периодическую таблицу и найдите элемент с атомным номером 42, он соответствует молибдену.
Сообщить об ошибке
Какой элемент имеет 17 электронов?
Возможные ответы:
Кремний
Аргон
Фосфор
Хлор
Сера
Правильный ответ:
Хлор
2 Пояснение: Поскольку атомы нейтральны, количество электронов должно равняться количеству протонов (чтобы уравновесить отрицательный и положительный заряды). Таким образом, элемент с 17 электронами также имеет 17 протонов. Количество протонов равно атомному номеру элемента. Используйте периодическую таблицу, чтобы найти элемент с атомным номером 17, хлор. Обратите внимание, что ионы не нейтральны, поэтому они имеют неравное количество протонов и электронов. Кроме того, изотопы одного и того же элемента содержат разное количество нейтронов, что также влияет на вес изотопа.

 Это число 16. Это сера S, формула её высшего оксида – SO3.
Это число 16. Это сера S, формула её высшего оксида – SO3.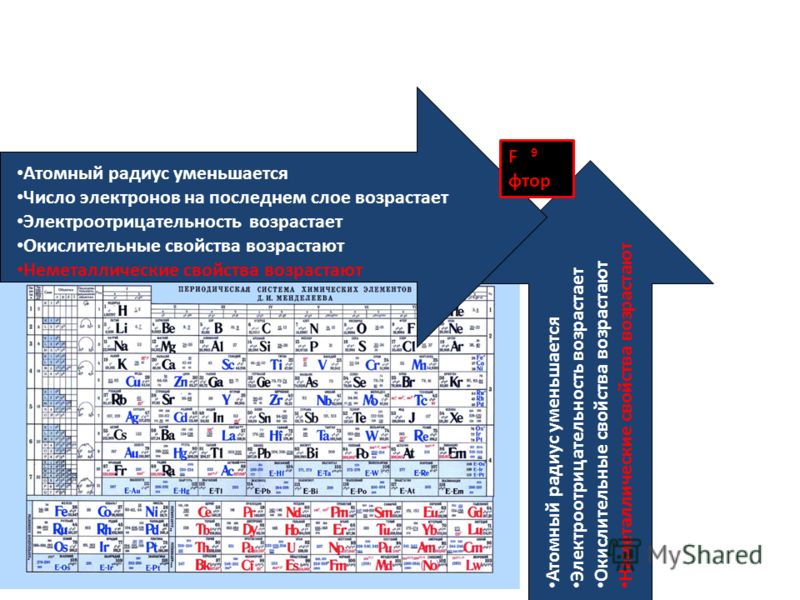
 Распределению электронов в атоме этого элемента соответствует ряд чисел:
Распределению электронов в атоме этого элемента соответствует ряд чисел: Это Mg. Ему соответствует оксид ЭО.
Это Mg. Ему соответствует оксид ЭО.  Be, Mg, Ca, Sr, Ba
Be, Mg, Ca, Sr, Ba
 [1]
[1]  5 Стандартное состояние
5 Стандартное состояние до н.э. Аристотель также использовал термин «элемент» и задумал пятый элемент, называемый «квинтэссенцией», который сформировал небеса. Аристотель определял элемент как:
до н.э. Аристотель также использовал термин «элемент» и задумал пятый элемент, называемый «квинтэссенцией», который сформировал небеса. Аристотель определял элемент как: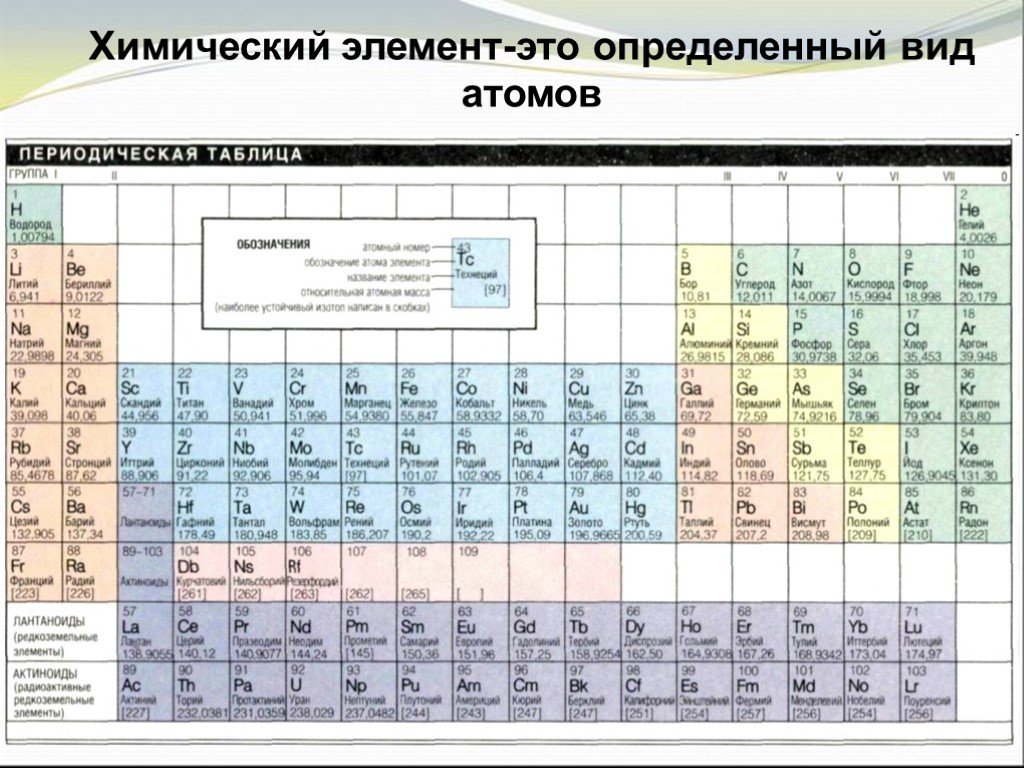 Ртуть включала связующий принцип, так что, когда она уходила в дым, дерево разваливалось. Дым представлял собой летучесть (принцип ртути), дающее тепло пламя представляло воспламеняемость (сера), а остатки пепла представляли твердость (соль). [5]
Ртуть включала связующий принцип, так что, когда она уходила в дым, дерево разваливалось. Дым представлял собой летучесть (принцип ртути), дающее тепло пламя представляло воспламеняемость (сера), а остатки пепла представляли твердость (соль). [5] 
 [10] [11] Из этих 117 элементов 94 встречаются в природе на Земле. Шесть из них встречаются в крайне малых количествах: технеций, атомный номер 43; прометий, номер 61; астатин, номер 85; франций, номер 87; нептуний, номер 93; и плутоний под номером 94. Эти 94 элемента, а также, возможно, элемент 98 californium были обнаружены во Вселенной в целом, в спектрах звезд, а также в сверхновых, где вновь образуются короткоживущие радиоактивные элементы.
[10] [11] Из этих 117 элементов 94 встречаются в природе на Земле. Шесть из них встречаются в крайне малых количествах: технеций, атомный номер 43; прометий, номер 61; астатин, номер 85; франций, номер 87; нептуний, номер 93; и плутоний под номером 94. Эти 94 элемента, а также, возможно, элемент 98 californium были обнаружены во Вселенной в целом, в спектрах звезд, а также в сверхновых, где вновь образуются короткоживущие радиоактивные элементы. Эта схема искусственного производства и последующего естественного открытия была повторена с несколькими другими радиоактивными микроэлементами естественного происхождения.
Эта схема искусственного производства и последующего естественного открытия была повторена с несколькими другими радиоактивными микроэлементами естественного происхождения. Так, например, все атомы углерода в конечном счете обладают одинаковыми химическими свойствами, потому что все они имеют одинаковое количество протонов в ядре и, следовательно, имеют одинаковый атомный номер. Именно по этой причине атомный номер, а не массовое число (или атомный вес) считается идентифицирующей характеристикой элемента.
Так, например, все атомы углерода в конечном счете обладают одинаковыми химическими свойствами, потому что все они имеют одинаковое количество протонов в ядре и, следовательно, имеют одинаковый атомный номер. Именно по этой причине атомный номер, а не массовое число (или атомный вес) считается идентифицирующей характеристикой элемента. В то время как массовое число — натуральное (или целое) число, атомная масса отдельного изотопа — действительное число, близкое к натуральному. В общем, оно немного отличается от массового числа, так как масса протонов и нейтронов не равна точно 1 u, электроны также вносят небольшой вклад в атомную массу и из-за энергии связи ядер. Например, масса 19 Ф 18.9984032 ед. Единственным исключением из атомной массы изотопа, не являющегося натуральным числом, является 12 C, масса которого равна , точно 12, из-за определения u (оно зафиксировано как 1/12 массы свободного атома углерода-12 точно).
В то время как массовое число — натуральное (или целое) число, атомная масса отдельного изотопа — действительное число, близкое к натуральному. В общем, оно немного отличается от массового числа, так как масса протонов и нейтронов не равна точно 1 u, электроны также вносят небольшой вклад в атомную массу и из-за энергии связи ядер. Например, масса 19 Ф 18.9984032 ед. Единственным исключением из атомной массы изотопа, не являющегося натуральным числом, является 12 C, масса которого равна , точно 12, из-за определения u (оно зафиксировано как 1/12 массы свободного атома углерода-12 точно). Поскольку их массовые числа равны 12, 13 и 14 соответственно, три изотопа углерода известны как углерод-12, углерод-13 и углерод-14, часто сокращенно до 9.0010 12С, 13С и 14С. Углерод в быту и в химии представляет собой смесь атомов 12С, атомов 13С и атомов 14С.
Поскольку их массовые числа равны 12, 13 и 14 соответственно, три изотопа углерода известны как углерод-12, углерод-13 и углерод-14, часто сокращенно до 9.0010 12С, 13С и 14С. Углерод в быту и в химии представляет собой смесь атомов 12С, атомов 13С и атомов 14С. 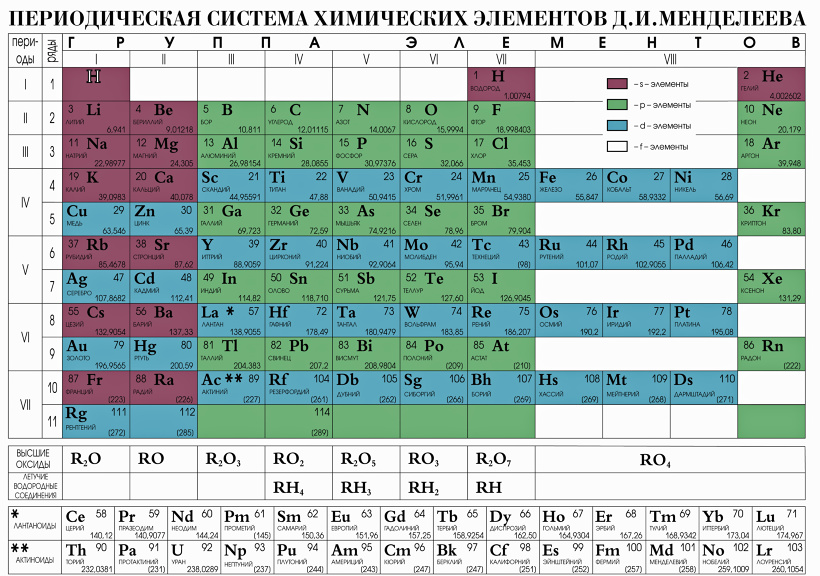 Например, углерод можно найти в виде алмаза, который имеет тетраэдрическую структуру вокруг каждого атома углерода; графит, имеющий слои атомов углерода с гексагональной структурой, и фуллерены, имеющие форму, близкую к сферической. Способность элемента существовать в одной из многих структурных форм известна как «аллотропия».
Например, углерод можно найти в виде алмаза, который имеет тетраэдрическую структуру вокруг каждого атома углерода; графит, имеющий слои атомов углерода с гексагональной структурой, и фуллерены, имеющие форму, близкую к сферической. Способность элемента существовать в одной из многих структурных форм известна как «аллотропия».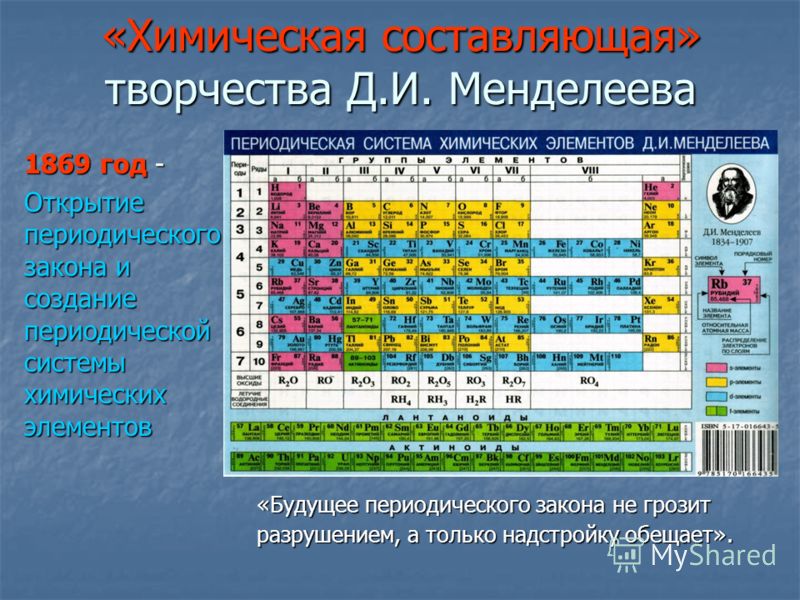 Например, немцы используют «Wasserstoff» для «водорода» и «Sauerstoff» для «кислорода», в то время как английский и некоторые романские языки используют «натрий» для «натрия» и «калий» для «калий», а французы, греки а поляки предпочитают «азот/азот» вместо «азота».
Например, немцы используют «Wasserstoff» для «водорода» и «Sauerstoff» для «кислорода», в то время как английский и некоторые романские языки используют «натрий» для «натрия» и «калий» для «калий», а французы, греки а поляки предпочитают «азот/азот» вместо «азота». Изотопы химических элементов тоже без прописной буквы пишутся: углерод-12 или уран-235.
Изотопы химических элементов тоже без прописной буквы пишутся: углерод-12 или уран-235. Он широко использовался как таковой в американских публикациях до международной стандартизации.
Он широко использовался как таковой в американских публикациях до международной стандартизации.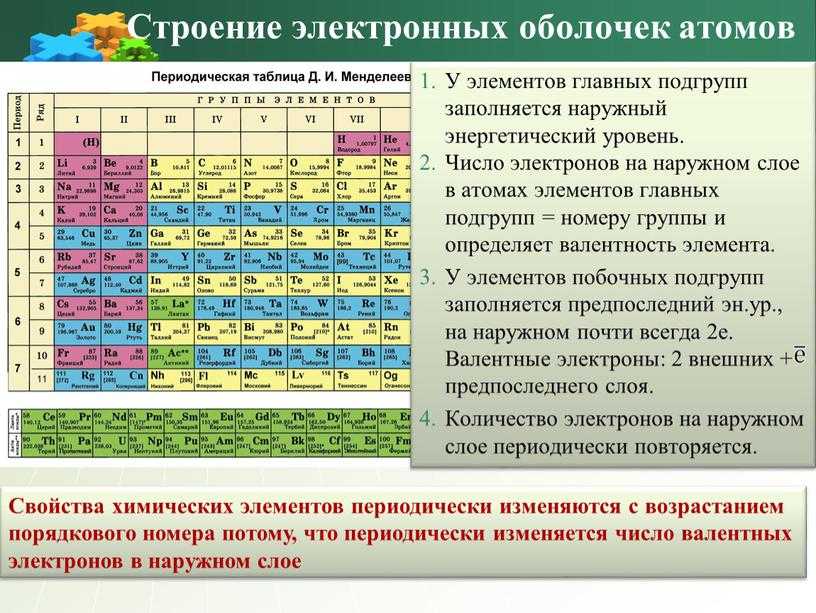 Первый из этих символов должен был быть полностью универсальным; так как в то время общим языком науки была латынь, то это были аббревиатуры, основанные на латинских названиях металлов — Fe происходит от Ferrum, Ag от Argentum. За символами не шла точка (точка), как за аббревиатурами. Более поздним химическим элементам также были присвоены уникальные химические символы, основанные на названии элемента, но не обязательно на английском языке. Например, натрий имеет химический символ «Na» после латинской 9.0076 натрий . То же самое относится к «W» (вольфрам) для вольфрама, «Hg» (Hydrargyrum) для ртути, «K» (калий) для калия, «Au» (золото) для золота, «Pb» (свинец) для свинца и «Sb» (сурьма) для сурьмы.
Первый из этих символов должен был быть полностью универсальным; так как в то время общим языком науки была латынь, то это были аббревиатуры, основанные на латинских названиях металлов — Fe происходит от Ferrum, Ag от Argentum. За символами не шла точка (точка), как за аббревиатурами. Более поздним химическим элементам также были присвоены уникальные химические символы, основанные на названии элемента, но не обязательно на английском языке. Например, натрий имеет химический символ «Na» после латинской 9.0076 натрий . То же самое относится к «W» (вольфрам) для вольфрама, «Hg» (Hydrargyrum) для ртути, «K» (калий) для калия, «Au» (золото) для золота, «Pb» (свинец) для свинца и «Sb» (сурьма) для сурьмы.
 Это написано так:
Это написано так: [14] Соседние галактики, которые развивались по сходным направлениям, имеют соответствующее обогащение элементами более тяжелыми, чем водород и гелий. Более далекие галактики рассматриваются такими, какими они были в прошлом, поэтому содержание элементов в них кажется более близким к первичной смеси. Однако, поскольку физические законы и процессы кажутся общими для всей видимой Вселенной, ожидается, что в этих галактиках также возникнет одинаковое количество элементов.
[14] Соседние галактики, которые развивались по сходным направлениям, имеют соответствующее обогащение элементами более тяжелыми, чем водород и гелий. Более далекие галактики рассматриваются такими, какими они были в прошлом, поэтому содержание элементов в них кажется более близким к первичной смеси. Однако, поскольку физические законы и процессы кажутся общими для всей видимой Вселенной, ожидается, что в этих галактиках также возникнет одинаковое количество элементов.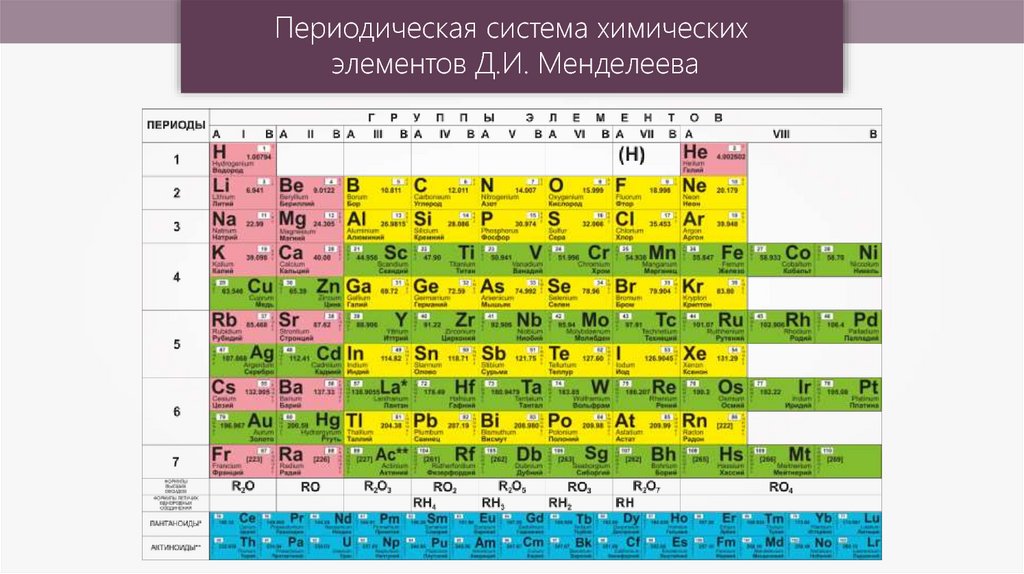 Самым тяжелым элементом, который был обнаружен на сегодняшний день, является элемент 118, унуноктий, который был успешно синтезирован 9 октября 2006 года в Лаборатории имени Флерова. Ядерные реакции в Дубне, Россия. 9 Оганесян Ю.А. Ц.; Утёнков, В.К.; Лобанов Ю.В.; Абдуллин, Ф.Ш.; Поляков, А.Н.; Сагайдак Р.Н.; Широковский, И.В.; Цыганов Ю.С.; Воинов Ю.С.; Гюльбекян, Г.Г.; Богомолов С.Л.; Б. Н. Гикал, А. Н. Мезенцев, С. Илиев; Субботин В.Г.; Сухов А.М.; Суботич, К; Загребаев, В.И.; Востокин Г.К.; Иткис, М. Г.; Муди, К.Дж.; Патин, Дж. Б.; Шонесси, Д.А.; Стойер, Массачусетс; Стойер, Нью-Джерси; Уилк, Пенсильвания; Кеннелли, Дж. М.; Ландрам, Дж. Х.; Уайлд, Дж. Х.; и Лугид, Р. В. (9 октября 2006 г.). «Синтез изотопов элементов 118 и 116 в 249 CF и 245 CM+ 48 Реакции CA слияния ». Физический обзор C 74 (4): 044602. DOI: 10,1103/PhysRevc.74.044602. Извлечен на 2006-10-16. 9303.044602.
Самым тяжелым элементом, который был обнаружен на сегодняшний день, является элемент 118, унуноктий, который был успешно синтезирован 9 октября 2006 года в Лаборатории имени Флерова. Ядерные реакции в Дубне, Россия. 9 Оганесян Ю.А. Ц.; Утёнков, В.К.; Лобанов Ю.В.; Абдуллин, Ф.Ш.; Поляков, А.Н.; Сагайдак Р.Н.; Широковский, И.В.; Цыганов Ю.С.; Воинов Ю.С.; Гюльбекян, Г.Г.; Богомолов С.Л.; Б. Н. Гикал, А. Н. Мезенцев, С. Илиев; Субботин В.Г.; Сухов А.М.; Суботич, К; Загребаев, В.И.; Востокин Г.К.; Иткис, М. Г.; Муди, К.Дж.; Патин, Дж. Б.; Шонесси, Д.А.; Стойер, Массачусетс; Стойер, Нью-Джерси; Уилк, Пенсильвания; Кеннелли, Дж. М.; Ландрам, Дж. Х.; Уайлд, Дж. Х.; и Лугид, Р. В. (9 октября 2006 г.). «Синтез изотопов элементов 118 и 116 в 249 CF и 245 CM+ 48 Реакции CA слияния ». Физический обзор C 74 (4): 044602. DOI: 10,1103/PhysRevc.74.044602. Извлечен на 2006-10-16. 9303.044602.