Номер периода указывает на. Группа периодической системы. Электронное строение инертных газов
Группа периодической системы химических элементов последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) … Википедия
К четвёртому периоду периодической системы относятся элементы четвёртой строки (или четвёртого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических)… … Википедия
К первому периоду периодической системы относятся элементы первой строки (или первого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Ко второму периоду периодической системы относятся элементы второй строки (или второго периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в … Википедия
Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в … Википедия
К пятому периоду периодической системы относятся элементы пятой строки (или пятого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
К третьему периоду периодической системы относятся элементы третьей строки (или третьего периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов … Википедия
К седьмому периоду периодической системы относятся элементы седьмой строки (или седьмого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов … Википедия
К шестому периоду периодической системы относятся элементы шестой строки (или шестого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6 … Википедия
Сюда перенаправляется запрос «Группировка». На эту тему нужна отдельная статья … Википедия
1. Номер периода в Периодической системе Д. И. Менделеева соответствует
1) числу энергетических уровней в атоме
2) числу валентных электронов в атоме
3) числу неспаренных электронов в атоме
4) общему числу электронов в атоме
2. Число электронов в электронной оболочке атома определяется
1) числом протонов
2) числом нейтронов
3) числом энергетических уровней
4) величиной относительной атомной массы
3. В ряду химических элементов кремний → фосфор → сера уменьшается
1) способность атома принимать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
4. У элементов А групп с увеличением атомного номера уменьшается
У элементов А групп с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательность
5. В главных подгруппах Периодической системы Д. И. Менделеева снизу вверх основные свойства гидроксидов металлов
1) увеличиваются
2) уменьшаются
3) не изменяются
4) изменяются периодически
6. Среди элементов IVA группы максимальный радиус атома имеет
1) германий
2) углерод
3) олово
4) кремний
7. Наиболее выражены металлические свойства у элемента
1) Na
2) Mg
3) К
4) Са
8. Менее выраженные неметаллические свойства, чем кремний, имеет элемент
1) углерод
2) германий
3) фосфор
4) азот
9. Наиболее сильное основание соответствует элементу
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук.
Шаги
Часть 1
Структура таблицы
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент.
 Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.

- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.

Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
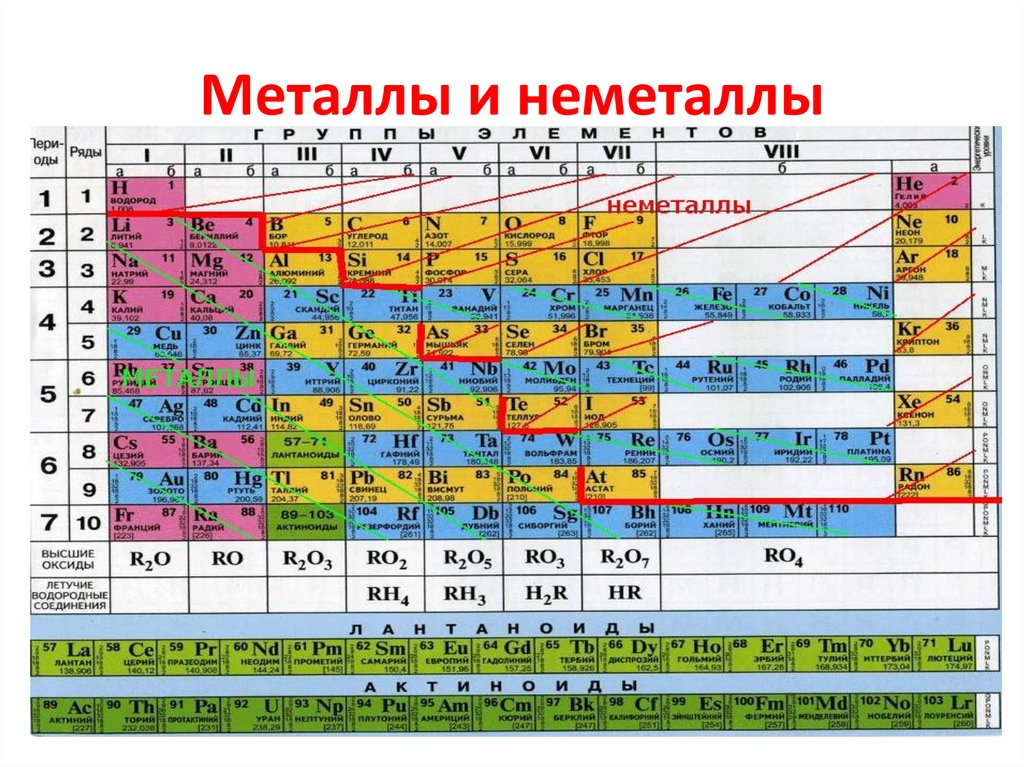
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами.
 Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.

- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
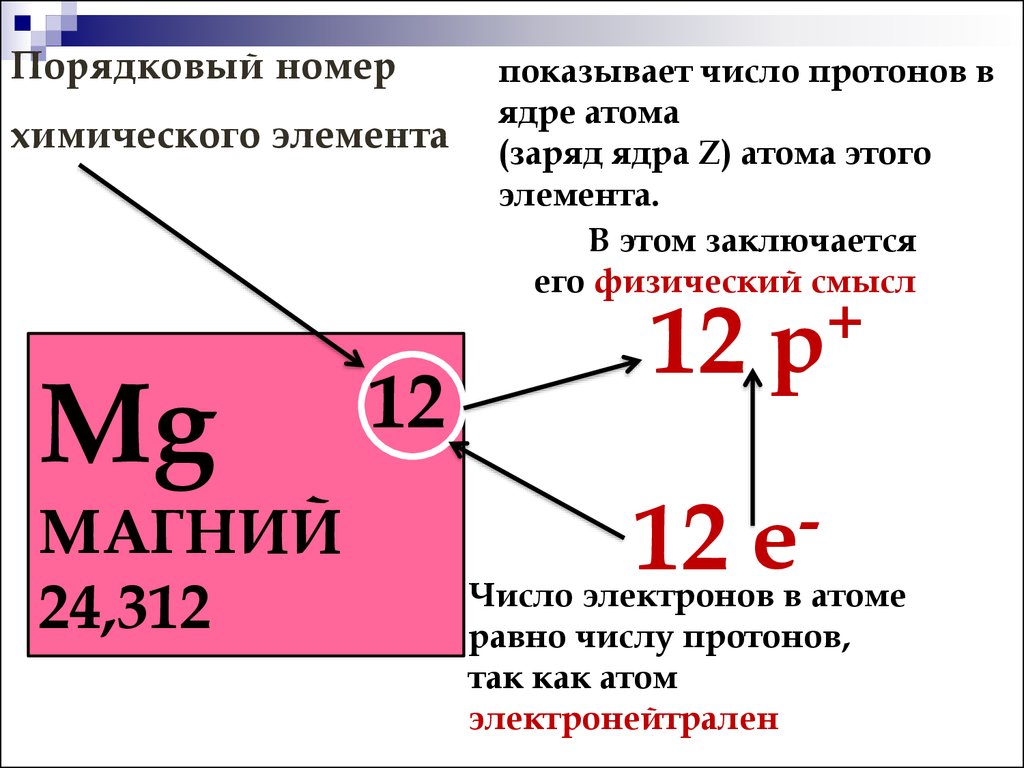
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны – отрицательный заряд.
 Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Состоит из вертикальных рядов (групп) и горизонтальных рядов (периодов). Для лучшего понимания принципов объединения элементов в группы и периоды, рассмотрим нескольких элементов, скажем, первой, четвертой и седьмой групп.
Из приведенных выше электронных конфигураций видно, что внешние (самые высокие по энергии) электронные оболочки атомов одной группы заполнены электронами одинаково. К одной группе принадлежат элементы, расположенные в одном вертикальном столбце таблицы.
 Элементы IVA группы периодической системы имеет два электрона на s-орбитали и два электрона на р-орбиталях. Конфигурация внешней электронной оболочки атомов фтора F, хлора Сl и брома Вг также одинакова (два s- и пять р-электронов). И эти элементы относятся к одной группе (VIIA). Атомы элементов одной группы имеют одинаковое строение внешней электронной оболочки. Именно поэтому такие элементы имеют сходные химические свойства. Химические свойства каждого элемента определяются электронным строением атомов этого элемента . Это основополагающий принцип современной химии. Именно он лежит в основе периодической системы.
Элементы IVA группы периодической системы имеет два электрона на s-орбитали и два электрона на р-орбиталях. Конфигурация внешней электронной оболочки атомов фтора F, хлора Сl и брома Вг также одинакова (два s- и пять р-электронов). И эти элементы относятся к одной группе (VIIA). Атомы элементов одной группы имеют одинаковое строение внешней электронной оболочки. Именно поэтому такие элементы имеют сходные химические свойства. Химические свойства каждого элемента определяются электронным строением атомов этого элемента . Это основополагающий принцип современной химии. Именно он лежит в основе периодической системы.Номер группы периодической системы соответствует числу электронов на внешней электронной оболочке атомов элементов этой группы. Номер периода (горизонтального ряда периодической таблицы) совпадает с номером высшей занятой электронной орбитали. Например, натрий и хлор — оба элементы 3-го периода и у обоих типов атомов высший, заполненный электронами,уровень – третий.

Строго говоря, число электронов на внешней электронной оболочке определяет номер группы только для так называемых непереходных элементов, расположенных в группах с буквенным индексом А.
Электронное строение атомов определяет химические и физические свойства элементов. А т.к электронное строение атомов повторяется через период, то и свойства элементов также повторяются периодически.
Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов» .
Размеры атомов
Нам следует остановиться еще на двух видах информации, получаемой из периодической системы. Первый из них — вопрос о размере (радиусе) атомов. Если двигаться вниз в пределах данной группы, переход к каждому следующему элементу означает заполнение электронами следующего, все более высокого уровня.
 В группе IA внешний электрон атома натрия находится на Зs-орбитали, калия — на 4s-орбитали, рубидия – 5s-орбитали и т. д. Поскольку 4s-орбиталь больше по размеру, чем Зs-орбиталь, атом калия имеет большие размеры, чем атом натрия. По этой же причине в каждой группе размеры атомов возрастают сверху вниз .
В группе IA внешний электрон атома натрия находится на Зs-орбитали, калия — на 4s-орбитали, рубидия – 5s-орбитали и т. д. Поскольку 4s-орбиталь больше по размеру, чем Зs-орбиталь, атом калия имеет большие размеры, чем атом натрия. По этой же причине в каждой группе размеры атомов возрастают сверху вниз .При движении направо по периоду атомные массы возрастают, но размеры атомов, как правило, уменьшаются. Во 2-м периоде, например, атом неона Ne имеет меньший размер, чем атом фтора, который, в свою очередь, меньше атома кислорода.
Электроотрицательность
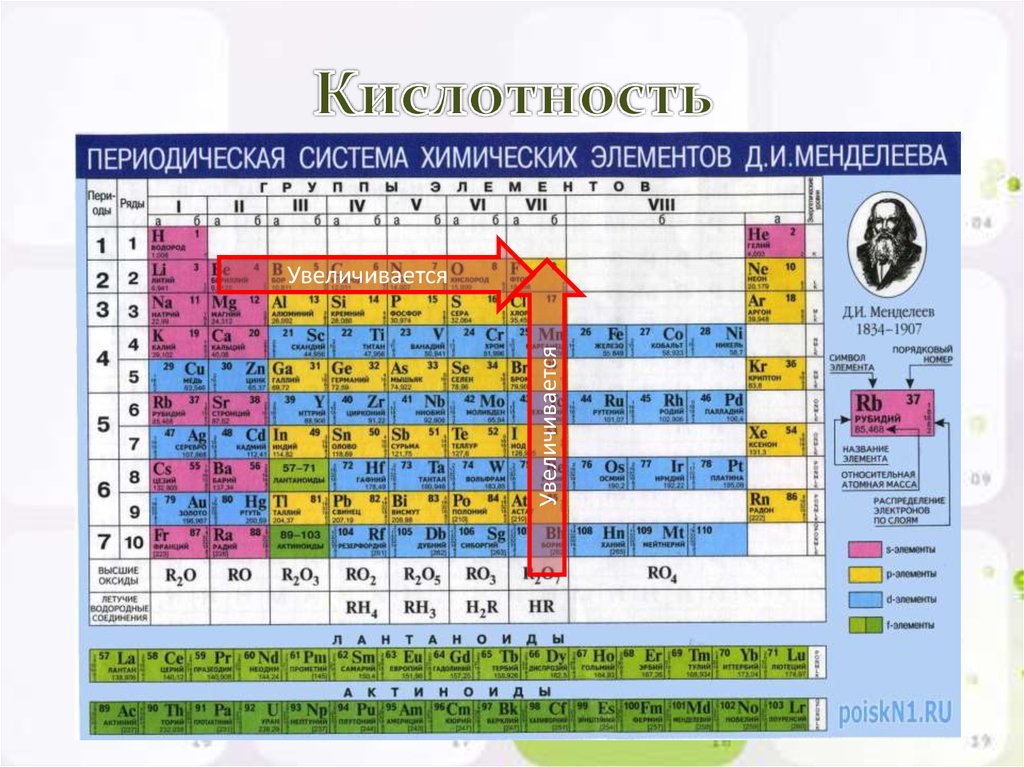
Другая тенденция, выявляемая с помощью периодической таблицы,- закономерное изменение злектроотрицательности элементов, т. е. относительной способности атомов притягивать электроны, образующие связи с другими атомами. Например, атомы инертных газов не склонны приобретать или терять электроны, тогда как атомы металлов легко отдают электроны, а атомы неметаллов охотно их принимают. Электроотрицательность (способность притягивать, приобретать электроны) возрастает слева направо в пределах периода и снизу вверх в пределах группы.
 Последняя группа (инертные газы) выпадает из этих закономерностей.
Последняя группа (инертные газы) выпадает из этих закономерностей.Фтор F, расположенный в правом верхнем углу периодической системы, – наиболее электроотрицательный элемент, а франций Fr, находящийся в левом нижнем углу, наименее электроотрицателен. Изменение электроотрицательности также показано стрелками на рисунке.Пользуясь этой закономерностью, можно, например, утверждать, что кислород более электроотрицательный элемент, чем углерод или сера. Это значит, что атомы кислорода сильнее притягивают к себе электроны, чем атомы углерода и серы.
Первая и широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора.
Электронное строение инертных газов
Элементы последней группы периодической системы называются инертными (благородными) газами. В атомах этих элементов, кроме гелия Не, на внешней электронной оболочке имеется восемь электронов. Инертные газы не вступают в химические реакции и не образуют никаких соединений с другими элементами (кроме очень немногих исключений).
 Это связано с тем, что конфигурация из восьми электронов на внешней электронной оболочке чрезвычайно стабильна.
Это связано с тем, что конфигурация из восьми электронов на внешней электронной оболочке чрезвычайно стабильна.Атомы других элементов образуют химические связи таким образом, чтобы на их внешней оболочке оказалось восемь электронов. Это положение часто называют правилом октета .
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Структура периодической системы элементов
Периодическая система химических элементов – естественная классификация химических элементов, являющаяся табличным выражением периодического закона Д.И. Менделеева. Прообразом Периодической системы химических элементов послужила таблица, составленная Д.И. Менделеевым 1 марта 1869 г. В 1870 г. В 1870 г. Менделеев назвал систему естественной, а в 1871 г. – периодической.
Число элементов в
современной Периодической системе
почти вдвое больше, чем было известно
60-х годах XIX в. (на сегодняшний день –
113), однако ее структура со времен
Менделеева почти не изменилась. Хотя
за всю историю Периодической системы
было опубликовано более 50 различных
вариантов ее изображения, наиболее
популярными являются предложенные
Менделеевым короткопериодная и
длиннопериодная формы.
Главный принцип построения Периодической системы – выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов. Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом). Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы – 18 групп, имеющих те же обозначения, что и в короткопериодном. Элементы одной группы имеют одинаковое строение внешних электронных оболочек атомов и проявляют определенное химическое сходство.
Номер
группы в Периодической системе определяет
число валентных электронов а атомах
элементов. При этом в группах, обозначенных
буквой А, содержатся элементы, в которых
идет заселение s–
и р-подуровней – s-элементы
(IA- и IIA-группы) и р-элементы
(IIIA-VIIIA-группы), а в группах, обозначенной
буквой Б, находятся элементы, в которых
заселяются d-подуровни
– d-элементы. Поскольку в каждом большом периоде
должно находиться по 10 d-элементов
(у которых заполняются пятьd-орбиталей),
то Периодическая система должна содержать
10 соответствующих групп. Однако
традиционно используется нумерация
групп лишь до восьми, поэтому число
групп d-элементов
расширяется за счет введения дополнительных
цифр – это IБ-VIIБ, VIIIБ0, VIIIБ1 и VIIIБ2-группы.
Для f-элементов
номеров групп не предусмотрено. Обычно
их условно помещают в ячейки Периодической
системы, отвечающие лантану (лантаноиды)
и актинию (актиноиды). Символы лантаноидов
и актиноидов выносятся за пределы
Периодической системы в виде отдельных
рядов.
Поскольку в каждом большом периоде
должно находиться по 10 d-элементов
(у которых заполняются пятьd-орбиталей),
то Периодическая система должна содержать
10 соответствующих групп. Однако
традиционно используется нумерация
групп лишь до восьми, поэтому число
групп d-элементов
расширяется за счет введения дополнительных
цифр – это IБ-VIIБ, VIIIБ0, VIIIБ1 и VIIIБ2-группы.
Для f-элементов
номеров групп не предусмотрено. Обычно
их условно помещают в ячейки Периодической
системы, отвечающие лантану (лантаноиды)
и актинию (актиноиды). Символы лантаноидов
и актиноидов выносятся за пределы
Периодической системы в виде отдельных
рядов.
Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами.
Номер периода = Число энергетических уровней, заполненных электронами = Обозначение последнего энергетического уровня
Порядок формирования
периодов связан с постепенным заселением
энергетических подуровней электронами. Последовательность заселения определяется
принципом минимума энергии, принципом
Паули и правилом Гунда.
Последовательность заселения определяется
принципом минимума энергии, принципом
Паули и правилом Гунда.
Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.
Располагая элементы в порядке возрастания их атомных весов, Д. И. Менделеев обнаружил фундаментальный закон природы, который теперь известен как Периодический закон: Свойства элементов периодически изменяются в соответствии с их атомным весом.
Связь периодического закона и периодической системы со строением атомов.
Итак, главной
характеристикой атома является не
атомная масса, а величина положительного
заряда ядра. Это более общая точная
характеристика атома, а значит, и
элемента. От величины положительного
заряда ядра атома зависят все свойства
Элемента и его положение в периодической
системе. Таким образом, порядковый номер
химического элемента численно совпадает
с зарядом ядра его атома. Периодическая
система элементов является графическим
изображением периодического закона и
отражает строение атомов элементов.
Периодическая
система элементов является графическим
изображением периодического закона и
отражает строение атомов элементов.
Теория строения атома объясняет периодическое изменение свойств элементов. Возрастание положительного заряда атомных ядер от 1-до 110 приводит к периодическому повторению у атомов элементов строения внешнего энергетического уровня. А поскольку от числа электронов на внешнем уровне в основном зависят свойства элементов; то и они периодически повторяются. В этом физический смысл периодического закона.
В качестве примера рассмотрим изменение свойств у первых и последних элементов периодов. Каждый период в периодической системе начинается элементами атомы, которых на внешнем уровне имеют один s-электрон (незавершенные внешние уровни) и потому проявляют сходные свойства — легко отдают валентные электроны, что обуславливает их металлический характер. Это щелочные металлы — Li, Na, К, Rb, Cs.
В каждом
периоде с возрастанием порядкового
номера элементов металлические свойства
постепенно ослабевают и возрастают
неметаллические, заканчивается период
инертным газом. В каждом периоде с
возрастанием порядкового номера
элементов металлические свойства
постепенно ослабевают и возрастают
неметаллические, заканчивается период
инертным газом.
В каждом периоде с
возрастанием порядкового номера
элементов металлические свойства
постепенно ослабевают и возрастают
неметаллические, заканчивается период
инертным газом.
В свете учения о строении атома становится понятным разделение всех элементов на семь периодов, сделанное Д. И. Менделеевым. Номер периода соответствует числу энергетических уровней атома, то есть положение элементов в периодической системе обусловлено строением их атомов. В зависимости от того, какой подуровень заполняется электронами, все элементы делят на четыре типа.
1. s-элементы. Заполняется s-подуровень внешнего уровня (s1 — s2). Сюда относятся первые два элемента каждого периода.
2. р-элементы. Заполняется р-подуровень внешнего уровня (р1 — p6)- Сюда относятся последние шесть элементов каждого периода, начиная со второго.
3. d-элементы. Заполняется d-подуровень
последнего уровня (d1 — d10), а на последнем
(внешнем) уровне остается 1 или 2 электрона.
К ним относятся элементы вставных декад
(10) больших периодов, начиная с 4-го,
расположенные между s- и p-элементами
(их также называют переходными элементами).
4. f-элементы. Заполняется f-подуровень глубинного (треть его снаружи) уровня (f1 —f14), а строение внешнего электронного уровня остается неизменным. Это лантаноиды и актиноиды, находящиеся в шестом и седьмом периодах.
Итак, строение атомов обуславливает две закономерности:
а) изменение свойств элементов по горизонтали — в периоде слева направо ослабляются металлические и усиливаются неметаллические свойства;
б) изменение свойств элементов по вертикали — в группе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические.
Таким образом: по мере возрастания заряда ядра атомов химических элементов периодически изменяется строение их электронных оболочек, что является причиной периодического изменения их свойств.
6
Энергия ионизации атома. Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией (потенциалом) ионизации I:
Энергия
ионизации выражается в кДж/моль или
эВ/моль. Энергии, необходимые для отрыва
второго, третьего и последующих
электронов, носят название второй (I2),
третьей (I3) и т.д. энергий ионизации. Увеличение
положительного заряда образовавшегося
иона ведет к росту энергии ионизации (
I1<I2< I3…).
Энергии, необходимые для отрыва
второго, третьего и последующих
электронов, носят название второй (I2),
третьей (I3) и т.д. энергий ионизации. Увеличение
положительного заряда образовавшегося
иона ведет к росту энергии ионизации (
I1<I2< I3…).
Энергия ионизации возрастает в периодах от щелочных металлов к благородным газам и уменьшается в группах сверху вниз. Наименьшие энергии ионизации имеют щелочные металлы, начинающие периоды, а наибольшие – благородные газы, заканчивающие периоды. Энергии ионизации элементов, находящихся в главной подгруппе одной и той же группы уменьшаются с увеличением порядкового номера элемента. Для d- и f-элементов закономерности более сложные.
Сродство к электрону. Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону (Е):
Сродство к электрону выражается в кДж/моль или эВ/моль.
Для элементов главных
подгрупп сродство к электрону возрастает
в периодах слева направо и уменьшается в
группах сверху вниз.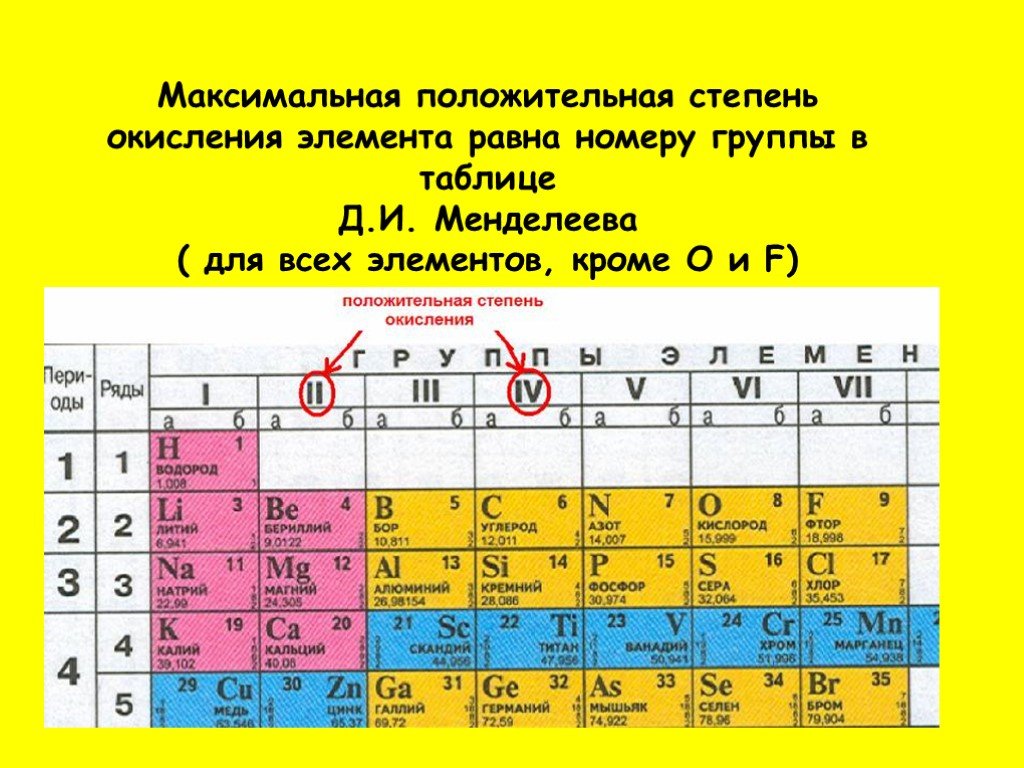 Максимальное
значение сродства к электрону имеет
фтор.
Максимальное
значение сродства к электрону имеет
фтор.
Электроотрицательность. Способность атома, находясь в составе устойчивой молекулы, смещать к себе электронную плотность характеризуется электроотрицательностью. Существует много способов количественной оценки электроотрицательности. Так, электроотрицательность по Малликену (χ) равна полусумме энергии ионизации и сродства к электрону:
χ = ½ (I + Е)
Для s- и р-элементов электроотрицательность возрастает в периодах слева направо и уменьшается в группах сверху вниз. Минимальное значение сродства к электрону имеет франций, а максимальное – фтор.
Атомные радиусы. За атомные радиусы принимают величины, найденные на основе тех или иных допущений. Теоретически рассчитывают так называемые орбитальные радиусы, или расстояние от центра ядра до наиболее удаленного от него максимума электронной плотности. И за одно скажи что тако электронная плотность
Электро́нная
пло́тность — плотность
вероятности обнаружения электрона в
данной точке пространства.
Периодичность изменения атомных радиусов особенно отчетливо выражена у s- и р-элементов: в периодах слева направо радиусы уменьшаются, а в группах сверху вниз увеличиваются. Закономерности изменения атомных радиусов для d- и f-элементов имеют более сложный характер.
Ио́нный ра́диус — характерный размер шарообразных ионов, применяемый для вычисления межатомных расстояний в ионных соединениях. Понятие ионный радиус основано на предположении, что размеры ионов не зависят от состава молекул, в которые они входят. На него влияет количество электронных оболочек и плотность упаковки атомов и ионов в кристаллической решётке.
Что представляет собой номер периода?
Обновлено 23 апреля 2018 г.
Автор: Serm Murmson
Элементы периодической таблицы относятся к группам и периодам. Группы периодической таблицы – это столбцы. Периодами периодической таблицы являются строки.
TL;DR (слишком длинно, не читал)
Элементы одного периода имеют одно и то же главное квантовое число, которое описывает как размер, так и энергию внешней электронной оболочки атома.
Электронные оболочки
Электроны атома вращаются вокруг ядра в нечетком облаке, управляемом вероятностью. Однако может быть полезно думать об электронных орбитах как о жестких оболочках, содержащих множество различных возможных электронных орбиталей. По мере увеличения атомного номера его оболочки должны вмещать все большее число электронов. Самая внешняя оболочка называется валентной оболочкой; номер периода относится к этой оболочке.
Квантовые числа
Схема возможного положения электрона в атоме определяется квантовыми числами. Главное квантовое число n соответствует размеру и энергии электронных оболочек. Он может иметь ненулевые целые значения: 1, 2, 3 и так далее. По мере увеличения чисел увеличиваются как размер, так и энергия электронной оболочки. Второе квантовое число l соответствует форме орбиталей внутри оболочки. Эти числа обычно обозначаются соответствующими буквами: 0=s, 1=p, 2=d и 3=f. Значение l может варьироваться от нуля до n-1. Например, если электрон имеет главное квантовое число 2, он может существовать в одной из двух различных форм орбиты, s или p. Третье квантовое число m соответствует ориентации орбиталей. Третье квантовое число всегда должно быть между -l и +l. Следовательно, имеется одна s-орбиталь, три p-орбитали, пять d-орбиталей и семь f-орбиталей.
Значение l может варьироваться от нуля до n-1. Например, если электрон имеет главное квантовое число 2, он может существовать в одной из двух различных форм орбиты, s или p. Третье квантовое число m соответствует ориентации орбиталей. Третье квантовое число всегда должно быть между -l и +l. Следовательно, имеется одна s-орбиталь, три p-орбитали, пять d-орбиталей и семь f-орбиталей.
Добавление электронов и перемещение по периодической таблице
Одна пара электронов заполняет орбиталь. У водорода один электрон, поэтому он занимает первую орбиталь: 1s. У гелия есть два электрона, оба из которых все еще помещаются на 1s-орбитали. Следующий элемент, литий, имеет три электрона. Первые два укладываются в орбиталь 1s. Однако третий электрон должен находиться на новой орбитали. Главное квантовое число 1 ограничивает второе квантовое число нулем, что, в свою очередь, означает, что третье тоже должно быть нулем. Таким образом, все пространство, связанное с первой оболочкой, занято. Следующий электрон должен существовать в новой оболочке и на новой орбите: 2s-орбитали. Это означает, что главное квантовое число увеличилось; элемент должен находиться в другом периоде. Как и ожидалось, литий начинает группу 2 периодической таблицы, так как его валентная оболочка имеет главное квантовое число 2.
Следующий электрон должен существовать в новой оболочке и на новой орбите: 2s-орбитали. Это означает, что главное квантовое число увеличилось; элемент должен находиться в другом периоде. Как и ожидалось, литий начинает группу 2 периодической таблицы, так как его валентная оболочка имеет главное квантовое число 2.
Тенденции атомного радиуса
Атомы не меняют главные квантовые числа при перемещении слева направо по периодической таблице. Следовательно, все электроны находятся примерно на одинаковом расстоянии от ядра. Однако добавляется больше протонов. Это создает больший положительный заряд в ядре, что приводит к большему притяжению электронов внутрь. Следовательно, атомный радиус или расстояние от ядра до самого внешнего края атома фактически уменьшается по мере того, как вы перемещаетесь по периоду. С другой стороны, по мере продвижения вниз по периодической таблице номер периода увеличивается. Главное квантовое число увеличивается, и поэтому электронное облако увеличивается в размерах. В свою очередь, атомный радиус увеличивается по мере продвижения вниз по таблице Менделеева.
В свою очередь, атомный радиус увеличивается по мере продвижения вниз по таблице Менделеева.
Как найти группу и период элемента
Периодическая таблица помогает в систематическом изучении большинства природных элементов. В периодической таблице элементы подразделяются на разные группы и периоды, что помогает в изучении соединений, созданных этими элементами. Также можно анализировать энергию ионизации, электромагнетизм, сродство к электрону и так далее.
Впервые Менделеев опубликовал периодический закон, утверждая, что «свойства элементов являются периодической функцией их атомных весов». Настоящая периодическая таблица, которую мы используем сегодня, представляет собой обновленную версию некоторых моделей, предложенных учеными в девятнадцатом и двадцатом веках. Таблица представляет собой список элементов, расположенных в порядке возрастания их атомных номеров.
Периодическая таблица в ее нынешнем виде известна как современная периодическая таблица. Он имеет 18 вертикальных столбцов и 7 горизонтальных рядов. Положение элементов в современной периодической таблице определяется путем определения периодов и групп в периодической таблице. Мы обсудим, как можно определить групповой период и блок элементов, используя различные разработанные правила. Периодическая таблица с номерами групп и периодов приведена ниже:-
Он имеет 18 вертикальных столбцов и 7 горизонтальных рядов. Положение элементов в современной периодической таблице определяется путем определения периодов и групп в периодической таблице. Мы обсудим, как можно определить групповой период и блок элементов, используя различные разработанные правила. Периодическая таблица с номерами групп и периодов приведена ниже:-
Периодическая таблица с номерами групп и номерами периодов
Период
Горизонтальная строка периодической таблицы называется периодом. Периодическая таблица разделена на семь периодов, каждый из которых начинается с крайнего левого. Когда новый первичный энергетический уровень начинает заполняться электронами, начинается новый период. Период 1 включает только два элемента (водород и гелий), а периоды 2 и 3 — по восемь. В периодах 4 и 5 имеется 18 элементов. Две нижние строки содержат 32 элемента, принадлежащих периодам 6 и 7, поэтому они отделены от остальной части таблицы.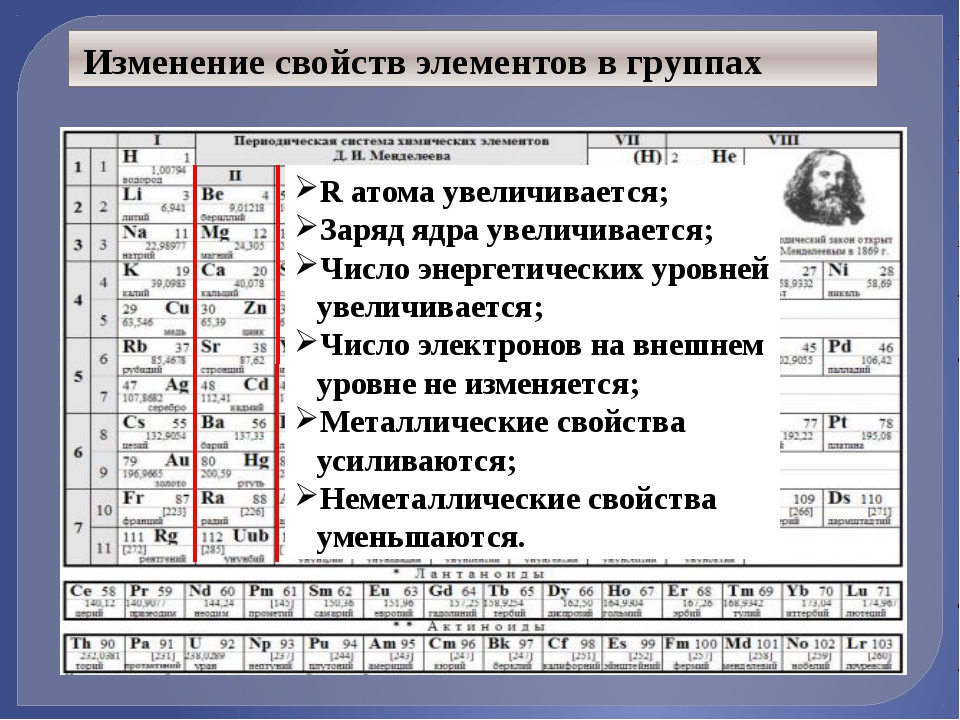 Эти две строки были удалены, чтобы таблица легче помещалась на одной странице. Эти две строки находятся в конце таблицы, в основном называемые лантанидами и актинидами. Элементы в левой части периода — это все металлы, а элементы в правой части — обычно неметаллы.
Эти две строки были удалены, чтобы таблица легче помещалась на одной странице. Эти две строки находятся в конце таблицы, в основном называемые лантанидами и актинидами. Элементы в левой части периода — это все металлы, а элементы в правой части — обычно неметаллы.
Как найти период элемента?
Значение n для самой внешней или валентной оболочки показано точкой. Количество оболочек в атоме определяет период. Период элемента представлен главным квантовым числом (n) валентных электронов в электронной конфигурации атома.
Количество оболочек равно количеству периодов при определении периода.
Пример: Na- 2,8,1 – Имеется три оболочки, поэтому номер периода равен 3.
Кальций – 2,8,8,2 – Имеется четыре оболочки, следовательно, число периодов равно четырем.
Группа
Основываясь на организации электронов внешней оболочки, группа представляет собой вертикальный столбец периодической таблицы. Всего 18 групп. Вы должны быть знакомы с обеими системами нумерации, которые часто используются для обозначения групп. Буквы A и B используются в традиционной системе США. 1А и 2А — первые две группы, а с 3А по 8А — последние шесть. Имена средних групп начинаются с буквы B. Однако в Европе существовала несколько иная структура. Международный союз теоретической и прикладной химии (IUPAC) согласился, что официальная система нумерации групп будет простой от 1 до 18 слева направо, чтобы избежать недоразумений. Если g — элемент какой-либо группы, а n — некоторое натуральное число, то порядок элемента в группе определяется как e=gn.
Всего 18 групп. Вы должны быть знакомы с обеими системами нумерации, которые часто используются для обозначения групп. Буквы A и B используются в традиционной системе США. 1А и 2А — первые две группы, а с 3А по 8А — последние шесть. Имена средних групп начинаются с буквы B. Однако в Европе существовала несколько иная структура. Международный союз теоретической и прикладной химии (IUPAC) согласился, что официальная система нумерации групп будет простой от 1 до 18 слева направо, чтобы избежать недоразумений. Если g — элемент какой-либо группы, а n — некоторое натуральное число, то порядок элемента в группе определяется как e=gn.
Как узнать номер группы?
Чтобы определить группу, мы должны сначала знать следующие правила:
Если элемент принадлежит p-блоку, номер группы можно рассчитать по формуле (число валентных электронов + 10) для группы.
Пример: Сера (16) – 2,8,6
Группа = нет.

 Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.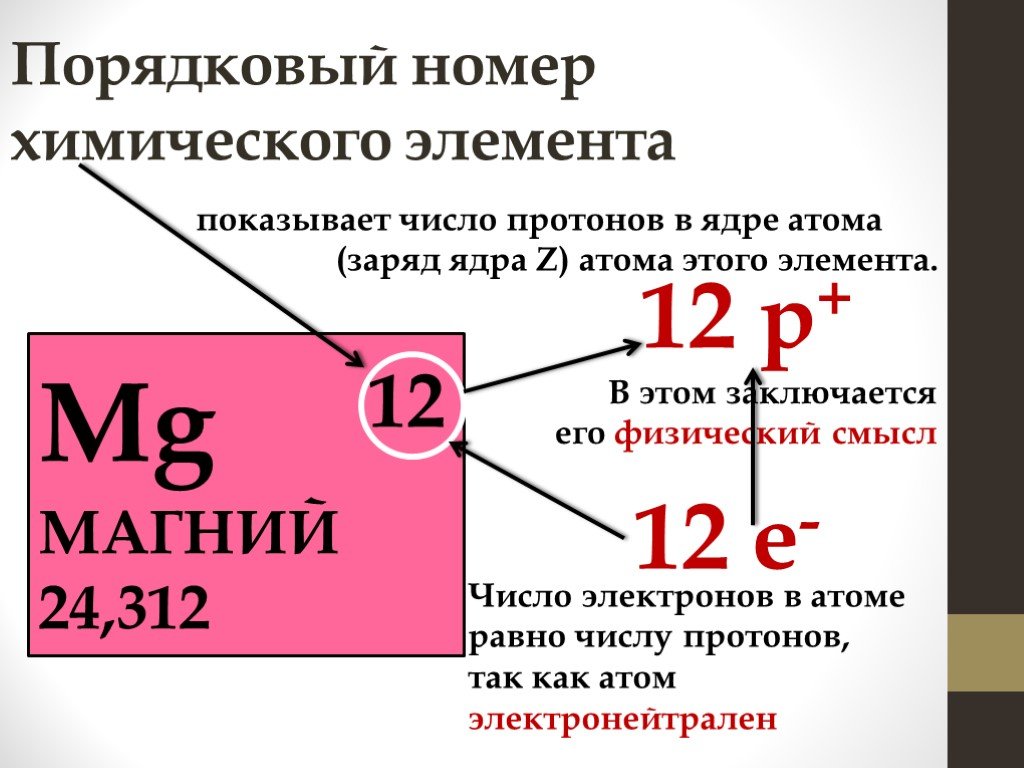
 Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
 Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется. Элементы IVA группы периодической системы имеет два электрона на s-орбитали и два электрона на р-орбиталях. Конфигурация внешней электронной оболочки атомов фтора F, хлора Сl и брома Вг также одинакова (два s- и пять р-электронов). И эти элементы относятся к одной группе (VIIA). Атомы элементов одной группы имеют одинаковое строение внешней электронной оболочки. Именно поэтому такие элементы имеют сходные химические свойства. Химические свойства каждого элемента определяются электронным строением атомов этого элемента . Это основополагающий принцип современной химии. Именно он лежит в основе периодической системы.
Элементы IVA группы периодической системы имеет два электрона на s-орбитали и два электрона на р-орбиталях. Конфигурация внешней электронной оболочки атомов фтора F, хлора Сl и брома Вг также одинакова (два s- и пять р-электронов). И эти элементы относятся к одной группе (VIIA). Атомы элементов одной группы имеют одинаковое строение внешней электронной оболочки. Именно поэтому такие элементы имеют сходные химические свойства. Химические свойства каждого элемента определяются электронным строением атомов этого элемента . Это основополагающий принцип современной химии. Именно он лежит в основе периодической системы.
 В группе IA внешний электрон атома натрия находится на Зs-орбитали, калия — на 4s-орбитали, рубидия – 5s-орбитали и т. д. Поскольку 4s-орбиталь больше по размеру, чем Зs-орбиталь, атом калия имеет большие размеры, чем атом натрия. По этой же причине в каждой группе размеры атомов возрастают сверху вниз .
В группе IA внешний электрон атома натрия находится на Зs-орбитали, калия — на 4s-орбитали, рубидия – 5s-орбитали и т. д. Поскольку 4s-орбиталь больше по размеру, чем Зs-орбиталь, атом калия имеет большие размеры, чем атом натрия. По этой же причине в каждой группе размеры атомов возрастают сверху вниз . Последняя группа (инертные газы) выпадает из этих закономерностей.
Последняя группа (инертные газы) выпадает из этих закономерностей. Это связано с тем, что конфигурация из восьми электронов на внешней электронной оболочке чрезвычайно стабильна.
Это связано с тем, что конфигурация из восьми электронов на внешней электронной оболочке чрезвычайно стабильна.