Молекулярная физика и термодинамика
Уравнение Клапейрона — Менделеева следует из молекулярно-кинетической теории в предположении идеальности газа. Если мы хотим описывать поведение реальных систем, надо учесть взаимодействие молекул между собой. Точный учет межмолекулярных сил — задача чрезвычайно трудная. Поэтому было предложено несколько модификаций уравнения состояния идеального газа, которые могли бы учесть основные особенности реальных систем. Наиболее удачной попыткой стало уравнение Ван-дер-Ваальса, при получении которого вносились поправки в уравнение состояния идеального газа
В подходе Ван-дер-Ваальса, во-первых, принимается во внимание, что молекулы имеют конечные размеры. Если обозначить собственный объем всех молекул в моле вещества буквой b, то для движения молекул остается свободный объем
и именно он должен фигурировать в уравнении состояния. Во-вторых, учитывается, что молекула, подлетающая к стенке сосуда, «чувствует» притяжение других молекул, которое уравновешивалось, когда молекула была внутри сосуда.
Как зависит внутреннее давление pi от параметров системы? Сила, действующая на каждую молекулу, пропорциональна концентрации п молекул в системе. Число подлетающих к стенке молекул также пропорционально п, и потому внутреннее давление пропорционально квадрату концентрации частиц:
Обозначая коэффициент пропорциональности буквой а, приходим к уравнению Ван-дер-Ваальса
|
|
(2. |
Для одного моля вещества это уравнение упрощается:
|
|
(2.36) |
Дополнительная информация
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm — Я. де Бур Введение в молекулярную физику и термодинамику, Изд. ИЛ, 1962 г. — стр. 38–47, ч. I, § 6, п.п. б, в. — обсуждается уравнение Ван-дер-Ваальса и приводятся экспериментально полученные межмолекулярные потенциальные энергии взаимодействия для гелия, водорода, аргона и углекислого газа;
http://www.plib.ru/library/book/14222.html — Яворский Б.М., Детлаф А.А. Справочник по физике, Наука, 1977 г. — стр. 246–248 — детальная информация о силах межмолекулярного притяжения в газе Ван-дер-Ваальса.
Рассмотрим вид изотерм газа Ван-дер-Ваальса на (р,V) – диаграмме (рис. 2.14). Они описываются функцией
|
|
(2.37) |
При достаточно высоких температурах и больших объемах введенными поправками можно пренебречь, и вид изотерм получится обычным. При понижении температуры вид изотерм все более искажается и при некотором критическом значении температуры Тсданная изотерма приобретает точку перегиба (критическую точку) с координатами (рс, Vc), в которой равны нулю первая и вторая производные давления по объему. При дальнейшем понижении температуры точка перегиба превращается в минимум и максимум функции p(V).
Рис. 2.14. Изотермы газа Ван-дер-Ваальса
Найдем сначала значения параметров, соответствующих критической точке. Берем первую и вторую производные функции (2.37) и приравниваем их нулю:
|
|
(2.38) |
Решение этой пары уравнений даст нам критические значения Tc и Vc. Находя из первого уравнения значение
|
|
(2.39) |
подставляем его во второе уравнение, откуда тогда следует
или
Получаем сначала значение молярного критического объема
|
|
(2. |
Подставляя его в уравнение (2.39), находим критическую температуру
|
|
(2.41) |
Наконец, подставляя найденные значения Тс, Vcв уравнение (2.37), находим критическое давление
|
|
(2.42) |
Эти критические значения получены для одного моля вещества.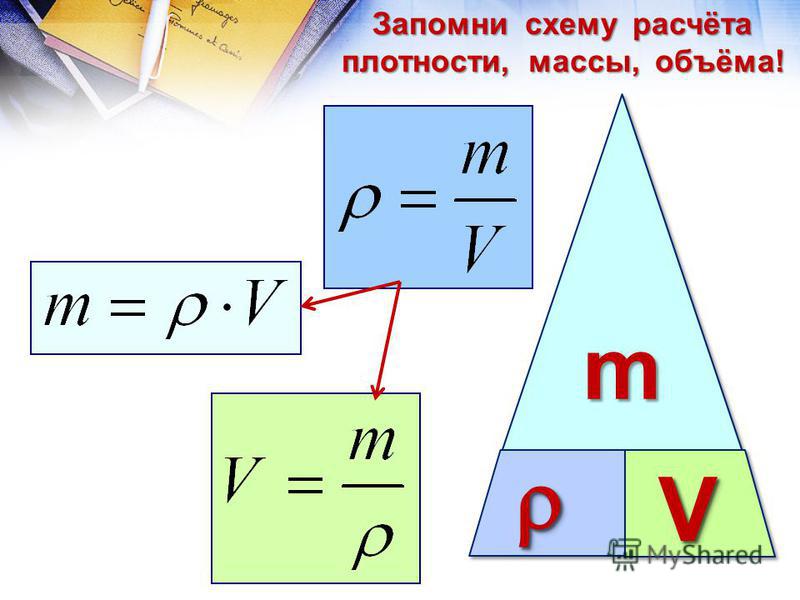 Чтобы найти их для произвольного числа молей, заметим, что при переходе от уравнения (2.36) к (2.35) надо произвести масштабное преобразование
Чтобы найти их для произвольного числа молей, заметим, что при переходе от уравнения (2.36) к (2.35) надо произвести масштабное преобразование
Выполняя то же преобразование в формулах для критических значений термодинамических параметров, убеждаемся, что критические температура и давление не изменяются, а объем преобразуется естественным образом:
|
|
(2.43) |
Значения критических параметров берутся из данных эксперимента. Отметим, что газовая постоянная R также может быть выражена через критические параметры:
|
|
(2. |
Для каждого реального газа следует вычислять свою индивидуальную газовую постоянную R, которая будет отличаться от универсальной газовой постоянной NAkBидеального газа. Этому не следует удивляться, учитывая феноменологический приближенный характер уравнения Ван-дер-Ваальса. Значения критических параметров некоторых веществ и их газовая постоянная приведены в табл. 2.
Таблица 2.
Критические параметры некоторых газов
|
Газ |
Тс , К |
рс , МПа |
Vm , см3/моль |
|
|
Не |
5. |
0.23 |
57.5 |
0.82 |
|
Н2 |
33.2 |
1.30 |
65.5 |
0.82 |
|
02 |
154.8 |
5.08 |
78 |
0. |
|
С02 |
304.1 |
7.39 |
94 |
0.73 |
|
Н20 |
647.3 |
22.1 |
56.3 |
0.62 |
Возьмем для примера пары воды. Из таблицы следует значение коэффициента
Поделив на число Авогадро, получаем объем одной молекулы
откуда для диаметра молекулы следует оценка
Это действительно близко к размерам молекулы воды, что свидетельствует о правильности модели Ван-дер-Ваальса.
Введем обозначения в виде соответствующих греческих букв для термодинамических параметров, измеренных в единицах их критических значений, то есть для безразмерных отношений:
|
|
(2.45) |
В этих обозначениях все критические значения термодинамических параметров равны единице, а уравнение Ван-дер-Ваальса (2.36) принимает простой вид
|
|
(2.46) |
Отметим универсальность этого уравнения, которое может быть использовано даже без точного знания значений критических параметров (но они нужны, конечно, при возвращении к обычным единицам измерения температуры, давления и объема).
На рис. 2.15 представлены изотермы газа Ван-дер-Ваальса для нескольких значений температуры (q=2; 1.1; 1; 0.9; 0.85).
Рис. 2.15. Изотермы газа Ван-дер-Ваальса для различных значений температуры (построены для безразмерных отношений термодинамических параметров р, V , Т к их критическим значениям рс , Vc , Tc)
При достаточно высоких температурах Т = 2Тс(q = 2) изотермы Ван-дер-Ваальса совпадают с изотермами идеального газа за исключением области малых объемов. При понижении температуры гиперболы начинают искажаться и при Т = Тс(q = 1) график имеет точку перегиба при р = рс , V = Vc(p = 1, u = 1). При еще более низких температурах на изотерме появляются минимум и максимум.
Дополнительная информация
http://www. femto.com.ua/articles/part_1/0356.html — Физическая энциклопедия. «Точка Бойля» на изотермах Ван-дер-Ваальса в координатах (P – PV) разграничивает силы межмолекулярного притяжения и отталкивания.
femto.com.ua/articles/part_1/0356.html — Физическая энциклопедия. «Точка Бойля» на изотермах Ван-дер-Ваальса в координатах (P – PV) разграничивает силы межмолекулярного притяжения и отталкивания.
Объем, масса, плотность, удельный объем. Приведение к нормальным и стандартным условиям и пересчет
Главная / Справочник / Приложения / Единицы физических величин, физико-химические понятия, соотношения, состав и характеристики газов / Объем, масса, плотность, удельный объем. Приведение к нормальным и стандартным условиям и пересчет
Приведение к нормальным и стандартным условиям
Единицей измерения объема газа является кубический метр (м³). Измеренный объем приводится к нормальным физическим условиям.
Нормальные физические условия: давление 101 325 Па, температура 273,16 К (0 °С).
Стандартные условия: давление 101 325 Па, температура 293,16 К (+20 °С).
В настоящее время эти обозначения выходят из употребления.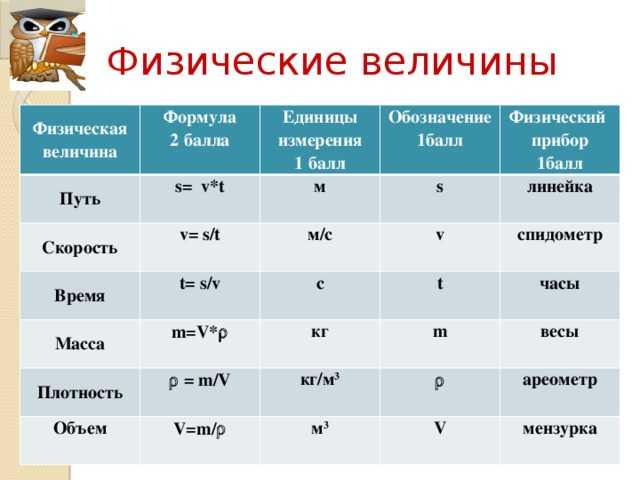 Поэтому в дальнейшем следует указывать те условия, к которым относятся объемы и другие параметры газа. Если эти условия не указываются, то это значит, что параметры газа даны при 0 °С (273,16 °К) и 760 мм рт. ст. (1,033 кгс/см²). Иногда объем газа (особенно в иностранной литературе и нормах) при пользовании системой СИ приводится к 288,16 °К (+15 °С) и давлению 1 бар (105 Па).
Поэтому в дальнейшем следует указывать те условия, к которым относятся объемы и другие параметры газа. Если эти условия не указываются, то это значит, что параметры газа даны при 0 °С (273,16 °К) и 760 мм рт. ст. (1,033 кгс/см²). Иногда объем газа (особенно в иностранной литературе и нормах) при пользовании системой СИ приводится к 288,16 °К (+15 °С) и давлению 1 бар (105 Па).
Если известен объем газа при одних условиях, то пересчитать его в объемы при других условиях можно с помощью коэффициентов, приведенных следующей таблице.
Коэффициенты для пересчета объемов газа из одних условий в другие
| Температура и даление газа | 0 °С и 760 мм рт. ст. | 15 °С и 760 мм рт. ст. | 20 °С и 760 мм рт. ст. | 15 °С (288,16 °К) и 1 бар |
| 0 °С и 760 мм рт. ст. (норм. условия) | 1 | 1,055 | 1,073 | 1,069 |
15 °С и 760 мм рт. ст. (в зар. литературе) ст. (в зар. литературе) |
0,948 | 1 | 1,019 | 1,013 |
| 20 °С и 760 мм рт. ст. (ст. условия) | 0,932 | 0,983 | 1 | 0,966 |
| 15 °С (288,16 °К) и 1 бар (СИ) | 0,936 | 0,987 | 1,003 | 1 |
Для приведения объемов газа к 0 °С (273,16 °К) и 760 мм рт. ст. (1,033 кгс/см²), а также к 20 °С (293,16 °К) и 760 мм рт. ст. (1,033 кгс/см²) могут быть применены следующие формулы:
где V0 °С и 760 мм рт. ст. — объем газа при 0 °С и 760 мм рт. ст., м³;
V20° С и 760 мм рт. ст. — объем газа при 20 °С и 760 мм рт. ст., м³;
VP — объем газа в рабочих условиях, м³;
р — абсолютное давление газа в рабочих условиях, мм рт. ст.;
Т — абсолютная температура газа в рабочих условиях, °К.
Пересчет объемов газа, приведенных к 0 °С и 760 мм рт. ст., а также к 20 °С и 760 мм рт. ст., в объемы при других (рабочих) условиях можно производить по формулам:
ст., а также к 20 °С и 760 мм рт. ст., в объемы при других (рабочих) условиях можно производить по формулам:
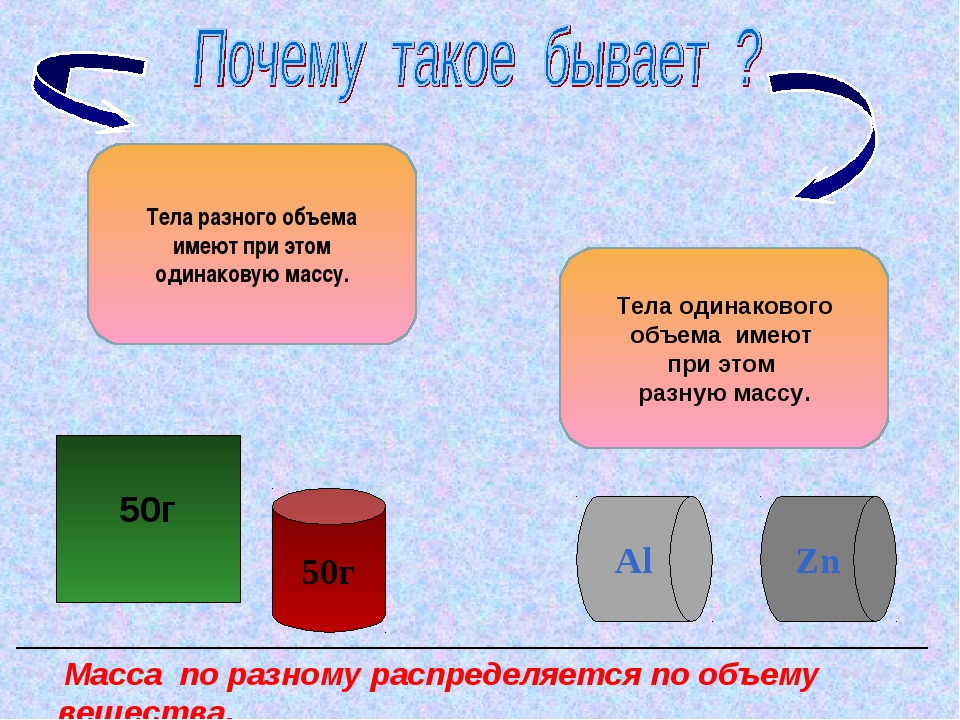
Любой газ способен расширяться. Следовательно, знание объема, который занимает газ, недостаточно для определения его массы, так как в любом объеме, целиком заполненном газом, его масса может быть различной.
Масса — это мера вещества какого-либо тела (жидкости, газа) в состоянии покоя; скалярная величина, характеризующая инерционные и гравитационные свойства тела. Единицы массы в СИ — килограмм (кг).
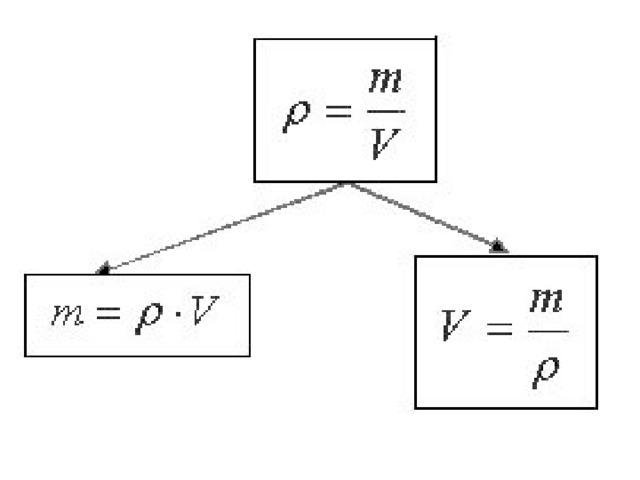
Плотность, или масса единицы объема, обозначаемая буквой p, — это отношение массы тела m, кг, к его объему, V, м³:
p = m/V
или с учетом химической формулы газа:
p = M/VМ = M/22,4,
где M — молекулярная масса,
VМ — молярный объем.
Единица плотности в СИ — килограмм на кубический метр (кг/м³).
Зная состав газовой смеси и плотность ее компонентов, определяем по правилу смешения среднюю плотность смеси:
pсм = (p1V1 + p2V2 + … + pnVn)/100,
где p1, p2, …, pn — плотность компонентов газового топлива, кг/м³;
V1, V2, …, Vn — содержание компонента, об. %.
%.
Величину, обратную плотности, называют удельным, или массовым, объемом (ν) и измеряют в кубических метрах на килограмм (м³/кг).
Как правило, на практике, чтобы показать, на сколько 1 м³ газа легче или тяжелее 1 м³ воздуха, используют понятие относительная плотность d, которая представляет собой отношение плотности газа к плотности воздуха:
d = p/1,293
и
d = M/(22,4×1,293).
| |||||||||||||||||||||

 35)
35)
 44)
44) 2
2 82
82 Замечено, что если мы имеем
определенное количество (масса или объем) присутствующего газа, значение
температура и давление не зависят от количества газа,
мы рассматриваем. Например, предположим, что у нас есть бак с бензином.
Если мы вставим тарелку в бак
что сокращает объем вдвое, температуру в
каждая половина остается неизменной, как и давление. Значение
давление и температура не зависят от количества газа, используемого в
измерение. С другой стороны, масса газа зависит
на громкости. Разрезание объема на две части сокращает массу на две части.
масса каждой секции бака равна половине массы всего бака.
масса зависит от объема, а объем, в свою очередь, зависит от
масса. Если мы сохраним давление и температуру этого газа и
заполнить объект, который может изменять свой объем, например, воздушный шар или
цилиндр со скользящим концом, конечный объем напрямую зависит от
количество газа, которое мы закачиваем. Вы можете попробовать этот эксперимент на
анимированная газовая лаборатория.
Замечено, что если мы имеем
определенное количество (масса или объем) присутствующего газа, значение
температура и давление не зависят от количества газа,
мы рассматриваем. Например, предположим, что у нас есть бак с бензином.
Если мы вставим тарелку в бак
что сокращает объем вдвое, температуру в
каждая половина остается неизменной, как и давление. Значение
давление и температура не зависят от количества газа, используемого в
измерение. С другой стороны, масса газа зависит
на громкости. Разрезание объема на две части сокращает массу на две части.
масса каждой секции бака равна половине массы всего бака.
масса зависит от объема, а объем, в свою очередь, зависит от
масса. Если мы сохраним давление и температуру этого газа и
заполнить объект, который может изменять свой объем, например, воздушный шар или
цилиндр со скользящим концом, конечный объем напрямую зависит от
количество газа, которое мы закачиваем. Вы можете попробовать этот эксперимент на
анимированная газовая лаборатория. Обратите внимание, что если
мы держим объем постоянным и вводим массу, значение давления
и изменение температуры, но в примере на этом слайде общее
масса сохраняется постоянной.
Обратите внимание, что если
мы держим объем постоянным и вводим массу, значение давления
и изменение температуры, но в примере на этом слайде общее
масса сохраняется постоянной.  Для многих жидкостей
динамические (подвижные) приложения, масса варьируется от одного места к
другой, и аэродинамики обычно используют плотность как интенсивную
имущество.
Для многих жидкостей
динамические (подвижные) приложения, масса варьируется от одного места к
другой, и аэродинамики обычно используют плотность как интенсивную
имущество.