Молярный объем газа – таблица и формула (химия, 8 класс)
4.3
Средняя оценка: 4.3
Всего получено оценок: 486.
4.3
Средняя оценка: 4.3
Всего получено оценок: 486.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Рис. 1. Закон Авогадро.Молярный объем газа
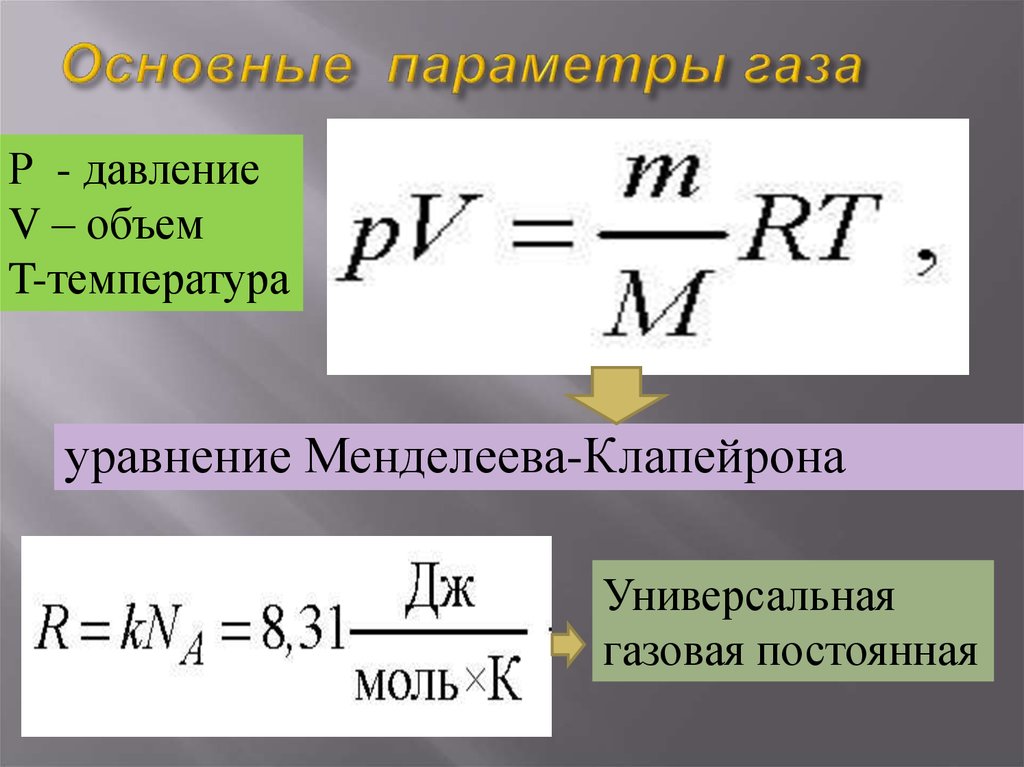
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
Рис. 2. Молярный объем формула.В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Аэлита Коробка
5/5
Александр Котков
5/5
Настя Бабич
5/5
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 486.
А какая ваша оценка?
Страница не найдена – РОО “Ассоциация победителей олимпиад”
Ваши ФИО*
Ваш email*
Ваш номер телефона*
Какой предмет вы хотели бы преподавать?*
Расскажите кратко о своих олимпиадных достижениях*
Приложите резюме*
Please leave this field empty.
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
Ваша электронная почта*
Из какого вы региона?*
Расскажите, как мы могли бы сотрудничать*
Please leave this field empty.
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО*
Ваша электронная почта*
Ваш номер телефона*
Образовательное учреждение*
Расскажите кратко, какая у вас сложилась ситуация с олимпиадным движением в школе и какого результата вы ожидаете от сотрудничества с АПО*
Please leave this field empty.
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
Ваш email
Каким предметом вы интересуетесь
Выберите наиболее подходящий статус Статус не выбранУченикРодительПредставитель школыПедагог
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО ученика
Дата рождения ученика
Класс
Образовательное учреждение
Город образовательного учреждения
ФИО родителя
Телефон родителя
Email родителя
Выберите группу Группа не выбрана
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО ученика
Дата рождения ученика
Класс
Образовательное учреждение
Город образовательного учреждения
ФИО родителя
Телефон родителя
Email родителя
Выберите группу Группа не выбрана
Мотивационное письмо Объём файла не должен превышать 2 Мбайт / Доступные форматы: doc / docx / rtf / pdf / html / txt
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.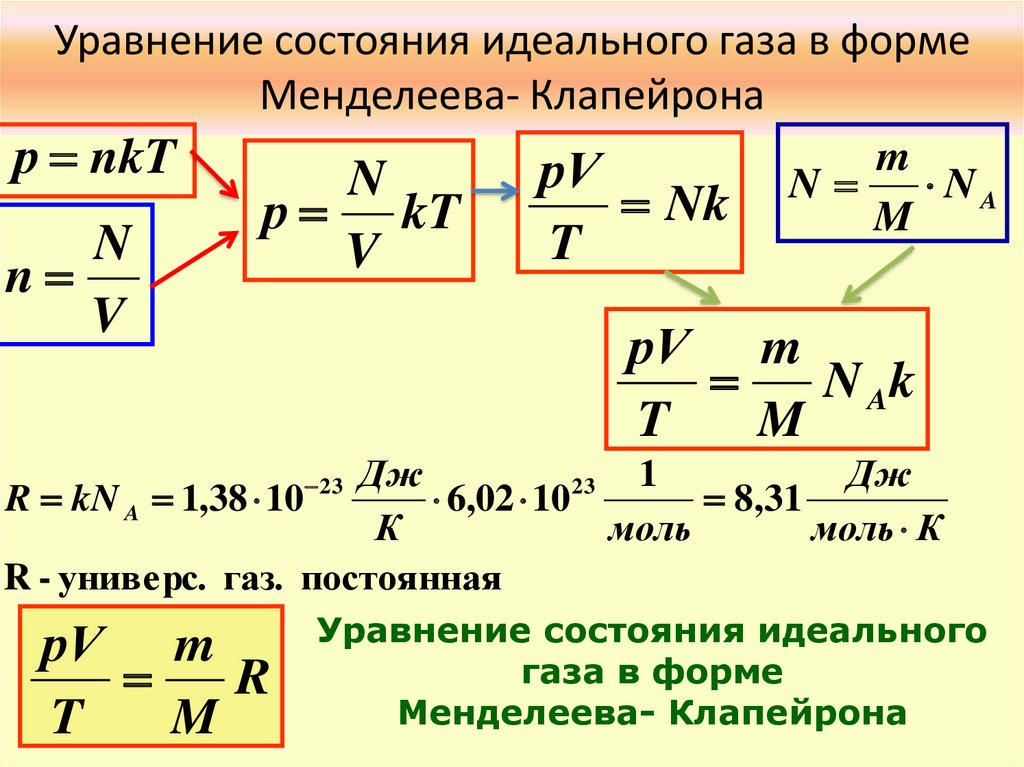
ФИО
Телефон
Образовательное учреждение
Город образовательного учреждения
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО
Телефон
Проект / отдел
Должность
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
ФИО ребенка
Название образовательного учреждения
Город образовательного учреждения
ФИО родителя
Телефон родителя
Email родителя
Нажимая на кнопку, вы принимаете положение и согласие на обработку персональных данных.
Войти
Родитель
Буду покупать курсы для своего ребёнка ЗарегистрироватьсяОбучающийся
Сам буду проходить курсы ЗарегистрироватьсяПредставитель школы
Буду заказывать услуги для своего образовательного учреждения и контролировать их исполнение ЗарегистрироватьсяКалькулятор закона идеального газа
Создано Bogna Szyk
Отзыв Стивена Вудинга
Последнее обновление: 28 января 2023 г.
- Что такое идеальный газ
- Константа идеального газа
- FAQ
- Как рассчитать температуру газа, зная количество молей, объем и давление?
Этот калькулятор закона идеального газа поможет вам установить свойства идеального газа в зависимости от изменения давления, температуры или объема. Читайте дальше, чтобы узнать о характеристиках идеального газа, как использовать уравнение закона идеального газа и определение постоянной идеального газа.
Мы также рекомендуем воспользоваться нашим калькулятором комбинированного газового закона для лучшего понимания основных термодинамических процессов идеальных газов.
Что такое идеальный газ
Идеальный газ — это частный случай любого газа, который удовлетворяет следующим условиям:
- Газ состоит из большого числа молекул, которые движутся беспорядочно.
- Все молекулы являются точечными частицами (не занимают места).
- Молекулы не взаимодействуют, за исключением столкновения.

- Все столкновения между частицами газа абсолютно упругие (посетите наш калькулятор сохранения импульса, чтобы узнать больше).
- Частицы подчиняются законам движения Ньютона.
Уравнение закона идеального газа
Все свойства идеального газа сводятся к одной формуле вида: ⋅R⋅T
где:
- ppp – давление газа, измеренное в Па;
- VVV – объем газа, измеренный в м³;
- nnn – количество вещества, измеренное в молях;
- RRR — постоянная идеального газа; и
- TTT – температура газа, измеряемая в градусах Кельвина.
Чтобы найти любое из этих значений, просто введите другие значения в калькулятор закона идеального газа.
Например, если вы хотите рассчитать объем 40 молей газа при давлении 1013 гПа и температуре 250 К, результат будет равен:
V = nRT/p = 40 * 8,31446261815324 * 250 / 101300 = 0,82 м³ .
Постоянная идеального газа
Газовая постоянная (символ R) также называется молярной или универсальной постоянной. Он используется во многих фундаментальных уравнениях, таких как закон идеального газа.
Он используется во многих фундаментальных уравнениях, таких как закон идеального газа.
Значение этой константы равно 8,31446261815324 Дж/(моль·К) .
Газовая постоянная часто определяется как произведение постоянной Больцмана k (которая связывает кинетическую энергию и температуру газа) и числа Авогадро (число атомов в моле вещества): 9{-23} \text{ J/K})\\
&= 8,3144626 \text{ Дж/(моль} \cdot \text{К)}
\end{align*}R=NAk=(6,02214076×1023 /моль)⋅(1,38064852×10−23 Дж/К)=8,3144626 Дж/(моль⋅К)
Вы можете найти это давление воздуха при Калькулятор высоты тоже полезен.
Часто задаваемые вопросы
Когда можно использовать закон идеального газа?
Вы можете применить закон об идеальном газе для любого * газа с плотностью достаточно низкой для предотвращения возникновения сильных межмолекулярных взаимодействий. В этих условиях любой газ более или менее правильно моделируется простым уравнением PV = nRT , которое относится к давлению, температуре и объему.
Какова формула закона идеального газа?
Формула закона идеального газа:
P · V = n · R · T
где:
-
P— давление , в паскалях; -
V— объем в кубических метрах; -
n— количество родинок ; -
T— Температура в кельвинах; и -
R— Постоянная идеального газа .
Не забывайте использовать согласованные единицы измерения! Значение, обычно используемое для R , 8,314... Дж · К/моль , относится к давлению, измеренному исключительно в паскалях.
Чему равно давление
0,1 молей газа при 50 °C в кубическом метре? 268,7 Па или 0,00265 атм . Чтобы найти этот результат:
- Преобразуйте температуру в кельвины:
Т [К] = 273,15 + 50 = 323,15 К.
- Вычислите произведение температуры, числа молей и газовой постоянной:
n · R · T = 0,1 моль · 323,15 K · 8,3145 Дж · K/моль = 268,7 Дж(то есть энергии ). - Разделить на объем. В этом случае объем равен
1, следовательно:
P = 268,7 Па .
Какие три закона термодинамики можно выделить в законе идеального газа?
Закон идеального газа имеет четыре параметра . Одним из них является число молей, которое немного выходит за рамки термодинамики. Остальные три — это давление , температура и объем . Мы можем выделить три закона, зафиксировав по очереди каждый из трех:
- Зафиксировав температуру, мы найдем изотермическое превращение (или закон Бойля ):
PV = k. - Фиксируя объем, находим изохорное преобразование ( закон Шарля ):
П/Т = k.
- Зафиксировав давление, мы имеем изобарическое преобразование ( закон Гей-Люссака ):
V/T = k.
Как рассчитать температуру газа, зная количество молей, объем и давление?
Чтобы рассчитать температуру газа по давлению и объему, выполните следующие простые шаги:
- Рассчитайте произведение давления и объемов. Убедитесь, что вы используете одинаковые единицы измерения: хороший выбор — 9.0108 паскалей и кубических метров .
- Рассчитайте произведение количества молей на газовую постоянную . Если вы использовали паскали и кубические метры, константа равна
R = 8,3145 Дж · К/моль. - Разделить результат шага 1 на результат шага 2: результатом будет температура (в кельвинах ):
T = P · V/n · R`
Bogna Szyk
Давление (p)
Объем (V)
Количество вещества (n)
моль
Температура (T)
Ознакомьтесь с 42 похожими калькуляторами термодинамики и тепла 🌡️
Число Био Фактор Больцмана Закон Бойля… Еще 39
Объем газа: уравнение, законы и единицы измерения
9000 не имеет определенной формы и объема. Молекулы газа могут расширяться, чтобы заполнить любой контейнер, в котором они находятся. Как же тогда рассчитать объем газа, если его нельзя зафиксировать? В этой статье рассматривается объем газа и его свойства. Мы также обсудим другие свойства, на которые влияет изменение объема газа. Наконец, мы рассмотрим примеры, где мы будем вычислять объем газа. Приятного обучения!
Молекулы газа могут расширяться, чтобы заполнить любой контейнер, в котором они находятся. Как же тогда рассчитать объем газа, если его нельзя зафиксировать? В этой статье рассматривается объем газа и его свойства. Мы также обсудим другие свойства, на которые влияет изменение объема газа. Наконец, мы рассмотрим примеры, где мы будем вычислять объем газа. Приятного обучения!
Определение объема газа
Рис. 1: Объем газа принимает форму сосуда, в котором хранится газ.
Газы не имеют четкой формы или объема , пока они контейнер. Их молекулы рассредоточены и движутся беспорядочно , и это свойство позволяет газам расширяться и сжиматься, когда газ выталкивается в контейнеры различных размеров и форм.
Объем газа можно определить как объем контейнера, в котором он содержится. 93\).
Приведенное выше уравнение справедливо только при комнатной температуре и атмосферном давлении. Но что, если давление и температура также меняются? На объем газа влияют изменения давления и температуры . Давайте посмотрим на их отношения.
Давайте посмотрим на их отношения.
Теперь давайте изучим влияние изменения давления на объем газа.
Зависимость между давлением и объемом газа
Рис. 3: По мере уменьшения объема газа давление увеличивается. Это связано с тем, что увеличивается частота и влияние столкновений между молекулами газа и стенками сосуда.
Теперь рассмотрим фиксированное количество газа, поддерживаемого при постоянной температуре. Уменьшение объема газа заставит молекулы газа двигаться ближе друг к другу. Это увеличит столкновения между молекулами и стенками контейнера. Это приводит к увеличению давления газа. Давайте посмотрим на математическое уравнение для этого отношения, называемое законом Бойля.
Формула, описывающая объем газа
Закон Бойля дает соотношение между давлением и объемом газа при постоянной температуре. 93\) . Проще говоря, закон Бойля звучит так:
\[\text{давление}\times \text{объем}=\text{константа}. \]
\]
Приведенное выше уравнение верно, только если температура и количество газа постоянны. Его также можно использовать при сравнении одного и того же газа в разных условиях, 1 и 2:
\[p_1v_1=p_2V_2,\]
или прописью:
\[\text{начальное давление}\times \text{начальное volume}=\text{конечное давление}\times \text{конечный объем}.\]
Подводя итог, можно сказать, что для фиксированного количества газа (в молях) при постоянной температуре произведение давления на объем постоянно.
Чтобы дать вам более полное представление о факторах, влияющих на объем газов, мы рассмотрим изменение температуры газа во время этого глубокого погружения. Мы говорили о том, как молекулы газа хаотично движутся в сосуде, в котором они находятся: эти молекулы сталкиваются друг с другом и со стенками сосуда.
Рис. 4: При нагревании газа при постоянном давлении его объем увеличивается. Это связано с тем, что средняя скорость частиц газа увеличивается и заставляет газ расширяться.
Теперь рассмотрим фиксированное количество газа, находящегося в закрытом контейнере при постоянном давлении . По мере повышения температуры газа средняя энергия молекул увеличивается, увеличивая их среднюю скорость. Это приводит к расширению газа. Жак Шарль сформулировал закон, связывающий объем и температуру газа следующим образом.
Объем фиксированного количества газа при постоянном давлении прямо пропорционален его температуре.
Это соотношение может быть описано математически как 93\). Этот ответ имеет смысл, потому что после увеличения давления мы ожидаем уменьшения объема.
На этом мы подошли к концу статьи. Давайте посмотрим, что мы уже узнали.
Объем газа – основные выводы
- Газы не имеют определенной формы или объема, пока они не будут считаться содержащимися в закрытом контейнере.
- Объем, занимаемый одним молем любого газа при комнатной температуре и атмосферном давлении, равен \(24\,\,\mathrm{дм}^3\).