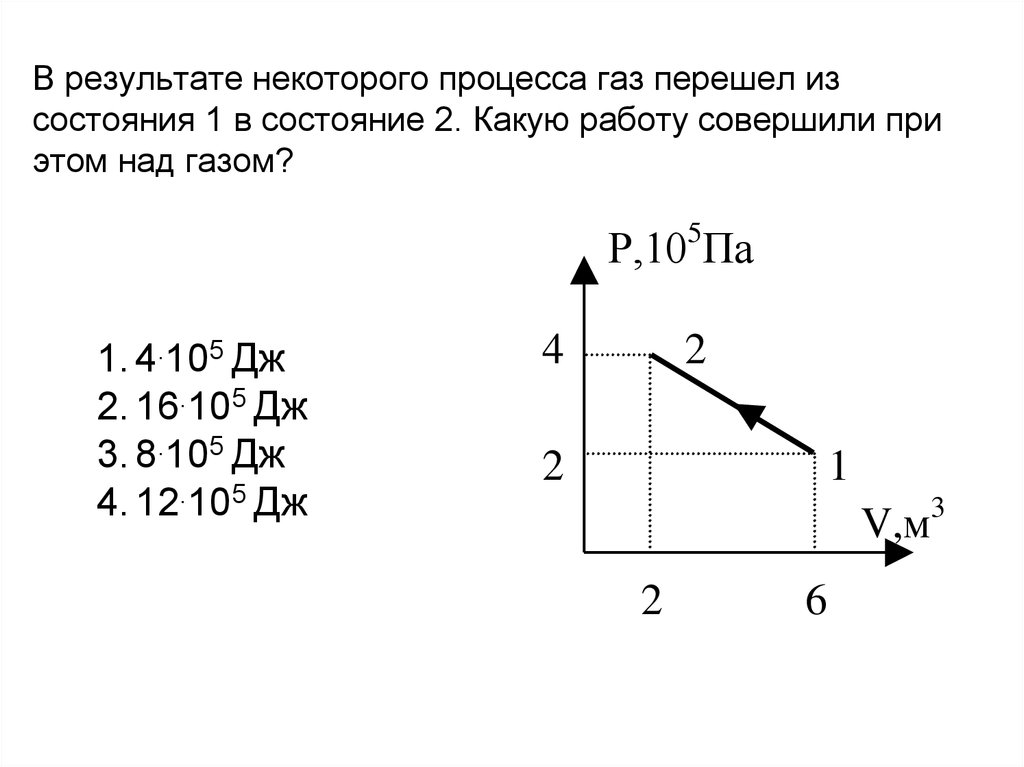
Помогите решить / разобраться (Ф)
| fiztech |
| ||
09/07/12 |
| ||
| |||
| Bulinator |
| |||
30/10/10 |
| |||
| ||||
| fiztech |
| ||
09/07/12 |
| ||
| |||
| DimaM |
| |||
28/12/12 |
| |||
| ||||
| Показать сообщения за: Все сообщения1 день7 дней2 недели1 месяц3 месяца6 месяцев1 год Поле сортировки АвторВремя размещенияЗаголовокпо возрастаниюпо убыванию |
| Страница 1 из 1 | [ Сообщений: 4 ] |
Модераторы: Pphantom, Jnrty, Aer, Парджеттер, Eule_A, photon, whiterussian, profrotter, Супермодераторы
Одноатомный идеальный газ нагревают так что его давление линейно меняется с температурой
Идеальный газ изохорно нагревают так, что его температура изменяется на T = 240 К, а давление — в 1,8 раза.
 Масса газа постоянна. Определите
Масса газа постоянна. ОпределитеКак быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Идеальный одноатомный газ нагревается от температуры Т1 = 300К до температуры Т2 = 400К таким образом , что его температура меняется линейно с изменением давления от Р1 = 1атм до Р2 = 2атм ?
Идеальный одноатомный газ нагревается от температуры Т1 = 300К до температуры Т2 = 400К таким образом , что его температура меняется линейно с изменением давления от Р1 = 1атм до Р2 = 2атм .
Найти отношение конечной и начальной теплоёмкостей газа в этом процессе.
Решение во вложении
в правильности ответа не уверен.
Некоторое количество идеального одноатомного газа нагревается от температуры T = 300 К до температуры T2 = 400 К?
Некоторое количество идеального одноатомного газа нагревается от температуры T = 300 К до температуры T2 = 400 К.
При этом объём газа изменялся прямо пропорционально его абсолютной температуре (V = αT, α = const).
Начальный объём газа V1 = 3 л, давление, измеренное в конце процесса, оказалось равным P = 1 атм.
Какую работу совершил газ в этом процессе?
Какое количество теплоты было подведено газу?
Если можете, то решение на фото и подробно.
Заранее огромное спасибо!
Один моль идеального газа / одноатомного / , находящийся при температуре 27°С нагревают при постоянном давлении, затратив энергию 30 кДж?
Один моль идеального газа / одноатомного / , находящийся при температуре 27°С нагревают при постоянном давлении, затратив энергию 30 кДж.
Найти изменение его внутренней энергии.
Объем идеального газа неизменной массы при изобарном процессе уменьшили в 2 раза?
Объем идеального газа неизменной массы при изобарном процессе уменьшили в 2 раза.
Определите конечную температуру газа, если его начальная температура была равна 600 К.
Газ в сосуде находится под давлением 2 атм при температуре 127 градусов?
Газ в сосуде находится под давлением 2 атм при температуре 127 градусов.
Определить давление газа после того как половина массы газа выпущена из, сосуда а температура на 50 градусов.
Газ при давлении 6 атм и температуре 27 0С занимает объем 50 л?
Газ при давлении 6 атм и температуре 27 0С занимает объем 50 л.
Каким будет его давление, если газ данной массы при температуре 127 0С займет объем 100 л?
1) 2 атм 2) 4 атм 3) 8 атм 4) 6 атм.
Имеется 12л углекислого газа под давлением 9 атм, и температуре 288°С найти массу газа?
Имеется 12л углекислого газа под давлением 9 атм, и температуре 288°С найти массу газа.
Определите начальную температуру газа, если в изохорном процессе давление изменилось с 2кпа до 4кпа а конечная температура 400к?
Определите начальную температуру газа, если в изохорном процессе давление изменилось с 2кпа до 4кпа а конечная температура 400к.
Идеальный газ изохорно нагревают так что его температура изменяется на 240К, а давление — в 1, 8 раза?
Идеальный газ изохорно нагревают так что его температура изменяется на 240К, а давление — в 1, 8 раза.
Масса газа постоянная.
Найдите начальную температуру по шкале Кельвина.
Имеется 12л углекислого газа под давлением 9 атм и температуре 288 гр Цельсия?
Имеется 12л углекислого газа под давлением 9 атм и температуре 288 гр Цельсия.
Найти массу газа.
Найти начальную температуру водорода, если его давление при нагревании газа при постоянном объёме на ΔТ = 200К увеличилась с Р1 = 1 атм до Р2 = 2 атм?
Найти начальную температуру водорода, если его давление при нагревании газа при постоянном объёме на ΔТ = 200К увеличилась с Р1 = 1 атм до Р2 = 2 атм.
Вы открыли страницу вопроса Идеальный одноатомный газ нагревается от температуры Т1 = 300К до температуры Т2 = 400К таким образом , что его температура меняется линейно с изменением давления от Р1 = 1атм до Р2 = 2атм ?. Он относится к категории Физика. Уровень сложности вопроса – для учащихся 10 — 11 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Физика, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Больше внутреннюю энергию имеет вода при 0С чем лед при 0C так как при плавлении льда он поглощает тепло Q = л * m.
E = A + Ek Ek = E — A = 6, 2 — 2, 5 = 3, 7 эВ.
Дано : Решение : Q = mL m = 0. 005 кг. Q = 0. 005 x 2300000 = 11500 Дж t = 100 °C L = 2300000 Дж / кг Найти : Q — ? Ответ : 11. — 1)/ \alpha$.
— 1)/ \alpha$.
Один моль одноатомного газа совершает цикл, состоящий из двух изохор и двух изобар
Условие задачи:
Один моль одноатомного газа совершает цикл, состоящий из двух изохор и двух изобар. При этом максимальное давление в 2 раза больше минимального, а максимальный объем в 3 раза больше минимального. Определите коэффициент полезного действия цикла.
Задача №5.5.45 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
\(\nu=1\) моль, \(p_2=2p_1\), \(V_2=3V_1\), \(\eta-?\)
Решение задачи:
Изобразим цикл, совершаемый над газом, в координатах p-V (смотрите схему).
КПД цикла \(\eta\) определяют по формуле:
\[\eta = \frac{A}{{{Q_н}}}\;\;\;\;(1)\]
Работа газа в цикле \(A\) равна площади цикла в координатах p-V, при этом если цикл обходится по часовой стрелке (как у нас), то работа цикла положительна.
\[A = \left( {{p_2} – {p_1}} \right)\left( {{V_2} – {V_1}} \right)\]
Так как по условию \(p_2=2p_1\) и \(V_2=3V_1\), то:
\[A = \left( {2{p_1} – {p_1}} \right)\left( {3{V_1} – {V_1}} \right) = 2{p_1}{V_1}\;\;\;\;(2)\]
Отлично! Теперь, чтобы найти количество теплоты \(Q_н\), нужно определить все процессы в цикле, в которых тепло подводилось к газу. Для начала запишем первый закон термодинамики, мы к нему будем постоянно обращаться:
Для начала запишем первый закон термодинамики, мы к нему будем постоянно обращаться:
\[Q = \Delta U + A\;\;\;\;(3)\]
Изменение внутренней энергии одноатомного идеального газа \(\Delta U\) определяют по формуле:
\[\Delta U = \frac{3}{2}\nu R\Delta T\;\;\;\;(4)\]
Работу газа \(A\) можно определить следующим образом:
\[A = p\Delta V\;\;\;\;(5)\]
Также запишем уравнение Клапейрона-Менделеева для состояния газа в точках 1-4. В уравнениях сразу учтём, что \(p_2=2p_1\) и \(V_2=3V_1\).
\[\left\{ \begin{gathered}
{p_1}{V_1} = \nu R{T_1} \;\;\;\;(6)\hfill \\
2{p_1}{V_1} = \nu R{T_2} \;\;\;\;(7)\hfill \\
2{p_1} \cdot 3{V_1} = \nu R{T_3} \;\;\;\;(8)\hfill \\
{p_1} \cdot 3{V_1} = \nu R{T_4} \hfill \\
\end{gathered} \right.\]
Рассмотрим процесс 1-2, который является изохорным (\(V=const\)), значит работа газа \(A_{12}\) в этом процессе равна нулю (так как \(\Delta V_{12}=0\)). Поэтому количество теплоты \(Q_{12}\) по формуле (3) равно:
\[{Q_{12}} = \Delta {U_{12}}\]
Тогда согласно формуле (4), имеем:
\[{Q_{12}} = \frac{3}{2}\nu R\Delta {T_{12}}\;\;\;\;(9)\]
Так как в этом изохорном процессе давление увеличивается, значит по закону Шарля температура также растёт (\(\Delta T_{12}>0\)). Поэтому из формулы (9) следует, что тепло в процессе 1-2 подводилось (\(Q_{12}>0\)). Отнимем из уравнения (7) уравнение (6):
Поэтому из формулы (9) следует, что тепло в процессе 1-2 подводилось (\(Q_{12}>0\)). Отнимем из уравнения (7) уравнение (6):
\[{p_1}{V_1} = \nu R\left( {{T_2} – {T_1}} \right)\]
\[{p_1}{V_1} = \nu R\Delta {T_{12}}\]
Тогда формула (9) примет такой вид:
\[{Q_{12}} = \frac{3}{2}{p_1}{V_1}\;\;\;\;(10)\]
Если провести аналогичные рассуждения для изохорного процесса 3-4, то Вы выясните, что \(Q_{34}<0\), то есть тепло в этом процессе отводилось от газа.
Также рассмотрим изобарный процесс 2-3 (\(p=const\)). Количество теплоты \(Q_{12}\) согласно формуле (3) равно:
\[{Q_{23}} = \Delta {U_{23}} + {A_{23}}\;\;\;\;(11)\]
Изменение внутренней энергии \(\Delta U_{23}\) по формуле (4) равно:
\[\Delta {U_{23}} = \frac{3}{2}\nu R\Delta {T_{23}}\;\;\;\;(12)\]
Работа газа \(A_{23}\) согласно формуле (5) равна:
\[{A_{23}} = {p_2} \cdot \left( {{V_2} – {V_1}} \right) = {p_2}{V_2} – {p_2}{V_1}\]
Так как в условии сказано, что \(p_2=2p_1\) и \(V_2=3V_1\), то:
\[{A_{23}} = 2{p_1} \cdot 3{V_1} – 2{p_1}{V_1}\]
Учитывая уравнения (7) и (8), имеем:
\[{A_{23}} = \nu R{T_3} – \nu R{T_2}\]
\[{A_{23}} = \nu R\Delta {T_{23}}\;\;\;\;(13)\]
Подставив выражения (12) и (13) в формулу (11), получим:
\[{Q_{23}} = \frac{3}{2}\nu R\Delta {T_{23}} + \nu R\Delta {T_{23}}\]
\[{Q_{23}} = \frac{5}{2}\nu R\Delta {T_{23}}\;\;\;\;(14)\]
Так как в изобарном процессе 2-3 объем увеличивался, значит по закону Гей-Люссака его температура росла (\(\Delta T_{23}>0\)). Поэтому из формулы (14) следует, что тепло в процессе 2-3 подводилось (\(Q_{23}>0\)). Отнимем из уравнения (8) уравнение (7):
Поэтому из формулы (14) следует, что тепло в процессе 2-3 подводилось (\(Q_{23}>0\)). Отнимем из уравнения (8) уравнение (7):
\[4{p_1}{V_1} = \nu R\left( {{T_3} – {T_2}} \right)\]
\[4{p_1}{V_1} = \nu R\Delta {T_{23}}\]
Тогда формула (14) примет такой вид:
\[{Q_{23}} = \frac{5}{2} \cdot 4{p_1}{V_1}\]
\[{Q_{23}} = 10{p_1}{V_1}\;\;\;\;(15)\]
Проведя аналогичные рассуждения для изобарного процесса 4-1, Вы выясните, что \(Q_{41}<0\), то есть тепло в этом процессе отводилось от газа.
В ходе наших рассуждений мы выяснили, что к газу теплота подводится только в процессах 1-2 и 2-3, то есть количество теплоты \(Q_н\) равно:
\[{Q_н} = {Q_{12}} + {Q_{23}}\]
Примем во внимание полученные равенства (10) и (15), тогда:
\[{Q_н} = \frac{3}{2}{p_1}{V_1} + 10{p_1}{V_1}\]
\[{Q_н} = \frac{{23}}{2}{p_1}{V_1}\;\;\;\;(16)\]
Тогда согласно формуле (1) коэффициент полезного действия цикла \(\eta\), учитывая выражения (2) и (16), равен:
\[\eta = \frac{{2{p_1}{V_1}}}{{\frac{{23}}{2}{p_1}{V_1}}} = \frac{4}{{23}} = 0,174\]
Ответ: 0,174.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
5.5.44 Тепловая машина с максимально возможным КПД имеет в качестве нагревателя
5.5.46 Над одним молем идеального газа совершают цикл, показанный на рисунке
5.5.47 В некотором процессе внутренняя энергия газа уменьшилась на 300 Дж, а газ
Что такое внутренняя энергия идеального газа – одноатомный газ, двухатомная молекула атомы или молекулы в системе и различны для одноатомных газов и двухатомных молекул. Теплотехника
Внутренняя энергия идеального газа
Внутренняя энергия представляет собой сумму всей энергии, связанной с движением атомов или молекул в системе. Микроскопические формы энергии включают в себя формы, обусловленные вращением , вибрацией , поступательным движением и взаимодействиями между молекулами вещества.
Одноатомный газ – внутренняя энергия
Для одноатомного идеального газа (такого как гелий, неон или аргон) единственный вклад в энергию вносит поступательная кинетическая энергия . Средняя поступательная кинетическая энергия отдельного атома зависит только от от температуры газа и определяется уравнением:
К ср = 3/2 кт.
Внутренняя энергия n молей идеального одноатомного (один атом на молекулу) газа равна средней кинетической энергии на молекулу, умноженной на общее число молекул, N:
E int = 3/2 NkT = 3/2 nRT
, где n — число молей. Каждое направление (x, y и z) дает вклад (1/2)nRT к внутренней энергии . Вот тут-то и появляется идея о равнораспределении энергии – любой другой вклад в энергию также должен вносить свой вклад (1/2)nRT . Как видно, внутренняя энергия идеального газа зависит только от температуры и количества молей газа.
Как видно, внутренняя энергия идеального газа зависит только от температуры и количества молей газа.
Двухатомная молекула – внутренняя энергия
Если молекулы газа содержат более одного атома, имеется три направления переноса и кинетическая энергия вращения также вносит свой вклад, но только для вращения вокруг двух из трех перпендикулярных осей. Пять вкладов в энергию (пять степеней свободы) дают:
Двухатомный идеальный газ:
E int = 5/2 NkT = 5/2 nRT
промежуточные температуры. При низких температурах только поступательная кинетическая энергия вносит , а при более высоких температурах два дополнительных вклада (кинетическую и потенциальную энергию) вносят вибрации. внутренняя энергия будет больше при данной температуре, чем у одноатомного газа, но для идеального газа она все же будет функцией только температуры.
Внутренняя энергия реальных газов также в основном зависит от температуры, но подобно закону идеального газа внутренняя энергия реальных газов также несколько зависит от давления и объема . Все реальные газы приближаются к идеальному состоянию при низких давлениях (плотностях). При низком давлении молекулы находятся достаточно далеко друг от друга, чтобы не взаимодействовать друг с другом. Внутренняя энергия жидкостей и твердых тел довольно сложна, ибо включает в себя электрическая потенциальная энергия связана с силами (или химическими связями ) между атомами и молекулами.
Удельная теплоемкость при постоянном объеме и постоянном давлении
Удельная теплоемкость — это свойство, связанное с внутренней энергией , которое очень важно в термодинамике. Интенсивные свойства c v и c p определяются для чистых, простых сжимаемых веществ как частные производные внутренняя энергия u(T, v) и энтальпия h(T, p) соответственно:
где индексы v и p обозначают фиксированные переменные, удерживаемые при дифференцировании. Свойства c v и c p называются удельной теплоемкостью (или теплоемкостью ), поскольку при определенных особых условиях они связывают изменение температуры системы с количеством энергии, добавленной теплопередача. Их единицы СИ равны 9.0013 Дж/кг K или Дж/моль K . Для газов определены две удельные теплоемкости: одна для постоянного объема (c v ) и одна для постоянного давления (c p ) .
Свойства c v и c p называются удельной теплоемкостью (или теплоемкостью ), поскольку при определенных особых условиях они связывают изменение температуры системы с количеством энергии, добавленной теплопередача. Их единицы СИ равны 9.0013 Дж/кг K или Дж/моль K . Для газов определены две удельные теплоемкости: одна для постоянного объема (c v ) и одна для постоянного давления (c p ) .
Согласно первому закону термодинамики , для процесса постоянного объема с одноатомным идеальным газом молярная удельная теплоемкость будет: потому что
U = 3/2nRT
Можно вывести, что молярная теплоемкость при постоянном давлении равна: C p больше, чем молярная удельная теплоемкость при постоянном объеме C v , потому что теперь необходимо подводить энергию не только к , но и повышать температуру газа газ, чтобы сделать работу , потому что в этом случае изменяется объем.
Ссылки:
Физика реакторов и теплогидравлика:
- Дж. Р. Ламарш, Введение в теорию ядерных реакторов, 2-е изд., Addison-Wesley, Reading, MA (1983).
- Дж. Р. Ламарш, А. Дж. Баратта, Введение в ядерную технику, 3-е изд., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
- В. М. Стейси, Физика ядерных реакторов, John Wiley & Sons, 2001, ISBN: 0-471-39127-1.
- Гласстоун, Сезонске. Разработка ядерных реакторов: разработка реакторных систем, Springer; 4-е издание, 1994 г., ISBN: 978-0412985317
- Тодреас Нил Э., Казими Муджид С. Ядерные системы, том I: Основы термогидравлики, второе издание. CRC-пресс; 2 издание, 2012 г., ISBN: 978-0415802871
- Зохури Б., Макдэниел П. Термодинамика в системах атомных электростанций. Спрингер; 2015 г., ISBN: 978-3-319-13419-2
- Моран Михал Дж., Шапиро Ховард Н. Основы инженерной термодинамики, пятое издание, John Wiley & Sons, 2006 г.
 , ISBN: 978-0-470-03037-0
, ISBN: 978-0-470-03037-0 - Кляйнштройер К. Современная гидродинамика. Спрингер, 2010 г., ISBN 978-1-4020-8670-0.
- Министерство энергетики США, ТЕРМОДИНАМИКА, ТЕПЛОПЕРЕДАЧА И ПОТОК ЖИДКОСТИ. Справочник по основам Министерства энергетики, том 1, 2 и 3. Июнь 1992 г.
См. также:
Закон идеального газа
Мы надеемся, что эта статья Внутренняя энергия идеального газа — одноатомный газ, двухатомная молекула поможет вам . Если это так, дайте нам лайк на боковой панели. Основная цель этого веб-сайта – помочь общественности узнать интересную и важную информацию о теплотехнике.
Категории ТеплотехникаCopyright 2022 Теплотехника | Все права защищены | Атомная энергия | Реакторная физика |
Гл. 3 задачи – University Physics Volume 2
Проблемы
3.1 Термодинамические системы
19.
Газ соответствует pV=bp+cTpV=bp+cT на изотермической кривой, где p — давление, V — объем, b — константа, а c — функция температуры . Покажите, что для этого газа можно установить температурную шкалу при изохорном процессе, которая идентична шкале идеального газа.
20.
Моль газа имеет изобарический коэффициент расширения dV/dT=R/pdV/dT=R/p и изохорный коэффициент давление-температура dp/dT=p/Tdp/dT=p/T. Найдите уравнение состояния газа.
21.
Найдите уравнение состояния твердого тела с коэффициентом изобарического расширения dV/dT=2cT−bpdV/dT=2cT−bp и изотермическим коэффициентом давление-объем dV/dp=−bT.dV/dp=−bT.
3.2 Работа, теплота и внутренняя энергия
22.
Газ при давлении 2,00 атм совершает квазистатическое изобарическое расширение от 3,00 до 5,00 л. Какую работу совершает газ?
23.
Требуется 500 Дж работы, чтобы квазистатически сжать 0,50 моль идеального газа до одной пятой его первоначального объема. Рассчитайте температуру газа, считая, что она остается постоянной во время сжатия.
24.
Установлено, что при квазистатическом расширении разбавленного газа от 0,50 до 4,0 л он совершает работу 250 Дж. Если предположить, что температура газа остается постоянной на уровне 300 К, сколько молей газа имеется?
25.
При квазистатическом изобарическом расширении газ совершает работу 500 Дж. Если давление газа равно 0,80 атм, на какую долю увеличится объем газа, если предположить, что первоначально он составлял 20,0 л?
26.
При квазистатическом изобарическом изменении объема газа от 10,0 до 2,0 л требуется 15 Дж работы от внешнего источника. Каково давление газа?
Каково давление газа?
27.
Идеальный газ квазистатически и изотермически расширяется из состояния с давлением p и объемом V в состояние с объемом 4V. Покажите, что работа, совершаемая газом при расширении, равна pV(ln 4).
28.
Как показано ниже, рассчитайте работу, совершаемую газом в квазистатических процессах, представленных путями (a) AB; (б) АБР; (в) АКБ; и (d) ADCB.
29.
(a) Рассчитайте работу, совершаемую газом на замкнутом пути, показанном ниже. Изогнутая часть между R и S имеет полукруглую форму. б) Какова работа, совершаемая газом, если процесс протекает в обратном направлении?
30.
Идеальный газ квазистатически расширяется до трехкратного своего первоначального объема. Какой процесс требует больше работы от газа, изотермический процесс или изобарический? Определить отношение работы, совершаемой в этих процессах.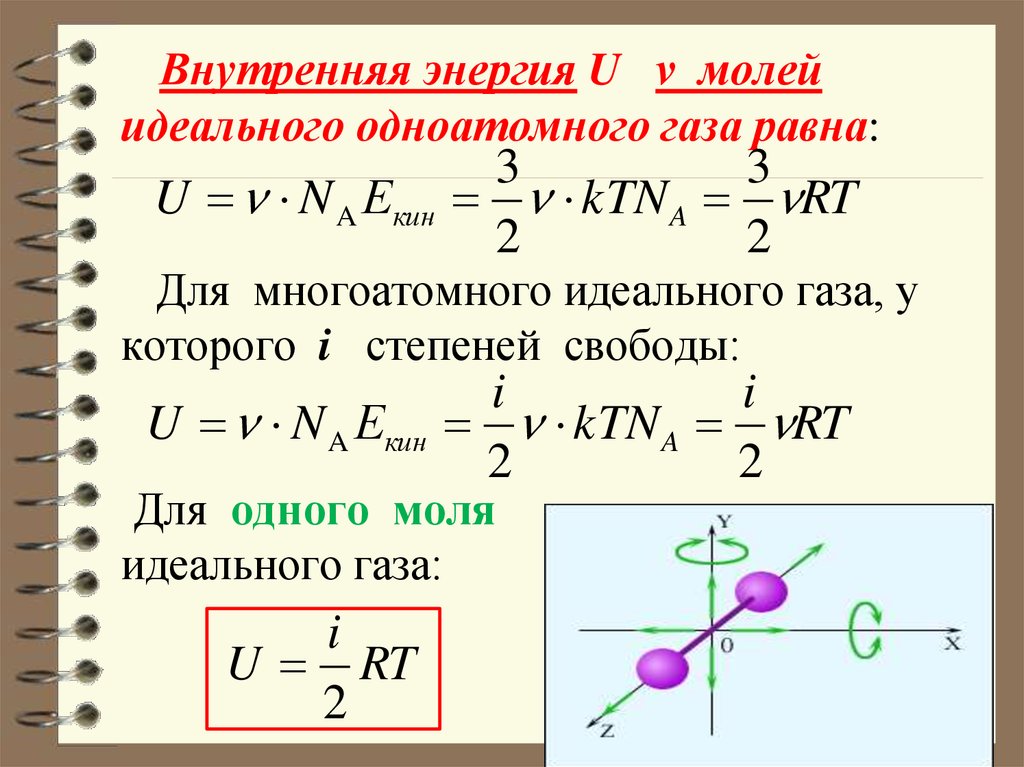
31.
Разбавленный газ при давлении 2,0 атм и объеме 4,0 л проходит следующие квазистатические стадии: (а) изобарическое расширение до объема 10,0 л, (б) изохорное изменение до давления 0,50 атм, (в) изобарическое сжатие до объема 4,0 л и (г) изохорное изменение до давления 2,0 атм. Покажите эти шаги на диаграмме pV и определите по вашему графику чистую работу, выполненную газом.
32.
Какова средняя механическая энергия атомов идеального одноатомного газа при 300 К?
33.
Какова внутренняя энергия 6,00 моль идеального одноатомного газа при 200°C200°C ?
34.
Рассчитайте внутреннюю энергию 15 мг гелия при температуре 0°С.0°С.
35.
Два одноатомных идеальных газа A и B имеют одинаковую температуру. Если 1,0 г газа А имеет ту же внутреннюю энергию, что и 0,10 г газа В, каково (а) отношение числа молей каждого газа и (б) отношение атомных масс двух газов?
36.
Коэффициенты Ван-дер-Ваальса для кислорода: a=0,138 Дж·м3/моль2a=0,138 Дж·м3/моль2 и b=3,18×10-5м3/мольб=3,18×10-5м3/моль. Используйте эти значения, чтобы нарисовать изотерму Ван-дер-Ваальса кислорода при 100 К. На том же графике нарисуйте изотерму одного моля идеального газа.
37.
Найдите работу, выполненную в квазистатических процессах, показанных ниже. Состояния представлены в виде значений (p, V) для точек плоскости pV: 1 (3 атм, 4 L), 2 (3 атм, 6 L), 3 (5 атм, 4 L), 4 (2 атм, 4 L), , 6 л), 5 (4 атм, 2 л), 6 (5 атм, 5 л) и 7 (2 атм, 5 л).
3.3 Первый закон термодинамики
38.
Когда разбавленный газ квазистатически расширяется от 0,50 до 4,0 л, он совершает работу 250 Дж. Если предположить, что температура газа остается постоянной на уровне 300 К, а) как изменится внутренняя энергия газа? б) Какое количество теплоты поглощается газом в этом процессе?
39.
При расширении газа газ совершает работу 500 Дж. Какое количество теплоты поглотил газ, если внутренняя энергия газа при расширении увеличилась на 80 Дж?
40.
Идеальный газ квазистатически и изотермически расширяется из состояния с давлением p и объемом V в состояние с объемом 4V. Какое количество теплоты передается расширяющемуся газу?
41.
Как показано ниже, если теплота, поглощаемая газом вдоль AB, составляет 400 Дж, определите количества теплоты, поглощаемой вдоль (a) ADB; (б) АКБ; и с) АДКБ.
42.
При изобарическом расширении из точки А в точку В, представленном ниже, к газу добавляется 3100 Дж тепла. Как изменится его внутренняя энергия?
43.
(a) Каково изменение внутренней энергии для процесса, представленного замкнутой траекторией, показанной ниже? б) Какое количество теплоты передается? в) Какое количество теплоты обменялось при движении в обратном направлении?
44.
Когда газ расширяется по пути AC, показанному ниже, он совершает работу 400 Дж и поглощает либо 200, либо 400 Дж тепла. а) Предположим, вам сказали, что на пути АВС газ поглощает либо 200, либо 400 Дж тепла. Какое из этих значений верно? б) Дайте правильный ответ из пункта (а), какую работу совершает газ вдоль АВС? в) На пути CD внутренняя энергия газа уменьшается на 50 Дж. Какое количество теплоты обменивается газом на этом пути?
45.
Когда газ расширяется вдоль AB (см. ниже), он совершает работу 20 Дж и поглощает 30 Дж тепла. Когда газ расширяется вдоль AC , он совершает работу 40 Дж и поглощает 70 Дж тепла. а) Сколько теплоты газообмен проходит вдоль г. до н.э. г.? б) При переходе газа из C в A по CDA над ним совершается работа 60 Дж из C в D . Какое количество тепла он обменивает на КДА ?
Какое количество тепла он обменивает на КДА ?
46.
Разбавленный газ хранится в левой камере контейнера, стенки которого идеально изолированы (см. ниже), а правая камера откачивается. При удалении перегородки газ расширяется и заполняет весь контейнер. Вычислите работу, совершенную газом. Изменяется ли при этом внутренняя энергия газа?
47.
Идеальные газы A и B хранятся в левой и правой камерах изолированного контейнера, как показано ниже. Перегородка убирается и газы смешиваются. Совершается ли какая-либо работа в этом процессе? Если температуры А и В изначально равны, что произойдет с их общей температурой после их смешивания?
48.
Идеальный одноатомный газ при давлении 2,0×105 Н/м22,0×105 Н/м2 и температуре 300 К испытывает квазистатическое изобарическое расширение от 2,0×103 до 4,0×103 см3,2,0×103 до 4,0×103 см3 . а) Какую работу совершает газ? б) Какова температура газа после расширения? в) Сколько молей газа? г) Как изменилась внутренняя энергия газа? д) Какое количество теплоты передано газу?
а) Какую работу совершает газ? б) Какова температура газа после расширения? в) Сколько молей газа? г) Как изменилась внутренняя энергия газа? д) Какое количество теплоты передано газу?
49.
Рассмотрим процесс пара в цилиндре, показанный ниже. Предположим, что изменение внутренней энергии в этом процессе равно 30 кДж. Найдите теплоту, поступающую в систему.
50.
Состояние 30 молей пара в цилиндре изменяется циклически из а-в-в-а, где давление и объем состояний: а (30 атм, 20 л), б (50 атм, 20 л) и в (50 атм, 45 л). Предположим, что каждое изменение происходит вдоль линии, соединяющей начальное и конечное состояния в плоскости pV. (а) Отобразите цикл в плоскости pV. б) Найдите чистую работу, совершаемую паром за один цикл. в) Найдите количество теплоты, переданное пару за один цикл.
51.
В одноатомном идеальном газе происходит квазистатический процесс, описываемый функцией p(V)=p1+3(V−V1)p(V)=p1+3(V−V1), где начальным состоянием является (p1,V1)(p1,V1) и конечное состояние (p2,V2)(p2,V2). Предположим, что система состоит из n молей газа в сосуде, который может обмениваться теплом с окружающей средой и объем которого может свободно изменяться. а) Оцените работу, совершаемую газом при изменении состояния. б) Найдите изменение внутренней энергии газа. в) Найдите подвод тепла к газу при переходе. г) Что такое начальная и конечная температуры?
Предположим, что система состоит из n молей газа в сосуде, который может обмениваться теплом с окружающей средой и объем которого может свободно изменяться. а) Оцените работу, совершаемую газом при изменении состояния. б) Найдите изменение внутренней энергии газа. в) Найдите подвод тепла к газу при переходе. г) Что такое начальная и конечная температуры?
52.
Металлический контейнер фиксированного объема 2,5×10-3 м32,5×10-3 м3, погруженный в большой резервуар с температурой 27°С-27°С, содержит два отсека, разделенные свободно подвижной стенкой. Первоначально стенка удерживается на месте пробкой, так что с одной стороны находится 0,02 моля газообразного азота, а с другой стороны – 0,03 моля газообразного кислорода, каждый из которых занимает половину объема. Когда стопор снимается, стенка перемещается и занимает конечное положение. Движение стены контролируется так, что стена движется бесконечно малыми квазистатическими шагами. (a) Найдите окончательные объемы двух сторон, предполагая идеальное газовое поведение для двух газов. б) Какую работу каждый газ совершает над другим? в) Как изменилась внутренняя энергия каждого газа? г) Найдите количество теплоты, которое входит в каждый газ или выходит из него.
б) Какую работу каждый газ совершает над другим? в) Как изменилась внутренняя энергия каждого газа? г) Найдите количество теплоты, которое входит в каждый газ или выходит из него.
53.
Газ в цилиндрическом закрытом сосуде адиабатически и квазистатически расширяется из состояния A (3 МПа, 2 л) в состояние B объемом 6 л по пути 1,8pV=const.1,8pV = постоянный. (а) Постройте путь в плоскости pV . б) Найдите работу, совершаемую газом, и изменение внутренней энергии газа в процессе.
3.4 Термодинамические процессы
54.
Два моля одноатомного идеального газа при (5 МПа, 5 л) изотермически расширяют, пока объем не удвоится (шаг 1). Затем изохорно охлаждают до давления 1 МПа (этап 2). Температура в этом процессе падает. Теперь газ изотермически сжимается до тех пор, пока его объем не вернется к 5 л, но его давление теперь равно 2 МПа (шаг 3). Наконец, газ изохорно нагревается, чтобы вернуться в исходное состояние (шаг 4). а) Изобразите четыре процесса в плоскости pV. б) Найдите полную работу, совершенную газом.
Наконец, газ изохорно нагревается, чтобы вернуться в исходное состояние (шаг 4). а) Изобразите четыре процесса в плоскости pV. б) Найдите полную работу, совершенную газом.
55.
Рассмотрим преобразование из точки A в B в двухэтапном процессе. Сначала давление снижают с 3 МПа в точке А до давления 1 МПа, сохраняя при этом объем на уровне 2 л за счет охлаждения системы. Достигнутое состояние помечено C . Затем систему нагревают при постоянном давлении до достижения объема 6 л в состоянии B . (a) Найдите количество работы, выполненной на пути ACB . б) Найдите количество теплоты, переданное системой при переходе от A — B на пути ACB . (c) Сравните изменение внутренней энергии, когда процесс AB протекает изотермически, с изменением AB в результате двухстадийного процесса на пути ACB .
56.
Рассмотрим цилиндр с подвижным поршнем, содержащий n молей идеального газа. Весь аппарат погружают в баню с постоянной температурой Т Кельвина. Затем поршень медленно толкают, так что давление газа квазистатически изменяется от p1p1 до p2p2 при постоянной температуре T. Найдите работу, совершаемую газом, через n, R, T, p1, p1 и p2.p2. .
57.
Идеальный газ изотермически расширяется вдоль АВ и совершает работу 700 Дж (см. ниже). а) Какое количество теплоты газообменует вдоль АВ? б) Затем газ адиабатически расширяется вдоль ВС и совершает работу 400 Дж. Когда газ возвращается в А по СА, он отдает в окружающую среду 100 Дж тепла. Какую работу совершает газ на этом пути?
58.
Рассмотрим процессы, показанные ниже для одноатомного газа. а) Найдите работу, выполненную в каждом из процессов AB, BC, AD и DC. б) Найдите изменение внутренней энергии в процессах АВ и ВС. (c) Найдите разницу внутренней энергии между состояниями C и A. (d) Найдите общее тепло, добавленное в процессе АЦП. (e) Из приведенной информации можете ли вы найти теплоту, подведенную в процессе AD? Почему или почему нет?
(c) Найдите разницу внутренней энергии между состояниями C и A. (d) Найдите общее тепло, добавленное в процессе АЦП. (e) Из приведенной информации можете ли вы найти теплоту, подведенную в процессе AD? Почему или почему нет?
59.
Два моля газообразного гелия помещены в цилиндрический контейнер с поршнем. Газ находится при комнатной температуре 25°C25°C и под давлением 3,0×105 Па. 3,0×105 Па. Когда давление снаружи уменьшается, а температура остается такой же, как и комнатная, объем газа удваивается. а) Найдите работу, которую внешний агент совершает над газом в процессе. б) Найдите теплоту, передаваемую газом, и укажите, поглощает ли газ теплоту или отдает ее. Предположим, что поведение идеального газа.
60.
Одноатомный идеальный газ в количестве n молей в проводящем сосуде с подвижным поршнем помещают в большую термальную баню при температуре T1T1 и дают газу прийти в равновесие. После достижения равновесия давление на поршень снижается, так что газ расширяется при постоянной температуре. Процесс продолжается квазистатически до тех пор, пока конечное давление не составит 4/3 от начального давления p1.p1. а) Найдите изменение внутренней энергии газа. б) Найдите работу, совершенную газом. в) Найдите количество теплоты, передаваемое газом, и укажите, поглощает ли газ теплоту или отдает ее.
Процесс продолжается квазистатически до тех пор, пока конечное давление не составит 4/3 от начального давления p1.p1. а) Найдите изменение внутренней энергии газа. б) Найдите работу, совершенную газом. в) Найдите количество теплоты, передаваемое газом, и укажите, поглощает ли газ теплоту или отдает ее.
3,5 Теплоемкость идеального газа
61.
Температура идеального одноатомного газа повышается на 8,0 К. Как изменится внутренняя энергия 1 моль газа при постоянном объеме?
62.
При повышении температуры на 10°C10°C при постоянном объеме сколько тепла поглощается (a) 3,0 моль разбавленного одноатомного газа; б) 0,50 моль разбавленного двухатомного газа; в) 15 моль разбавленного многоатомного газа?
63.
Если газы из предыдущей задачи изначально имеют температуру 300 К, какова их внутренняя энергия после того, как они поглотят тепло?
64.
Рассмотрим 0,40 моль разбавленного углекислого газа при давлении 0,50 атм и объеме 50 л. Какова внутренняя энергия газа?
65.
При медленном подводе 400 Дж теплоты к 10 моль идеального одноатомного газа его температура повышается на 10°С10°С. Какую работу совершил газ?
66.
Один моль разбавленного двухатомного газа, занимающий объем 10,00 л, расширяется при постоянном давлении 2000 атм при медленном нагревании. Если в процессе выделяется 400,0 Дж теплоты, каков его конечный объем?
3,6 Адиабатические процессы для идеального газа.
67.
Одноатомный идеальный газ испытывает квазистатическое адиабатическое расширение, при котором его объем удваивается. Как изменилось давление газа?
68.
Идеальный газ имеет давление 0,50 атм и объем 10 л. Он сжимается адиабатически и квазистатически до тех пор, пока его давление не станет равным 3,0 атм и объем 2,8 л. Является ли газ одноатомным, двухатомным или многоатомным?
Он сжимается адиабатически и квазистатически до тех пор, пока его давление не станет равным 3,0 атм и объем 2,8 л. Является ли газ одноатомным, двухатомным или многоатомным?
69.
Измерения давления и объема разбавленного газа, подвергающегося квазистатическому адиабатическому расширению, показаны ниже. Постройте график зависимости ln p от V и определите γγ для этого газа по вашему графику.
| Р (атм) | В (Д) |
|---|---|
| 20,0 | 1,0 |
| 17,0 | 1,1 |
| 14,0 | 1,3 |
| 11,0 | 1,5 |
| 8,0 | 2,0 |
| 5,0 | 2,6 |
| 2,0 | 5,2 |
| 1,0 | 8,4 |
70.
Идеальный одноатомный газ при температуре 300 К адиабатически и обратимо расширяется до удвоенного объема. Какова его конечная температура?
71.
Идеальный двухатомный газ при температуре 80 К медленно адиабатически и обратимо сжимается до половины своего объема. Какова его конечная температура?
72.
Идеальный двухатомный газ при температуре 80 К медленно адиабатически сжимается до одной трети своего первоначального объема. Какова его конечная температура?
73.
Сравните запас внутренней энергии идеального газа при квазистатическом адиабатическом расширении и при квазистатическом изотермическом расширении. Что происходит с температурой идеального газа при адиабатическом расширении?
74.
Температура n молей идеального газа изменяется от T1T1 до T2T2 при квазистатическом адиабатическом переходе. Докажите, что работа, совершаемая газом, равна 9.0007
Докажите, что работа, совершаемая газом, равна 9.0007
W=nRγ-1(T1-T2).W=nRγ-1(T1-T2).
75.
Разбавленный газ квазистатически расширяется до объема, в три раза превышающего его первоначальный объем. Какое конечное давление газа больше при изотермическом или адиабатическом расширении? Зависит ли ваш ответ от того, является ли газ одноатомным, двухатомным или многоатомным?
76.
(a) Идеальный газ адиабатически расширяется от объема 2,0×10−3м32,0×10−3м3 до 2,5×10−3м32,5×10−3м3. Если начальное давление и температура были 5,0×105 Па, 5,0×105 Па и 300 К соответственно, каковы конечные давление и температура газа? Используйте γ=5/3γ=5/3 для газа. (b) В изотермическом процессе идеальный газ расширяется от объема 2,0×10-3м32,0×10-3м3 до 2,5×10-3м32,5×10-3м3. Если начальное давление и температура были 5,0×105 Па, 5,0×105 Па и 300 К соответственно, каковы конечные давление и температура газа?
77.
Об адиабатическом процессе изменения давления, объема и температуры идеального газа, при котором pVγpVγ является постоянной величиной с γ=5/3γ=5/3 для одноатомного газа, такого как гелий, и γ=7/5γ=7/5 для двухатомного газа например водород при комнатной температуре. Используйте числовые значения, чтобы построить две изотермы 1 моль газообразного гелия, используя закон идеального газа и два адиабатических процесса между ними. Используйте T1=500K, V1=1L и T2=300KT1=500K, V1=1L и T2=300K для вашего графика.
78.
Два моля одноатомного идеального газа, например гелия, адиабатически и обратимо сжимаются из состояния (3 атм, 5 л) в состояние с давлением 4 атм. а) Найдите объем и температуру конечного состояния. б) Найдите температуру начального состояния газа. в) Найдите работу, совершенную газом при этом. г) Найдите изменение внутренней энергии газа при этом.
Идеальные газы одноатомные или двухатомные?
Вопрос задан: Ана Кун II
Оценка: 4,8/5 (19 голосов)
Термодинамические и идеальные газы
В одноатомном (моно-: один) газе, поскольку он имеет только одну молекулу, способов получить энергию будет меньше, чем у двухатомного газа (ди-: два), поскольку у двухатомного газа больше способов получить энергию ( Следовательно, двухатомный газ имеет коэффициент 5/2, а одноатомный газ имеет коэффициент 3/2).
Всегда ли идеальный газ одноатомный?
При различных условиях температуры и давления многие реальные газы ведут себя качественно подобно идеальному газу, где молекулы газа (или атомы для одноатомного газа) играют роль идеальных частиц. … Однако модель идеального газа не описывает и не допускает фазовых переходов.
Является ли идеальный газ одноатомным?
Одноатомный газ – внутренняя энергия
Для одноатомного идеального газа (такого как гелий, неон или аргон) единственный вклад в энергию вносит поступательная кинетическая энергия. Средняя поступательная кинетическая энергия отдельного атома зависит только от температуры газа и определяется уравнением: K ср = 3/2 кт.
Что такое одноатомный идеальный газ?
Идеальный газ, состоящий из отдельных атомов . Примеры включают благородные газы аргон, криптон и ксенон.
Являются ли реальные газы одноатомными?
В физике и химии «одноатомный» представляет собой комбинацию слов «моно» и «атомный» и означает « одиночный атом ». … Примеры при стандартных условиях включают благородные газы аргон, криптон и ксенон, хотя все химические элементы будут одноатомными в газовой фазе при достаточно высоких температурах.
… Примеры при стандартных условиях включают благородные газы аргон, криптон и ксенон, хотя все химические элементы будут одноатомными в газовой фазе при достаточно высоких температурах.
11 глава 5 | Газообразное состояние 07 | Реальный газ и идеальный газ IIT JEE/NEET | Коэффициент сжимаемости Z ||
Найдено 43 связанных вопроса
Что такое реальный газ и идеальный газ?
Идеальный газ — это газ, который следует газовым законам при любых условиях температуры и давления. Для этого газ должен полностью подчиняться кинетико-молекулярной теории. … Реальный газ – это газ, который ведет себя не в соответствии с предположениями кинетико-молекулярная теория.
… Реальный газ – это газ, который ведет себя не в соответствии с предположениями кинетико-молекулярная теория.
Какой газ является одноатомным?
Одноатомный газ, газ, состоящий из частиц (молекул), состоящих из отдельных атомов, таких как пары гелия или натрия , и этим отличается от двухатомных, трехатомных или вообще многоатомных газов.
Что такое CV для одноатомного газа?
Молярная удельная теплоемкость газа при постоянном объеме Cv – это количество теплоты, необходимое для повышения температуры 1 моль газа на 1 ◦C при постоянном объеме. Его значение для одноатомного идеального газа равно 9.0644 3R/2 , а значение для двухатомного идеального газа равно 5R/2.
Какой газ является одноатомным при СТП?
( гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn)) существуют в виде одноатомных газов при стандартной температуре и давлении (STP) и называются благородные газы.
Является ли одноатомный газ нереакционноспособным?
Одноатомный газ существует в виде одного атома и не связан друг с другом. Они стабильны при стандартной комнатной температуре. В этих газах нет химической связи. Они очень нереакционноспособны из-за полностью полной внешней валентной оболочки .
Они стабильны при стандартной комнатной температуре. В этих газах нет химической связи. Они очень нереакционноспособны из-за полностью полной внешней валентной оболочки .
Что такое r в нРТ PV?
PV = нРТ. Коэффициент «R» в уравнении закона идеального газа известен как «газовая постоянная ». Р = ПВ. нТл. Давление, умноженное на объем газа, деленное на число молей, и температура газа всегда равна постоянному числу.
Что такое внутренняя энергия идеального газа?
Таким образом, внутренняя энергия идеального газа равна сумме кинетических энергий частиц в газе . Кинетическая молекулярная теория предполагает, что температура газа прямо пропорциональна средней кинетической энергии его частиц, как показано на рисунке ниже.
Как рассчитать одноатомный идеальный газ?
Наиболее точен для одноатомных газов при высоких температурах и низких давлениях. Закон идеального газа имеет вид: PV=nRT , где R — универсальная газовая постоянная, и с ее помощью мы можем найти значения давления P, объема V, температуры T или числа молей n при некотором идеальном термодинамическом условие.
Как узнать, является ли газ идеальным?
Для того, чтобы газ был «идеальным», есть четыре основных предположения:
- Частицы газа имеют незначительный объем.
- Частицы газа имеют одинаковый размер и не имеют межмолекулярных сил (притяжения или отталкивания) с другими частицами газа.
- Частицы газа движутся хаотично в соответствии с законами движения Ньютона.
Каковы 5 предположений об идеальном газе?
Кинетико-молекулярная теория газов предполагает, что молекулы идеального газа (1) постоянно движутся; (2) иметь незначительный объем; (3) обладают незначительными межмолекулярными силами; (4) испытывают абсолютно упругие столкновения; и (5) имеют среднюю кинетическую энергию, пропорциональную абсолютной температуре идеального газа .
Что такое идеальный газовый цикл?
Идеальные циклы — это упрощенные термодинамические замкнутые циклы для анализа процессов сжатия, сгорания и расширения в двигателе с упором на получение работы от сгорания топливно-воздушной смеси.
Является ли азот одноатомным газом?
А. Азот. Термин обычно используется для газов , одноатомный газ — это газ, в котором имеется один атом или атом не связан ни с кем. …
Является ли сера газом на СТП?
Плотность газа:
Учитывая, что газообразный диоксид серы находится в состоянии STP, стандартная температура газа равна 273,15 Кельвина, а стандартное давление равно 1 атм.
Является ли одноатомный газ окрашенным?
Все эти газы имеют сходные свойства при стандартных условиях: все они не имеют запаха, бесцветны, одноатомные газы с очень низкой химической активностью. В природе встречаются шесть благородных газов: гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn).
Что такое CP и CV?
CV и CP — два термина, используемые в термодинамике. CV — удельная теплоемкость при постоянном объеме , а CP — удельная теплоемкость при постоянном давлении. Удельная теплоемкость – это тепловая энергия, необходимая для повышения температуры вещества (на единицу массы) на один градус Цельсия.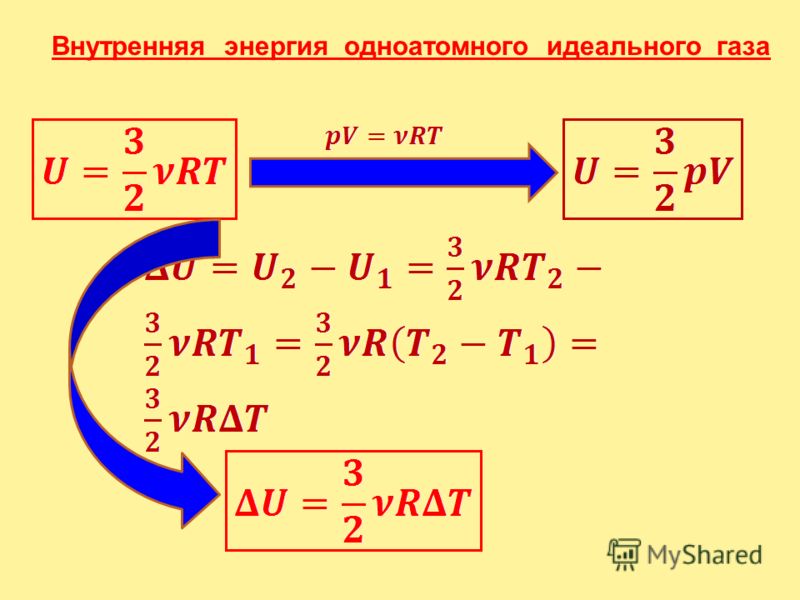
Как рассчитать CV газа?
Объемный расход жидкости можно рассчитать, умножив скорость жидкости на площадь потока . Таким образом, Cv численно равно количеству галлонов США воды при температуре 60°F, которое пройдет через клапан за одну минуту, когда перепад давления на клапане составляет один фунт на квадратный дюйм.
Что больше CP или CV?
cp на больше, чем CV , потому что, когда газ нагревается при постоянном объеме, все подведенное тепло используется только для повышения температуры. Но когда газ нагревается при постоянном давлении, подведенное тепло используется для увеличения как температуры, так и объема газа.
Является ли калий одноатомным?
Калий(1+) представляет собой одноатомный монокатион , полученный из калия. Он играет роль человеческого метаболита и кофактора. Это катион щелочного металла, элементарный калий, одновалентный неорганический катион и одноатомный монокатион.
Является ли двуокись углерода одноатомным газом?
Одноатомные газы :
Нас окружают газы, и два из них очень важны для нашей жизни в виде кислорода и углекислого газа, причем кислород крайне важен.


 09.2013, 18:35
09.2013, 18:35  09.2013, 19:43
09.2013, 19:43  А температура пропорциональна произведению давления на объем.
А температура пропорциональна произведению давления на объем. , ISBN: 978-0-470-03037-0
, ISBN: 978-0-470-03037-0