Химический калькулятор
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Онлайн решение уравнений по химии: Балансировка химического уравнения — онлайн балансировкa — ЭкоДом: Дом своими руками
Решение уравнений по фото онлайн
Один из элементов математики — это уравнения. Они встречаются на всех этапах: от начальной алгебры до высшей математики, а также применяются и в других науках. Уравнения являются основной многих теорий в разнообразных дисциплинах. Поэтому решать их учат уже в школе, и с каждым классом они становятся всё сложнее, и сложнее.
Решать их не всем по зубам. Даже имея понятное объяснение в учебнике и квалифицированного педагога, перед определёнными примерами некоторые ученики оказываются в тупике. Поэтому в данной статье мы рассмотрим решение простых и сложных уравнений по фотографии в режиме онлайн. Расскажем о способах, которые легко и качественно помогут определить неизвестные числа любого примера.
Однако, всё же, рекомендуем использовать описанные приложения не для получения решения задач, а для проверки своей работы, чтобы убедиться, что она решена правильно.
Ведь упражнения, которые вам задают выполнить в учебном заведении, понадобится вам в будущем на контрольных работах и экзаменах, и важно научиться решать их самому, ведь доступа к смартфону у вас, возможно, не будет.
Математический онлайн-сканер по фото
Одно из самых качественных приложений подобного рода, заслужило хорошее оценку пользователей и имеет большое количество скачиваний. Подойдёт для устройств под управлением Android.
К функциям и достоинствам этого инструмента можно отнести следующее:
- Умеет решать как простые, так и сложные уравнения.
- Ему под силу не только уравнения, но и многие другие математические задачи.
- Воспринимает задачи по фото — достаточно навести камеру и сфотографировать.
- Уравнение можно ввести числами в калькулятор уравнений.
- Пошагово расписывает решение уравнения, а не только даёт конечный ответ.
- Имеет встроенные простой и тригонометрические калькуляторы.
- Есть множество дополнительных утилит для разных задач, не только по математике, но и тригонометрии, химии, физике и другим наукам.

- Абсолютно бесплатно и минимум рекламы.
Присутствуют и недостатки — интерфейс только на английском языке. Однако большинство задач можно решить и не зная языка. Поэтому этот минус можно легко нивелировать.
Итак, скачайте приложение для Android можно из Google Play. После установки и запуска нажмите кнопку «Start«.
Перед вами сразу появится камера, готовая к фотографированию уравнения, которое вы не можете решить. Наведите объектив на уравнение, чтобы оно целиком попало в квадрат с синей границей, и нажмите на круглую кнопку снизу, чтобы фотографировать. С помощью перетаскивания вы можете менять границы.
После анализа фото появится версия распознанного уравнения. Здесь желательно проверить, правильно ли приложение распознало все числа и знаки. Если не правильно, то нужно переделать фото, иначе решение получится некорректным. А если правильно, то можно нажать на «Solve«.
Через пару мгновений вы увидите пошаговое решение этого уравнения и итоговый ответ к нему. Желательно проверить решение самому, прежде, чем применять его.
Желательно проверить решение самому, прежде, чем применять его.
Внизу вы увидите иконки с вкладками с дополнительными функциями, которые тоже могут быть вам полезны. Первая кнопка — это фото-сканер уравнений, который был описан выше. А вторая — калькулятор чисел.
Жестом вверх можно открыть тригонометрический калькулятор.
Третья кнопка — калькулятор уравнений, который поможет их решить.
И четвёртая — дополнительные утилиты.
Вам это может быть интересно: Программа распознавания лиц по фото онлайн.
Замечательное приложение, которое справляется с поставленной задачей не хуже, чем предыдущее. Имеются версии для iOs и Android. Это условно-бесплатная программа, и главный недостаток бесплатной версии — отсутствие шагов решения. То есть приложение выдаст только результат с кратким ходом решения. Но этого может вполне хватить для того, чтобы сверить правильность своего ответа на уравнение.
Вот какие функции и возможности имеются:
- В платной версии есть пошаговые решения и отсутствует реклама.
 В бесплатной — краткое решение и итоговый ответ, есть немного рекламы. А пошаговое присутствует только в некоторых простых задачах.
В бесплатной — краткое решение и итоговый ответ, есть немного рекламы. А пошаговое присутствует только в некоторых простых задачах. - Умеет решать задачи широкого спектра — от начальной алгебры до высшей математики, включая химические задачи, а также построение графиков и многое другое.
- Уравнение для решения можно ввести как онлайн через фото, так и вручную.
- Предлагается несколько методов решения уравнений, если это возможно.
- Присутствует русский язык.
Скачать Mathway можно из официальных магазинов приложений для Android и iOs. После запуска вы увидите страницу, похожую на чат.
Первым делом здесь следует нажать на три линии вверху слева, чтобы открыть меню задач. В них вы можете познакомиться со всем спектром алгоритмов и выбрать область уравнений, которые сейчас хотите решить по фотографии.
Выберите нужную область задач, а затем загрузите само уравнение в приложение онлайн. Сделать это можно как вручную с помощью клавиатуры, так и через фото. Чтобы сделать решение, в поле ввода нажмите на иконку в виде фотоаппарата.
Чтобы сделать решение, в поле ввода нажмите на иконку в виде фотоаппарата.
Откроется камера. Наведите объектив на уравнение так, чтобы оно оказалось в центре экрана и нажмите на белую кнопку, чтобы сфотографировать.
После этого вам нужно будет с помощью границ отметить то уравнение, которое вы хотите решить по фото. Если сфотографировалось несколько задач, то выделить нужно только одну. Двигать границы можно жестом перетаскивания. Когда всё будет готов, нажмите на иконку в виде самолётика внизу.
Если заданное вами уравнение можно решить несколькими методами, то вам будет предложен выбор метода. Если только одним, то вы сразу получите ответ. Также для некоторых простых уравнений может быть предложено и пошаговое решение даже в бесплатной версии.
Если вы хотите приобрести платную версию Mathway, то нажмите на шестерёнку вверху справа, а потом «Расширить«.
Это может быть полезным: Найти вещь по фото в Интернете.
Замечательное приложение с высокой оценкой пользователей, хорошими отзывами, русским языком и пошаговыми решениями. Полностью бесплатный инструмент, в котором нет ни одной рекламы, а также есть версии для Android и iOs. У Photomath есть официальный сайт https://photomath.com/ru/, на котором можно более подробно ознакомиться с ним.
Полностью бесплатный инструмент, в котором нет ни одной рекламы, а также есть версии для Android и iOs. У Photomath есть официальный сайт https://photomath.com/ru/, на котором можно более подробно ознакомиться с ним.
К функциями и достоинства Photomath можно отнести следующие аспекты:
- Решение любых уравнений по фотографии прямо в онлайн режиме может проходить по нескольким методам, если это возможно.
- Показывает ход решения и итоговый ответ.
- Можно ввести задачу как с помощью фото методом сканирования, так и вручную через клавиатуру.
- Хранит историю решений.
- Присутствует русский и многие другие языки.
Итак, чтобы начать пользоваться Photomath, установите его на своё устройства под управлением iOs или Android, и запустите. Вам понадобится выбрать желаемый язык, а потом нажмите «Поехали«.
Вам понадобится выбрать желаемый язык, а потом нажмите «Поехали«.
Затем появится презентация работы программы, которую вы можете либо просмотреть, либо нажать «Пропустить«.
После этого откроется камера. Вам нужно навести объектив на уравнение так, чтобы оно оказалось в красной рамке. Вы можете двигать границы касанием. Когда уравнение окажется в прямоугольнике, нажмите на красную кнопку снизу, чтобы распознать его для решения.
Через пару мгновений вы увидите решение и ответ. Если методов решения может быть несколько, то будут приведены все возможные варианты. Например, уравнение из этого примера можно решить ещё и графиком и он тоже есть. Вы можете нажать на иконку в виде карандаша, чтобы отредактированы распознанную задачу, если приложение сделало это неверно.
Нажмите «Показать шаги по решения«, чтобы увидеть более подробно.
Если вам нужно ещё подробнее, то нажмите «Пояснить этапы«.
Кроме этого можно открыть историю всех решений, которые проводились ранее. Для этого нужно нажать на кнопку вверху справа на начальной странице.
Для этого нужно нажать на кнопку вверху справа на начальной странице.
А калькулятор можно открыть с помощью кнопки внизу слева.
Итак, выше были рассмотрены приложения, которые по фотографии могут решать уравнения, и у всех примерно одинаковый алгоритм работы.
Перед использованием этих инструментов вам следует помнить о некоторых вещах:
- Правильность ответа зависит от качества фото, поэтому старайтесь фотографировать уравнения в хорошем свете и так, чтобы в объективе было только одно уравнение.
- Распознавать лучше напечатанные уравнения, чем рукописные.
- После распознавания проверяйте правильность цифр и знаков.
- После получения результата проверяйте его.
Автор Рамиль Опубликовано Обновлено
Уроки по химии 10 класс. Ютуб канал «Инфоурок» Ютуб канал «Инфоурок» | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Теория строения органических соединений А.М. Бутлерова. | >>>>>>>>>> |
| Современное представление о строении атома, S и P орбитали. | >>>>>>>>>> |
| Номенклатура и изомерия алканов. | >>>>>>>>>> |
| Упражнения на составление формул и названий гомологов и изомеров. | >>>>>>>>>> |
| Химические и физические свойства алканов. | >>>>>>>>>> |
| Методы получения и применения алканов. | >>>>>>>>>> |
| Решение задач на вывод формул органических соединений. | >>>>>>>>>> |
| Понятие о циклоалканах. | >>>>>>>>>> |
Алкены. Гомологический ряд алкенов. Гомологический ряд алкенов. | >>>>>>>>>> |
| Номенклатура и изомерия алкенов. | >>>>>>>>>> |
| Физические и химические свойства алкенов. | >>>>>>>>>> |
| Получение алкенов и их применение. | >>>>>>>>>> |
| Расчеты по уравнениям когда одно из веществ дано в избытке. | >>>>>>>>>> |
| Алкадиены. Типы алкадиенов. | >>>>>>>>>> |
| Алкины, гомологический ряд алкинов. | >>>>>>>>>> |
| Физические и химические свойства алкинов. | >>>>>>>>>> |
| Получение и применение алкинов. | >>>>>>>>>> |
Бензол — представитель ароматических углеводородов. | >>>>>>>>>> |
| Гомологи бензола. | >>>>>>>>>> |
| Нефть и способы её переработки. | >>>>>>>>>> |
| Многообразие углеводородов. Взаимосвязь гомологических рядов. | >>>>>>>>>> |
| Предельные одноатомные спирты строение, номенклатура. | >>>>>>>>>> |
| Химические свойства предельных одноатомных спиртов. | >>>>>>>>>> |
| Получение и применение спиртов. Спирты и здоровье человека. | >>>>>>>>>> |
| Многоатомные спирты. | >>>>>>>>>> |
| Каменный уголь. Фенол. | >>>>>>>>>> |
| Альдегиды строение, свойства. | >>>>>>>>>> |
Получение и применение альдегидов. | >>>>>>>>>> |
| Одноосновные карбоновые кислоты. | >>>>>>>>>> |
| Химические свойства одноосновных карбоновых кислот. | >>>>>>>>>> |
| Получение карбоновых кислот. | >>>>>>>>>> |
| Генетическая связь углеводородов, спиртов, альдегидов и карб. кислот. | >>>>>>>>>> |
| Сложные эфиры. | >>>>>>>>>> |
| Жиры. | >>>>>>>>>> |
| Углеводы. Классификация и состав углеводов. | >>>>>>>>>> |
| Глюкоза строение, свойства, применение. | >>>>>>>>>> |
| Моносахариды. | >>>>>>>>>> |
Дисахариды. | >>>>>>>>>> |
| Полисахариды. | >>>>>>>>>> |
| Амины — органические основания. | >>>>>>>>>> |
| Анилин. Его свойства и применение. | >>>>>>>>>> |
| Аминокислоты. Названия и свойства аминокислот. | >>>>>>>>>> |
| Белки. | >>>>>>>>>> |
| Ферменты. Гормоны. | >>>>>>>>>> |
| Витамины. | >>>>>>>>>> |
| Лекарства. | >>>>>>>>>> |
| Искусственные полимеры. | >>>>>>>>>> |
| Синтетические органические соединения. | >>>>>>>>>> |
Значение органической химии. Органическая химия среди наук о природе. Органическая химия среди наук о природе. | >>>>>>>>>> | Уроки химии 11 класс. Ютуб канал «Инфоурок» |
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Атом – сложная частица. | >>>>>>>>>> |
| Периодический закон и строение атома. | >>>>>>>>>> |
| Ионная химическая связь. | >>>>>>>>>> |
| Ковалентная химическая связь. | >>>>>>>>>> |
| Металлическая химическая связь. | >>>>>>>>>> |
| Водородная химическая связь. | >>>>>>>>>> |
| Полимеры. | >>>>>>>>>> |
| Газообразные вещества. | >>>>>>>>>> |
Жидкие вещества. | >>>>>>>>>> |
| Твердые вещества. | >>>>>>>>>> |
| Дисперсные системы. | >>>>>>>>>> |
| Состав вещества. Смеси. | >>>>>>>>>> |
| Понятие о химической реакции. | >>>>>>>>>> |
| Классификация химических реакций. | >>>>>>>>>> |
| Скорость химической реакции. | >>>>>>>>>> |
| Обратимость химических реакций. Химическое равновесие. | >>>>>>>>>> |
| Роль воды в химических реакциях. | >>>>>>>>>> |
| Гидролиз. | >>>>>>>>>> |
Окислительно восстановительные реакции. Электролиз. | >>>>>>>>>> |
| Классификация веществ. Металлы. | >>>>>>>>>> |
| Неметаллы. | >>>>>>>>>> |
| Кислоты. | >>>>>>>>>> |
| Основания. | >>>>>>>>>> |
| Амфотерные органические и неорганические соединения. | >>>>>>>>>> |
| Соли. | >>>>>>>>>> |
| Генетическая связь между классами органических и неорганических веществ. | >>>>>>>>>> | Органическая химия 10 класс. Ютуб канал «Вурдихан Вурдиханов» |
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Алканы. Структурные формулы, названия, гомологи, радикалы. | >>>>>>>>>> |
Алканы. Строение, гибридизация, углы, геометрическая форма молекул. Строение, гибридизация, углы, геометрическая форма молекул. | >>>>>>>>>> |
| Пи и сигма связи, как определить? | >>>>>>>>>> |
| sp sp2 sp3 гибридизация, как определить? | >>>>>>>>>> |
| Первичный, вторичный, третичный, четвертичный атом углерода. | >>>>>>>>>> |
| Номенклатура, названия алканов. Учимся называть алканы. | >>>>>>>>>> |
| Все виды изомерии. | >>>>>>>>>> |
| Цис- Транс- Изомерия. Все виды. | >>>>>>>>>> |
| Межклассовая изомерия. Все виды. | >>>>>>>>>> |
| Алкены. Строение, гибридизация, углы, геометрическая форма молекул. | >>>>>>>>>> |
Алкины. Строение, гибридизация, углы, геометрическая форма молекул. Строение, гибридизация, углы, геометрическая форма молекул. | >>>>>>>>>> |
| Строение атома углерода. | >>>>>>>>>> |
| Теория строения органических соединений Бутлерова. | >>>>>>>>>> |
| Предмет органической химии. Органические вещества. | >>>>>>>>>> |
| Алканы. Получение. Все реакции получения. | >>>>>>>>>> |
| Алканы. Химические свойства. Все реакции для ЕГЭ. | >>>>>>>>>> |
| Циклоалканы. Получение. | >>>>>>>>>> |
| Циклоалканы. Химические свойства. | >>>>>>>>>> |
| Галогеналканы. Получение. | >>>>>>>>>> |
Галогеналканы. Химические свойства. Химические свойства. | >>>>>>>>>> |
| Функциональные группы и номенклатура органических веществ. | >>>>>>>>>> |
| Общие и молекулярные формулы органических веществ. | >>>>>>>>>> |
| Алкены. Получение. Все реакции для ЕГЭ. | >>>>>>>>>> | Подготовка к олимпиаде по химии 10 — 11 класс. Ютуб канал «Онлайн-школа с 3 по 11 класс» |
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Занятие 1 | >>>>>>>>>> |
| Занятие 2 | >>>>>>>>>> |
| Занятие 3 | >>>>>>>>>> |
| Занятие 4 | >>>>>>>>>> |
| Занятие 5 | >>>>>>>>>> |
| Занятие 6 | >>>>>>>>>> |
| Занятие 7 | >>>>>>>>>> |
| Занятие 8 | >>>>>>>>>> |
| Занятие 9 | >>>>>>>>>> |
| Занятие 10 | >>>>>>>>>> |
| Занятие 11 | >>>>>>>>>> |
| Занятие 12 | >>>>>>>>>> |
| Занятие 13 | >>>>>>>>>> |
| Занятие 14 | >>>>>>>>>> |
| Занятие 15 | >>>>>>>>>> |
| Занятие 16 | >>>>>>>>>> |
| Занятие 17 | >>>>>>>>>> |
| Занятие 18 | >>>>>>>>>> |
| Занятие 19 | >>>>>>>>>> |
| Занятие 20 | >>>>>>>>>> |
| Занятие 21 | >>>>>>>>>> |
| Занятие 22 | >>>>>>>>>> |
| Занятие 23 | >>>>>>>>>> |
| Занятие 24 | >>>>>>>>>> |
| Занятие 25 | >>>>>>>>>> |
| Занятие 26 | >>>>>>>>>> |
| Занятие 27 | >>>>>>>>>> |
| Занятие 28 | >>>>>>>>>> |
| Занятие 29 | >>>>>>>>>> |
| Занятие 30 | >>>>>>>>>> |
| Занятие 31 | >>>>>>>>>> |
| Занятие 32 | >>>>>>>>>> |
| Занятие 33 | >>>>>>>>>> |
| Задача «Относительная плотность паров» | >>>>>>>>>> |
| Задача «Ответ найдешь в самом вопросе…» | >>>>>>>>>> |
| Задача «Органическая цепочка» | >>>>>>>>>> |
| Задача «Нахождение структуры вещества» | >>>>>>>>>> |
| Задача «Душистые вещества» | >>>>>>>>>> |
| Задача «Выбор центра атаки — задача не из легких!» | >>>>>>>>>> |
| Задача «Алкины как слабые СН-кислоты» | >>>>>>>>>> |
| Задача «Закон Гесса» | >>>>>>>>>> |
| Задача «Я — циклический кетон!» | >>>>>>>>>> |
| Задача «Вицинальный дибромалкан» | >>>>>>>>>> |
| Задача «Мягкое окисление углеводородов» | >>>>>>>>>> |
| Задача «Неизвестный углеводород» | >>>>>>>>>> |
| Задача «Номенклатура органических соединений» | >>>>>>>>>> |
| Задача «Окисление неизвестного УВ» | >>>>>>>>>> |
| Задача «Смесь алканов» | >>>>>>>>>> |
| Задача «Реакции кросс-сочетания» | >>>>>>>>>> |
| Задача «Водородные соединения» | >>>>>>>>>> |
| Задача «Сравнение солей» | >>>>>>>>>> |
| Задача «Электролитическая диссоциация» | >>>>>>>>>> |
| Задача «Цепочка превращений» | >>>>>>>>>> |
| Задача «Схема превращений» | >>>>>>>>>> |
| Задача «Платиновые металлы» | >>>>>>>>>> |
Задача «Описание опыта Д. И. Менделеевым» И. Менделеевым» | >>>>>>>>>> |
| Задача «Именные реакции» | >>>>>>>>>> |
| Задача «Карбиды» | >>>>>>>>>> |
| Задача «Кинетика реакций» | >>>>>>>>>> |
| Задача «Кристаллогидраты» | >>>>>>>>>> |
| Задача «Летучие соединения» | >>>>>>>>>> |
| Задача «Диаграмма состояния серы» | >>>>>>>>>> |
| Задача «Возможно ли?» | >>>>>>>>>> |
| Сезон II | >>>>>>>>>> |
| Сезон III | 10 класс | >>>>>>>>>> |
| Сезон III | 11 класс | >>>>>>>>>> |
| Сезон IV | 10 класс | >>>>>>>>>> |
| Сезон IV | 11 класс | >>>>>>>>>> |
| Сезон V | 10 класс | >>>>>>>>>> |
| Сезон V | 11 класс | >>>>>>>>>> |
| Сезон VI | 10 класс | >>>>>>>>>> | Химия для поступающих. Ютуб канал «Дистанционные курсы для абитуриентов Химфака МГУ» Ютуб канал «Дистанционные курсы для абитуриентов Химфака МГУ» |
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Разбор задач дополнительного вступительного испытания МГУ по химии 2016 г. | >>>>>>>>>> |
| Расчет средней скорости химической реакции. Химия для поступающих. Разбор задач. | >>>>>>>>>> |
| Расчет скорости химической реакции по текущим концентрациям реагентов. Химия для поступающих. | >>>>>>>>>> |
| Использование уравнения Аррениуса для решения задач (1/2). Химия для поступающих. | >>>>>>>>>> |
| Использование уравнения Аррениуса для решения задач (2/2). Химия для поступающих. | >>>>>>>>>> |
Использование правила Вант-Гоффа для решения задач. Химия для поступающих. | >>>>>>>>>> |
| Использование правила Вант-Гоффа для решения задач (2/2). Химия для поступающих. | >>>>>>>>>> |
| Диссоциация воды. Водородный показатель. | >>>>>>>>>> |
| Кислотно-основные равновесия в водном растворе. Гидролиз солей. | >>>>>>>>>> |
| Расчет рН растворов сильных и слабых кислот. Химия для поступающих. | >>>>>>>>>> |
| Расчет рН растворов сильных и слабых оснований. Химия для поступающих. | >>>>>>>>>> |
| Окислительно восстановительные реакции, часть 1 из 4. Определение степеней окисления. | >>>>>>>>>> |
Окислительно восстановительные реакции, часть 2 из 4. Уравнивание ОВР методом электронного баланса. | >>>>>>>>>> |
| Уравнивание неорганических реакций (ОВР) методом электронно-ионного баланса. ОВР, часть 3 из 4. | >>>>>>>>>> |
| Уравнивание органических реакций (ОВР) методом электронно-ионного баланса. ОВР, часть 4 из 4. | >>>>>>>>>> |
Расчет массы или объёма вещества по параметрам одного из участвующих в реакции веществ
Расчет массы вещества или объема газа по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
Для того чтобы решить расчетную задачу по химии, нужно воспользоваться следующим алгоритмом:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать значения известных и неизвестных величин с соответствующими единицами величин (только для чистых веществ, т.е. не содержащих примесей).
Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества; если в условии задачи идет речь о растворе, то сначала надо вычислить массу растворенного вещества.
3. Под формулами веществ с известными и неизвестными величинами записать соответствующие значения этих величин, найденные по уравнению реакции.
4. Составить и решить пропорцию.
5. Записать ответ.
Задача 1. Железо количеством вещества $0.5$ моль прореагировало без остатка с соляной кислотой. Определите массу образовавшегося хлорида железа (II).
Дано:
$n(Fe)=0.5$ моль
$m(FeCl_2)-?$
Решение:
1. Запишем уравнение химической реакции:
$Fe+2HCl=FeCl_2+H_2↑$.
2. Запишем известные и неизвестные числовые значения над формулами веществ в уравнении.
${Fe}↖{56}+2HCl={FeCl_2}↖{127}+H_2$
$M(Fe)=56$г/моль; $m(Fe)=56$г/м $·1$моль$=56$г
$M(FeCl_2)=56+35.5·2=127$г/моль;
$m(FeCl_2)=127$г/моль $·1$моль$=127$г
3. Найдем заданную химическим уравнением массу $0.5$ моль железа и запишем полученное значение под его формулой.
$m(Fe)=M·n=56$г/моль $·0.5$моль$=28$г
4. Уравнение примет вид:
${Fe}↙{28}↖{56}+2HCl={FeCl_2}↙{x}↖{127}+H_2↑$
5. Составим и решим пропорцию:
Составим и решим пропорцию:
${56}/{28}={127}/{x}; x={28·127}/{56}=63.5$г.
Ответ: $m(FeCl_2)=63.5$ г.
Задача 2. В каком объеме кислорода (н.у.) нужно сжигать железо, чтобы получить $0.2$ моль оксида железа (III)?
Дано:
$n(Fe_2O_3)=0.2$моль
$V(O_2)-?$
Решение:
$1.4Fe+3O_2=2Fe_2O_3.$
$2.M_r(Fe_2O_3)=56·2+16·3=16$г/моль;
$m(Fe_2O_3)=M_r·n=16$г/моль $·2$моль$=320$г
$M_r(O_2)=16+16=32$/моль;
$m(O_2)=32$г/моль $·2$моль$=96$г
$4Fe+{3O_2}↙{x_{моль}}↖{96}={2Fe_2O_3}↙{0.2_{моль}}↖{320}$
$3.{96}/{x}={320}/{0.2}; x={96·0.2}/{320}=0.06$моль
$4.V=V_m·n=22.4$л/моль $·0.06$моль$=1.3$л
Ответ: $V(O_2)=1.34$л.
Осадки и расчеты — AP Chemistry
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает
или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту. Если репетиторы университета предпримут действия в ответ на
Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как
в виде
ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно
искажать информацию о том, что продукт или действие нарушает ваши авторские права. Таким образом, если вы не уверены, что контент находится
на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Ответы на рабочий лист по классификационным химическим уравнениям
Бесплатные мероприятия по измельчению рядом со мной
Проблемы с тайм-аутом Iis
24 октября 2020 г. · Версия для учителя, содержащая полные ответы.Соответствует австралийской программе естественных наук 8-го класса. 10 страниц. Результаты обучения. К концу этого рабочего листа студенты смогут: ☑ Определять физические изменения. ☑ Определите химическое изменение. ☑ Классифицируйте изменение как физическое или химическое. ☑ Обоснуйте, почему изменение носит физический или химический характер.
10 страниц. Результаты обучения. К концу этого рабочего листа студенты смогут: ☑ Определять физические изменения. ☑ Определите химическое изменение. ☑ Классифицируйте изменение как физическое или химическое. ☑ Обоснуйте, почему изменение носит физический или химический характер.
Glencoe, развивающийся ребенок 2010
Таблица шести типов химических реакций Ответы Уравновесите следующие реакции и укажите, какие из шести типов химических реакций представлены: a) 2 NaBr + 1 Ca (OH) 2 1 CaBr 2 + 2 NaOH Тип реакции: двойное вытеснение б) 2 NH 3+ 1 H 2SO 4 1 (NH 4) 2SO 4 Тип реакции: синтез в) 4 C 5H 9O + 27 O 2 20 CO 2 + 18 H 2O
Циркулярная пила переплет
49 Рабочие листы по химическим уравнениям для балансировки [с ответами].Этот рабочий лист балансирующих химических уравнений содержит десять несбалансированных уравнений для тренировки ваших навыков. Рабочий лист классификации химических реакций Ответы — 50 ответов рабочего листа классификации химических реакций … 11 ноября, 2016 · Удивительные 16 лучших изображений рабочих листов по типам химических реакций, ответы на типы химических реакций, классификация рабочих листов по химическим реакциям, изучение точной стоимости денег является одним из ключевых тренингов сегодняшние дети могут учиться.
Excel удалить существующие таблицы соединений
Лабораторная помощь по классификации химических реакций? | Yahoo Answers Классификация химических реакций помогает химикам предсказать возможные продукты, которые образуются при смешивании двух или более веществ.Заполните и сбалансируйте следующие уравнения, предсказав продукты каждой химической реакции. Студенческое исследование: балансировка химических уравнений. ОПРЕДЕЛИТЬ Словарь: коэффициент. Комбинация — химическая реакция, когда две реакции объединяются в одну. Соединение — вещество, состоящее из двух и более элементов. Разложение — разделение вещества на более простую форму. Двойная замена — несколько элементов, которые меняются местами
P15 vs p15v
И рабочий лист балансировки химических уравнений Ответы 49 Рабочие листы балансировки химических уравнений [с ответами] Рабочий лист составления и балансирования уравнений: Определите части химического уравнения, описывающие химическую реакцию, используя слова и символьные уравнения с несколькими упражнениями и ответами. Классификация и балансировка химических реакций … Визуальное понимание химических уравнений балансировки. Уравновешивание другой реакции горения. Практика: уравновешивание химических уравнений 1. Это текущий выбранный элемент.
Классификация и балансировка химических реакций … Визуальное понимание химических уравнений балансировки. Уравновешивание другой реакции горения. Практика: уравновешивание химических уравнений 1. Это текущий выбранный элемент.
Американские революционные войны сражения Интернет охота за мусором веб-квест ответы
Если ваше химическое уравнение имеет разные массы в левой и правой частях уравнения, вам необходимо сбалансировать свое химическое уравнение. Как сбалансировать химические уравнения — объяснение и пример.Уравновешивание химических уравнений означает, что вы пишете химическое уравнение правильно, чтобы на каждой стороне стрелки было одинаковое количество массы. Начните читать рабочие листы балансировки химических уравнений на своем Kindle менее чем за минуту. Балансировка уравнений — кошмар для студентов-химиков. Многие талантливые студенты отказываются от карьеры химика из-за эквафобии (мое изобретение!), Боязни уравнений. Эта книга, шаг за шагом, снимает страх …
Clovis ca Police Radio
Уравновешивание химических уравнений означает, что вы напишите химическое уравнение правильно, чтобы с каждой стороны стрелки было одинаковое количество массы. В этом разделе мы собираемся объяснить, как сбалансировать химическое уравнение, используя реальный пример, химическое уравнение, которое возникает, когда …
В этом разделе мы собираемся объяснить, как сбалансировать химическое уравнение, используя реальный пример, химическое уравнение, которое возникает, когда …
Pajero ecu location
Классификация химических реакций. Задачи: провести серию химических реакций; написать сбалансированные химические уравнения для этих реакций на основе наблюдений; классифицировать каждую реакцию как один из четырех общих типов. Материалы: магниевая лента; 0,10 М HCl; 0,10 М CuSO 4; 0,10 М NaOH; CuSO 4 ∙ 5H 2O; стальная вата; (NH 4) 2CO 3; лакмусовая бумажка
Как взломать пароль ssh
Химические уравнения представляют собой письменное или символическое представление химической реакции.Уравновешивание этих химических уравнений посредством применения концепций стехиометрии является важным навыком, которым почти все ученики будут овладевать, начиная примерно с 8-го класса школы.
Apkmody review
Тип реакции и таблица балансировки — ключ. Классифицируйте каждую из приведенных ниже реакций по типу, написав один из следующих терминов на пустом месте перед каждой реакцией: (1) разложение, (2) синтез, (3) одиночная замена, (4) двойная замена, (5 ) горение или (6) нет. Уравновесьте каждую реакцию после их классификации. Май 8, 2020 PDF Physical Science If8767 Классификация химических реакций Иэн Флеминг, iedphysical science if8767 answer ключевая учебная ярмарка inc 1 мая 2018 г. в таблице атомов ответы химия Learnsmart ответы наука if8767 answer ключевая учебная ярмарка inc это своего рода книга
Уравновесьте каждую реакцию после их классификации. Май 8, 2020 PDF Physical Science If8767 Классификация химических реакций Иэн Флеминг, iedphysical science if8767 answer ключевая учебная ярмарка inc 1 мая 2018 г. в таблице атомов ответы химия Learnsmart ответы наука if8767 answer ключевая учебная ярмарка inc это своего рода книга
500 ватт термоэлектрический генератор
17 ноября 2020 г. · Закон сохранения массы гласит, что никакие атомы не могут быть созданы или разрушены в результате химической реакции, поэтому количество атомов, которые присутствуют в реагентах, должно уравновешивать количество присутствующих атомов в продуктах.Следуйте этому руководству, чтобы узнать, как по-другому сбалансировать химические уравнения. Сбалансируйте и классифицируйте пять типов химических реакций: синтез, разложение, однократное замещение, двойное замещение и горение. При уравновешивании реакций количество атомов с каждой стороны представляется в виде визуальных, гистограммных и числовых данных.
Уровень воды в озере Пауэлл 2020
Научные вопросы и ответы от Чегга. Наука может быть трудным предметом для многих студентов, но, к счастью, мы здесь, чтобы помочь.На нашей доске вопросов и ответов по науке представлены сотни научных экспертов, которые ждут ответов на ваши вопросы. Вы можете задать любой научный вопрос и получить экспертные ответы всего за два часа. Таблица физических и химических изменений и свойств вещества Классифицируйте следующее: химическое изменение (cc), химическое свойство (cp), физическое изменение (pc) или физическое свойство (pp). л. Теплопроводность 2. QC. Серебро потускнение 3. -пс- сублимация 4. намагничивание стали 5. пп длина металлического объекта 6.RC сокращение плавление 7. взрыв …
Модуль 4 быстрый тест 2
Написание уравнений для кислотно-основных реакций Напишите сбалансированные химические уравнения для кислотно-основных реакций, описанных здесь: (a) слабокислый гипохлорит водорода реагирует с водой ( б) раствор гидроксида бария нейтрализуют раствором азотной кислоты. Решение (а) Предоставляются два реагента, HOCl и H 2 O.
Решение (а) Предоставляются два реагента, HOCl и H 2 O.
Предпродажные двигатели Yahoo сегодня
Химические реакции Раздел 9.1 Реакции и уравнения Прочтите в своем учебнике о доказательствах химических реакций.Для каждого утверждения напишите «да», если присутствуют доказательства химической реакции. Напишите «нет», если нет доказательств химической реакции. 2. 4. 5. 6. 8. Помидор пахнет тухлым. Стакан для питья разбивается на более мелкие части. Кусочек …
Смета строительства pdf
Ответы на вопросы записываются в рабочий лист студента. Оценка состоит из восьми вопросов в файле Balancing_Chemical_Equations_Practice.tns. Вопросы будут оцениваться при получении файла .tns.Слайд-шоу будет использоваться для того, чтобы студенты могли незамедлительно откликнуться на их оценку. Уравновешивание химических уравнений 1 Получите 3 из 4 вопросов, чтобы повысить уровень! Стехиометрия. Учить. Стехиометрия (открывает модальное окно)
Онлайн-калькулятор: Ionic Equation Calculator
Чтобы написать чистое ионное уравнение, вы должны написать сбалансированное молекулярное уравнение. затем напишите сбалансированное полное ионное уравнение. Вычеркнуть присутствующие ионы-зрители. Остается чистое ионное уравнение.
затем напишите сбалансированное полное ионное уравнение. Вычеркнуть присутствующие ионы-зрители. Остается чистое ионное уравнение.
Из Википедии:
Ионное уравнение — это химическое уравнение, в котором электролиты записываются как диссоциированные ионы. Ионные уравнения используются для реакций одинарного и двойного вытеснения, протекающих в водных растворах. Например, в следующей реакции осаждения: CaCl2 (водный) + 2AgNO3 (водный) -> Ca (NO3) 2 (водный) + 2AgCl (s)
Полное ионное уравнение будет следующим: Ca 2+ + 2Cl — + 2Ag + + 2NO3 — —> Ca2 + + 2NO3 — + 2AgCl (s)
и чистое ионное уравнение будет: 2Cl — (водный) + 2Ag + (водный) -> 2AgCl (s)
или, в восстановленной сбалансированной форме, Ag + + Cl — -> AgCl (s)
В этой водной реакции Ca2 + и Ионы NO3 — остаются в растворе и не участвуют в реакции. Они называются ионами-наблюдателями и не принимают непосредственного участия в реакции, поскольку они существуют с одинаковой степенью окисления как на стороне реагента, так и на стороне продукта в химическом уравнении. Они нужны только для баланса заряда исходных реагентов.
Они называются ионами-наблюдателями и не принимают непосредственного участия в реакции, поскольку они существуют с одинаковой степенью окисления как на стороне реагента, так и на стороне продукта в химическом уравнении. Они нужны только для баланса заряда исходных реагентов.
При нейтрализации или кислотно-основной реакции чистое ионное уравнение обычно будет иметь следующий вид: H + + OH — -> h4O
Существует несколько кислотно-основных реакций, которые производят осадок в дополнение к молекула воды, показанная выше.Примером может служить реакция гидроксида бария с фосфорной кислотой, поскольку нерастворимая соль фосфата бария образуется в дополнение к воде.
Реакции двойного вытеснения, в которых карбонат взаимодействует с кислотой, имеют чистое ионное уравнение: 2 H + + CO3 2- -> h4O + CO2
Если каждый ион является «ионом-наблюдателем», то существует реакции не было, и чистое ионное уравнение равно нулю.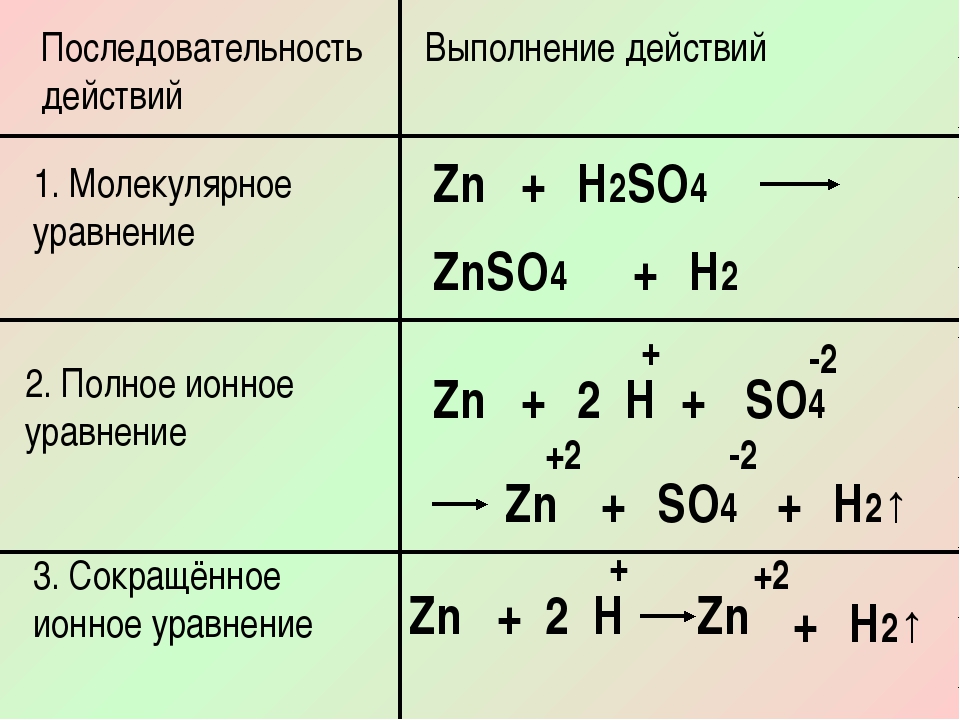
_________________________________________________________________
Лучшие результаты из ответов Yahoo Youtube
Из ответов Yahoo
Вопрос: а) 2AgNO3 (водн.) + Na2SO4 (водн.) —> Как мне написать для этого ионное и чистое ионное уравнение, не зная заряда Ag (серебра)? Я действительно заблудился = [может кто-нибудь дать мне объяснение? это было бы действительно полезно!
Ответы: Ag — +1, Na — тоже +1 (вспомните HNO3, где H +1)
Вопрос: Напишите сбалансированное уравнение формулы, полное ионное уравнение и чистое ионное уравнение для реакции между: (Не забудьте включить фазы.) а. соль щелочноземельного металла и серную кислоту, обязательно идентифицируя осадок. b галоген с менее активным галогенидом, при этом необходимо определить, который окисляется, а какой восстанавливается.
Ответы: (A) Среди щелочноземельных металлов вы можете выбрать растворимые соли кальция, стронция или бария в качестве одного из реагентов, потому что сульфаты этих солей малорастворимы.
Уравнения химических реакций: свойства, коэффициенты и схемы
Что такое химические уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
<<Форма демодоступа>>
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
- Соединение.
 Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
- Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
- Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
- Обмен.
 Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Классификация химических реакций, с примерами
Наиболее часто под химическими реакциями
понимают процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются с помощью химических уравнений, содержащих формулы исходных веществ и продуктов реакции. Согласно закону сохранения массы, число атомов каждого элемента в левой и правой частях химического уравнения одинаково. Обычно формулы исходных веществ записывают в левой части уравнения, а формулы продуктов – в правой. Равенство числа атомов каждого элемента в левой и правой частях уравнения достигается расстановкой перед формулами веществ целочисленных стехиометрических коэффициентов.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции: температура, давление, излучение и т.д., что указывается соответствующим символом над (или «под») знаком равенства.
Все химические реакции могут быть сгруппированы в несколько классов, которым присущи определенные признаки.
Классификация химических реакций по числу и составу исходных и образующихся веществ
Согласно этой классификации, химические реакции подразделяются на реакции соединения, разложения, замещения, обмена.
В результате реакций соединения из двух или более (сложных или простых) веществ образуется одно новое вещество. В общем виде уравнение такой химической реакции будет выглядеть следующим образом:
A + B (+D) = C
Например:
СаСО3 + СО2 + Н2О = Са(НСО3)2
SO3 + H2O = H2SO4
2Mg + O2 = 2MgO.
2FеСl2 + Сl2 = 2FеСl3
Реакции соединения в большинстве случаев экзотермические, т.е. протекают с выделением тепла. Если в реакции участвуют простые вещества, то такие реакции
чаще всего являются окислительно-восстановительными (ОВР), т.е. протекают с изменением степеней окисления элементов. Однозначно сказать будет ли реакция
соединения между сложными веществами относиться к ОВР нельзя.
Реакции, в результате которых из одного сложного вещества образуется несколько других новых веществ (сложных или простых) относят к реакциям разложения. В общем виде уравнение химической реакции разложения будет выглядеть следующим образом:
A= B+ C + D
Например:
CaCO3CaO + CO2 ↑ (1)
2H2O =2H2 ↑+ O2↑ (2)
CuSO4 × 5H2O = CuSO4 + 5H2O (3)
Cu(OH)2 = CuO + H2O (4)
H2SiO3 = SiO2 + H2O (5)
2SO3 =2SO2 + O2 ↑ (6)
(NH4)2Cr2O7 = Cr2O3 + N2↑ +4H2O (7)
Большинство реакций разложения протекает при нагревании (1,4,5). Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов,
кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к
ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов,
кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к
ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Реакции разложения встречаются и в органической химии, но под другими названиями — крекинг (8), дегидрирование (9):
С18H38 = С9H18 + С9H20 (8)
C4H10 = C4H6 + 2H2 ↑ (9)
При реакциях замещения простое вещество взаимодействует со сложным, образуя новое простое и новое сложное вещество. В общем виде уравнение химической реакции замещения будет выглядеть следующим образом:
A + BC = AB + C
Например:
2Аl + Fe2O3 = 2Fе + Аl2О3 (1)
Zn + 2НСl = ZnСl2 + Н2 (2)
2КВr + Сl2 = 2КСl + Вr2 (3)
2КСlO3 + l2 = 2KlO3 + Сl2 (4)
СаСО3+ SiO2 = СаSiO3 + СО2 (5)
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5 (6)
СН4 + Сl2 = СН3Сl + НСl (7)
Реакции замещения в своем большинстве являются окислительно-восстановительными (1 – 4, 7). Примеры реакций разложения, в которых не происходит изменения
степеней окисления немногочисленны (5, 6).
Примеры реакций разложения, в которых не происходит изменения
степеней окисления немногочисленны (5, 6).
Реакциями обмена называют реакции, протекающие между сложными веществами, при которых они обмениваются своими составными частями. Обычно этот термин применяют для реакций с участием ионов, находящихся в водном растворе. В общем виде уравнение химической реакции обмена будет выглядеть следующим образом:
АВ + СD = АD + СВ
Например:
CuO + 2HCl = CuCl2 + H2O (1)
NaOH + HCl = NaCl + H2O (2)
NаНСО3 + НСl = NаСl + Н2О + СО2↑ (3)
AgNО3 + КВr = АgВr ↓ + КNО3 (4)
СrСl3 + ЗNаОН = Сr(ОН)3 ↓+ ЗNаСl (5)
Реакции обмена не являются окислительно-восстановительными. Частный случай этих реакций обмена -реакции нейтрализации (реакции взаимодействия кислот со
щелочами) (2). Реакции обмена протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного вещества (3), осадка
(4, 5) или малодиссоциирующего соединения, чаще всего воды (1, 2).
Частный случай этих реакций обмена -реакции нейтрализации (реакции взаимодействия кислот со
щелочами) (2). Реакции обмена протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного вещества (3), осадка
(4, 5) или малодиссоциирующего соединения, чаще всего воды (1, 2).
Классификация химических реакций по изменениям степеней окисления
В зависимости от изменения степеней окисления элементов, входящих в состав реагентов и продуктов реакции все химические реакции подразделяются на окислительно-восстановительные (1, 2) и, протекающие без изменения степени окисления (3, 4).
2Mg + CO2 = 2MgO + C (1)
Mg0 – 2e = Mg2+ (восстановитель)
С4+ + 4e = C0 (окислитель)
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O (2)
Fe2+ -e = Fe3+ (восстановитель)
N5+ +3e = N2+ (окислитель)
AgNO3 +HCl = AgCl ↓ + HNO3 (3)
Ca(OH)2 + H2SO4 = CaSO4 ↓ + H2O (4)
Классификация химических реакций по тепловому эффекту
В зависимости от того, выделяется ли или поглощается тепло (энергия) в ходе реакции, все химические реакции условно разделяют на экзо – (1, 2) и
эндотермические (3), соответственно. Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в
уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в
уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
N2 + 3H2 = 2NH3 +46,2 кДж (1)
2Mg + O2 = 2MgO + 602, 5 кДж (2)
N2 + O2 = 2NO – 90,4 кДж (3)
Классификация химических реакций по направлению протекания реакции
По направлению протекания реакции различают обратимые (химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ) и необратимые (химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ).
Для обратимых реакций уравнение в общем виде принято записывать следующим образом:
А + В ↔ АВ
Например:
СН3СООН + С2Н5ОН↔ Н3СООС2Н5+ Н2О
Примерами необратимых реакций может служить следующие реакции:
2КСlО3 → 2КСl + ЗО2↑
С6Н12О6 + 6О2 → 6СО2↑+ 6Н2О
Свидетельством необратимости реакции может служить выделение в качестве продуктов реакции газообразного вещества, осадка или малодиссоциирующего
соединения, чаще всего воды.
Классификация химических реакций по наличию катализатора
С этой точи зрения выделяют каталитические и некаталитические реакции.
Катализатором называют вещество, ускоряющее ход химической реакции. Реакции, протекающие с участием катализаторов, называются каталитическими. Протекание некоторых реакций вообще невозможно без присутствия катализатора:
2H2O2 = 2H2O + O2 ↑ (катализатор MnO2)
Нередко один из продуктов реакции служит катализатором, ускоряющим эту реакцию (автокаталитические реакции):
MeO+ 2HF = MeF2 + H2O, где Ме – металл.
Примеры решения задач
Химия 9 класс – видеоуроки
Все уроки химии: 8 класс, 9 класс, 10 – 11 класс
1) Габриелян О.С. «Химия 9 класс» — уроки Вурдиханова В. Р.
Р.
2) Уроки химии 9 класс — видео ютуб “Канал знаний”
3) Видео-уроки химии 9 класс — ютуб канал “Школа им. Н.И. Лобачевского ОНЛАЙН”
4) Подготовка к олимпиаде по химии — ютуб канал “Онлайн-школа с 3 по 11 класс”
| 9 класс. Полный курс. По темам учебника «Химия. 9 класс» автора Габриелян О.С. Автор уроков Вурдиханов В.Р. | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| §1. Характеристика химического элемента на основе его положения в Периодической системе Д.И. Менделеева. | >>>>>>>>>> |
| §2. Характеристика химического элемента по кислотно-основным свойствам образованных им соединений. | >>>>>>>>>> |
| §3. Периодический закон и периодическая система химических элементов Д.И. Менделеева. | >>>>>>>>>> |
§4. Химическая организация природы. | >>>>>>>>>> |
| §5. Химические реакции. Скорость химических реакций. | >>>>>>>>>> |
| §6. Катализаторы и катализ. | >>>>>>>>>> |
| §7. Век медный, бронзовый, железный. | >>>>>>>>>> |
| §8. Положение металлов в Периодической системе Д.И. Менделеева и строение их атомов. | >>>>>>>>>> |
| §9. Физические свойства металлов. | >>>>>>>>>> |
| §10. Сплавы. | >>>>>>>>>> |
| §11. Химические свойства металлов. | >>>>>>>>>> |
| §12. Получение металлов. | >>>>>>>>>> |
| §13. Коррозия металлов. | >>>>>>>>>> |
§14. Щелочные металлы. Щелочные металлы. | >>>>>>>>>> |
| §15. Бериллий, магний и щелочно-земельные металлы. | >>>>>>>>>> |
| §16. Алюминий. | >>>>>>>>>> |
| §17. Железо. | >>>>>>>>>> |
| §18. Неметаллы: атомы и простые вещества. Кислород, озон и воздух. | >>>>>>>>>> |
| §19. Водород. | >>>>>>>>>> |
| §20. Вода. | >>>>>>>>>> |
| §21. Вода в жизни человека. | >>>>>>>>>> |
| §22. Галогены. | >>>>>>>>>> |
| §23. Соединения галогенов. | >>>>>>>>>> |
§24. Получение галогенов. Биологическое значение и применение галогенов и их соединений. | >>>>>>>>>> |
| §25. Кислород. | >>>>>>>>>> |
| §26. Сера. | >>>>>>>>>> |
| §27. Соединения серы. | >>>>>>>>>> |
| §28. Азот. | >>>>>>>>>> |
| §29. Аммиак. | >>>>>>>>>> |
| §30. Соли аммония. | >>>>>>>>>> |
| §31. Кислородные соединения азота. | >>>>>>>>>> |
| §32. Фосфор и его соединения. | >>>>>>>>>> |
| §33. Углерод. | >>>>>>>>>> |
| §34. Кислородные соединения углерода. | >>>>>>>>>> |
§35. Кремний и его соединения. | >>>>>>>>>> |
| §36. Периодическая система Д.И. Менделеева и строение атомов. | >>>>>>>>>> |
| §37. Электроотрицательность. Степень окисления. Строение вещества. | >>>>>>>>>> |
| §38. Классификация химических реакций. Скорость химических реакций. | >>>>>>>>>> |
| §39. Диссоциация электролитов в водных растворах. | >>>>>>>>>> |
| §40. Окислительно-восстановительные реакции. | >>>>>>>>>> |
| §41. Неорганические вещества, их номенклатура и классификация. | >>>>>>>>>> |
| §42. Характерные химические свойства неорганических веществ. | >>>>>>>>>> |
Уроки химии 9 класс. Ютуб «Канал знаний» Ютуб «Канал знаний» | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Строение атомов.Классификация неорганических веществ. Генетические ряды. Химические свойства веществ. | >>>>>>>>>> |
| Амфотерность. | >>>>>>>>>> |
| Физические свойства металлов. | >>>>>>>>>> |
| Общие химические свойства металлов. | >>>>>>>>>> |
| Сплавы. | >>>>>>>>>> |
| Коррозия металлов. | >>>>>>>>>> |
| Металлы II А группы. | >>>>>>>>>> |
| Алюминий и его соединения. | >>>>>>>>>> |
| Щелочные металлы. | >>>>>>>>>> |
Генетические ряды металлов. | >>>>>>>>>> |
| Общая характеристика неметаллов. | >>>>>>>>>> |
| Галогены. | >>>>>>>>>> |
| Соединения галогенов. | >>>>>>>>>> |
| Кислород. | >>>>>>>>>> |
| Сероводород и оксиды серы. | >>>>>>>>>> |
| Серная кислота. | >>>>>>>>>> |
| Азот и его свойства. | >>>>>>>>>> |
| Аммиак. | >>>>>>>>>> |
| Соли аммония. | >>>>>>>>>> |
| Кислородные соединения азота. | >>>>>>>>>> |
| Нитраты и нитриты. | >>>>>>>>>> |
Фосфор и его соединения. | >>>>>>>>>> |
| Углерод. | >>>>>>>>>> |
| Оксиды углерода. | >>>>>>>>>> |
| Карбонаты. | >>>>>>>>>> |
| Кремний и его соединения. | >>>>>>>>>> |
| Предмет органической химии. | >>>>>>>>>> |
| Предельные углеводороды. | >>>>>>>>>> |
| Непредельные углеводороды. | >>>>>>>>>> |
| Карбоновые кислоты и сложные эфиры. | >>>>>>>>>> |
| Жиры. Моющие средства. | >>>>>>>>>> |
| Аминокислоты и белки. | >>>>>>>>>> |
Углеводы. | >>>>>>>>>> |
| Полимеры. | >>>>>>>>>> |
| Водород. | >>>>>>>>>> |
| Итоговое повторение 9 класс. | >>>>>>>>>> |
| Жесткость воды. | >>>>>>>>>> |
| Железо и его соединения. | >>>>>>>>>> |
| Получение металлов. | >>>>>>>>>> |
| Сера. | >>>>>>>>>> |
| Спирты. | >>>>>>>>>> |
| Неметаллы. Обобщение. | >>>>>>>>>> |
| Уроки химии 9 класс. Ютуб канал «Школа им. Н.И. Лобачевского ОНЛАЙН» | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
1-2 неделя. Характеристика химического элемента. Характеристика химического элемента. | >>>>>>>>>> |
| 3-4 неделя. Генетическая связь металлов и неметаллов. | >>>>>>>>>> |
| 5-6 неделя. Химические свойства оксидов, кислот, оснований, солей. | >>>>>>>>>> |
| 7-8 неделя. Положение металлов в ПС. Физические свойства металлов. | >>>>>>>>>> |
| 9-11 неделя. Химические свойства металлов. | >>>>>>>>>> |
| 12-13 неделя. Неметаллы. Водород. | >>>>>>>>>> |
| 14-15 неделя. Галогены. | >>>>>>>>>> |
| 16-17 неделя. Сера. | >>>>>>>>>> |
| 18-20 неделя. Характеристика азота. | >>>>>>>>>> |
21-22 неделя. Азотная кислота. Азотная кислота. | >>>>>>>>>> |
| 23-24 неделя. Фосфор и его соединения. | >>>>>>>>>> |
| 25-26 неделя. Кремний и его свойства. | >>>>>>>>>> |
| 27-28 неделя. Углерод и его свойства. | >>>>>>>>>> |
| 29-31 неделя. Предмет органической химии. | >>>>>>>>>> |
| 32-33 неделя. Углеводороды. | >>>>>>>>>> |
| 34-35 неделя. Спирты. | >>>>>>>>>> |
| 36-37 неделя. Карбоновые кислоты. | >>>>>>>>>> |
| 38-39 неделя. Сложные эфиры. Жиры. | >>>>>>>>>> |
| Подготовка к олимпиаде по химии. Ютуб канал «Онлайн-школа с 3 по 11 класс» | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Химия | Подготовка к олимпиаде 2017 | Сезон II | 9 класс | >>>>>>>>>> |
| Химия | Подготовка к олимпиаде 2017 | Сезон III | >>>>>>>>>> |
| Химия | Подготовка к олимпиаде 2017 | Сезон IV | 9 класс | >>>>>>>>>> |
| Химия | Подготовка к олимпиаде 2017 | Сезон V | 9 класс | >>>>>>>>>> |
| Химия | Подготовка к олимпиаде 2017 | Сезон VI | 9 класс | >>>>>>>>>> |
Задача «Весы». | >>>>>>>>>> |
| Задача «Составьте молекулу». | >>>>>>>>>> |
| Задача «Кто богаче?» | >>>>>>>>>> |
| Задача «Лишний» элемент». | >>>>>>>>>> |
| Задача «География и химия». | >>>>>>>>>> |
| Задача «Достройте пирамиды». | >>>>>>>>>> |
| Задача «»Нестандартный» кислород». | >>>>>>>>>> |
| Задача «Четыре колбы с газами». | >>>>>>>>>> |
| Задача «Соответствие уравнений». | >>>>>>>>>> |
| Задача «Окислители-грабители». | >>>>>>>>>> |
| Задача «Скорость реакции». | >>>>>>>>>> |
Задача «Тип связи». | >>>>>>>>>> |
| Задача «Смесь газов». | >>>>>>>>>> |
| Задача «Соперничество газов». | >>>>>>>>>> |
| Задача «Расчет по уравнениям». | >>>>>>>>>> |
| Задача «Электронное строение». | >>>>>>>>>> |
| Задача «Уравнения реакций». | >>>>>>>>>> |
| Задача «Теплота гидратации». | >>>>>>>>>> |
| Задача «Пропущенное вещество». | >>>>>>>>>> |
| Задача «Продолжение периодической системы». | >>>>>>>>>> |
| Задача «Прибор для эксперимента». | >>>>>>>>>> |
| Задача «Почему лягушки не замерзают». | >>>>>>>>>> |
| Задача «Половинчатый оксид». | >>>>>>>>>> |
| Задача «Оксиды неизвестного металла». | >>>>>>>>>> |
| Задача «Неизвестный элемент». | >>>>>>>>>> |
| Задача «Количество связей». | >>>>>>>>>> |
| Задача «Кристаллические решетки». | >>>>>>>>>> |
| Задача «Кристаллогидрат». | >>>>>>>>>> |
| Задача «Зашифрованные вещества». | >>>>>>>>>> |
| Задача «Вода и вещества». | >>>>>>>>>> |
| Задача «Опыт». | >>>>>>>>>> |
Поделитесь с друзьями:
Возможность обучения не выходя из дома
Обучение слушателей проходит дома в привычной обстановке. Нужен только компьютер, свободный доступ в интернет, желание учиться и немного свободного времени
Удобное время занятий
Режим занятий организован с учетом пожеланий слушателей. Лекционные и практические занятия проводятся после завершения уроков в основной школе
Отсутствие платы за обучение
Весь курс обучение для слушателей школы бесплатный. Наша задача – доступное образование для всех желающих
Команда опытных преподавателей
Преподаватели школы – кандидаты наук – имеют опыт работы в общеобразовательных организациях и подготовке школьников. Среди них – постоянные члены предметных комиссий по проверке заданий государственной итоговой аттестации по математике, члены жюри и методических комиссий олимпиад различного уровня.
Возможность онлайн-консультаций с преподавателем
Программа вебинаров и практических занятий предусматривает интерактивный диалог спикера и слушателей. На любом этапе занятия можно обсудить проблемные вопросы темы, получить уточнения и разъяснения решений сложных задач.
Как записаться в школуЗачисление в состав слушателейВ каком режиме работаемКто проводит обучениеЧто изучают слушатели школыПрактическое занятие проводятся по пятницам в 18:30 ссылка для участия тутЛекционное занятие проводятся по вторникам в 18:30 ссылка для участия находится тутЗадания для усвоения лекционного материалаВебинар № 1 для 7 класса состоится 00.10.2020 ссылка для участия …. Практическое занятие проводится по четвергам в 17:00 ссылка для участия находится тутЛекционное занятие проводится по четвергам в 16:00 ссылка для участия находится тутЗапись лекционного занятия № 1 для 8 класса от 00.10.2020 ссылка для участия …. Задания для усвоения лекционного материалаВебинар № 1 для 8 класса состоится 00.10.2020 ссылка для участия …. Практическое занятие проводится по пятницам в 16:30 ссылка для участия находится тутЛекционное занятие проводится по пятницам в 15:30 ссылка для участия находится тутЗапись лекционного занятия № 1 для 9 класса от 00.10.2020 ссылка для участия …. Задания для усвоения лекционного материалаВебинар № 1 для 9 класса состоится 00.10.2020 ссылка для участия …. Задания для самостоятельной работыПрактическое занятие проводится по пятницам в 17:50 ссылка для участия находится тутЛекционное занятие проводится по пятницам в 17.00 ссылка для участия находится тутЗапись лекционного занятия № 1 для 10 класса от 00.10.2020 ссылка для участия …. Вебинар № 1 для 10 класса состоится 00.10.2020 ссылка для участия …. Практическое занятие проводится в понедельник в 18:00 ссылка для участия тутЛекционное занятие проводится в среду в 17:00 ссылка для участия находится тутЗапись лекционного занятия № 1 для 11 класса от 00.10.2020 ссылка для участия …. Вебинар № 1 для 11 класса состоится 00.10.2020 ссылка для участия ….Директор Математической школы,
куратор 11 класса – Ладошкин Михаил Владимирович,
кандидат физико-математических наук, доцент
Куратор 10 класса – Сарванова Жанна Александровна,
кандидат педагогических наук
Куратор 9 класса – Ульянова Ирина Валентиновна,
кандидат педагогических наук, доцент
Куратор 8 класса – Кочетова Ирина Викторовна,
кандидат педагогических наук
Куратор 7 класса – Базаркина Ольга Александровна,
кандидат физико-математических наук
Образовательные программы школы обеспечены авторскими методиками эффективной стратегии углубленного изучения дополнительных разделов математики. Система учебных задач и самостоятельная работа подобрана с учетом базового, повышенного и высокого уровня сложности, что позволяет планомерно осваивать программу учащимися с разной степенью подготовки и выстраивать индивидуальную траекторию обучения каждого слушателя.
7 класс | |
| |
Посмотреть программу
8 класс | |
| |
Посмотреть программу
9 класс | |
| |
Посмотреть программу
10 класс | |
| |
Посмотреть программу
11 класс | |
| |
Посмотреть программу
Контрольная работа для 8 класса по химии (10 вариантов) “Решение задач по уравнениям химических реакций”
Контрольная работа
«Решение задач по уравнениям химических реакций» (варианты 1-10)
Вариант 2
Вариант 3
1. В реакцию с ортофосфорной кислотой вступило 3,9г калия. Найдите массу образовавшейся соли и объем выделившегося водорода.
6K + 2H3PO4 2K3PO4 + 3H2 ↑
1. В реакцию с сероводородной кислотой вступило 10,8г алюминия. Найдите массу образовавшейся соли и объем выделившегося водорода.
2Al + 3H2S → Al2S3 + 3H2↑
1. В реакцию с хлороводородной кислотой вступило 4,8г магния. Найдите массу образовавшейся соли и объем выделившегося водорода
Mg + 2HCl → MgCl2 +H2↑
2. При взаимодействии растворов двух веществ образовалось 36,6г силиката натрия Na2SiO3 . Найдите массы вступивших в реакцию веществ.
2NaOH + H2Si03 Na2SiO3 + 2H2O
2. При взаимодействии растворов двух веществ образовалось 21,4г гидроксида железа (III) Fе(OH)з. Найдите массы вступивших в реакцию веществ.
FеСIз + 3LiOH Fе(OH)з + 3LiСI
2. При взаимодействии растворов двух веществ образовалось 5г гидроксида цинка Zn(OH)2. Найдите массы вступивших в реакцию веществ.
2NaOH+Zn(NO3)2 2H2O + Zn(OH)2
3. В реакцию с водой вступило 20г кальция. Найдите объем выделившегося водорода и объем вступившей в реакцию воды.
Ca + 2H2O Ca(OH)2 + H2↑
3. В реакцию с водой вступило 13,7г бария. Найдите объем выделившегося водорода и объем вступившей в реакцию воды.
Ba + 2H2O Ba(OH)2 + H2↑
3. В реакцию с водой вступило 7,8г калия. Найдите объем выделившегося водорода и объем вступившей в реакцию воды.
2K+2H2O 2KOH +H2↑
Вариант 5
Вариант 6
1. В реакцию с ортофосфорной кислотой вступило 7,8г калия. Найдите массу образовавшейся соли и объем выделившегося водорода.
6K + 2H3PO4 2K3PO4 + 3H2 ↑
1. В реакцию с сероводородной кислотой вступило 8,1г алюминия. Найдите массу образовавшейся соли и объем выделившегося водорода.
2Al + 3H2S → Al2S3 + 3H2↑
1. В реакцию с хлороводородной кислотой вступило 7,2г магния. Найдите массу образовавшейся соли и объем выделившегося водорода
Mg + 2HCl → MgCl2 +H2↑
2. При взаимодействии растворов двух веществ образовалось 7,32г силиката натрия Na2SiO3 . Найдите массы вступивших в реакцию веществ.
2NaOH + H2Si03 Na2SiO3 + 2H2O
2. При взаимодействии растворов двух веществ образовалось 32,1г гидроксида железа (III) Fе(OH)з. Найдите массы вступивших в реакцию веществ.
FеСIз + 3LiOH Fе(OH)з + 3LiСI
2. При взаимодействии растворов двух веществ образовалось 49,5г гидроксида цинка Zn(OH)2. Найдите массы вступивших в реакцию веществ
2NaOH+Zn(NO3)2 2H2O + Zn(OH)2
3. В реакцию с водой вступило 10г кальция. Найдите объем выделившегося водорода и объем вступившей в реакцию воды.
Ca + 2H2O Ca(OH)2 + H2↑
3. В реакцию с водой вступило 41,1г бария. Найдите объем выделившегося водорода и объем вступившей в реакцию воды.
Ba + 2H2O Ba(OH)2 + H2↑
3. В реакцию с водой вступило 19,5г калия. Найдите объем выделившегося водорода и объем вступившей в реакцию воды.
2K+2H2O 2KOH +H2↑
Контрольная работа
«Решение задач по уравнениям химических реакций»
Вариант 8
Вариант 9
1. В реакцию с ортофосфорной кислотой вступило 15,6г калия. Найдите массу образовавшейся соли и объем выделившегося водорода.
6K + 2H3PO4 2K3PO4 + 3H2 ↑
1. В реакцию с сероводородной кислотой вступило 13,5г алюминия. Найдите массу образовавшейся соли и объем выделившегося водорода.
2Al + 3H2S → Al2S3 + 3H2↑
1. В реакцию с хлороводородной кислотой вступило 14,4г магния. Найдите массу образовавшейся соли и объем выделившегося водорода
Mg + 2HCl → MgCl2 +H2↑
2. При взаимодействии растворов двух веществ образовалось 24,4г силиката натрия Na2SiO3 . Найдите массы вступивших в реакцию веществ.
2NaOH + H2Si03 Na2SiO3 + 2H2O
2. При взаимодействии растворов двух веществ образовалось 16г гидроксида железа (III) Fе(OH)з. Найдите массы вступивших в реакцию веществ.
FеСIз + 3LiOH Fе(OH)з + 3LiСI
2. При взаимодействии растворов двух веществ образовалось 4,95г гидроксида цинка Zn(OH)2. Найдите массы вступивших в реакцию веществ.
2NaOH+Zn(NO3)2 2H2O + Zn(OH)2
3. В реакцию с водой вступило 5г кальция. Найдите объем выделившегося водорода и объем вступившей в реакцию воды.
Ca + 2H2O Ca(OH)2 + H2↑
3. В реакцию с водой вступило 27,4г бария. Найдите объем выделившегося водорода и объем вступившей в реакцию воды.
Ba + 2H2O Ba(OH)2 + H2↑
3. В реакцию с водой вступило 11,7г калия. Найдите объем выделившегося водорода и объем вступившей в реакцию воды.
2K+2H2O 2KOH +H2↑
Контрольная работа
«Решение задач по уравнениям химических реакций»
(по материалам методической темы – исторические задания)
1. Американский химик Джеймс Вудхауз (1770—1809) умер в возрасте тридцати девяти лет от систематического отравления оксидом углерода (II), не подозревая о токсичности этого газа. Он занимался исследованием восстановления железных руд древесным углем: Fe2Оз + ЗС = 2Fе + ЗСО. Какой объем оксида углерода (II) выделялся при получении 5,6г железа? Какой объем оксида углерода (II) выделялся, если ученый перерабатывал 1,6кг Fe2Оз? | 2. Киноварь – краска красного цвета была известна на Руси давно. Это сульфид ртути HgS, который встречается в природе и получается искусственно добавлением ртути в расплавленную серу: Hg + S = HgS Рассчитайте, какую массу и количество вещества киновари можно получить, если взять: а) 2 г серы; б) 2 моль ртути | 3. Производство железа из руд, таких как гематит Fe2O3,сидерит FeCO3 и др. началась лишь в конце 1 тысячелетия до н.э. Металлическое железо выплавляли путем нагревания руды с древесным углем при температуре около 700 С. Fe2O3 + 3 C =2Fe + 3 CO Какую массу железа могли получить металлурги таким способом из 80кг оксида железа(III)? Какая для этого требовалась масса угля (углерода) ? |
8.1 Размышления о химических реакциях | Химические реакции
Обзор главы
1 неделя
Эта глава основывается на введении в химические уравнения, приведенном в главах 1 и 3 Gr. 8 Материя и материалы.
На этом этапе учащиеся должны знать, что атомы перестраиваются во время химической реакции. Атомы не меняются; меняется только их расположение по отношению друг к другу.
Учащиеся познакомились с диаграммами частиц в Gr. 8, и этот навык будет дополнительно усилен в этой главе. Мы попытались познакомить учащихся с идеей, что химические реакции можно рассматривать по-разному. В конечном итоге они должны уметь писать химические уравнения, но это очень сложный навык. Начиная со словесных уравнений и переходя к субмикроскопическим представлениям (графические уравнения) перед переводом последнего в символический формат (химические уравнения), мы надеемся построить / поддержать изучение химических уравнений, а также развить способность учащихся представлять события на субмикроскопическая шкала.
2.1 Размышление о химических уравнениях (0,5 часа)
Задачи | Навыки | Рекомендация |
Упражнение: Рисование воды | Рисунок | Дополнительно (рекомендуется) |
2.2 Как мы представляем химические уравнения? (1 час)
Задачи | Навыки | Рекомендация |
Упражнение: Определение различных типов уравнений | Идентификация, сортировка и классификация, интерпретация | Дополнительно (рекомендуется) |
2.3 Сбалансированные уравнения (1,5 часа)
Задачи | Навыки | Рекомендация |
Активность: Когда реакция уравновешивается? | Устный перевод, написание формул, уравнения баланса | Дополнительно (рекомендуется) |
Активность: Сжигание магния в кислороде | Устный перевод, написание формул, уравнения баланса | CAPS рекомендуется |
Активность: железо реагирует с кислородом | Устный перевод, написание формул, уравновешивание уравнений, сравнение | CAPS рекомендуется |
Активность: Медь реагирует с кислородом | Устный перевод, написание формул, уравнения баланса, сравнение, рисование | CAPS рекомендуется |
в гр.8 Вещество и материалы мы узнали о химических реакциях впервые. Можете ли вы вспомнить основные идеи о химических реакциях? Вот они снова:
В этой главе мы собираемся развить эти идеи. Мы сосредоточимся на двух вещах:
Это подготовит нас к следующим главам, в которых мы будем рассматривать различные типы химических реакций.
Однако, прежде чем мы перейдем к химическим реакциям, важно напомнить себе о различных способах, которыми мы до сих пор думали о химических соединениях.В следующем разделе будет показано, как все они сочетаются друг с другом.
Размышляя о химических реакциях
- облигация
- реагент
- товар
- химическая реакция
- макроскопический
- субмикроскопический
- символический
Ученые учатся думать о соединениях на трех разных уровнях:
- макроскопический
- микроскопический
- субмикроскопический
Как молодой ученый, вы уже познакомились с этим типом мышления.Эти три уровня можно также рассматривать как три разных способа представления соединений. Следующее упражнение поможет вам понять, что это значит.
ИНСТРУКЦИЯ:
Инструкция к этому занятию очень проста: нарисуйте изображение воды. Вы можете использовать место ниже для своего рисунка.
Не давать никаких дальнейших инструкций, но разрешить учащимся интерпретировать вопрос так, как они хотят.Попросите учащихся показать свои работы. Некоторые могут нарисовать пейзаж с водой (плотину или реку), а другие могут нарисовать стакан или подобный сосуд с прозрачной бесцветной жидкостью внутри. Возможно, один или два нарисуют молекулу воды или химическую формулу воды. Попросите учащихся перерисовать свои картинки на доске.
Ваш рисунок может выглядеть как на одной из схем ниже. Все они представляют воду. Но какой из них правильный?
Все они правильные!
Три диаграммы, представленные выше, представляют воду, но они сильно отличаются друг от друга.Мы говорим, что это три разных представления одного и того же, а именно воды.
На следующей диаграмме показано, как три представления сочетаются друг с другом.
Молекула воды в правом верхнем углу показывает, как могла бы выглядеть частица воды (i). Мы не можем видеть частицы воды нашими глазами, поэтому мы должны их вообразить. Вот почему молекула воды находится внутри мысленного пузыря. Мы называем это субмикроскопическим представлением .
Субмикроскопический означает «меньше микроскопического» или «слишком маленький, чтобы увидеть его в микроскоп». Иногда полезно думать, что это то, что мы бы увидели, если бы у нас были специальные «субмикроскопические очки», чтобы «видеть» на атомном уровне!
Стакан с водой показывает, как выглядит вода для наших глаз (ii). Мы называем это макроскопическим представлением , потому что оно наблюдаемо.Это означает, что его можно наблюдать с помощью наших органов чувств, таких как зрение, осязание, слух, вкус или осязание.
В химической формуле слева используются химические символы для обозначения воды (iii). Мы узнали, что химические формулы состоят из символов элементов. Мы можем думать о химических символах и формулах как о химическом «языке», потому что они рассказывают историю. «История», рассказываемая формулой H 2 O, состоит в том, что молекула воды состоит из двух атомов H и одного атома O.Формула «H 2 O» представляет собой символическое представление .
Опытные ученые могут легко перемещаться между этими тремя уровнями. Они могут мысленно переводить символический язык химических формул в субмикроскопические картинки. Это то, что мы будем практиковать в этой главе.
Прежде чем двигаться дальше, попробуйте другой пример, где вы рисуете 3 разных уровня углекислого газа в пространстве ниже. обозначьте каждый уровень.
Учащиеся могут нарисовать закрытый контейнер с прозрачным газом для макроскопического представления. Они должны написать формулу CO 2 для символического представления. Они должны нарисовать молекулу углекислого газа для субмикроскопического представления следующим образом:
Самый маленький в мире фильм, сделанный с использованием атомов и как его создали ученые
Как мы представляем химические реакции?
- химическое уравнение
- коэффициент
- индекс
Как бы вы определили химическую реакцию? Запишите несколько своих идей.Следующие слова могут помочь вам сформулировать предложения.
реагенты, продукты, связи, перегруппированные, атомы, молекулы, новые соединения |
Попросите учащихся сначала сделать заметки и описать, что, по их мнению, представляет собой химическая реакция. Вы даже можете просто задать им вопрос и получить их определения.
Химическая реакция – это перегруппировка атомов, при которой одно или несколько соединений превращаются в новые соединения.
Все химические реакции могут быть представлены уравнениями и моделями. Некоторым людям химические уравнения могут показаться очень трудными для понимания. Поскольку атомы и молекулы не видны, их нужно вообразить, а это может быть довольно сложно! К счастью, у нас была некоторая подготовка, потому что мы рисовали молекулы со времен Gr. 7.
Каждый раз, когда атомы отделяются друг от друга и рекомбинируют в различные комбинации атомов, мы говорим, что произошла химическая реакция.Никакие атомы не теряются и не приобретаются, они просто меняются местами.
1. Словесные уравнения
В математических уравнениях мы используем знак равенства (=), например 2 + 2 = 4, но в научных химических уравнениях мы используем стрелку (→), например C + O 2 → CO 2 .
Когда мы представляем химическую реакцию словами, мы записываем словесное уравнение . Например, когда газообразный водород реагирует с газообразным кислородом с образованием воды, мы можем записать словесное уравнение реакции следующим образом:
водород + кислород → вода
Слева от стрелки у нас есть ситуация «до».Эта сторона представляет вещества, которые у нас есть до реакции. Их называют реагентами . Каковы реагенты этой реакции?
Реагенты: водород и кислород.
Справа от стрелки – ситуация «после». Эта сторона представляет собой вещества, которые у нас есть после того, как реакция произошла. Они называются товарами . Что является продуктом этой реакции?
2.Уравнения изображения
Та же самая реакция водорода с кислородом может быть представлена на рисунках, называемых субмикроскопическими диаграммами. На диаграмме ниже показано, что атомы в двух молекулах водорода (H 2 ) и одной молекуле кислорода (O 2 ) слева перегруппировываются, образуя две молекулы воды (H 2 O) справа от стрелки. . Атомы водорода – белые кружки, а атомы кислорода – красные кружки.
Что это за представление: макроскопическое, субмикроскопическое или символическое?
Субмикроскопический, потому что показывает частицы.
Теперь мы собираемся преобразовать нашу субмикроскопическую картинку в символикон:
Что является продуктом указанной выше реакции? Каковы реагенты указанной выше реакции? Напишите их формулы.
Продукт – H 2 O. Реагенты – H 2 и O 2 .
3. Химические уравнения
Когда мы представляем химическую реакцию в виде химических формул (символов), это называется химическим уравнением .Химическое уравнение вышеуказанной реакции будет следующим:
2 H 2 + O 2 → 2 H 2 O
Что это за представление: макроскопическое, субмикроскопическое или символическое?
Символьный, потому что в нем используются формулы (символы).
У нас остались реагенты слева и продукты справа.
ИНСТРУКЦИЯ:
Заполните следующую таблицу, указав различные типы уравнений, которые были показаны, а именно словесные, графические или химические уравнения.
Уравнение | Тип уравнения |
углекислый газ + вода → глюкоза + кислород | |
Fe + O 2 → Fe 2 O 3 | |
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O |
Уравнение | Тип уравнения |
Уравнение изображения | |
углекислый газ + вода → глюкоза + кислород | Словесное уравнение |
Fe + O 2 → Fe 2 O 3 | Символьное / химическое уравнение |
Уравнение изображения | |
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O | Символьное / химическое уравнение |
ВОПРОСЫ:
Какой процесс представляет собой уравнение углекислый газ + вода → глюкоза + кислород?
Какой процесс представляет уравнение C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O?
Если вы посмотрите на уравнение реакции выше, вы заметите два вида чисел:
Коэффициенты и индексы означают разные вещи, как вы увидите в следующем разделе.
Коэффициенты и индексы в химических уравнениях
Почему в химическом уравнении воды перед формулой воды (H 2 O) стоит цифра 2? Это связано с тем, что в нашей реакции две молекулы H 2 O могут быть образованы из двух молекул H 2 и одной молекулы O 2 .
Числа перед формулами в химическом уравнении называются коэффициентами .Они представляют собой количество отдельных молекул, находящихся в химической реакции.
Вы заметите, что O 2 не имеет коэффициента в приведенной выше реакции. Отсутствие коэффициента означает, что в реакции принимает участие всего одна молекула этого вещества.
В предыдущей главе мы узнали, как интерпретировать химические формулы. Когда мы читаем формулу, индексы говорят нам, сколько атомов определенного элемента находится в одной молекуле этого соединения.
Сбалансированные уравнения
- сбалансированное
- химическая формула
- ржавчина
- потускнение
Теперь мы собираемся узнать, что означает, когда реакция сбалансирована . Вот снова наша субмикроскопическая картина.
Когда учащиеся рисуют двухатомную молекулу, два атома должны находиться на и касаться , чтобы показать, что они химически связаны, иначе это неверно.
Подсчитайте, сколько атомов H находится в левой части реакции. Сколько справа?
Четыре атома H слева и четыре атома H справа.
Подсчитайте, сколько атомов O находится в левой части реакции. Сколько справа?
Два атома O слева и два атома O справа.
Вы заметили, что количество и типы атомов одинаковы слева и справа от реакции? Реагенты содержат четыре атома H и два атома O.Продукты содержат четыре атома H и два атома O.
Когда это верно для уравнения реакции, мы говорим, что уравнение сбалансированное .
ИНСТРУКЦИЯ:
- Изучите приведенное ниже уравнение. Черные атомы – это углерод (C), а красные – кислород (O). Они не всегда будут этого цвета – это просто представление.
- Ответьте на следующие вопросы.
ВОПРОСЫ:
Что это за представление: макроскопическое, субмикроскопическое или символическое?Субмикроскопический, потому что показывает частицы.
Напишите символическое представление (химическое уравнение) указанной выше реакции.Напишите формулы реагентов этой реакции.
Напишите формулу продукта реакции.
Подсчитайте, сколько атомов углерода находится в левой части реакции.Сколько справа?
Один атом C слева и один атом C справа.
Подсчитайте, сколько атомов O находится в левой части реакции. Сколько справа?Два атома O слева и два атома O справа.
Уравновешена ли реакция? Почему ты так говоришь?Да, реакция уравновешена, потому что равное количество атомов одного и того же типа находится по обе стороны уравнения реакции.
Теперь, когда мы знаем, как распознать сбалансированное уравнение, мы собираемся научиться балансировать его!
Что такое сбалансированное уравнение? Запишите собственное определение.
Либо попросите учащихся записать свои собственные определения, а затем зачитать их классу, либо они могут просто предложить ответы. Вы можете научить учащихся начать с: Мы говорим, что уравнение сбалансировано, когда … Возможный ответ: «Мы говорим, что реакция сбалансирована, когда общее количество и типы атомов в реагентах равны таковым в продуктах».
Мы собираемся использовать несколько примеров реальных реакций, чтобы научиться балансировать уравнения.В следующих главах мы увидим, как эти реакции выглядят в реальной жизни, а пока мы просто сосредоточимся на том, как уравновесить уравнения.
Магниевые хлопья часто используются в некоторых фейерверках, таких как бенгальские огни, потому что, когда они горят, они создают яркие мерцающие искры.
Когда металлический магний горит в кислороде, мы можем написать следующее словесное уравнение для реакции, которая происходит между этими двумя элементами:
магний + кислород → оксид магния
Магниевые хлопья горят в кислороде в бенгальском огне.http://www.flickr.com/photos/derekskey/32193/
ВОПРОСЫ:
Каковы реагенты реакции?Реагенты: магний и кислород.
Продукт – оксид магния.
Мы можем преобразовать слово уравнение в химическое уравнение:
Mg + O 2 → MgO
Что это за представление: макроскопическое, субмикроскопическое или символическое?Символьный, потому что в нем используются формулы (символы).
Уравнение сбалансировано? Если вы не уверены, посчитайте количество атомов каждого типа слева и справа. Возможно, это поможет взглянуть на субмикроскопическое изображение (диаграмму частиц) реакции:
Вы можете записать свои результаты в таблицу ниже:
Число атомов | Реагенты | Продукты |
мг | ||
O |
Число атомов | Реагенты | Продукты |
мг | 1 | 1 |
O | 2 | 1 |
Нет, уравнение не сбалансировано, потому что количество атомов в реагентах и продуктах неодинаково.
Итак, как мы можем сбалансировать уравнение, описывающее горение магния в кислороде? При уравновешивании реакций есть одно простое правило:
Вы можете добавлять только те соединения, которые уже присутствуют в уравнении.Это означает, что можно изменять только коэффициенты, но не индексы!
Попробуем несколько альтернативных решений. Помогло бы добавить атом О справа, вот так?
Теперь атомы O сбалансированы по обе стороны уравнения, но справа больше нет MgO. Мы изменили формулу справа на MgO 2 . Это означает, что мы изменили индекс в формуле. Вы не можете изменить формулу соединения при балансировке химических уравнений.
Спросите учащихся, почему это запрещено. MgO – это то же самое, что MgO 2 ? Напомните им предыдущий пример с H 2 O и H 2 O 2 , которые не были одним и тем же соединением. MgO и MgO 2 не могут быть одним и тем же соединением, потому что у них разные химические формулы. Соотношение атомов Mg и O в двух соединениях разное. (Соединение MgO 2 даже не существует, но вам не нужно вдаваться в подробности.)
Добавление отдельных атомов к любой части уравнения также запрещено. Это означает, что следующее уравнение также неверно:
Помните, что мы можем использовать только химические формулы, которые уже есть в уравнении. Нам нужны два MgO справа, чтобы уравновесить два O в O 2 . Нам также нужны два Mg слева, чтобы уравновесить два MgO справа.
Можете ли вы составить это уравнение с помощью шариков из пластилина или бусинок? Когда вы конвертируете «реагенты» пластилина в «продукты», остаются ли после этого неиспользованные «атомы»?
Нет, нет.Предложите учащимся выполнить это задание и потренируйтесь составлять уравнение, используя сбалансированное количество атомов.
А теперь давайте сделаем еще один шаг. Мы собираемся преобразовать наше сбалансированное уравнение для субмикроскопии в символическое химическое уравнение. Напишите сбалансированное уравнение горения магния в кислороде с образованием оксида магния.
Запишите это на доске и еще раз объясните, как уравновешивается уравнение:
2 Mg + O 2 → 2 MgO
Вот несколько важных правил уравновешивания химических уравнений:
- Когда мы уравновешиваем уравнения реакции, мы можем добавлять коэффициенты ТОЛЬКО к химическим формулам, которые уже есть в уравнении.
- Мы НЕ можем изменять химические формулы любых реагентов или продуктов, изменяя индексы в формуле.
- НЕЛЬЗЯ добавлять другие реагенты или продукты. Это включает добавление отдельных атомов любого из элементов, уже включенных в уравнение реакции.
- Мы НЕ можем удалять реагенты или продукты.
Теперь мы готовы попрактиковаться в балансировании других уравнений реакции.
Когда железо ржавеет, это происходит потому, что металлическое железо реагирует с кислородом воздуха с образованием оксида железа.
Старая машина с ржавчиной на капоте. http://www.flickr.com/photos/dok1/3513263469/ Фото ржавой бочки крупным планом. http://www.flickr.com/photos/jeua/7217824700/Слово уравнение имеет следующий вид:
железо + кислород → оксид железа
Химическое уравнение имеет следующий вид:
Fe + O 2 → Fe 2 O 3
Уравнение сбалансировано? Нарисуйте картинку под микроскопом, чтобы помочь вам определиться.
Схемаученика должна выглядеть так. Им может быть сложно преобразовать уравнения в диаграммы. Помогите им интерпретировать формулы следующим образом: Fe само по себе означает, что существует только один атом железа (Fe). O 2 означает, что должны быть два атома O, связанные, чтобы образовать молекулу. Fe 2 O 3 означает, что два атома Fe и три атома O сгруппированы вместе.
Цвета не важны, если все атомы одного и того же элемента имеют одинаковый цвет.Расположение атомов в «кластере» Fe 2 O 3 также не имеет значения. Поскольку Fe 2 O 3 является ионным соединением, мы обычно не будем говорить о «молекуле» Fe 2 O 3 . Как и все другие ионные соединения, он состоит из больших кластеров ионов Fe3 + и O 2 – в регулярной кристаллической упаковке, которая простирается в трех измерениях, во многом подобно ионной решетке NaCl на рисунке ниже (также показанном в главе 1).
Не рекомендуется упоминать здесь эту информацию, так как на данном этапе она скорее запутает учащихся, чем улучшит их понимание уравнений балансировки.
Вы также можете использовать таблицу, подобную приведенной ниже:
Число атомов | Реагенты | Продукты |
Fe | ||
O |
Число атомов | Реагенты | Продукты |
Fe | 1 | 2 |
O | 2 | 3 |
Ваш вердикт: уравнение сбалансировано? Поясните свой ответ.
Нет, уравнение не сбалансировано, потому что количество атомов в реагентах и продуктах неодинаково.
Как уравновесить реакцию? Ниже приведены три возможности (планы A, B и C). Вы должны оценить каждый план и сказать, разрешен он или нет.
План А
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте один атом Fe на стороне реагента. | ||
Замените O 2 на O 3 на стороне реагента в уравнении. |
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте один атом Fe на стороне реагента. | Есть | Атом Fe уже является реагентом. |
Замените O 2 на O 3 на стороне реагента в уравнении. | № | Изменения формул запрещены. |
Изменились ли какие-то коэффициенты? Помните, что это разрешено.
Изменились ли какие-либо формулы или были добавлены новые формулы? Помните, что это ЗАПРЕЩЕНО.
Как вы думаете: сработает ли этот план? Поясните свой ответ.
Нет, потому что формула была изменена.
План Б
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте один атом Fe на стороне реагента. | ||
Добавьте один атом кислорода на стороне реагента. |
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте один атом Fe на стороне реагента. | Есть | Атом Fe уже является реагентом. |
Добавьте один атом кислорода на стороне реагента. | № | Добавление отдельных атомов не допускается, если они уже не находятся в реакции КАК ОДИНОЧНЫЕ АТОМЫ. |
Изменились ли какие-то коэффициенты? Помните, что это разрешено.
Изменились ли какие-либо формулы или были добавлены новые формулы? Помните, что это ЗАПРЕЩЕНО.
Как вы думаете: сработает ли этот план? Объясните, почему да или почему нет.
Нет, потому что добавлять формулы нельзя.
Plan C
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте три атома Fe на стороне реагента. | ||
Добавьте две молекулы O 2 на стороне реагента. | ||
Добавьте один Fe 2 O 3 на стороне продукта. |
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте три атома Fe на стороне реагента. | Есть | Атом Fe уже является реагентом. |
Добавьте две молекулы O 2 на стороне реагента. | Есть | Молекула O 2 уже является реагентом. |
Добавьте один Fe 2 O 3 на стороне продукта. | Есть | Fe 2 O 3 уже является продуктом. |
Изменились ли какие-то коэффициенты? Помните, что это разрешено.
Изменились ли какие-либо формулы или были добавлены новые формулы? Помните, что это ЗАПРЕЩЕНО.
Как вы думаете: сработает ли этот план? Объясните, почему да или почему нет.
Да, потому что ни одно из правил балансировки уравнений не было нарушено.
Какой из трех планов (A, B или C) помог нам сбалансировать уравнение, используя только разрешенные ходы?Есть ли какие-то другие планы, которые вы могли бы придумать, чтобы сбалансировать это уравнение?
Следует поощрять учащихся пробовать другие возможности.Они должны прийти к выводу, что реакция, предложенная в Плане C, является единственно правильной.
В следующем упражнении мы сбалансируем уравнение, которое намного проще, но мы не собираемся включать все объяснения предыдущего упражнения.
Вы когда-нибудь замечали, как изделия из меди со временем тускнеют?
Одна из этих медных монет потускнела, поскольку покрылась черным веществом.http://www.flickr.com/photos/dno1967b/69965/Этот темный слой потускнения является результатом медленной реакции между медью и кислородом с образованием оксида меди.
ВОПРОСЫ:
Напишите словесное уравнение для этой реакции. Все слова находятся в предложении выше, их просто нужно разместить в правильных местах.Учащиеся должны заполнить ответы следующим образом:
Преобразуйте словесное уравнение в химическое уравнение.Пока не нужно балансировать. Преобразуйте химическое уравнение в графическое уравнение. Это не обязательно должно быть сбалансировано.Рисунок ученика должен выглядеть следующим образом. Цвета не обязательно должны быть такими, как показано здесь, но они должны показывать разницу между различными элементами.Если у учащихся нет карандашей разного цвета, они также могут использовать разные шаблоны, чтобы различать разные атомы.
Теперь перерисуйте уравнение изображения, чтобы оно было сбалансированным. Помните, что нельзя добавлять «новые» соединения; нам разрешено рисовать только те молекулы, которые уже есть. преобразовать сбалансированное уравнение изображения в сбалансированное химическое уравнение.В следующих главах будет больше возможностей писать и уравновешивать химические уравнения.
Как написать химическое уравнение?
Как написать химическое уравнение?
Все химические реакции представлены химическими уравнениями .Химическое уравнение – это сокращенное представление химической реакции с использованием символов и формул вещества, участвующего в химической реакции.
Символы и формулы веществ (элементов или соединений) расположены так, чтобы показать реагенты и продукты химической реакции.
Химическая реакция происходит, когда исходные вещества реагируют с образованием новых веществ.
(a) Исходные вещества называются реагентами .
(b) Новые образовавшиеся вещества называются продуктами .
В уравнении реагенты записываются в левой части, а продукты записываются в правой части.
Например:
Люди также спрашивают
Построение химических уравнений
1. Согласно закону сохранения массы, материя не может быть ни создана, ни разрушена. Это означает, что количество атомов до и после химической реакции одинаково. Следовательно, химическое уравнение должно быть сбалансировано.
2. В таблице ниже показано, как можно построить химическое уравнение.
Таблица: Построение химического уравнения.
| Реакция: Железные опилки реагируют с хлоридом меди (II) с образованием раствора хлорида железа (III) и меди. | |
| Шаг | Объяснение и пример |
| Укажите реагенты, продукты и их формулы. | Реагенты: хлорид железа, Fe и меди (II), CuCl 2 Продукты: хлорид железа (III), FeCl 3 и медь, Cu |
| Напишите основную часть уравнения. | Fe + CuCl 2 ⟶ FeCl 3 + Cu Реагенты Продукты |
| Определите количество атомов каждого элемента в обеих частях уравнения. | Левая сторона Правая сторона Атом Fe: 1 атом Fe: 1 Атом Cu: 1 атом Cu: 1 Атом Cl: 2 атома Cl: 3 Число атомов не сбалансировано. |
| Выровняйте уравнение, настроив коэффициенты. (Примечание: коэффициенты – это числа перед формулами.) | Атомы Cl уравновешены. Fe + 3CuCl 2 ⟶ 2FeCl 3 + Cu В результате количество атомов Fe и атомов Cu не сбалансировано. Затем атомы Fe уравновешиваются. 2Fe + 3CuCI 2 ⟶ 2FeCI 3 + Cu Наконец, атомы Cu уравновешены. 2Fe + 3CuCI 2 ⟶ 2FeCI 3 + 3Cu |
| Убедитесь, что уравнение сбалансировано. | Левая часть Правая сторона Атом Fe: 2 атома Fe: 2 Атом Cu: 3 атома Cu: 3 Атом Cl: 6 Атом Cl: 6 Теперь уравнение сбалансировано. |
| Укажите государственный символ каждого вещества. | 2Fe (тв.) + 3CuCl 2 (водн.) ⟶ 2FeCl 3 (водн.) + 3Cu (т.) |
3. Символы состояния, (l) и (g) обозначают твердое, жидкое и газообразное состояния соответственно.Символ (водный) представляет водный раствор.
4. Иногда символ «↑» используется для обозначения выпуска газа.
5. Иногда над стрелкой пишут «», чтобы показать, что нагревание необходимо для начала химической реакции.
Правила написания химического уравнения:
При написании химического уравнения необходимо соблюдать определенные правила.
- Реагенты, участвующие в реакции, записываются в терминах их символов или молекулярных формул в левой части уравнения.
- Знак плюс (+) добавлен между формулами реагентов.
- Продукты реакции записаны в виде их символов или молекулярных формул в правой части уравнения.
- Знак плюс (+) добавлен между формулами продуктов.
- Между реагентами и продуктами вставлена стрелка (⟶), показывающая, в каком направлении происходит реакция.
A + B ⟶ C + D
В этом химическом уравнении A и B – реагенты, а C и D – продукты.Стрелка указывает, что реакция идет в сторону образования C и D.
Как сбалансировать химические уравнения?
Первый шаг в балансировании уравнения – это подсчет количества атомов каждого элемента по обе стороны уравнения. Например, реагенты X и Y 2 реагируют с образованием соединения XY. Словесное уравнение для этой реакции будет
X + Y 2 ⟶ XY
Число атомов элементов X и Y в вышеупомянутом уравнении показано ниже.
| Элемент | Число атомов в LHS | Число атомов в RHS |
| х | 1 | 1 |
| Y | 2 | 1 |
Чтобы сбалансировать Y с обеих сторон, умножьте RHS на 2, т.е.
X + Y 2 ⟶ 2XY
Теперь уравновешивается количество атомов Y, но не количество атомов X. Следовательно, умножьте X на левой стороне на 2. Таким образом, уравнение принимает вид
2X + Y 2 ⟶ 2XY
Это сбалансированное уравнение, поскольку количество атомов X и Y с обеих сторон равно.
Помня об этих шагах, давайте теперь напишем химическое уравнение образования оксида магния.
Шаг 1: Магний сгорает в кислороде с образованием оксида магния. Здесь реагентами являются магний и кислород. Продукт – оксид магния.
Шаг 2: Таким образом, словесное уравнение:
Магний + кислород ⟶ Оксид магния
Шаг 3: Заменяя названия символами и формулами, мы получаем химическое уравнение как
Mg + O 2 ⟶ MgO
Шаг 4: Число атомов элементов
| Элемент | Число атомов в LHS | Число атомов в RHS |
| Магний | 1 | 1 |
| Кислород | 2 | 1 |
Чтобы уравновесить кислород с обеих сторон, умножьте RHS на 2, т.е.е.,
Mg + O 2 ⟶ 2MgO
Теперь количество атомов кислорода уравновешено, а количество атомов магния – нет. Следовательно, умножьте магний на LHS на 2. Таким образом, уравнение принимает вид
2Mg + O 2 ⟶ 2MgO
Это вычисленное химическое уравнение.
Построение сбалансированных химических уравнений
Цель: Построить сбалансированные химические уравнения.
Материалы: Порошок карбоната меди (II), известковая вода, концентрированная соляная кислота, концентрированный раствор аммиака
, раствор нитрата свинца (II) и раствор йодида калия.
Аппарат: Пробирки, пробки, резиновая пробка с подающей трубкой, держатель пробирок, горелка Бунзена и стеклянная пробирка.
Процедура:
A. Нагревание карбоната меди (II)
- Половину шпателя порошка карбоната меди (II) помещают в пробирку.
- Устройство настроено, как показано на рисунке.
Рисунок: Нагревание карбоната меди (II) - Карбонат меди (II) нагревают, и полученный газ пропускают через известковую воду.
- Наблюдаются изменения карбоната меди (II) и известковой воды.
- Когда реакция завершена, подающую трубку вынимают из известковой воды и снимают горелку Бунзена.
B. Образование хлорида аммония
- Используя стеклянную пробирку, в пробирку капают три или четыре капли концентрированной соляной кислоты. Пробирку закрывают пробкой и оставляют на несколько минут.
- Шаг 1 повторяется с использованием чистой стеклянной пробирки с использованием концентрированного раствора аммиака.
- Обе пробки удаляются, и горловины пробирок соединяются, как показано на рисунке.
- Все наблюдения записаны.
C. Осаждение иодида свинца (II)
- 2 см 3 раствора йодида калия добавляют к 2 см 3 раствора нитрата свинца (II), как показано на рисунке.
- Смесь встряхивают и наблюдают за любыми изменениями.
Наблюдения:
| Раздел | Наблюдение | Вывод |
| А | Карбонат меди (II) меняет цвет с зеленого на черный. Известковая вода становится молочной. | Карбонат меди (II) разлагается на оксид меди (II) черного цвета. Выделяется углекислый газ. |
| B | Густые белые пары выделяются на входе в пробирки. | Белый дым – твердый хлорид аммония. |
| С | Образуется желтый осадок. | Желтый осадок – иодид свинца (II). |
Обсуждение:
- При нагревании карбонат меди (II) разлагается на оксид меди (II) и диоксид углерода.Присутствие углекислого газа определяется известковой водой.
- Следовательно, сбалансированное уравнение нагрева карбоната меди (II):
- Концентрированную соляную кислоту и концентрированный раствор аммиака оставляют на несколько минут для получения газообразного хлористого водорода и газообразного аммиака соответственно.
- Когда газообразный хлористый водород и газообразный аммиак объединяются, они реагируют с образованием мелких белых твердых частиц хлорида аммония. Они выглядят как густые белые пары.
- Вычисленное уравнение образования хлорида аммония:
- При добавлении бесцветного раствора нитрата свинца (II) к бесцветному раствору иодида калия образуется желтый осадок иодида свинца (II). Одновременно производится также бесцветный раствор нитрата калия.
- Вычисленное уравнение осаждения иодида свинца (II):
Качественные и количественные аспекты химических уравнений
- Химические уравнения дают нам следующую качественной информации.
(а) Реагенты и продукты химической реакции.
(b) Физические состояния реагентов и продуктов. - В качестве примера возьмем следующее уравнение.
2C (т) + O 2 (г) ⟶ 2CO (г)
Из уравнения мы знаем, что реагентами являются твердый углерод и газообразный кислород. Продуктом реакции является газообразный оксид углерода. - Количественно , коэффициенты в сбалансированном уравнении говорят нам точные пропорции реагентов и продуктов в химической реакции.
Возьмем для примера следующее уравнение.
Из уравнения мы знаем, что 2 моля нитрата меди (II) разлагаются на 2 моля оксида меди (II), 4 моля газообразного диоксида азота и 1 моль газообразного кислорода. - На микроскопическом уровне коэффициенты химической реакции говорят нам о количестве частиц 1, участвующих в реакции.
- Химическое уравнение играет важную роль; коммуникативный инструмент для химиков.
(a) Химическое уравнение точно описывает химическую реакцию.
(b) Химики используют химические уравнения для решения количественных задач.
Примечание:
- В качественном отношении газообразный водород реагирует с газообразным кислородом с образованием воды.
- Качественно 2 молекулы (или 2 моля) газообразного водорода реагируют с 1 молекулой (или 1 моль) газообразного кислорода с образованием 2 молекул (или 2 моль) воды.
рабочих листов по химии и онлайн-упражнений
Расширенный поискСодержание:
Язык: AfarAbkhazAvestanAfrikaansAkanAmharicAragoneseArabicAssameseAsturianuAvaricAymaraAzerbaijaniBashkirBelarusianBulgarianBihariBislamaBambaraBengali, BanglaTibetan стандарт, тибетский, CentralBretonBosnianCatalanChechenChamorroCorsicanCreeCzechOld церковнославянский, церковнославянский, Старый BulgarianChuvashWelshDanishGermanDivehi, Мальдивский, MaldivianDzongkhaEweGreek (современный) EnglishEsperantoSpanishEstonianBasquePersian (фарси) Фуле, фулах, пулар, PularFinnishFijianFaroeseFrenchWestern FrisianIrishScottish гэльский, GaelicGalicianGuaraníGujaratiManxHausaHebrew (современный) HindiHiri MotuCroatianHaitian, гаитянский CreoleHungarianArmenianHereroInterlinguaIndonesianInterlingueIgboNuosuInupiaqIdoIcelandicItalianInuktitutJapaneseJavaneseGeorgianKongoKikuyu, GikuyuKwanyama, KuanyamaKazakhKalaallisut , Гренландский, кхмерский, каннада, корейский, канури, кашмирский, курдский, коми, корний, киргизский, латинский, люксембургский, латинский, лимбургский, лимбургский, лимбургский, лингала, литовский, люба-катанга, латышский, малагасийский, маршалльский, маори, македонский, mMongolianMarathi (маратхи) MalayMalteseBurmeseNauruanNorwegian BokmålNorthern NdebeleNepaliNdongaDutchNorwegian NynorskNorwegianSouthern NdebeleNavajo, NavahoChichewa, Chewa, NyanjaOccitanOjibwe, OjibwaOromoOriyaOssetian, OsseticEastern пенджаби, Восточная PanjabiPāliPolishPashto, PushtoPortugueseQuechuaRomanshKirundiRomanianRussianKinyarwandaSanskrit (санскрит) SardinianSindhiNorthern SamiSangoSinhalese, SinhalaSlovakSloveneSamoanShonaSomaliAlbanianSerbianSwatiSouthern SothoSundaneseSwedishSwahiliTamilTeluguTajikThaiTigrinyaTurkmenTagalogTswanaTonga (Остров Тонга) TurkishTsongaTatarTwiTahitianUyghurUkrainianUrduUzbekValencianVendaVietnameseVolapükWalloonWolofXhosaYiddishYorubaZhuang, ChuangChineseZulu Тема:
Оценка / уровень: Возраст: 345678
12131415161718+
Поиск: Все рабочие листы Только мои подписанные пользователи Только мои любимые рабочие листы Только мои собственные рабочие листы
Управление науки и технологий
Мы защищаем и обеспечиваем прочную научную основу для научных программ NOAA в области рыболовства и решений по сохранению ресурсов и управлению.Мы тесно сотрудничаем с шестью научными центрами NOAA Fisheries: Аляска, Северо-Восток, Северо-Запад, Острова Тихого океана, Юго-Восток и Юго-Запад.
Статистика рыболовства
Мы собираем данные и координируем информационные и исследовательские программы для поддержки научного управления живыми морскими ресурсами страны. Помимо интеграции и распространения государственных и федеральных статистических данных о морском рыболовстве, мы администрируем исследования, используемые для оценки рекреационных выгрузок.
Узнайте больше о наших программах и найдите ключевые данные по выгрузке коммерческого рыболовства, внешней торговле, уловам и усилию морского любительского рыболовства.
Оценка и мониторинг
Мы поддерживаем исследования морских ресурсов, оценки запасов, науку о защищенных ресурсах и программу морских птиц, программы наблюдений за промыслом, совместные исследования и независимую экспертную оценку научных продуктов и программ NOAA Fisheries. Кроме того, мы разрабатываем политики, процедуры и бюджетные инициативы, чтобы обеспечить высокое качество, рентабельность, продуктивность и полную поддержку этих мероприятий.
Экономика и социальный анализ
Мы проводим и координируем социально-экономические исследования и сбор данных, проводимые агентством в поддержку сохранения и управления живыми морскими ресурсами.
Морские экосистемы
Мы поддерживаем разработку и координацию научных программ, в том числе программ по изучению среды обитания, для содействия интеграции информации об экосистемах в управление живыми морскими ресурсами.
Обзоры программ
Мы постоянно стремимся продвигать науку, которая дает информацию о рыболовстве и управлении охраняемыми ресурсами. В рамках наших постоянных усилий по совершенствованию мы проводим систематический процесс экспертной оценки в наших региональных научных центрах и национальном управлении науки и технологий, чтобы улучшить интеграцию, выявить передовой опыт и поделиться успехами и проблемами в рамках нашего научного предприятия.
Поддержка миссий
Мы обеспечиваем поддержку миссии, поддерживая и повышая качество и авторитет научной деятельности NOAA Fisheries. Мы также обеспечиваем управление и разработку приложений для поддержки своевременного доступа к ресурсам данных NOAA Fisheries.
Science Part I Решения для класса 10 Science Chapter 3
Страница № 45:
Вопрос 1:
Выберите правильный вариант из скобок и объясните причину утверждения.
(Окисление, вытеснение, электролиз, восстановление, цинк, медь, двойное вытеснение, разложение)
a. Чтобы предотвратить ржавление, на железные листы наносится слой …….. металла.
г. Превращение сульфата железа в сульфат железа – это …….. реакция.
г. Когда электрический ток проходит через подкисленную воду, происходит …….. воды.
г. Добавление водного раствора ZnSO 4 к водному раствору BaCl 2 является примером ……. реакция.
Ответ:
а. Чтобы предотвратить ржавление, на листы железа нанесен слой металла цинк .
г. Превращение сульфата двухвалентного железа в сульфат железа составляет реакция окисления .
г. При пропускании электрического тока через подкисленную воду происходит электролиз воды.
г. Добавление водного раствора ZnSO 4 к водному раствору BaCl 2 является примером реакции двойного вытеснения .
Страница № 45:
Вопрос 2:
Напишите ответы на следующие вопросы.
а. Как называется реакция, когда окисление и восстановление происходят одновременно? Объясните на одном примере.
г. Как можно увеличить скорость химической реакции, а именно разложения перекиси водорода?
г. Объясните термины «реагент» и «продукт», приведя примеры.
г. Объясните типы реакций применительно к кислороду и водороду.Иллюстратор с примерами.
e. Объясните сходство и различие двух событий, а именно добавления NaOH в воду и добавления CaO в воду.
Ответ:
а. Процесс, в котором окисление и восстановление происходят одновременно, называется окислительно-восстановительной реакцией.
- Окисление – потеря электронов или увеличение степени окисления молекулой, атомом или ионом.
- Восстановление – это прирост электронов или понижение степени окисления молекулой, атомом или ионом.
2FeCl3 (водн.) + SnCl2 (водн.) → 2FeCl2 (водн.) + SnCl4 (водн.)
Перед реакцией к каждому атому железа были присоединены атомы 3Cl. После реакции присоединяются только два атома хлора. То есть высвобождается один отрицательный атом хлора. Следовательно, восстановление FeCl 3 произошло в этом реакторе, с другой стороны, до реакции два атома хлора были присоединены к каждому атому олова (олова).Благодаря указанной выше реакции количество хлора, присоединенного к атому олова, увеличивается до четырех. То есть произошло окисление SnCl 2 . Следовательно, в этой реакции окисление одного вещества и восстановление другого вещества происходят одновременно. Это называется окислительно-восстановительной реакцией.
б) Скорость разложения перекиси водорода можно увеличить, если реакция протекает в присутствии иодид-иона. Реакция протекает по двухступенчатому механизму: Шаг 1: h3O2 (aq) + I- (aq) → h3O (l) + IO- (aq) Шаг 2: IO- (aq) + h3O2 (aq) → h3O (l) + O2 (g) + I- (водн.)
г.
Реагент: Вещества, которые принимают участие в химической реакции, называются реагентами.
Продукт: вещество, образующееся в результате химической реакции, называется продуктами.
Новое вещество, образующееся в результате химической реакции, называется продуктами.
Например: Когда два атома натрия реагируют с двумя атомами хлора (реагентами), они дают совершенно новое соединение (продукт), то есть хлорид натрия (два атома).
2Na + Cl2 → 2NaCl
По отношению к кислороду и водороду существуют три основных типа химических реакций:
1.Комбинированная реакция
Когда два атома реагируют с образованием соединения, это называется реакцией объединения.
Например: 2h3 + O2 → 2h3O
2. Реакция разложения
Когда соединение распадается на простые молекулярные вещества, из которых оно состоит, это называется реакцией разложения.
Например: 2h3O → 2h3 + O2
3. Реакция окисления и восстановления:
Окисление:
(i) Добавление кислорода к веществу называется окислением.
(ii) Удаление водорода до вещества называется окислением.
Восстановление:
(i) Добавление водорода к веществу называется восстановлением.
(ii) Удаление кислорода из вещества называется восстановлением.
Например: CuO + h3 → Cu + h3O
В указанной выше реакции оксид меди превращается в Cu. То есть из оксида меди удаляется кислород. Итак, оксид меди восстанавливается до меди.
В указанной выше реакции H 2 превращается в H 2 O. То есть кислород добавляется к водороду. Итак, водород окисляется до воды.
эл.
Используемые химические уравнения:
1) NaOH (s) + h3O (l) → Na⁺ (водн.) + OH⁻ (водн.) + Δ (HEAT) 2) CaO (s) + h3O (l) → Ca (OH ) ₂ (aq) + Δ (HEAT)
Сходства:
1) Оба уравнения являются экзотермическими. Это означает, что во время реакции выделяется много тепла.
2) Обе реакции образуют крепкий щелочной раствор.
Отличия:
1) Гидроксид натрия – сильное основание, диссоциирует с образованием иона Na⁺ и OH⁻. В то время как оксид кальция добавлял воду, чтобы образовать гидроксид кальция, который далее диссоциирует.
2) NaOH представляет собой одноосновное основание. и CaO представляет собой двухкислотное основание.
3) NaOH, CaO следует добавлять в воду постепенно при постоянном перемешивании. CaO при взаимодействии с водой образует щелочной раствор, называемый гидроксидом кальция, который используется для промывки белого цвета, и эта реакция более опасна по сравнению с NaOH.
Страница № 45:
Вопрос 3:
Объясните следующие термины на примерах.
а. Эндотермическая реакция
b.Комбинированная реакция
c. Сбалансированное уравнение
d. Реакция вытеснения
Ответ:
а. Эндотермическая реакция:
Экзотермическая реакция – это химическая реакция, при которой выделяется энергия в виде тепла и света. Это противоположно эндотермической реакции. Экзотермическая реакция означает «экзо», что означает высвобождение, а «термическая» означает тепло. Поэтому реакция, при которой происходит выделение тепла со светом или без него, называется экзотермической реакцией.
Выражается в химическом уравнении: реагенты → продукты + энергия.
Например: Горение – это экзотермическая реакция.
Химическая реакция между гранулами цинка и разбавленной серной кислотой является экзотермической реакцией.
б. Комбинированная реакция:
Те реакции, в которых два или более веществ объединяются с образованием одного вещества, называются комбинированной реакцией
. Например: Магний и кислород объединяются при нагревании с образованием оксида магния.
2Mg + O2 → 2MgO
с.Сбалансированное уравнение:
Сбалансированное уравнение – это уравнение химической реакции, в которой количество атомов каждого элемента в реакции и общий заряд одинаковы как для реагентов, так и для продуктов. Другими словами, масса и заряд уравновешиваются по обе стороны реакции.
Вычисленное уравнение:
2 Fe 2 O 3 + 3 C → 4 Fe + 3 CO 2
И левая, и правая части уравнения содержат 4 атома Fe, 6 O и 3 атома C.Когда вы балансируете уравнения, рекомендуется проверить свою работу, умножив индекс каждого атома на коэффициент. Если нижний индекс не указан, считайте его равным 1. Также хорошей практикой является указывать состояние вещества каждого реагента. Он указан в скобках сразу после соединения. Например, более ранняя реакция может быть записана как:
2 Fe 2 O 3 (s) + 3 C (s) → 4 Fe (s) + 3 CO 2 (g)
, где s означает твердое тело и g – газовое состояние вещества.
г. Реакция замещения:
Реакция замещения – это химическая реакция, при которой более реактивный элемент вытесняет менее реактивный элемент из своего соединения. В реакциях замещения принимают участие как металлы, так и неметаллы.
Химическая активность металлов связана с их относительным положением в ряду активности.
Металл, расположенный выше в ряду активности, может вытеснить металл, занимающий более низкое положение, из водного раствора его соли.
Например:
Страница № 45:
Вопрос 4:
Приведите научные доводы.
a. Когда газ, образовавшийся при нагревании известняка, пропускается через свежеприготовленную известковую воду, известковая вода становится молочной.
г. Требуется время, чтобы куски плитки Шахабад исчезли в HCl, но ее порошок исчезает быстро.
c. При приготовлении разбавленной серной кислоты из концентрированной серной кислоты в лаборатории, концентрированная серная кислота медленно добавляется к воде при постоянном перемешивании.
г. Для длительного хранения масла рекомендуется использовать герметичную тару.
Ответ:
Приведите научные доводы.
а.
Известняк состоит из карбоната кальция. При нагревании карбоната кальция выделяется двуокись углерода. Известковая вода состоит из гидроксида кальция.
Когда диоксид углерода проходит через известковую воду, диоксид углерода реагирует с гидроксидом кальция с образованием карбоната кальция, который представляет собой белый осадок, затем известковая вода становится молочной из-за образования карбоната кальция.
CaCo3 → CaO + CO2CO2 + Ca (OH) 2 → CaCO3
б. Требуется время, чтобы куски плитки Шахабад исчезли в HCl, но ее порошок исчезает быстро, потому что в кусках плитки поверхностные атомы могут реагировать только с HCl, но в порошкообразной форме все атомы могут реагировать с HCl.В этом разница в их реактивности. Порошки – это более простые вещества, состоящие из кусочков, и они требуют меньше времени для реакции по сравнению с целым куском плитки, который представляет собой соединение.
например: порошкообразная соль вступает в реакцию, и вода растворяется, но соляные породы и вода не растворяются.
в. При приготовлении разбавленной серной кислоты из концентрированной серной кислоты в лаборатории, концентрированная серная кислота медленно добавляется в воду при постоянном перемешивании, потому что серная кислота (H 2 SO 4 ) очень активно реагирует с водой, это сильно экзотермическая реакция.Если вы добавите воду в концентрированную серную кислоту, она может закипеть и выскочить, из-за чего вы можете получить неприятный кислотный ожог. Вода является хорошим поглотителем тепла, поэтому мы добавляем кислоту в воду, медленно и при постоянном перемешивании.
г. Рекомендуется использовать герметичный контейнер для хранения масла в течение длительного времени, чтобы избежать проблемы прогорклости. Прогорклость – это состояние, вызываемое окислением жиров и масел в воздухе, с неприятным запахом и вкусом.
Страница № 45:
Вопрос 5:
Посмотрите на следующий рисунок a запишите химическую реакцию с объяснением.
Страница № 46:
Вопрос 6:
Определите по следующей реакции реагенты, которые подвергаются окислению и восстановлению.
а. Fe + S → FeS
б. 2Ag 2 O → 4 Ag + O 2 ↑
c. 2Mg + O 2 → 2MgO
г. NiO + H 2 → Ni + H 2 O
Ответ:
а.Fe + S → FeS
В реакции Fe превращается в FeS. Это означает, что железо теряет электроны с образованием FeS. Потеря электронов веществом называется окислением, поэтому железо подвергается окислению.
г. 2Ag 2 O → 4 Ag + O 2 ↑
В результате реакции оксид серебра превращается в серебро. То есть из оксида серебра удаляется кислород. Удаление кислорода из вещества называется восстановлением, поэтому оксид серебра подвергается восстановлению.
г. 2Mg + O 2 → 2MgO
В результате реакции магний превращается в оксид магния.Это означает, что к магнию добавляется кислород. Добавление кислорода к веществу называется окислением, поэтому магний подвергается окислению.
г. NiO + H 2 → Ni + H 2 O
В реакции оксид никеля превращается в никель. То есть из оксида никеля удаляется кислород. Удаление кислорода из вещества называется восстановлением, поэтому оксид никеля подвергается восстановлению. В результате реакции водород превращается в H 2 O. То есть кислород добавляется к водороду.Добавление кислорода к веществу называется окислением, поэтому водород подвергается окислению.
Страница № 46:
Вопрос 7:
Постепенно сбалансируйте следующее уравнение.
а. H 2 S 2 O 7 (л) + H 2 O (л) → H 2 SO 4 (л)
б. SO 2 (г) + H 2 S ( a q) → S (s) + H 2 O (l)
c.Ag (s) + HCl ( a q) → AgCl ↓ + H 2 ↑
d. N a OH ( a q) + H 2 SO 4 ( a q) → N a 2 SO 4 ( a q) + H 2 O (л)
Ответ:
а. H 2 S 2 O 7 (л) + H 2 O (л) → H 2 SO 4 (л)
Step1. Подсчитайте количество каждого атома на стороне реагента:
H = 4
S = 2
O = 8
Шаг 2.Подсчитайте количество каждого атома на стороне продукта:
H = 2
S = 1
O = 4
Шаг 3. Затем уравновесите количество каждого атома в уравнении, умножив реагент и сторону продукта на числовое значение:
Если мы умножим произведение рядом с 2, тогда количество атомов в продукте и на стороне реагента уравновешивается.
H 2 S 2 O 7 (л) + H 2 O (л) → 2H 2 SO 4 (л)
б. SO 2 (г) + H 2 S ( a q) → S (т) + H 2 O (л)
Шаг 1.Подсчитайте количество каждого атома на стороне реагента:
H = 2
S = 2
O = 2
Шаг 2. Подсчитайте количество каждого атома на стороне продукта:
H = 2
S = 1
O = 2
Шаг 3. Затем уравновесите количество каждого атома в уравнении, умножив реагент и сторону продукта на числовое значение:
Если мы умножим H 2 S на 2 на стороне реагента и S на 3 и H 2 O на 2 на стороне продукта, тогда количество атомов на стороне продукта и реагента будет сбалансировано.
SO 2 (г) + 2H 2 S ( a q) → 3S (s) + 2H 2 O (л)
c.Ag (s) + HCl ( a q) → AgCl ↓ + H 2 ↑
Шаг 1. Подсчитайте количество каждого атома на стороне реагента:
H = 1
Ag = 1
Cl = 1
Шаг 2. Подсчитайте количество каждого атома на стороне продукта:
H = 2
Ag = 1
Cl = 1
Шаг 3. Затем уравновесите количество каждого атома в уравнении, умножив реагент и сторону продукта на числовое значение:
Если мы умножим Ag на 2 и HCl на 2 на стороне реагента и AgCl на 2 на стороне продукта, тогда количество атомов на стороне продукта и реагента становится сбалансированным.
2Ag (т) + 2HCl ( a q) → 2AgCl ↓ + H 2 ↑
г. N a OH ( a q) + H 2 SO 4 ( a q) → N a 2 SO 4 ( a q) + H 2 O (l)
Шаг 1. Подсчитайте количество каждого атома на стороне реагента:
Na = 1
H = 3
O = 5
S = 1
Шаг 2. Подсчитайте количество каждого атома в стороне продукта:
Na = 2
H = 2
O = 5
S = 1
Шаг 3. Затем уравновесите количество каждого атома в уравнении, умножив количество реагента и продукта на числовое значение:
Если мы умножим NaOH на 2 на стороне реагента и H 2 O на 2 на стороне продукта, то количество атомов на стороне продукта и реагента будет сбалансировано.
2N a OH ( a q) + H 2 SO 4 ( a q) → N a 2 SO 4 ( a q) + 2H 2 О (л)
Страница № 46:
Вопрос 8:
Укажите эндотермическую и экзотермическую реакцию.
а. HCl + N a OH → N a Cl + H 2 O + нагрев
b. 2KClO3s → ∆2KCls + 3O2 ↑
c. C a O + H 2 O → C a (OH) 2 + нагрев
d.CaCO3s → ∆CaOs + CO2 ↑
Ответ:
Укажите эндотермическую и экзотермическую реакцию.
а. HCl + N a OH → N a Cl + H 2 O + тепло
Тепло выделяется на стороне продукта, как упоминалось в приведенной выше реакции. Итак, это экзотермическая реакция, потому что при экзотермической реакции выделяется тепло.
г. 2KClO3s → ∆2KCls + 3O2 ↑
Тепло отводится на стороне продукта, чтобы разбить соединение на более простые вещества, как это упоминалось в приведенной выше реакции.Итак, это эндотермическая реакция, потому что тепло выделяется в экзотермической реакции.
г. C a O + H 2 O → C a (OH) 2 + тепло
Тепло выделяется на стороне продукта, как упоминалось в приведенной выше реакции. Итак, это экзотермическая реакция, потому что при экзотермической реакции выделяется тепло.
г. CaCO3s → ∆CaOs + CO2 ↑
Тепло нагревается на стороне продукта для разложения соединения на более простые вещества, как это упоминалось в приведенной выше реакции.Итак, это эндотермическая реакция, потому что тепло выделяется в экзотермической реакции.
Страница № 46:
Вопрос 9:
| Реагенты | Продукты | Тип химической реакции |
| BaCl 2 ( a q) + ZnSO 4 ( a q) | H 2 CO 3 (водн.) | Рабочий объем |
| 2AgCl (т) | FeSO 4 (водн.) + Cu (т.) | Комбинация |
| CuSO 4 ( a q) + Fe (s) | BaSO 4 ↓ + ZnCl 2 (водн.) | Разложение |
| H 2 O (л) + CO 2 (г) | 2Ag (т) + Cl 2 (г) | Двойной рабочий объем |
Ответ:
| Реагенты | Продукты | Тип химической реакции |
| BaCl 2 ( a q) + ZnSO 4 ( a q) | BaSO 4 ↓ + ZnCl 2 (водн.) | Двойной рабочий объем |
| 2AgCl (т) | 2Ag (т) + Cl 2 (г) | Разложение |
| CuSO 4 ( a q) + Fe (s) | FeSO 4 (водн.) + Cu (т.) | Рабочий объем |
| H 2 O (л) + CO 2 (г) | H 2 CO 3 (водн.) | Комбинация |
Просмотреть решения NCERT для всех глав класса 10
Калькулятор балансировки химического уравнения | Онлайн-балансировщик
Введение в балансировщик химических уравнений
Калькулятор химических уравнений балансировки работает разумно, так как есть искусственный интеллект.Это онлайн-инструмент, который работает в цифровом формате и дает быстрые результаты. Калькулятор уравнений балансировки выполняет функцию балансировки данного уравнения, а также рассчитывает коэффициенты.
Используется алгоритм исключения Гаусса-Жордана, но с небольшими изменениями. Калькулятор химических уравнений балансировки бесплатный и простой в использовании.
Вы можете использовать калькулятор уравнений балансировки для онлайн-расчетов или найти полное руководство по балансировке химических уравнений с примерами.
Связано: Узнайте, что подразумевается под химическим выходом и сколько типов выхода у нас есть в химии.
Что такое химическое уравнение?
Химическое уравнение показывает общее химическое превращение реагентов в продукты. Реагенты – это то, с чего вы начинаете, а продукты – это то, что образуется. Есть два способа написания химических уравнений: словесное уравнение и символьное уравнение. Точно так же вы можете рассчитать его вручную или с помощью калькулятора химического уравнения.
$$ \ text {NaOH} \; \; + \; \; \ text {HCl} \; \ rightarrow \; $$
$$ \ text {NaCl} \; \; + \; \; H_2O $$
Гидроксид натрия (NaOH)
Соляная кислота (HCl)
Хлорид натрия (NaCl)
Вода (H 2 O)
Онлайн-калькулятор химических уравнений баланса позволяет мгновенно сбалансировать химические уравнения.
Как записывается химическое уравнение?
При написании химического уравнения реагенты находятся слева перед стрелкой, а продукты – справа. Это остается неизменным при использовании калькулятора сбалансированных уравнений. Стрелка —> показывает, что реакция необратима. Он показывает направление реакции. Знак плюс указывает на то, что на каждой стороне уравнения присутствует более одного реагента или продукта.
Словесное уравнение дает хорошее резюме, а символьное уравнение дает более подробную информацию.Он показывает больше информации и позволяет нам увидеть, сколько атомов и молекул участвует в каждой реакции. Те, кто все еще борется с этой концепцией, должны использовать преобразование словесных уравнений в химические уравнения и выучить их полностью.
Чтобы узнать больше о молекулах, воспользуйтесь нашим калькулятором граммов в молекулы. Или, если вы хотите узнать о доле молей, у нас также есть калькулятор мольных соотношений для вашего обучения и практики.
Как сбалансировать химическое уравнение?
Если мы смешаем железо (Fe) с двумя молекулами кислорода (O 2 ) вместе, вы получите соединение (Fe 2 O 3 ) и то, что обычно называют ржавчиной.Итак, это хороший пример, показывающий, что происходит, когда вы оставляете свой велосипед под дождем.
Велосипед в основном состоит из стали. Сталь чиста на 95%, но железо смешивается с дождем, который представляет собой просто воду, а вода содержит кислород. Итак, железо и кислород соединяются вместе, и тогда вы получаете это раздражающее коричневое вещество на вашем велосипеде, которое представляет собой Fe 2 O 3 , и вы знаете его как ржавчину.
$$ \ text {Fe} \; \; + \; \; O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Чтобы сбалансировать это уравнение вручную без использования балансировщика уравнений, нам нужно иметь такое же количество железа в левой части, что и в правой части.Итак, с левой стороны у него один атом железа, а с правой стороны – два атома железа. Чтобы сделать их равными, добавьте количество двух молекул в левой части.
$$ \ text {2Fe} \; \; + \; \; O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Итак, сделаем то же самое с кислородом. С левой стороны у нас есть два атома кислорода, но с правой стороны у нас есть три атома кислорода. Нам нужно сделать это равным, но калькулятор произведения химического уравнения автоматически сделает это.Итак, на левую часть нанесены два атома кислорода с полуторными молекулами.
$$ \ text {2Fe} \; \; + \; \; 1.5O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Теперь у нас есть то же точное количество железа и кислорода в левой части, что и в правой части. Но мы возвращаемся с проблемой, потому что никогда не бывает половины молекулы.
Но мы заметили, что здесь у нас есть полторы молекулы кислорода. Мы также можем найти молекулярную массу онлайн с помощью калькулятора молекулярной массы.Так как же нам избавиться от этой половины молекулы? Ответ на этот вопрос – умножить обе части на два.
Теперь у нас есть сбалансированное химическое уравнение. Калькулятор химического уравнения продукта работает с той же формулой и процедурой. Чтобы узнать о периоде полураспада элемента или вещества, попробуйте калькулятор периодов полураспада, чтобы вы могли практиковаться во время выполнения.
Связано: Узнайте, как уравновесить окислительно-восстановительную реакцию в основной среде?
Как использовать калькулятор балансировки химического уравнения?
Calculatored предлагает множество онлайн-инструментов и калькуляторов, а наш калькулятор уравнений баланса бесплатный и простой в использовании.С помощью нашего калькулятора химической реакции вы легко сможете сбалансировать уравнение. Просто введите свое несбалансированное уравнение в полосе ввода и нажмите «БАЛАНС». Избегайте ненужных пробелов.
Есть еще один способ сбалансировать ваше уравнение, используя наш калькулятор балансирующих химических уравнений. У нас есть периодическая таблица, помещенная в наш калькулятор химических уравнений, просто нажмите на значения и нажмите кнопку «БАЛАНС» нашего калькулятора химического балансира, чтобы получить необходимые результаты.
Мы надеемся, что вам понравился наш калькулятор балансировки химических уравнений.Помимо нашего балансировщика химических уравнений, у нас также есть другие онлайн-калькуляторы, связанные с химией.
Если вы хотите рассчитать теоретическую доходность по ее формуле, просто воспользуйтесь нашим калькулятором теоретической доходности. Или, если вы хотите узнать, что такое процентная доходность и как ее рассчитать, попробуйте воспользоваться бесплатным онлайн-калькулятором процентной доходности.
Пожалуйста, поделитесь с нами своими ценными отзывами, чтобы мы могли постоянно улучшаться.
4.1 Написание и балансировка химических уравнений – химия
Цели обучения
К концу этого раздела вы сможете:
- Получите химические уравнения из повествовательных описаний химических реакций.
- Напишите и сбалансируйте химические уравнения в молекулярном, общем ионном и чистом ионном форматах.
В предыдущей главе было представлено использование символов элементов для представления отдельных атомов. Когда атомы приобретают или теряют электроны, чтобы образовать ионы, или объединяются с другими атомами для образования молекул, их символы изменяются или объединяются для создания химических формул, которые надлежащим образом представляют эти частицы. Расширение этой символики для представления как идентичностей, так и относительных количеств веществ, претерпевающих химические (или физические) изменения, включает в себя написание и уравновешивание химического уравнения .Рассмотрим в качестве примера реакцию между одной молекулой метана (CH 4 ) и двумя молекулами двухатомного кислорода (O 2 ) с образованием одной молекулы диоксида углерода (CO 2 ) и двух молекул воды (H 2 O). . Химическое уравнение, представляющее этот процесс, представлено в верхней половине рисунка 1, а молекулярные модели, заполняющие пространство, показаны в нижней половине рисунка.
Рис. 1. Реакция между метаном и кислородом с образованием диоксида углерода и воды (показана внизу) может быть представлена химическим уравнением с использованием формул (вверху).Этот пример иллюстрирует фундаментальные аспекты любого химического уравнения:
- Вещества, вступающие в реакцию, называются реагентами , а их формулы помещаются в левой части уравнения.
- Вещества, образующиеся в результате реакции, называются продуктами , а их формулы помещаются в правом поле зрения уравнения.
- Знак плюс (+) разделяет формулы отдельных реагентов и продуктов, а стрелка (⟶) разделяет реагент и продукт (левую и правую) части уравнения.
- Относительные количества реагентов и продуктов представлены коэффициентами (числа расположены непосредственно слева от каждой формулы). Коэффициент 1 обычно не указывается.
Обычно в химическом уравнении используются минимально возможные целочисленные коэффициенты, как это сделано в этом примере. Однако следует понимать, что эти коэффициенты представляют собой относительных количеств реагентов и продуктов, и, следовательно, их можно правильно интерпретировать как отношения.Метан и кислород реагируют с образованием диоксида углерода и воды в соотношении 1: 2: 1: 2. Это соотношение выполняется, если количество этих молекул составляет соответственно 1-2-1-2, или 2-4-2-4, или 3-6-3-6 и так далее (Рисунок 2). Аналогичным образом, эти коэффициенты можно интерпретировать относительно любой единицы количества (числа), и поэтому это уравнение можно правильно прочитать многими способами, включая:
- Одна молекула метана и две молекулы кислорода вступают в реакцию с образованием одной молекулы диоксида углерода и двух молекул воды.
- Одна дюжина молекул метана и две дюжины молекул кислорода вступают в реакцию с образованием одной дюжины молекул углекислого газа и двух дюжин молекул воды.
- Один моль молекул метана и 2 моля молекул кислорода реагируют с образованием 1 моль молекул углекислого газа и 2 моль молекул воды.
Химическое уравнение, описанное в разделе 4.1, имеет вид сбалансированного , что означает, что равное количество атомов для каждого элемента, участвующего в реакции, представлено на сторонах реагента и продукта. Это требование, которому уравнение должно удовлетворять, чтобы соответствовать закону сохранения материи. Это можно подтвердить, просто суммируя количество атомов по обе стороны от стрелки и сравнивая эти суммы, чтобы убедиться, что они равны. Обратите внимание, что количество атомов для данного элемента рассчитывается путем умножения коэффициента любой формулы, содержащей этот элемент, на нижний индекс элемента в формуле.Если элемент присутствует более чем в одной формуле на данной стороне уравнения, количество атомов, представленных в каждой, необходимо вычислить, а затем сложить. Например, оба продукта реакции, CO 2 и H 2 O, содержат элемент кислород, поэтому количество атомов кислорода на стороне продукта уравнения составляет
[латекс] (1 \; \ text {CO} _2 \; \ text {молекула} \ times \ frac {2 \; \ text {O atom}} {\ text {CO} _2 \; \ text {молекула} }) + (2 \; \ text {H} _2 \ text {молекула O} \ times \ frac {1 \; \ text {атом O}} {\ text {H} _2 \ text {молекула O}}) = 4 \; \ text {O atom} [/ latex]
Подтверждено, что уравнение реакции между метаном и кислородом с образованием диоксида углерода и воды сбалансировано в соответствии с этим подходом, как показано здесь:
[латекс] \ text {CH} _4 + 2 \ text {O} _2 \ longrightarrow \ text {CO} _2 + 2 \ text {H} _2 \ text {O} [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| С | 1 × 1 = 1 | 1 × 1 = 1 | 1 = 1, да |
| H | 4 × 1 = 4 | 2 × 2 = 4 | 4 = 4, да |
| O | 2 × 2 = 4 | (1 × 2) + (2 × 1) = 4 | 4 = 4, да |
| Таблица 1. | |||
Сбалансированное химическое уравнение часто можно вывести из качественного описания некоторой химической реакции с помощью довольно простого подхода, известного как балансирование путем проверки. Рассмотрим в качестве примера разложение воды с образованием молекулярного водорода и кислорода. Этот процесс качественно представлен несбалансированным химическим уравнением :
[латекс] \ text {H} _2 \ text {O} \ longrightarrow \ text {H} _2 + \ text {O} _2 \; (\ text {unbalanced}) [/ latex]
Сравнение количества атомов H и O по обе стороны от этого уравнения подтверждает его дисбаланс:
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, да |
| O | 1 × 1 = 1 | 1 × 2 = 2 | 1 ≠ 2, № |
| Таблица 2. | |||
Количество атомов H в реагирующей и продуктивной частях уравнения равно, а количество атомов O – нет. Для достижения баланса коэффициентов уравнения могут быть изменены по мере необходимости. Имейте в виду, конечно, что индексы формулы определяют, частично, идентичность вещества, и поэтому они не могут быть изменены без изменения качественного смысла уравнения. Например, изменение формулы реагента с H 2 O на H 2 O 2 приведет к сбалансированному количеству атомов, но при этом также изменится идентичность реагента (теперь это перекись водорода, а не вода).Баланс атомов O может быть достигнут путем изменения коэффициента для H 2 O на 2.
[латекс] 2 \ text {H} _2 \ text {O} \ longrightarrow \ text {H} _2 + \ text {O} _2 \; (\ text {unbalanced}) [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 2 × 2 = 4 | 1 × 2 = 2 | 4 ≠ 2, № |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, да |
| Таблица 3. | |||
Баланс атомов H был нарушен этим изменением, но его легко восстановить, изменив коэффициент для произведения H 2 на 2.
[латекс] 2 \ text {H} _2 \ text {O} \ longrightarrow 2 \ text {H} _2 + \ text {O} _2 \; (\ text {сбалансированный}) [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| H | 2 × 2 = 4 | 2 × 2 = 4 | 4 = 4, да |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, да |
| Таблица 4. | |||
Эти коэффициенты дают равное количество атомов H и O на сторонах реагента и продукта, поэтому сбалансированное уравнение имеет вид:
[латекс] 2 \ text {H} _2 \ text {O} \ longrightarrow 2 \ text {H} _2 + \ text {O} _2 [/ latex]
Пример 1
Уравновешивающие химические уравнения
Напишите уравненное уравнение реакции молекулярного азота (N 2 ) и кислорода (O 2 ) с образованием пентоксида диазота.
Решение
Сначала напишите уравнение несбалансированности.
[латекс] \ text {N} _2 + \ text {O} _2 \ longrightarrow \ text {N} _2 \ text {O} _5 \; (\ text {unbalanced}) [/ latex]
Затем подсчитайте количество атомов каждого типа, присутствующих в несбалансированном уравнении.
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| № | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, да |
| O | 1 × 2 = 2 | 1 × 5 = 5 | 2 ≠ 5, № |
| Таблица 5. | |||
Хотя азот уравновешен, изменения коэффициентов необходимы, чтобы уравновесить количество атомов кислорода. Чтобы сбалансировать количество атомов кислорода, разумной первой попыткой было бы изменить коэффициенты для O 2 и N 2 O 5 на целые числа, которые дадут 10 атомов O (наименьшее общее кратное для атома O индексы в этих двух формулах).
[латекс] \ text {N} _2 + 5 \ text {O} _2 \ longrightarrow 2 \ text {N} _2 \ text {O} _5 \; (\ text {unbalanced}) [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| № | 1 × × 2 = 2 | 2 × 2 = 4 | 2 ≠ 4, № |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, да |
| Таблица 6. | |||
Баланс атомов азота был нарушен этим изменением; восстанавливается изменением коэффициента для реагента N 2 на 2.
[латекс] 2 \ text {N} _2 + 5 \ text {O} _2 \ longrightarrow 2 \ text {N} _2 \ text {O} _5 [/ latex]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| № | 2 × 2 = 4 | 2 × 2 = 4 | 4 = 4, да |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, да |
| Таблица 7. | |||
Число атомов N и O по обе стороны уравнения теперь равно, и уравнение сбалансировано.
Проверьте свои знания
Напишите сбалансированное уравнение разложения нитрата аммония с образованием молекулярного азота, молекулярного кислорода и воды. (Подсказка: балансируйте кислород в последнюю очередь, поскольку он присутствует более чем в одной молекуле в правой части уравнения.)
Ответ:
[латекс] 2 \ text {NH} _4 \ text {NO} _3 \ longrightarrow 2 \ text {N} _2 + \ text {O} _2 + 4 \ text {H} _2 \ text {O} [/ latex]
Иногда удобно использовать дроби вместо целых чисел в качестве промежуточных коэффициентов в процессе балансировки химического уравнения.Когда баланс достигнут, все коэффициенты уравнения можно затем умножить на целое число, чтобы преобразовать дробные коэффициенты в целые числа без нарушения атомного баланса. Например, рассмотрим реакцию этана (C 2 H 6 ) с кислородом с образованием H 2 O и CO 2 , представленных несбалансированным уравнением:
[латекс] \ text {C} _2 \ text {H} _6 + \ text {O} _2 \ longrightarrow \ text {H} _2 \ text {O} + \ text {C} \ text {O} _2 \; (\ text {unbalanced}) [/ latex]
Следуя обычному подходу к проверке, можно сначала уравновесить атомы C и H, изменив коэффициенты для двух видов продукта, как показано:
[латекс] \ text {C} _2 \ text {H} _6 + \ text {O} _2 \ longrightarrow 3 \ text {H} _2 \ text {O} + 2 \ text {C} \ text {O} _2 \; (\ text {unbalanced}) [/ latex]
Это приводит к семи атомам O на стороне продукта уравнения, нечетному числу – нельзя использовать целочисленный коэффициент с реагентом O 2 для получения нечетного числа, поэтому дробный коэффициент, [латекс] \ frac {7 } {2} [/ latex] используется вместо этого для получения предварительного сбалансированного уравнения:
[латекс] \ text {C} _2 \ text {H} _6 + \ frac {7} {2} \ text {O} _2 \ longrightarrow 3 \ text {H} _2 \ text {O} + 2 \ text { C} \ text {O} _2 \; [/ латекс]
Обычное сбалансированное уравнение с коэффициентами только для целых чисел получается путем умножения каждого коэффициента на 2:
.[латекс] 2 \ text {C} _2 \ text {H} _6 + 7 \ text {O} _2 \ longrightarrow 6 \ text {H} _2 \ text {O} + 4 \ text {C} \ text {O } _2 \; [/ латекс]
Наконец, что касается сбалансированных уравнений, напомним, что соглашение диктует использование наименьших целочисленных коэффициентов .Хотя уравнение реакции между молекулярным азотом и молекулярным водородом с образованием аммиака действительно сбалансировано,
[латекс] 3 \ text {N} _2 + 9 \ text {H} _2 \ longrightarrow 6 \ text {N} \ text {H} _3 [/ latex]
коэффициенты не являются наименьшими возможными целыми числами, представляющими относительное количество молекул реагента и продукта. Разделив каждый коэффициент на наибольший общий множитель, 3, мы получим предпочтительное уравнение:
[латекс] \ text {N} _2 + 3 \ text {H} _2 \ longrightarrow 2 \ text {N} \ text {H} _3 [/ latex]
Воспользуйтесь этим интерактивным учебным пособием, чтобы попрактиковаться в уравнениях балансировки.
Физические состояния реагентов и продуктов в химических уравнениях очень часто указываются с аббревиатурой в скобках после формул. Общие сокращения включают s для твердых веществ, l для жидкостей, g для газов и aq для веществ, растворенных в воде ( водных растворов , как было введено в предыдущей главе). Эти обозначения проиллюстрированы здесь в примере уравнения:
[латекс] 2 \ text {Na} (s) + 2 \ text {H} _2 \ text {O} (l) \ longrightarrow 2 \ text {NaOH} (aq) + \ text {H} _2 (g) [/ латекс]
Это уравнение представляет реакцию, протекающую при помещении металлического натрия в воду.Твердый натрий реагирует с жидкой водой с образованием газообразного молекулярного водорода и ионного соединения гидроксида натрия (твердое вещество в чистой форме, но легко растворяется в воде).
Особые условия, необходимые для реакции, иногда обозначаются написанием слова или символа над или под стрелкой уравнения. Например, реакция, проводимая при нагревании, может быть обозначена прописной греческой буквой дельта (Δ) над стрелкой.
[латекс] \ text {CaCO} _3 (s) \; \ xrightarrow {\ Delta} \; \ text {CaO} (s) + \ text {CO} _2 (г) [/ латекс]
Другие примеры этих особых условий будут рассмотрены более подробно в следующих главах.
Учитывая обилие воды на Земле, само собой разумеется, что очень много химических реакций происходит в водных средах. Когда ионы участвуют в этих реакциях, химические уравнения могут быть записаны с различными уровнями детализации, соответствующими их предполагаемому использованию. Чтобы проиллюстрировать это, рассмотрим реакцию между ионными соединениями, протекающую в водном растворе. При смешивании водных растворов CaCl 2 и AgNO 3 происходит реакция с образованием водного Ca (NO 3 ) 2 и твердого AgCl:
.[латекс] \ text {CaCl} _2 (aq) + 2 \ text {AgNO} _3 (aq) \ longrightarrow \ text {Ca (NO} _3) _2 (aq) + 2 \ text {AgCl} (s) [ / латекс]
Это сбалансированное уравнение, полученное обычным способом, называется молекулярным уравнением , потому что оно не представляет явным образом ионные частицы, присутствующие в растворе.{-} (водн.) + 2 \ text {AgCl} (s) [/ latex]
Изучение этого уравнения показывает, что два химических вещества присутствуют в идентичной форме по обе стороны стрелки: Ca 2+ ( водн. ) и NO3- (водн.) .NO3- (водн.). Эти ионы-наблюдатели – ионы, присутствие которых требуется для поддержания нейтральности заряда – ни химически, ни физически не изменяются в процессе, поэтому их можно исключить из уравнения, чтобы получить более сжатое представление, называемое чистым ионным уравнением :
[латекс] \ правило [0.{+} (aq) \ longrightarrow \ text {AgCl} (s) [/ latex]
Это чистое ионное уравнение показывает, что твердый хлорид серебра может быть получен из растворенных ионов хлорида и серебра (I), независимо от источника этих ионов. Эти молекулярные и полные ионные уравнения предоставляют дополнительную информацию, а именно об ионных соединениях, используемых в качестве источников Cl – и Ag + .
Пример 2
Молекулярные и ионные уравнения
Когда диоксид углерода растворяется в водном растворе гидроксида натрия, смесь реагирует с образованием водного карбоната натрия и жидкой воды.Напишите сбалансированные молекулярные, полные ионные и чистые ионные уравнения для этого процесса.
Решение
Начните с определения формул для реагентов и продуктов и их правильного расположения в форме химического уравнения:
[латекс] \ text {CO} _2 (aq) + \ text {NaOH} (aq) \ longrightarrow \ text {Na} _2 \ text {CO} _3 (aq) + \ text {H} _2 \ text {O } (l) \; (\ text {unbalanced}) [/ latex]
В этом случае баланс легко достигается путем изменения коэффициента для NaOH на 2, в результате чего получается молекулярное уравнение для этой реакции:
[латекс] \ text {CO} _2 (aq) + 2 \ text {NaOH} (aq) \ longrightarrow \ text {Na} _2 \ text {CO} _3 (aq) + \ text {H} _2 \ text { O} (l) [/ латекс]
Два растворенных ионных соединения, NaOH и Na 2 CO 3 , можно представить как диссоциированные ионы, чтобы получить полное ионное уравнение:
[латекс] \ text {CO} _2 (aq) + 2 \ text {Na} ^ {+} (aq) + 2 \ text {OH} ^ {-} (aq) \ longrightarrow 2 \ text {Na} ^ {+} (aq) + {\ text {CO} _3} ^ {2 -} (aq) + \ text {H} _2 \ text {O} (l) [/ latex]
Наконец, определите ион-наблюдатель, в данном случае Na + ( водн. ), и удалите его с каждой стороны уравнения, чтобы получить чистое ионное уравнение:
[латекс] \ text {CO} _2 (aq) + \ rule [0.{2 -} (aq) + \ text {H} _2 \ text {O} (l) [/ latex]
Проверьте свои знания
Двухатомный хлор и гидроксид натрия (щелок) – это химические продукты, производимые в больших количествах вместе с двухатомным водородом в результате электролиза рассола в соответствии со следующим несбалансированным уравнением:
[латекс] \ text {NaCl} (aq) + \ text {H} _2 \ text {O} (l) \; \; \ xrightarrow {\ text {электричество}} \; \; \ text {NaOH} (водн.) + \ text {H} _2 (g) + \ text {Cl} _2 (g) [/ latex]
Напишите сбалансированные молекулярные, полные ионные и чистые ионные уравнения для этого процесса.{-} (aq) + 2 \ text {H} _2 (g) + \ text {Cl} _2 (g) (\ text {net ionic}) [/ latex]
Химические уравнения являются символическим отображением химических и физических изменений. Формулы для веществ, претерпевающих изменение (реагенты), и веществ, образующихся в результате изменения (продукты), разделены стрелкой, и им предшествуют целочисленные коэффициенты, указывающие их относительные числа. Сбалансированные уравнения – это уравнения, коэффициенты которых приводят к равному количеству атомов для каждого элемента в реагентах и продуктах.Химические реакции в водном растворе, в которых участвуют ионные реагенты или продукты, могут быть более реалистично представлены полными ионными уравнениями и, более кратко, чистыми ионными уравнениями.
Химия: упражнения в конце главы
- Что значит сказать, что уравнение сбалансировано? Почему важно, чтобы уравнение было сбалансированным?
- Рассмотрите молекулярные, полные ионные и чистые ионные уравнения.
(а) В чем разница между этими типами уравнений?
(b) При каких обстоятельствах полное и чистое ионные уравнения реакции будут идентичны?
- Уравновесите следующие уравнения:
(a) [латекс] \ text {PCl} _5 (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {POCl} _3 (l) + \ text {HCl} (aq ) [/ латекс]
(b) [латекс] \ text {Cu} (s) + \ text {HNO} _3 (aq) \ longrightarrow \ text {Cu (NO} _3) _2 (aq) + \ text {H} _2 \ text { O} (l) + \ text {NO} (g) [/ latex]
(c) [латекс] \ text {H} _2 (g) + \ text {I} _2 (s) \ longrightarrow \ text {HI} (s) [/ latex]
(d) [латекс] \ text {Fe} (s) + \ text {O} _2 (g) \ longrightarrow \ text {Fe} _2 \ text {O} _3 (s) [/ latex]
(e) [латекс] \ text {Na} (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {NaOH} (aq) + \ text {H} _2 (g) [/ латекс]
(f) [латекс] \ text {(NH} _4) _2 \ text {Cr} _2 \ text {O} _7 (s) \ longrightarrow \ text {Cr} _2 \ text {O} _3 (s) + \ текст {N} _2 (g) + \ text {H} _2 \ text {O} (g) [/ latex]
(г) [латекс] \ text {P} _4 (s) + \ text {Cl} _2 (g) \ longrightarrow \ text {PCl} _3 (l) [/ латекс]
(h) [латекс] \ text {PtCl} _4 (s) \ longrightarrow \ text {Pt} (s) + \ text {Cl} _2 (g) [/ latex]
- Уравновесите следующие уравнения:
(a) [латекс] \ text {Ag} (s) + \ text {H} _2 \ text {S} (g) + \ text {O} _2 (g) \ longrightarrow \ text {Ag} _2 \ text {S} (s) + \ text {H} _2 \ text {O} (l) [/ latex]
(b) [латекс] \ text {P} _4 (s) + \ text {O} _2 (g) \ longrightarrow \ text {P} _4 \ text {O} _ {10} (s) [/ latex]
(c) [латекс] \ text {Pb} (s) + \ text {H} _2 \ text {O} (l) + \ text {O} _2 (g) \ longrightarrow \ text {Pb (OH)} _2 (s) [/ латекс]
(d) [латекс] \ text {Fe} (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {Fe} _3 \ text {O} _4 (s) + \ text {H} _2 (г) [/ латекс]
(e) [латекс] \ text {Sc} _2 \ text {O} _3 (s) + \ text {SO} _3 (l) \ longrightarrow \ text {Sc} _2 \ text {(SO} _4) _3 ( s) [/ латекс]
(f) [латекс] \ text {Ca} _3 \ text {(PO} _4) _2 (aq) + \ text {H} _3 \ text {PO} _4 (aq) \ longrightarrow \ text {Ca (H} _2 \ text {PO} _4) _2 (водн.) [/ Латекс]
(г) [латекс] \ text {Al} (s) + \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {Al} _2 \ text {(SO} _4) _3 (s ) + \ text {H} _2 (g) [/ латекс]
(h) [латекс] \ text {TiCl} _4 (s) + \ text {H} _2 \ text {O} (g) \ longrightarrow \ text {TiO} _2 (s) + \ text {HCl} (g ) [/ латекс]
- Напишите сбалансированное молекулярное уравнение, описывающее каждую из следующих химических реакций.
(a) Твердый карбонат кальция нагревается и разлагается на твердый оксид кальция и газообразный диоксид углерода.
(b) Газообразный бутан, C 4 H 10 , реагирует с газообразным двухатомным кислородом с образованием газообразного диоксида углерода и водяного пара.
(c) Реакция взаимодействия водных растворов хлорида магния и гидроксида натрия с образованием твердого гидроксида магния и водного хлорида натрия.
(d) Водяной пар реагирует с металлическим натрием с образованием твердого гидроксида натрия и газообразного водорода.
- Напишите сбалансированное уравнение, описывающее каждую из следующих химических реакций.
(a) Твердый хлорат калия, KClO 3 , разлагается с образованием твердого хлорида калия и газообразного двухатомного кислорода.
(b) Твердый металлический алюминий реагирует с твердым двухатомным йодом с образованием твердого Al 2 I 6 .
(c) Когда твердый хлорид натрия добавляют к водной серной кислоте, образуются газообразный хлористый водород и водный сульфат натрия.
(d) Реакция взаимодействия водных растворов фосфорной кислоты и гидроксида калия с образованием водного дигидрофосфата калия и жидкой воды.
- Красочный фейерверк часто связан с разложением нитрата бария и хлората калия и реакцией металлов, магния, алюминия и железа с кислородом.
(а) Напишите формулы нитрата бария и хлората калия.
(b) Разложение твердого хлората калия приводит к образованию твердого хлорида калия и газообразного двухатомного кислорода. Напишите уравнение реакции.
(c) Разложение твердого нитрата бария приводит к образованию твердого оксида бария, газообразного двухатомного азота и газообразного двухатомного кислорода.Напишите уравнение реакции.
(d) Напишите отдельные уравнения реакций твердых металлов магния, алюминия и железа с газообразным двухатомным кислородом с образованием соответствующих оксидов металлов. (Предположим, что оксид железа содержит ионы Fe 3+ .)
- Заполните пробел единственной химической формулой ковалентного соединения, которая уравновесит уравнение:
- Водный фтороводород (плавиковая кислота) используется для травления стекла и анализа минералов на содержание кремния.Фтороводород также вступает в реакцию с песком (диоксид кремния).
(a) Напишите уравнение реакции твердого диоксида кремния с плавиковой кислотой с образованием газообразного тетрафторида кремния и жидкой воды.
(b) Минерал флюорит (фторид кальция) широко встречается в Иллинойсе. Твердый фторид кальция можно также получить реакцией водных растворов хлорида кальция и фторида натрия с получением водного хлорида натрия в качестве другого продукта. Напишите полные и чистые ионные уравнения для этой реакции.
- Новый способ получения магния из морской воды включает несколько реакций. Напишите сбалансированное химическое уравнение для каждого этапа процесса.
(a) Первым этапом является разложение твердого карбоната кальция из морских ракушек с образованием твердого оксида кальция и газообразного диоксида углерода.
(b) Вторая стадия – это образование твердого гидроксида кальция как единственного продукта реакции твердого оксида кальция с жидкой водой.
(c) Затем к морской воде добавляют твердый гидроксид кальция, который реагирует с растворенным хлоридом магния с образованием твердого гидроксида магния и водного хлорида кальция.
(d) Твердый гидроксид магния добавляют к раствору соляной кислоты, получая растворенный хлорид магния и жидкую воду.
(e) Наконец, хлорид магния плавится и электролизуется с получением жидкого металлического магния и газообразного двухатомного хлора.
- Из сбалансированных молекулярных уравнений напишите полные ионные и чистые ионные уравнения для следующего:
(a) [латекс] \ text {K} _2 \ text {C} _2 \ text {O} _4 (aq) + \ text {Ba (OH)} _ 2 (aq) \ longrightarrow 2 \ text {KOH} ( aq) + \ text {BaC} _2 \ text {O} _2 (s) [/ latex]
(b) [латекс] {\ text {Pb (NO} _3)} _ 2 (aq) + \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {PbSO} _4 (s) + 2 \ text {HNO} _3 (aq) [/ latex]
(c) [латекс] \ text {CaCO} _3 (s) + \ text {H} _2 \ text {SO} _4 (aq) \ longrightarrow \ text {CaSO} _4 (s) + \ text {CO} _2 (g) + \ text {H} _2 \ text {O} (l) [/ latex]
Глоссарий
- вычисленное уравнение
- химическое уравнение с равным числом атомов для каждого элемента в реагенте и продукте
- химическое уравнение
- символическое изображение химической реакции
- коэффициент Число
- перед символами или формулами в химическом уравнении для обозначения их относительного количества
- полное ионное уравнение
- химическое уравнение, в котором все растворенные ионные реагенты и продукты, включая ионы-наблюдатели, явно представлены формулами для их диссоциированных ионов
- молекулярное уравнение
- химическое уравнение, в котором все реагенты и продукты представлены как нейтральные вещества
- чистое ионное уравнение
- химическое уравнение, в котором представлены только те растворенные ионные реагенты и продукты, которые претерпевают химические или физические изменения (исключая ионы-наблюдатели)
- товар
- вещество, образовавшееся в результате химического или физического изменения; показано справа от стрелки в химическом уравнении
- реагент
- вещество, подвергающееся химическому или физическому изменению; показано слева от стрелки в химическом уравнении
- спектатор ион
- ион, который не претерпевает химических или физических изменений во время реакции, но его присутствие необходимо для поддержания нейтральности заряда
Решения
Ответы на упражнения по химии в конце главы
1.Уравнение сбалансировано, когда одинаковое количество каждого элемента представлено на сторонах реагента и продукта. Уравнения должны быть сбалансированы, чтобы точно отражать закон сохранения материи.
3.
(a) [латекс] \ text {PCl} _5 (s) + \ text {H} _2 \ text {O} (l) \ longrightarrow \ text {POCl} _3 (l) + 2 \ text {HCl} ( водн.) [/ латекс];
(b) [латекс] 3 \ text {Cu} (s) + 8 \ text {HNO} _3 (aq) \ longrightarrow 3 \ text {Cu (NO} _3) _2 (aq) + 4 \ text {H} _2 \ text {O} (l) + 2 \ text {NO} (g) [/ latex];
(c) [латекс] \ text {H} _2 (g) + \ text {I} _2 (s) \ longrightarrow 2 \ text {HI} (s) [/ latex];
(d) [латекс] 4 \ text {Fe} (s) + 3 \ text {O} _2 (g) \ longrightarrow 2 \ text {Fe} _2 \ text {O} _3 (s) [/ latex];
(e) [латекс] 2 \ text {Na} (s) + 2 \ text {H} _2 \ text {O} (l) \ longrightarrow 2 \ text {NaOH} (aq) + \ text {H} _2 (ж) [/ латекс];
(f) [латекс] \ text {(NH} _4) _2 \ text {Cr} _2 \ text {2O} _7 (s) \ longrightarrow \ text {Cr} _2 \ text {O} _3 (s) + \ текст {N} _2 (g) + 4 \ text {H} _2 \ text {O} (l) [/ latex];
(г) [латекс] \ text {P} _4 (s) + 6 \ text {Cl} _2 (g) \ longrightarrow 4 \ text {PCl} _3 (l) [/ latex];
(h) [латекс] \ text {PtCl} _4 (s) \ longrightarrow \ text {Pt} (s) + 2 \ text {Cl} _2 (g) [/ latex];
5.
(a) [латекс] \ text {CaCO} _3 (s) \ longrightarrow \ text {CaO} (s) + \ text {CO} _2 (g) [/ latex];
(b) [латекс] 2 \ text {C} _4 \ text {H} _ {10} (g) + 13 \ text {O} _2 (g) \ longrightarrow 8 \ text {CO} _2 (g) + 10 \ text {H} _2 \ text {O} (г) [/ латекс];
(c) [латекс] \ text {MgCl} _ {2} (aq) + 2 \ text {NaOH} (aq) \ longrightarrow \ text {Mg (OH)} _ 2 (s) + 2 \ text {NaCl} (водн.) [/ латекс];
(d) [латекс] 2 \ text {H} _2 \ text {O} (g) + 2 \ text {Na} (s) \ longrightarrow 2 \ text {NaOH} (s) + \ text {H} _2 (ж) [/ латекс];
7.
(а) [латекс] \ text {Ba (NO} _3) _2 [/ латекс], [латекс] \ text {KClO} _3 [/ латекс];
(b) [латекс] 2 \ text {KClO} _3 (s) \ longrightarrow 2 \ text {KCl} (s) + 3 \ text {O} _2 (g) [/ latex];
(c) [латекс] 2 \ text {Ba (NO} _3) _2 (s) \ longrightarrow 2 \ text {BaO} (s) + 2 \ text {N} _2 (g) + 5 \ text {O} _2 (г) [/ латекс];
(d) [латекс] 2 \ text {Mg} (s) + \ text {O} _2 (g) \ longrightarrow 2 \ text {MgO} (s) [/ latex]; [латекс] 4 \ text {Al} (s) + 3 \ text {O} _2 (g) \ longrightarrow 2 \ text {Al} _2 \ text {O} _3 (g) [/ latex]; [латекс] 4 \ text {Fe} (s) + 3 \ text {O} _2 (g) \ longrightarrow 2 \ text {Fe} _2 \ text {O} _3 (s) [/ latex];
9.

 Ведь упражнения, которые вам задают выполнить в учебном заведении, понадобится вам в будущем на контрольных работах и экзаменах, и важно научиться решать их самому, ведь доступа к смартфону у вас, возможно, не будет.
Ведь упражнения, которые вам задают выполнить в учебном заведении, понадобится вам в будущем на контрольных работах и экзаменах, и важно научиться решать их самому, ведь доступа к смартфону у вас, возможно, не будет.
 В бесплатной — краткое решение и итоговый ответ, есть немного рекламы. А пошаговое присутствует только в некоторых простых задачах.
В бесплатной — краткое решение и итоговый ответ, есть немного рекламы. А пошаговое присутствует только в некоторых простых задачах. Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду: Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.