Периодическая таблица – Простая англоязычная Википедия, бесплатная энциклопедия
Переключить оглавлениеПереключить оглавление
Из простой английской Википедии, бесплатной энциклопедии
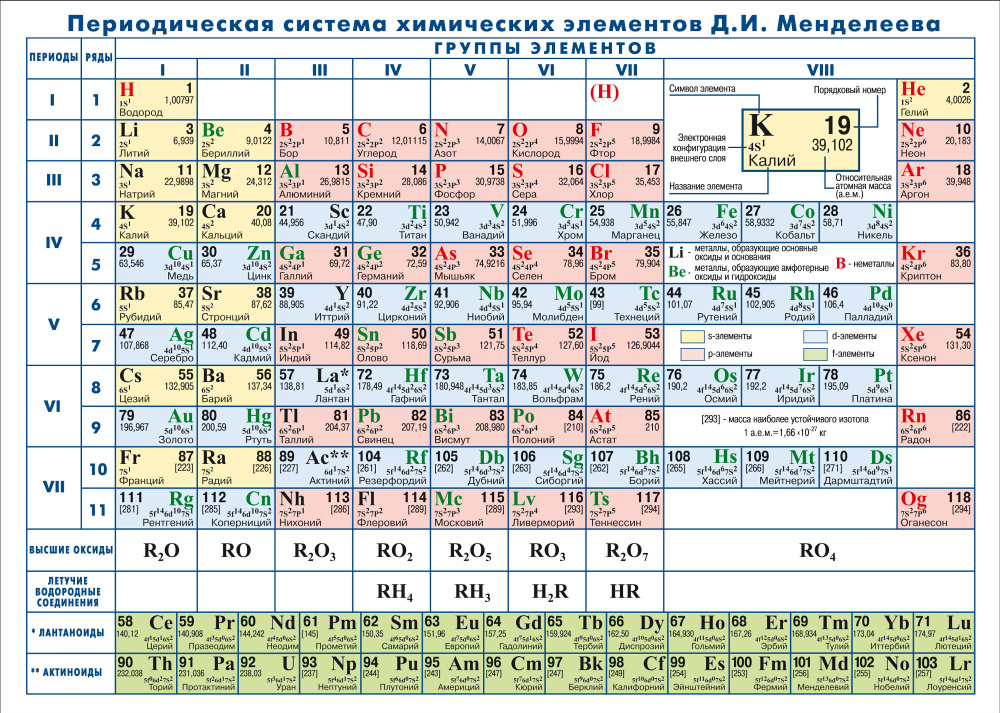
Периодическая таблица — это таблица, в которой все известные химические элементы расположены в определенном порядке. Элементы, имеющие схожие характеристики, часто располагают рядом друг с другом. В таблице элементы расположены в порядке их атомных номеров, начиная с наименьшего номера единицы, водорода. Атомный номер элемента равен количеству протонов в этом конкретном ядре атома. В периодической таблице элементы расположены в периоды и группы. Ряд элементов в таблице называется периодом . Каждый период имеет номер; от 1 до 8. В периоде 1 всего 2 элемента: водород и гелий. Период 2 и период 3 содержат по 8 элементов. Другие периоды длиннее. Элементы в периоде имеют последовательные атомные номера.
Стандартная таблица Менделеева
 В стандартной периодической таблице 18 групп. Каждая группа имеет номер: от 1 до 18. Элементы в группе имеют электроны, расположенные сходным образом, в соответствии с числом валентных электронов, что придает им сходные химические свойства (они ведут себя сходным образом). Например, группа 18 известна как благородные газы, потому что все они являются газами и не соединяются с другими атомами.
В стандартной периодической таблице 18 групп. Каждая группа имеет номер: от 1 до 18. Элементы в группе имеют электроны, расположенные сходным образом, в соответствии с числом валентных электронов, что придает им сходные химические свойства (они ведут себя сходным образом). Например, группа 18 известна как благородные газы, потому что все они являются газами и не соединяются с другими атомами.Существуют две системы нумерации групп; один с использованием арабских цифр (1,2,3), а другой с использованием римских цифр (I, II, III). Имена римскими цифрами использовались на протяжении большей части 20 века. В 1990 году Международный союз теоретической и прикладной химии (IUPAC) решил использовать новую систему с арабскими цифрами, чтобы заменить две старые системы групп, в которых использовались римские цифры.
Периодическая таблица использовалась химиками для наблюдения закономерностей и взаимосвязей между элементами. В Периодической таблице есть 3 основные группы; металлов, металлоидов и неметаллов. Например, элементы внизу и в крайнем левом углу таблицы являются наиболее металлическими, а элементы в правом верхнем углу — наименее металлическими. (например, цезий гораздо более металлический, чем гелий). Есть также много других закономерностей и отношений.
Например, элементы внизу и в крайнем левом углу таблицы являются наиболее металлическими, а элементы в правом верхнем углу — наименее металлическими. (например, цезий гораздо более металлический, чем гелий). Есть также много других закономерностей и отношений.
Периодическую таблицу изобрел русский химик Дмитрий Иванович Менделеев (1834–1907). В его честь был назван элемент 101 — менделевий.
| Группа → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Период | | |||||||||||||||||||
| 1 | 1 Н | | 2 Он | |||||||||||||||||
| 2 | 3 Ли | 4 Бе | | 5 Б | 6 С | 7 Н | 8 О | 9 Ф | 10 Не | |||||||||||
| 3 | 11 Нет | 12 мг | | 13 Ал | 14 Си | 15 П | 16 С | 17 Кл | 18 Ар | |||||||||||
| 4 | 19 К | 20 Ка | 21 Sc | 22 Ти | 23 В | 24 Кр | 25 Мн | 26 Fe | 27 Ко | 28 Никель | 29 Медь | 30 Цинк | 31 Га | 32 Ге | 33 Как | 34 Се | 35 Бр | 36 Кр | ||
| 5 | 37 руб.  | 38 Старший | 39 Д | 40 Зр | 41 НБ | 42 Мо | 43 Тк | 44 Ру | 45 Правая | 46 палладий | 47 Аг | 48 CD | 49 В | 50 Сн | 51 Сб | 52 Те | 53 Я | 54 Хе | ||
| 6 | 55 Цс | 56 Ба | * Лантаниды | 72 Хф | 73 Та | 74 Вт | 75 Ре | 76 Ос | 77 Ир | 78 Точка | 79 Золото | 80 рт.ст. | 81 Тл | 82 Pb | 83 Би | 84 ПО | 85 В | 86 р-н | ||
| 7 | 87 Пт | 88 Ра | ** Актиниды | 104 РФ | 105 Дб | 106 Сг | 107 Бх | 108 Гс | 109 Мт | 110 Дс | 111 Рг | 112 Сп | 113 Нх | 114 Фл | 115 Мк | 116 Ур.  | 117 Ц | 118 | ||
| 8 | 119 Ууэ | 120 Убн | ||||||||||||||||||
| | ||||||||||||||||||||
| * Серия лантанидов | 57 Ла | 58 Се | 59 Пр | 60 Нд | 61 м | 62 см | 63 ЕС | 64 Гд | 65 Тб | 66 краситель | 67 Хо | 68 Эр | 69 Тм | 70 Ыб | 71 Лу | |||||
| ** Серия актинидов | 89 Ас | 90 | 91 Па | 92 У | 93 Нп | 94 Пу | 95 утра | 96 см | 97 Бк | 98 См. | 99 Эс | 100 FM | 101 Мд | 102 Нет | 103 Лр | |||||
- Химический ряд периодической таблицы
Щелочные металлы
Щелочные земли
Лантаниды
Актиниды
Переходные металлы
Бедные металлы
Металлоиды/Полуметаллы/Полуметаллы
Галогены
Благородные газы
- Состояние при стандартной температуре и давлении.
 Цвет числа (атомного номера) над символом элемента показывает состояние элемента при нормальных условиях.
Цвет числа (атомного номера) над символом элемента показывает состояние элемента при нормальных условиях.
- синим цветом обозначены газы
- выделенные зеленым цветом жидкости
- черные – твердые
- Радиоактивность
Те, что со сплошными границами, имеют стабильные изотопы (первичные элементы)
Те, что обведены пунктиром, содержат только радиоактивные природные изотопы
Элементы с пунктирными границами не встречаются в природе (синтетические элементы)
Те, у кого нет границ, слишком радиоактивны, чтобы их можно было обнаружить.
Другие аранжировки Периодической таблицы[изменить | change source]
Показанная выше версия периодической таблицы является наиболее используемой. Другие распространенные версии показаны ниже:
Теодор Бенфей расположил элементы по спирали вокруг водорода. Атомный вес определяет положение элемента.

Дмитрий Иванович Менделеев использовал цветочную композицию; Актиниды, лантаноиды показаны в виде петель рядом с основной группой.
Тимоти Стоув расположил элементы по квантовому числу.
Беттерман упорядочил элементы по их изоэлектрическим свойствам, которые можно преобразовать в полиномиальную форму.
Треугольная версия Zmaczynski and Bayley
Расположен в виде пирамиды.
- Стандартная таблица содержит основные сведения. Показано выше
- Вертикальная таблица для улучшения читаемости в веб-браузерах
- Большая таблица содержит основные сведения, а также полные имена элементов
- Огромная таблица содержит основные сведения, а также полные названия элементов и атомные массы
- Электронные конфигурации
- Металлы и неметаллы
- Список элементов: включает название, символ, атомный номер, атомную массу, группу и период; сортируется по любому из этих
- Список элементов по символу
- Список элементов по температуре кипения
- Список элементов по температуре плавления
- Список элементов по плотности
- Группа периодической таблицы
- Период периодической таблицы
- Расширенная периодическая таблица
- Периодическая таблица элементов — отображает основные свойства
- WebElements Периодическая таблица
Краткое описание периодической таблицы
Периодический закон гласит, что физические и химические свойства элементов повторяются систематическим и предсказуемым образом, когда элементы расположены в порядке возрастания атомного номера.
Таблица Менделеева называется периодической из-за того, как элементы расположены в строках и столбцах. Горизонтальные ряды (слева направо) называются «периодами», а вертикальные столбцы (сверху вниз) называются «группами».
Таблица, иллюстрирующая периодическую систему, в которой химические элементы, ранее расположенные в порядке их атомного веса, а теперь в соответствии с их атомными номерами, показаны в связанных группах.
Периодическая таблица представляет собой табличное расположение химических элементов, упорядоченных по их атомному номеру, электронной конфигурации и повторяющимся химическим свойствам.
Этот порядок показывает периодические тренды, например элементы с похожим поведением в одном столбце. На нем также показаны четыре прямоугольных блока с примерно одинаковыми химическими свойствами.
Обычно в пределах одного ряда элементы представляют собой металлы с левой стороны и неметаллы с правой стороны.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| я | Н 01 | Он 02 | ||||||||||||||||
| II | Ли 03 | Бе 04 | Б 05 | С 06 | Н 07 | О 08 | Ф 09 | Ne 10 | ||||||||||
| III | № 11 | мг 12 | Ал 13 | Si 14 | П 15 | С 16 | Класс 17 | Ar 18 | ||||||||||
| IV | К 19 | Ca 20 | Sc 21 | Ти 22 | В 23 | Cr 24 | Мн 25 | Fe 26 | Со 27 | Ni 28 | Медь 29 | Zn 30 | Ga 31 | Ge 32 | Как 33 | Се 34 | Бр 35 | Кр 36 |
| В | руб. 37 37 | Старший 38 | Д 39 | Zr 40 | № 41 | Пн 42 | ТК 43 | Ру 44 | Rh 45 | Pd 46 | Ag 47 | Cd 48 | В 49 | Сн 50 | Сб 51 | Те 52 | I 53 | Хе 54 |
| ВИ | Cs 55 | Ва 56 | Ла 57-71 | Hf 72 | Та 73 | Вт 74 | Re 75 | Ос 76 | Ир 77 | часть 78 | Au 79 | рт.ст. 80 | ТИ 81 | Pb 82 | Би 83 | ПО 84 | В 85 | Р-н 86 |
| VII | Пт 87 | Ра 88 | Ас 89-103 | Рф 104 | Дб 105 | Сг 106 | Бх 107 | Hs 108 | Мт 109 | Дс 110 | Rg 111 | 112 | Nh 113 | ФИ 114 | Мк 115 | ур. | ||

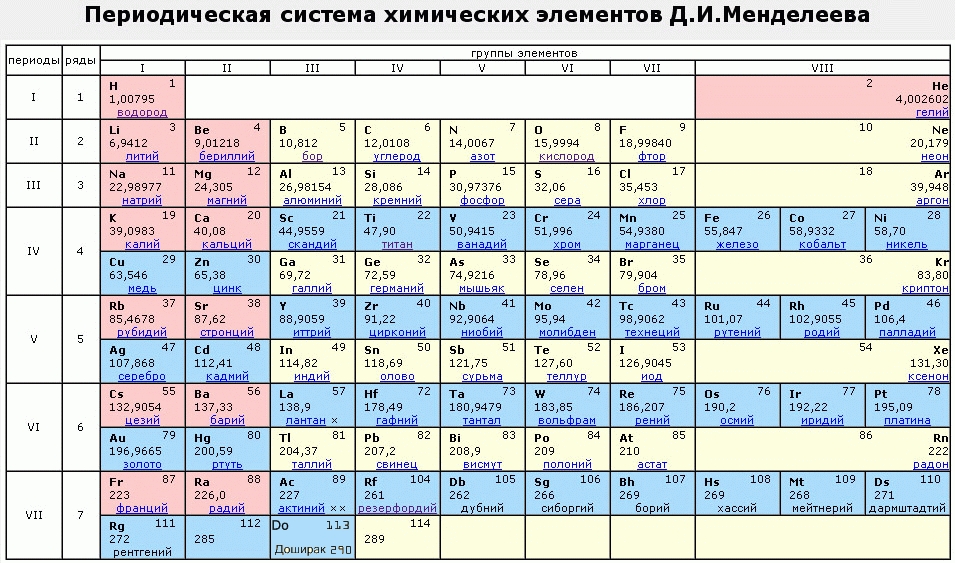 Цвет числа (атомного номера) над символом элемента показывает состояние элемента при нормальных условиях.
Цвет числа (атомного номера) над символом элемента показывает состояние элемента при нормальных условиях.