ОФС.1.2.3.0002.15 Определение воды | Фармакопея.рф
Содержимое (Table of Contents)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ст. ГФ XI
- Метод К. Фишера (полумикрометод)
Метод основан на химическом взаимодействии воды с компонентами реактива К. Фишера.
Реактив К. ФишераРеактив К. Фишера представляет собой раствор серы диоксида, йода и пиридина (или другого основания, например, имидазола) в метаноле. Взаимодействие реактива с водой протекает в две стадии стехиометрически по уравнениям:
Используемые растворы и реактивы должны быть безводными. Их хранят и применяют в условиях, исключающих возможность воздействия на них атмосферной влаги.
Йодсернистый реактив представляет собой раствор, содержащий пиридин безводный, монометиловый эфир этиленгликоля, йод и серу диоксид. В йодсернистых реактивах часто пиридин заменяют на другие основания. Использование реактивов такого состава должно быть предварительно валидировано для подтверждения в каждом конкретном случае стехиометрии реакции и отсутствия несовместимости между испытуемым веществом и реактивом.
При определении воды в твердых веществах, нерастворимых в метаноле, тонко измельченную навеску вещества взбалтывают с метанолом, после чего титруют реактивом К. Фишера. Некоторые вещества или смеси можно растворять в безводной уксусной кислоте, хлороформе, пиридине и других растворителях.
Пропанол и другие алканолы имеют большую растворяющую способность для молекул с длинной цепью и могут использоваться как таковые или в смеси с метанолом при анализе высокомолекулярных соединений.
2-Метоксиэтанол (монометиловый эфир этиленгликоля) применяют в тех случаях, когда в присутствии метанола протекают побочные реакции (этерификация, образование кеталей и т. п.). Однако, титрование в этом растворителе протекает медленнее по сравнению с метанолом. Хлороформ является хорошим растворителем для жиров и может использоваться в смеси с метанолом, содержание которого обычно составляет 50 %, но не менее 25 %. Формамид улучшает растворимость полярных веществ и может добавляться в метанол для определения воды в протеинах.
С помощью реактива К. Фишера может быть определена как гигроскопическая, так и кристаллизационная вода. При этом воду можно определять в органических и неорганических соединениях, в различных растворителях и летучих веществах.
ПриборПрибор для титрования по методу К. Фишера представляет собой закрытую систему, состоящую из бюретки, снабженной осушительной трубкой, заполненной, осушающим агентом, (например, молекулярными ситами), сосуда для подачи реактива и колбы для титрования, соединенных с бюреткой. Колба для титрования представляет собой сосуд вместимостью 60–100 мл с двумя платиновыми электродами, трубкой для подвода азота, осушительной трубкой, заполненной, осушающим агентом, (например, молекулярными ситами), и пробкой, в которую вставляется кончик бюретки.
Конечную точку титрования определяют амперометрически. Электрическая схема состоит из потенциометра с сопротивлением 2000 Ом, подключенного к источнику постоянного тока с напряжением 1,5 В и обеспечивающего необходимую разность потенциалов. Разность потенциалов отрегулирована таким образом, чтобы через платиновые электроды, соединенные последовательно с микроамперметром, проходил небольшой начальный ток. При прибавлении реактива стрелка микроамперметра отклоняется, но сразу же возвращается в исходное положение. В конце реакции получаемое отклонение должно оставаться неизменным не менее 30 с.
Конечную точку титрования допускается определять визуально по изменению окраски титруемой жидкости от желтой до красновато-коричневой при условии обеспечения необходимой точности.
Допускается использование автоматических титраторов в соответствии с инструкцией производителя.
Если нет других указаний в фармакопейной статье, используют методику А.
Методика АТочную навеску испытуемого вещества, содержащую приблизительно от 30 до 50 мг воды, помещают в сосуд для титрования, в который предварительно внесено 5,0 мл метанола безводного. Перемешивают
1 мин и титруют реактивом К. Фишера, прибавляя его при приближении к конечной точке по 0,1–0,05 мл.
Параллельно проводят контрольный опыт (титруют 5,0 мл метанола безводного).
Методика БОколо 20 мл метанола безводного или растворителя, указанного в фармакопейной статье, помещают в сосуд для титрования и титруют реактивом К. Фишера, определяя конечную точку титрования амперометрически. Затем в сосуд для титрования вносят точную навеску испытуемого вещества, указанную в фармакопейной статье.
Около 10 мл метанола безводного или растворителя, указанного в фармакопейной статье, помещают в сосуд для титрования и титруют йодсернистым реактивом, определяя конечную точку титрования амперометрически.
Затем быстро вносят в сосуд для титрования указанное количество испытуемого вещества и точно отмеренный объем йодсернистого реактива, взятый с избытком приблизительно на 1 мл или объем, указанный в фармакопейной статье. Сосуд закрывают пробкой, выдерживают в защищенном от света месте в течение 1 мин или в течение времени, указанного в фармакопейной статье, периодически перемешивая содержимое сосуда. Избыток йодсернистого реактива титруют до первоначального значения силы тока, используя метанол безводный или растворитель, указанный в фармакопейной статье, к которому было прибавлено точно известное количество воды, эквивалентное около 2,5 мг/мл.
- Микрометод определения воды (кулонометрический)
При кулонометрическом титровании необходимый для реакции К. Фишера йод образуется при анодном окислении йодид-иона:
2J− − 2e → J2
Образующийся йод реагирует с присутствующей водой и диоксидом серы в присутствии основания. Йод потребляется до тех пор, пока в среде присутствует вода. Избыток йода указывает на достижение конечной точки титрования. Количество оттитрованной воды пропорционально количеству электричества, пропущенному через ячейку.
1 моль йода соответствует 1 молю воды, а количество электричества 10,71 Кл соответствует 1 мг воды.
Вследствие малого тока титрования кулонометрическое определение применяется для количественного определения микроколичеств воды: от
10 мкг до 10 мг.
Правильность и точность метода должны быть обеспечены устранением атмосферной влаги из системы.
ОборудованиеГлавным блоком прибора является кулонометрическая ячейка. Наиболее часто используемая ячейка состоит из анодного отделения, в котором протекает реакция К. Фишера, и меньшего по объему катодного отделения, в котором протекает катодная реакция восстановления. Каждое отделение содержит платиновый электрод. Анодное отделение заполняется анолитом, в качестве которого используется модифицированный реактив К. Фишера, содержащий йодид-анион вместо йода. Катодное отделение заполняется подходящим католитом, как правило, содержащим соли аммония в качестве активного компонента. Отделения разделены диафрагмой, предотвращающей смешение двух растворов. Поскольку диффузия активных компонентов не может быть полностью исключена диафрагмой, компоненты католита должны быть совместимы с анолитом. Могут использоваться и однокамерные ячейки без диафрагмы. В этом случае анодная и катодная реакции протекают в одном и том же объеме электролита, поэтому катодная реакция восстановления не должна давать продукты, способные окисляться на аноде, что может привести к завышенным результатам определения.
Наиболее часто используемая ячейка состоит из анодного отделения, в котором протекает реакция К. Фишера, и меньшего по объему катодного отделения, в котором протекает катодная реакция восстановления. Каждое отделение содержит платиновый электрод. Анодное отделение заполняется анолитом, в качестве которого используется модифицированный реактив К. Фишера, содержащий йодид-анион вместо йода. Катодное отделение заполняется подходящим католитом, как правило, содержащим соли аммония в качестве активного компонента. Отделения разделены диафрагмой, предотвращающей смешение двух растворов. Поскольку диффузия активных компонентов не может быть полностью исключена диафрагмой, компоненты католита должны быть совместимы с анолитом. Могут использоваться и однокамерные ячейки без диафрагмы. В этом случае анодная и катодная реакции протекают в одном и том же объеме электролита, поэтому катодная реакция восстановления не должна давать продукты, способные окисляться на аноде, что может привести к завышенным результатам определения.(1).jpg)
Реакционная ячейка должна поддерживаться в абсолютно сухом состоянии. Заливка реактива в анодное отделение производится через сухую воронку, после чего ячейка немедленно герметизируется. При этом может произойти обесцвечивание реактива. Влагу удаляют из системы предварительным электролизом.
Катодное отделение также должно быть безводным. Небольшой избыток элементарного йода в католите не оказывает влияния на титрование.
Анализируемая жидкая проба вводится в ячейку с анолитом шприцем через силиконовую прокладку. Следует избегать ввода твердых проб в ячейку. Тем не менее, если необходимо провести испытание на твердых образцах, они вводятся через герметично закрываемый ввод; при этом должны быть предприняты меры по предотвращению поступления в ячейку атмосферной влаги, например, работать в перчаточном боксе в атмосфере сухого инертного газа. Также твердые пробы могут вводиться в виде раствора после растворения в подходящем растворителе, или вода высвобождается из пробы в трубчатой печи при нагревании и переносится в анолит потоком сухого инертного газа.
Объем пробы не должен превышать 10 мл. Обычно в ячейку дозируется 0,5–5,0 мл жидкой пробы. Газовые пробы вводятся в объеме от 100 мл до 10 л.
МетодикаКулонометрическое титрование выполняют до установления конечной точки титрования.
Отделение реакционной ячейки заполняют электролитом для микроопределения воды согласно инструкциям изготовителя. Влагу удаляют из системы предварительным электролизом.
Точное количество испытуемого вещества, указанное в фармакопейной статье, вносят в реакционную ячейку и перемешивают в течение
30 с или в течение времени, указанного в фармакопейной статье. Титруют до установления конечной точки титрования.
При использовании испарителя точную навеску испытуемого вещества, указанную в фармакопейной статье, помещают в трубку и нагревают. После выпаривания воды из образца в ячейку проводят титрование.
Проводят контрольный опыт и вычисляют содержание воды в испытуемом веществе в процентах.
Проверка точности. Между двумя последовательными титрованиями вводят точно взвешенное количество воды – такое же, как в определяемом образце, и выполняют кулонометрическое титрование. Результат должен быть в пределах от 97,5 до 102,5 % для содержания 1000 мкг воды в образце и в пределах от 90,0 до 110,0 % для содержания 100 мкг воды в образце.
- Определение воды методом дистилляции
Определение проводят в приборе (рис. 1), состоящем из стеклянной круглодонной колбы (1) вместимостью от 250 до 500 мл, приемника (2), представляющего собой градуированную пробирку или бюретку вместимостью 6–10 мл с ценой деления 0,1 мл, и холодильника (3).
МетодикаВ колбу (1) отвешивают с точностью до 1 % указанное в фармакопейной статье количество испытуемого вещества (от 10,0 до 20,0 г (точная навеска), содержащее от 2 до 3 мл воды), прибавляют 100 мл толуола или ксилола и несколько кусочков пористого материала (например, несколько кусочков пемзы). Колбу нагревают на электроплитке или песчаной бане до кипения. Кипячение ведут так, чтобы конденсирующийся растворитель не скапливался в холодильнике, а спокойно стекал навстречу поднимающимся парам жидкости со скоростью от 2 до 4 капель в секунду. Кипячение прекращают, когда объем воды в приемнике перестанет увеличиваться и верхний слой растворителя в приемнике станет прозрачным. Внутреннюю трубку холодильника промывают толуолом и продолжают нагревание еще 5 мин, после чего приемник охлаждают до комнатной температуры и стряхивают со стенок приемника все капли воды.
Колбу нагревают на электроплитке или песчаной бане до кипения. Кипячение ведут так, чтобы конденсирующийся растворитель не скапливался в холодильнике, а спокойно стекал навстречу поднимающимся парам жидкости со скоростью от 2 до 4 капель в секунду. Кипячение прекращают, когда объем воды в приемнике перестанет увеличиваться и верхний слой растворителя в приемнике станет прозрачным. Внутреннюю трубку холодильника промывают толуолом и продолжают нагревание еще 5 мин, после чего приемник охлаждают до комнатной температуры и стряхивают со стенок приемника все капли воды.
Вся отогнанная вода собирается в нижней части приемника. После полного разделения слоев отмечают объем отогнанной воды.
Скачать в PDF ОФС.1.2.3.0002.15 Определение воды
Поделиться ссылкой:
Определение воды по Фишеру
- Подробности
- Опубликовано 14 Сентябрь 2013
- Автор: Administrator
Вода – это превосходный растворитель. Нетоксичный и дешевый. Однако лишь немногие органические реакции способны протекать в водной среде. Более того, вода способна оказывать разрушающее действие на многие органические соединения, приводить к побочным реакциям в химических процессах. Т.о. необходимо точное определение воды в используемых реагентах и/или растворителях.
Нетоксичный и дешевый. Однако лишь немногие органические реакции способны протекать в водной среде. Более того, вода способна оказывать разрушающее действие на многие органические соединения, приводить к побочным реакциям в химических процессах. Т.о. необходимо точное определение воды в используемых реагентах и/или растворителях.
Теория титрования по Фишеру
Для определения содержания воды в органических соединениях следовало подобрать такую реакцию, в которую вступает лишь растворенная вода, а сам метод может быть использован для широкого класса соединений.
Эту задачу удалось решить в 1935 году немецкому химику Карлу Фишеру (см. лит.). Фундаментальный принцип «определения воды по Фишеру» основан на реакции Бунзена между йодом, диоксидом серы и водой. К. Фишер обнаружил, что использование избытка диоксида серы, метанола в качестве растворителя и пиридина как основания (для буферизации раствора) можно использовать для определения воды в неполярных растворителях.
Титрование представляет собой трехстадийный процесс:
На первой стадии вода реагирует с диоксидом серы, в результате чего I2 восстанавливается до I– (реакция 1). Выделяющейся триоксид серы образует с пиридином комплекс (реакция 2), который в присутствии метанола (или другого спирта) превращается в стабильный пиридиновый комплекс (реакция 3). Таким образом, для титрования каждого эквивалента воды затрачивается один эквивалент йода.В качестве спирта обычно используется метанол, реже диэтиленгликоль.
В качестве основания – пиридин, но чаще имидазол или первичные амины.
Получение реактива Фишера
В колбу на 750 мл помещают безводный метанол (400 мл, содержание воды не более 0.03%), сухой пиридин (80 г). Через раствор на холоду медленно пропускают диоксид серы до увеличения массы раствора на 20 г. Затем добавляют йод (45 г), встряхивают до полного растворения и выдерживают 24 часа перед использованием. Реагент, полученный по данному методу, имеет эквивалент по воде – 3.5 мг/мл. Перед использованием реагент стандартизируют, используя стандартные реагенты с известным содержанием воды (вода/метанол), или титруют кристаллический дигидрат тартрата натрия (для сравнения получают безводный тартрат натрия прокаливанием дигидрата при 150 °С).
Реагент, полученный по данному методу, имеет эквивалент по воде – 3.5 мг/мл. Перед использованием реагент стандартизируют, используя стандартные реагенты с известным содержанием воды (вода/метанол), или титруют кристаллический дигидрат тартрата натрия (для сравнения получают безводный тартрат натрия прокаливанием дигидрата при 150 °С).
Типы титрования по Фишеру и рекомендации
Волюметрическое титрование (от 100 ppm до 100% воды)1) К образцу в подходящем для титрования растворителе (или без растворителя если вещество жидкое) из бюретки добавляют титрант, содержащий все необходимые компоненты реактива Фишера.
2) К образцу растворенному в среде содержащей основание, диоксид серы и спирт из бюретки добавляют титрант, содержащий только йод и спирт.
Кулонометрическое титрование (от 1 ppm до 5% воды)
В данном титровании йод генерируется электрохимически in situ в течение титрования, а содержание воды определяется как общее количество тока, прошедшее через кулонометрическую ячейку. В данном случае результат титрования определяется микропроцессором прибора и выводится на экран.
В данном случае результат титрования определяется микропроцессором прибора и выводится на экран.
Внимание!
1. Реагент Фишера неустойчив к действию света и влаги. Его стандартизация должна проводиться перед каждым использованием.
2. Рабочий интервал pH для определения воды по Фишеру между 5 и 8, в противном случае высоко кислотные или основные соединения рекомендуется буферизовать.
3. Плохо растворимые в метаноле соединения (например, жиры, углеводороды) следует растворять в высших спиртах или хлороформе, возможны также добавки формамида (для полярных веществ).
4. Следует избегать титрования веществ, которые способны реагировать с компонентами реактива Фишера (например, альдегиды и кетоны, сильные кислоты и основания, окислители и восстановители, соединения, реагирующие с компонентами реактива Фишера с образованием воды).
Фишера определение воды – Справочник химика 21
Фишера. Определение воды по методу Фишера основано на реакции [c. 157]
157]Определение воды в исходных органических растворителях по методу Фишера. Определение воды по методу Фишера основано на реакции [c.202]
Определение воды в исходных органических растворителях по методу Фишера. Определение воды по методу Фишера основано на реакции, которую схематически можно представить следующим образом [c.204]
ОПРЕДЕЛЕНИЕ ВОДЫ В НЕФТИ МЕТОДОМ ФИШЕРА (УР 78-003) [c.143]
Однако метод К. Фишера мало пригоден для определения воды в темных продуктах (трудности в титровании — указание автора) и в работавших маслах, содержащих кетоны и альдегиды [21]. [c.534]
Необходимо заметить, что в системе ГОСТ Р имеется ГОСТ 24614-81 Жидкости и газы, не взаимодействующие с реактивом Фишера. Кулонометрический метод определения воды . Данный нормативный документ регламентирует проведение измерений любой жидкости, не реагирующей с реактивом Фишера, то есть не создающей аналитических помех. В принципе это может быть и нефть, нефтепродукты и энергетические изоляционные масла. Однако в существующем виде этот стандарт не может быть использован для измерений воды в нефти без дополнительной переработки и адаптации поскольку, во-первых, в нем не учитывается специфика такого объекта, как нефть с водой. Поэтому пробоотбор и пробоподготовка, имеющие решающее значение для точности измерения, ока- [c.254]
В принципе это может быть и нефть, нефтепродукты и энергетические изоляционные масла. Однако в существующем виде этот стандарт не может быть использован для измерений воды в нефти без дополнительной переработки и адаптации поскольку, во-первых, в нем не учитывается специфика такого объекта, как нефть с водой. Поэтому пробоотбор и пробоподготовка, имеющие решающее значение для точности измерения, ока- [c.254]Для определения воды как примеси в органических соединениях предложено много способов. Одним из наиболее употребительных является титрование реактивом Фишера, Реактив Фишера представляет собой раствор иод,а [c.268]
Дж. Митчел, Д. Смит. Акваметрия (методы определения воды в различных материалах). Издатинлит, 1952, (427 стр.). Книга представляет собой обзор литературы по применению реактива Фишера в аналитической химии. В книге дается обзор различ. ных методов определения воды, описаны методы анализа с применением реактива Фишера, причем ряд прописей и методик экспериментально проверены авторами. Излагаются методы определения содержания воды в различных органических н неорганических соединениях и промышленных материалах. В последующих разделах авторы описывают реакции, протекающие с выделением или поглощением воды, которые могут быть использованы для определения ряда функциональных групп органических соединений. [c.492]
Излагаются методы определения содержания воды в различных органических н неорганических соединениях и промышленных материалах. В последующих разделах авторы описывают реакции, протекающие с выделением или поглощением воды, которые могут быть использованы для определения ряда функциональных групп органических соединений. [c.492]
Реактив Фишера применяют для определения воды в органических соединениях почти всех классов. Исключение составляют соединения, вступающие в реакцию с тем или инЫм компонентом реактива. Используют реактив Фишера также для определения воды в неорганических веществах, хотя мешающие соединения здесь встречаются чаще, чем при анализе органических веществ. Мешают определению сильные окислители и восстановители, которые реагируют с иодом или иодидом. Перхлораты вообще нельзя анализировать реактивом Фишера, так как при этом образуется взрывоопасная композиция. [c.281]
Все большее значение приобретает проведение редокс-титрования в органических растворителях.
 При этом, конечно, необходимо иметь в виду, что такие растворители могут оказаться нестойкими к действию окислителей. Одним из известных методов редокс-титрования в органических растворителях является определение воды по К. Фишеру [26]. [c.121]
При этом, конечно, необходимо иметь в виду, что такие растворители могут оказаться нестойкими к действию окислителей. Одним из известных методов редокс-титрования в органических растворителях является определение воды по К. Фишеру [26]. [c.121]Количественный титрометрический метод определения воды по Фишеру основан на реакциях, протекающих в смешанном растворителе из пиридина и метанола [c.413]
Методы ИК-спектроскопии. Вода характеризуется максимумом поглощения в ближней области ИК-спек-тра 1,94 мкм, который используют для определения влаги в различных материалах. Так, при определении воды в пищевых продуктах навеску образца диспергируют в диметилсульфоксиде, который спустя 2—4 ч практически полностью экстрагирует воду. После окончания экстракции наливают экстракт в 1-сантиметровую кварцевую кювету и измеряют оптическую плотность экстракта. В интервале 0,00—0,70 мл воды в 100 мл раствора наблюдается линейная зависимость между оптической плотностью и содержанием воды. Точность определения соизмерима с точностью определения воды химическим методом Карла Фишера.. [c.638]
Точность определения соизмерима с точностью определения воды химическим методом Карла Фишера.. [c.638]
Определению воды методом Фишера мешают вещества, которые при взаимодействии с одним из компонентов реагента образуют воду. Так, ири взаимодействии карбонильных соединений с метанолом [c.639]
Х.Г. ТИТРОВАНИЕ ПО КАРЛУ ФИШЕРУ И ОПРЕДЕЛЕНИЕ ВОДЫ [c.459]
Титрометрические методы основаны на прямом определении воды при титровании растворами химических реагентов. Эти методы по сравнению с волюмометрическими имеют большую точность, поэтому их применяют для определения малых количеств воды в нефтепродуктах. Чаще всего для этой цели используют реактив Фишера, представляющий собой раствор иода, пиридина и сернистого ангидрида в метаноле. Химизм реакции [c.292]
Прямая И. применяется для определения Аз (III), 8п(П), 8Ь(1П), сульфидов, сульфитов, тиосульфатов, аскорбиновой к-ты и др., косвенная-для определения Си (II), О2, Н Оз, Вг2, броматов, иодатов, гипохлоритов и др. И. лежит в основе метода определения воды с помощью Фишера реактива, т. е. по р-ции 12 с 802 в смеси пиридина и метанола. [c.254]
И. лежит в основе метода определения воды с помощью Фишера реактива, т. е. по р-ции 12 с 802 в смеси пиридина и метанола. [c.254]
Следует помнить, что при использовании апротонных растворителей трудно создать совершенно безводную среду. Остаточные количества воды, которые почти всегда находятся в сухом растворителе, могут влиять на результаты исследований. Воду из апротонных растворителей удаляют азеотропной перегонкой с бензолом или этанолом, с помощью молекулярных сит, сушкой над СаО, М 0, СаНг или КаН, пропусканием через колонку с оксидом алюминия. Для определения воды в органических растворителях обычно применяют метод Фишера. Однако он непригоден, если концентрация воды ниже 1 ммоль/л. Эффективность осушки растворителей определяют также с помощью газовой хроматографии и ИК-спектроскопии. [c.100]
Для проверки этого предположения были сопоставлены количество воды в фазе органического растворителя, определенное методом Фишера, количество воды, связанное с растворителем, определенное спектральным методом, и количество НС1 в фазе органического растворителя, определенное титрованием. [c.118]
[c.118]
Определение воды спектрофотометрическими методами и методом Фишера [c.157]
Реактив Фишера нельзя применять для определения воды в кетонах или альдегидах или в присутствии небольших количеств этих веществ в анализируемых растворителях. Для удаления альдегидов и кетонов прибавляют 2%-ный пиридиновый раствор цианистого водорода, под действием которого альдегиды и кетоны превращаются в циангидрины [30]. Было предложено использовать реактив Фишера для определения оксикислот, ангидридов кислот, карбонильных производных и гидратационной воды в солях [29]. [c.592]
Методика пригодна для определения воды в очищенных растворителях, а также кристаллизационной воды. Реагент Карла Фишера, содержащий, например, иод, диоксид серы, пиридин в молярном соотношении 1 3 10 в метаноле, можно использовать для прямого титрования воды в любом растворителе, ве реагирующем с диоксидом серы и/или иодом. Растворители, содержапще альдегиды и кетоны, титровать нельзя, поскольку онн связывают диоксид серы. [c.378]
[c.378]
Метод Карла Фишера используют для определения воды. [c.378]
Реактив Фишера представляет собою раствор сернистого ангидрида, иода и пиридина в метаноле. Он применяется для определения воды в некоторых органических веществах. Пиридин и метанол также должны быть обезвожены (допустимая влажность не более 0,1 %) [c.310]
Одно из основных достоинств полимерных сорбентов на основе стирола и дивинилбензола состоит в быстром элюировании воды (между этаном и пропаном на порапаках Р, Q, полисорбе-1, хромосорбе 102) с хорошей формой ника, что позволяет определять примеси воды в разных системах [1,143]. Точность хроматографического метода определения воды на таких сорбентах не уступает методу Фишера и позволяет определять на хроматографе с детектором по теплопроводности 10 ррм воды [143]. При этом рекомендуют вводить пробу непосредственно в хроматографическую колонку. [c.129]
Методы, применяемые для количественного определения воды, весьма разнообразны [103].
 Достаточно подробный обзор возможностей их применения и необходимой для этого аппаратуры можно найти в работах [83, 272, 360, 399]. Наиболее распространенным химическим методом определения Н2О является метод Карла — Фишера [103, 206, 267]. Однако, благодаря быстроте, [c.183]
Достаточно подробный обзор возможностей их применения и необходимой для этого аппаратуры можно найти в работах [83, 272, 360, 399]. Наиболее распространенным химическим методом определения Н2О является метод Карла — Фишера [103, 206, 267]. Однако, благодаря быстроте, [c.183]ОПРЕДЕЛЕНИЕ ВОДЫ МЕТОДОМ КАРЛА ФИШЕРА [c.154]
Вода. Определяют, как описано в разделе Определение воды методом Карла Фишера , метод А (т. 1, с. 155), используя около 1 г вещества и 25 мл раствора, состоящего из 1 объема метанола Р и 2 объемов пиридина Р, в качестве растворителя содержание воды не более 7,0 мг/г. [c.24]
Вода. Определяют, как описано в разделе Определение воды методом Карла Фишера , метод А (т. 1, с. 154), используя около 0,15 г вещества содержание воды составляет не менее 70 и не более 90 мг/г. [c.26]
Вода. Определяют, как описано в разделе Определение воды методом Карла Фишера , метод А (т. I, с. 155), используя около 0,15 г вещества и 25 мл пиридина Р в качестве растворителя содержание воды не более 80 мг/г. [c.34]
155), используя около 0,15 г вещества и 25 мл пиридина Р в качестве растворителя содержание воды не более 80 мг/г. [c.34]
Оба метода получили широкое распространение, но не являются достаточно точными при содержании воды от О до 1%. Для нефтей с таким содержанием воды рекомендуется применять метод Фишера, являющийся модификацией стандартного метода (А8ТМ0 1744), определения воды в жидких нефтепродуктах. Повышение точности достигается применением л-этилпиперидина. В отечественной практике этот метод пока не находит широкого применения. [c.142]
Своеобразно иодометрическое определение воды в органических растворителях и других материалах с помощью реактива Фишера, состоящего из иода, диоксида серы и пиридина в метаноле. Анализируемую пробу помещают в метиловый спирт и определяют воду титрованием указанным реактивом. Реакция титрования пр0 (0дит в две стадии. Упрощенно она может быть представлена схемой [c.281]
Для определения воды в удобрении взяли навеску массой 1,500 г и оттитровали 9,82 мл иодпиридинового раствора (SO2, h, sHsN — реактив Фишера), титр которого установили по стандартному раствору воды в метаноле с Т (Н2О) =0,0100. На титрование 2,00 мл стандартного раствора воды израсходовали 5,85 мл реактива Фишера. Вычислить массовую долю (%) воды в удобрении. Ответ 2,24%. [c.305]
На титрование 2,00 мл стандартного раствора воды израсходовали 5,85 мл реактива Фишера. Вычислить массовую долю (%) воды в удобрении. Ответ 2,24%. [c.305]
В 1935 г. немецкий химик Карл определять воду в анализируемых веществах путем тит]эования их растворов метанольным раствором иода, диоксида серы и пиридина. Этот реактив получил название реактив Фишера , а сам метод определения воды титрованием реактивом Фишера называют акваметрией. Метод щироко применяется в наши дни, особенно — в фармацевтическом анализе. [c.40]
АКВАМЕТРИЯ, совокупность методов количеств, определения воды. Наиб, широко примен. тйтриметрич. методы с использ. Фишера реактива, позволяющие определять от 0,5-10 до 100% (по массе) воды в анализируемом образце. При определении не менее 0,01 г воды навеску исследуемого в-ва высушивают в термостате при 100—105 °С [c.16]
Существенный интерес представляет определение воды в сухом растворителе. Метод К- Фишера непригоден, если концентрация воды ниже 0,002% (1 ммоль/л). Для определения содержания воды в некоторых циклических сложных эфирах использовали метод газовой хроматографии [224], однако введение в хроматограф растворов электролитов приводит к накоплению солей в испарителе, а иногда и к неправильным результатам из-за термического разложения электролитов. Аналитическое определение воды при длине волны 1900 нм в ближней ИК-области спектра [225] можно применять для таких растворителей, как пропиленкарбонат, однако метод непригоден для многих обычно используемых растворителей. Описан [226] метод, осповаииый на реакции воды с тетраацетатом свинца в бензоле образующийся при этом диоксид свинца определяют спск-трофотометрически при длине волны 499 им в кювете (2 мл) можно обнаружить 2,5-10 % вещества. Метод применим для ряда растворителей, а также для некоторых растворов, обычно используемых в электрохимии. [c.200]
Для определения содержания воды в некоторых циклических сложных эфирах использовали метод газовой хроматографии [224], однако введение в хроматограф растворов электролитов приводит к накоплению солей в испарителе, а иногда и к неправильным результатам из-за термического разложения электролитов. Аналитическое определение воды при длине волны 1900 нм в ближней ИК-области спектра [225] можно применять для таких растворителей, как пропиленкарбонат, однако метод непригоден для многих обычно используемых растворителей. Описан [226] метод, осповаииый на реакции воды с тетраацетатом свинца в бензоле образующийся при этом диоксид свинца определяют спск-трофотометрически при длине волны 499 им в кювете (2 мл) можно обнаружить 2,5-10 % вещества. Метод применим для ряда растворителей, а также для некоторых растворов, обычно используемых в электрохимии. [c.200]
Применение двух поляризуемых электродов позволяет отказаться от солевых мостиков, необходимых при использовании электродов сравнения. Поэтому данный метод широко применяется для титрования в неводных средах, например, при определении воды по Фишеру. При помощи титрования с двумя поляризованными электродами можно проводить многие окислительно-восстановительные титрования, выполняемые в обычном амперометрическом титровании. Кроме того, метод с двумя электродами находит широкое применение при индикации конечной точки в кулонометрическом титровании. Шконец, следует упомянуть и о том, что при титровании с двумя поляризованными электродами можно определять последовательно несколько веществ, подобно тому, как это делается в обычном амперометрическом титровании, но с более резкими перегибами кривой в точках эквивалентности. [c.514]
Поэтому данный метод широко применяется для титрования в неводных средах, например, при определении воды по Фишеру. При помощи титрования с двумя поляризованными электродами можно проводить многие окислительно-восстановительные титрования, выполняемые в обычном амперометрическом титровании. Кроме того, метод с двумя электродами находит широкое применение при индикации конечной точки в кулонометрическом титровании. Шконец, следует упомянуть и о том, что при титровании с двумя поляризованными электродами можно определять последовательно несколько веществ, подобно тому, как это делается в обычном амперометрическом титровании, но с более резкими перегибами кривой в точках эквивалентности. [c.514]
Для определения воды в удобрении взяли навеску массой 1,500 г и оттитровали 9,82 мл иодпиридинового раствора (ЗОз, 1з, СдНдМ — реактив Фишера), титр которого по воде установили по стандартному раствору воды в метаноле, равным 0,0100. На титрование 2,00 мл стандартного раствора воды израсходовали [c. 166]
166]
Известно большое число методов определения воды. Так, воду определяют гравиметрически косвенным или прямым методом (см. гл. 9). В косвенном методе о содержании воды судят по потере массы анализируемой пробы при ее высушивании или прокаливании. Этот метод часто не дает правильных результатов, что связано с трудностью определения температуры, необходимой для полного выделения воды, и потерей с водой летучих компонентов образца. Прямой гравиметрический метод основан на поглощении выделившейся из образца воды подходящим поглотителем, чаще всего безводным перхлоратом магния. О содержании воды судят по увеличению массы предварительно взвешенного поглотителя. Часто для определения воды 1фименяют титриметрический метод с использованием реагенга Фишера. [c.69]
Малые количества воды определяли в акрилонитриле [1501, в четырехокиси азота (1511, в аммиаке [ 1521, в органических растворителях [ 153, 1541, в спиртах [1481, в декстра-новых растворах [1551, в хлорофилле [ 156], в этиленгликоле [157], в ацетоинтриле [158], в продуктах хлорирования цик-логексанона [159. Указанные методы заменяют титриметрн-ческое определение воды методом Фишера [154]. [c.131]
Указанные методы заменяют титриметрн-ческое определение воды методом Фишера [154]. [c.131]
Титриметрическое определение воды методом Карла Фишера основано на оличественной реакции между водой и реактивом, состоящим из двуокиси серы и йода в безводном пиридине и обычно метанола. Реакцию проводят в подходящем растворителе, таком,. как метанол или уксусная кислота. [c.154]
Кулонометрическое титрование по Карлу Фишеру
Кулонометрическое титрование по Карлу Фишеру | Инжиниринговый центр РИЦ АФСТитрование по методу Карла Фишера
Классический метод титрования в аналитической химии, используемый для определения малого количества воды в анализируемой пробе. Разработан в 1935г. немецким химиком Карлом Фишером. Суть метода заключается в добавлении к анализируемому образцу раствор вещества с известной концентрацией (титрант). Фактически метод заключается в подсчете объема затраченного на анализ титранта. Существует две методики для определения содержания воды по Карлу Фишеру: волюметрическое или кулонометрическое титрование. В случае волюмометрического титрования йод добавляется с помощью бюретки в процессе титрования. В кулонометрическом анализе йод генерируется электрохимически в процессе титрования.
Разработан в 1935г. немецким химиком Карлом Фишером. Суть метода заключается в добавлении к анализируемому образцу раствор вещества с известной концентрацией (титрант). Фактически метод заключается в подсчете объема затраченного на анализ титранта. Существует две методики для определения содержания воды по Карлу Фишеру: волюметрическое или кулонометрическое титрование. В случае волюмометрического титрования йод добавляется с помощью бюретки в процессе титрования. В кулонометрическом анализе йод генерируется электрохимически в процессе титрования.
Преимущества метода и его применение
Метод позволяет определить содержание воды в жидких, твердых и газообразных продуктах в диапазоне от 0,1 до 100%.
Области применения:
- Фармацевтика
- Биотехнологии
- Пищевая промышленность
- Нефтяная химия
- Парфюмерия и косметика
Преимущества:
- Высокая точность и воспроизводимость результатов
- Селективность по воде
- Малые количества необходимых образцов
- Легкая пробоподготовка
- Малое время анализа
- Практически неограниченный диапазон измерения (1ppm до 100 %)
- Пригоден для анализа:
- Твердых веществ
- Жидкостей
- Газов
- Независимость от наличия других летучих веществ
- Пригодность для автоматизации
Metrohm 915 KF Ti-Touch
Идеальное решение для определения воды волюмометрическим титрованием по методу Карла Фишера.
- Бесконтактная смена реактивов
- Насос, бюретка, мешалка, сенсорная панель и блок титратора — в одном корпусе
- Запуск титрования нажатием одной кнопки
- Создание PDF отчетов с выгрузкой на флешку и доступ в LIMS без ПК.
- Пригоден для анализа:
- Твердых веществ
- Жидкостей
- Газов
Связаться с нами
Закрыть
Нажатием кнопки «Оформить заявку» я даю свое согласие на обработку персональных данных в соответствии с указанными здесь условиями.Спасибо… С вами скоро свяжется наш специалист
Закрыть
Нажатием кнопки «Оформить заявку» я даю свое согласие на обработку персональных данных в соответствии с указанными здесь условиями.Спасибо… С вами скоро свяжется наш специалист
Определение воды по Фишеру | ТИТРАТОР
Исторические данные
С момента, как Карл Фишер в 1935 году предложил метод определения воды, он получил широкое распространение в лабораторной практике. Долгие годы метод развивался в методическом и инструментальном совершенствовании и попытки замены компонентов самого реактива не приводили к успеху. В литературе бытовало мнение, что предложенный самим Карлом Фишером состав реактива наиболее оптимален. Однако недостатки классического реактива были очевидны: нетерпимый запах пиридина, токсичность, нестабильность титра, нечетко идентифицирующаяся точка эквивалентности при медленно протекающей реакции.
Долгие годы метод развивался в методическом и инструментальном совершенствовании и попытки замены компонентов самого реактива не приводили к успеху. В литературе бытовало мнение, что предложенный самим Карлом Фишером состав реактива наиболее оптимален. Однако недостатки классического реактива были очевидны: нетерпимый запах пиридина, токсичность, нестабильность титра, нечетко идентифицирующаяся точка эквивалентности при медленно протекающей реакции.В 1979 Эйген Шольц (Eugen Scholz) в команде с Хельгой Хоффман(Helga Hoffman) предложил заменить пиридин имидазолом. Дальнейшие исследования показали, что по совокупности метрологических свойств реактивы на основе имидазола превзошли классический реактив, и исключение пиридина (как токсичного и дурно-пахнущего) приобрело лишь второстепенное значение.
Так как пиридин является слабым основанием, неспособным обеспечить полного сдвига реакции Бунзена вправо, которая протекает медленно, и конечная точка титрования нестабильна. Закономерно, что нестабильность основной реакции приводит к снижению воспроизводимости результатов титрования.

Имидазол же полностью сдвигает равновесие реакции Бунзена вправо, которая протекает при максимальной скорости и конечная точка титрования достаточно стабильна. В настоящее время, имидазол является наилучшим основанием для обеспечения метода Фишера.
Замена пиридина на имидазол в реактиве Фишера позволила:
- повысить скорость титрования в 5 раз;
- улучшить стабильность конечной точки титрования, что особенно важно при титровании следов воды;
- уменьшить погрешность измерения от 4% до 0,6%;
- отсутствие неприятного запаха и токсичности пиридина позволяют проводить титрование вне вытяжки;
- уменьшить себестоимость анализа за счет стабильности титра;
- увеличить срок годности реактива от 6 месяцев до 5лет.
- желание обезопасить и улучшить условия работы лабораторного персонала;
- повысить точность определения содержания воды;
- снизить себестоимость анализа;
- приобретение автоматических титраторов;
- возможность одноразово закупать реактив Фишера на длительный срок до 5-х лет вместо ежеквартального.

При этом, нам неизвестны случаи обратного перехода с беспиридинового реактива на реактив Фишера с содержанием пиридина.
Основным сдерживающим фактором перехода на беспиридиновые реактивы Фишера являлись опасения несогласованности с требованиями формальной метрологии – ГОСТ, ТУ, МВИ и прочими НТД.
Известно также, что основным НОРМАТИВНО-ТЕХНИЧЕСКИМ ДОКУМЕНТОМ, регламентирующим объемный метод определения воды с помощью реактива Фишера является ГОСТ 14870-77, и кулонометрический — ГОСТ 24614-81.
Настоящий стандарт ГОСТ 14870-77 «МЕТОДЫ ОПРЕДЕЛЕНИЯ ВОДЫ» переиздан в июле 1989г. с Изменениями N 1,2, утвержденными в мае 1983г., июне 1989г. (ИУС 8-83, ИУС 11-89), которые в измененной редакции п.1.1. сняли ограничения по использованию реактива Фишера не содержащего пиридин: «Допускается применение импортной аппаратуры и лабораторной посуды по классу точности и реактивов по качеству не ниже отечественных. (Измененная редакция, Изм. №1,2)». Изм.редакция ГОСТ 14870-77…
№1,2)». Изм.редакция ГОСТ 14870-77…
В стандарт ГОСТ 14870-77 введены и международные стандарты:
ИСО 760-78 – Международный Стандарт ISO 760:1978 на определение содержание воды по методу Карла Фишера (общий метод) или Determination of water-Karl Fischer method (General method).ISO 760:1978
ИСО 4318-78 – Международный Стандарт ISO 4318:1978/1989 на поверхностно-активные буферы и добавки для определиния содержания воды азеотропным дистилляционным методом – или Surface active agents and soaps — Determination of water content — Azeotropic distillation method. ISO 4318:1978/1989
ИСО 6353/1-82(ОМ-12) — Международный Стандарт ISO 6353 1:1982 (GM12 Water –Karl Fischer method 6 page) на реактивы для химического анализа Части 1: Общие тест-методы. ISO 6353 1:1982 (GМ-12)
Настоящий стандарт ГОСТ 24614-81 «ЖИДКОСТИ И ГАЗЫ НЕ ВЗАИМОДЕЙСТВУЮЩИЕ С РЕАКТИВОМ ФИШЕРА» кулонометрический метод определения воды переиздан в ноябре 2003г. с Изменениями N 1,2, утвержденными в июне 1983г., декабре 1990г. (ИУС 9-86, ИУС 3-91), которые в измененной редакции п.2.1. сняли жесткие требования по использованию аппаратуры определенных параметров, реактивов Фишера и материалов для кулонометрического метода титрования: «Допускается применение любой установки для кулонометрического определения воды по Фишеру с параметрами, указанными выше. Реактив Фишера приготовленный по ГОСТ 14870 (пригодность реактива проверяют по обесцвечиванию йодной окраски реактива при добавлении воды независимо от срока его хранения). (Измененная редакция, Изм.№1,2)». Изм.редакция ГОСТ 24614-81…
с Изменениями N 1,2, утвержденными в июне 1983г., декабре 1990г. (ИУС 9-86, ИУС 3-91), которые в измененной редакции п.2.1. сняли жесткие требования по использованию аппаратуры определенных параметров, реактивов Фишера и материалов для кулонометрического метода титрования: «Допускается применение любой установки для кулонометрического определения воды по Фишеру с параметрами, указанными выше. Реактив Фишера приготовленный по ГОСТ 14870 (пригодность реактива проверяют по обесцвечиванию йодной окраски реактива при добавлении воды независимо от срока его хранения). (Измененная редакция, Изм.№1,2)». Изм.редакция ГОСТ 24614-81…
ТехОборудование | Титраторы по К. Фишеру
Автоматические титраторы по К. Фишеру
Определение влаги титрованием по Карлу Фишеру
Определение влаги в углеводородных жидкостях методом кулонометрического титрования по Карлу Фишеру – один из самых надежных и достоверных методов. Метод основан на количественном связывании присутствующей в образце влаги реагентом Карла Фишера:
H 2 O + I 2 + SO 2 + R’OH + 3RN > (RNH)SO 4 R’ + 2(RNH)I
где:
RN = органическое основание, например, пиридин;
R’OH = органический спирт (обычно метанол).
Существует две модификации метода:
-
классическое (волюметрическое) титрование реагентом Фишера с помощью дозирующей бюретки
-
кулонометрическое титрование, при котором реагент Фишера генерируется под действием электрического тока непосредственно в титрационной ячейке.
“Классический” или волюмометрический метод
В ячейку титрования подается реактив К. Фишера, который вступает в реакцию с водой, содержащейся в образце. Одновременно на платиновые электроды, находящиеся в ячейке, подается поляризационный потенциал. Пока в ячейке присутствует вода, свободного йода в ней практически не остается и требуется значительный потенциал для поддержания определенного тока поляризации. После того, как вся вода прореагировала с йодом в ячейке появляется свободный йод, что вызывает рост ионной проводимости. Для поддержания заданного тока поляризации требуется снижение потенциала, подаваемого на электроды. Когда напряжение падает ниже определенной величины, определяемой собственным дрейфом ячейки, процесс титрования считается завершенным. По объему реагента Карла Фишера рассчитывается количество воды, содержавшейся в образце.
Когда напряжение падает ниже определенной величины, определяемой собственным дрейфом ячейки, процесс титрования считается завершенным. По объему реагента Карла Фишера рассчитывается количество воды, содержавшейся в образце.
Кулонометрический метод
В основе метода лежит генерация йода в ячейке титрования путем анодного окисления. Содержание воды в анализируемой пробе прямо пропорционально количеству электричества, прошедшего через ячейку до остановки анализа. Прибор автоматически распознает конечную точку титрования по величине тока поляризации и рассчитывает искомую концентрацию воды.
Автоматические титраторы выполняют анализ по методу К. Фишера, который включает три главные методические задачи:
- Определение титра реагента Фишера
- Контроль дрейфа (герметичности) ячейки титрования
- Анализ образца
Для обеих модификаций разработаны соответствующие стандартные методы.
|
измеряется объем титранта |
измеряется количество электричества, |
||
|
|
|||
|
Диапазон измерения: 100 мк. |
Диапазон измерения: 10 мк…100 мг влаги в пробе |
||
|
+ |
Хорошо подходит для титрования твердых проб, образцов, |
+ |
Не требуется стандартизации реактива Фишера. |
|
– |
Требуется периодическая (ежедневная) |
+ |
|
Кулонометрический титратор ПЭ-9210 предназначен для быстрого и точного определения содержания влаги в широком спектре продуктов и материалов, находящихся в жидкой, газовой или твердой фазе методом кулонометрического титрования.
Универсальный кулонометрический анализатор “Эксперт-006” – прибор для определения кислотности, антиоксидантной, активности, кислотно-основного титрования, измерения диоксида серы и решения широкого круга химико-аналитических задач: по определению массы вещества, содержащегося в растворе…
Титратор Эксперт-007Титраторы Фишера серии “Эксперт-007М”: модельный ряд приборов для количественного определения воды в нефти, нефтепродуктах, природном газе, органических растворителях, трансформаторных маслах и др. по ГОСТ 24614, EN ISO 12937 (IP №438/01)
Титраторы MetrohmКулонометры Metrohm предназначены для определения влаги в следовом диапазоне (1 ppm … 1%) в жидких, твердых и газообразных пробах. Волюмометрические титраторы Metrohm – для определения влаги от нескольких ppm до 100% в твердых, жидких и газообразных пробах.
Титраторы Меттлер ТоледоОператору, работающему с титратором МЕТТЛЕР ТОЛЕДО по методу Карла Фишера, достаточно нажать всего лишь одну кнопку, чтобы запустить процесс определения содержания влаги
Активность воды как альтернатива определению содержания влаги в фармацевтических продуктах по методу Карла Фишера
Главная / Активность воды / Активность воды как альтернатива определению содержания влаги в фармацевтических продуктах по методу Карла ФишераДлительное время считалось, что содержание влаги в продукте определяет безопасность и стабильность продукта. С помощью метода титрования по Карлу Фишеру определяется содержание влаги во многих фармацевтических продуктах. Но знание о содержании влаги в продукте по Карлу Фишеру не дает нам понимания о влиянии воды на стабильность и безопасность продукта.
С помощью метода титрования по Карлу Фишеру определяется содержание влаги во многих фармацевтических продуктах. Но знание о содержании влаги в продукте по Карлу Фишеру не дает нам понимания о влиянии воды на стабильность и безопасность продукта.
В свою очередь измерение активности воды (aw) дает нам информацию об энергетическом состоянии воды в продукте (ее «доступности» для развития бактерий и микроорганизмов).
Большое количество научных исследований показало, что активность воды является более достоверным показателем при определении стабильности и безопасности продукта, чем общее содержание влаги в продукте.
Ранее долгое время активность воды использовалась при определении безопасности пищевых продуктов, но с выходом публикации USP Method ее также начали рассматривать как важную составляющую при определении безопасности и стабильности в фармацевтической промышленности.
Распределение воды в продукте
Как известно воду в системе (в продукте) можно разделить на три составляющих: «свободную», поглощенную, и связанную воду. Свободная вода имеет такую же энергию и свойства, как и чистая вода. Абсорбированная вода связана с продуктом слабее, и имеет отличные от чистой воды свойства и более низкую энергию. «Связанная» вода имеет более низкие энергетические свойства благодаря наличию ионных связей. На самом деле молекулы воды свободно перемещаются между этими тремя формами и очень трудно определить количественное состояние каждого из трех форм. Более того, общий энергетический статус воды определяется как сумма энергий каждой формы. Понижение энергетического статуса системы (или активность воды), приводит к уменьшению «доступной» воды для прохождения химических и биологических реакций. Определение содержания влаги в продукте не дает нам информацию о ее распределении по формам.
Свободная вода имеет такую же энергию и свойства, как и чистая вода. Абсорбированная вода связана с продуктом слабее, и имеет отличные от чистой воды свойства и более низкую энергию. «Связанная» вода имеет более низкие энергетические свойства благодаря наличию ионных связей. На самом деле молекулы воды свободно перемещаются между этими тремя формами и очень трудно определить количественное состояние каждого из трех форм. Более того, общий энергетический статус воды определяется как сумма энергий каждой формы. Понижение энергетического статуса системы (или активность воды), приводит к уменьшению «доступной» воды для прохождения химических и биологических реакций. Определение содержания влаги в продукте не дает нам информацию о ее распределении по формам.
Титрование по Карлу Фишеру может дать нам даже количественное значение «связанной» воды, и считается более качественным методом, чем сушка продукта. Тем не менее, давая нам количественное значение «связанной» воды, метод титрования по Карлу Фишеру не дает нам информацию об энергетическом состоянии воды.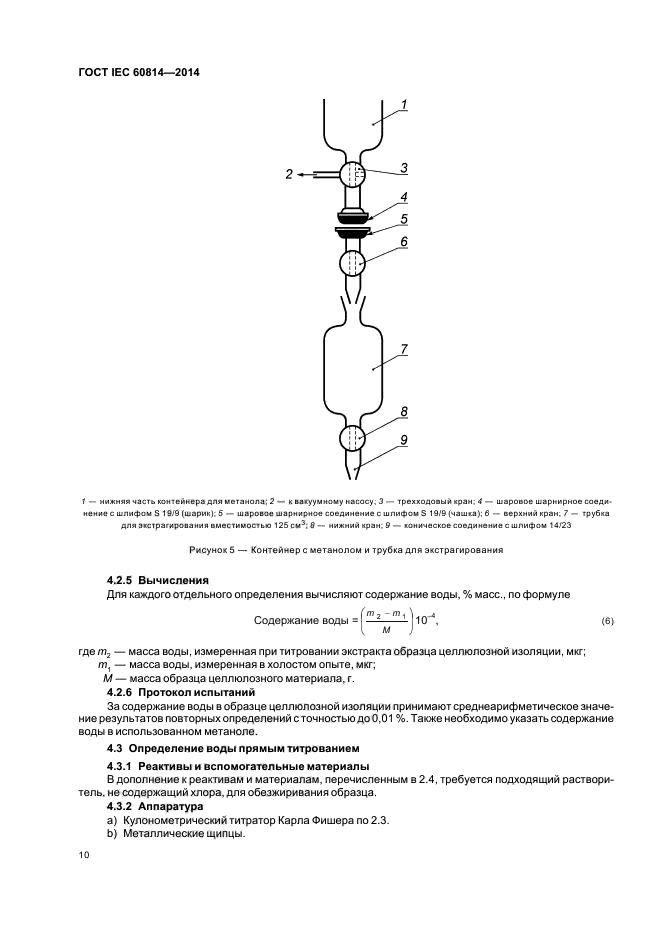 В то же самое время активность воды дает нам знать энергетический статус воды или ее «доступность» и не зависит от общего содержания влаги (зависит от распределения влаги по формам). Следовательно, активность воды дает более точное соответствие биологической и химической реакциям, чем метод Карла Фишера.
В то же самое время активность воды дает нам знать энергетический статус воды или ее «доступность» и не зависит от общего содержания влаги (зависит от распределения влаги по формам). Следовательно, активность воды дает более точное соответствие биологической и химической реакциям, чем метод Карла Фишера.
Что такое активность воды?
Активность воды описывает термодинамическое состояние воды в системе. Она не показывает, в каком количестве вода представлена в системе, но указывает как ее «энергетическое поведение» отличается от поведения чистой воды. Активность воды варьируется от 0 (абсолютно сухое вещество) до 1.0 (чистая вода). При снижении активность воды в системе, снижается энергетическая доступность воды, и она становится менее доступной в роли растворителя, необходимого для химических реакций, роста микроорганизмов, а также для перемещения воды в системе. Например, продукт, активность воды которого около 0,8 aw, может поддерживать рост плесени, в то время как в продукте с активность воды 0,6 aw не происходит роста никаких микроорганизмов. Вода становится более мобильной при увеличении активности воды, что влияет на молекулярную стабильность продукта, а также на химические и энзимные скорости реакции.
Вода становится более мобильной при увеличении активности воды, что влияет на молекулярную стабильность продукта, а также на химические и энзимные скорости реакции.
Если говорить более научным языком, то активность воды можно охарактеризовать как соотношение давления пара над продуктом (p) к давлению пара над чистой водой (po) при одной и той же температуре.
Для чего необходимо контролировать активность воды?
Активность воды является наилучшим показателем для определения возможного роста микроорганизмов. Продукт может иметь относительно большое процентное содержание воды, но при этом, если эта вода химически «связана» с помощью влагоудерживающих веществ или растворов, как соль, сахар, полиолы (высокомолекулярные спирты), в этом случае она недоступна для роста микроорганизмов.
Активность воды уже долгое время используется в пищевой и фармацевтической промышленности как критерий, служащий показателем стабильности, безопасности продукта. Каждый микроорганизм имеет определенное значение активности воды (aw), ниже которого они не могут размножаться. В то же самое время, нет никакой прямой зависимости между содержанием влаги в продукте и ростом микроорганизмов!
В то же самое время, нет никакой прямой зависимости между содержанием влаги в продукте и ростом микроорганизмов!
Также существует зависимость между активностью воды и стабильностью продукта. Различие в активностях воды компонентов, составляющих конечный продукт, или между продуктом и окружающей его среды, приводит к перемещению (миграции) влаги в продукте. Знание о том, будет ли продукт поглощать или отдавать влагу важно для предотвращения ухудшения свойств продукта, в особенности, если один из компонентов чувствителен к воздействию влаги. Например, если компонент 1 с влажностью 2% нужно смешать с равным количеством компонента 2 с влажностью 10%, будет ли при этом происходить взаимодействие влаги компонентов 1 и 2? Влажность конечного продукта будет равна 6%, но ответ о перемещении влаги будет зависит от значения активности воды. Т.е., если активность воды компонентов 1 и 2 одинакова, то между ними не будет никакого перемещения влаги.
Если два компонента с разными активностями воды, но одинаковым содержанием влаги в них, приводятся в соприкосновение, то вода будет мигрировать между ними, пока не наступит равновесие в активностях воды. Т.о., для предотвращения перемещения влаги в мультикомпонентном продукте, необходимо, чтобы активность воды компонентов его составляющих была примерно близка. Влага будет перемещаться от компонента с более высокой активностью воды к компоненту, имеющему более низкую активность воды. Такое перемещение влаги может привести к не желаемым изменениям в качествах всех компонентов. Поэтому контроль активности воды является важным при разработке новых рецептур, определения условий производства, а также условий упаковки и хранения продукта.
Т.о., для предотвращения перемещения влаги в мультикомпонентном продукте, необходимо, чтобы активность воды компонентов его составляющих была примерно близка. Влага будет перемещаться от компонента с более высокой активностью воды к компоненту, имеющему более низкую активность воды. Такое перемещение влаги может привести к не желаемым изменениям в качествах всех компонентов. Поэтому контроль активности воды является важным при разработке новых рецептур, определения условий производства, а также условий упаковки и хранения продукта.
Замена метода Карла Фишера с помощью активности воды
Анализ по методу Карла Фишера дает хорошие результаты лишь только в четко контролируемых условиях. Также этот тип анализа требует применения вредных химикатов и требует специального обучения для проведения тестов. Следовательно, необходимо найти более простою замену данному опыту. Активность воды является отличной заменой методу Карла Фишера, т.к. дает более важную информацию о состоянии воды в системе. Данные активности воды никак не будут совпадать с результатами, получаемыми методом Карла Фишера, но будут давать лучшее соответствие в вопросах роста микроорганизмов, химической стабильности и физических свойствах продукта. Особенно это становится заметным для продуктов, которые испытывают большие изменения в стабильности при небольших изменениях в содержании влаги в продукте.
Данные активности воды никак не будут совпадать с результатами, получаемыми методом Карла Фишера, но будут давать лучшее соответствие в вопросах роста микроорганизмов, химической стабильности и физических свойствах продукта. Особенно это становится заметным для продуктов, которые испытывают большие изменения в стабильности при небольших изменениях в содержании влаги в продукте.
Соотношение активности воды и метода Карла Фишера?
Существует зависимость между содержанием влаги в продукте (можно определить по методу Карла Фишера) и активностью воды, но она является сложной и уникальной для каждого отдельного продукта. Обычно при увеличении значения параметра активности воды идет увеличение содержания влаги в продукте, но это зависимость не линейна. Зависимость активность воды от содержания влаги в продукте при определенной температуре называется изотермой сорбции продукта. Для большинства продуктов изотерма сорбции имеет сигмоидальную форму, хотя для некоторых продуктов с большим содержанием кристаллических может иметь типа J. Наиболее часто встречаемым уравнением, применяемым для описания изотермы сорбции являются уравнения Guggenheim-Anderson-de Boer (GAB) и Brunauer-Emmett-Teller (BET). Данные уравнения служат для определения коэффициентов для лучшего описания поведения изотермы сорбции. Аналитические программы служат для определения данных коэффициентов, которые будут использованы для предсказания поведения зависимости активности воды от содержания влаги в продукте и наоборот.
Наиболее часто встречаемым уравнением, применяемым для описания изотермы сорбции являются уравнения Guggenheim-Anderson-de Boer (GAB) и Brunauer-Emmett-Teller (BET). Данные уравнения служат для определения коэффициентов для лучшего описания поведения изотермы сорбции. Аналитические программы служат для определения данных коэффициентов, которые будут использованы для предсказания поведения зависимости активности воды от содержания влаги в продукте и наоборот.
Полный анализ влаги в продукте с помощью одного инструмента
Несмотря на то, что активность воды является отличной альтернативой при определении стабильности и безопасности продукта, по сравнению с определением содержания влаги в нем по методу Карла Фишера, все же иногда необходимо знать именно содержание влаги в продукте. В этом случае метод Карла Фишера все равно может быть замещен определением активности воды, через которую посредством изотермы сорбции будет определено содержание влаги в продукте.
(PDF) Некоторые аспекты определения воды методом Карла Фишера
ЖУРНАЛ АНАЛИТИЧЕСКОЙ ХИМИИ
Vol. 62
62
№ 2
2007
НЕКОТОРЫЕ АСПЕКТЫ ОПРЕДЕЛЕНИЯ ВОДЫ ПО МЕТОДУ КАРЛА ФИШЕРА 195
Содержание воды в стандартном растворе
определено в день его приготовления. Для этого стандартный раствор и метанол, использованные для приготовления стандартного раствора,
титровали по методике, описанной выше.Содержание воды в стандартном растворе рассчитывали по уравнению
(3)
где
г
– навеска воды, израсходованной на приготовление стандартного раствора, мг,
V
2
– объем
реактива Карла Фишера, использованного для титрования
V
C
метанола, мл [7, с. 509].
1
Статистическую обработку результатов измерения
проводили в соответствии с рекомендациями руководства [10] с уровнем значимости 0.95
с использованием одностороннего ( ) или двустороннего (
P
) теста.
2
Мы использовали
Следующие обозначения:
N
– это количество измерений репликации
в эксперименте (при анализе
определенного образца),
S
и
RSD
являются образец абсолютного и
относительных стандартных отклонений одного результата,
F
представляет собой
Количество степеней свободы,
±
Δ
x
– это результат
определение содержания воды в определенной пробе, а
±
∆
М
является результатом определения
массы воды в определенной пробе.
Использовались выборочные дисперсии, предварительно оцененные
по результатам повторных анализов различных выборок. Эти значения выборочных дисперсий лучше характеризуют
соответствующих универсальных дисперсий, чем значения
, полученные на малых выборках [10, с. 84 и 98].
Значимость разницы между истинным значением
и средним значением выборки определяли по критерию
t
методом добавлено-найдено.Для сравнения
средних значений двух выборок использовали критерий
t
, если дисперсии
выборки по критерию
F
различались незначительно
[10, с. 122] и тест
q
, то есть тест Дункана, для
существенно различающихся выборочных дисперсий. Последний
обычно используется для попарного сравнения нескольких
средних, расположенных в порядке убывания; однако уровень значимости быстро снижается с увеличением числа
сравниваемых средних значений и достигает максимума в случае, когда сравниваются два средних
[10, с. 147].
147].
Предел определения, то есть наименьшая концентрация или количество, которое может быть определено максимальная
допустимая для количественной процедуры анализа
[12, с. 27]. В качестве последнего
было принято значение
3
RSD = 30, где
RSD
— относительное стандартное отклонение единичного результата
.
1
Уравнение в цитируемой книге также включает поправку на
поверхностную влажность в сосуде для титрования. Эта поправка отсутствует в
Eq. (3) потому что предлагаемая процедура включает другой способ
устранения поверхностной влаги.
2
Во избежание терминологической путаницы следует отметить, что величина
n
ранее называлась доверительным уровнем [11, с. 84].
mgV1
V1V2
–
——————,=
P
x
M
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3 отклонения оценены дляширокого диапазона концентраций воды в метаноле и
содержания воды в
α
-Al
2
O
3
получены из anКонцентрационные зависимости относительных стандартных отклонений
хорошо согласуются с
аналогичными зависимостями, приведенными в [13, с. 29] и ADE-
29] и ADE-
вклименно описаны уравнением
RSD =
A
+
B
/
C
, (4)
, где
C
– концентрация воды в метаноле или
содержание воды (массовая доля) в
α
-Al
2
O
3
.
Это уравнение линейно в координатах
RSD
–
1/
c
.
Мы нашли значения
RSD
, соответствующие предварительно
описанным значениям c, используя полученные линейные зависимости
для дальнейших статистических оценок. Согласно
статистике линейных зависимостей, числа
степеней свободы полученных оценок RSD
составляют N – 2, где N – общее количество экспериментов
, использованных для нахождения параметров уравнения.(4).
Полученные экспериментальные зависимости
описываются следующими уравнениями: = 0,018 + 0,026 (1/сох). (7)
Применяются для определения воды в метаноле с использованием разбавленного (уравнение (5)) и концентрированного (уравнение (6))
раствора реактива Карла Фишера и для определения-
воды в α-Al2O3 (уравнение (7)) (рис. 2 и 3).
2 и 3).
Экстраполяция полученных зависимостей на
ОСО = 30 позволяет оценить пределы определения
(наименьшее количество, которое можно определить)
воды в указанных пробах. Для метанола
0,04 и 0,09 мг/мл соответственно, а для α-Al2O3
0,09 мас.%. Фактическая концентрация воды в этих
объектах значительно выше; поэтому полученные значения
являются теоретическими.
Как видно из данных, представленных на рис. 2,
точность результатов анализа, полученных с использованием автоматизированных электрометрических методов, значительно хуже, чем в случае
предлагаемого метода с использованием разбавленных
Реактив Карла Фишера. Ориентировочные значения теоретических пределов определения воды в метаноле для
электрометрических методов составляют 0,1–0,13 мг/мл.
Действие влаги, содержащейся в колбе для титрования
, устраняется в процессе предварительного титрования путем связывания
всей содержащейся в колбах влаги, то есть
влаги, приносимой с растворителем и с раствором
фоновый краситель, влага, адсорбированная на стенках
сосуда, и водяной пар, содержащийся в объеме
сосуда. Такую процедуру следует проводить для
Такую процедуру следует проводить для
каждой отдельной колбы в день титрования; поэтому ни форма колб, ни меняющаяся изо дня в день влажность воздуха не могли повлиять на результат анализа. В предлагаемой методике
не используются громоздкие приспособления или
Некоторые аспекты определения воды методом Карла Фишера
Ничуговский Г.Ф., Определение влажности химических веществ, Ленинград: Химия, 1977.
Google Scholar
Артеменко А.И., Малеванный В.А., Тикунова И.В. Справочное руководство по химии . М.: Высшая школа, 1990.
Google Scholar
Манжелий Л.С., Бланк А.Б., Булгакова А.М., Никитина Л.М., Мартынченко Л.И. Щелочные и щелочноземельные галогениды), Харьков, 1971, ч. 2, с.120.
ГОСТ 14870-77 – Реактивы. Методы анализа воды .
Митчелл, Дж. и Смит, Д.М., Акваметрия , Нью-Йорк: Interscience, 1948.
и Смит, Д.М., Акваметрия , Нью-Йорк: Interscience, 1948.
Google Scholar
Справочник химика . Л.: Химия, 1971, вып. 1.
Колтхофф И.М., Белчер Р., Стенгер В.А., Мацуяма Г., Volumetric Analysis , New York: Interscience, 1957, vol. 3.
Google Scholar
Эбериус Э. и Ковальски В., З. Анал. хим. , 1956, том. 150, с. 13.
Артикул КАС Google Scholar
Fischer, E., Angew. хим. , 1952, том. 64, с. 592.
КАС Google Scholar
Doerffel, K., Statistik in der analytische Chemie , Leipzig: Deutsche Verlag für Grundstoffindustrie, 1990.
Google Scholar
Налимов В.В. Применение математической статистики при анализе веществ . М.: Физматгиз, 1960.
М.: Физматгиз, 1960.
Google Scholar
Бланк, А.Харьков, 2005.
Плинер Ю.Л., Свечникова Е.А. Управление качеством химического анализа в металлургии . М.: Металлургия, 1979.
. Google Scholar
Бонаугури, Э. и Сенига, Г., З. Анал. хим. , 1955, том. 144, с. 161.
Артикул КАС Google Scholar
Бланк Т.А., Экспериандова Л.П., Городилова Л.И., Паникарская В.Д., Кудин К.А., Функц. Матер. , 2005, том. 12, с. 600.
КАС Google Scholar
Margolis, S.A. and Angelo, J., Anal. Биоанал.хим. , 2002, том. 374, с. 505.
Артикул КАС Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Определение содержания воды по Карлу Фишеру: Фармацевтические рекомендации
Многие официальные лекарства содержат различное количество воды либо в форме кристаллизационной воды, т.е. гидратов, либо в абсорбированной форме. Поэтому важно указать пределы содержания воды, чтобы поддерживать однородность этих препаратов. Содержание воды можно определить с помощью любой из следующих процедур:Потеря при сушке, для лекарственных средств, не содержащих других компонентов, кроме воды, летучей при 105°C;
Содержание воды по Карлу Фишеру (титриметрический)
Смешайте и точно взвесьте испытуемое вещество и, если в отдельной статье не указано иное, проведите определение на 1–2 г.
 Если испытуемый образец имеет форму крупных кристаллов, уменьшите размер частиц примерно до 2 мм путем быстрого измельчения. Взвесьте неглубокую бутылку для взвешивания со стеклянной пробкой, высушенную в течение 30 минут в тех же условиях, которые будут использоваться при определении. Поместите испытуемый образец в бутыль, закройте крышку и точно взвесьте бутыль и содержимое. Осторожным встряхиванием из стороны в сторону распределите испытуемый образец как можно более равномерно на глубину около 5 мм, как правило, и не более 10 мм в случае объемных материалов.Поместите загруженную бутылку в сушильную камеру, сняв пробку и оставив ее также в камере. Образец высушивают при температуре и в течение времени, указанных в монографии. После открытия камеры немедленно закройте бутылку и дайте ей нагреться до комнатной температуры в эксикаторе перед взвешиванием.
Если испытуемый образец имеет форму крупных кристаллов, уменьшите размер частиц примерно до 2 мм путем быстрого измельчения. Взвесьте неглубокую бутылку для взвешивания со стеклянной пробкой, высушенную в течение 30 минут в тех же условиях, которые будут использоваться при определении. Поместите испытуемый образец в бутыль, закройте крышку и точно взвесьте бутыль и содержимое. Осторожным встряхиванием из стороны в сторону распределите испытуемый образец как можно более равномерно на глубину около 5 мм, как правило, и не более 10 мм в случае объемных материалов.Поместите загруженную бутылку в сушильную камеру, сняв пробку и оставив ее также в камере. Образец высушивают при температуре и в течение времени, указанных в монографии. После открытия камеры немедленно закройте бутылку и дайте ей нагреться до комнатной температуры в эксикаторе перед взвешиванием. Если вещество плавится при более низкой температуре, чем указанная для определения потери при сушке, выдерживают бутыль с ее содержимым в течение 1-2 часов при температуре на 5-10° ниже температуры плавления, затем сушат при указанной температуре .
Содержание воды по Карлу Фишеру
Наиболее важным методом определения содержания воды является метод электрометрического титрования Карла Фишера. Он широко применяется для определения влажности лекарственных веществ, потому что он очень быстрый, специфичный и требует очень небольшого количества образца.
Метод заключается в титровании образца в метаноле реактивом Карла Фишера, который включает йод, диоксид серы, пиридин и метанол. Участвующие реакции показаны как:
I 2 + SO 2 + H 2 O –> 2HI + SO 3
SO 3 + C 5 H 5 N –> C 5 H 5 N.SO 3 (пиридин-триоксид серы)
HI + C 5 H 5 N –> C 5 H 5 N.HI
C 5 H 5 N.SO 3 + CH 3 OH –> C 5 H 5 N.HSO 4 CH 9 0
Поместите достаточное количество метанола в сосуд для титрования и добавьте достаточное количество реактива Карла Фишера, чтобы получить характеристическую конечную точку. Точно взвесьте 150-350 мг тартрата натрия (Na 2 C 4 H 4 O 6 ,2H 2 O) точно взвесьте по разнице и титруйте до конечной точки. Фактор водного эквивалента F в мг воды на мл реагента определяется выражением 0,1566 вес/объем, где w — вес в мг тартрата натрия, а v — объем реагента в мл. обязательный.
Точно взвесьте 150-350 мг тартрата натрия (Na 2 C 4 H 4 O 6 ,2H 2 O) точно взвесьте по разнице и титруйте до конечной точки. Фактор водного эквивалента F в мг воды на мл реагента определяется выражением 0,1566 вес/объем, где w — вес в мг тартрата натрия, а v — объем реагента в мл. обязательный.
Коэффициент водного эквивалента F, в мг H 2 O на мл реагента, рассчитывается по формуле 0.1566 x масса/объем, где W — масса тартрата натрия в мг, а V — объем реагента в мл.
Каждый мг тартрата натрия эквивалентен:
2H 2 O 36.04
———————— = ————– = 0,155 мг H 2 O
Na 2 C 4 H 4 O 6 ,2H 2 O 230,08 ПроцедураВ колбу для титрования добавляют 30 мл метанола.
Нейтрализовать реагентом Карла Фишера до электрометрической конечной точки.
Наполнить бюретку.
Взвесьте точно указанное количество образца и перенесите в колбу для титрования, перемешайте в течение 1 минуты и оттитруйте раствор реактивом Карла Фишера до конечной электрометрической точки.
Запишите объем израсходованного реактива Карла Фишера.
Формула расчета:
Б.Р. х Ф х 100
% воды (вес/вес) = ————————–
Вес x 1000
Где,
Б.R = объем израсходованного реактива Карла Фишера в мл.
F = Фактор реагента Карла Фишера в мг/мл.
wt = Вес взятого образца в г.
Блог The Scientific Gear | Стандарты воды Карла Фишера
Мы все это видели. Мы проводим тест, чтобы увидеть, сколько влаги содержится в нашем образце, когда по необъяснимым причинам жидкость внутри сосуда Карла Фишера начинает менять цвет с нормального светло-желтого на темно-красный. Иногда экран титратора информирует нас о проблеме с цифровым индикатором, показывающим страшные
.
”
ПЕРЕТИТРОВАНИЕ !”
Иногда цифровая индикация вообще ничего не говорит.В любом случае оператор знает, что что-то пошло не так, потому что титратор Карла Фишера больше не дает результатов измерения влажности. Паника, чтобы выяснить проблему и снова начать тестирование, становится непосредственным приоритетом.
Но с чего начать?
Как оказалось, «чрезмерное титрование», вероятно, является одной из 2 или 3 основных жалоб или проблем , о которых мы слышим от операторов. Так что же вызывает эту проблему? Как мы можем определить источник этой проблемы, устранить ее и, что более важно, как мы можем избежать ее?
Это критический вопрос для операторов и менеджеров, работающих на производстве или в сфере контроля качества, которые заинтересованы в поддержании своего титратора Карла Фишера на 100 % «в рабочем состоянии» изо дня в день.Очень важно иметь возможность правильно определить проблему, чтобы можно было быстро принять соответствующие меры.
Итак, как нам решить проблему «избыточного титрования»? Зная факты . Четкое понимание процесса может помочь операторам быстрее решить проблему, когда время имеет решающее значение.
Важные факты, которые следует знать о избыточном титровании:
- Чрезмерное титрование – это состояние, при котором в сосуде содержится больше йода, чем воды (общее определение).
- При перетитровании сосуд становится очень темным из-за большого количества йода внутри сосуда.
- Реагент внутри сосуда обычно должен иметь светло-желтый цвет, за исключением очень темных образцов, таких как масло.
- Титратор Карла Фишера всегда пытается поддерживать равновесие, когда вводится ровно столько йода, чтобы противодействовать и нейтрализовать воду, присутствующую внутри сосуда.
- Во время одного теста на титрование должно быть введено ровно столько йода, сколько нужно, чтобы противодействовать и нейтрализовать количество воды, присутствующей внутри сосуда для титрования во время этого теста, – не больше и не меньше.

- Любой инцидент, который влияет на конечное количество йода, введенного во время теста титрования, может привести к нарушению равновесия и привести к тому, что будет введено больше йода, чем необходимо.
Важные факты, которые необходимо знать о титраторе Карла Фишера Стеклянная посуда:
- Сосуд и стеклянная посуда Карла Фишера состоят из следующих компонентов:
- Сосуд (кулонометрический и объемный)
- Генераторный электрод (только кулонометрический) — Генераторный электрод представляет собой прецизионный электрод, предназначенный для подачи электрического тока внутри сосуда к реагенту, заставляющего реагент производить йод
- Насадка для титрования (только объемная) — насадка для титрования подает точное количество йода (композитного или титранта) через механизм, приводимый в действие бюреткой, с использованием поршня
- Детекторный электрод (кулонометрический и волюметрический) — Детекторный электрод имеет единственное назначение и, возможно, самую важную роль в постоянном контроле и определении уровней проводимости в сосуде для титрования.

Итак, каковы причины, которые могут привести к чрезмерному титрованию?
✓ Поврежденный электрод детектора
✓ «Обманутый» или «обманутый» детекторный электрод (без шуток)
Поскольку кулонометрические и волюмометрические титраторы Карла Фишера по-разному справляются с подачей йода, стоит описать эти два метода отдельно.
Несколько слов о кулонометрическом титровании по методу Карла Фишера:
В кулонометрической системе реагент представляет собой полную систему, в которой он предназначен для выделения йода, когда генераторный электрод подает на него электрический ток.Так что же заставляет генераторный электрод выдавать слишком большой ток, вызывая перепроизводство йода? Другими словами, «кто или что» говорит генераторному электроду продолжать генерировать ток, когда он не нужен?
Электрод детектора! Так зачем электроду детектора это делать?
Не слишком углубляясь в электронику, электрод детектора предназначен для «обнаружения» проводимости в сосуде. В зависимости от обнаруженной величины электропроводности электрод-детектор отправит титратору сообщение о продолжении подачи тока, достаточного для высвобождения соответствующего количества йода, противодействующего и нейтрализующего воду, присутствующую в сосуде.Пока этот процесс работает во время титрования, будет найдена возможная конечная точка и будет получен результат.
В зависимости от обнаруженной величины электропроводности электрод-детектор отправит титратору сообщение о продолжении подачи тока, достаточного для высвобождения соответствующего количества йода, противодействующего и нейтрализующего воду, присутствующую в сосуде.Пока этот процесс работает во время титрования, будет найдена возможная конечная точка и будет получен результат.
Так что это действительно проблема дезинформации . Если титратор Карла Фишера не получает правильную информацию от электрода детектора, возможно чрезмерное титрование.
Проблемы, которые, как мы видим, могут повлиять на правильное функционирование электрода детектора, включают:
- Кабель электрода. Если кабель треснет или порвется, это может привести к ситуации, когда на титратор будет выведено сообщение о продолжении подачи тока – постоянно.В этом случае сосуд станет очень темным, и в большинстве случаев титратор даже не узнает, что он находится в состоянии избыточного титрования.
 Генераторный электрод будет просто продолжать производить ток, делая сосуд очень темным. Других предупреждений или уведомлений от титратора для оператора не будет.
Генераторный электрод будет просто продолжать производить ток, делая сосуд очень темным. Других предупреждений или уведомлений от титратора для оператора не будет. - Треснувший электрод. Иногда неправильное обращение или даже подпрыгивание стержня мешалки внутри сосуда может вызвать крошечную трещину в нижней части электрода детектора, которую нельзя увидеть невооруженным глазом.Эти трещины могут пропускать внутрь электрода небольшое количество реагента, достаточное для того, чтобы возникали ошибки в обнаружении. В результате возникает нестабильный дрейф, который прыгает, давая титратору неправильные показания. Прыгающий и нестабильный дрейф может быть уловлен титратором, и на экране титратора может появиться сообщение об ошибке «OVER TITRATION».
- Кабельные соединители. Иногда разъемы самого титратора могут загрязняться, намокать и корродировать. Кроме того, в некоторых электродах используется конструкция с несколькими штекерами, которые также могут загрязняться, намокать и подвергаться коррозии.
 Эти разъемы, если они не чистые и не сухие, могут привести к аналогичным неправильным показаниям, подобным треснувшему электроду, когда дрейф начинает прыгать и становится нестабильным. В этом случае титратор может также указать, что имеет место «ПЕРЕТИТИРОВАНИЕ».
Эти разъемы, если они не чистые и не сухие, могут привести к аналогичным неправильным показаниям, подобным треснувшему электроду, когда дрейф начинает прыгать и становится нестабильным. В этом случае титратор может также указать, что имеет место «ПЕРЕТИТИРОВАНИЕ».
“Обманутый” или “обманутый” детекторный электрод, говорите вы?
Если определено, что проблема не в электроде детектора, нам нужно посмотреть на перемешивание внутри сосуда. Если высвобождающийся йод плохо перемешивается из-за того, что мешалка выключена или установлена на слишком низкое значение, то детекторный электрод не обнаружит, что йод уже высвобождается внутри сосуда.Это приведет к тому, что электрод детектора будет продолжать указывать титратору производить больший ток через электрод генератора до момента, когда электрод детектора обнаружит снижение уровня проводимости внутри сосуда. Проводимость снижается только при взаимодействии йода с водой. Поэтому важно, чтобы электрод детектора определял истинную и наиболее точную «смесь или состояние» йода и воды во время процесса титрования. Если он не знает истинного состояния смеси, он будет введен в заблуждение и скажет титратору продолжать работу, что приведет к ПЕРЕТИТРОВАНИЮ.
Если он не знает истинного состояния смеси, он будет введен в заблуждение и скажет титратору продолжать работу, что приведет к ПЕРЕТИТРОВАНИЮ.
Несколько слов о волюметрическом титровании по методу Карла Фишера:
В волюмометрической системе установка реагента отличается, когда композит или титрант вводятся через поршень бюретки через сопло для титрования. Количество вводимого композита или титранта зависит от команд титратора. Команда от титратора на бюретку и поршень, выталкивающие «йод» через сопло титрования, да, подается электродом-детектором. Для целей данного обсуждения разница между кулонометрической и волюметрической установками заключается в том, что доставка йода различна.Но та же проблема может возникнуть, когда йод плохо смешивается и, следовательно, обманывает электрод детектора, думая, что внутри сосуда недостаточно йода, чтобы противодействовать и нейтрализовать воду. Поскольку и кулонометрические, и волюмометрические титраторы Карла Фишера используют детекторные электроды, упомянутые выше проблемы, связанные с детекторным электродом, будут справедливы и для волюмометрических титраторов.
7 мыслей (что нужно и чего нельзя делать) о решении и предотвращении проблем:
1. Не допускайте неправильного обращения с электродом детектора ! Будьте очень осторожны с электродом детектора и не трогайте его без необходимости. Небольшие удары (лязг) тут и там могут привести к трещине. Вам действительно нужно все время вынимать электрод детектора из сосуда?
2. Не увеличивать скорость мешалки титратора до высокой. Это приведет только к тому, что стержень мешалки будет бесконтрольно подпрыгивать и, возможно, ударит и повредит электрод детектора (трещина).
3. Выполните осмотр всех соединений и разъемов кабеля электрода детектора и титратора Карла Фишера, чтобы убедиться, что они сухие и чистые.
4. Будьте осторожны с кабелем электрода детектора. Старайтесь не сгибать его без необходимости.
5. При выполнении убедитесь, что перемешивание внутри сосуда достаточно для эффективного перемешивания йода. Должен быть виден небольшой вихрь. Но не слишком быстро, чтобы мешалка подпрыгивала.
Должен быть виден небольшой вихрь. Но не слишком быстро, чтобы мешалка подпрыгивала.
6. Внесите немного влаги в . Иногда, когда вы находитесь в ситуации чрезмерного титрования, а сосуд уже очень темный, вы можете ввести немного влаги, чтобы вернуть сосуд в равновесие.Иногда это срабатывает, и сразу сосуд из темно-красного цвета становится светло-желтым.
7. У должен быть запасной электрод детектора. На этот маленький электрод, кажется, не обращают внимания, но он играет огромную роль внутри сосуда титратора Карла Фишера.
Санитарная инспекция, анализ качества воды на микроорганизмы и безопасность воды в ручных насосах в сельских районах Африки к югу от Сахары
В этом исследовании изучалась взаимосвязь между санитарным контролем и качеством воды на наличие микробов с использованием данных более 1000 ручных насосов в 12 странах ЮЮА.Результаты подтверждают использование альтернативной модели, которая отражает причинный путь загрязнения водной системы и показывает, что связь между санитарным контролем и микробным загрязнением можно моделировать более продуманно. Когда применялись предыдущие статистические модели, они не выявили значимой корреляции между оценкой санитарного риска и появлением E. coli . Когда была применена наша альтернативная модель, учитывающая взаимосвязь между источниками загрязнения, переносчиками и поломками барьера, она продемонстрировала слабую, но значимую связь между поломками ручных насосов и E.coli появление. Кроме того, он показывает, что некоторые санитарные факторы риска, особенно разрушение ограждений, более тесно связаны с качеством воды, чем другие.
Когда применялись предыдущие статистические модели, они не выявили значимой корреляции между оценкой санитарного риска и появлением E. coli . Когда была применена наша альтернативная модель, учитывающая взаимосвязь между источниками загрязнения, переносчиками и поломками барьера, она продемонстрировала слабую, но значимую связь между поломками ручных насосов и E.coli появление. Кроме того, он показывает, что некоторые санитарные факторы риска, особенно разрушение ограждений, более тесно связаны с качеством воды, чем другие.
Альтернативная модель показала, что сценарий риска, при котором присутствует пробой барьера, но отсутствуют источник заражения и носитель, был единственным сценарием, достоверно связанным с появлением E. coli (OR = 3,6, p = 0,019). Это может свидетельствовать о том, что разрушение барьера является лучшим предиктором E.coli , что важные источники и переносчики контаминации отсутствуют в действующих формах и моделях санитарного надзора и/или что источники и переносчики труднее надежно зафиксировать с помощью средств санитарного надзора, чем при разрушении барьеров. Ограниченная роль факторов риска носительства в модели, возможно, неудивительна, поскольку только один санитарный фактор риска (стоячая вода в пределах двух метров) попадает в категорию носительства. Чтобы решить эту проблему, в модель были добавлены недавние осадки, о которых ранее сообщалось, что они являются важным предиктором и переносчиком микробного загрязнения 10,13,15 .Когда осадки были включены в качестве переносчика загрязнения, соответствие альтернативной модели немного улучшилось (AIC: 1079 до 1070, R 2 : 0,0086 до 0,019), но ни один из сценариев риска не был значимо связан с E. coli появление.
Ограниченная роль факторов риска носительства в модели, возможно, неудивительна, поскольку только один санитарный фактор риска (стоячая вода в пределах двух метров) попадает в категорию носительства. Чтобы решить эту проблему, в модель были добавлены недавние осадки, о которых ранее сообщалось, что они являются важным предиктором и переносчиком микробного загрязнения 10,13,15 .Когда осадки были включены в качестве переносчика загрязнения, соответствие альтернативной модели немного улучшилось (AIC: 1079 до 1070, R 2 : 0,0086 до 0,019), но ни один из сценариев риска не был значимо связан с E. coli появление.
Неудивительно, что статистические модели, сравнивающие оценку санитарного риска и частоту возникновения E. coli , не дают значимой связи, что соответствует результатам исследований, в которых использовались установленные модели 12,13,16,17,18 .Санитарная инспекция была разработана как инструмент оценки риска и принятия решений, и ожидается, что она будет слабо коррелировать с появлением E. coli в данной пробе воды в данный момент времени 14 . Эту слабую корреляцию демонстрируют значения R 2 , которые не превышали 3% ни в одной из моделей данного исследования. Мы предлагаем три объяснения малых значений R 2 : (1) одно измерение E. coli не точно отражает микробное качество воды данной системы водоснабжения с течением времени; (2) текущие формы санитарной инспекции ВОЗ не указывают должным образом все соответствующие источники, носители и нарушения барьеров, влияющие на загрязнение системы водоснабжения; (3) использование модели, которая не взвешивает факторы риска, искажает ассоциации, в которых небольшое количество важных факторов доминирует над микробным риском.Возможно, что одно, два или все три из этих объяснений применимы в некоторых условиях.
coli в данной пробе воды в данный момент времени 14 . Эту слабую корреляцию демонстрируют значения R 2 , которые не превышали 3% ни в одной из моделей данного исследования. Мы предлагаем три объяснения малых значений R 2 : (1) одно измерение E. coli не точно отражает микробное качество воды данной системы водоснабжения с течением времени; (2) текущие формы санитарной инспекции ВОЗ не указывают должным образом все соответствующие источники, носители и нарушения барьеров, влияющие на загрязнение системы водоснабжения; (3) использование модели, которая не взвешивает факторы риска, искажает ассоциации, в которых небольшое количество важных факторов доминирует над микробным риском.Возможно, что одно, два или все три из этих объяснений применимы в некоторых условиях.
Маловероятно, что одна проба воды с микробами точно отразит основную тенденцию качества воды в системе водоснабжения. Встречаемость и концентрация E. coli сильно различаются в пространстве и времени. Предыдущие исследования показали, что микробы неравномерно распределены в источниках воды, а это означает, что две пробы качества воды могут содержать очень разные концентрации E. coli , даже если они взяты из одного и того же источника в одно и то же время 19 .Микробное загрязнение также резко меняется в течение коротких периодов времени и зависит от сезонных погодных условий и недавних осадков 20 .
coli сильно различаются в пространстве и времени. Предыдущие исследования показали, что микробы неравномерно распределены в источниках воды, а это означает, что две пробы качества воды могут содержать очень разные концентрации E. coli , даже если они взяты из одного и того же источника в одно и то же время 19 .Микробное загрязнение также резко меняется в течение коротких периодов времени и зависит от сезонных погодных условий и недавних осадков 20 .
Альтернативная модель была разработана на основе предположения, что источник загрязнения, переносчик и разрушение барьера необходимы для возникновения загрязнения в системе водоснабжения. Однако результаты показывают, что только сценарий, в значительной степени связанный с появлением E. coli , представляет собой сценарий, в котором присутствует только разрушение барьера.Это говорит о том, что факторы санитарного риска в нынешних формах могут неадекватно охватывать все соответствующие источники загрязнения, носители и нарушения барьеров для систем водоснабжения в условиях исследования. Экологические, технические и социальные факторы, не включенные в действующие формы санитарного надзора, также могут иметь важное значение для объяснения загрязнения. Например, топография 15 , возраст системы водоснабжения 21 и плотность населения 22 были определены как детерминанты загрязнения системы водоснабжения и не включены в формы санитарной инспекции ВОЗ.
Экологические, технические и социальные факторы, не включенные в действующие формы санитарного надзора, также могут иметь важное значение для объяснения загрязнения. Например, топография 15 , возраст системы водоснабжения 21 и плотность населения 22 были определены как детерминанты загрязнения системы водоснабжения и не включены в формы санитарной инспекции ВОЗ.
Наконец, формы санитарной инспекции ВОЗ не взвешивают факторы риска, но некоторые факторы могут быть более влиятельными, чем другие. Наличие трещин в плите, например, может быть в большей или меньшей степени связано с микробным загрязнением, чем отсутствие ограждения, а относительная важность различных факторов может даже варьироваться в зависимости от условий, времени года и/или качества строительства. Во многих случаях одно серьезное нарушение барьера может доминировать над всеми другими факторами риска в этой категории. Такие ограничения могут уменьшить очевидную связь между санитарным контролем и микробиологическим качеством воды. Тем не менее, все санитарные факторы риска, по-видимому, заслуживают внимания и рассмотрения, и, таким образом, нынешний подход к санитарной инспекции можно считать более подходящим в качестве инструмента оценки риска, чем в качестве косвенного показателя микробиологических данных.
Тем не менее, все санитарные факторы риска, по-видимому, заслуживают внимания и рассмотрения, и, таким образом, нынешний подход к санитарной инспекции можно считать более подходящим в качестве инструмента оценки риска, чем в качестве косвенного показателя микробиологических данных.
Результаты этого исследования имеют значение для управления сельским водоснабжением, политики и дальнейших исследований. Что касается управления, санитарная инспекция должна иметь приоритет перед анализом качества воды как средство выявления и приоритизации ремонта систем водоснабжения.Это особенно ценно в условиях, когда проверка качества воды проводится нечасто или невозможна. Хотя санитарная инспекция и анализ качества воды рекомендуются в качестве дополнительных инструментов, многие небольшие сельские системы водоснабжения в АЮС не проводят мониторинг качества воды с периодичностью, рекомендованной ВОЗ 23 или другими 24 . Таким образом, один тест, который не может обнаружить E. coli , может дать менеджерам ложное чувство безопасности, если он не сопровождается данными санитарной инспекции.Результаты санитарной инспекции меняются со временем меньше, чем результаты микробиологического контроля качества воды, требуют меньшей технической подготовки для выполнения и предоставляют полезную информацию даже при нечастом проведении. Оператор даже небольшого водопровода должен иметь возможность самостоятельно проводить санитарный осмотр один или несколько раз в год; операторы должны быть обучены или, по крайней мере, приглашены на плановые проверки, проводимые правительствами и другими исполнителями, для обучения. При выявлении фактора санитарного риска следует принять меры по ремонту системы или иным образом уменьшить риск.Корректирующие действия могут включать заделку трещин и утечек, ремонт или замену поврежденных или отсутствующих компонентов или, в крайних случаях, восстановление поврежденных систем. Операторы должны быть обучены выполнению основных действий по устранению неполадок или получить доступ к внешней поддержке для более сложных действий по устранению неполадок.
coli , может дать менеджерам ложное чувство безопасности, если он не сопровождается данными санитарной инспекции.Результаты санитарной инспекции меняются со временем меньше, чем результаты микробиологического контроля качества воды, требуют меньшей технической подготовки для выполнения и предоставляют полезную информацию даже при нечастом проведении. Оператор даже небольшого водопровода должен иметь возможность самостоятельно проводить санитарный осмотр один или несколько раз в год; операторы должны быть обучены или, по крайней мере, приглашены на плановые проверки, проводимые правительствами и другими исполнителями, для обучения. При выявлении фактора санитарного риска следует принять меры по ремонту системы или иным образом уменьшить риск.Корректирующие действия могут включать заделку трещин и утечек, ремонт или замену поврежденных или отсутствующих компонентов или, в крайних случаях, восстановление поврежденных систем. Операторы должны быть обучены выполнению основных действий по устранению неполадок или получить доступ к внешней поддержке для более сложных действий по устранению неполадок.
Последствия для политики включают возможные модификации существующих форм санитарной инспекции для повышения их полезности для оценки уязвимости системы водоснабжения. Дополнительные носители и источники риска, основанные на доказательствах, могут быть включены в санитарные инспекции, или данные открытого доступа могут быть загружены и включены после сбора данных санитарной инспекции, в зависимости от ситуации.
Последствия для исследований включают необходимость разработки более крупных и богатых наборов данных, связывающих данные санитарного надзора, продольные метеорологические данные, данные о качестве воды и/или результатах для здоровья, а также использование этих наборов данных для дальнейшей проверки и улучшения существующих инструментов и форм санитарного надзора. Такие мероприятия могут включать в себя проверку интеграции сезона как переменной или ковариации в санитарных инспекциях, изучение значимости дополнительных факторов риска (таких как глубина колодца, прерывистая или непрерывная подача воды, характеристики почвы, факторы сообщества и т. д.) при санитарных инспекциях и/или дальнейшем изучении важности взаимодействия между факторами санитарного риска. Изучение того, в какой степени значимость различных санитарных факторов риска различается в разных условиях, также может способствовать дальнейшим уточнениям.
д.) при санитарных инспекциях и/или дальнейшем изучении важности взаимодействия между факторами санитарного риска. Изучение того, в какой степени значимость различных санитарных факторов риска различается в разных условиях, также может способствовать дальнейшим уточнениям.
Эта работа имеет несколько ограничений. Хотя размер выборки в 1028 человек был достаточным для регрессионного анализа, набор данных объединяет данные из 12 географически разных стран АЮС. Более крупный набор данных позволил бы дезагрегировать данные на страновом уровне, что могло бы привести к выводам по конкретным странам и регионам.Модели, использованные в этом исследовании, были относительно простыми и не включали переменные системы водоснабжения, такие как глубина колодца, характеристики почвы, постоянное и прерывистое давление в водопроводных системах и т. д., а также не учитывали ковариаты, такие как размер общины, степень сельской местности, плотность населения, геологическое строение недр, интенсивность животноводческой деятельности, параметры землепользования и санитарии, а также другие факторы, способные способствовать фекальному загрязнению водных систем; включение таких переменных в будущие анализы может улучшить взаимосвязь между показателями санитарной инспекции и данными о микробном качестве воды.
Что касается альтернативной модели, использованной в этом исследовании, некоторые факторы риска было трудно классифицировать. В то время как наличие поврежденных или треснутых дренажных каналов было классифицировано как барьерный фактор, его можно было бы классифицировать как фактор переноса, поскольку он связан с выбросом перекачиваемой воды, которая может просачиваться в скважину и переносить близлежащие загрязнения в систему водоснабжения.
Наша обновленная альтернативная модель обеспечивает простую концептуальную основу для представления и оценки санитарных факторов риска в отношении их вероятной роли в путях микробной передачи.В текущей работе каждая категория риска (источник загрязнения, носитель, нарушение барьера) классифицируется как присутствующая или отсутствующая. Более подробный метод, который включает эти группы факторов и отдельные факторы риска в них и/или учитывает кумулятивное воздействие нескольких факторов риска в данной категории, может повысить ценность этих инструментов санитарной проверки. Как отмечалось выше, преимущества любых таких улучшений в отношении диагностической и прогностической способности должны быть взвешены с любой связанной с этим потерей простоты, прежде чем определять, уместно ли их включение в обычные санитарные проверки.
Как отмечалось выше, преимущества любых таких улучшений в отношении диагностической и прогностической способности должны быть взвешены с любой связанной с этим потерей простоты, прежде чем определять, уместно ли их включение в обычные санитарные проверки.
Санитарный контроль и анализ качества воды являются дополнительными и ценными инструментами для описания и защиты безопасности воды. Санитарная инспекция особенно полезна в условиях, когда анализ качества воды не проводится часто, поскольку он позволяет выявить и устранить риски для безопасности воды. По мере повышения уровня обслуживания в сельских ССО мы должны рассмотреть наиболее эффективные способы обеспечения безопасности воды в сельских системах водоснабжения, а актуальность санитарного надзора как инструмента оценки риска, вероятно, возрастет.Мы рекомендуем, чтобы операторы систем водоснабжения прошли обучение санитарному надзору и мерам по устранению недостатков, а также регулярно проводили проверки. Кроме того, санитарные инспекции могут более эффективно обеспечивать своевременные и надлежащие действия, если они сочетаются с мобильными инструментами обследования и/или полуавтоматическими инструментами анализа, что способствует быстрому реагированию и эффективному принятию решений. По мере того, как предпринимаются эти усилия по мониторингу и реализации, исследователи также должны стремиться продолжать сбор и обобщение данных о микробном качестве воды, санитарном риске и соответствующих результатах, а также продолжать изучать взаимосвязь между уязвимостью системы водоснабжения и загрязнением.Такое исследование выиграет от использования структуры, которая включает данные о причинных путях загрязнения, а также социальных и экологических детерминантах загрязнения, и которая способствует своевременному и эффективному реагированию на выявленные риски для безопасности воды.
По мере того, как предпринимаются эти усилия по мониторингу и реализации, исследователи также должны стремиться продолжать сбор и обобщение данных о микробном качестве воды, санитарном риске и соответствующих результатах, а также продолжать изучать взаимосвязь между уязвимостью системы водоснабжения и загрязнением.Такое исследование выиграет от использования структуры, которая включает данные о причинных путях загрязнения, а также социальных и экологических детерминантах загрязнения, и которая способствует своевременному и эффективному реагированию на выявленные риски для безопасности воды.
Кулонометрическое титрование по методу Карла Фишера с пояснениями и иллюстрациями
Загрязнение воды является причиной серьезного беспокойства в большом количестве применений. В некоторых отраслях и средах вода является гораздо более разрушительным загрязнителем, чем твердые частицы, и часто упускается из виду как основная причина выхода из строя компонентов.В некоторых случаях даже небольшое количество воды может нанести вред производству или оборудованию.
Вода может существовать в трех состояниях или фазах. Растворенная вода характеризуется отдельными молекулами воды, рассеянными по всему объему масла. Подобно влаге в воздухе, растворенная вода не видна в масле. Если в масле слишком много воды, молекулы диспергированной воды начинают насыщаться; это похоже на образование тумана. Когда это происходит, вода считается эмульгированной.Свободная вода образуется, когда добавление воды приводит к фазовому разделению обоих жидких компонентов с образованием слоя воды.
Существует несколько методов определения уровня загрязнения воды в жидкостях. Кулонометрический титратор Карла Фишера (KF) является одним из наиболее точных методов. В отличие от других методов, он может отслеживать низкие уровни свободных, эмульгированных и растворенных веществ (которые не могут быть обнаружены другими методами, такими как тест на кракле). При правильном использовании тест способен измерять уровни воды до 1 ppm или 0.0001 процент.
Кулонометрический и волюметрический
Титрование — это химический анализ, определяющий содержание вещества, например воды, путем добавления реагента известной концентрации в тщательно отмеренных количествах до завершения химической реакции. Существует два типа титраторов Карла Фишера: волюметрические и кулонометрические титраторы. Основное различие между ними заключается в том, что при объемном методе титрант добавляется непосредственно в образец с помощью бюретки.И наоборот, при кулонометрическом методе титрант образуется электрохимически в ячейке для титрования. Кулонометрический метод измеряет уровень воды намного ниже, чем объемный метод.
Существует два типа титраторов Карла Фишера: волюметрические и кулонометрические титраторы. Основное различие между ними заключается в том, что при объемном методе титрант добавляется непосредственно в образец с помощью бюретки.И наоборот, при кулонометрическом методе титрант образуется электрохимически в ячейке для титрования. Кулонометрический метод измеряет уровень воды намного ниже, чем объемный метод.
Кулонометрическое титрование Основы химии
Для титрования по методу Карла Фишера была предложена следующая схема реакции:
ROH представляет собой спирт, такой как метанол или этанол.
В кулонометрическом методе ячейка для титрования состоит из двух частей: анодной и катодной.На рис. 1 показаны оба отсека, разделенные керамической диафрагмой. Анодное отделение содержит раствор анолита, который включает диоксид серы (SO 2 ), йодид (I – ) и имидазол, необходимые для химической реакции. В качестве растворителя обычно используют метанол или этанол (ROH).
Рисунок 1. Ячейка для титрования (любезно предоставлена Mettler-Toledo)
При кулонометрическом титровании по методу Карла Фихера йод (I 2 ) образуется электрохимически из йодида (I – ).При контакте йода (I 2 ) с водой в пробе воду титруют по указанной выше схеме реакции (уравнения № 1 и № 2). Как только вся доступная вода прореагировала, реакция завершена. Количество воды в образце рассчитывают путем измерения тока, необходимого для электрохимического образования йода (I 2 ) из йодида (I – ) в соответствии со следующей реакцией (уравнение № 3):
Особенности кулонометрического титратора
Есть несколько особенностей, которые следует учитывать при выборе кулонометрического титратора Карла Фишера.В таблице 1 перечислены производители, предлагающие кулонометрические титраторы Карла Фишера. Каждый производитель предлагает разные функции.
Чувствительность к влажности
Влажность, вероятно, является самым большим источником ошибок при титровании. Во время настройки и испытаний следует соблюдать особые меры предосторожности, особенно в прибрежных или тропических регионах. Система кондиционирования воздуха должна быть оборудована конденсатором влаги. Кроме того, титратор Карла Фишера не следует устанавливать рядом с вентиляционным отверстием кондиционера.
Во время настройки и испытаний следует соблюдать особые меры предосторожности, особенно в прибрежных или тропических регионах. Система кондиционирования воздуха должна быть оборудована конденсатором влаги. Кроме того, титратор Карла Фишера не следует устанавливать рядом с вентиляционным отверстием кондиционера.
Ячейки для титрования закрыты, чтобы исключить попадание воды из атмосферы; однако очень небольшое количество воды почти всегда попадает в ячейку для титрования. Количество воды, поступающее за определенный период времени, называется дрейфом. Многие производители указывают значения дрейфа и максимально допустимую влажность воздуха.
Чувствительность к pH
Химическая реакция чувствительна к кислотности или щелочности раствора.Оптимальный диапазон pH раствора образца для эффективного титрования по методу Карла Фишера находится между pH 5,5 и 8. Когда pH больше 8,5, скорость реакции увеличивается из-за побочных химических реакций. Это приводит к более вялой конечной точке и более высокому потреблению йода, что повлияет на результаты. Буферные агенты доступны для кислых или щелочных образцов, чтобы поддерживать идеальный рН от 5,5 до 8.
Буферные агенты доступны для кислых или щелочных образцов, чтобы поддерживать идеальный рН от 5,5 до 8.
Диафрагменное и безмембранное титрование
Диафрагма разделяет анодное и катодное отделения.Его цель состоит в том, чтобы предотвратить превращение электрохимически генерируемого йода обратно в йодид на катоде вместо реакции с водой. В бездиафрагменном титраторе используется другая геометрическая конструкция для предотвращения обратного превращения образовавшегося йода в йодид (рис. 2). Когда газообразный водород образуется в катодном отсеке, он создает слой пузырьков газа на поверхности катода. Этот слой газа предотвращает восстановление йода на катоде. Тем не менее, небольшие количества йода все еще могут превращаться в йодид при достижении катода.
Рис. 2. Конфигурации с диафрагмой и без диафрагмы
(Предоставлено Меттлер-Толедо)
Титрование без диафрагмы выгодно, потому что диафрагма не загрязняется; его легче чистить; и можно использовать меньший дрейф (это связано с тем, как быстро завершается реакция).
Бездиафрагменная ячейка достаточно точна для многих приложений. Тем не менее, уточните у поставщика титраторов Карла Фишера, требуется ли для ваших задач диафрагма.
Метод совместной перегонки
Некоторые образцы могут медленно выделять воду или иметь побочные реакции с реагентами. В этом случае ASTM D6304 с содистилляцией является более надежным методом и снизит вероятность этого. В этом методе образец масла нагревается в вакууме, так что любая вода в образце испаряется. Пары воды конденсируются и растворяются в толуоле.
Затем его титруют по методике ASTM D6304.Поскольку присадки и другие мешающие загрязняющие вещества, которые могут присутствовать в пробе отработанного масла, остаются растворенными или взвешенными в масле, конденсированная вода в толуоле не подвержена влиянию помех и является истинным количеством воды в пробе. Многие компании предлагают дополнительные сушильные шкафы для этой цели.
Программируемые или встроенные методы
Метод кулонометрического титратора Карла Фишера может быть скорректирован в зависимости от области применения и требуемой точности. Настройка требует некоторого понимания принципов работы и управления титратором. Чтобы обеспечить точную настройку, многие титраторы имеют встроенные методы, которые можно использовать для более распространенных задач. Этот более удобный метод позволяет пользоваться прибором человеку, не имеющему большого опыта.
Настройка требует некоторого понимания принципов работы и управления титратором. Чтобы обеспечить точную настройку, многие титраторы имеют встроенные методы, которые можно использовать для более распространенных задач. Этот более удобный метод позволяет пользоваться прибором человеку, не имеющему большого опыта.
Для специальных приложений конкретный метод может не быть встроенным. В этом случае многие титраторы позволяют пользователю программировать метод. Когда все настройки установлены, этот конкретный метод можно выбирать каждый раз, когда требуется приложение, и титратор будет работать самостоятельно.
Количество встроенных и программируемых методов зависит от прибора. Полезно приблизительно определить, сколько приложений доступно, и ознакомиться с особенностями каждого приложения.
Встроенные насосы
Важно, чтобы реагенты не загрязнялись. Некоторые кулонометрические титраторы поставляются со встроенным насосом, который может заполнять и сливать реагенты. Это помогает исключить загрязнение реагентов и сокращает количество шагов, необходимых для процедуры.
Это помогает исключить загрязнение реагентов и сокращает количество шагов, необходимых для процедуры.
Скорости титрования
Скорость титрования различна для каждой единицы. Хотя скорость может быть важна, чем быстрее устройство титрует, тем менее точным оно будет. Для образцов с низким содержанием воды (менее 50 мкг) титрование следует проводить медленно. Также лучше медленно титровать образец, если критична точность уровня воды. Если измеряются высокие уровни воды (более 1000 мкг на образец), титрование может быть более быстрым.
Емкость памяти
Большинство устройств имеют подключение к компьютеру или принтеру, а некоторые имеют встроенные принтеры.Каждое устройство имеет разную емкость памяти. Если он не будет подключен к персональному компьютеру, важным фактором может стать его объем памяти.
Каталожные номера
- ASTM D6304: Стандартный метод определения содержания воды в нефтепродуктах, смазочных маслах и присадках кулонометрическим титрованием по методу Карла Фишера.

- (2003 г., июль-август). Анализ воды и нефти 101. Практика анализа нефти .
- (2001 г., июль-август). Вода – Забытый Загрязнитель. Практика анализа масла .
- Брошюра Mettler-Toledo Applications 32, Основы кулонометрического титрования по методу Карла Фишера с избранными приложениями. Mettler-Toledo Inc. Получено 1 августа 2003 г. с сайта www.mt.com.
Боковая панель 1
Метод Карла Фишера стал проще благодаря автоматическому титрованию проб
Автоматическое титрование — это аксессуар, предлагаемый некоторыми производителями Karl Fischer, который позволяет пользователю выполнять несколько титрований, не останавливаясь для подготовки образца.Он сочетается с кулонометрическим или волюметрическим титратором Карла Фишера для эффективного и бесконтрольного определения количества воды в образце, что позволяет аналитику сосредоточиться на других важных задачах во время работы.
Как это работает?
Образцы помещаются во вращающийся лоток и запечатываются. После запуска прибора первый образец перемещается в печь с регулируемой температурой. Затем образец прокалывается, так что по мере того, как вода превращается в пар, он переносится либо в кулонометрический, либо в волюметрический титратор, который определяет содержание воды в образце.При контроле температуры испаряется только вода, а оставшаяся часть пробы остается в бутылке для проб. Как только вся вода удалена и измерена, бутыль с образцом возвращается в исходное положение на лотке, а лоток поворачивается к следующему образцу, который необходимо выполнить.
После запуска прибора первый образец перемещается в печь с регулируемой температурой. Затем образец прокалывается, так что по мере того, как вода превращается в пар, он переносится либо в кулонометрический, либо в волюметрический титратор, который определяет содержание воды в образце.При контроле температуры испаряется только вода, а оставшаяся часть пробы остается в бутылке для проб. Как только вся вода удалена и измерена, бутыль с образцом возвращается в исходное положение на лотке, а лоток поворачивается к следующему образцу, который необходимо выполнить.
Преимущества
- Несколько образцов можно анализировать одновременно, не останавливаясь для подготовки каждого образца.
- В печи или ячейке для титрования нет загрязнений, поскольку оставшаяся жидкая или твердая проба остается в колбе для проб.
- Не нужно беспокоиться о каких-либо побочных реакциях, которые могут возникнуть между образцом и реагентами для титрования.
- В процессе используется гораздо меньше реагента.



 ..500 мг влаги в пробе
..500 мг влаги в пробе


 Генераторный электрод будет просто продолжать производить ток, делая сосуд очень темным. Других предупреждений или уведомлений от титратора для оператора не будет.
Генераторный электрод будет просто продолжать производить ток, делая сосуд очень темным. Других предупреждений или уведомлений от титратора для оператора не будет. Эти разъемы, если они не чистые и не сухие, могут привести к аналогичным неправильным показаниям, подобным треснувшему электроду, когда дрейф начинает прыгать и становится нестабильным. В этом случае титратор может также указать, что имеет место «ПЕРЕТИТИРОВАНИЕ».
Эти разъемы, если они не чистые и не сухие, могут привести к аналогичным неправильным показаниям, подобным треснувшему электроду, когда дрейф начинает прыгать и становится нестабильным. В этом случае титратор может также указать, что имеет место «ПЕРЕТИТИРОВАНИЕ».
