Основы органической химии
Основы органической химии
ОглавлениеПРЕДИСЛОВИЕГлава 1. КЛЮЧЕВЫЕ ПОНЯТИЯ ХИМИИ АТОМНАЯ ТЕОРИЯ ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКАЯ СВЯЗЬ ФОРМУЛЫ ЛЬЮИСА ФОРМАЛЬНЫЙ ЗАРЯД РЕЗОНАНС ГЕОМЕТРИЯ МОЛЕКУЛ ГИБРИДИЗАЦИЯ ХИМИЧЕСКИЕ ФОРМУЛЫ СОВЕТЫ ИЗУЧАЮЩЕМУ ОРГАНИЧЕСКУЮ ХИМИЮ СВОДКА ОСНОВНЫХ ПОЛОЖЕНИЙ ГЛ. 1 Глава 2. ОБЩИЕ ВОПРОСЫ ОРГАНИЧЕСКОЙ ХИМИИ РАЗДЕЛЫ ХИМИИ СИНТЕТИЧЕСКАЯ ОРГАНИЧЕСКАЯ ХИМИЯ КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ ИЗОМЕРИЯ СВОДКА ОСНОВНЫХ ПОЛОЖЕНИЙ ГЛ. 2 Прикладная органическая химия: ХИМИЧЕСКИЙ СИНТЕЗ И МЕДИЦИНСКИЕ ИССЛЕДОВАНИЯ Глава 3. АЛКАНЫ ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ СТРОЕНИЕ АЛКАНОВ ПОЛУЧЕНИЕ АЛКАНОВ РЕАКЦИИ АЛКАНОВ ХИМИЯ НЕФТИ СОВЕТЫ ИЗУЧАЮЩЕМУ ОРГАНИЧЕСКУЮ ХИМИЮ.  ИЗУЧЕНИЕ РЕАКЦИЙ ИЗУЧЕНИЕ РЕАКЦИЙГлава 4. СТЕРЕОХИМИЯ И ОПТИЧЕСКАЯ АКТИВНОСТЬ СПОСОБЫ ИЗОБРАЖЕНИЯ ЭНАНТИОМЕРОВ ОБОЗНАЧЕНИЕ АБСОЛЮТНОЙ КОНФИГУРАЦИИ НАЗВАНИЯ ХИРАЛЬНЫХ МОЛЕКУЛ D,L-НОМЕНКЛАТУРА ЭНАНТИОМЕРОВ ТЕРМИНОЛОГИЯ, ПРИМЕНЯЕМАЯ В СТЕРЕОХИМИИ ЗНАЧЕНИЕ ОПТИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ Глава 5. ОРГАНИЧЕСКИЕ ГАЛОГЕНСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ПОЛУЧЕНИЕ ГАЛОГЕНАЛКАНОВ РЕАКЦИИ ГАЛОГЕНАЛКАНОВ ПРАКТИЧЕСКИ ВАЖНЫЕ ГАЛОГЕНАЛКАНЫ Прикладная органическая химия: ОРГАНИЧЕСКИЕ ПЕСТИЦИДЫ Глава 6. НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ НОМЕНКЛАТУРА АЛКЕНОВ ПОЛУЧЕНИЕ АЛКЕНОВ ОСНОВНЫЕ РЕАКЦИИ АЛКЕНОВ ПОЛИМЕРЫ НОМЕНКЛАТУРА АЛКИНОВ ПОЛУЧЕНИЕ АЛКИНОВ РЕАКЦИИ АЛКИНОВ НАПИСАНИЕ ОРГАНИЧЕСКИХ РЕАКЦИЙ Глава 7. СПИРТЫ И ПРОСТЫЕ ЭФИРЫ НОМЕНКЛАТУРА СПИРТОВ НЕКОТОРЫЕ ВАЖНЫЕ ВЕЩЕСТВА, СОДЕРЖАЩИЕ СПИРТОВУЮ ГРУППУ ПОЛУЧЕНИЕ СПИРТОВ РЕАКЦИИ СПИРТОВ ПРОСТЫЕ ЭФИРЫ Прикладная органическая химия: ВЕЩЕСТВА, ОБЛАДАЮЩИЕ АЛЛЕЛОХИМИЧЕСКИМ ДЕЙСТВИЕМ.  ФЕРОМОНЫ ФЕРОМОНЫГлава 8. АЛЬДЕГИДЫ И КЕТОНЫ ПОЛУЧЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ РЕАКЦИИ АЛЬДЕГИДОВ И КЕТОНОВ Глава 9. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ НОМЕНКЛАТУРА АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ ПРИМЕНЕНИЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ В ПРОМЫШЛЕННОСТИ И В БЫТУ АРОМАТИЧНОСТЬ ПОЛУЧЕНИЕ АЛКИЛЬБЕНЗОЛОВ РЕАКЦИИ БЕНЗОЛА И ЕГО ПРОИЗВОДНЫХ АРОМАТИЧЕСКОЕ ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ Прикладная органическая химия: КАНЦЕРОГЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ Глава 10. ОРГАНИЧЕСКИЙ СИНТЕЗ СТРАТЕГИЯ РЕШЕНИЯ СИНТЕТИЧЕСКИХ ПРОБЛЕМ Глава 11. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ СПЕКТРОСКОПИЯ ЯДЕРНОГО МАГНИТНОГО РЕЗОНАНСА УЛЬТРАФИОЛЕТОВАЯ СПЕКТРОСКОПИЯ МАСС-СПЕКТРОМЕТРИЯ ОПРЕДЕЛЕНИЕ СТРУКТУРЫ ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ Прикладная органическая химия: ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ АЛКОГОЛЯ В КРОВИ Глава 12. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ АНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ ГАЛОГЕНАНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ СЛОЖНЫЕ ЭФИРЫ СОЛИ АМИДЫ ГИДРОЛИЗ ПРОИЗВОДНЫХ КАРБОНОВЫХ КИСЛОТ СИНТЕТИЧЕСКИЕ ВОЛОКНА Прикладная органическая химия: СВОЙСТВА ВОЛОКОН Глава 13.  АМИНЫ АМИНЫБИОЛОГИЧЕСКИ АКТИВНЫЕ АМИНЫ ОСНОВНОСТЬ АМИНОВ ПОЛУЧЕНИЕ АМИНОВ РЕАКЦИИ АМИНОВ Прикладная органическая химия: ПОЛИМЕРЫ, ПОДВЕРГАЮЩИЕСЯ БИОЛОГИЧЕСКОЙ ДЕСТРУКЦИИ Глава 14. УГЛЕВОДЫ МОНОСАХАРИДЫ РЕАКЦИИ МОНОСАХАРИДОВ СИНТЕЗЫ САХАРОВ ДИСАХАРИДЫ ПОЛИСАХАРИДЫ Прикладная органическая химия: ПИЩЕВЫЕ СВОЙСТВА УГЛЕВОДОВ Глава 15. АМИНОКИСЛОТЫ И БЕЛКИ КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ АНАЛИЗ АМИНОКИСЛОТ СТРОЕНИЕ БЕЛКОВ УСТАНОВЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКОВ Глава 16. ЛИПИДЫ ЖИРНЫЕ КИСЛОТЫ НАЗВАНИЯ ТРИАЦИЛГЛИЦЕРИНОВ РЕАКЦИИ ТРИАЦИЛГЛИЦЕРИНОВ ЛИПИДЫ, ОТЛИЧНЫЕ ОТ ТРИАЦИЛГЛИЦЕРИНОВ Прикладная органическая химия: ПИЩЕВЫЕ СВОЙСТВА ЛИПИДОВ Глава 17. НУКЛЕИНОВЫЕ КИСЛОТЫ РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ НУКЛЕОТИДЫ ДВОЙНАЯ СПИРАЛЬ ДНК ВТОРИЧНАЯ СТРУКТУРА И ФУНКЦИИ РНК Приложение 1. ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ Приложение 2. МЕХАНИЗМЫ НЕКОТОРЫХ РЕАКЦИЙ Приложение 3. НЕКОТОРЫЕ ВАЖНЫЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА |
Органическая химия.
 Основные положения. История развития науки
Основные положения. История развития наукиНевозможно отобразить презентацию
Похожие презентации:
Органическая химия
Органическая химия. История развития
Введение в органическую химию
Предмет органической химии
Предмет органической химии
Органическая химия. (Урок 1-2)
Теоретические основы органической химии
Предмет органической химии
Теория химического строения органических соединений. (10 класс)
Ароматические углеводороды, строение, изомерия, номенклатура
Органическая химия.
Основные положения.
История развития науки Выполнил: Хаустов Юрий учащийся 10 кл.
МОУ Борисоглебская СОШ №1 2009-2010 уч.
год Цель работы: Получить основную информацию об органической химии и истории её развития.
Органическими называют соединения углерода с другими элементами.
Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P.
Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения обусловливает многообразие органических соединений (к концу XX века их число превысило 10 млн.).
Органические соединения играют ключевую роль в существовании живых организмов.
Органическая химия – химия углеводородов и их производных.
Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н (СН4, С4Н10).
Производные УВ – продукты замещения атомов «Н» в молекулах УВ на другие атомы или группы атомов.
Органическая вещества Природные (Нефть, белки, жиры, углеводы) Искусственные (Бензин, вескоза) Синтетические (Лекарства, витамины , пластмасса) Важнейшие характристики Примечания Многочисленность (около 27 млн.) а) гомология б) изомерия в) котенация В состав обязательно входят атомыHиC Все органические соединения горючи.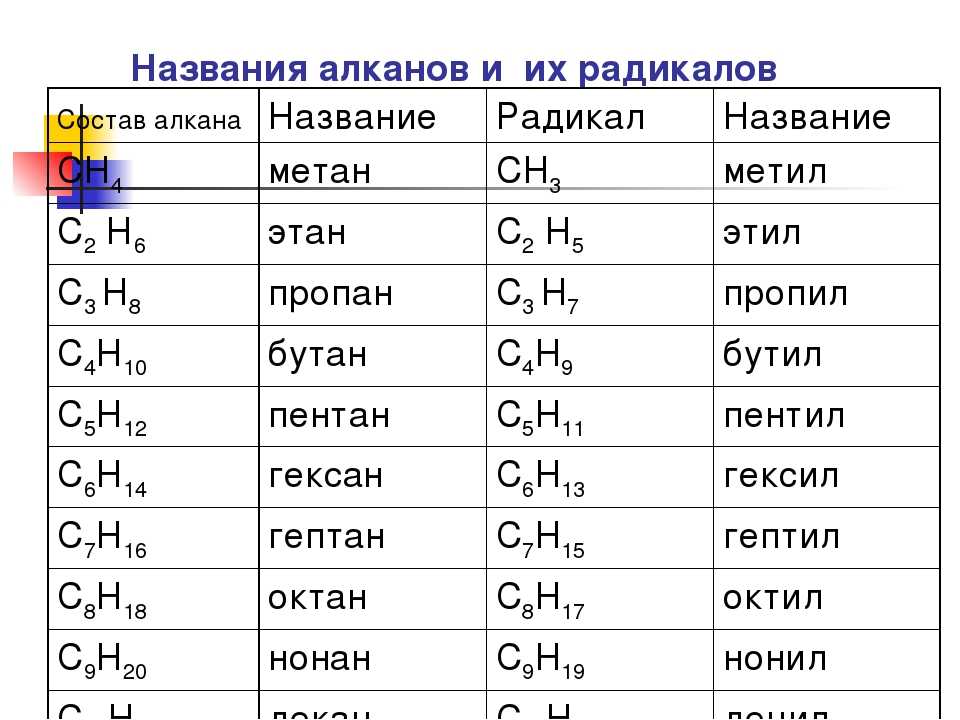
н.
«гомологическую разность».
Чаще всего это метиленовые звенья: …—СН2—… Простейший пример гомологического ряда — низшие гомологи алканов (общая формула Сnh3n+2): метан Ch5, этан C2H6, пропан С3H8 и т.
д.
Гомологи – сходное строение и свойства, отличающиеся на одну или несколько СН2 Изомерия́ (от izos — равный и meros — доля, часть греч.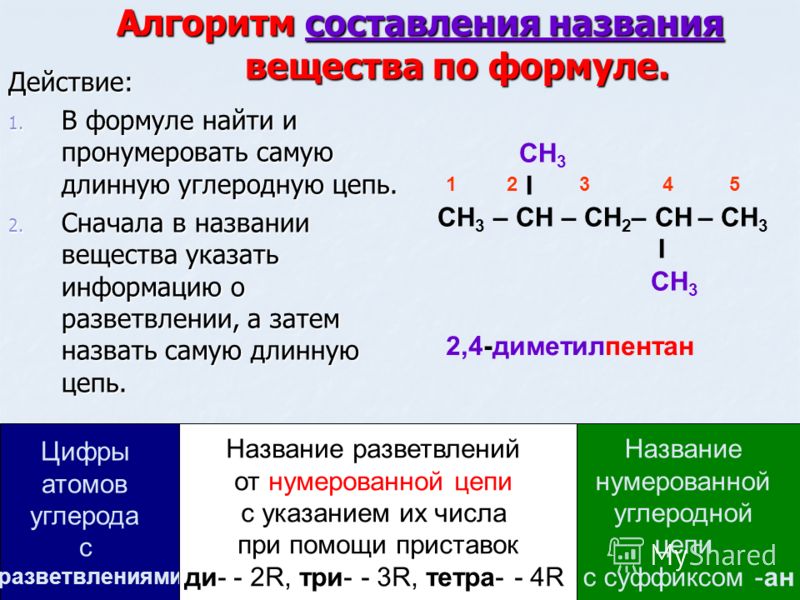 , ср.
, ср.
изо-) — существование соединений (главным образом органических), одинаковых по элементному составу и молекулярной массе, но различных по физическим и химическим свойствам.
Такие соединения называются изомерами.
Изомеры – вещества, имеющие одинаковую молекулярную форму, но разное строение и свойства.
Например История Способы получения различных органических веществ были известны ещё с древности.
Египтяне и римляне использовали красители индиго и ализарин, содержащиеся в растительных веществах.
Многие народы знали секреты производства спиртных напитков и уксуса из сахар- и крахмалсодержащего сырья.
Как принято считать, органическая химия как наука появилась в 1828 году когда Фридрих Вёлер впервые получил органическое вещество — мочевину — в результате упаривания водного раствора цианата аммония (Nh5OCN).
Во времена средневековья к этим знаниям ничего не прибавилось, некоторый прогресс начался только в 16-17 в: были получены некоторые продукты, в основном путём перегонки некоторых растительных продуктов.
В 1769—1785 г.
Шееле выделил несколько органических кислот, таких как яблочная, винная, лимонная, галловая, молочная и щавелевая.
В 1773 г.
Руэль выделил из человеческой мочи мочевину.
Выделенные из животного или растительного сырья продукты имели между собой много общего, но отличались от неорганических соединений.
Так возник термин «Органическая химия» — раздел химии, изучающий вещества, выделенные из организмов (определение Берцелиуса, 1807 г.).
При этом полагали, что эти вещества могут быть получены только в живых организмах благодаря «жизненной силе».
Руэль Гийом Франсуа Как принято считать, органическая химия как наука появилась в 1828 году когда Фридрих Вёлер впервые получил органическое вещество — мочевину — в результате упаривания водного раствора цианата аммония (Nh5OCN).
Важным этапом стала разработка теории валентности Купером и Кекуле в 1857 г., а также теории химического строения Бутлеровым в 1861 г.
В основу этих теорий были положены четырёхвалентность углерода и его способность к образованию цепей.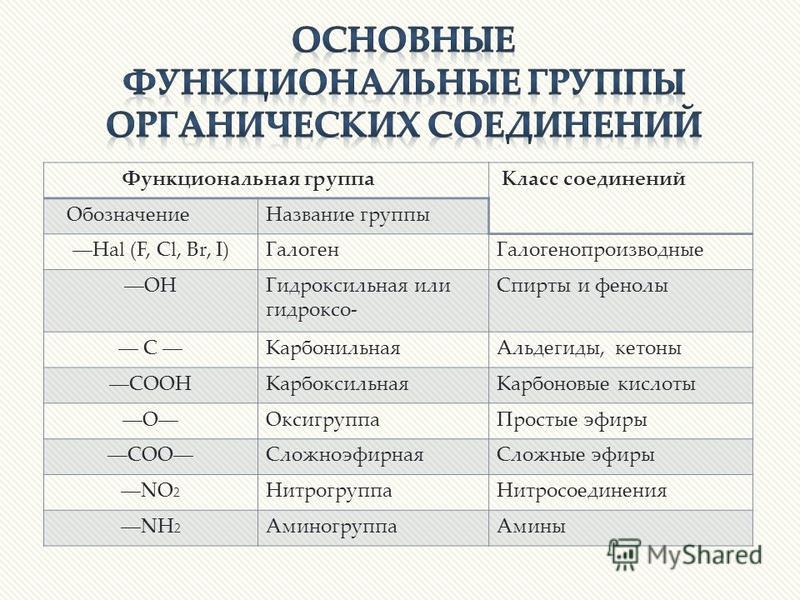
В 1865 году Кекуле предложил структурную формулу бензола, что стало одним из важнейших открытий в органической химии.
В 1875 г.
Вант-Гофф и Ле Бель предложили тетраэдрическую модель атома углерода, по которой валентности углерода направлены к вершинам тетраэдра, если атом углерода поместить в центр этого тетраэдра.
В 1917 году Льюис предложил рассматривать химическую связь с помощью электронных пар.
Кекуле -> В 1931 г.
Хюккель применил квантовую теорию для объяснения свойств альтернантных ароматических углеродов, чем основал новое направление в органической химии — квантовую химию.
В 1933 г.
Ингольд провел изучение кинетики реакции замещения у насыщенного атома углерода, что привело к масштабному изучению кинетики большинства типов органических реакций.
Это углерод -> На заре органической химии предметом изучения были преимущественно субстанции биологического происхождения.
Именно этому факту органическая химия обязана своим названием.
Научно-технический прогресс не стоял на месте, и со временем основной материальной базой органической химии стала каменноугольная смола, выделяемая при получении кокса прокаливанием каменного угля.
Именно на основе переработки каменноугольной смолы в конце 19 века возник основной органический синтез.
В 50-60 годах прошлого века произошёл переход основного органического синтеза на новую базу — нефть.
Таким образом появилась новая область химии — нефтехимия.
Огромный потенциал, который был заложен в новом сырье вызвал бум в органической химии и химии вообще.
Появление и интенсивное развитие такой области как химии полимеров обязана прежде всего новой сырьевой базе.
Несмотря на то, что современная органическая химия в качестве материальной базы по прежнему использует сырье биологического происхождения и каменноугольную смолу, объем переработки этих видов химического сырья по сравнению с переработкой нефти мал.
Смена материально-сырьевой базы органической химии была вызвана прежде всего возможностями наращивания объёмов производства.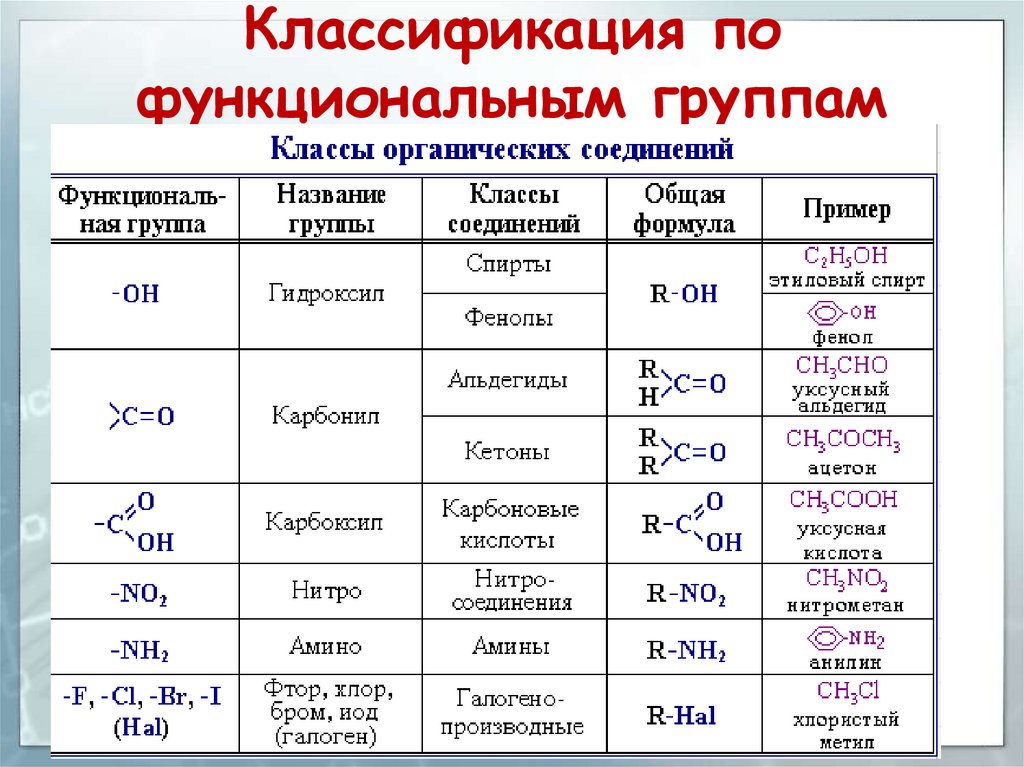
Органическая химия имеет исключительно важное научное и практическое значение.
Объектом её исследований в настоящее время являются более 20 млн.
соединений синтетического и природного происхождения.
Поэтому органическая химия стала
English Русский Правила
1.1: Органическая химия – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 178734
Цели обучения
- Знать состав и свойства, характерные для органических и неорганических соединений.
Ученые 18 и начала 19 веков изучали соединения, полученные из растений и животных, и обозначили их как органические , потому что они были выделены из «организованных» (живых) систем. Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были обозначены как неорганические . Многие годы ученые считали, что органические соединения могут образовываться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам. Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Вёлер синтезировал мочевину из неорганических исходных материалов. Он прореагировал с цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), рассчитывая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были обозначены как неорганические . Многие годы ученые считали, что органические соединения могут образовываться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам. Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Вёлер синтезировал мочевину из неорганических исходных материалов. Он прореагировал с цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), рассчитывая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
\[AgOCN + NH_4Cl \rightarrow AgCl + NH_4OCN \label{Eq1}\]
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, легко выделяемое из мочи. Этот результат привел к серии экспериментов, в которых большое разнообразие органических соединений было получено из неорганических исходных материалов. Теория жизненной силы постепенно ушла в прошлое, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Теория жизненной силы постепенно ушла в прошлое, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия изучает химию соединений углерода, а неорганическая химия изучает химию всех остальных элементов. Может показаться странным, что мы делим химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 остальных элементов. Однако такое деление представляется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов. Органические продукты – это продукты, выращенные без синтетических пестицидов или удобрений. Органическая химия – это химия соединений углерода.
Углерод уникален среди других элементов тем, что его атомы могут образовывать стабильные ковалентные связи друг с другом и с атомами других элементов во множестве вариаций. Образовавшиеся молекулы могут содержать от одного до миллионов атомов углерода. Ранее мы рассмотрели органическую химию, разделив ее соединения на семейства на основе функциональных групп. Мы начнем с простейших членов семейства, а затем перейдем к молекулам, которые являются органическими в первоначальном смысле, то есть они производятся живыми организмами и находятся в них. Эти сложные молекулы (все содержащие углерод) определяют формы и функции живых систем и являются предметом биохимии.
Образовавшиеся молекулы могут содержать от одного до миллионов атомов углерода. Ранее мы рассмотрели органическую химию, разделив ее соединения на семейства на основе функциональных групп. Мы начнем с простейших членов семейства, а затем перейдем к молекулам, которые являются органическими в первоначальном смысле, то есть они производятся живыми организмами и находятся в них. Эти сложные молекулы (все содержащие углерод) определяют формы и функции живых систем и являются предметом биохимии.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах органических и неорганических молекул. Тем не менее полезно сравнить типичные члены каждого класса, как в таблице \(\PageIndex{1}\).
| Органический | Гексан | Неорганические | NaCl | |
|---|---|---|---|---|
| низкая температура плавления | −95°С | высокая температура плавления | 801°С | |
| низкая температура кипения | 69°С | высокие точки кипения | 1413°С | |
| низкая растворимость в воде; высокая растворимость в неполярных растворителях | нерастворим в воде; растворим в бензине | большая растворимость в воде; низкая растворимость в неполярных растворителях | растворим в воде; нерастворим в бензине | |
| легковоспламеняющиеся | легковоспламеняющийся | негорючий | негорючий | |
| водные растворы не проводят электричество | непроводящий | водные растворы проводят электричество | проводящий в водном растворе | |
| имеют ковалентную связь | ковалентные связи | проявляют ионную связь | ионные связи |
Однако имейте в виду, что для каждой категории в этой таблице есть исключения. Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице \(\PageIndex{1}\) также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворитель, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице \(\PageIndex{1}\).
Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице \(\PageIndex{1}\) также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворитель, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице \(\PageIndex{1}\).
1.1: Organic Chemistry распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- источник-хим-16063
1.5: Номенклатура ИЮПАК — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 178738
Цели обучения
- Называть алканы по системе ИЮПАК и писать формулы для алканов, получивших названия ИЮПАК
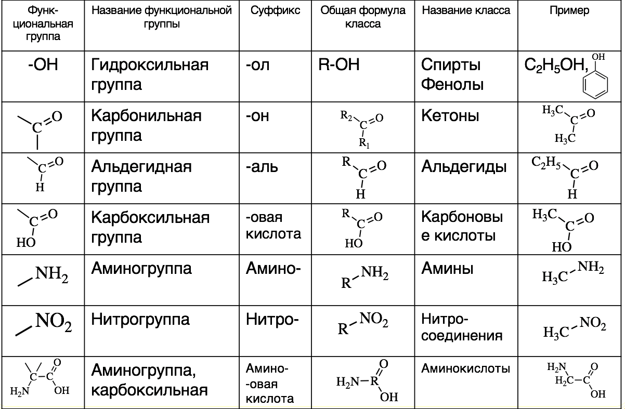
Как отмечалось ранее, число изомеров быстро увеличивается с увеличением числа атомов углерода. Имеется 3 пентана, 5 гексанов, 9 гептанов и 18 октанов. Было бы трудно присвоить уникальные индивидуальные имена, которые мы могли бы запомнить. Систематический способ именования углеводородов и других органических соединений был разработан Международным союзом теоретической и прикладной химии (IUPAC). Эти правила, используемые во всем мире, известны как Система номенклатуры IUPAC. (Некоторые названия, которые мы использовали ранее, такие как изобутан, изопентан и неопентан, не соответствуют этим правилам и называются общих имен .) Название основы (Таблица \(\PageIndex{1}\)) указывает количество атомов углерода в самой длинной непрерывной цепи (LCC). Атомы или группы, присоединенные к этой углеродной цепи, называемые заместителями , затем называются, а их положения обозначаются цифрами. Сейчас мы будем рассматривать только те заместители, которые называются алкильными группами.
Систематический способ именования углеводородов и других органических соединений был разработан Международным союзом теоретической и прикладной химии (IUPAC). Эти правила, используемые во всем мире, известны как Система номенклатуры IUPAC. (Некоторые названия, которые мы использовали ранее, такие как изобутан, изопентан и неопентан, не соответствуют этим правилам и называются общих имен .) Название основы (Таблица \(\PageIndex{1}\)) указывает количество атомов углерода в самой длинной непрерывной цепи (LCC). Атомы или группы, присоединенные к этой углеродной цепи, называемые заместителями , затем называются, а их положения обозначаются цифрами. Сейчас мы будем рассматривать только те заместители, которые называются алкильными группами.
| Стержень | Номер |
|---|---|
| мет- | 1 |
| эт- | 2 |
| опора- | 3 |
| а- | 4 |
| отложен- | 5 |
| шестигранник- | 6 |
| гепт- | 7 |
| окт- | 8 |
| не | 9 |
| дек- | 10 |
Алкильная группа представляет собой группу атомов, образующуюся при удалении одного атома водорода из алкана. Группа названа путем замены суффикса -ane исходного углеводорода на -yl 9.0031 . Например, группа -CH 3 , полученная из метана (CH 4 ), получается в результате вычитания одного атома водорода и называется метильной группой . Алкильные группы, которые мы будем использовать чаще всего, перечислены в таблице \(\PageIndex{2}\). Алкильные группы не являются независимыми молекулами; это части молекул, которые мы рассматриваем как единое целое, чтобы систематически называть соединения.
Группа названа путем замены суффикса -ane исходного углеводорода на -yl 9.0031 . Например, группа -CH 3 , полученная из метана (CH 4 ), получается в результате вычитания одного атома водорода и называется метильной группой . Алкильные группы, которые мы будем использовать чаще всего, перечислены в таблице \(\PageIndex{2}\). Алкильные группы не являются независимыми молекулами; это части молекул, которые мы рассматриваем как единое целое, чтобы систематически называть соединения.
| Исходный алкан | Алкильная группа | Концентрированная структурная формула | ||
|---|---|---|---|---|
| “> метан | метил | СН 3 – | ||
| этан | этил | We will introduce the other three where appropriate.”> CH 3 CH 2 – | ||
| пропан | пропил | CH 3 CH 2 CH 2 – | ||
| We will introduce the other three where appropriate.”> изопропил | (CH 3 ) 2 CH– | |||
| бутан | бутил* | CH 3 CH 2 CH 2 CH 2 – | ||
* Имеется четыре бутильных группы, две из которых получены из бутана, а две – из изобутана.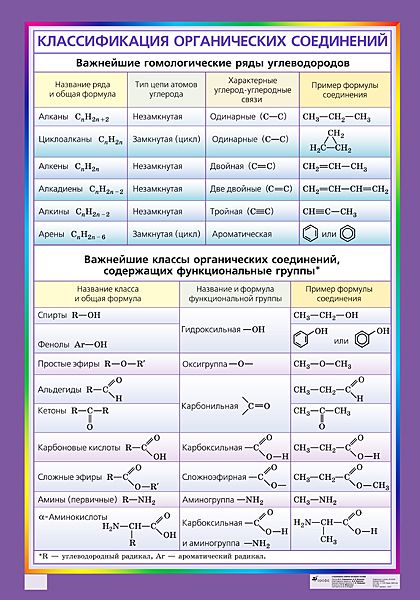 Мы представим остальные три, где это уместно. Мы представим остальные три, где это уместно. | ||||
Упрощенные правила ИЮПАК для обозначения алканов следующие (показаны в примере \(\PageIndex{1}\)).
1. Назовите алканы в соответствии с LCC (самая длинная непрерывная цепь) атомов углерода в молекуле (а не общим числом атомов углерода). Этот LCC, считающийся материнской цепью, определяет название основания, к которому мы добавляем суффикс – ан , чтобы указать, что молекула является алканом.
2. Если углеводород разветвлен, пронумеруйте атомы углерода LCC. Номера присваиваются в том направлении, которое дает наименьшие номера атомам углерода с присоединенными заместителями. Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не нужно писать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.)
3. Расположите названия групп заместителей в алфавитном порядке перед названием исходного соединения. Если одна и та же алкильная группа встречается более одного раза, указываются номера всех атомов углерода, к которым она присоединена. Если одна и та же группа появляется более одного раза у одного и того же атома углерода, номер этого атома углерода повторяется столько раз, сколько появляется группа. Причем количество одинаковых групп обозначается греческими префиксами ди -, три -, тетра – и так далее. Эти префиксы , а не учитываются при определении алфавитного порядка заместителей. Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово.
Если одна и та же алкильная группа встречается более одного раза, указываются номера всех атомов углерода, к которым она присоединена. Если одна и та же группа появляется более одного раза у одного и того же атома углерода, номер этого атома углерода повторяется столько раз, сколько появляется группа. Причем количество одинаковых групп обозначается греческими префиксами ди -, три -, тетра – и так далее. Эти префиксы , а не учитываются при определении алфавитного порядка заместителей. Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово.
При соблюдении этих правил каждое уникальное соединение получает собственное эксклюзивное имя. Правила позволяют нам не только называть соединение по заданной структуре, но и рисовать структуру по заданному имени. Лучший способ научиться пользоваться системой IUPAC — это заставить ее работать, а не просто запомнить правила.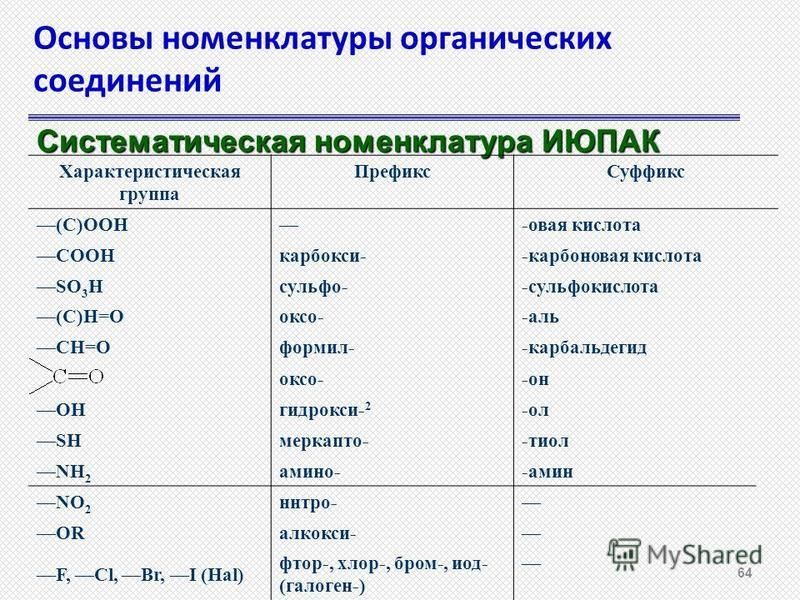 Это проще, чем кажется.
Это проще, чем кажется.
Пример \(\PageIndex{1}\)
Назовите каждое соединение.
РАСТВОР
- LCC имеет пять атомов углерода, поэтому исходным соединением является пентан (правило 1). Ко второму атому углерода пентановой цепи присоединена метильная группа (правило 2). Поэтому название 2-метилпентан.
- LCC имеет шесть атомов углерода, поэтому исходным соединением является гексан (правило 1). Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название 2,5-диметилгексан.
- LCC имеет восемь атомов углерода, поэтому исходным соединением является октан (правило 1). Имеются метильная и этильная группы (правило 2), обе присоединены к четвертому атому углерода (если считать от вправо, то дает этому атому углерода меньший номер; правило 3). Таким образом, правильное название – 4-этил-4-метилоктан.

Упражнение \(\PageIndex{1}\)
Назовите каждое соединение.
Пример \(\PageIndex{2}\)
Нарисуйте структуру каждого соединения.
- 2,3-диметилбутан
- 4-этил-2-метилгептан
РЕШЕНИЕ
Рисуя структуры, всегда начинайте с родительской цепи.
Исходной цепью является бутан, что указывает на четыре атома углерода в LCC.
Затем добавьте группы на свои места. Вы можете нумеровать родительскую цепочку в любом направлении, если вы непротиворечивы; просто не меняйте направление до того, как структура будет готова. Название указывает на два метила (CH 3 ), одна у второго атома углерода и одна у третьего.
Наконец, заполните все атомы водорода, имея в виду, что каждый атом углерода должен иметь четыре связи.
В данном случае исходной цепью является гептан, что указывает на семь атомов углерода в LCC.