Загальна та органічна хіміяТема 1 «Теоретичні основи органічної хімії» Стислий конспект
- 1.1. Вступ
- 1.2. Предмет органічної хімії
- 1.3. Особливості органічних сполук
- 1.3.1. Поняття про гомологію
- 1.3.2. Ізомерія
- 1.3.1. Поняття про гомологію
1.1. Вступ
Величезна кількість органічних сполук, різноманітність їх складу, особливості будови молекул (включаючи як послідовність сполучення атомів у ланцюгу, так і взаємне розташування окремих атомів і атомних груп у просторі) не дозволяє в рамках обмеженої кількості лекцій докладно викласти відомості про структуру, властивості, способи добування, області використання, а також екологічні наслідки виробництва і застосування органічних речовин.
Отже, органічна хімія охоплює в своїх дослідженнях майже 20 млн. сполук, переважна більшість яких має дуже складну будову. Очевидно, що орієнтуватися в такому масиві можливо тільки, по-перше, спираючись на чітку класифікацію і, по-друге, вивчаючи характерні родові ознаки, які притаманні великим групам сполук залежно від їх особливостей їх будови і складу. Інакше кажучи, слід набути певного комплексу знань з основ органічної хімії, які при зіткненні з якоюсь конкретною органічною сполукою одночасно стануть і теоретичним фундаментом і практичним інструментом для її детального дослідження. Саме на допомогу в оволодінні мінімальним комплексом таких знань і направлений запропонований курс органічної хімії.
Інакше кажучи, слід набути певного комплексу знань з основ органічної хімії, які при зіткненні з якоюсь конкретною органічною сполукою одночасно стануть і теоретичним фундаментом і практичним інструментом для її детального дослідження. Саме на допомогу в оволодінні мінімальним комплексом таких знань і направлений запропонований курс органічної хімії.
1.2. Предмет органічної хімії
Визначення Берцеліуса: Органічна хімія – це частина хімічної науки про речовини рослинного та тваринного походження.
Визначення Кекуле: Органічна хімія – це наука про сполуки Карбону з іншими елементами.
Визначення Шорлеммера: Органічна хімія – це наука про вуглеводні та їх похідні.
Сучасне визначення: Органічна хімія – це наука, що вивчає сполуки Карбону, їх будову, властивості, способи одержання і закони їх взаємних перетворень, а також шляхи практичного застосування.
До органічних речовин належать сполуки Карбону із Гідрогеном, Оксигеном, Нітрогеном, Фосфором, галогенами та іншими хімічними елементами, за виключенням оксидів карбону СО, СО2, вугільної кислоти Н2СО3 та її солей, які традиційно відносять до неорганічних сполук.
1.3. Особливості органічних сполук
Специфічні особливості органічних сполук:
- Величезна кількість органічних речовин, яка пояснюється унікальною здатністю атомів Карбону сполучатися один з одним, утворюючи ланцюги і кільця.
- Органічні сполуки поряд із водою є головним будівельним матеріалом тваринних і рослинних організмів і – одночасно – основним харчовим компонентом, що забезпечує постійну підтримку їх життєдіяльності на відповідному рівні. Крім того, величезна кількість органічних сполук є основою для створення багатьох виробів з широким спектром властивостей, які набули застосування у всіх без виключення галузях промисловості, у будівництві, а також у повсякденному побуті.

- Молекули органічних речовин, в яких атоми сполучені між собою переважно за рахунок неполярних чи малополярних ковалентних зв’язків, як правило, належать до неелектролітів. Іонний тип зв’язку зустрічається рідко, найчастіше в солях органічних кислот, наприклад, в ацетаті натрію.
- Органічні сполуки, що містять тільки прості одинарні зв’язки С–С, С–Н, за звичайних умов взаємодіють між собою надзвичайно повільно або не взаємодіють зовсім.
- При нагріванні до підвищених температур органічні речовини обвуглюються, а у присутності кисню – згоряють. Це пояснюється невисокою міцністю зв’язків між атомами Карбону.
- Органічні сполуки всіх класів утворюють особливі ряди сполук, які називаються
- Будову органічних сполук виражають за допомогою структурних формул. Структурні формули – це умовне зображення будови органічної сполуки, в якому кожний ковалентний зв’язок позначається рисочкою.
 Наприклад, структурна формула пропану С3Н8:
Наприклад, структурна формула пропану С3Н8:Однак доцільніше і зручніше користуватися скороченими формулами, що називаються раціональні структурні формули
Для тих органічних сполук, які мають розгалужену будову, інколи допускається така форма запису скороченої структурної формули, при якій бокові ланцюги записуються у дужках після сполученого з ними атома С, наприклад:
Раціональні структурні формули циклічних сполук зображують багатокутниками із відповідною кількістю кутів. Наприклад, структуру циклобутану С
Структуру бензену прийнято зображувати одним з двох способів:
1.
 3.1. Поняття про гомологію
3.1. Поняття про гомологіюГомологічний ряд – це послідовність подібних за будовою та властивостями речовин, в якій кожний наступний член відрізняється від попереднього на постійну структурну одиницю СН2, яка називається гомологічна різниця.
Генетичною основою гомологічних рядів для більшості класів органічних сполук є гомологічний ряд насичених незамкнутих вуглеводнів – алканів. Загальна формула для алканів – CnH2n+2. Як видно із порівняння їх складу, два найближчі сусідні гомологи дійсно відрізняються один від одного на гомологічну різницю СН2.
Подібним чином органічні сполуки будь-якого класу теж утворюють власні гомологічні ряди, кожний з них має свою загальну формулу. Наприклад, загальна формула для насичених одноатомних спиртів (тобто таких, що містять тільки одну групу ОН) – CnH2n+1OH, для насичених карбонових кислот – CnH2n+1COOH.
1.3.2. Ізомерія
Ізомерія – це явище, при якому декілька сполук – ізомери – мають однаковий склад і однакову молекулярну масу, але відрізняються один від одного будовою молекул, а отже, і своїми фізичними та хімічними властивостями.
Існують різні типи ізомерії, серед яких найбільш поширеними є структурна і просторова.
І Структурна ізомерія зумовлюється різним порядком розміщення окремих атомів чи атомних груп у молекулі. Вона поділяється на певні види:
- ізомерія карбонового ланцюгу, наприклад, для алканів складу С5Н12 існують три ізомери різної будови:
- ізомерія положення кратного зв’язку, наприклад, для ацетиленових вуглеводнів складу С5Н8, які мають нормальну будову, але різне розташування в карбоновому ланцюгу потрійного зв’язку:
- ізомерія положення замісника; так, для спиртів складу С3Н7–ОН можливо існування двох ізомерів:
- міжкласова ізомерія (так звана метамерія).

ІІ Просторова ізомерія, при якій склад і послідовність сполучення атомів в молекулах ізомерів залишаються однаковими, але змінюється просторове розміщення однакових атомів чи атомних груп відносно карбонового ланцюгу. Просторова ізомерія представлена такими видами:
II.1 Геометрична ізомерія (інша назва – π-діастереомерія) зумовлена різним положенням замісників відносно подвійного зв’язку чи малого циклу. Геометричні ізомери, в яких обидва замісники (або продовження карбонового ланцюгу) розташовані по різні боки від подвійного зв’язку чи циклу, називаються транс-ізомерами, а ті, в яких замісники знаходяться з одного боку, –
Геометричні ізомери, в яких обидва замісники (або продовження карбонового ланцюгу) розташовані по різні боки від подвійного зв’язку чи циклу, називаються транс-ізомерами, а ті, в яких замісники знаходяться з одного боку, –
Геометричні ізомери відрізняються фізичними показниками і реакційною здатністю, що пояснюється різним енергетичним станом цис– і транс-ізомерів. Транс-ізомери є стійкішими, оскільки замісники в їх молекулах більш віддалені один від одного. Перехід геометричних ізомерів із однієї форми в іншу можливий тільки при обертанні навколо подвійного зв’язку, для чого необхідно розірвати π-зв’язок, витративши енергію.
II.2 Оптична ізомерія (або стереоізомерія) у свою чергу поділяється на два види: конформаційну і конфігураційну.
а) Конформаційна стереоізомерія
Різні геометричні форми молекули, які можуть перетворюватися одна в одну внаслідок обертання окремих атомів і атомних груп навколо σ-зв’язків С–С, називаються конформації ( від лат. сonformatio – форма, розміщення).
При обертанні навколо σ-зв’язків С–С молекула прагне набути найвигіднішої конформації з найменшою внутрішньою енергією. Варіантів таких конформацій дуже багато, але частіше зустрічаються дві:
- загальмована конформація, в якій атоми Н двох сусідніх метильних груп (СН3) віддалені на максимальну відстань; при цьому електронна взаємодія зв’язків С–Н і потенціальна енергія молекули будуть найменшими;
- заслонена конформація, в якій відстань між атомами Гідрогену двох сусідніх метильних груп (СН3) найменша, тому зв’язки С–Н в них взаємно відштовхуються; це приводить до збільшення потенціальної енергії молекули і, отже, до меншої міцності.
б) Конфігураційна стереоізомерія зумовлюється наявністю в молекулі асиметричних атомів Карбону (в структурних формулах він позначається зірочкою: С*).
Асиметричний атом С* – це sp3-гібридизований атом Карбону, сполучений з чотирма різними за складом і будовою замісниками. Асиметричний атом С* має й іншу назву – хіральний центр (від грецького χειρ – рука), яка наголошує на відсутність симетрії відносно лівого і правого боків. Наприклад, хіральним є відображення об’єкту в ідеально плоскому дзеркалі, яке відрізняється від самого об’єкту.
Існує тільки два варіанти тетраедричного розміщення чотирьох замісників навколо sp3-гібридизованого асиметричного атома С*, які складають пару конфігураційних ізомерів – їх звичайно називають оптичні антиподи, або енантіомери. Енантіомери подібно до співвідношення між правою та лівою рукавичками уявляють собою дзеркальні відображення одна одної.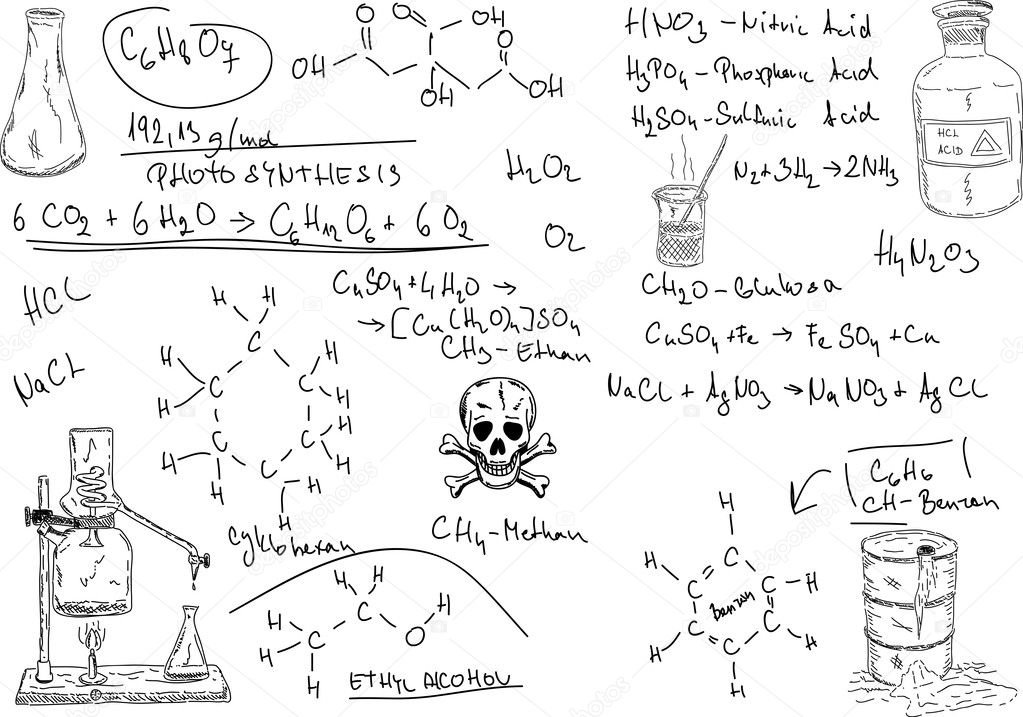
Для умовного зображення асиметричного атома на площині використовують
Енантіомери за звичайних умов не відрізняються між собою ні за фізичними, ні за хімічними властивостями. Їх головною ознакою вважається оптична активність – здатність обертати площину поляризації світла, яка вперше була знайдена Луї Пастером. Визначення конфігурації оптичних антиподів проводять експериментально, пропускаючи через розчин оптично активної речовини промінь плоскополяризованого світла і фіксуючи його напрямок і кут відхилення. Лівообертальний енантіомер позначають знаком «–», а правообертальній – знаком «+». Наприклад, якщо один з енантіомерів має, наприклад, кут питомого обертання –20о, то його оптичний антипод – +20о.
Енантіомери (оптичні антиподи, дзеркальні ізомери) – це пара оптично активних ізомерів, які відрізняються конфігурацією асиметричного атома Карбону і мають протилежні за знаком, але однакові за величиною кути обертання площини поляризації світла (при ідентичності всіх інших фізичних і хімічних властивостей, за винятком реакцій з іншими оптично активними речовинами).
Сполуки, до складу яких входять декілька асиметричних атомів Карбону, відрізняються своїми особливостями від вже розглянутих оптично активних речовин – енантіомерів. Такі сполуки правильно називати σ-діастереізомерами, або просто σ-діастереомери (від грецьких diá – через, stereos – об’ємний), однак звичайно символом σ нехтують – його наводять тільки при необхідності розрізнити σ-діастереомери від π-діастереомерів (тобто геометричних ізомерів).
σ-Діастереомери – просторові ізомери, що не належать до оптичних антиподів і містять декілька асиметричних атомів Карбону, для частини з яких конфігурації центрів хіральності співпадають, а для решти асиметричних атомів є протилежними.
Діастереомерними вважаються будь-які комбінації просторових ізомерів, що не складають пару оптичних антиподів – енантіомерів. Деякі діастереомери мають ще й спеціальну назву – епімери.
Епімери – це діастереомери, які відрізняються один від одного конфігурацією тільки одного асиметричного атома Карбону.
Наявність у складі молекули асиметричного атома ще не є достатньою умовою оптичної активності речовини.
Оптично неактивна модифікація речовини, що містить асиметричні атоми і складається з однакових кількостей обох оптичних антиподів, називається рацемат. Інакше кажучи, рацемат – це суміш однакових кількостей оптичних ізомерів, яка поводить себе як індивідуальна хімічна сполука, що позбавлена оптичної активності і відрізняється за фізичними властивостями від кожного з антиподів.
На відміну від енантіомерів, у яких конфігурація відповідних асиметричних центрів є протилежною (антиподною) і які відрізняються між собою тільки оптичними властивостями при повному збігу всіх інших властивостей, σ-діастереомери відрізняються не тільки величиною кута обертання плоскополяризованого світла, але і фізичними та хімічними особливостями, наприклад, температурами кипіння та плавлення, розчинністю, швидкостями перебігу реакцій тощо. До речі, на відмінності властивостей діастереомерів базується метод розщеплення рацематів на окремі оптичні антиподи.
Конфігураційна стереоізомерія найбільш поширена серед сполук природного походження: амінокислот, вуглеводів, алкалоїдів тощо. Наприклад, для складу С6Н12О6, відомо 16 стереоізомерів. В загальному випадку кількість стереізомерів для сполуки визначається за формулою 2n, де n – число асиметричних центрів. Однак дійсна кількість стереізомерів може зменшуватися завдяки частковій симетрії, коли два асиметричних центри мають формально однакові конфігурації.
Стереоізомерія має велике значення в реакціях біологічно активних речовин. З урахуванням того, що діастереомери відрізняються за своїми властивостями, можна зрозуміти, чому енантіомери однаково реагують з симетричними молекулами, але різним чином поводять себе з хіральними молекулами, до яких, наприклад, належать ферменти. Якщо два енантіомери взаємодіють з одним і тим самим хіральним реагентом, то продукти, що утворюються, вже втрачають ознаки оптичних антиподів, а набувають ознак діастереомерів і, як наслідок, відрізняються між собою за енергетичними характеристиками і властивостями.
Вступ до органічної хімії. Виникнення органічної хімії » mozok.click
Ви вже знаєте, що хімічні речовини утворюють атоми різних хімічних елементів. Серед усіх хімічних елементів окреме місце посідає Карбон, оскільки він є основою величезної кількості природних і синтетичних сполук. Карбон утворює десятки мільйонів речовин, вивченням яких займається органічна хімія.
Органічна хімія — це розділ хімії, що вивчає сполуки Карбону, їхні властивості та методи добування.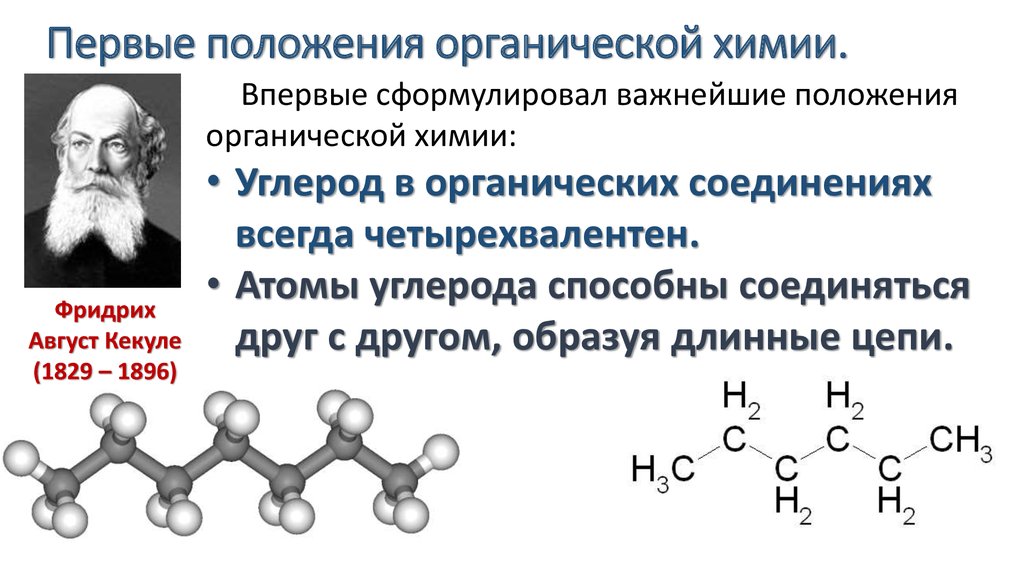
Це визначення не є абсолютно точним, оскільки існують сполуки Карбону (вуглекислий та чадний гази, карбонатна кислота та карбонати тощо), які за характером властивостей відносять до неорганічних. Але це підкреслює, що принципової різниці між органічними та неорганічними речовинами не існує, оскільки органічні сполуки можуть перетворюватися на неорганічні, і навпаки.
Органічні речовини відомі людству з давніх-давен — це олії, винний спирт, оцтова кислота, цукор, крохмаль тощо. Але тривалий час ці речовини могли виділяти тільки з живих організмів (рослин і тварин) або продуктів їхньої життєдіяльності й не могли самостійно їх синтезувати. Це пояснювали теорією віталізму (від латин. vita — життя), згідно з якою органічні речовини можуть утворюватися тільки в живих організмах під впливом якоїсь «життєвої сили». Саме тому 1807 року шведський хімік Йенс-Якоб Берцеліус запропонував назву «органічні» для позначення речовин, що одержують із живих організмів.
Переворот в уявленні про органічні речовини стався після відомого досліду Фрідріха Велера. 1828 року Велер з неорганічної сполуки у звичайній пробірці синтезував сечовину, яку до цього часу виділяли лише із сечі й тому вважали винятково органічною речовиною.
1828 року Велер з неорганічної сполуки у звичайній пробірці синтезував сечовину, яку до цього часу виділяли лише із сечі й тому вважали винятково органічною речовиною.
Відомий німецький хімік. На вимогу батьків закінчив медичний факультет Марбургського університету, хоча з дитинства захоплювався хімією. Здобувши звання доктора медицини, лікарем він не став, але вмовив Берцеліуса взяти його до себе лаборантом, після чого перекваліфікувався на хіміка. У 28 років став професором хімії, працював у багатьох університетах Німеччини. Був автором декількох підручників з хімії, за якими навчалися наступні покоління хіміків. Але найвідомішим досягненням Велера було добування сечовини з амоній ціанату NH4NCO — перший в історії штучний синтез органічної речовини, що став початком бурхливого розвитку органічної хімії.
І хоча сечовина була не такою вже й важливою речовиною, але дослід Велера довів, що органічні речовини можуть утворюватися і без «життєвої сили». Це було крахом теорії віталізму. Після повідомлення Велера багато хіміків почали здійснювати досліди з добування органічних речовин. Розпочався бурхливий розвиток нового напрямку — органічної хімії.
Це було крахом теорії віталізму. Після повідомлення Велера багато хіміків почали здійснювати досліди з добування органічних речовин. Розпочався бурхливий розвиток нового напрямку — органічної хімії.
Історія органічної хімії налічує багато видатних імен, але серед усіх хіміків-органіків слід у першу чергу відзначити двох — Фрідріха Кекуле та Олександра Бутлерова, чиї дослідження були найзначущими для розуміння будови органічних речовин і стали могутнім інструментом для розвитку органічної хімії.
Поняття про органічні речовини
Сьогодні органічними називають як природні, так і синтетичні сполуки Карбону. Їх відомо вже понад 20 мільйонів. Органічні речовини відіграють важливу роль у природі, оскільки є основою життя на Землі. Вони є основною складовою харчових продуктів, їх здавна застосовують як сировину для виготовлення тканин, вони містяться у складі різних видів палива (мал. 22.2). Сучасні синтетичні органічні високомолекулярні сполуки використовують як конструкційні матеріали, для виготовлення волокна тощо. Багато з них за своїми властивостями перевершують природні аналоги. Органічні сполуки є основними компонентами ліків, мийних засобів тощо.
Багато з них за своїми властивостями перевершують природні аналоги. Органічні сполуки є основними компонентами ліків, мийних засобів тощо.
Чому саме Карбон є основою органічних сполук? На відміну від інших хімічних елементів, Карбон може утворювати величезне число сполук, що зумовлене двома важливими властивостями його атомів:
• атоми Карбону можуть утворювати між собою міцні хімічні зв’язки і сполучатися в досить довгі карбонові ланцюги: нерозгалу-жені, розгалужені та циклічні;
• атоми Карбону можуть утворювати між собою та з атомами інших елементів зв’язки різної кратності: одинарні, подвійні й потрійні:
Мал. 22.2. Органічні речовини: а — продукти харчування; б — лікарські препарати; в — будівельні матеріали; г — пальне та мастильні матеріали
Видатний німецький хімік-органік. Вивчав архітектуру в Гіссенському університеті, але після лекцій Лібіха зацікавився хімією. Працював в університетах Парижа, Гейдельберга, Гента, а в 36 років став професором Боннського університету, де працював до кінця життя. Наукова діяльність була присвячена теоретичній і синтетичній органічній хімії. Уперше синтезував багато органічних речовин, установив структурні формули багатьох природних речовин. Першим висловив думку, що валентності елементів є цілими числами, класифікував усі елементи за валентністю, заклав поняття про валентність як фундаментальну властивість атомів (теорію валентності). Ця теорія була основою теорії хімічної будови Бутлерова.
Наукова діяльність була присвячена теоретичній і синтетичній органічній хімії. Уперше синтезував багато органічних речовин, установив структурні формули багатьох природних речовин. Першим висловив думку, що валентності елементів є цілими числами, класифікував усі елементи за валентністю, заклав поняття про валентність як фундаментальну властивість атомів (теорію валентності). Ця теорія була основою теорії хімічної будови Бутлерова.
Незважаючи на велике різноманіття, органічні сполуки мають певні спільні властивості:
• складаються з атомів Карбону, Гідрогену, часто містять Штроген, Oксиген, хоча можуть містити атоми й інших елементів;
• атоми Карбону в молекулах сполучені в різноманітні ланцюги;
• між атомами в молекулах переважно неполярні або слабопо-лярні ковалентні зв’язки;
• більшість мають молекулярну будову, тому для них характерні порівняно низькі температури плавлення й кипіння;
• більшість не розчиняються у воді, є леткими рідинами або легкоплавкими твердими речовинами, багато з них газуваті за звичайних умов;
• розчинні у воді органічні сполуки зазвичай є неелектролітами;
• переважно є горючими речовинами;
• під час нагрівання вище за 300 °С зазвичай розкладаються.
Видатний хімік, академік Петербурзької академії наук. Спочатку захоплювався біологією, але під впливом лекцій Зініна зацікавився хімією. У 26 років захистив докторську дисертацію, а у 29 років став професором Казанського університету. 1868 року за поданням Менделєєва був обраний професором Санкт-Петербурзького університету. 1861 року (у віці 33 роки!) сформулював основні положення теорії хімічної будови органічних сполук. Бутлеров був засновником відомої казанської («бутле-ровської») школи хіміків-органіків, серед яких В. В. Мар-ковніков, О. М. Зайцев, О. Є. Фаворський.
Класифікація органічних сполук
Для вивчення органічних речовин зручно класифікувати їх за будовою або властивостями, подібно до того, як класифікують неорганічні речовини (схема 1, с. 5).
• За вмістом хімічних елементів
Найпростіші органічні сполуки містять тільки два елементи — Карбон і Гідроген, їх називають вуглеводнями (від двох слів — вуглець і водень), часто органічні сполуки містять атоми Оксигену або Нітрогену. Оскільки ці чотири елементи утворюють майже всі органічні сполуки, що містяться в живих організмах, їх називають елементами-органогенами.
Оскільки ці чотири елементи утворюють майже всі органічні сполуки, що містяться в живих організмах, їх називають елементами-органогенами.
За наявністю кратного зв’язку між атомами Карбону
У молекулах деяких органічних сполук містяться певні групи атомів, що є характерними для всіх сполук цього класу. їх називають характеристичними (або функціональними) групами. У вуглеводнів такі групи відсутні, група атомів -СООН обов’язково міститься в молекулах органічних кислот і є характеристичною для карбонових кислот.
За наявністю характеристичних груп розрізняють такі класи органічних речовин:
• вуглеводні: характеристичні групи відсутні;
• спирти, у молекула яких наявна гідроксильна група -OH;
• карбонові кислоти, у молекула яких наявна карбоксильна група -COOH;
• амінокислоти, у молекула яких наявні карбоксильна група -COOH та аміногрупа -NH2.
Звісно, що наведені класифікації не відображають усього розмаїття органічних сполук, але саме такі речовини ви вивчатимете в 9 класі, а з іншими ознайомитеся під час подальшого вивчення хімії.
Ключова ідея
Предметом вивчення органічної хімії є органічні сполуки, їх перетворення та методи добування. До органічних належать речовини природного й синтетичного походження, що утворені на основі атомів Карбону.
Контрольні запитання
249. Що вивчає органічна хімія?
250. Які були погляди прихильників теорії віталізма щодо добування органічних речовин?
251. Що стало історичним поштовхом для розвитку органічної хімії? Чому?
252. Які речовини називають органічними? Наведіть приклади органічних речовин.
253. Сформулюйте основні відмінності між органічними та неорганічними речовинами.
254. Які хімічні елементи містяться в органічних сполуках?
255. Які особливості Карбону зумовлюють існування великої кількості органічних сполук?
256. За якими ознаками класифікують органічні сполуки?
Завдання для засвоєння матеріалу
257. Найпростіша органічна сполука — метан CH4. До яких груп органічних речовин він належить?
258. CH. Запропонуйте спосіб класифікації цих речовин за різними ознаками.
CH. Запропонуйте спосіб класифікації цих речовин за різними ознаками.
259. Як ви вважаєте, чому органічну хімію виділяють в окремий розділ хімії?
260. Знайдіть у додаткових джерелах різні визначення органічної хімії. Чим вони відрізняються від визначення, наведеного в параграфі? Яке з них, на вашу думку, найточніше?
Органическая химия – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25123
Органическая химия изучает строение, свойства и реакции органических соединений, содержащих углерод в ковалентной связи. Изучение структуры определяет их химический состав и формулу, а изучение свойств включает физические и химические свойства и оценку химической активности для понимания их поведения. Изучение органических реакций включает химический синтез природных продуктов, лекарств и полимеров, а также изучение отдельных органических молекул в лаборатории и путем теоретического (in silico) исследования.
Изучение органических реакций включает химический синтез природных продуктов, лекарств и полимеров, а также изучение отдельных органических молекул в лаборатории и путем теоретического (in silico) исследования.
- УПРАЖНЕНИЯ: Органическая химия
- Дополнительные модули (органическая химия)
- Органические химические исследования включают в себя синтез органических молекул и исследования их реакционных путей, и применения и применения, и применения, и применения, и применения и применения.
- Лабораторные методы органической химии (Nichols)
- установка и нагревание аппаратов (см. вкладку «Оглавление» для более полного списка тем). Все процедуры сопровождаются пошаговыми картинками, на ресурсе активно используется графика.
- Книга: Учебная книга по номенклатуре на органической химии (О’Доннелл)
- Книга: как быть успешным органическим химиком (Сандторв)
- Как быть в аспекте.
 chemist предназначен в качестве вводного текста для студентов, посещающих учебные лаборатории по органической химии. Текст представляет собой четкое и практическое введение в безопасность, обращение с химическими веществами, методы органической химии и лабораторные отчеты.
chemist предназначен в качестве вводного текста для студентов, посещающих учебные лаборатории по органической химии. Текст представляет собой четкое и практическое введение в безопасность, обращение с химическими веществами, методы органической химии и лабораторные отчеты.
- Органическая химия (LibreTexts)
- Органическая химия изучает структуру, свойства и реакции органических соединений, которые содержат углерод в ковалентной связи. Изучение строения определяет их структурную формулу. Изучение свойств включает физические и химические свойства, а также оценку химической активности для понимания их поведения. Изучение органических реакций включает химический синтез природных продуктов, лекарств и полимеров, изучение отдельных органических молекул в лабораторных и теоретических условиях.
- Органическая химия с биологическим акцентом (Содерберг)
- В этом онлайн-учебнике используется уникальный подход к изучению органической химии.
 В максимально возможной степени биологические молекулы и биохимические реакции используются для объяснения и иллюстрации центральных понятий органической химии. Этот подход охватывает основные механизмы органических реакций в биологическом контексте. Однако более ранние главы, посвященные органической структуре и спектроскопии, также максимально сосредоточены на примерах, представляющих интерес для студентов, изучающих биологию и медико-санитарные науки.
В максимально возможной степени биологические молекулы и биохимические реакции используются для объяснения и иллюстрации центральных понятий органической химии. Этот подход охватывает основные механизмы органических реакций в биологическом контексте. Однако более ранние главы, посвященные органической структуре и спектроскопии, также максимально сосредоточены на примерах, представляющих интерес для студентов, изучающих биологию и медико-санитарные науки.
- Книга: Основные принципы органической химии (Робертс и Казерио)
- Эта общая текстовая карта органических веществ, составленная Джоном Д. Робертом и Марджори К. Казерио, делает акцент на термохимии, чтобы помочь студентам понять органические реакции 900
- Front Matter
- 1: Введение в органическую химию
- 2: Структурная органическая химия
- 3: Органическая номенклатура
- 4: Алканы
- 5. Стереоизомерия органических молекул
- 6.
 Связывание в органических молекулах
Связывание в органических молекулах- 7. Другие соединения, кроме углеводородов
- 8. Реакции нуклеофильного замещения и элиминирования
- 9. Разделение, очистка и идентификация органических соединений 9003 9003 Алкены и Алкины I – Реакции ионных и радикальных присоединений
- 11: Алкены и Алкины II – Реакции окисления и восстановления. Кислотность алкинов
- 12: Циклоалканы, циклоалкены и циклоалкины
- 13: Полифункциональные соединения, алкадиены и подходы к органическому синтезу.
- 14: Галогенорганические и металлоорганические соединения.
- 15: Спирты и простые эфиры. Реакции присоединения карбонильной группы
- 17: Карбонильные соединения II – енолы и енолят-анионы. Ненасыщенные и поликарбонильные соединения
- 18: Карбоновые кислоты и их производные
- 19: Дополнительные сведения о стереохимии
- 20: Углеводы
- 21: Резонансный и молекулярно-орбитальный методы
- 22: Арены, электрофильное ароматическое замещение
- 23: Азоторганические соединения I – Амины
- 24: Азоторганические соединения II – Амиды, нитрилы и нитросоединения 2 Пептиноамиды,
- 0 Ациды
- 0
- 26: Подробнее об ароматических соединениях
- 27: Подробнее о спектроскопии
- 28: Фотохимия
- 29: Полимеры
- 30: Натуральные продукты и биосинтез
- 31: переходные металлические органические соединения
- Back Matter
- Книга: Виртуальный учебник OCHEM (REUSCH).
 Подход (МакМайкл)
Подход (МакМайкл) - Это учебник для односеместрового курса органической химии «обзор». Вы будете изучать и применять принципы, управляющие структурой органических соединений, и связывать свое понимание структуры с реакциями — изменениями в структуре — которые происходят, когда определенные части органических соединений взаимодействуют с другими химическими веществами. Мы проведем первые несколько недель семестра, изучая группу органических соединений, которые имеют общий структурный элемент — молекулу 9.0008
- Органическая химия I (Лю)
- Открытый учебник, который подходит для первого семестра органической химии. В этом открытом учебнике изложены основные понятия о структуре и реакционной способности органических молекул. Помимо фундаментальных обсуждений органических кислот-оснований, стереохимии, ИК и ЯМР, эта книга также включает темы реакций замещения и элиминирования, радикального замещения алканов, получения и реакций алкенов и алкинов.

- Карта: Органическая химия (Bruice)
- Фронт
- 1: Электронная структура и связь (кислоты и основания)
- 2: Введение в органические совоку , и Представление структуры
- 3: Алкены – Структура, номенклатура и введение в реакционную способность • Термодинамика и кинетика
- 4: Реакции алкенов
- 5: Стереохимия – Расположение атомов в пространстве; Стереохимия реакций присоединения
- 6: Реакции алкинов – введение в многостадийный синтез
- 7: Делокализованные электроны и их влияние на стабильность, реакционную способность и pKa (подробнее о молекулярно-орбитальной теории)
- 8: Реакции замещения алкилгалогенидов
- 9: Реакции элиминирования алкилгалогенидов (конкуренция замещения и элиминирования)
- 10: Реакции спиртов, простых эфиров, эпоксидов, аминов и серосодержащих соединений
- 11: Металлоорганические соединения
- 12: радикалы (реакции алканов)
- 13: Массовая спектрометрия, инфракрасная спектроскопия и ультрафиолетовая/видимая спектроскопия
- 14: ЯМР -спектроскопия
- 15: ароматичность (реакция бензола)
- 16: Реакции.
 Загладные.
Загладные. - 17: Карбонильные соединения I- Реакции карбоновых кислот и карбоновых производных
- 18: Карбонильные соединения II- Реакции альдегидов и кетонов • Дополнительные реакции производных карбоновых кислот • Реакции α, β-ненасыщенных карбонильных соединений
- 19: Карбонильные соединения III. Реакции на α-углероде
- 20: Подробнее об окислительно-восстановительных реакциях
- 21: Подробнее об аминах (гетероциклических соединениях)
- 22: Органическая химия углеводов 29:00 Химия аминокислот, пептидов и белков
- 9000
 Химия (Bruice)
Химия (Bruice)- 1: Электронная структура и ковалентная связь
- 2: Кислоты и основания
- 3: Введение в органические соединения: номенклатура, физические свойства и представление структуры
- 4. Алкены: структура, номенклатура и введение в реакционную способность Реакционная способность и pKa (ультрафиолетовая и видимая спектроскопия)
- 8: Ароматичность: реакции бензола и замещенных бензолов
- 9: реакции замещения и отщепления алкилгалогенидов
- 10: Реакции спиртов, аминов, простых эфиров и эпоксидов
- 11: Карбонильные соединения I: Реакции карбоновых кислот и производных карбоновых кислот
- 12: Карбонильные соединения II: Реакции альдегидов и кетонов • Другие реакции производных карбоновых кислот
- 0 13. Карбонильные соединения III. Реакции у α-углерода
- 14. Определение строения органических соединений
- 15. Органическая химия углеводов
- 16. Органическая химия аминокислот, пептидов и белков
- 17: Как ферменты катализируют реакции Органическая химия витаминов
- 18: Органическая химия метаболических путей
- 19: Органическая химия липидов
- 20: Химия нуклеиновых кислот
- Химия лекарственных средств : Discovery and Design
- Карта: Органическая химия (Vollhardt and Schore)
- Front Matter in 9 Organic Mocule 1
- 0010
- 2: Структура и реакционная способность: кислоты и основания, полярные и неполярные молекулы
- 3: Реакции алканов: энергия диссоциации связи, радикальное галогенирование и относительная реакционная способность
- 4: Циклоалканы
- 5: Стереоизомеры 6:00 Нуклеофильное замещение в галогеналканах
 Дальнейшие реакции галогеналканов: мономолекулярное замещение и пути элиминации
Дальнейшие реакции галогеналканов: мономолекулярное замещение и пути элиминации )
)- Front Matter
- 1: Введение и обзор
- 2: Структура и свойства органических молекул
- 3: Функциональные группы и номенклатура
- 4: Органическая структура и стереохимия алканов с использованием Введение в An Свободно-радикальное галогенирование алканов
- 6: Стереохимия в тетраэдрических центрах
- 7: Алкилгалогениды – нуклеофильное замещение и отщепление
- 8: Структура и синтез алкенов
- 9: Реакции алкенов
- 10: Alkynes
- 11: Инфракрасная спектроскопия и масс -спектрометрия
- 12: ядерная магнитно -резонансная спектроскопия
- 13: Структура и синтез спиртов
- 14: Реакции спиртов
- 15: Ether , эпоксиды и тиоэфиры
- 16: сопряженные системы, орбитальная симметрия и ультрафиолетовая спектроскопия
- 17: ароматические соединения
- 18: реакции ароматических соединений
- 19: Ketones and Aldehydes
- 20: Amines
- 21: Carboxylic Acids
- 22: Carboxylic Acid Derivatives and Nitriles
- 23: Alpha Substitutions and Condensations of Carbonyl Compounds
- 24: Carbohydrates
- 25: Amino Acids, Peptides, and Белки
- 26: Липиды
- 27: Нуклеиновые кислоты
- Back Matter
- Карта: Органическая химия (Смит)
- Книга: Логика органического синтеза (Rao)
- Владение несколькими такими методами позволяет молекулярному архитектору (широко известному как химик-органик) выполнять сложную задачу синтеза множества молекулярных структур, встречающихся в естественной среде.
 Химия продуктов, химия лекарств и современные молекулярные материалы. В этой задаче химики-органики далее руководствуются несколькими «эмпирическими правилами», которые химики разработали за последние два столетия.
Химия продуктов, химия лекарств и современные молекулярные материалы. В этой задаче химики-органики далее руководствуются несколькими «эмпирическими правилами», которые химики разработали за последние два столетия.
- Book: Complex Molecular Synthesis (Salomon)
- Design and Logic in the Biosynthesis and Total Synthesis of Natural Products
- Book: Catalytic Asymmetric Synthesis (Punniyamurthy)
- Каталитический асимметричный синтез Синтез соединения, который способствует образованию определенного энантиомера или диастереомера с помощью методов катализа. Энантиоселективный синтез является ключевым процессом в современной химии и особенно важен в области фармацевтики, поскольку разные энантиомеры или диастереомеры молекулы часто обладают разной биологической активностью.
- Книга: Радикальные реакции углеводов (Бинкли)
- Том I: “Структура и реакционная способность углеводных радикалов” посвящен основной структуре углеводных радикалов и ожидаемой от них реакционной способности.
 промежуточные продукты. «Том II: Радикальные реакции в синтезе углеводов» содержит обсуждение и анализ радикальных реакций, которые использовались в синтезе углеводов.
промежуточные продукты. «Том II: Радикальные реакции в синтезе углеводов» содержит обсуждение и анализ радикальных реакций, которые использовались в синтезе углеводов. - Radical Reactions of Carbohydrates I: Structure and Reactivity of Carbohydrate Radicals
- Radical Reactions of Carbohydrates II: Radical Reactions of Carbohydrates
- Organic Chemistry I (Cortes)
- OCLUE : Органическая химия, жизнь, Вселенная и все остальное (Коппер и Климковский)
- Органическая химия — это химия углерода и углеродсодержащих соединений. Поскольку основными структурными, каталитическими, информационными и поисковыми системами организмов являются макромолекулы на основе углерода, органическая химия имеет прямое отношение к наукам о жизни. Не менее важно и то, что свойства углерода делают возможным создание удивительного диапазона молекул с уникальными свойствами, от небольших молекул до сложных пластиков и еще более сложных биомолекул.

- Ядерно-магнитный резонанс: приложения к органической химии (Робертс)
- Эта краткая книга является результатом примерно сорока лекций, в которых была предпринята попытка объяснить явление поглощения ядерного магнитного резонанса и использование спектроскопии ядерного магнитного резонанса высокого разрешения химикам-органикам, чей опыт, как и у автора, часто недостаточен в ядерной и электромагнитной теории.
- Была ли эта статья полезной?
- Тип изделия
- Книга или блок
- Показать страницу TOC
- № на стр.

- Теги
- органическая химия
Органическая химия I – Открытая библиотека учебников
Отзыв Мэгги Бамп, старшего инструктора Технологического института Вирджинии, 23.05.22
Этот текст охватывает половину стандартных концепций и реакций по органической химии для студентов бакалавриата и является разумным охватом в течение одного семестра курса. В тексте не рассматриваются полимеры, фармацевтические препараты, биоматериалы или зеленая химия. Эти… читать далее
Отзыв Мэгги Бамп, старшего инструктора Технологического института Вирджинии, 23.05.22
Полнота рейтинг: 4 видеть меньше
Этот текст охватывает половину стандартных понятий и реакций по органической химии для студентов бакалавриата и является разумным охватом в течение одного семестра курса.
Текст не касается полимеров, фармацевтических препаратов, биоматериалов или зеленой химии. Эти развивающиеся области должны быть включены профессором.
Включение предметного указателя, глоссария и сводки реакций было бы отличным дополнением.
Точность содержания рейтинг: 5
Содержание является точным и объективным.
Актуальность/долговечность рейтинг: 4
Включенный материал представляет собой новейшее освещение давних принципов и реакций, содержание которого не меняется быстро.
Реальные приложения, такие как полимеризация винила, используемая в больших промышленных масштабах, не включены, но это повысит актуальность текстового материала.
Ясность рейтинг: 4
Текст написан на уровне, соответствующем первокурсникам и второкурсникам, изучающим органическую химию. Поля примеров и распространенных ошибок удобны и хорошо расположены.
Грамматические ошибки отвлекают и могут вызвать незначительные проблемы для некоторых стилей обучения.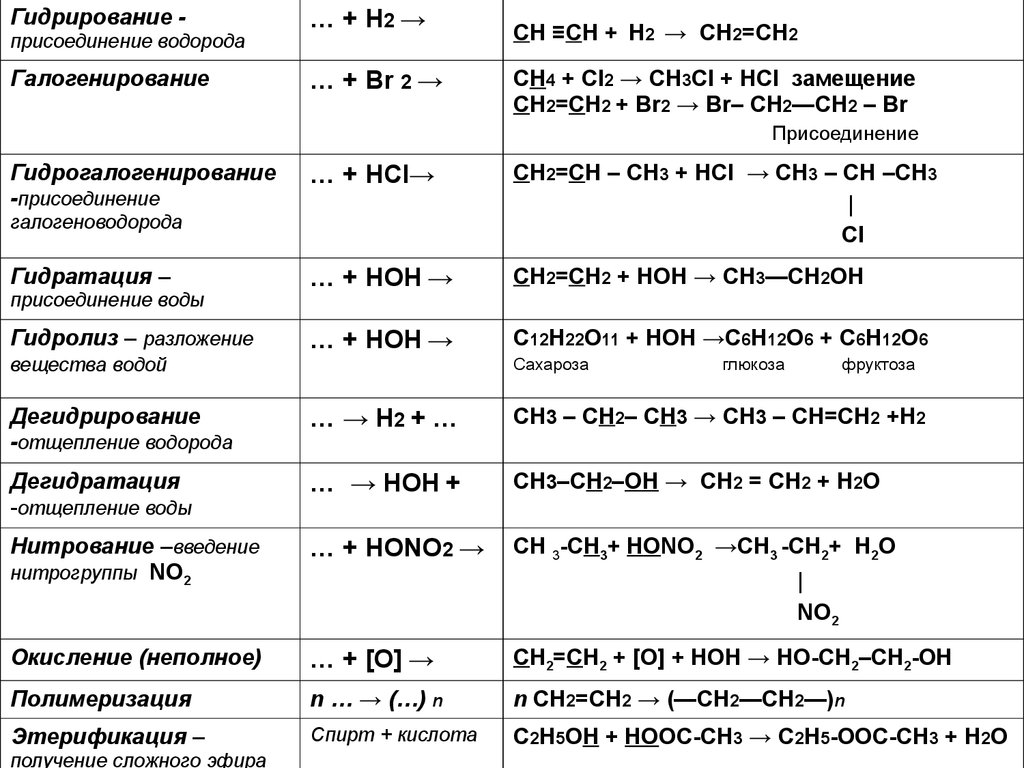
Последовательность рейтинг: 5
Текст во всех главах соответствует стилю и уровню как содержания, так и представления содержания.
Модульность рейтинг: 5
Главы и подзаголовки эффективно используются для разделения текста на чтение до и после занятий или для адаптации порядка материала для индивидуального охвата.
Организация/Структура/Поток рейтинг: 5
Темы представлены в логическом порядке и ясно.
Интерфейс рейтинг: 5
В тексте отсутствуют существенные проблемы с интерфейсом. Изображения выглядят четкими, а навигация между оглавлением и встроенными ссылками логична и плавна.
Грамматические ошибки рейтинг: 3
Есть несколько небольших грамматических ошибок, в основном во временах глаголов и во множественном числе существительных. Они отвлекают, но не мешают пониманию содержания.
Культурная значимость рейтинг: 5
Химия представлена в научной манере. Нет выражений мнений и примеров, не учитывающих культурные особенности.


 Наприклад, структурна формула пропану С3Н8:
Наприклад, структурна формула пропану С3Н8:
 chemist предназначен в качестве вводного текста для студентов, посещающих учебные лаборатории по органической химии. Текст представляет собой четкое и практическое введение в безопасность, обращение с химическими веществами, методы органической химии и лабораторные отчеты.
chemist предназначен в качестве вводного текста для студентов, посещающих учебные лаборатории по органической химии. Текст представляет собой четкое и практическое введение в безопасность, обращение с химическими веществами, методы органической химии и лабораторные отчеты. В максимально возможной степени биологические молекулы и биохимические реакции используются для объяснения и иллюстрации центральных понятий органической химии. Этот подход охватывает основные механизмы органических реакций в биологическом контексте. Однако более ранние главы, посвященные органической структуре и спектроскопии, также максимально сосредоточены на примерах, представляющих интерес для студентов, изучающих биологию и медико-санитарные науки.
В максимально возможной степени биологические молекулы и биохимические реакции используются для объяснения и иллюстрации центральных понятий органической химии. Этот подход охватывает основные механизмы органических реакций в биологическом контексте. Однако более ранние главы, посвященные органической структуре и спектроскопии, также максимально сосредоточены на примерах, представляющих интерес для студентов, изучающих биологию и медико-санитарные науки. Связывание в органических молекулах
Связывание в органических молекулах Подход (МакМайкл)
Подход (МакМайкл)
 Загладные.
Загладные. Химия продуктов, химия лекарств и современные молекулярные материалы. В этой задаче химики-органики далее руководствуются несколькими «эмпирическими правилами», которые химики разработали за последние два столетия.
Химия продуктов, химия лекарств и современные молекулярные материалы. В этой задаче химики-органики далее руководствуются несколькими «эмпирическими правилами», которые химики разработали за последние два столетия. промежуточные продукты. «Том II: Радикальные реакции в синтезе углеводов» содержит обсуждение и анализ радикальных реакций, которые использовались в синтезе углеводов.
промежуточные продукты. «Том II: Радикальные реакции в синтезе углеводов» содержит обсуждение и анализ радикальных реакций, которые использовались в синтезе углеводов.
