Чем органические продукты отличаются от неорганических?
Чем органические продукты отличаются от неорганических?
Конечно же, вы видели в супермаркетах упаковки молока с красивой зеленой наклейкой “ЭКО” или яйца в сене с надписью “100% органика”. Возможно, даже покупали. И не раз задавались вопросом, чем такие продукты отличаются от неорганических.
Исследование, проведённое сотрудниками Стэнфордского университета, показало, что по влиянию на человеческое здоровье органические и неорганические продукты из супермаркета практически не отличаются друг от друга.Главное отличие — способ выращивания
Хотя многие уверены, что продукты, выращенные органическим путем, являются более питательными и содержат в себе большее количество витаминов и минералов, это не совсем так. Главным отличием между так называемыми “органическими” и “неорганическими” продуктами является способ их выращивания.
Органика — это обыкновенная пища, выращенная дедовским способом без использования синтетических пестицидов, регуляторов роста и любой другой химии.
Неорганические продукты иногда могут быть даже питательней органических
Кажется, что съев банан с наклейкой “ЭКО”, вы тут же почувствуете, как по вашему телу расходятся тысячи питательных веществ. А обычный банан не даст вам столько пользы. Но если говорить о питательности, то неорганические продукты иногда даже выигрывают у органических. Ведь в обычный рис часто добавляют дополнительный бета-каротин, молоко обогащают витамином D, а фруктовые соки — кальцием. Добавлять что-то в органические продукты категорически запрещено.
Органическое молоко имеет больше железа, фосфора и витамина Е и жирных кислот омега-3
Но, во-первых, это разница в несколько процентов, во-вторых, наш организм обычно не страдает дефицитом этих веществ.
Также органическое молоко и мясо содержит примерно на 50% больше полезных для человека жирных кислот омега-3. От них зависит тонус кровеносных сосудов, давление, иммунитет и обмен веществ человеческого организма.
Но даже в два раза большего количества жирных кислот омега-3 в молоке все равно слишком мало для удовлетворения потребностей человека. Поэтому даже органическое молоко значительно уступает в этом плане морепродуктам или семенам льна.
Поэтому даже органическое молоко значительно уступает в этом плане морепродуктам или семенам льна.
Количество патогенной микрофлоры в “органике” может быть такой же, как и в “неорганике”. Хотя надо еще учесть добропорядочность украинских “органических предпринимателей”- ведь деды навоз для удобрения не стерилизовали. То есть подхватить кишечную палочку у вас больше шансов именно от органических продуктов.

РАЗНИЦА МЕЖДУ ОРГАНИЧЕСКОЙ ХИМИЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИЕЙ | СРАВНИТЕ РАЗНИЦУ МЕЖДУ ПОХОЖИМИ ТЕРМИНАМИ – НАУКА
В ключевое отличие между органической химией и неорганической химией заключается в том, что Органическая химия – это область химии, которая занимается структурой, свойствами, реакциями и другими факта
В ключевое отличие между органической химией и неорганической химией заключается в том, что
Химия – это в основном отрасль науки, изучающая вещества, из которых состоит материя, исследование их свойств и реакций, а также использование таких реакций для образования новых веществ. Когда мы говорим «органическая химия», мы имеем дело с органическими соединениями, а «неорганическая химия» – с неорганическими соединениями.
1. Обзор и основные отличия
2. Что такое органическая химия
4. Сравнение бок о бок – органическая химия и неорганическая химия в табличной форме
5. Резюме
Что такое органическая химия?
Органическая химия – это раздел химии, который занимается органическими соединениями. Органическое соединение – это химическое соединение, которое содержит один или несколько атомов углерода в качестве основного компонента. Эти атомы углерода связаны друг с другом или с другими химическими элементами посредством ковалентных химических связей. Однако некоторые углеродсодержащие соединения не считаются органическими соединениями; они классифицируются как неорганические соединения, то есть карбонаты и цианиды являются неорганическими соединениями в основном по историческим причинам (эти соединения исторически назывались неорганическими соединениями). Кроме того, почти все органические соединения содержат ковалентную связь C-H.
В основном, большинство молекул, которые связаны с живыми организмами, являются органическими. Например, углеводы, белки, нуклеиновые кислоты и т. Д. Все органические молекулы содержат углерод, почти все содержат водород, а также могут содержать кислород. Область органической химии изучает структуру, свойства, классификации, реакции и многие другие факты об этих соединениях.
Например, углеводы, белки, нуклеиновые кислоты и т. Д. Все органические молекулы содержат углерод, почти все содержат водород, а также могут содержать кислород. Область органической химии изучает структуру, свойства, классификации, реакции и многие другие факты об этих соединениях.
Что такое неорганическая химия?
Неорганическая химия – это раздел химии, изучающий неорганические соединения. Неорганическое соединение – это любое соединение, не являющееся органическим соединением. Другими словами, неорганические соединения – это все соединения, кроме органических. Следовательно, в этих соединениях нет существенных атомов углерода или связей C-H.
В эту категорию входят соли, металлы и другие элементарные соединения. Однако некоторые неорганические соединения содержат атомы углерода. Область неорганической химии – это изучение свойств, классификаций, реакций и многих других фактов об этих соединениях.
В чем разница между органической химией и неорганической химией?
Органическая химия – это область химии, которая занимается структурой, свойствами, реакциями и другими фактами об органических соединениях, тогда как неорганическая химия – это область химии, которая имеет дело с неорганическими соединениями.
Дальнейшие различия показаны в инфографике разницы между органической и неорганической химией.
Резюме – Органическая химия против неорганической химии
Органическая и неорганическая химия – два основных раздела химии. Ключевое различие между органической химией и неорганической химией заключается в том, что органическая химия – это область химии, которая имеет дело со структурой, свойствами, реакциями и другими фактами об органических соединениях, тогда как неорганическая химия – это область химии, которая имеет дело с неорганическими соединениями.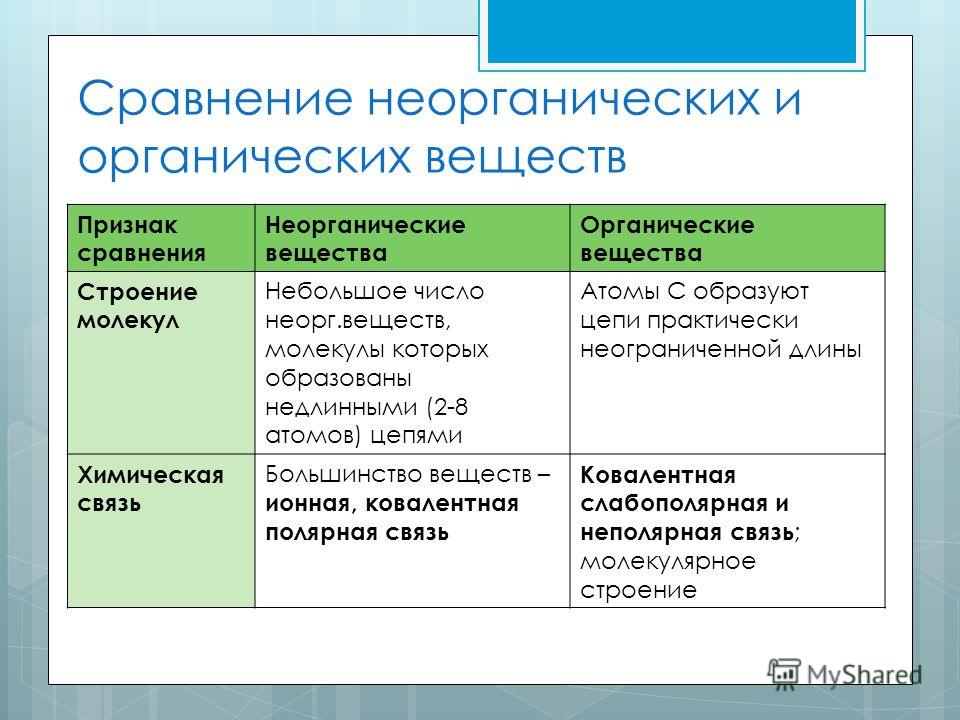
НЕОРГАНИЧЕСКАЯ ХИМИЯ – это… Что такое НЕОРГАНИЧЕСКАЯ ХИМИЯ?
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
наука о внутренних свойствах и о внутренних соединениях и способности производить те или другие изменения неорганических тел: минералов, металлов и металлоидов.
Полный словарь иностранных слов, вошедших в употребление в русском языке.- Попов М., 1907.
.
- НЕОРАМА
- НЕОСИКЛОСТИН
Смотреть что такое “НЕОРГАНИЧЕСКАЯ ХИМИЯ” в других словарях:
НЕОРГАНИЧЕСКАЯ ХИМИЯ — изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений углерода, которые изучаются органической химией).

НЕОРГАНИЧЕСКАЯ ХИМИЯ — НЕОРГАНИЧЕСКАЯ ХИМИЯ. Название Н. х., или химия неорганических минеральных соединений, было дано в противоположность органической химии в то время, когда полагали (см. Органическая химия), что органические соединения в отличие от не •513… … Большая медицинская энциклопедия
НЕОРГАНИЧЕСКАЯ ХИМИЯ — наука, изучающая хим. элементы, их строение, свойства, состав, а также законы превращения их в соединения. На материале H. X. в XIX в. возникла органическая (см.) химия соединений (см.). Однако резкого разграничения между неорганикой и органикой… … Большая политехническая энциклопедия
НЕОРГАНИЧЕСКАЯ ХИМИЯ — НЕОРГАНИЧЕСКАЯ ХИМИЯ, изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений, изучаемых органической химией).
 История развития неорганической химии тесно связана с общей историей химии.… … Современная энциклопедия
История развития неорганической химии тесно связана с общей историей химии.… … Современная энциклопедияНеорганическая химия — НЕОРГАНИЧЕСКАЯ ХИМИЯ, изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений, изучаемых органической химией). История развития неорганической химии тесно связана с общей историей химии.… … Иллюстрированный энциклопедический словарь
НЕОРГАНИЧЕСКАЯ ХИМИЯ — НЕОРГАНИЧЕСКАЯ ХИМИЯ, см. химия … Научно-технический энциклопедический словарь
неорганическая химия — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN inorganic chemistry A branch of chemistry dealing with the chemical reactions and properties of all inorganic matter. (Source: LEE)… … Справочник технического переводчика
неорганическая химия — – раздел химии, имеющий своим предметом соединения химических элементов, за исключением большей части соединений углерода.
 Словарь по аналитической химии [3] … Химические термины
Словарь по аналитической химии [3] … Химические терминыНеорганическая химия — Неорганическая химия раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических… … Википедия
НЕОРГАНИЧЕСКАЯ ХИМИЯ — наука о хим. элементах и образуемых ими простых и сложных в вах, за исключением орг. соединений. Понятие Н. х. (минер. химия) появилось первоначально для обозначения в в минер. происхождения. Осн. задачи соврем. Н. х.: изучение строения, св в и… … Химическая энциклопедия
Неорганическая химия – это… Что такое Неорганическая химия?
Неоргани́ческая хи́мия — раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических веществ (класса соединений, в которые входит углерод, за исключением нескольких простейших соединений, обычно относящихся к неорганическим[1]). Различие между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными.[2]Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений). Обеспечивает создание материалов новейшей техники. Число неорганических веществ приближается к 400 тысячам.
Различие между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными.[2]Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений). Обеспечивает создание материалов новейшей техники. Число неорганических веществ приближается к 400 тысячам.
Теоретическим фундаментом неорганической химии является периодический закон и основанная на нём периодическая система Д. И. Менделеева. Важнейшая задача неорганической химии состоит в разработке и научном обосновании способов создания новых материалов с нужными для современной техники свойствами.
В России исследованиями в области неорганической химии занимаются Институт неорганической химии им. А. В. Николаева СО РАН (ИНХ СО РАН, Новосибирск), Институт общей и неорганической химии им. Н. С. Курнакова (ИОНХ РАН, Москва), Институт физико-химических проблем керамических материалов (ИФХПКМ, Москва), Научно-технический центр «Сверхтвердые материалы» (НТЦ СМ, Троицк) и ряд других учреждений. Результаты исследований публикуются в журналах («Журнал неорганической химии» и др.).
Результаты исследований публикуются в журналах («Журнал неорганической химии» и др.).
История определения
Исторически название неорганическая химия происходит от представления о части химии, которая занимается исследованием элементов, соединений, а также реакций веществ, которые не образованы живыми существами. Однако со времен синтеза мочевины из неорганического соединения цианата аммония (NH4OCN), который совершил в 1828 году выдающийся немецкий химик Фридрих Вёлер, стираются границы между веществами неживой и живой природы. Так, живые существа производят много неорганических веществ. С другой стороны, почти все органические соединения можно синтезировать в лаборатории. Однако деление на различные области химии является актуальным и необходимым, как и раньше, поскольку механизмы реакций, структура веществ в неорганической и органической химии различаются. Это позволяет проще систематизировать методы и способы исследования в каждой из отраслей.
Классификация химических элементов
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен[3] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и так далее). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен[3] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и так далее). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Простые вещества
Состоят из атомов одного химического элемента (являются формой его существования в свободном состоянии). Все простые вещества в неорганической химии делятся на две большие группы: Металлы — Неметаллы.
Металлы
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск. Из 118[4]химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
Из 118[4]химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
Таким образом, к металлам относится 96 элементов из всех открытых.
Неметаллы
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их бо́льшую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов. К неметаллам также относят водород и гелий.
К неметаллам также относят водород и гелий.
Сложные вещества
Большую часть сложных неорганических веществ (то есть состоящих из двух и более химических элементов) можно разделить на следующие группы:
Оксиды
Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом.
Соли
Со́ли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония ; известны соли фосфония или гидроксония ) и анионов кислотного остатка. Типы солей:
Типы солей:
Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостей или по-другому «жидких солей», органических солей с температурой плавления ниже 100 °C.
Основания
Основа́ния — класс химических соединений:
Кислоты
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Также можно выделить следующие группы неорганических веществ: карбиды, нитриды, гидриды, интерметаллиды и другие, которые не укладываются в приведённую выше классификацию (более подробно см. Неорганическое вещество).
Карбиды
Карби́ды — соединения металлов и неметаллов с углеродом.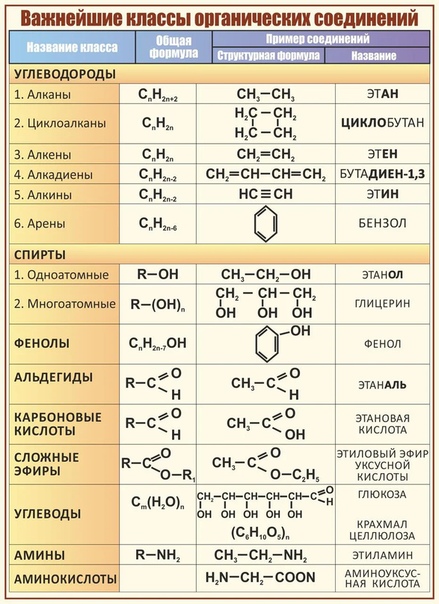 Традиционно к карбидам относят соединения, в которых углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и тому подобные). Карбиды — тугоплавкие твёрдые вещества: карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью.
Традиционно к карбидам относят соединения, в которых углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и тому подобные). Карбиды — тугоплавкие твёрдые вещества: карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью.
Нитриды
Нитри́ды — соединения азота с менее электроотрицательными элементами, например, с металлами (AlN;TiNx;Na3N;Ca3N2;Zn3N2; и т. д.) и с рядом неметаллов (NH3, BN, Si3N4). Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Гидриды
Гидри́ды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом[5][6].
Иногда к гидридам причисляют соединения всех элементов с водородом[5][6].
Интерметаллиды
Интерметалли́д (интерметаллическое соединение) — химическое соединение из двух или более металлов. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами. Интерметаллиды обладают, как правило, высокой твёрдостью и высокой химической стойкостью. Очень часто интерметаллиды имеют более высокую температуру плавления, чем исходные металлы. Почти все интерметаллиды хрупки, так как связь между атомами в решётке становится ковалентной или ионной (например, в ауриде цезия CsAu), а не металлической. Некоторые из них имеют полупроводниковые свойства, причём, чем ближе к стехиометрии соотношение элементов, тем выше электрическое сопротивление. Никелид титана, известный под маркой «нитинол», обладает памятью формы — после закалки изделие может быть деформировано механически, но примет исходную форму при небольшом нагреве.
См. также
Примечания
- ↑ К неорганическим соединениям углерода обычно относят некоторые соли (карбонаты, цианиды, цианаты, тиоцианаты) и соответствующие им кислоты, а также оксиды углерода, карбонилы металлов и карбиды.
- ↑ Spencer L. Seager, Michael R. Slabaugh. Chemistry for Today: general, organic, and biochemistry. // Thomson Brooks/Cole, 2004. — Р. 342. ISBN 0-534-39969-X
- ↑ В книге В. М. Потапов, Г. Н. Хомченко «Химия», М. 1982 (стр. 26) утверждается, что их более 400.
- ↑ Международный химический союз признал 112-й химический элемент
- ↑ Гидриды. XuMuK.ru. Архивировано из первоисточника 22 июня 2012. Проверено 15 июля 2010.
- ↑ onium compounds // IUPAC Gold Book
Литература
- Капустинский А. Ф. Очерки по истории неорганической и физической химии в России. М.-Л., 1949
- Жамбулова М. Ш. Развитие неорганической химии (Историко-методологический аспект).
 Алма-Ата, 1981.- 187 с.
Алма-Ата, 1981.- 187 с. - Неорганическое материаловедение в СССР. Под ред. И. В. Тананаева — Киев: Наукова думка, 1983. — 720 с.
- Популярная библиотека химических элементов. Т. 1,2. / Под ред. И. В. Петрянова-Соколова — М.: Наука, 1983. — 575 с., — 572 с.
- Реми Г. Курс неорганической химии. Т. 1. М.: Изд-во иностранной ли-тературы, 1963. — 920 с.
- Реми Г. Курс неорганической химии. Т. 2. М.: Мир, 1974. — 775 с.
- Шрайвер Э. Неорганическая химия. Т. 1,2. / Э. Шрайвер, П. Эткинс — М.: Мир, 2004. — 679 с., — 486 с.
- Энциклопедия неорганических материалов / Под ред. И. М. Федорчен-ко. В 2-х т. — Киев: Укр. сов. энциклопедия, 1977. — 1652 с.
- Аблесимов Н. Е. Синопсис химии: Справочно-учебное пособие по общей химии — Хабаровск: Изд-во ДВГУПС, 2005. — 84 с. — http://www.neablesimov.narod.ru/pub04c.html
- Аблесимов Н. Е. Сколько химий на свете? ч. 1. // Химия и жизнь — XXI век. — 2009. — № 5. — С. 49-52.
Ссылки
В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 мая 2011. |
Классификация химических реакций в неорганической и органической химии » HimEge.ru
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
По изменению степени окисления элементовПервый признак классификации — по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
б) без изменения степени окисления
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из нескольких более простых, например:
4Li + O2 = 2Li2O
Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
CaCO3 = CaO + CO2
Реакции разложения можно рассматривать как процессы, обратные соединению.
Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Fe + 2HCl = FeCl2 + H2
Их отличительный признак — взаимодействие простого вещества со сложным.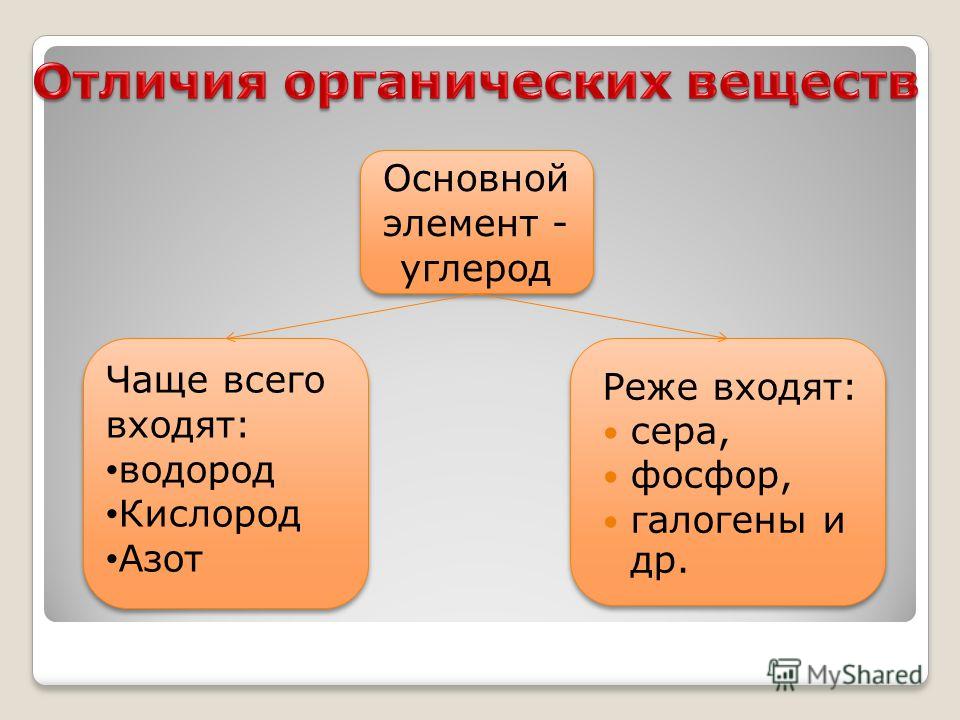 Такие реакции есть и в органической химии.
Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
— обмена (в том числе и нейтрализации).
Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
AgNO3 + KBr = AgBr + KNO3
По возможности протекать в обратном направлении
По возможности протекать в обратном направлении – обратимые и необратимые.
Обратимыми называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N2 +3H2↔2NH3
Необратимыми называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + h3O
2Ca + O2 = 2CaO
BaBr2 + Na2SO 4 = BaSO4↓ + 2NaBr
По тепловому эффектуЭкзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q < 0, а ΔH > 0.
Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
Гомогенными называют реакции, протекающие в однородной среде (однородные вещества, в одной фазе, например г-г, реакции в растворах).
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
По использованию катализатораКатализатор – вещество ускоряющее химическую реакцию.
Каталитические реакции протекают только в присутствии катализатора (в том числе и ферментативные).
Некаталитические реакции идут в отсутствие катализатора.
По типу разрыва связейПо типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов.
- гомолитические (равный разрыв, каждый атом по 1 электрону получает)
- гетеролитический (неравный разрыв – одному достается пара электронов)
Радикальными (цепными) называют химические реакции с участием радикалов, например:
CH4 + Cl2hv →CH3Cl + HCl
Ионными называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO3 = KNO3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C6H6 + Cl2FeCl3→ C 6 H 5 Cl + HCl
H2C =CH2 + Br2 → BrCH2 –CH2Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH3Br + NaOH → CH3OH + NaBr
CH3C(O)H + C2H5OH → CH3CH(OC2H5)2 + H2O
Классификация органических реакций
Классификация органических реакций приведена в таблице:
Таблицы по теме «Типы химических реакций»
На границе органической и неорганической химии
На границе органической и неорганической химии [c.143]Переходы между науками должны быть естественными. Только при таком подходе к определению органической химии и к ее границе с неорганической химией может быть найдено правильное решение этого вопроса. [c.25]
Только при таком подходе к определению органической химии и к ее границе с неорганической химией может быть найдено правильное решение этого вопроса. [c.22]
В XX в. начала приоткрываться завеса над обширной областью, прилегающей к границе органической и неорганической химии В 1899 г. английский химик Фредерик Стенли Киппинг (1863— 1949) занялся изучением органических соединений, содержащих кремний — самый распространенный после кислорода элемент земной коры. Киппинг посвятил изучению кремния более сорока лет и синтезировал множество органических соединений, содержащих один или несколько атомов кремния. Как выяснилось, можно получать бесконечно длинные цепи, состоящие из чередующихся атомов кремния и кислорода. [c.143]
К Шорлеммер в 1889 г дал определение органической химии как химии углеводородов и их производных Однако и это определение не является строгим, и найти четкую границу между органической и неорганической химиями трудно [c.21]
Элементоорганические соединения составляют большую и быстро растущую область на границе между органической и неорганической химией. Многие из них сыграли важную роль в развитии теоретических представлений органической химии или играют эту роль теперь, существенно содействовали развитию синтетических методов органической химии, приобрели большое значение в технике, сельском хозяйстве, медицине. Подробное знакомство с теоретической и практической стороной химии элементоорганических соединений потребовало бы написания целой серии книг. В рамках нашей книги можно рассмотреть лишь наиболее важные вопросы 113 этой обширной области. [c.241]
На основе успехов химии твердого тела по-новому излагаются вопросы современной химической атомистики, постоянства и переменности химического состава, четко очерчиваются границы применимости стехиометрических законов и отмечается их ограниченный характер. Даются формулировки законов постоянства состава, эквивалентов и кратных отношений с учетом немолекулярной формы существования вещества. Идея взаимосвязи химического строения вещества (в том числе твердого) и его свойств проходит красной нитью через весь курс общей и неорганической химии. В этой связи обращается особое внимание на теорию химического строения А. М. Бутлерова в ее современной интерпретации, являющуюся по своему существу общехимической теорией, а не монополией органической химии. В конечном итоге важнейшей задачей химии (неорганической и органической) было и остается выявление зависимости между химическим строением вещества, с одной стороны, и его свойствами — с другой. [c.3]
Таким образом, видно, что границы между органической и неорганической химией намечены достаточно четко, хотя, например, в обла- [c.19]
Неудачи многочисленных попыток найти эту границу привели многих химиков к мысли, что хотя неорганические и органические соединения следует рассматривать как строго самостоятельные группы, различие между ними довольно трудно определить Эти неудачи объясняются стремлением дать формально-логическое определение органической химии, отыскать резкую грань между ней и неорганической химией Такая задача ошибочна в самой ее постановке и принципиально неразрешима Так как в природе все явления взаимосвязаны, то естественно, что грубое отсечение одной отрасли науки от другой невозможно Между смежными науками существуют естественные диалектические переходы В частности, на границе между органическими и неорганическими соединениями находятся такие вещества, как сода, сероуглерод, мочевина, оксид углерода (IV) и т д, которые можно с равным правом рассматривать в качестве как органических, так и неорганических соединений. [c.6]
Органическая химия может быть определена также как химия углеводородов и их производных. Хотя такое определение лучше отражает содержание органической химии, однако и оно ие дает возможности провести резкую границу между органическими и неорганическими веществами, так как понятие производные углеводородов опять-таки охватывает некоторые соединения, являющиеся объектом изучения как органической, так и неорганической химии. Например, поташ и мрамор, представляющие собой производные угольной кислоты, являются в конечном счете производными углеводорода метана, окислением которого может быть получена эта кислота. [c.13]
Судя по тому, что в экзаменационных билетах непрерывно увеличивается число вопросов, относящихся к различным аспектам механизмов неорганических реакций, можно сделать вывод, что этот раздел является неотъемлемой частью программ по неорганической химии даже на тех факультетах, где нет больших групп сотрудников, ведущих активную научно-исследовательскую работу в этой области. Учитывая то, что по данному предмету раньше никаких учебников не было, а многие из издаваемых сейчас книг рассчитаны на читателей, обладающих определенным минимумом знаний, мы попытались собрать тот материал, который, по нашему мнению, необходим для студентов старших курсов. Хотя основное внимание в книге уделяется неорганическим реакциям (а не физико-химическому аспекту механизмов реакций), мы хотели показать, что и углерод (а следовательно, и механизмы органических реакций) прекрасно подходит под общую схему. Вместе с тем провести границу между органическими и неорганическими реакциями было совершенно необходимо, ибо в противном случае наша проблема утеряла бы конкретность, что существенно затруднило бы рассмотрение отдельных ее аспектов. [c.8]
Границы неорганической химии, по мнению ведущих специа-листов-неоргаников, трудно определить. Она простирается от физической химии до органической химии и биохимии. [c.12]
Из этих определений следует, что Лавуазье имел в виду сложность растительных и животных окисляемых и кислотообразующих радикалов, сравнительно с радикалами минеральных кислот. Однако он не проводил резкой границы между неорганическими и органическими веществами и рассматривал их окислы с единой точки зрения. Иначе говоря, он не считал органическую химию самостоятельной и особой областью химии. [c.162]
После избрания на новое пятилетие Бутлеров продолжал преподавание в прежнем объеме. В связи с отъездом в 1878 г. Менделеева за границу он взял на себя его курс неорганической химии, а курс органической передал Меншуткину — вероятному своему преемнику по кафедре органической химии. Лекции, читавшиеся Бутлеровым в первый семестр 1878/79 учебного года, были затем изданы литографским способом под названием Металлоиды . [c.121]
Эти неудачи объясняются стремлением дать формально-логическое определение органической химии, отыскать резкую грань между ней и неорганической химией. Такая задача ошибочна в самой ее постановке и принципиально неразрешима. Так как в природе все явления взаимосвязаны, то естественно, что грубое отсечение одной отрасли науки вт другой невозможно. Между смежными науками существуют естественные диалектические переходы. В частности, на границе между органическими и неорганическими соединениями находятся такие вещества, как сода, поташ, сероуглерод, мочевина, окись углерода и т. д., которые можно с равным правом рассматривать в качестве как органических, так и неорганических соединений. [c.5]
Не следует, однако, быть слишком педантичным, проводя границу между органической и неорганической химией. Между этими науками существует не пограничная линия, а, скорее, пограничная область, куда входят многие соединения, например, такие, как угольная кислота и ее соли. Их всегда, и не без основания, причисляли к неорганическим веществам, так как во многом они напоминают другие неорганические кислоты и соли. В то же время некоторые производные угольной кислоты, например мочевину, можно рассматривать только как органические соединения. К органическим соединениям можно причислить и угольную кислоту. К счастью, подобных случаев не так уж много, и обычно провести разграничение легче. [c.12]
В том, что автору удалось изложить основные идеи квантовой механики и расчетных методов квантовой химии, как нам кажется, оптимальным образом. Он, по-видимому, впервые в монографической литературе по квантовой химии решился широко использовать так называемый скобочный метод Дирака. Этот несколько формальный подход отличается исключительной ясностью и не требует от читателя практически никакой математической подготовки, за исключением внимания при выводах. Конечно, эти главы необходимо проконспектировать (а желательно и решить сопровождающие их задачи), но уже после первых, приблизительно пятидесяти, страниц читатель получает возможность разобраться в настоящих современных методах квантовой химии и в их основе — подходе Хартри — Фока (теории самосогласованного поля). Можно напомнить, что Стрейтвизер подошел к изложению основных идей метода Хартри — Фока только в конце своей книги и уделил им всего две страницы. Дьюар же исходит из этого метода с самого начала и к тому же вполне доступным образом. Правильно, по нашему мнению, и то, что при рассмотрении методов, реально используемых для сложных систем, автор идет от более общего и точного подхода к его упрощенным вариантам, а не отталкивается от примитивных приближенных методов, пытаясь их постепенно исправлять . Это дает читателю солидную подготовку, которая позволяет по мере все более широкого использования усовершенствованных вариантов следить за ними без особого труда. После изложения основ методов Хартри — Фока и Рутана в книге подробно рассматривается подход Попла, который в настоящее время лежит в основе большинства применений к органической химии. Лишь затем автор приступает к анализу метода Хюккеля. Теперь читатель, вооруженный достаточными знаниями, сам может разобраться в границах применимости этого варианта теории. Критика Дьюара самого метода МОХ и особенно попыток его улучшения и распространения на более широкий круг систем (для которых он вообще непригоден) в виде так называемого расширенного метода Хюккеля (или метода Вольфсберга — Гельмгольца) очень солидна и должна повлиять на тех теоретиков, которые пытаются таким путем решать самые сложные проблемы органической и неорганической химии. Можно надеяться, что книга Дьюара выявит нецелесообразность таких работ, которые оказываются устаревшими еще до своего появления. Таким образом, первые четыре методические главы и пятая глава, в которой излагаются результаты применения метода Попла, можно рассматривать как хороший учебник органической квантовой химии, вполне доступный органику, согласному затратить некоторые усилия для овладения современной теорией. [c.6]
Гей-Люссаку принадлежит открытие циана который, будучи соединением неорганическим, находится на границе между неорганической и органической химией. Поведение циана, подобное поведению элемента (сам Гей-Люссак открыл его аналогию с галогенами), способствовало не только изучению производных циана (самой цианистоводородной кислоты и цианидов), но также и развитию теории радикалов в органической химии. Гей-Люссак получил циан, нагревая докрасна совершенно сухой цианид ртути (Hg( N)2-> Hg – – N0). [c.180]
За время, протекшее с выхода в свет первой монографии этой серии, введенное редакторами этой серии понятие элементоорганической химии нашло признание. Где же ее границы По смыслу вещей элементоорганическая химия это химия углеродистых производных всех элементов. Но тогда она включает всю органическую химию как частность Так, элементоорганические соединения азота это, в частности, и белки, и нуклеотиды, и алкалоиды Вряд ли целесообразно сейчас толковать термин так расширительно. Классификационные границы всегда в известной степени произвольны. Когда развитие химии сотрет рубежи органической, элементоорганической и неорганической химии, отнесение того или иного явления к той или иной из этих областей науки будет зависеть от точки зрения, с которой рассматривается данное явление. Так, например, если интересны особенности функционального поведения, скажем, третичного азота алкалоидов — это будет точка зрения элементоорганическая, если же внимание сосредоточено на построении скелета этих алкалоидов — это уже точка зрения чисто органического интереса. Предвосхищая такой подход, мы решились включить в нашу серию и некоторые галоидорганические соединения со всеми особенностями их химии. Развитие методов создания хлорсодержащей функции, изучение роли этой функции в химических и физико-химических свойствах молекулы — задачи, вполне созвучные предмету элементоорганической химии. [c.5]
Эта идея развивалась в атмосфере господствующего мнения, что между органической и неорганической химией нет резкой границы, что атомы углерода, азота, водорода и другие служат строи- [c.259]
Отсюда тесная связь химии со многими естественными науками — геологией, биологией, физикой и другими. На границе между химией и геологией возникла геохимия, изучающая распространенность и миграцию химических элементов на Земле. На стыке химии, биологии и геологии возникла биогеохимия, изучающая геохимические процессы с участием живых организмов. На границе биологии, неорганической и биологической химии появилась новая наука — бионеорганическая химия, задачей которой является изучение химических процессов, протекающих в клетках живых организмов при участии соединений биогенных элементов. Тесная связь биохимии и органической химии привела к возникновению биоорганической химии, а физики, химии, биологии — к созданию биофизической химии, которая описывает закономерности и механизмы протекания биологических процессов на основе фундаментальных законов физической химии. [c.5]
Наконец, следует сказать несколько слов относительно развития химии. За последнее десятилетие во многих работах выражается пессимизм в отношении будущего химии. Узкая полоска переднего края фундаментальной и теоретической химии заполнена специалистами, которых правильнее было бы отнести к физикам, тщательно маскирующимся под химиков-теоретиков. Наиболее выигрышные разделы органической химии во все возрастающем масштабе переходят в биологию. Что же касается все более расплывчатого призрака, называемого неорганической химией ,— кто в настоящее время может определить ее точные границы И все-таки кажется, что нет оснований для пессимизма, когда мы говорим о будущем химии, стоит лишь внести небольшое изменение и назвать ее химической наукой. [c.12]
Французский химик Пьер Эжен Марселей БертАо (1827—1907) в 50-е годы XIX в. начал систематическую разработку синтеза органических соединений и достиг больших успехов. Он синтезировал, в частности, такие хорошо известные и важные соединения, как метиловый и этиловый спирты, метан, бензол, ацетилен. Бертло – нарушил границу между неорганической и органической химией, покончив с пресловутым запретом . В дальнейшем такое нарушение границ стало обычным. [c.71]
В подобное определение включаются некоторые переходные вещества, вследствие чего граница между органической и неорганической химией несколько сглаживается. Так, например, окись углерода СО, двуокись углерода СОа, а также угольная кислота Н2СО3 и ее соли па-столько тесно связаны с неорганическим миром, что их рассматривают обычно в неорганической химии. Углеводороды же, наоборот, причисляют к органическим соединениям, и именно эти вещества лежат в основе систематики органических соединений. [c.3]
Но если существует вполне определенная граница между двумя способами активации, то это еще не означает, что именно она представляет собой также границу между каталитической химией и не-каталитической. Дело в том, что названные два способа активации представляют собой лишь крайности. В чистом виде активация только посредством подачи энергии извне возможиа для большинства неорганических соединений лишь вблизи плазменных состояний, а для органических веществ — выше 800—1000 °С. В чистом виде каталитическая активация практически е встречается при низких температурах реакции мало изучены, а те процессы катализа, которые осуществляет природа в живых организмах, представляют совмещение каталитической и энергетической активации, но с явным преобладашием первой. Процессы, происходящие в промышленных реакторах в интервале температур от О до 400—600 °С, в большинстве представляют реакции, вызванные и каталитическим влиянием, и энергетическими факторами одновременно. Их различие в этом отношении состоит только в степени преобладания одного способа активации над другим. [c.135]
Совр. X. составляет обширнейшую область человеческих знаний и играет огромную роль в народном х-ве. Объекты и методы исследования X. настолько разнообразны, что миогие ее разделы являются по существу самостоят. науч. дисциплинами. X. принято подразделять на 5 разделов неорганическая химия, органическая химия, физическая химия, аналитическая химия и X. высокомолекулярных соединений. Однако четких границ между этими разделами не существует. Нанр., координац. и элементоорг. соединения представляют собой объекты, находящиеся в сфере исследований как неорг., так и орг. X. Развитие же этих разделов невозможно без широкого использования методов и представлений физ. и аналит. X. [c.653]
Почти все отравляющие вещества, имеющие военное значение, являются органическими соединениями. Кроме двойной соли аммонийбериллийфторида, которую можно использовать для заражения воды, мышьяковистого и фосфористого водородов, обладающих общетоксическим действием, но не применимых вследствие неподходящих физических свойств, не имеется других не органических токсичных соединений, пригодных для военных целей. В настоящее время трудно провести границу между органической и неорганической химией. Металлоорганические соединения занимают промежуточное положение, и среди них имеются соединения, которые могут иметь определенное военно-химическое значение, — это некоторые карбонилы металлов и тетраэтилсвинец. Для большинства органических ОВ, нашедших применение в качестве боевых химических веществ, характерно наличие гетероатомов. Сильнодействующие отравляющие вещества (а только такие здесь и рассматриваются), кроме некоторых ядов животного и растительного мира, таких, как кантаридин или окись углерода, в редких случаях состоят только из трех главных элементов — углерода, водорода и кислорода. Обычно в них входят элементы, наличие которых и придает им токсические свойства прн действии на теплокровные организмы фтор, хлор, сера, азот, фосфор и мышьяк. Те элементы, которые входят в состав металлоорганических соединений, здесь не упомянуты. [c.33]
Более точное определение органической химии было дано К. Шо-рлеммером в 1889 г. Органическая химия является химией углеводородов и их производных . Это определение тоже не проводит резкой границы между органической и неорганической химией. Так, например, оксиды углерода мы можем рассматривать как неорганические и как органические (производные метаиа) соединения. Большое семейство элементорганических соединений принадлежит одновременно как органической, так и неорганической химии ( третья химия ) [c.10]
Развитие области неорганических полимеров вместе с тем составляет новый этап в современной неорганической химии, который характеризуется переходом от традиционных реакций в водных растворах к применению экспериментальной техники органической химии — проведению реакций в неводных растворах или в расплавленном состоянии. Таким образом, намечается соприкосновение неорганической химии с органической. На границе этих двух областей возникает новая химия ковалентных соединений, применяющая экспериментальные методы органической химии и оперирующая со всеми элементами нериодической системы. [c.322]
Чрезвычайное сближение органической и неорганической химии в структурах металлоценов и аренных комплексов металлов породило новую область, в равной мере привлекающую внимание как химиков-экспериментаторов, так и химиков-теоре-тиков. Это всего лишь одно из подлинно волнующих новых событий, происходящих в металлоорганической химии. Энтузиазм, который явно чувствуется в появляющихся сообщениях, посвященных этой проблеме, подтверждается быстро увеличивающимся числом научных работ и научных работников, связанных с изучением металл-углеродных соединений. Разносторонность прилагаемых усилий и улучшение научного взаимодействия между химиками — органиками и неорганиками — все это позво ляет высказать оптимистическое мнение, что искусственные барьеры, существовавшие ранее между органической химией и физическими науками, у этой границы также будут стерты. [c.11]
Неудачи многочисленных попыток найти границу между минеральными и органическими веществами объясняются тем, что ученые пытались дать формально-логическое определение органической химии, отыскать реэкую грань между ней и неорганической химией. Такая задача ошибочна в самой ее постановке и принципиально неразрешима. Так как в природе все явления взаимосвязаны, то естественно, что простое отсечение одной отрасли науки от другой, ей смежной, — например, органической химии от неорганической — невозможно. Между смежными науками существуют естественные диалектические переходы. В частности, между органическими и неорганическими веществами имеется естественная смежная область, в которую входит ряд таких веществ, как сода, поташ, мрамор, сероуглерод, окись углерода и т. п. [c.25]
Прямое, синтетическое направление планирования в программе SOS было использовано при решении задач, поставленных перед нами в двух различных областях химии. Первый формальный подход к катализу (TAMREA ) был развит по инициативе Отдела химии в Марселе, который побудил нас начать исследования на границе между органической и неорганической химией. Вторая область исследования возникла под влиянием профессора Вернена, который анализировал очень сложную смесь гетероциклов, имеющих отношение к химии вкусовых веществ [312]. По первому проекту мы ввели в компьютер схемы основных реакций катализа переходными металлами [313—316]. Покончив с этим, мы спросили ЭВМ, какая последовательность реакций возникнет, если смешать этилен и комплекс переходного металла. Компьютер предложил большое число возможных процессов, среди которых один ранее предлагался Грином, но еще не рассматривался в литературе, хотя и кажется вполне разумным [169]. Машина предложила строение промежуточного соединения, объяснявшее экспериментально показанное отсутствие в реакционной смеси тримеров этилена [169] [c.49]
По мере изучения проблемы жизни все яснее становится необходимость комплексного рассмотрения биологических явлений с позиций химии, физики, математики. Участвует в этом и неорганическая химия. Ведь известно, что в возникновении и функционировании биохимических систем организмов и растений значительная роль принадлежит тем элементам, которые до недавнего времени не относились к числу входящих в органические соединения. Имеются в виду прежде всего металлы, которые все более и более занимают внимание ксследователей, по мере того как раздвигаются границы нашего познания живого. [c.3]
Неорганические полимеры обладают не только термостойкостью и твердостью, но и, подобно органическим, могут быть эластичными. Например, стеклянное волокно не горит, не гниет, не впитывает влагу, не боится действия большинства кислот и щелочей или синтетический асбест, отличающийся от природного большим постоян-ство м свойств и химического состава, а также более высокой термостойкостью или полученный полимер сульфида кремния, имеющий асбестоподобную структуру. Ныне твердо установлено, что неорганическая природа многих больших молекул не исключает эластичности и других типичных свойств органических полимеров. Таким образом, на границе органической и неорганической химии оформилась и успешно развивается новая ветвь — неорганические полимеры. Все новые и новые открытия совершаются в этой области. Неудержимо растет число [c.119]
Следует однако отметить, что многие химики стихийно понимали непроходимой границы между обоими классами химических соединений не существует. На этой основе прокладывались пути к рациональному объяснению свойств и конституции органических соединений, шаг за шагом отвоевывались у концепции жизненной силы ее позиции. Особенно большое значение в развитии органической химии имели упорные попытки приложения атомистической теории к объяснению состава и конституции органических соединений. В этом отношении особую роль сыграли исследования Берцелиуса, который, как мы видели, принадлежал к числу приверженцев учения о жизненной силе. Установив под-чиняемость органических соединений закону постоянных пропорций, Берцелиус в дальнейшем распространил на них и свою электрохимическую дуалистическую теорию. И несмотря на то, что вскоре дуалистическая теория была отвергнута, сам факт ее приложения к органическим соединениям сблизил новую область химии с ее старинной ветвью — неорганической химией. [c.198]
Однако разделение полимеров па стабильные, консервативные , чисто неорганические полимеры и пластичные, многоликие , органические, хотя и верно в основном, но относительно. На границе органической и неорганической химии разви лась мощная и полнокровная химия элементоорганических соединений, ставшая самостоятельным разделом химии. Таким же образом и в области высокомолекулярных соединений элементоорганические полимеры рассматриваются самостоятельно. Введение в органические полимеры элементов неорганогенов III и следующих периодов, а также фтора позволяет сообщать им некоторые свойства неорганических полимеров. Кремний- и фторорганические полимеры завоевали прочное и признанное место среди синтетических материалов конструкционного назначения. [c.72]
Все сильнее стираются грани, отделяющие неорганическую хи-лшю от других областей химической науки. Поэтому весьма ценно, что в настоящем учебном пособии уделяется достаточно внимания соединениям, находящимся на границе Л1ежду органической и неорганической химией, а именно металлоорганическим соединениям. Широко обсуждается также химия технологических процессов. Хорошо иллюстрируется связь химических теорий с практическим использованием металлов и их соединений в промышленности, сельском хозяйстве, оборонной технике. [c.5]
Двойственность химизма гармонирует с двумя отделами химии — органической и неорганической. Типичные превращения органической химии лежат по существу ближе к проявлениям энергии впутроннего давления, типичные превращения неорганической химии—ближе к проявлениям электрическох энергии. Конечно, в ряду разнообразных химических превращений не существует резкой границы между теми и другими. Однако с этой двойственностью приходится считаться при установке химических теорий, охватывающих типичные явления в той и другой области. Теория строения, блестяще проведенная во всех отделах органической химии, далеко не охватила всех областей неорганической химии. Для неорганической химии должны быть созданы новые теории. Согласно вышесказанному эти теории вероятнее всего могут быть электрохимическими . [c.98]
Хотя причины, вызвавшие разделение описательной химии на две дисциплины, давно исчезли, это разделение сохранилось из практических соображений. В первую очередь число органических соединений (считается, что их около 1 750 ООО) гораздо больше числа неорганических соединений, которых вместе со всеми солями насчитывается не больше 500 ООО. Включение соединений углерода в число соединений остальных элементов затруднило бы ясное и простое описание обоих классов соединений. Кроме того, органические вещества часто отличаются от неорганических по своим свойствам и структуре. Кроме того, методы, применяемые в обеих этих областях химии, также различны. Органические вещества образуют огромную единую систему, что и оправдывает их отдельное изучение. Как будет видно далее, между органической и неорганической химией не существует резкой границы. Элементарный углерод, а тaклie его окиси и кислородные кислоты изучаются по старой тра- [c.303]
Фтор стоит на грани органической и неорганической химии. Особые свойства этого элемента, образующего соедине ния с металлами и неметаллами, причем с проявлением максимальной валентности элемента широкий интервал прочности элемент-фторной связи приводит к реализации таких структур, которые не имеют аналогов среди углеводородных соединений. Решение многих технических задач привело к тщательному исследованию насыщенных и ненасыщенньь Г фторуглеродов. Получены фторуглероды с различными функциональными группами перфторированные галоидные алк I-лы, спирты, альдегиды, кетоны, сульфиды, карбоновые кислоты, диазосоединения, кетены и прочие. Свойства этих соединений резко отличаются от свойств производных углеводородов. Они расширяют границы использования химических соединений в науке и технике. [c.6]
Типы химических реакций в органической химии
При протекании химических реакций происходит разрыв одних и возникновение других связей. Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Классификация по характеру химических превращений
- Реакции замещения
- Реакции присоединения
- Реакция элиминирования (отщепления)
- Реакция изомеризации и перегруппировка
- Реакции окисления
- Реакции конденсации и поликонденсации
- Реакции разложения
Реакции замещения
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Реакции присоединения
При протекании реакций присоединения из двух или более молекул веществ образуется одна молекула нового соединения. Такие реакции характерны для ненасыщенных соединений. Различают реакции гидрирования (восстановления), галогенирования, гидрогалогенирования, гидратации, полимеризации и т.п:
- Гидрирование – присоединение молекулы водорода:
- Галогенирование — присоединение молекулы галогена:
- Гидрогалогенирование — присоединение молекулы галогенводорода:
- Гидратация — присоединение молекулы воды:
- Полимеризация – образование высокомолекулярного соединения посредством многократного присоединения низкомолекулярного соединения, например:
Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
- Дегидрирование – отщепления молекулы водорода:
- Дегидратация – отщепление молекулы воды:
- Дегидрогалогенирования – отщепления молекулы галогеноводородов:
Реакции изомеризации и перегруппировка
В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например:
Реакции окисления
В результате воздействия окисляющего реагента происходит повышение степени окисления углерода в органическом атоме, молекуле или ионе процесс за счет отдачи электронов, вследствие чего образуется новое соединение:
Реакции конденсации и поликонденсации
Заключаются во взаимодействии нескольких (двух и более) органических соединений с образованием новых С-С связей и низкомолекулярного соединения:
Поликонденсация – образование молекулы полимера из мономеров, содержащих функциональные группы с выделением низкомолекулярного соединения. В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:
Реакции разложения
Это процесс расщепления сложного органического соединения на менее сложные или простые вещества:
С18H38 → С9H18 + С9H20
Классификация химических реакций по механизмам
Протекание реакций с разрывом ковалентных связей в органических соединениях возможно по двум механизмам (т.е. пути, приводящему к разрыву старой связи и образованию новой) – гетеролитическому (ионному) и гомолитическому (радикальному).
Гетеролитический (ионный) механизм
В реакциях, протекающих по гетеролитическому механизму образуются промежуточные частицы ионного типа с заряженным атомом углерода. Частицы, несущие положительный заряд называются карбкатионы, отрицательный – карбанионы. При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
Склонность к гетеролитическому разрыву проявляют сильно полярные, например Н–O, С–О и легко поляризуемые, например С–Вr, С–I связи.
Реакции, протекающие по гетеролитическому механизму делят на нуклеофильные и электрофильные реакции. Реагент, располагающий электронной парой для образования связи называют нуклеофильным или электронодонорным. Например, HO—,RO—, Cl—, RCOO—, CN—, R—, NH2, H2O, NH3, C2H5OH, алкены, арены.
Реагент, имеющий незаполненную электронную оболочку и способные присоединить пару электронов в процессе образования новой связи.называют электрофильным реагентам относятся следующие катионы: Н+, R3C+, AlCl3, ZnCl2, SO3, BF3, R-Cl, R2C=O
Реакции нуклеофильного замещения
Характерны для алкил- и арилгалогенидов:
Реакции нуклеофильного присоединения
Реакции электрофильного замещения
Реакции электрофильного присоединения
Гомолитический (радикальный механизм)
В реакциях, протекающих по гомолитическому (радикальному) механизму на первой стадии происходит разрыв ковалентной связи с образованием радикалов. Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Различают реакции радикального замещения и радикального присоединения
Реакции радикального замещения
Характерны для алканов
Реакции радикального присоединения
Характерны для алкенов и алкинов
Таким образом, мы рассмотрели основные типы химических реакций в органической химии
Разница между неорганической и органической химией
Основное различие между органической и неорганической химией заключается в наличии (или отсутствии) углерода в соединениях, которые изучаются, обрабатываются или синтезируются. Основная задача органической химии – это соединения, содержащие углерод или углеродные цепи, такие как углеводороды или белки. С другой стороны, неорганическая химия занимается такими вещами, как металлы, минералы и металлоорганические соединения.
С точки зрения методологии, техники и фундаментальных концепций, как органическая, так и неорганическая химия имеет дело с различными типами соединений, химическими реакциями и свойствами.В этой статье мы исследуем сходства, различия и взаимосвязь между органической и неорганической химией.
Что такое органическая и неорганическая химия?И органическая химия, и неорганическая химия изучают свойства, реакции, структуру и синтез различных химических веществ:
- Органическая химия сосредоточена на соединениях, производимых живыми организмами, или на синтетических химикатах, содержащих цепочки атомов углерода, таких как пластмассовые полимеры.
- Неорганическая химия сосредоточена на неорганических простых соединениях, таких как диоксид углерода или цианиды, и металлоорганических соединениях, таких как переходные металлы.
Обе эти научные отрасли используют аналитические лабораторные методы и приборы для изучения поведения и реакций соединений в рамках своей дисциплины. Рассматриваются три ключевых области:
- Свойства веществ: Это относится как к физическим свойствам, таким как температура плавления или плотность, так и к химическим свойствам, таким как реакционная способность, токсичность или типы создаваемых связей.
- Реакционная способность соединений: Реакционная способность химических веществ, которая включает скорость и интенсивность реакций, является решающим поведенческим фактором, который изучается как в неорганической, так и в органической химии.
- Структура веществ: Это относится к тому, как атомы организованы в молекулы определенных форм и углов. Формы молекул во многом определяются молекулярными связями, в основе которых лежат валентные электроны.
После определения свойств, реакционной способности и структуры соединения эта информация служит основой для синтеза этого вещества или создания его аналога.Например, ароматы фруктов можно имитировать с помощью синтетических химических аналогов.
Чем отличается органическая химия от неорганической химии?Органическую химию можно отличить от неорганической химии, рассматривая типы соединений в каждом полевом исследовании. Мы начнем с неорганической химии, которая занимается изучением свойств неорганических веществ. Эта отрасль также занимается синтезом различных неорганических химикатов, имеющих экономическое и промышленное значение, включая аммиак, хлор и соляную кислоту.
Между тем, органическая химия сосредоточена на изучении и синтезе любых соединений на основе углерода, таких как углеводороды, а также их производных, таких как пластмассы. Таким образом, органическая химия частично совпадает с неорганической химией:
- Химическая промышленность и фармацевтическая промышленность синтезируют и массово производят различные типы продуктов, которые основаны на слиянии или перекрытии неорганической и органической химии
- Продукты, такие как пигменты, покрытия, топливо и лекарства, стали возможны благодаря как неорганической, так и органической химии
- Перекрытия между неорганической и органической химией особенно заметны в субдисциплине металлоорганической химии
Органическая химия также пересекается с биохимией, которая играет важную роль в этой дисциплине, потому что оба предмета смотрят на органические реакции и изучают важные биохимические молекулы.Тем не менее, по сравнению с органической химией, биохимия более конкретно сосредоточена на сложных химических процессах в живых организмах, таких как то, как белки складываются определенным образом с образованием определенных ферментов или гормонов.
При производстве топлива необходима как органическая, так и неорганическая химия. Как избавиться от органических и неорганических отходовСуществуют надлежащие способы утилизации органических и неорганических отходов, в зависимости от того, какой у вас тип. Вы также можете найти эти протоколы и процедуры, оформленные в местных постановлениях, национальных законах, региональных постановлениях и международных договорах.
Как органические, так и неорганические отходы потенциально опасны для окружающей среды, а также связаны с риском для здоровья. В то же время не все отходы имеют одинаковый потенциал причинения вреда:
- Некоторые виды органических отходов являются биоразлагаемыми и могут легко рассеиваться в окружающей среде, что упрощает утилизацию
- С некоторыми типами неорганических отходов , такими как остатки обработки газа, необходимо осторожно обращаться и утилизировать из-за их воздействия на окружающую среду
- Существует также опасных видов отходов, которые являются как органическими, так и неорганическими , такими как нефтесодержащие шламы, которые также имеют специальные инструкции по удалению
Следовательно, соответствующий метод утилизации любых отходов будет зависеть от того, что они собой представляют и насколько опасны.Например, жидкие отходы нельзя сбрасывать ни в какой водоем.
Как правило, отходы можно разделить на четыре основные категории, и все они содержат смесь органических и неорганических соединений:
- Жидкие отходы: Сюда входят сточные воды, разливы сырой нефти и промышленные растворы или растворители. Этот тип отходов обычно содержит неорганические химические вещества и должен проходить многоступенчатую обработку, чтобы либо полностью удалить токсичный остаток, либо нейтрализовать его.Например, жидкие отходы, используемые при производстве бумаги, такие как растворы щелочи, перед утилизацией следует нейтрализовать, чтобы удалить высокую щелочность.
- Твердые отходы: Этот вид отходов включает такие вещи, как стекло, керамика, пластик или бумага, а также древесные отходы и отходы металлов или сплавов. Многие из этих продуктов подлежат переработке или повторному использованию. Другие потенциально опасны, особенно металлические отходы батарей, такие как свинец или кадмий. Твердые отходы можно утилизировать либо на свалках, либо путем сжигания, в зависимости от того, что это такое.
- Биоразлагаемые отходы: Это органические отходы, такие как гниющее мясо, кожура фруктов, овощи, другие продукты питания и бумага. В идеале органические отходы следует утилизировать путем компостирования или сжигания. Органические отходы крупных животноводческих ферм можно даже перерабатывать в качестве источника топлива, особенно метан.
- Опасные отходы: В дальнейшем их можно подразделить на несколько категорий, например, биологически опасные отходы, взрывоопасные или легковоспламеняющиеся отходы, коррозионные отходы, токсичные отходы и радиоактивные отходы.В зависимости от потенциального вреда, который они могут причинить, протоколы утилизации могут отличаться, но если они не могут быть нейтрализованы, сожжены или отправлены на санитарную свалку, опасные отходы следует изолировать, запечатать в защитные контейнеры и захоронить в специально предназначенных для этого местах.
Все металлы являются неорганическими, потому что они находятся либо в элементарной форме, либо в форме сплава. Даже если они содержат следы углерода, как, например, в случае стали, они не связаны химически с углеродом, и углерод не является основным элементом основной цепи.Вот почему металлы неорганические.
Витамины органические или неорганические?Все витамины являются органическими соединениями, поскольку содержат углерод и синтезируются в живых организмах. Организм человека нуждается в 13 типах витаминов, которые классифицируются как питательные микроэлементы, которые в основном служат коферментами для облегчения метаболических процессов. Витамины можно разделить на два основных класса:
- Жирорастворимые витамины , в том числе витамины A, D, E и K
- Водорастворимые витамины , в том числе аскорбиновая кислота или витамин С, тиамин, рибофлавин, ниацин, витамин B6, фолацин, витамин B12, биотин и пантотеновая кислота
Витамины присутствуют практически во всех живых организмах в разном количестве.Некоторые из них синтезируются животными через кожу и печень, а другие можно найти в самых разных растениях. Витамины всегда содержат углерод в различных формах и химических комбинациях вместе с другими функциональными группами или элементами. Вот почему все витамины являются органическими.
И в органической, и в неорганической химии используются аналитические методы для исследования органических и неорганических веществ соответственно. Азотная кислота – органическая или неорганическая?Мы знаем, что азотная кислота является неорганическим соединением, потому что ее химическая формула (HNO 3 ) говорит нам, что каждая молекула в этом соединении имеет один атом водорода, один атом азота и три атома кислорода.Хотя азотная кислота используется в качестве предшественника органических соединений азота, сама по себе, очевидно, не содержит углерода, поэтому она классифицируется как неорганическое соединение.
органических соединений по сравнению с неорганическими
Органические и неорганические соединенияЕсть основные различия между органическими и неорганическими соединениями. Хотя оба типа соединений составляют основу химии, эти два типа довольно сильно различаются. Основное отличие заключается в наличии атома углерода; органические соединения будут содержать атом углерода (и часто атом водорода для образования углеводородов), в то время как почти все неорганические соединения не содержат ни одного из этих двух атомов.
Хотя большинство неорганических соединений не содержат углерода, некоторые из них содержат. Окись углерода и двуокись углерода, например, содержат атомы углерода, но их количество недостаточно велико для образования прочных связей с кислородом, присутствующим в молекуле. Из-за небольшого количества углерода и слабых связей, которые он образует, ученые давно классифицируют эти молекулы как неорганические, но это побудило некоторых представителей научного сообщества заявить о необходимости создания более совершенной системы классификации соединений.
Еще одно важное различие между органическими и неорганическими соединениями – это тип молекулы и ее связь с живыми существами. Органические соединения будут включать такие вещи, как нуклеиновые кислоты, содержащиеся в ДНК, липиды и жирные кислоты, обнаруженные в клетках живых организмов, белки и ферменты, необходимые для протекания клеточных процессов, и многое другое. Между тем неорганические соединения включают соли металлов и других элементарных соединений.
1. C 12 H 22 O 11 – Сахароза, более известная как сахар, который мы используем в домашних условиях, является важным органическим соединением, которое содержит не только углерод и водород, но и их в изобилии и в более высоких соотношениях. чем присутствующий кислород.
2. CH 4 – Это органическое соединение на основе углерода и водорода, также известное как метан, является широко известным продуктом жизнедеятельности живых существ.
3. C 55 H 72 O 5 N 4 Mg – Более известный среди исследователей как хлорофилл-а, этот компонент, обнаруженный в зеленых растениях, не только имеет высокое соотношение углерода и водорода, но также является главный фактор процесса фотосинтеза у растений.
4. (NH 4 ) 2 S – Несмотря на присутствие атомов водорода в этом соединении, отсутствие атома углерода и возникающие в результате слабые связи, которые образуются между атомами, делают сульфид аммония неорганическим соединением.
5. CaCl 2 – Хлорид кальция – неорганическое соединение, имеющее множество применений, но отсутствие в нем атома углерода, атома водорода или обоих означает, что он классифицируется как неорганическое соединение.
Сравнение органических и неорганических соединений
В чем разница между органическими и неорганическими соединениями?
Куда бы мы ни посмотрели, можно увидеть как неорганические, так и органические соединения. Когда мы идем в супермаркет, мы видим разные товары; некоторые из них являются органическими, а другие – неорганическими.В чем разница между органическими и неорганическими соединениями?
Ну, химическая разница не та, которую вы слышите в новостях, которая отличает «органические» овощи от «неорганических». Угадайте, что оба состоят из органических и неорганических соединений.
Допустим, определение «сельскохозяйственная промышленность» не то же самое, что определение химического вещества. В химии есть серьезное различие, которое четко определено.
Определение разницы между органическими и неорганическими соединениями – одна из главных вещей, которую вам нужно четко понимать при изучении химии.Если вам интересно, узнайте больше о термодинамике и кинетике, еще двух из самых важных концепций в химии.
В этой статье мы объясним это подробно, так что в конце вы сможете без труда различать оба типа химикатов. Мы постараемся решить все ваши сомнения по поводу этого извечного химического вопроса!
Вначале ученые разделяли органические и неорганические соединения на том факте, что первая группа считалась результатом деятельности живых существ, тогда как вторая группа относилась к процессам, не связанным с каким-либо образом жизни.Теперь есть более четкие определения.
| Знаете ли вы? Неорганическая и органическая химия – две основные дисциплины химии. Органическая химия связана с (большей частью) химией углерода, а неорганическая химия изучает в основном остальные химические соединения. |
Введение
Около 200 лет назад, на переходе между алхимией и химией, химики разделили химические соединения на две основные группы.
1. Органические соединения
Простое и понятное непрофессионалам определение органических соединений состоит в том, что это те соединения, которые получены из живых существ, таких как растения и животные, известны как органические соединения, такие как сахара, липиды, белки, нуклеиновые кислоты и т. Д. и т. д.
Более строго говоря, мы считаем соединение органическим, если оно состоит из атомов углерода, которые участвуют в ковалентных связях. Обычно (но не всегда) в органических соединениях также присутствуют ковалентные связи C – H.
2.Неорганические соединения
Простое определение для постороннего: те соединения, которые получены из неживых существ или минеральных источников, известны как неорганические соединения, такие как NaCl (поваренная соль) и NaHCO 3 (пищевая сода) и т. Д.
Определить неорганические соединения довольно просто после определения органических соединений. Как правило, каждое химическое вещество, не попадающее в категорию «органическое», считается неорганическим соединением.
Теория жизненной силы и первый полный химический синтез
Давайте снова вернемся в прошлое, к самым ранним дням химии.Теория, известная как «теория жизненной силы», может стать для вас звонком, если вы знакомы с историей химии.
Эта теория была предложена шведским химиком Берцелиусом в 1815 году. Эта теория утверждает, что органические соединения нельзя синтезировать в лаборатории. Ранние химики считали, что органические соединения можно получить только из живых организмов с помощью «жизненных сил». Вот почему эту теорию называют «теорией жизненной силы».
В 1828 году немецкий химик Фридрих Велер синтезировал мочевину в лаборатории.Это составляет первых случаев полного химического синтеза природного органического соединения!
Это достижение показало, что можно синтезировать органическое соединение (мочевину), исходя из неорганического соединения (цианата аммония), в лаборатории: обработка цианата серебра хлоридом аммония дает кристаллическое соединение, которое, как было установлено, идентично мочевина, выделенная из мочи.
Велер химический синтез мочевины, первого органического природного соединения, полученного в лаборатории.Это химическое преобразование опровергло теорию жизненной силы, и вскоре после этого химики начали создавать органические соединения в лаборатории. Таким образом, в научный мир было введено современное определение органических соединений. Это также знаменует собой самое начало органической химии как дисциплины .
Современные определения
Органические соединения
Соединения, которые содержат атомы углерода в качестве основного компонента, которые связаны друг с другом ковалентными связями, называются органическими соединениями.Большинство органических соединений также содержат водород. Другими распространенными элементами, присутствующими в органических соединениях, являются кислород, азот, сера, галогены или фосфор. Но это не единственные.
В большинстве случаев все атомы различных элементов удерживаются вместе ковалентными связями. Некоторыми исключениями могут быть, например, органические карбоксилаты или соли аммония. Но вы можете возразить, что это «неорганические соли органических соединений».
Некоторые соединения, которые могут показаться «чертовски неорганическими», такие как полимеры (причудливое название пластмасс), на самом деле представляют собой органические соединения с длинной цепью.Пример – полистирол. Его основа состоит в основном из ковалентных связей C – C и C – H.
Имейте в виду, что «органическое соединение» не означает «биохимическое соединение». С другой стороны, основу биохимии составляют в основном органические соединения (хотя металлы чрезвычайно важны в биологических системах, например, железо в гемоглобине).
Неорганические соединения
Удалите все органические соединения. У вас остались неорганические соединения. Если он не подпадает под определение органического, это неорганический.
Обычно соединения, не имеющие ковалентных связей C – C или C – H, называются неорганическими соединениями.
Есть много соединений, которые имеют только ковалентные связи, у них есть атомы углерода, , но не являются органическими соединениями. Примеры неорганических соединений этого типа включают монооксид углерода, диоксид углерода, неорганические карбонаты, карбиды и т.д. Примечательно, что аллотропы углерода, такие как графит, графен или алмаз, содержат только атомы углерода, но считаются неорганическими соединениями.
Как видите, иногда определение не так хорошо установлено. Фактически, я не смог найти четкого определения для обоих, предоставленного IUPAC. Это иллюстрирует тот факт, что определяют грань между неорганическими и органическими химическими веществами.
Некоторыми интересными примерами этой золотой середины являются металлоорганических соединений . Они состоят из органического компонента, обычно связанного с неорганическим компонентом углеродно-металлической связью. Это действительно весело, и они являются одной из наиболее широко исследуемых тем в современной химии!
Основные различия между органическими и неорганическими соединениями
Мы попытаемся обобщить в быстрой сравнительной таблице основные различия между органическими и неорганическими соединениями.
Однако имейте в виду, что в большинстве случаев это просто обобщения и не будет верным для любого сценария, и определенно будут исключения.
| Органические соединения | Неорганические соединения | |
| Определение | Органические соединения обычно состоят из основной цепи, состоящей из C – C и C – H ковалентных связей. | Неорганические соединения не имеют основной цепи на основе ковалентных связей C – C. |
| Происхождение | Живые организмы, как правило, состоят по большей части из органических соединений. | Неорганические соединения обычно встречаются в неживых существах, таких как минералы, воздух или космическое пространство. |
| Состав | Органические соединения в основном состоят из углерода и водорода, а также кислорода, азота, галогена, фосфора и других веществ. | Неорганические соединения могут содержать огромное количество химических элементов.Для каждого элемента периодической таблицы есть неорганические соединения. |
| Химическая связь | Органические соединения удерживаются вместе ковалентными связями. | Неорганические соединения образуют ионные связи или металлические связи, хотя ковалентные связи также могут присутствовать. |
| Растворимость | В самых общих чертах органические соединения менее растворимы в воде. Обычно они растворимы в органических растворителях. | В самых общих чертах неорганические соединения растворимы в воде и менее растворимы в органических растворителях. |
| Точка плавления | В самых общих чертах органические соединения имеют низкие температуры плавления и кипения. | В самых общих чертах неорганические соединения имеют высокие температуры плавления и кипения. |
| Примеры | Углеводы, липиды, белки, нуклеиновые кислоты, органические растворители, метан… | Хлорид натрия (поваренная соль), графит, металлическое железо, сталь, стекло, диоксид углерода… |
И как вы, наверное, догадались, примеры для обоих типов обоих типов можно продолжать бесконечно.
Примеры органических соединений
Пора погрузиться в изучение органической химии! Это всего лишь некоторые природные и неприродные примеры органических соединений.
Углеводы
Они широко известны как сахара. Что касается функциональных групп, это альдегиды или кетоны, имеющие дополнительные гидроксильные группы. Углеводы – простой способ проиллюстрировать органические соединения, поскольку они представляют собой просто цепочки ковалентных связей C – C и C – H в сочетании с некоторыми из наиболее типичных органических функциональных групп (спиртов и карбонилов).Примерами углеводов являются глюкоза, фруктоза, сахароза и т. Д.
Белки
Белки состоят из цепочек аминокислот, соединенных вместе с образованием пептидов. Белки на самом деле являются полимерами, которые могут состоять из одной цепи из многих аминокислот или из нескольких цепей, которые упакованы вместе за счет нековалентных взаимодействий. Поскольку они состоят из аминокислот, они содержат атомы углерода, водорода, кислорода, а также атомы азота, которые удерживаются вместе ковалентными связями, а также нековалентными взаимодействиями.Классическим примером белков являются ферменты.
Органические растворители
Органические растворители – это органические соединения, которые обычно используются для растворения химикатов в лаборатории, в основном для проведения химических реакций. Они говорят: «Подобное растворяется в подобном», поэтому эти растворители необходимы для проведения органических реакций. Обычно это простые органические соединения, состоящие из углерода, водорода, а также кислорода или азота, иногда серы. Обычно они представляют собой жидкости при комнатной температуре и имеют температуру кипения от 40 ºC до 200 ºC.Обычными примерами являются гексан, циклогексан (CyH), ацетон, тетрагидрофуран (THF), толуол (PhMe), этанол (EtOH), метанол (MeOH), бензол (PhH), диметилсульфоксид (DMSO) или диметилформамид (DMF).
Любое органическое соединение, которое вы можете себе представить в лаборатории органической химии.
Единственным ограничением для органических соединений является воображение химика. Скорее всего, существует бесконечное количество комбинаций, в которых вы можете расположить атомы углерода и водорода для образования органических соединений.Не говоря уже о других элементах.
Случайный пример выдуманного, но вполне выполнимого органического соединения.Это то, что я сделал менее чем за 1 минуту в ChemDraw, и это кажется вполне разумным органическим соединением.
Примеры неорганических соединений
Готовитесь изучать область неорганической химии? Это всего лишь несколько распространенных примеров неорганических молекул.
NaCl – хлорид натрия или поваренная соль
Соль, которую вы используете для приготовления пищи, в основном хлорид натрия, NaCl, и это самый классический пример неорганического соединения.В частности, это ионное соединение, состоящее из равного количества катионов натрия (I) и анионов хлора, расположенных в симметричной трехмерной сети.
Двуокись углерода
Двуокись углерода – еще один пример неорганического соединения с химической формулой CO 2 . Несмотря на наличие атома углерода, CO 2 считается неорганическим соединением, поскольку наличие углеродных и ковалентных связей не делает соединение напрямую органическим. Вам потребуется облигация C – H или эквивалент.
Например, четыреххлористый углерод CCl4 считается органическим соединением, потому что вместо ковалентных связей C – H у него есть связи C – Cl, которые электронно эквивалентны. Модель связывания в двуокиси углерода, окиси углерода и других небольших неорганических соединениях совершенно иная.
Алмаз и графит
Аллотропы углерода, такие как графит, графен или алмаз, классифицируются как неорганические соединения, даже если они имеют
Пример металлоорганического соединения
Прямо среди органических и неорганических соединений мы можем найти металлоорганические соединения. соединения, которые характеризуются наличием связи углерод – металл (которая во многих случаях является «гибридом» между ковалентной и ионной связью).
Примером этого являются реактивы Гриньяра (такие как фенилмагнийбромид) или литийорганические соединения (такие как бутиллитий).
Подводя итоги
Надеюсь, нам удалось четко объяснить основные различия между органическими и неорганическими соединениями.
Органические соединения всегда содержат атомы углерода и почти всегда атомы водорода, и все они удерживаются вместе ковалентными силами.
Неорганические соединения – это все остальное!
Неорганическая химия – Американское химическое общество
Что такое неорганическая химия?
Неорганическая химия изучает свойства и поведение неорганических соединений, включая металлы, минералы и металлоорганические соединения.
В то время как органическая химия определяется как изучение углеродсодержащих соединений, неорганическая химия – это изучение оставшейся (то есть не содержащей углерод) подгруппы соединений. Но эти два поля могут частично совпадать. Например, металлоорганические соединения обычно содержат металл или металлоид, непосредственно связанный с углеродом.
Чем занимаются химики-неорганики?
Химики-неорганики работают в самых разных областях, от горнодобывающей промышленности до микрочипов. Их работа основана на понимании:
- Поведение и аналоги для неорганических элементов, и
- Как эти материалы могут быть изменены, отделены и использованы.
К конкретным работам могут относиться:
- Разработка методов извлечения металлов из потоков отходов
- Работает химиком-аналитиком по анализу добытых руд
- Проведение исследований по использованию неорганических химикатов для обработки почвы
Многие химики-неорганики работают в промышленности, но они также работают в академических учреждениях и государственных лабораториях. Химики-неорганики, работающие в правительстве, говорят, что их время все чаще тратится на написание заявок на гранты и борьбу за деньги на исследования.
Химики-неорганики сравнивают свою работу с работой материаловедов и физиков. Все сосредоточены на изучении взаимосвязи между физическими свойствами и функциями. Но химика-неорганика больше интересуют эти свойства на молекулярном уровне.
Где применяется неорганическая химия?
Неорганические соединения используются в качестве катализаторов, пигментов, покрытий, поверхностно-активных веществ, лекарств, топлива и т. Д. Они часто имеют высокие температуры плавления и особые свойства высокой или низкой электропроводности, что делает их полезными для определенных целей.Например:
- Аммиак является источником азота в удобрениях. Это одно из основных неорганических химикатов, используемых при производстве нейлона, волокон, пластмасс, полиуретанов, гидразина (используется в реактивном и ракетном топливе) и взрывчатых веществ.
- Хлор используется в производстве поливинилхлорида (используется для изготовления труб, одежды, мебели и т. Д.), Агрохимикатов (например, удобрений, инсектицидов или обработки почвы), фармацевтических препаратов и химикатов для очистки и стерилизации воды.
- Диоксид титана – это встречающийся в природе оксид титана, который используется в качестве белого порошкового пигмента в красках, покрытиях, пластмассах, бумаге, чернилах, волокнах, продуктах питания и косметике. он также обладает хорошими свойствами стойкости к ультрафиолетовому излучению, и растет спрос на его использование в фотокатализаторах.
Разница между органической и неорганической химией
Разница между органической и неорганической химией
В широком смысле химию можно классифицировать как раздел физической науки, который объясняет происхождение, структуру и поведение материи, а также переход материи из одной формы в другую.Неорганическая и органическая химия – это две разные области химии, которые зависят от природы соединений. Основное различие между органической и неорганической химией состоит в том, что неорганическая химия – это изучение неорганических соединений, тогда как органическая химия – это изучение органических соединений.
В этой статье объясняется,
1. Что такое неорганическая химия?
– Определение, реакции, структура, свойства
2. Что такое органическая химия?
– Определение, реакции, структура, свойства
3. В чем разница между неорганической и органической химией?
Что такое неорганическая химия
В общем, неорганические молекулы – это молекулы, не имеющие окончательной углеводородной (состоящей из атомов углерода и водорода) структуры. В основном они состоят из ионов, и эти ионы служат основой их химической активности. Ионы образуются, когда молекула или атом имеет меньше или больше электронов, чем их исходная электронная конфигурация.Однако ионы образуются для того, чтобы сделать атомы / молекулы более стабильными, придав им электронную конфигурацию благородного газа. Следовательно, когда атомы достигают электронной конфигурации благородного газа, они становятся либо положительно, либо отрицательно заряженными. Положительно заряженные частицы называются катионами, а отрицательно заряженные частицы – анионами. Катионы и анионы естественным образом притягиваются друг к другу через ионные взаимодействия, образуя самые прочные типы химических связей, называемые ионными связями.В целом все они относятся к неорганическим соединениям. Однако существует также большое количество соединений, связанных ковалентными связями, которые подпадают под категорию неорганических соединений. т.е. HCl, CO 2 , H 2 O
Основным типом неорганических реакций являются реакции замещения и окислительно-восстановительные реакции. Что происходит в случае реакций замещения, так это то, что катионы и анионы между двумя соединениями обмениваются в зависимости от их реакционного потенциала. С другой стороны, окислительно-восстановительные реакции происходят из-за окисления и восстановления.Таким образом, металлы и их формы имеют большое значение в неорганической химии, в том числе в области химии переходных металлов. Неорганические соединения обычно имеют более высокие температуры плавления. Другие методы, такие как перекристаллизация, электрохимия, рентгеновская кристаллография, кислотно-щелочная химия, химия pH, катализ и т. Д., Относятся к неорганической химии.
Структура ионного каркаса в оксиде калия
Что такое органическая химия
Помимо металлоорганических соединений (соединений, которые включают органическую структуру плюс металлы), между органической химией и неорганической химией очень мало общего.Как упоминалось выше, органические молекулы состоят из углеводородов. Следовательно, очень легко отличить органическое соединение от неорганического. До -го -го века считалось, что органические молекулы являются естественными и могут быть извлечены только из природы. Однако самый большой прорыв в органической химии произошел, когда Кекуле объяснил существование структуры бензола. Бензольное ядро стало неотъемлемой частью органической химии.
Классификация и реакции органических соединений зависят от их функциональных групп.Длина углеродной цепи просто определяет физические характеристики соединения. Органические соединения имеют свойство плавиться и кипеть, в отличие от неорганических соединений. Методы спектроскопии в основном используются для анализа органических соединений. Органическая химия широко используется в медицинской химии для открытия новых лекарств, химии питания, химии ароматизаторов и ароматизаторов, нефти и т. Д.
Шаровидная модель молекулы метана
Разница между органической и неорганической химией
Определение
Неорганическая химия занимается неорганическими соединениями, обычно имеющими ионное основание.
Органическая химия занимается органическими соединениями из углеводородов.
Реакция
Неорганическая химия включает кислотно-основные реакции, реакции замещения, окислительно-восстановительные реакции и т. Д.
Органическая химия включает реакции, которые зависят от функциональной группы, присутствующей в соединении.
Структура
Неорганическая химия в основном занимается солями и кристаллами.
Органическая химия занимается маслами, жирами, сахарами и т. Д.
Физические свойства
Неорганические молекулы имеют более высокие температуры плавления и разлагаются вместо кипения.
Органические молекулы плавятся и кипят.
Изображение предоставлено:
«Метан-CRC-MW-3D-шары» Бен Миллс – собственная работа (общественное достояние) через Commons Wikimedia
«Оксид калия-3D-vdW» (общественное достояние) через Commons Wikimedia
Важные различия между органическими и неорганическими соединениями 2021
Органические и неорганические соединения составляют одну из основных основ химии.Изучение органических соединений известно как органическая химия; изучение неорганических соединений известно как неорганическая химия. В этой статье мы собираемся обсудить различия между органическими и неорганическими соединениями, а также рассмотрим некоторые основные примеры обоих типов соединений.
Основное и наиболее важное различие между органическими и неорганическими соединениями состоит в том, что органические соединения всегда содержат атом углерода, в то время как большинство неорганических соединений нет. С другой стороны, почти все органические соединения содержат углерод-водородные или простые связи C-H.Тот факт, что чаще всего используется для различения органических и неорганических соединений, заключается в том, что органические соединения обычно являются результатом деятельности живого существа. Органические соединения, с другой стороны, в основном получаются в результате естественных процессов, которые не связаны ни с одной из форм жизни, обнаруженных на Земле, или с какими-либо результатами экспериментов человека, которые проводятся в лабораториях. Конечно, различия между неорганическими и органическими соединениями не ограничиваются наличием или отсутствием атома углерода.
Разница между органическими и неорганическими соединениями: органические соединения
Органическое соединение – это соединение, которое обычно содержит углерод, ковалентно связанный с другими атомами, особенно CC (углерод-углерод) и CH (углерод-водород) ), например, в углеводородах.
Химическое соединение – это любое вещество, состоящее из 2 или более элементов, которые связаны между собой химически. С другой стороны, элементы относятся к веществам, которые состоят только из одного типа атомов.Когда элементы связаны друг с другом с помощью химической связи, образуется соединение. Соединения можно разделить на органические или неорганические. В общем, органические соединения почти всегда содержат атом углерода, а неорганические соединения не содержат атом углерода.
Витализм
На протяжении многих веков население верило в преобладающее понятие витализма, то есть представление о том, что все живые существа обладают жизненной силой или жизненной силой – вис-виталисом. Эта сила отличает их от неживых существ.Считалось, что эта сила может производить определенные химические вещества, иначе эти химические вещества не образовались бы. Согласно верованию витализма, только живые организмы способны обладать жизненной силой, и поэтому они будут единственными, кто сможет создавать соединения.
Даже Луи Пастер считал, что брожение – это жизненная сила, на которую способны только живые элементы. Виталисты, поддерживающие теорию витализма, называли эти соединения органическими. Поэтому соединения, полученные в результате химического вмешательства, были названы неорганическими.Со временем витализм потерял поддержку, так как его обоснованность подвергалась все большему сомнению. В 1828 году Фридрих Велер обнаружил, что мочевину можно производить химически, используя неорганические соли сульфата аммония и цианата калия. Это полностью противоречило убеждениям виталистов, которые считали, что мочевина является органическим соединением, а живые организмы могут производить только эту мочу.
Неопределенность
Поэтому неудивительно узнать, что современное определение органических соединений больше не основывается на этом источнике.Сегодня определение органического соединения – это соединение, которое содержит атомы углерода, которые связаны с другими атомами ковалентной связью. Однако интересно отметить, что на сегодняшний день не существует единого абсолютного определения органического соединения. Если бы вы определили органическое соединение как соединение, содержащее атом углерода, оно также включало бы некоторые неорганические соединения.
Некоторые неорганические соединения содержат соединения, в том числе цианиды, карбонаты, тиоцианаты, карбиды, диоксид углерода и монооксид углерода.Другими исключениями являются алмаз, уголь и графит, известные как аллотропы углерода. Они состоят только из одного типа элементов, а именно углерода, и поэтому не могут быть классифицированы как органические соединения, поскольку они не являются соединением, а являются чистым элементом.
Органическое вещество
По сравнению с другими составляющими земной коры, органические соединения составляют лишь небольшой процент. Однако, независимо от этого, органические соединения, составляющие этот небольшой процент, имеют жизненно важное значение, поскольку все живые существа основаны на этих же соединениях.Примерами важных органических соединений являются липиды, углеводы, белки и нуклеиновые кислоты.
Живые существа состоят из соединений на основе углерода. Они могут быть разбиты на более простые соединения, когда они умирают в результате разложения. Живые организмы также выделяют или выделяют материалы, которые считаются органическими веществами или материалами. Органические вещества относятся к любым находящимся в природе соединениям на основе углерода. Таким образом, в экосистеме, например, в почвенной экосистеме, много органических веществ.Они перемещаются в основной поток воды или в почву, где служат источником питания для живых организмов.
Сравнение природных и синтетических органических соединений
Существует несколько способов классификации органических соединений; один из них основан на том, как они синтезируются. Простое природное соединение или природное органическое соединение производится естественным образом растениями или животными. С другой стороны, синтетическое соединение или синтетическое органическое соединение получают химическими реакциями или химическими манипуляциями.Природные соединения – это те органические соединения, которые можно получить из природных источников. Их также можно производить искусственно, хотя этот процесс делает продукт дорогим.
Некоторые из наиболее распространенных природных органических соединений:
- Сахара
- Гормоны
- Ферменты
- Липиды
- Жирные кислоты
- Антигены
- Нуклеиновые кислоты
- Нейротрансмиттеры
- Леминогенные кислоты Пептиды Пептиды
- Витамины
- Некоторые терпеноиды и алкалоиды
Синтетические соединения получаются, когда соединениям позволяют взаимодействовать друг с другом в химической реакции.Они могут иметь или не иметь аналог в природных соединениях. Многие полимеры, такие как каучуки и пластмассы, производятся синтетическим путем.
Маленькие органические молекулы по сравнению с большими органическими соединениями
В зависимости от размера или длины соединения органические соединения также могут быть классифицированы как маленькие или большие. Небольшая молекула – это небольшое органическое соединение с молекулярной массой менее 900 дальтон. Пример небольшой молекулы можно найти в фармацевтических препаратах.Маленькие молекулы не следует путать с биомолекулами, такими как нуклеиновые кислоты, белки, полисахариды, РНК и ДНК, поскольку это более крупные структуры. Органическое соединение, которое должно быть классифицировано как большое органическое соединение, должно быть представлено макромолекулой или полимером, содержащим множество повторяющихся субъединиц.
Неорганические соединения
По определению, неорганическое соединение – это соединение, в котором отсутствуют ковалентные связи углерод-водород (C-H) и углерод-углерод (C-C).База данных неорганических кристаллических структур, составленная Гюнтером Бергерхоффом и И.Д. Брауном в 1978 году, представляла собой базу данных неорганических кристаллических структур, определяющих неорганические углеродные соединения как соединения, содержащие либо связи C-C, либо связи C-H, но не то и другое вместе. Некоторые из наиболее распространенных соединений, которые считаются неорганическими:
- Карбонаты
- Цианаты
- Цианиды
- Карбиды
- Окись углерода
- Двуокись углерода
- Тиоцианты
Аллотропы углерода, такие как как алмазы, являются чистыми элементами углерода, а не соединениями; по этой причине они классифицируются как неорганические вещества, а не как неорганические соединения.
Типы неорганических соединений
Химическое соединение – это вещество, состоящее из ионов или атомов, или 2 или более элементов, которые химически связаны друг с другом. В отличие от этого, химические элементы представляют собой вещества только одного типа атомов. Большинство элементов являются неорганическими, но, поскольку они содержат только один тип атомов, они не являются технически неорганическими соединениями. По этой причине классификация неорганических соединений включает группировку веществ, которые содержат более одного типа атомов.С другой стороны, простые неорганические вещества, которые не обязательно являются соединениями, относятся к неметаллам или металлам. Однако следует отметить, что нет четкого различия между этими неметаллами и металлами.
Большинство неорганических соединений, по сути, являются ионными соединениями, это означает, что связь, удерживающая вместе атомы, является ионной химической связью. По этой причине ионные соединения можно классифицировать как соли, кислоты и основания. Ионная связь возникает, когда происходит полный перенос электронов от одного атома к другому.Это электростатическое притяжение, которое возникает между ионами, такими как анион и катион, которые заряжены противоположно. Примером этого может быть ионное соединение хлорида натрия. Здесь анион CL- и катион NA + удерживаются вместе ионной связью.
Когда ионное соединение содержит ионы водорода, оно классифицируется как кислота. Когда ионное соединение содержит оксид (O2-) или гидроксид (OH-), оно называется основанием. Когда ионное соединение образуется без этих ионов и с использованием кислотно-щелочной реакции, оно известно как соль.Без сомнения, вода – одно из самых важных неорганических соединений, если не самое важное. Вода состоит из двух атомов водорода и одного атома кислорода. Однако вода на самом деле представляет собой молекулу, удерживаемую ковалентной связью между кислородом и водородом, и поэтому технически не является ионным соединением.
Сравнение органических и неорганических соединенийВ приведенной ниже таблице показаны общие различия между неорганическими и органическими соединениями.
| Органические соединения | Неорганические соединения | |
| 1. | Наличие в них атомов углерода характеризует органические соединения | Большинство неорганических соединений не содержат атомов углерода, хотя есть некоторые исключения |
| 2. | Органические соединения, состоящие из водорода, углерода, кислорода и их производных | Они не содержат кислорода, водорода или их производных |
| 3. | Органические соединения считаются легковоспламеняющимися и более летучими | Эти соединения не являются нелетучими или негорючими |
| 4. | Эти соединения существуют в твердой, газовой и жидкой форме | Они существуют как в твердой, так и в жидкой форме |
| 5. | Органические соединения нерастворимы в воде. | Было обнаружено, что они растворимы в воде, а также не растворяются в некоторых органических растворах. |
| 6. | Эти соединения имеют связи CH (углерод, водород) | Они не содержат связей CH (углерод-водород) |
| 7. | Органические соединения обычно встречаются в большинстве живые существа | Эти соединения обычно содержатся в неживых существах |
| 8. | Органические соединения классифицируются по их способности образовывать ковалентные связи | Неорганические соединения способны образовывать ионные связи между атомами молекул |
| 9. | В большинстве водных растворов они плохо проводят электричество и тепло | В водных растворах они являются хорошими проводниками электричества и тепла |
| 10. | Примерами органических соединений являются жиры, сахара, нуклеиновые кислоты, ферменты, углеводородное топливо и белки. | Примеры неорганических соединений включают неметаллы, металлы, соли, основания, кислоты и вещества, состоящие из отдельных элементов. |
| 11. | Они имеют относительно низкие точки плавления и кипения | По сравнению с органическими соединениями они имеют низкие температуры плавления и кипения |
| 12 | Они являются биологическими и обычно более сложными по своей природе | Они минеральные, а также не очень сложные по природе |
| 13 | Органические соединения не могут образовывать соли | Неорганические соединения могут образовывать соли |
| 14 | Скорость реакции обычно считается равной медленные неорганические соединения | Неорганические соединения обычно имеют высокую скорость реакции |
https: // www.youtube.com/watch?v=0WAV47hsCpY
Со временем определение и представления об органических и неорганических соединениях изменились. Со времен виталистов был достигнут большой прогресс в идентификации органических и неорганических соединений и различий между ними. По-прежнему существует некоторая двусмысленность, и определения соединений и различия между ними все еще могут быть изменены. На сегодняшний день следует прежде всего отметить, что:
- Органических соединений гораздо больше, чем неорганических, потому что атом углерода обладает способностью соединяться с другими атомами углерода в цепочки, кольца и геометрические формы.На сегодняшний день человечеству известно более 10 миллионов различных органических соединений.
- Хотя есть некоторые исключения, органические соединения имеют гораздо более низкие температуры кипения и плавления, чем неорганические соединения. Исключения из этого правила обусловлены ковалентными связями, а не ионными.
- Как правило, органические соединения не так растворимы в воде, как неорганические соединения.
- Органические соединения, как известно, более летучие (горючие), но также известны как более слабые проводники электричества и тепла, чем их неорганические аналоги.
- Известно, что органические соединения реагируют медленнее, чем неорганические соединения, и дают более сложные наборы продуктов.
- Органические соединения обычно образуются в результате деятельности живых организмов, а неорганические соединения обычно образуются в лабораториях или в результате естественных процессов. Здесь следует отметить, что Велер нашел исключения из этих правил.
- Органические соединения не могут образовывать соли, как неорганические соединения, это может быть связано с ковалентностью углерода.
- Неорганические соединения содержат металл и другие элементы, а органические соединения всегда содержат углерод.
- Связи углерода с водородом характерны для органических соединений; эти связи, с другой стороны, не встречаются в неорганических соединениях.
- Неорганические соединения могут содержать атомы металлов; они не встречаются в органических соединениях.
- Органические соединения являются биологическими, а неорганические – минеральными.
- Органические соединения известны как ковалентные, а неорганические – как ионные, так и ковалентные.
- Органические соединения содержат сложные длинные цепочки молекул; это не относится к неорганическим соединениям.
- Неорганические соединения являются катализаторами, тогда как органические соединения можно рассматривать как источник энергии для живых существ
В чем разница между органической и неорганической химией?
Органические соединения содержат углерод, а неорганические – нет.
Все еще ищете помощь? Получите правильный ответ быстро.
ИЛИ
Найдите онлайн-репетитора сейчасВыберите эксперта и познакомьтесь онлайн. Никаких пакетов или подписок, платите только за необходимое время.
¢ € £ ¥ ‰ µ · • § ¶ SS ‹ › « » < > ≤ ≥ – – ¯ ‾ ¤ ¦ ¨ ¡ ¿ ˆ ˜ ° – ± ÷ ⁄ × ƒ ∫ ∑ ∞ √ ∼ ≅ ≈ ≠ ≡ ∈ ∉ ∋ ∏ ∧ ∨ ¬ ∩ ∪ ∂ ∀ ∃ ∅ ∇ * ∝ ∠ ´ ¸ ª º † ‡ А Á Â Ã Ä Å Æ Ç È É Ê Ë Я Я Я Я Ð Ñ Ò Ó Ô Õ Ö Ø Œ Š Ù Ú Û Ü Ý Ÿ Þ à á â ã ä å æ ç è é ê ë я я я я ð ñ ò ó ô х ö ø œ š ù ú û ü ý þ ÿ Α Β Γ Δ Ε Ζ Η Θ Ι Κ Λ Μ Ν Ξ Ο Π Ρ Σ Τ Υ Φ Χ Ψ Ω α β γ δ ε ζ η θ ι κ λ μ ν ξ ο π ρ ς σ τ υ φ χ ψ ω ℵ ϖ ℜ ϒ ℘ ℑ ← ↑ → ↓ ↔ ↵ ⇐ ⇑ ⇒ ⇓ ⇔ ∴ ⊂ ⊃ ⊄ ⊆ ⊇ ⊕ ⊗ ⊥ ⋅ ⌈ ⌉ ⌊ ⌋ 〈 〉 ◊ .


 История развития неорганической химии тесно связана с общей историей химии.… … Современная энциклопедия
История развития неорганической химии тесно связана с общей историей химии.… … Современная энциклопедия Словарь по аналитической химии [3] … Химические термины
Словарь по аналитической химии [3] … Химические термины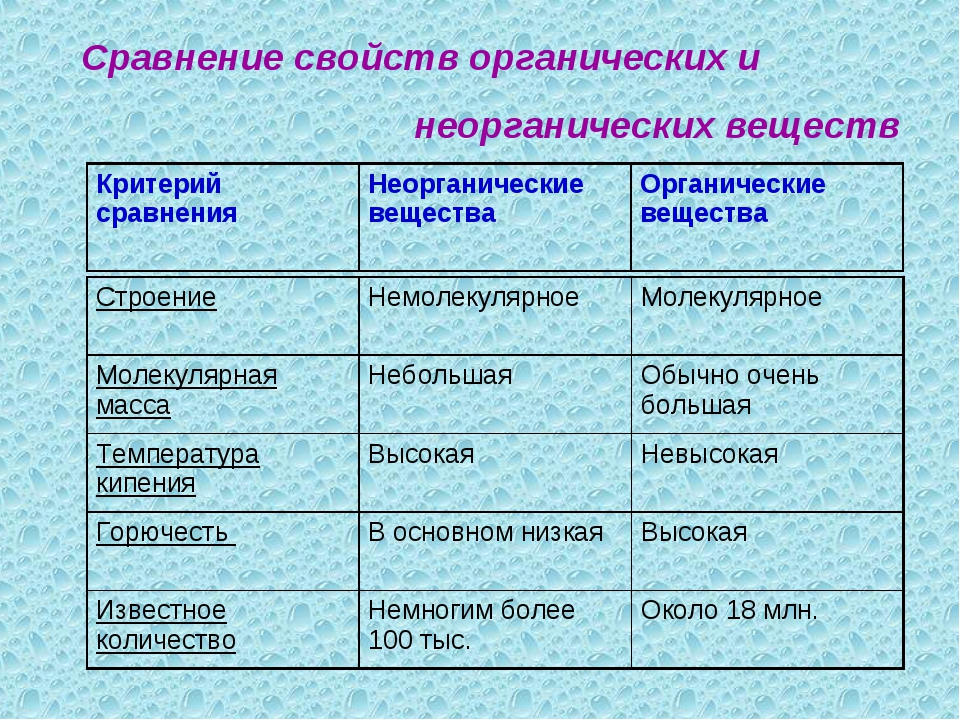 Алма-Ата, 1981.- 187 с.
Алма-Ата, 1981.- 187 с.