Тема 14. Теоретические основы органической химии.
Учебные вопросы
1. Органические соединения и их значение.
2. Основы теории строения органических соединений.
Понятие органических соединений и органической химии. Органические соединения (вещества) – это класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода, тиоцианатов и цианидов).
Органическую химию называют химией соединений углерода.
Критерий деления соединений на органические неорганические. Критерием деления соединений на органические неорганические служит их элементный состав. Но в любом случае, органическое соединение содержит углерод.
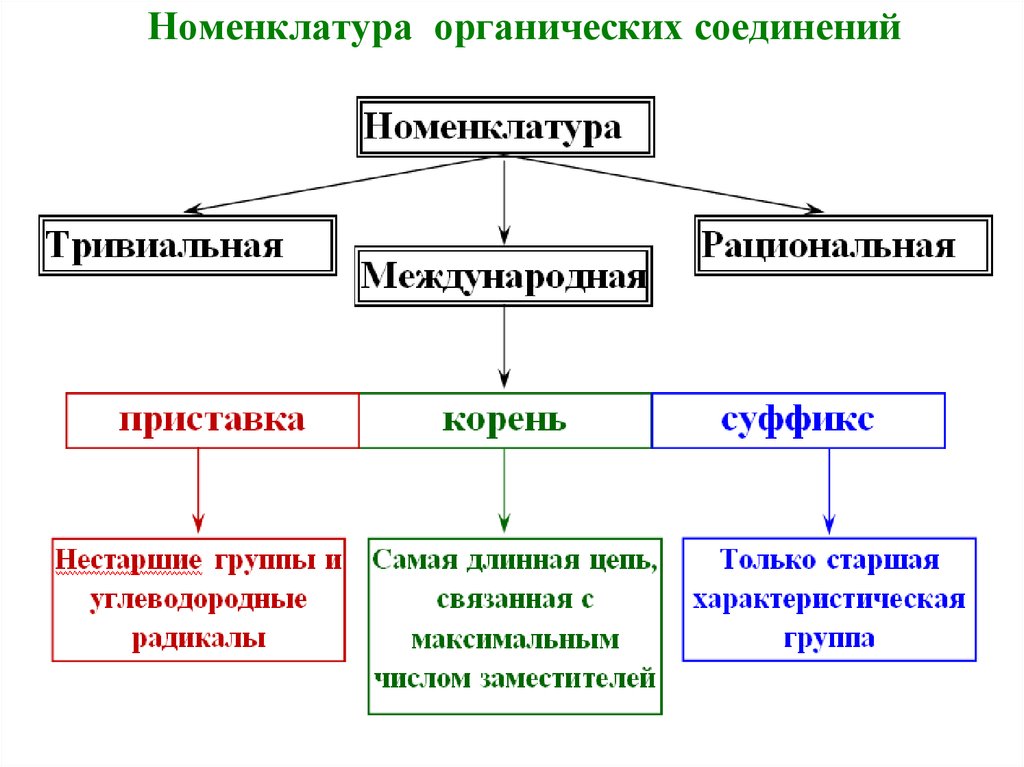
Классификация
органических
соединений по их составу.
Органические соединения подразделяют по
составу на: углеводороды,
кислородсодержащие органические
соединения и азотсодержащие органические
соединения.
Классификация органических соединений по их строению. Различаются: по типу скелета молекулы; по наличию (или отсутствию) в молекуле кратных связей и бензольных колец; по наличию (или отсутствию) функциональных групп.
Цепи и кольца органических соединений (веществ). Свойства углерода позволяют соединяться непосредственно друг с другом, образуя сколь угодно длинные цепи и кольца. Вещества, построенные на основе этих цепей или колец, называются органическими.
Понятие углеродного скелета. Улеродные цепи и кольца веществами, не являются: их называют углеродным скелетом. Этот скелет может «обрастать» любыми другими атомами, чаще всего водородом, кислородом, азотом, серой, галогенами и некоторыми металлами.
Химическая формула метана. Наиболее простые органические вещества содержат только углерод и водород: это углеводороды. Самый легкий углеводород, углеродный скелет которого состоит только из одного атома углерода, имеет формулу CН4
Это метан – бытовой
газ.
Классификация органических соединений в зависимости от углеродного скелета.
Ациклические соединения. Ациклические соединения – металлоорганические или соединения, не содержащие ароматических связей.
Две основные группы ациклических соединений. Различают две основные группы ациклических соединений: насыщенные (предельные) углеводороды и ненасыщенные (непредельные) углеводороды.
Циклические соединения. Циклические – это соединения, молекулы которых содержат один или несколько циклов, за исключением ароматических соединений.
Это соединения с замкнутой углеродной цепью.
Карбоциклические и гетероциклические органические соединения
Карбоциклические
содержат в структуре цикла только атомы
углерода.
Гетероциклические – помимо углерода содержат атомы других элементов (серу, кислород и т.д.).
Основные классы органических соединений биологического происхождения. Это: белки, липиды (жиры), углеводы, нуклеиновые кислоты.
Специфические особенности органических соединений. «Классические» органические соединения определяются содержанием в них прежде всего водорода, кислорода, азота и серы.
Значение органической химии. Органическая химия является химическим фундаментом биологической химии и молекулярной биологии – наук, изучающих процессы, происходящие в клетках организмов на молекулярном уровне.
Органическая химия. Основные положения. История развития науки
Невозможно отобразить презентацию
Похожие презентации:
Органическая химия
Органическая химия. История развития
Введение в органическую химию
Предмет органической химии
Предмет органической химии
Органическая химия.
Теоретические основы органической химии
Предмет органической химии
Теория химического строения органических соединений. (10 класс)
Ароматические углеводороды, строение, изомерия, номенклатура
Органическая химия.
Основные положения.
История развития науки Выполнил: Хаустов Юрий учащийся 10 кл.
МОУ Борисоглебская СОШ №1 2009-2010 уч.
год Цель работы: Получить основную информацию об органической химии и истории её развития.
Органическая химия Органическая химия — раздел химии, изучающий соединения углерода, их структуру, свойства, методы синтеза.
Органическими называют соединения углерода с другими элементами.
Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P.
Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения обусловливает многообразие органических соединений (к концу XX века их число превысило 10 млн. ).
).
Органические соединения играют ключевую роль в существовании живых организмов.
Органическая химия – химия углеводородов и их производных.
Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н (СН4, С4Н10).
Производные УВ – продукты замещения атомов «Н» в молекулах УВ на другие атомы или группы атомов.
Органическая вещества Природные (Нефть, белки, жиры, углеводы) Искусственные (Бензин, вескоза) Синтетические (Лекарства, витамины , пластмасса) Важнейшие характристики Примечания Многочисленность (около 27 млн.) а) гомология б) изомерия в) котенация В состав обязательно входят атомыHиC Все органические соединения горючи. Низкая температура плавления, соединения не прочны У большенства молекулярная кисталлическая решетка В большенстве неэлектролиты (в растворе в виде молекул) Реакции протикают медленно и чаще с участием катализатора Большая молекулярная масса Обра зуют гомологические ряды определение Образуют изомеры определение Большинство учаастники или продукты процессов протекающих живых организмах Гомологический ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — т.
н.
«гомологическую разность».
Чаще всего это метиленовые звенья: …—СН2—… Простейший пример гомологического ряда — низшие гомологи алканов (общая формула Сnh3n+2): метан Ch5, этан C2H6, пропан С3H8 и т.
д.
Гомологи – сходное строение и свойства, отличающиеся на одну или несколько СН2 Изомерия́ (от izos — равный и meros — доля, часть греч., ср.
изо-) — существование соединений (главным образом органических), одинаковых по элементному составу и молекулярной массе, но различных по физическим и химическим свойствам.
Такие соединения называются изомерами.
Изомеры – вещества, имеющие одинаковую молекулярную форму, но разное строение и свойства.
Египтяне и римляне использовали красители индиго и ализарин, содержащиеся в растительных веществах.
Многие народы знали секреты производства спиртных напитков и уксуса из сахар- и крахмалсодержащего сырья.
Как принято считать, органическая химия как наука появилась в 1828 году когда Фридрих Вёлер впервые получил органическое вещество — мочевину — в результате упаривания водного раствора цианата аммония (Nh5OCN).
Во времена средневековья к этим знаниям ничего не прибавилось, некоторый прогресс начался только в 16-17 в: были получены некоторые продукты, в основном путём перегонки некоторых растительных продуктов.
В 1769—1785 г.
Шееле выделил несколько органических кислот, таких как яблочная, винная, лимонная, галловая, молочная и щавелевая.
В 1773 г.
Руэль выделил из человеческой мочи мочевину.
Выделенные из животного или растительного сырья продукты имели между собой много общего, но отличались от неорганических соединений.
Так возник термин «Органическая химия» — раздел химии, изучающий вещества, выделенные из организмов (определение Берцелиуса, 1807 г.).
При этом полагали, что эти вещества могут быть получены только в живых организмах благодаря «жизненной силе».
Руэль Гийом Франсуа Как принято считать, органическая химия как наука появилась в 1828 году когда Фридрих Вёлер впервые получил органическое вещество — мочевину — в результате упаривания водного раствора цианата аммония (Nh5OCN).
Важным этапом стала разработка теории валентности Купером и Кекуле в 1857 г., а также теории химического строения Бутлеровым в 1861 г.
В основу этих теорий были положены четырёхвалентность углерода и его способность к образованию цепей.
В 1865 году Кекуле предложил структурную формулу бензола, что стало одним из важнейших открытий в органической химии.
В 1875 г.
Вант-Гофф и Ле Бель предложили тетраэдрическую модель атома углерода, по которой валентности углерода направлены к вершинам тетраэдра, если атом углерода поместить в центр этого тетраэдра.
В 1917 году Льюис предложил рассматривать химическую связь с помощью электронных пар.
Кекуле -> В 1931 г.
Хюккель применил квантовую теорию для объяснения свойств альтернантных ароматических углеродов, чем основал новое направление в органической химии — квантовую химию.
В 1933 г.
Ингольд провел изучение кинетики реакции замещения у насыщенного атома углерода, что привело к масштабному изучению кинетики большинства типов органических реакций.
Это углерод -> На заре органической химии предметом изучения были преимущественно субстанции биологического происхождения.
Именно этому факту органическая химия обязана своим названием.
Научно-технический прогресс не стоял на месте, и со временем основной материальной базой органической химии стала каменноугольная смола, выделяемая при получении кокса прокаливанием каменного угля.
Именно на основе переработки каменноугольной смолы в конце 19 века возник основной органический синтез.
В 50-60 годах прошлого века произошёл переход основного органического синтеза на новую базу — нефть.
Таким образом появилась новая область химии — нефтехимия.
Огромный потенциал, который был заложен в новом сырье вызвал бум в органической химии и химии вообще.
Появление и интенсивное развитие такой области как химии полимеров обязана прежде всего новой сырьевой базе.
Несмотря на то, что современная органическая химия в качестве материальной базы по прежнему использует сырье биологического происхождения и каменноугольную смолу, объем переработки этих видов химического сырья по сравнению с переработкой нефти мал.
Смена материально-сырьевой базы органической химии была вызвана прежде всего возможностями наращивания объёмов производства.
Органическая химия имеет исключительно важное научное и практическое значение.
Объектом её исследований в настоящее время являются более 20 млн.
соединений синтетического и природного происхождения.
Поэтому органическая химия стала
English Русский Правила
Основы органической химии
Изучая биологию, вы обнаружите, что в живых организмах постоянно происходят многие процессы. Изучение o органической химии , сосредоточенное на молекулах углерода, занимает центральное место во всех живых организмах.
Способность преобразовывать проглоченное топливо в полезную энергию — вот что отличает живой организм от мертвого. Поглощенное топливо содержит множество крупных молекул (макромолекул), которые расщепляются. Когда макромолекулы расщеплены на мельчайшие части, они могут проникать в клетки, содержащие больше макромолекул, которые участвуют в большем количестве процессов.
Поглощенное топливо содержит множество крупных молекул (макромолекул), которые расщепляются. Когда макромолекулы расщеплены на мельчайшие части, они могут проникать в клетки, содержащие больше макромолекул, которые участвуют в большем количестве процессов.
Что такое органическая химия?
В органической химии , основное внимание уделяется элементу углероду. Углерод занимает центральное место во всех живых организмах; однако тысячи неживых вещей (таких как лекарства, пластмассы и красители) сделаны из углеродных соединений. Алмазы представляют собой атомы углерода в кристаллической структуре. Алмазы такие твердые, потому что атомы углерода так тесно связаны друг с другом в кристаллической форме. Та же самая способность плотно упаковываться делает углерод отличным структурным элементом и в других его формах.
Один атом углерода может соединяться с четырьмя другими атомами. Поэтому органические соединения обычно имеют большие размеры и могут иметь несколько связанных вместе атомов и молекул. Органические молекулы могут быть большими, и они включают в себя структурные компоненты живых организмов: углеводы, белки, нуклеиновые кислоты и липиды.
Органические молекулы могут быть большими, и они включают в себя структурные компоненты живых организмов: углеводы, белки, нуклеиновые кислоты и липиды.
Карбоновый ключ
В своих внешних оболочках атомы углерода имеют четыре электрона, которые могут связываться с другими атомами. Когда углерод связан с водородом (что характерно для органических молекул), атом углерода делит электрон с водородом, а водород также делит электрон с углеродом. Молекулы углерод-водород обозначаются как углеводороды. Азот, сера и кислород также часто присоединяются к углероду в живых организмах.
Длинные углеродные цепи = низкая реакционная способность
Большие молекулы образуются, когда атомы углерода соединяются по прямой линии или в кольца. Чем длиннее углеродная цепь, тем менее химически реактивным является соединение. Однако в биологии используются другие меры реактивности. Одним из примеров является ферментативная активность, которая относится к тому, насколько быстрее определенная молекула может позволить протекать реакции.
Одним из ключей к тому, чтобы узнать, что соединение менее реакционноспособно, является высокая температура его плавления и кипения. Как правило, чем ниже температура плавления и кипения соединения, тем более оно реакционноспособно. Например, углеводород метан, который является основным компонентом природного газа, имеет только один атом углерода и четыре атома водорода. Поскольку это самое короткое углеродное соединение, у него самая низкая температура кипения (-162°C) и при комнатной температуре он представляет собой газ. Он очень реакционноспособен.
С другой стороны, соединение, состоящее из чрезвычайно длинной углеродной цепи, имеет температуру кипения 174°C (по сравнению с водой, температура кипения которой составляет 100°C). Поскольку для его кипения требуется гораздо больше времени, он гораздо менее реактивен и не является газообразным при комнатной температуре.
Формирование функциональных групп на основе свойств
В органической химии молекулы, обладающие схожими свойствами (будь то химические или физические свойства), группируются вместе. Причина, по которой они имеют схожие свойства, заключается в том, что они имеют схожие группы атомов; эти группы атомов называются функциональными группами .
Причина, по которой они имеют схожие свойства, заключается в том, что они имеют схожие группы атомов; эти группы атомов называются функциональными группами .
Химические свойства включают превращение одного вещества в другое в результате реакции. Примером химического свойства является способность газообразного хлора реагировать со взрывом при смешивании с натрием. Химическая реакция создает новое вещество, хлорид натрия (поваренная соль). Физические свойства относятся к разным формам вещества, но вещество остается одним и тем же; никакой химической реакции или превращения в новое вещество не происходит.
Некоторые из свойств, которые обеспечивают функциональные группы, включают полярность и кислотность. Например, функциональная группа, называемая карбоксилом (-COOH), представляет собой слабую кислоту. Полярность относится к тому, что один конец молекулы имеет заряд (полярный), а другой конец не имеет заряда (неполярный). Например, плазматическая мембрана имеет полярные гидрофильные головки снаружи, а гидрофобные хвосты (которые неполярны) образуют внутреннюю часть плазматической мембраны.
Основные понятия органической химии
Содержание
Основные факты и резюме основных понятий органической химии- Органическая химия изучает структуру, свойства, состав, углеродсодержащие соединения.
- Ковалентная связь — это химическая связь, которая включает совместное использование электронных пар между атомами.
- Модель Льюиса — это диаграммы, которые показывают связи между атомами молекулы и неподеленными парами электронов, которые могут существовать в молекуле.
- Молекулярная орбиталь (МО) может использоваться для представления областей в молекуле, где с большой вероятностью может находиться электрон, занимающий эту орбиталь.
- Резонансные структуры : когда для молекулы может быть записано более одной структуры Льюиса, одной структуры недостаточно для ее описания.
- Сопряженные системы : система, в которой электроны делокализованы в молекуле.

- Функциональные группы : часть структуры, которая контролирует реакционную способность всей молекулы и большую часть ее физических свойств.
Органическая химия – изучение строения, свойств, состава, реакций и получения углеродсодержащих соединений, к которым относятся не только углеводороды, но и соединения с любым количеством других элементов, в том числе водород, азот , кислород, галогены, фосфор, кремний и сера. Спектр применения органических соединений огромен и включает, помимо прочего, фармацевтику, нефтехимию, продукты питания, взрывчатые вещества, краски и косметику.
Ковалентная связь Ковалентная связь, также называемая молекулярной связью, представляет собой химическую связь, которая включает совместное использование электронных пар между атомами. Эти электронные пары известны как общие пары или связывающие пары. Стабильный баланс сил притяжения и отталкивания между атомами, когда они имеют общие электроны, известен как ковалентная связь. Ковалентные связи бывают трех типов: одинарные, двойные и тройные связи. Одинарная связь состоит из 2 связанных электронов. Естественно, двойная связь имеет 4 электрона, а тройная связь имеет 6 связанных электронов.
Ковалентные связи бывают трех типов: одинарные, двойные и тройные связи. Одинарная связь состоит из 2 связанных электронов. Естественно, двойная связь имеет 4 электрона, а тройная связь имеет 6 связанных электронов.
Полярная ковалентная связь — это процесс неравного распределения электронов. Это происходит из-за разных значений электроотрицательности двух атомов. Из-за этого более электроотрицательный атом будет притягивать и сильнее притягивать электроны. Таким образом, электроны будут проводить больше времени вокруг этого атома.
Модель Льюиса Структуры Льюиса представляют собой диаграммы, которые показывают связи между атомами молекулы и неподеленными парами электронов, которые могут существовать в молекуле. Структуру Льюиса можно изобразить для любой ковалентно связанной молекулы. Структуры Льюиса показывают каждый атом и его положение в структуре молекулы с помощью его химического символа. Между атомами, связанными друг с другом, проведены линии (вместо линий можно использовать пары точек). Избыточные электроны, образующие неподеленные пары, изображаются парами точек и располагаются рядом с атомами.
Между атомами, связанными друг с другом, проведены линии (вместо линий можно использовать пары точек). Избыточные электроны, образующие неподеленные пары, изображаются парами точек и располагаются рядом с атомами.
Модель Льюиса ограничивает элементы второго ряда (Li, Be, B, C, N, O, F, Ne) общим числом электронов 8 (общие и неразделенные). Это означает, что один атом углерода может соединяться с четырьмя другими атомами. Поэтому органические соединения обычно имеют большие размеры и могут иметь несколько связанных вместе атомов и молекул.
На своих внешних оболочках атомы углерода имеют четыре электрона, которые могут связываться с другими атомами. Когда углерод связан с водородом (что характерно для органических молекул), атом углерода делит электрон с водородом, а водород также делит электрон с углеродом. Молекулы углерод-водород называются углеводородами.
Резонанс Иногда для молекулы может быть записано более одной структуры Льюиса, особенно для тех, которые содержат несколько связей. Примером является озон (O 3 ). Структура озона требует, чтобы центральный кислород был одинаково связан с обоими концевыми атомами кислорода.
Примером является озон (O 3 ). Структура озона требует, чтобы центральный кислород был одинаково связан с обоими концевыми атомами кислорода.
Чтобы иметь дело с такими обстоятельствами, как связь в озоне, было разработано понятие резонанса между структурами Льюиса.
Согласно концепции резонанса, когда для молекулы может быть записано более одной структуры Льюиса, одной структуры недостаточно для ее описания. Скорее, истинная структура имеет электронное распределение, которое является «гибридом» всех возможных структур Льюиса, которые могут быть записаны для молекулы. В случае озона можно записать две эквивалентные структуры Льюиса. Мы используем двунаправленную стрелку для обозначения резонанса между этими двумя структурами Льюиса. Иногда это означает, что пара электронов равна делокализован, или разделен на несколько ядер.
Молекулярные орбитали Молекулярная орбиталь — это область пространства внутри молекулы, где существует высокая вероятность обнаружения определенной пары электронов. Молекулярная орбиталь (МО) может использоваться для обозначения областей в молекуле, где с большой вероятностью может находиться электрон, занимающий эту орбиталь. Молекулярные орбитали получаются из комбинации атомных орбиталей, которые предсказывают расположение электрона в атоме. Для метана молекулярная орбиталь называется sp 3 и имеет четырехгранную форму.
Молекулярная орбиталь (МО) может использоваться для обозначения областей в молекуле, где с большой вероятностью может находиться электрон, занимающий эту орбиталь. Молекулярные орбитали получаются из комбинации атомных орбиталей, которые предсказывают расположение электрона в атоме. Для метана молекулярная орбиталь называется sp 3 и имеет четырехгранную форму.
Наиболее сильным типом ковалентной химической связи являются сигма-связи (σ-связи). Пи-связи (π-связи) представляют собой ковалентные химические связи, в которых две доли орбитали одного атома перекрывают две доли орбитали другого атома. Каждая из этих атомных орбиталей имеет нулевую электронную плотность в общей узловой плоскости, проходящей через два связанных ядра. Эта же плоскость является также узловой плоскостью для молекулярной орбитали пи-связи.
σ-связь между двумя атомами: локализация электронной плотности
Две p-орбитали, образующие π-связь
Сопряженные системы.
В химии сопряженная система — это система делокализованных электронов в молекуле, которая в целом повышает стабильность молекулы. Обычно его представляют как имеющий чередующихся одинарных и множественных связей . Наиболее крупные сопряженные системы обнаружены в графене, графите, проводящих полимерах и углеродных нанотрубках 9.0053 .
Функциональные группы Когда углеродная цепь алкана модифицируется каким-либо образом, говорят, что она функционализирована. Другими словами, введена функциональная группа и создан новый класс органических веществ. Функциональная группа — это определенное расположение определенных атомов в органической молекуле, которая становится центром реакционной способности. То есть это часть структуры, которая контролирует реакционную способность всей молекулы и большую часть ее физических свойств. Вся система классификации функциональных групп основана на гибридизации атомов.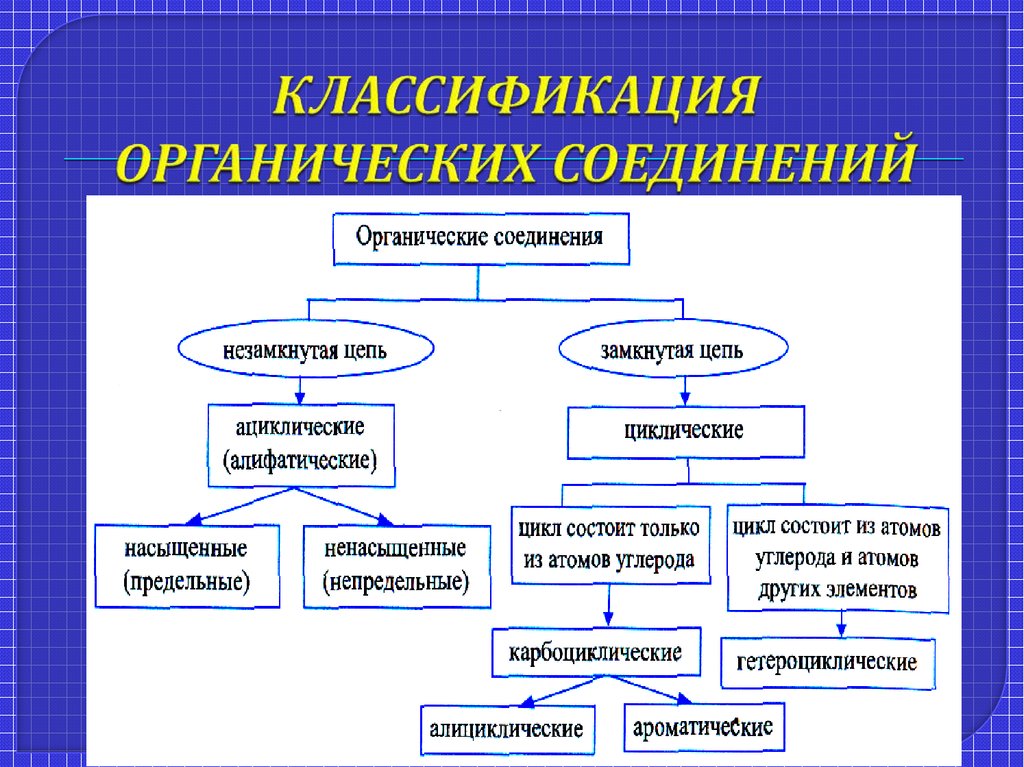
Изомер молекулы имеет одинаковое количество атомов каждого элемента, но имеет различное расположение атомов. Он имеет ту же молекулярную формулу, что и другая молекула, но с другой химической структурой. Изомеры не обязательно обладают сходными свойствами, если только они не имеют одинаковых функциональных групп. Существуют две основные формы изомерии: структурная изомерия (или конституционная изомерия) и стереоизомерия (или пространственная изомерия).
В стереоизомерах структура связи одинакова, но различается геометрическое расположение атомов и функциональных групп в пространстве. Этот класс включает энантиомеры, которые не являются зеркальными отражениями друг друга, и диастереомеры, которые не являются таковыми.
Узнайте больше об анализе органических соединений
Часто задаваемые вопросы
Что такое ковалентная связь и каковы ее виды?
Связь, образованная взаимным обменом электронами между атомами, образующими молекулу или соединение, называется ковалентной связью. Ковалентная связь бывает двух типов; полярная ковалентная связь и неполярная ковалентная связь. Э.Н. разница составляет менее 1,7 для ковалентных связей.
Ковалентная связь бывает двух типов; полярная ковалентная связь и неполярная ковалентная связь. Э.Н. разница составляет менее 1,7 для ковалентных связей.
Что лежит в основе модели Льюиса?
В основе модели Льюиса лежит наличие одной или нескольких неподеленных пар электронов на валентной оболочке атома, которые принимают участие в химической связи.
Является ли сигма-связь прочнее пи-связи?
Да. Сигма-связь прочнее, чем пи-связь, потому что лобовое перекрытие молекулярных орбиталей в сигма-связи сильнее, чем боковое перекрытие в пи-связи.
Что такое изомеры функциональных групп?
Соединения, имеющие одинаковую химическую формулу, но разные функциональные группы, известны как изомеры функциональных групп. Эти изомеры образуются за счет атомных перегруппировок в молекулярной структуре. Например, простые эфиры и спирты демонстрируют изомерию функциональных групп.
Ссылки и дополнительная литература: https://www.