Тема: « Основные сведения о строении атомов». | План-конспект урока по химии (8 класс):
Общие сведения
Фамилия, имя, отчество | Фетисова С. Е. |
Образовательное учреждение | ГБОУ лицей 369 Санкт-Петербург |
Стаж работы | 31 год |
Квалификационная категория | высшая |
Предмет | химия |
УМК | Габриелян О.С. |
Тема урока | Строение атома |
Класс | 8 |
Тип урока | Урок – предъявления и усвоения (изучения) нового учебного материала |
Тема: « Основные сведения о строении атомов».
Цель: формирование способности учащихся к новому способу действия при работе с периодической системой химических элементов; формирование основ умения прогнозировать свойства элементов, исходя из их положения в ПСХЭ и знаний о составе атома и атомного ядра, полученных в процессе работы с мультимедийными и дидактическими пособиями.
Учебные задачи, направленные на достижение личностных результатов обучения: Освоить новый способ синтеза на примере теоретического исследования; воспитывать у детей чувство коллективизма и ответственности перед товарищами за результаты собственной деятельности. Продолжить воспитание чувства патриотизма в ходе изучения структуры ПСХЭ русского учёного Д.И. Менделеева. Продолжить воспитание активной жизненной позиции каждого обучающегося, осуществляя индивидуальный подход к каждому члену коллектива.
Учебные задачи, направленные на достижение предметных результатов обучения: расширение понятийной базы за счет включения в нее новых элементов знаний: состав атома, состав атомного ядра, протон, электрон, нейтрон, относительная атомная масса, элементарные частицы, нуклоны, массовое число, электронная оболочка.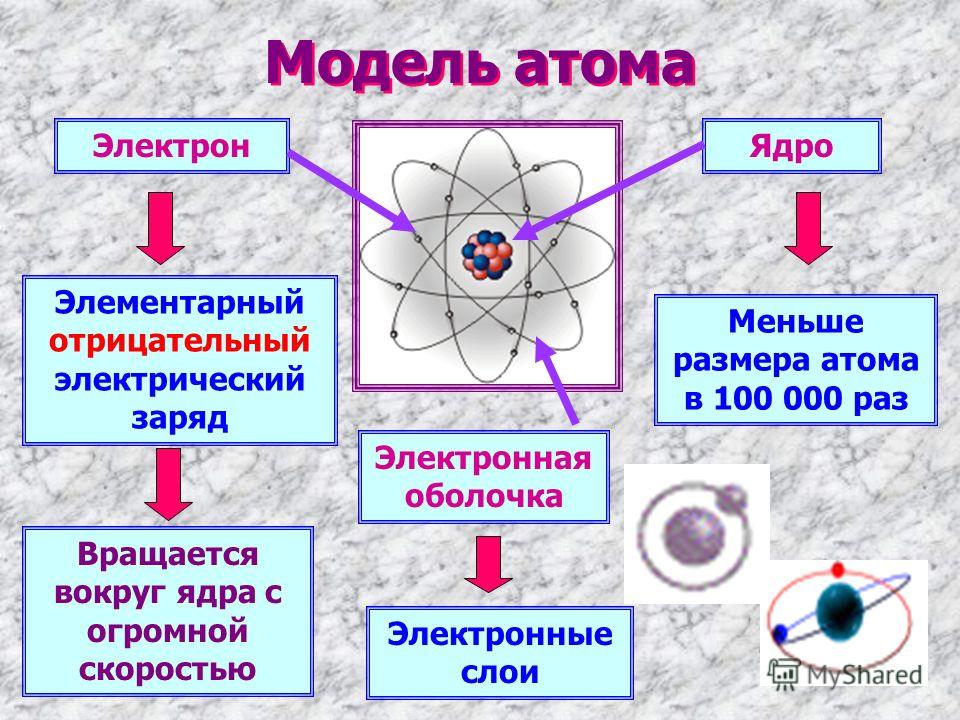
Учебные задачи, направленные на достижение метапредметных результатов обучения: Развивать умение сопоставлять новые научные данные с уже известной структурой Периодической системы, умение анализировать теоретические данные; находить взаимосвязи, прогнозировать и формулировать выводы. Развивать познавательный интерес и творческую активность в процессе изучения нового материала.
Оборудование урока: ПСХЭ Д.И. Менделеева, мультимедийный комплект, эбонитовая палочка, клочки бумаги, презентация в MicrosoftPowerPoint
Технологическая карта урока
№ п/п | Этапы урока | Деятельность учителя | Деятельность учащихся | Формируемые УУД |
1. | Мотивационно-ориентировочный – помогает определить проблему, план ее решения | Организует деятельность учащихся по актуализации знаний. Выполни задание (Приложение 1, слайд 2). Запишите формулы веществ, укажите, какое из этих веществ является простым, а какое сложным, вычислите относительные молекулярные массы, если известно, что в состав молекулы входят 2 атома фосфора и 5 атомов кислорода; 2 атома водорода. Дополните, пожалуйста, предложенную схему – цепочку, вставьте пропущенные слова (слайд 3-4).(Приложение № 5) Учитель организует дискуссию. На свете много великих тайн. Вот, например, яблоко. – Какая же это тайна? Съесть его и – все дела! – А если разрезать яблоко пополам, что тогда? – А если каждую из этих половинок – ещё раз пополам? – Правильно! Но сколько раз можно делить это яблоко? Есть ли предел делению его на части? Вот вам и великая тайна – делимость вещества. О чём же пойдёт речь сегодня на уроке? Возможно ли дальнейшее деление атома? Атом – это фундаментальное понятие, рассматриваемое не только в курсе химии, но и в курсе физики. Действительно ли можно разделить атом на более мелкие части? | Учащиеся выполняют задания на карточках (4 варианта) (Приложение № 4) Учащиеся вставляют пропущенные термины, вставляя заключительное слово АТОМ (Приложение № 5) Получатся две половинки яблока. – Яблоко разделится на 4 части. – А если ещё? – Получится 8 частей. Учащиеся вставляют пропущенные слова. Выдвигают гипотезу: атом можно разделить на более мелкие части. | умение организовать свою работу, распределить время; умение работать с различными формами заданий |
2. | Операционно-исполнительский – этап решения проблемы. | Учитель организует деятельность учащихся по осмыслению понятия АТОМ. Идеи атомного строения возникли ещё в античном мире. Ещё 2500 лет назад древнегреческий философ Демокрит полагал, что любой предмет состоит из мельчайших частиц – атомов. Само слово «атом», кстати, означает «неделимый». Так считали учёные вплоть до конца 19 века, когда было доказано, что атом делим, что он состоит из более мелких или элементарных частиц. Наш русский учёный М.ВЛомоносов считал, что существует два вида материи “элементы” (атом), “корпускулы” (молекулы). Атом, как и яблоко, можно разделить на части или на составляющие. -Что же входит в состав атома? – Что Вы знаете из курса физики по данному вопросу? Заглянем на страницы истории и проведём своё расследование. Выясним из чего же состоит атом. -Какую роль в атомах играют нейтроны? Учитель подводит итог дискуссии Проанализируйте данные таблицы (слайд 24 ) и определите черты сходства и различия элементарных частиц: протонов, нейтронов и электронов. Обсудим некоторые термины.
Строение всех атомов зашифровано в периодической системе химических элементов Д. И. Менделеева. Вы, знаете, что каждому химическому элементу присвоен порядковый номер и для каждого элемента подсчитана атомная масса. Но это не просто числа, они имеют физический смысл. Учитель организует деятельность учащихся по осмыслению понятия атом с учётом вновь приобретённых знаний. В чем он заключается, мы сейчас узнаем. Введем следующие обозначения( слайд 25) Z – порядковый номер химического элемента М – массовое число,М =Ar N – число нейтронов Z – указывает на заряд ядра, а следовательно на число протонов, а так как атом нейтрален, то число протонов равно числу электронов. М – сумма протонов и нейтронов в ядре атома М = Z + N Приведём пример( разбирается 2-3 примера). Na Z= 11, е- = 11, р+ = 11, n0= 23-11=12 Учитель оказывает помощь при формулировании выводов учащимися понятия атома. | Учащиеся включаются в активный поиск, исследование Учащиеся делают экспресс-сообщения, слушают, делают выводы, обобщают полученные сведения. (Приложение № 1) На сегодня известно, что в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны. Экспериментально доказано, что ядро состоит из протонов (положительных частиц) и нейтронов (нейтральных частиц) ( слайд 23) Нейтроны подобны ленивому человеку в доме. Он никому не доставляет неприятностей – просто смотрит телевизор. В доме ссорятся, спорят. Но он способен гасить очаг напряжения своей коронной фразой: «Замолчите сейчас же! Я смотрю телевизор». После этого в доме восстанавливается мир. Таким же образом нейтроны не позволяют ядру разваливаться на части. Протоны, отталкиваясь друг от друга, разделены нейтронами, что не дает ядру распасться. Учащиеся перечерчивают таблицу в тетради. (Приложение № 2) Учащиеся включаются в активный познавательный процесс. Учащиеся анализируют состав атомов химических элементов, ориентируясь на вновь приобретённые знания. Учащиеся делают выводы. ( слайд 26 – 27) 1.Атом- мельчайшая химически неделимая частица. 2.Атом-электронейтральная частица. 3.В центре атома находится положительно заряженное ядро, вокруг которого двигаются электроны. 4. Ядро состоит из протонов и нейтронов. Вся масса атома сосредоточена в его ядре. 5. Порядковый номер химического элемента численно равен заряду ядра атома и соответствует количеству протонов и электронов. 6. Чтобы найти количество нейтронов надо из массового числа вычесть порядковый номер химического элемента. | умение обобщать, анализировать, рассуждать умение работать с различными формами заданий, умение читать схемы, выстраивать логические цепочки Развитие умения устанавливать логические связи между причиной и следствием. Умение видеть главные аспекты, обобщать, резюмировать Умение переносить предметные знания на другие сферы деятельности человека Умение переносить предметные знания на другие сферы деятельности человека Развитие умения переводить информацию, записанную в виде текста в символы, и наоборот, умение анализировать количественное представление зависимости Развитие метапредметного навыка быстрой работы с математическими выражениями Развитие умения переводить информацию, записанную в виде символов в текстовую и словесную форму, умение анализировать количественное представление зависимости. |
3 | Рефлексивно-оценочный этап – предназначен для осмысления и оценки результатов проведенных исследований, оценки и самооценки учебной деятельности. | Учитель подводит итоги работы и организует деятельность учащихся по самоконтролю полученных знаний. Итак, подведём итоги урока
Учитель задаёт домашнее задание 4.Домашняя работа. § 6 Рассчитать число элементарных частиц для первых 20 элементов ПС. | Учащиеся заполняют таблицы с учётом новых знаний и проводят взаимопроверку (обмен тетрадями).Слайды 28,29). Учащиеся принимают активное участие в оценивании работы на уроке одноклассников и исправляют выявленные ошибки. | Умение делать вывод, кратко резюмировать Развитие умения развивать обратную логическую цепочку Умение выделять и осознавать уто, что уже усвоено и что еще подлежит усвоению, самооценивания качества и уровня усвоения материала. |
Основные сведения о строение атом
Тема: «Основные сведения о строение атом»
Цели урока:
обучающие:
сформировать знания о строении атома, познакомить с планетарной моделью атома по Резерфорду;
научить находить число протонов, нейтронов, электронов указанного атома.
развивающие:
научиться использовать периодическую систему для составления моделей строения атомов
расширение кругозора в области исторических знаний об изучении электрических зарядов;
развитие навыков выделять электрические явления в природе и технике.
продолжить работу по формированию умений составлять, анализировать, делать выводы.
воспитательные:
содействовать формированию мировоззренческой идеи познаваемости явлений и свойств окружающего мира.
Раздаточный материал: таблица Менделеева.
Тип урока: изучение и первичное закрепление новых знаний.
Ход урока
Организационный момент. (1-2 мин)
Проверка домашнего задания. (13-15 мин)
Изучение нового материала. (25 мин)
Закрепление, подведение итогов. (5 мин)
Организационный момент
– Здравствуйте, садитесь. Приготовьте учебники, тетради. Мы начинаем урок.
Проверка домашнего задания.
Вопрос: Что вы изучали на прошлом уроке?
Ответ: Изучали структуру Периодической таблицы, закономерности изменения свойств элементов и т. д….
д….
– Проверим, как вы усвоили этот материал.
а) Индивидуальное задание по карточкам:
Вариант 1.
Горизонтальные ряды химических элементов Периодической системы Д.И. Менделеева называются:
периоды
группы
подгруппы
строки
Главные подгруппы образуют элементы
больших периодов
малых периодов
малых и больших периодов
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Mg, Ca, Be
S, Cl, O
O, F, B
Выберите ряд элементов, в котором они расположены в порядке усиления металлических свойств
Li,Na, K
N, O, F
Al, Si, Mg
Установите соответствие между элементом и его положением в периодической системе.
Элемент | Положение элемента в таблице |
А)Al | 1) 2 период, 4 группа |
Б)F | 2) 2 период, 7 группа |
В) C | 3) 3 период, 3 группа |
Г)Li | 4) 3 период, 1 группа |
Вариант 2.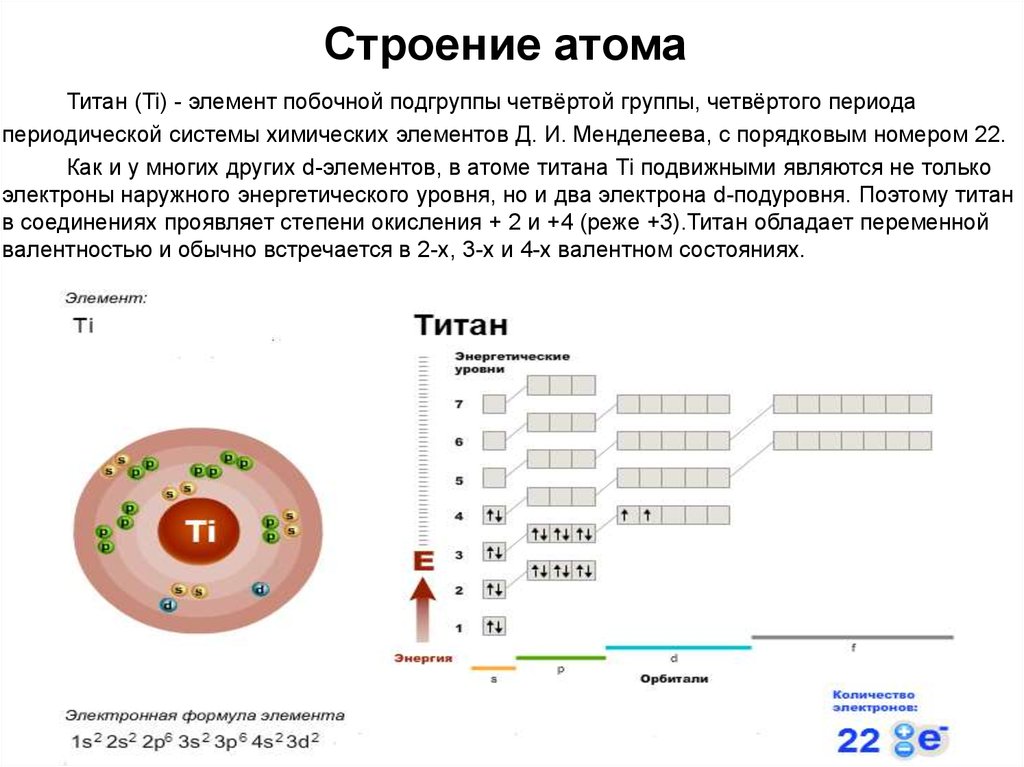
Всего в ПС насчитывается
10 периодов
7 периодов
6 периодов
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одной группе.
Mg, Ca, Be
S, Cl, O
O, F, B
Побочные подгруппы состоят из элементов
малых периодов
больших периодов
малых и больших периодов
Выберите ряд элементов, в котором они расположены в порядке усиления неметаллических свойств
B, Be, Li
N, O, F
Al, Si, Mg
5. Установите соответствие между элементом и его положением в периодической системе.
Элемент | Положение элемента в таблице |
А) C | 1) 6 период, 2 группа, главная подгруппа |
Б) Ba | 2) 2 период, 4 группа |
В) Cu | 3) 2 период, 6 группа |
Г) O | 4) 4 период, 1 группа, побочная подгруппа |
б) Фронтальный опрос:
Вопрос: Какую структуру имеет Периодическая система химических элементов Д. И. Менделеева?
И. Менделеева?
Ответ:Периодическая таблица Менделеева состоит из 8 групп и 7 периодов. Горизонтальные ряды называются периодами. Различают малые и большие периоды. Вертикальные столбцы таблицы называют группами. Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. При этом группа разделяется на главные и побочные подгруппы.
Молодцы!
Вопрос:Какие свойства характерны для элементов, объединенных в одну группу?
Ответ:1. Высшая валентность с соединением с кислородом (за некоторыми исключениями) соответствует номеру группы.
2. В главных подгруппах сверху вниз с увеличением относительных атомных масс усиливаются металлические свойства и ослабевают неметаллические свойства.
– Таким образом, по положению химического элемента в Периодической таблице, мы можем предсказывать его свойства.
Изучение нового материала.
Появление Периодической системы и открытие периодического закона открыло новую научную эру в истории химии и ряде смежных наук – взамен разрозненных сведений об элементах и соединениях Д.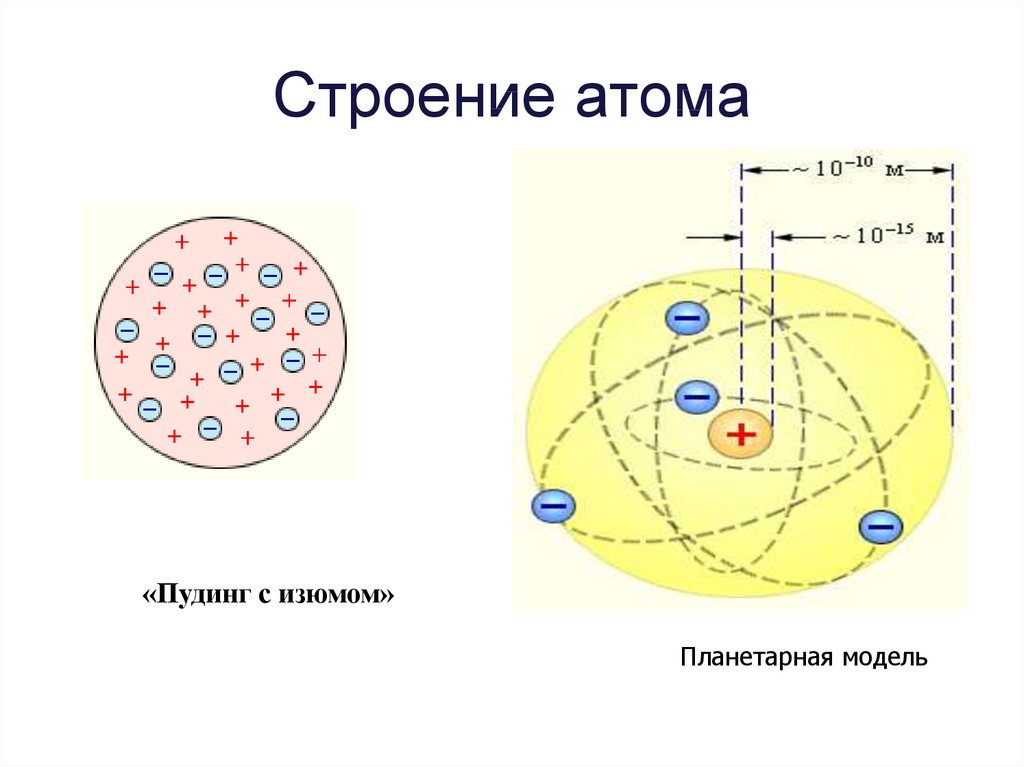 И. Менделеевым и его последователями создана стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
И. Менделеевым и его последователями создана стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Вопрос:Полное название таблицы – Периодическая система (или таблица) химических элементов Д.И.Менделеева. Что же называется химическим элементом?
Ответ:Химический элемент- это вид атома.
Сегодня мы с вами поговорим ещё об одном не менее важном открытии в истории химии – о строении атома. На всех прошедших уроках вы встречались с этим понятием.
Вопрос:Что вы знаете об атоме?
Ответ:(учащиеся предлагают, учитель записывает на доске)
– мельчайшая частица химического элемента,
– бывают разного вида,
– образуют химический элемент,
– бывают различного размера,
– бывают различной массы,
– относительная атомная масса указана в ПТ,
– масса может быть выражена в кг, г и атомных единицах массы,
– в переводе с греческого означает «неделимый».
– Да, в переводе с греческого атом означает «неделимый».До конца XIX в. атом действительно считали неделимой частицей. Насколько правильно это утверждение, мы узнаем сегодня.
Тема урока: (учитель записывает на доске, ученики – в тетрадь «Строение атома».
–Сегодня на уроке мы ещё раз постараемся доказать, что именно строение атома является главной характеристикой элемента и вспомним, как определять число протонов, нейтронов, электронов в атоме любого химического элемента.
Вопрос: В каких формах может существовать любой химический элемент? Ответ: Свободные атомы, простые вещества и сложные вещества.
–Понятие «атом» возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый». До конца XIX в. атом действительно считали неделимой частицей, но последовавшие позже открытия (радиоактивность, фотоэффект) изменили это убеждение.
Вопрос: В физике, вы уже знакомились с таким явлением, как радиоактивность, что же это такое?
Ответ:Радиоактивность – это самопроизвольный распад ядер атомов с испусканием элементарных частиц.
– Тогда уже возникли сомнения, а такой ли уж неделимый атом? Сейчас известно, что атом состоит из элементарных частиц.
Вопрос: Физике вы наверняка уже знакомились с ними, какие это частицы? Ответ: Протоны, нейтроны, электроны.
– Радиоактивность была обнаружена в 1896 году французским ученым А. Беккерелем. Он установил, что элемент уран излучает лучи, подобно рентгеновским. Изучением радиоактивности занимались ученые Мария Склодовская-Кюри и Пьер Кюри, которые наблюдали радиоактивность у элементов радия и полония. Оказалось, что радиоактивное излучение неоднородно и состоит из альфа- лучей, бета-лучей и гамма- лучей. Как показали дальнейшие исследования, альфа- лучи представляют собой поток частиц с массой 4 и зарядом +2 (ядра атома Не), бета- лучи – поток электронов, гамма- лучи подобны рентгеновским.
Вопрос:Учитывая явление радиоактивности, скажите, какие частицы входят в состав атомов?
Ответ: В состав атомов входят положительно заряженные частицы и отрицательно заряженные электроны.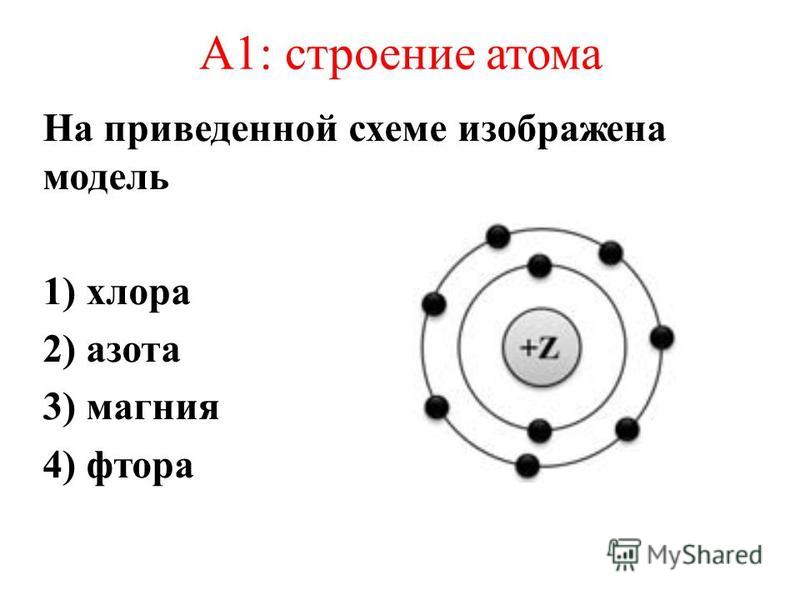
Вопрос: Вспомните из физики, из каких элементарных частиц состоит атом?
Ответ:Атом состоит из протонов, нейтронов, электронов.
– Первые попытки создать модель атома в 1903 году принадлежит Дж. Томсону.
Он предложил свою модель строения атома, которая получила условное название«пудинг с изюмом». Согласно этой модели, атом представляет собой некую субстанцию, в которой равномерно распределены протоны, нейтроны и электроны. Число протонов равно числу электронов, поэтому атом в целом электронейтрален.
В 1913 г. Резерфорд предложил свою модель строения атома, получившую название планетарной.
Модель Резерфорда опирается на экспериментальных данных.
Он проводил опыты по рассеянию альфа-частиц, облучал положительно заряженными альфа-частицами золотую фольгу. Большинство альфа-частиц пролетало сквозь фольгу, как будто ее и не было, однако некоторые изменяли свой путь и даже отскакивали назад.
Вопрос:Какие частицы могли изменить траекторию движения положительно заряженных, тяжелых альфа-частиц?
Ответ:Траекторию движения положительно заряженных альфа –частиц могли изменить положительно заряженные, тяжелые частицы, так как одноименные заряды отталкиваются.
Вопрос: Какие размеры были у частиц золотой фольги, если большинство альфа-частиц пролетало сквозь фольгу.
Ответ:Размеры были маленькие.
– Таким образом, альфа-частицы при движении через золотую фольгу сталкивались с положительно заряженными, тяжелыми частицами, имеющими малые размеры.
Резерфорд заключил, что большая часть массы атома заключена в центре, которое он назвал ядром. Расчеты показали, что радиус ядра в 100 тысяч раз меньше радиуса всего атома. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро – футбольному мячу, находящемуся в центре поля.
Согласно модели атома Резерфорда, атом состоит из ядра, в котором сконцентрирована основная масса атома, поскольку ядро содержит протоны и нейтроны; вокруг ядра на огромной скорости вращаются электроны.
Атом любого химического элемента – как бы крохотная Солнечная система.
Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной.
Вопрос:Какое строение имеет атом?
Ответ:В атоме есть положительно заряженное ядро. Ядро состоит из элементарных частиц- протонов и нейтронов. Вокруг ядра вращаются электроны.
– Из курса химии вы уже знаете одно определение атома как мельчайшей, химически неделимой частицы. Теперь можно дать еще одно, физическое, определение этого понятия. Давайте запишем его тетрадь (Учащиеся записывают под диктовку определение в тетрадь).
Атом–электронейтральная частица, состоящая из положительно за-
ряженного ядра и отрицательно заряженных электронов. Заряд ядра совпадает с порядковым номером химического элемента в Периодической таблице Д.И. Менделеева, который равен числу протонов.
Позже было установлено, что ядро атома также имеет сложное строение. Оно состоит из частиц двух типов: протонов и нейтронов.
Протон и нейтрон имеют практически одинаковую массу, равную примерно 1 u, т. е. одной атомной единице массы. Протон (его символ р) имеет относительный заряд 1+, а нейтрон (символ n) электронейтрален.
Протон (его символ р) имеет относительный заряд 1+, а нейтрон (символ n) электронейтрален.
Относительный заряд электрона (его символическое обозначение е−) равен 1–, а масса примерно в 1840 раз меньше массы протона, т. е. равна
1/1840u. (Основные обозначения и значения записываются на доске).
Сумма протонов и нейтронов составляет массу атома. Количество протонов и электронов элемента можно определить по егопорядковому номеру в Периодической системе Д.И. Менделеева.
К примеру, Ве. Число его протонов равно порядковому номеру, т. е. 4.
Вопрос: Чему равно число протонов элементовNa,O,F? (Ответы учащихся фиксируются на доске)
Ответ:– Число протоновNa=11
– Число протонов О=8
– Число протонов F=9
– Порядковый номер элемента, заряд ядра атома и число протонов в ядре обозначают буквой Z, а число нейтронов – буквой N.
Суммарное число протонов и нейтронов называют массовым числом атома и обозначают буквой А:
А = Z + N
Массовое число атома А приблизительно равно (округлённо) относительной атомной массе Аr. К примеру, атомная масса Cl=35.
К примеру, атомная масса Cl=35.
Вопрос: Как определить число нейтронов в ядре?
Ответ: Число нейтронов в ядре равно разности между массовым числом элемента А и его атомным номером Z.
Вопрос: Чему равна атомная масса Mg,N,Li? (Ответы учащихся фиксируются на доске)
Ответ:-Атомная масса Mg=24
– Атомная масса N=14
– Атомная масса Li=7
Следовательно, число нейтронов в ядре равно разности между массовым числом элемента А и его атомным номером Z.
N = A – Z
Итак, возьмем, к примеру, Li. Его атомная масса (А) равна 7, а количество протонов (Z) равно 3, получаем: N=7-3,N=4.
Давайте вместе рассчитаем количество нейтронов элементов: Zn,S,Mg.(Ответы учащихся фиксируются на доске)
Ответ:– N (Zn)=65-30,N=35
-N(S)=32-16,N=16
-N(Mg)=24-12,N=12
– Число электронов в атоме равно числу протонов в ядре.
Положение химического элемента в таблице Д.И. Менделеева зависит от величины заряда атома, т.е. от числа протонов в нем. Если изменить число протонов в ядре, то это будет уже другой химический элемент.
Если, не изменяя число протонов в атоме химического элемента, т.е. заряд ядра, изменить число нейтронов, то положение химического элемента не изменится. Это будет все тот же химический элемент, но атомы его будут отличаться от исходной своей массы.
– Атомы одного и того же химического элемента могут иметь разные массы. Существуют атомы водорода с массами 1, 2 и 3, атомы хлора с массами 35 и 37 и т. д.
Вопрос:В физике вы уже знакомились с таким понятие, как «изотоп», что же это такое?
Ответ:Изотопы – разновидности атомов одного химического элемента, имеющие разные атомные массы.
– Слово «изотоп» состоит из двух греческих слов: изос – «одинаковый» и топос – «место», обозначает «занимающий одно место» (клетку) в таблице Д.И. Менделеева.
Теперь,с учётом знаний о строении ядра, это определение можно сформулировать по-другому. Давайте запишем его в тетрадь. (Учащиеся записывают определение)
Давайте запишем его в тетрадь. (Учащиеся записывают определение)
Изотопы – разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов.
Теперь мы можем понять, почему атомные массы большинства элементов, приведенных в таблице Д.И. Менделеева, дробные. Относительная атомная масса элемента как совокупность изотопов выражается дробным числом, потому что рассчитывается с учетом доли каждого изотопа в природной смеси.
Теперь понятно и то, почему в некоторых случаях у элементов с большим порядковым номером атомной массы меньше, чем у элементов с меньшим порядковым номером. Это зависит от того, какие изотопы, тяжёлые или лёгкие, преобладают в данном элементе.
Закрепление, подведение итогов
Итак, подведем итог: Что вы сегодня узнали на уроке?
Ответ: Электроны, протоны, и нейтроны являются микрочастицами, из которых состоит атом.
Изучение строения атома позволило нам дать новое определение (в современной интерпретации) понятия «атом».
Вопрос: Что же такое атом, как вы поняли?
Ответ: Атом – это электронейтральная и химически неделимая частица, состоящая из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Так, хорошо. Положительный заряд ядра является главной характеристикой атома. Он определяет строение атома, число электронов, движущихся вокруг ядра, и служит отличительным признаком различных видов атомов.
Вопрос: На что указывает порядковый номер элемента в Периодической системе?
Ответ: Порядковый номер элемента на заряд ядра, число протонов в ядре и число электронов, содержащихся в атоме. Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме.
Итак,мы знаем, что масса атома определяется массой ядра. Ядро состоит из протонов и нейтронов, относительные массы которых равны 1. Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Вопрос: Так же массовые числа атомов одного и того же элемента могут различаться. Что это за элементы?
Ответ:Изотопы — разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов.
Домашнее задание:
§52 учебника, вопросы 1-3 + тестовое задание
Для закрепления материала выполните тесты
1. Заряд ядра атома азота равен:
а) 7 б) 13 в) 4 г) 29 д) 11
Число протонов в ядре атома криптона:
а)36 б) 17 в) 4 г) 31 д) 6
Число нейтронов в ядре атома цинка:
а) 8 б) 35 в)11 г)30 д)4
Число электронов в атоме железа:
а) 11 б)8 в)56 г)26 д)30
Найдите ряд, в котором верно указаны число протонов в атомах химических элементов Аl, Si, P и заряды ядра:
а) 27, 28, 31;
б) +13, +14, +15;
в) 13, 14,15.
Структура атома – Введение в химию
ЛюменОбучение
Обзор атомной структуры
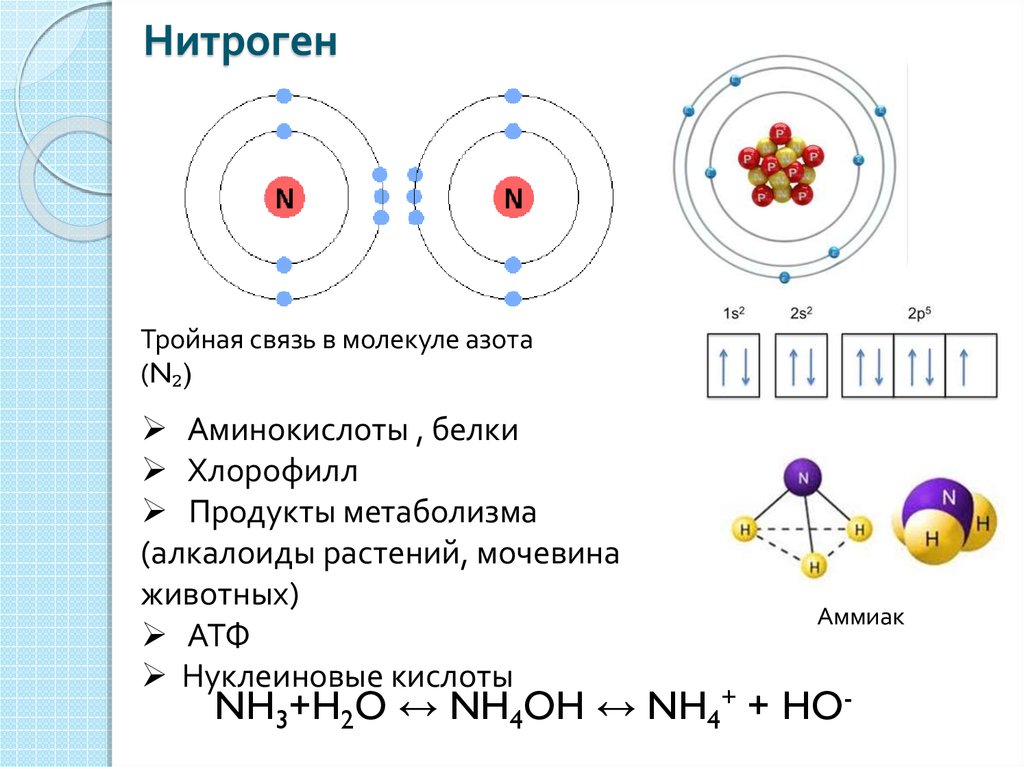
Атомы состоят из частиц, называемых протонами, нейтронами и электронами, которые отвечают за массу и заряд атомов.
ЦЕЛИ ОБУЧЕНИЯ
Обсудить электронные и структурные свойства атома
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые моменты
- Атом состоит из двух областей: ядра, которое находится в центре атома и содержит протоны и нейтроны, и внешней области атома, которая удерживает электроны на орбите вокруг ядро.
- Протоны и нейтроны имеют примерно одинаковую массу, примерно 1,67 × 10 -24 грамм, которую ученые определяют как одну атомную единицу массы (а.е.м.) или один дальтон.
- Каждый электрон имеет отрицательный заряд (-1), равный положительному заряду протона (+1).
- Нейтроны — это незаряженные частицы, находящиеся внутри ядра.
Ключевые термины
- : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, состоящий из ядра, окруженного электронами.

- : Положительно заряженная субатомная частица, входящая в состав ядра атома и определяющая атомный номер элемента. Он весит 1 а.е.м.
- : Субатомная частица, входящая в состав ядра атома. У него нет заряда. По массе он равен протону или весит 1 а.е.м.
Атом — наименьшая единица вещества, сохраняющая все химические свойства элемента. Атомы объединяются, образуя молекулы, которые затем взаимодействуют, образуя твердые тела, газы или жидкости. Например, вода состоит из атомов водорода и кислорода, которые, объединившись, образуют молекулы воды. Многие биологические процессы посвящены повторной сборке молекул в другие, более полезные молекулы.
Атомные частицы
Атомы состоят из трех основных частиц: протонов, электронов и нейтронов. Ядро (центр) атома содержит протоны (положительно заряженные) и нейтроны (без заряда). Самые внешние области атома называются электронными оболочками и содержат электроны (отрицательно заряженные). Атомы обладают различными свойствами в зависимости от расположения и количества их основных частиц.
Атомы обладают различными свойствами в зависимости от расположения и количества их основных частиц.
Атомная масса
Протоны и нейтроны имеют примерно одинаковую массу, примерно 1,67×10 -24 грамм. Ученые определяют это количество массы как одну атомную единицу массы (аму) или один дальтон. Несмотря на то, что протоны имеют одинаковую массу, они заряжены положительно, а нейтроны заряда не имеют. Следовательно, количество нейтронов в атоме вносит значительный вклад в его массу, но не в его заряд.
Электроны намного меньше по массе, чем протоны, и весят всего 9,11 × 10 -28 грамм, или около 1/1800 атомной единицы массы. Следовательно, они не вносят большого вклада в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и вычислять массу атома, основываясь только на числе протонов и нейтронов.
Следовательно, они не вносят большого вклада в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и вычислять массу атома, основываясь только на числе протонов и нейтронов.
Электроны вносят большой вклад в заряд атома, поскольку каждый электрон имеет отрицательный заряд, равный положительному заряду протона. Ученые определяют эти заряды как «+1» и «-1». В незаряженном нейтральном атоме число электронов, вращающихся вокруг ядра, равно числу протонов внутри ядра. В этих атомах положительные и отрицательные заряды компенсируют друг друга, что приводит к атому без суммарного заряда.
Изучение свойств электронов: сравните поведение электронов с поведением других заряженных частиц, чтобы узнать свойства электронов, такие как заряд и масса.

Объем атомов
С учетом размеров протонов, нейтронов и электронов большая часть объема атома — более 99 процентов — это, по сути, пустое место. Несмотря на все это пустое пространство, твердые объекты не просто проходят друг через друга. Электроны, окружающие все атомы, заряжены отрицательно и заставляют атомы отталкиваться друг от друга, не позволяя атомам занимать одно и то же пространство. Эти межмолекулярные силы не позволяют вам провалиться сквозь такой объект, как ваш стул.
Атомный номер и массовое число
Атомный номер — это количество протонов в элементе, а массовое число — это количество протонов плюс количество нейтронов.
ЦЕЛИ ОБУЧЕНИЯ
Определить соотношение между массовым числом атома, его атомным номером, его атомной массой и числом субатомных частиц
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые моменты
- Нейтральные атомы каждого элемента содержат равное количество протонов и электронов.
- Число протонов определяет атомный номер элемента и используется для отличия одного элемента от другого.

- Количество нейтронов изменчиво, в результате чего изотопы, которые представляют собой разные формы одного и того же атома, различаются только количеством нейтронов, которыми они обладают.
- Вместе количество протонов и количество нейтронов определяют массовое число элемента.
- Поскольку изотопы элемента имеют немного разные массовые числа, атомная масса рассчитывается путем получения среднего значения массовых чисел для его изотопов.
Ключевые термины
- : Сумма числа протонов и числа нейтронов в атоме.
- : Количество протонов в атоме.
Атомный номер
Нейтральные атомы элемента содержат равное количество протонов и электронов. Количество протонов определяет атомный номер элемента (Z) и отличает один элемент от другого. Например, атомный номер углерода (Z) равен 6, потому что у него 6 протонов. Количество нейтронов может варьироваться для получения изотопов, которые представляют собой атомы одного и того же элемента, имеющие разное количество нейтронов. Количество электронов также может быть разным в атомах одного и того же элемента, что приводит к образованию ионов (заряженных атомов). Например, железо Fe может существовать в нейтральном состоянии или в ионных состояниях +2 и +3.
Количество нейтронов может варьироваться для получения изотопов, которые представляют собой атомы одного и того же элемента, имеющие разное количество нейтронов. Количество электронов также может быть разным в атомах одного и того же элемента, что приводит к образованию ионов (заряженных атомов). Например, железо Fe может существовать в нейтральном состоянии или в ионных состояниях +2 и +3.
Массовый номер
Массовое число элемента (А) представляет собой сумму числа протонов и числа нейтронов. Небольшой вклад массы от электронов не учитывается при вычислении массового числа. Это приближение массы можно использовать, чтобы легко вычислить, сколько нейтронов имеет элемент, просто вычитая количество протонов из массового числа. Протоны и нейтроны весят примерно одну атомную единицу массы (а.е.м.). Изотопы одного и того же элемента будут иметь одинаковый атомный номер, но разные массовые числа.
У углерода атомный номер шесть и два стабильных изотопа с массовыми числами двенадцать и тринадцать соответственно.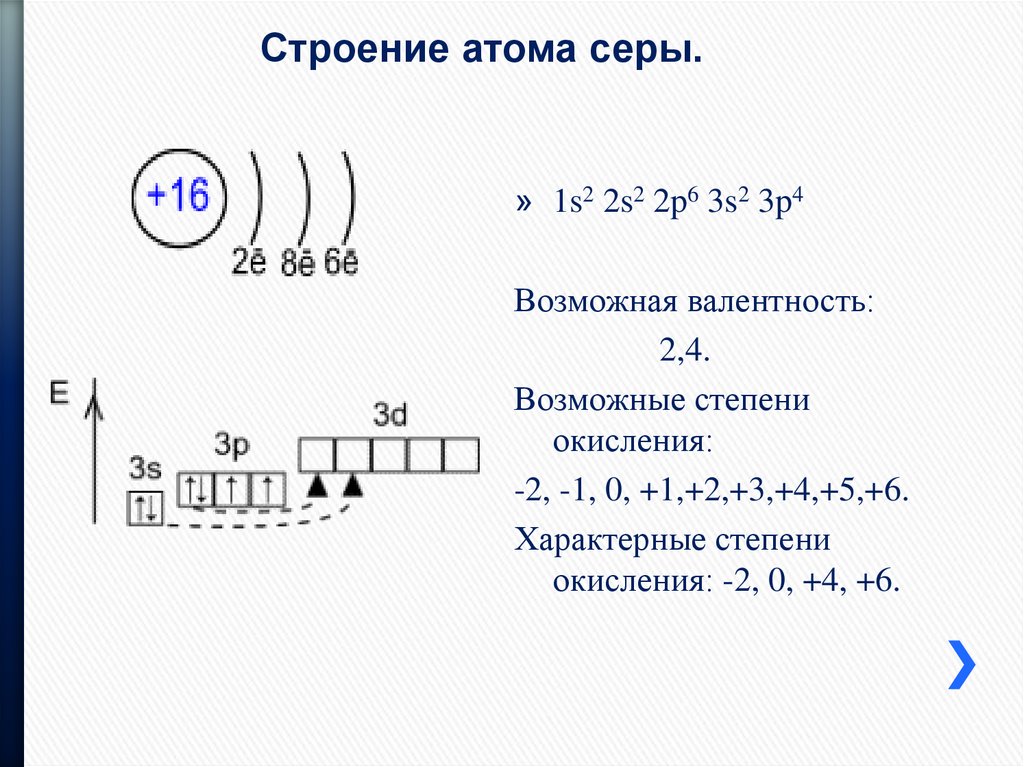
Ученые определяют атомную массу, вычисляя среднее значение массовых чисел для встречающихся в природе изотопов. Часто полученное число содержит десятичную дробь. Например, атомная масса хлора (Cl) составляет 35,45 а.е.м., поскольку хлор состоит из нескольких изотопов, некоторые из которых (большинство) имеют атомную массу 35 а.е.м. (17 протонов и 18 нейтронов), а некоторые — 37 а.е.м. (17 протонов и 20 нейтронов).
Зная атомный номер (Z) и массовое число (A), вы можете найти количество протонов, нейтронов и электронов в нейтральном атоме. Например, атом лития (Z=3, A=7 а.е.м.) содержит три протона (определено из Z), три электрона (поскольку число протонов равно числу электронов в атоме) и четыре нейтрона (7 – 3 = 4).
Изотопы
Изотопы — это различные формы элемента, которые имеют одинаковое количество протонов, но разное количество нейтронов.
ЦЕЛИ ОБУЧЕНИЯ
Обсудить свойства изотопов и их использование в радиометрическом датировании
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые моменты
- Изотопы — это атомы одного и того же элемента, содержащие одинаковое количество протонов, но разное количество нейтронов.

- Несмотря на разное количество нейтронов, изотопы одного и того же элемента имеют очень похожие физические свойства.
- Некоторые изотопы нестабильны и подвергаются радиоактивному распаду, превращаясь в другие элементы.
- Предсказуемый период полураспада различных распадающихся изотопов позволяет ученым датировать материал на основе его изотопного состава, например, с помощью датирования по углероду-14.
Ключевые термины
- : Любая из двух или более форм элемента, в которых атомы имеют одинаковое количество протонов, но разное количество нейтронов в ядрах.
- : Время, за которое половина исходной концентрации изотопа распадается обратно в более стабильную форму. 9{14}\text{C}[/latex] в атмосфере можно определить количество еще не распавшегося изотопа. На основе этого количества можно точно рассчитать возраст материала, если считается, что возраст материала составляет менее 50 000 лет. Этот метод называется радиоуглеродным датированием, или сокращенно углеродным датированием.

ЛИЦЕНЗИИ И АВТОРСТВО
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, ПРЕДОСТАВЛЕННОЕ РАНЕЕ
- Курирование и пересмотр. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, КОНКРЕТНОЕ АВТОРСТВО
- Колледж OpenStax, биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.
 org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution - Сунил Кумар Сингх, Основные типы сил. 27 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m14044/latest/. Лицензия : CC BY: Attribution
- нейтрон. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/neutron. Лицензия : CC BY-SA: Attribution-ShareAlike
- электрон. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/electron. Лицензия : CC BY-SA: Attribution-ShareAlike
- атом. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/atom. Лицензия : CC BY-SA: Attribution-ShareAlike
- протон.
 Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/proton. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/proton. Лицензия : CC BY-SA: Attribution-ShareAlike - Колледж OpenStax, Биология. 30 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Attribution
- атомный номер. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/atomic_number. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Биология.
 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution - Химия уровня A/OCR/Атомы, связи и группы/Атомы и реакции/Атомы. Предоставлено : Wikibooks. Расположен по адресу : http://en.wikibooks.org/wiki/A-level_Chemistry/OCR/Atoms,_Bonds_and_Groups/Atoms_and_Reactions/Atoms. Лицензия : CC BY-SA: Attribution-ShareAlike
- Безграничный. Предоставлено : Безграничное обучение. Расположен по адресу : http://www.boundless.com//biology/definition/atomic-mass–2. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Биология. 30 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest.
 Лицензия : CC BY: Attribution
Лицензия : CC BY: Attribution - Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Attribution
- Колледж OpenStax, Биология. 27 октября 2013 г. Предоставлено : OpenStaxCNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Колледж OpenStax, Биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Радиоуглеродный анализ. Предоставлено : Википедия.
 Расположен по адресу : http://en.wikipedia.org/wiki/Radiocarbon_dating. Лицензия : CC BY-SA: Attribution-ShareAlike изотоп
Расположен по адресу : http://en.wikipedia.org/wiki/Radiocarbon_dating. Лицензия : CC BY-SA: Attribution-ShareAlike изотоп - . Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/isotope. Лицензия : CC BY-SA: Attribution-ShareAlike
- Углерод-12. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Carbon-12. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Биология. 30 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX.
 Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Атрибуция
Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Атрибуция - Колледж OpenStax, Биология. 27 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_03.jpg. Лицензия : CC BY: Attribution
Эта глава является адаптацией главы «Структура атома» из книги Boundless Chemistry компании LumenLearning и распространяется под лицензией CC BY-SA 4.0.
Основная атомная структура | Экстрон
Версия для печати
Вся материя состоит из крошечных кусочков вещества, называемых атомами.
 Различные виды атомов называются элементами и перечислены на графическом дисплее, называемом периодической таблицей элементов. Большинство людей знакомы с названиями таких элементов, как кислород, азот, железо, золото и водород. Атомы всех элементов состоят из трех основных строительных блоков: протонов, нейтронов и электронов.
Различные виды атомов называются элементами и перечислены на графическом дисплее, называемом периодической таблицей элементов. Большинство людей знакомы с названиями таких элементов, как кислород, азот, железо, золото и водород. Атомы всех элементов состоят из трех основных строительных блоков: протонов, нейтронов и электронов.Периодическая таблица элементов Протоны — положительно заряженные частицы, нейтроны — незаряженные частицы, и в субатомном плане оба они тяжелые. Электроны являются отрицательно заряженными частицами и относительно легки по сравнению с протонами и нейтронами. Водород — самый простой из элементов; атом водорода состоит из одного протона и одного электрона. Структуру атома водорода можно представить как землю и ее луну. В центре находится большая тяжелая земля, а вокруг нее вращается меньшая луна. Точно так же тяжелый протон находится в центре атома водорода, а электрон вращается вокруг протона с большой скоростью.
 Все остальные элементы имеют одинаковую базовую структуру: протоны и нейтроны в центре и электроны, вращающиеся вокруг. Количество протонов в атоме определяет, к какому типу относится атом, и ожидается, что атом будет иметь такое же количество электронов, как и протонов, чтобы сбалансировать заряд атома. Гелий, например, имеет два протона и два электрона.
Все остальные элементы имеют одинаковую базовую структуру: протоны и нейтроны в центре и электроны, вращающиеся вокруг. Количество протонов в атоме определяет, к какому типу относится атом, и ожидается, что атом будет иметь такое же количество электронов, как и протонов, чтобы сбалансировать заряд атома. Гелий, например, имеет два протона и два электрона.Атом водорода Атом будет держать свои протоны и нейтроны при себе. Атомы, однако, будут иметь общие электроны. Атомам обычно нравится сохранять нейтральный заряд, поэтому, если они заимствуют электрон у одного атома, они склонны делиться им с другим атомом. Атомы будут делиться электронами с другими атомами, образуя связи, создавая молекулы и соединения, твердые тела и газы — короче говоря, всю материю. Кроме того, большое количество соседних атомов может обмениваться электронами в длинной цепочке от одного атома к другому и так далее, создавая поток электронов.
 Этот поток электронов и есть то, что мы называем электричеством.
Этот поток электронов и есть то, что мы называем электричеством.Итак, вся материя имеет электроны, готовые течь, но электричество не беспорядочно гудит повсюду, щелкая всякой всячиной. Это связано с тем, что баланс между электрическими силами и сопротивлением потоку электронов поддерживается в материи большую часть времени. Чтобы электроны двигались, электрические силы должны преодолевать сопротивление потоку электронов. Когда баланс склоняется либо с большими электрическими силами, либо с меньшим сопротивлением потоку электронов, создается электричество. Баланс между силой и сопротивлением будет количественно определен в разделе, посвященном электрическим цепям. Чтобы завершить обсуждение атомной структуры, давайте рассмотрим материалы, в которых текут электроны. Мы можем разделить материю на три категории в отношении потока электронов, проводников, изоляторов и полупроводников.
Проводники — это материалы, которые легко проводят электричество. Требуется очень небольшая электрическая сила, чтобы вызвать поток электронов в проводниках.
 Это связано с электронами, называемыми «свободными электронами», которые существуют в атомах проводников. «Свободные электроны» — это электроны, которые очень слабо связаны с атомом. С очень небольшой силой их можно обменять на другие атомы или течь для создания электричества. Такие металлы, как медь, серебро и золото, являются хорошими проводниками.
Это связано с электронами, называемыми «свободными электронами», которые существуют в атомах проводников. «Свободные электроны» — это электроны, которые очень слабо связаны с атомом. С очень небольшой силой их можно обменять на другие атомы или течь для создания электричества. Такие металлы, как медь, серебро и золото, являются хорошими проводниками.Изоляторы весьма эгоистичны в отношении обмена своими электронами. У них нет свободных электронов, и требуется большая электрическая сила, чтобы заставить электроны изолятора течь. Поток электронов в изоляторе встречается относительно редко, а когда он происходит, он обычно сопровождается сильным нагревом, громким шумом, плавлением или взрывами, дымом и/или пламенем. Такие материалы, как резина и стекло, являются хорошими изоляторами.
Полупроводники — это изоляторы, которым не хватает обязательств. Атомы полупроводника не имеют свободных электронов; однако у них есть электрон, который связан довольно слабо, и его можно разделить при приложении умеренной электрической силы.




 е.м.» означает атомную единицу массы. Поскольку ядерные частицы чрезвычайно малы, нет смысла выражать их массу в килограммах (протон и нейтрон весят примерно 1,67• 10-27кг, а электрон – 9,11• 10-31кг).
е.м.» означает атомную единицу массы. Поскольку ядерные частицы чрезвычайно малы, нет смысла выражать их массу в килограммах (протон и нейтрон весят примерно 1,67• 10-27кг, а электрон – 9,11• 10-31кг).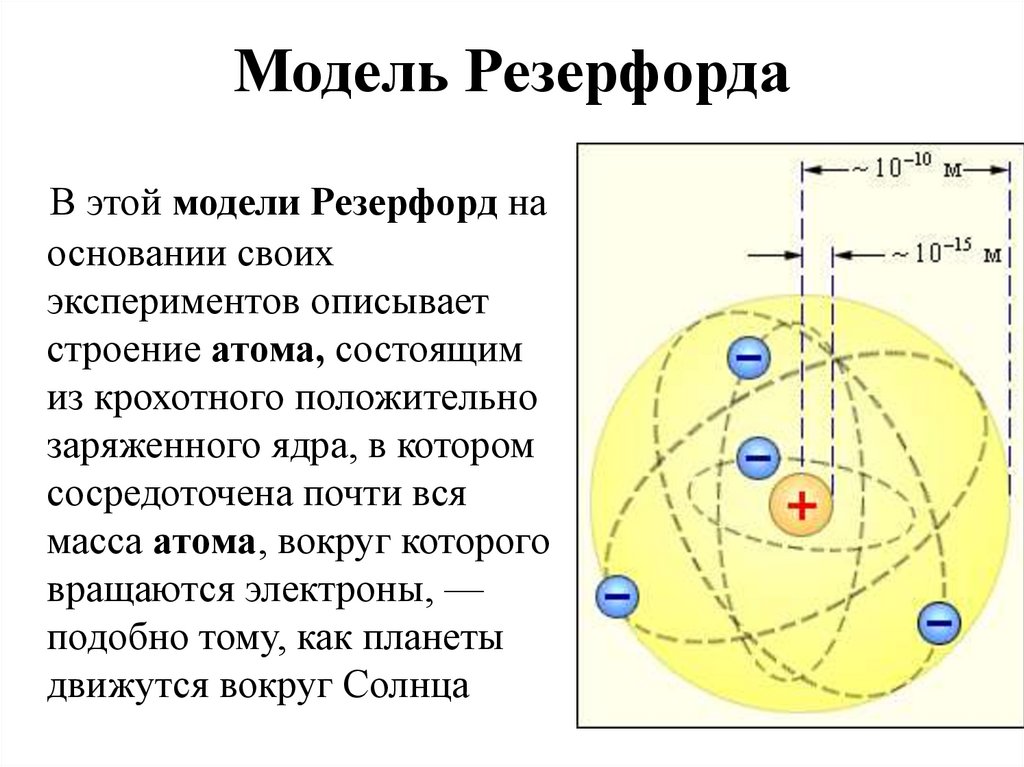





 org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution  Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/proton. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/proton. Лицензия : CC BY-SA: Attribution-ShareAlike  16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution
16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest/?collection=col11448/latest. Лицензия : CC BY: Attribution  Лицензия : CC BY: Attribution
Лицензия : CC BY: Attribution  Расположен по адресу : http://en.wikipedia.org/wiki/Radiocarbon_dating. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : http://en.wikipedia.org/wiki/Radiocarbon_dating. Лицензия : CC BY-SA: Attribution-ShareAlike  Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Атрибуция
Расположен по адресу : http://cnx.org/content/m44390/latest/Figure_02_01_01.jpg. Лицензия : CC BY: Атрибуция  Различные виды атомов называются элементами и перечислены на графическом дисплее, называемом периодической таблицей элементов. Большинство людей знакомы с названиями таких элементов, как кислород, азот, железо, золото и водород. Атомы всех элементов состоят из трех основных строительных блоков: протонов, нейтронов и электронов.
Различные виды атомов называются элементами и перечислены на графическом дисплее, называемом периодической таблицей элементов. Большинство людей знакомы с названиями таких элементов, как кислород, азот, железо, золото и водород. Атомы всех элементов состоят из трех основных строительных блоков: протонов, нейтронов и электронов. Все остальные элементы имеют одинаковую базовую структуру: протоны и нейтроны в центре и электроны, вращающиеся вокруг. Количество протонов в атоме определяет, к какому типу относится атом, и ожидается, что атом будет иметь такое же количество электронов, как и протонов, чтобы сбалансировать заряд атома. Гелий, например, имеет два протона и два электрона.
Все остальные элементы имеют одинаковую базовую структуру: протоны и нейтроны в центре и электроны, вращающиеся вокруг. Количество протонов в атоме определяет, к какому типу относится атом, и ожидается, что атом будет иметь такое же количество электронов, как и протонов, чтобы сбалансировать заряд атома. Гелий, например, имеет два протона и два электрона. Этот поток электронов и есть то, что мы называем электричеством.
Этот поток электронов и есть то, что мы называем электричеством. Это связано с электронами, называемыми «свободными электронами», которые существуют в атомах проводников. «Свободные электроны» — это электроны, которые очень слабо связаны с атомом. С очень небольшой силой их можно обменять на другие атомы или течь для создания электричества. Такие металлы, как медь, серебро и золото, являются хорошими проводниками.
Это связано с электронами, называемыми «свободными электронами», которые существуют в атомах проводников. «Свободные электроны» — это электроны, которые очень слабо связаны с атомом. С очень небольшой силой их можно обменять на другие атомы или течь для создания электричества. Такие металлы, как медь, серебро и золото, являются хорошими проводниками.