История открытия атома и его строения
09.10.2015Физика относится к науке полной тайн и загадок, а одной из увлекательных страниц ее истории, несомненно, является открытие строения сложного атома. Так к концу XIX века в обществе витало много предположений, что строение атома не так уж и просто. Все это стало известно благодаря открытию электролиза и самого электрона. Теории о существовании атома, как неделимой частицы, которая нас окружает, уходит своими корнями еще в далекое прошлое. Само понятие атом существовало еще и до н.э. Ученый Демокрит был убежденным исследователем атома. Он представлял себе картину мира следующим образом.
Все тела состоят из атомов, у которых неделимая и неизменная форма, число этих атомов неограниченно, так же как и число их типов, они смело могут образовывать различные соединения, благодаря различным крючкам и выступам, ну и ко всему они находятся в постоянном движении. В России огромное значение в исследовании атомной теории внес Ломоносов, разделяя две части материи – элементы и корпускулы.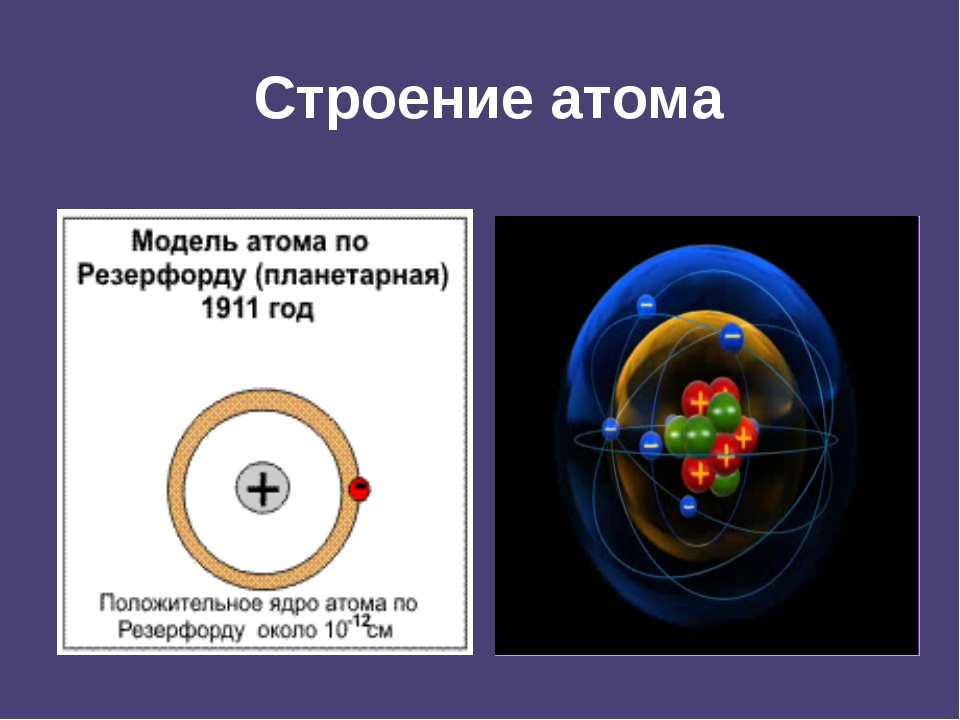
Согласно модели Томсона атом имеет положительный заряд, который равномерно заполняет весь его объем, внутри его расположены электроны, тем самым атом несколько напоминает пудинг с изюмом. Предполагалось, что электронов большое количество, и они могут находиться в движении. Сам атом являлся электро-нейтральным. Устойчивость атома определяло расположение электронов. Своей разработкой Томсон трактовал ряд физических явлений у некоторых веществ.
Вскоре была доказана несостоятельность этой теории. Модель строения атома Томсона противоречила опытам, которые были проведены Резерфордом. Резерфорд – это выдающийся ученый, основатель некоторых направлений в физики, лауреат Нобелевской премии. В начале 19 столетия, благодаря своим исследованиям, он доказал то, что атом имеет ядро. Оно заряжено положительно и занимает небольшую часть у атома, вокруг самого ядра двигаются электроны. Эти данные были опубликованы в Лондонском журнале по философии 1911 года.
Оно заряжено положительно и занимает небольшую часть у атома, вокруг самого ядра двигаются электроны. Эти данные были опубликованы в Лондонском журнале по философии 1911 года.
Д.И. Менделеев, открыв свой закон, подтвердил то, что между химическими элементами есть своя закономерность. Отсюда следовал вывод – все атомы тоже имеют что-то общее. До конца XIX века, считалось, что атом не может разрушаться, но в дальнейшем были сделаны открытия по строению атома, оно достаточно сложное, ко всему у него есть способность к превращениям. Так было доказано выделение электронов, получение рентгеновских лучей (В. Рентген в 1895 году) и радиоактивного излучения (А. Беккерелей в 1896 году).
Большой шаг в исследовании строения атома сделал Н. Бор. Им был сделан анализ всех данные, что привело его к выводу – описание систем атомов не должно ограничиваться привычными представлениями в физики. Им были написаны постулаты – о стационарных состояниях и правило частот.
Открытие урана в 1939 году доподлинно подтвердило, что атом способен делится. Ко всему он состоит не только из мелких частиц. Эти части способны к самопроизвольному испусканию при радиоактивном разрушении. Атом еще и способен давать излучение, и которое может быть не только видимое, но также и электромагнитное (пример: х-лучи).
Рейтинг статьи: 28483 просмотра
Автор: Елена Мазина
Открытия и атом [ВИДЕО]
Открытие профессора Рождественского – Наука – Коммерсантъ
Самая заветная, притягательная и важная проблема современной физики — это узнать, что такое атом. Как построены атомы тех 92 элементов, которые в стройной, периодической системе расположены по химическим свойствам творческим гением Д. И. Менделеева?
Как построены атомы тех 92 элементов, которые в стройной, периодической системе расположены по химическим свойствам творческим гением Д. И. Менделеева?
Каковы силы, действующие внутри атомов и между атомами? Какие силы заставляют связываться отдельные атомы в молекулы, а также определяют взаимодействие самих молекул? Если узнать эти силы, то можно предсказать, вычислить явления, которые происходят в природе в результате игры атомно-молекулярных сил.
Большой шаг вперед сделан недавно в этом смысле исследованиями профессора Рождественского, директора оптического института в Петрограде. Стало известно строение одного из самых простых атомов — лития; путь для исследования других атомов, таким образом, открыт. Спектральный анализ, который дал знание химического состава солнца, открыл теперь путь к познанию строения атома.
Уже ранее английский ученый Рутерфорд показал, что атомы состоят из тяжелого положительного ядра и невесомых электронов с отрицательным зарядом.
Вслед за Рутерфордом датский ученый Бор дал такую картину строения атомов: тучи электронов собираются круговыми кольцами, по 8–10 в кольцо, и с громадной быстротой носятся по этим кольцам.
Наконец, немецкий ученый Зоммерфельд доказал, что возможно движение единственного электрона — водорода — не только по кругам, но и по самым разнообразным вытянутым орбитам.
Но задача вычисления становилась слишком сложной даже при двух электронах, носящихся около ядра, и казалось, что через эту сложность нельзя было перешагнуть к познанию атома.
Этот важный шаг суждено было сделать русскому ученому, и притом в такое время, когда ученые в России изолированы от своих коллег на Западе.
Доказано, во-первых, какие возможны орбиты для внешних электронов. Во-вторых, для некоторых атомов точно открыты эти орбиты. Наконец, доказано, что не только электрические, но и магнитные силы управляют движениями электронов внутри атомов.
Картина определилась с убедительной ясностью во всей невероятной сложности. Воспроизвести эту картину не под силу одному человеку. Годы нужны для полного решения задачи, но как решать ее — отныне ясно.
При оптическом институте предполагается создать атомную комиссию из целого ряда ученых. При комиссии будет специальное вычислительное бюро. Уже теперь, когда граница еще закрыта, русские ученые должны как можно дальше продвинуться в решении поставленной задачи. Слишком важно для России, чтобы на Западе знали, что творческие силы страны не исчезли, несмотря на разруху, вызванную войной, на голод, холод, блокаду и т. д. Периодическая система элементов родилась в России. Пусть же в России будет разработана и ее теоретическая основа.
При комиссии будет специальное вычислительное бюро. Уже теперь, когда граница еще закрыта, русские ученые должны как можно дальше продвинуться в решении поставленной задачи. Слишком важно для России, чтобы на Западе знали, что творческие силы страны не исчезли, несмотря на разруху, вызванную войной, на голод, холод, блокаду и т. д. Периодическая система элементов родилась в России. Пусть же в России будет разработана и ее теоретическая основа.
Об открытии профессора Рождественского сообщила газета «Известия» 31 января 1920 года.
Материал подготовил Алексей Алексеев
II. Проверочная работа (10 минут). Тест “Химические формулы”. Вопросы теста подаются на экран. Приложение 1. III. Формирование новых понятий.
1. Важнейшие этапы истории развития представлений о строении вещества.
Приложение 2. Приложение 3. Вывод: В начале ХХ века разрушилось представление о неделимости атома. Причиной послужили открытие электронов, явление радиоактивности. Атом – сложная частица.2. Планетарная модель атома (Резерфорд). Приложение 4. На основании опытов Резерфорда было установлено: (составляется схема на доске)
Атом “Нуклеус” (латинское nucleus) – ядро. Масса атома сосредоточена в ядре. Поэтому эта модель называется – нуклеарная. Характеристики элементарных частиц. Таблица 2 в учебнике.
IV.
V. Применение знаний. Определите число протонов, электронов, нейтронов для атомов элементов.
VI. |
Отвечают на листочках.
Слушают пояснения к слайдам.
Записывают тезисами в тетрадь.
Вспоминают сведения из курса физики. Обращаются к учебнику, рассматривают рисунок 6
“Радиоактивное излучение в электрическом
поле”.
Рисуют схему в тетрадях
Записывают в тетрадях.
Изучают таблицу 2 в учебнике. Выписывают из таблицы примечания.
Записывают в тетрадях.
Выполняют в тетрадях. Проверяем фронтально.
Записывают домашнее задание. |
Электронный учебник модуль
№ 065. Тест “Химические формулы”
Работа с электронным учебником.
Работа с электронным учебником. Модуль № 108 “История открытия строения атома”.
Работа с электронным учебником. Mодуль № 111 “Опыт Резерфорда”.
|
Открытие электрона.
 Модель Томсона — урок. Физика, 9 класс.
Модель Томсона — урок. Физика, 9 класс.Электрон
Долгое время атом считался наименьшей неделимой частицей вещества. Такое представление об атоме было разрушено в \(1897\) году. Этот год считается датой открытия элементарной частицы — электрона.
В конце \(XIX\) века английский физик Джозеф Джон Томсон занимался изучением «катодных лучей» (рис. \(1\)).
Рис. \(1\). Джозеф Джон Томсон
Этот вид излучения наблюдался при пропускании электрического тока через разреженные газы. Схема установки, которую использовал Томсон, представлена на рисунке \(2\).
Рис. \(2\). Схема установки, которую использовал Томсон
Ток между анодом (\(1\)) и катодом (\(2\)) проходит через колбу, заполненную разреженным газом. Через узкую щель (\(3\)) «катодный луч» попадает в электрическое поле (\(4\)) и отклоняется. По шкале (\(5\)) можно определить угол отклонения луча от начального направления.
Отклонение луча означает, что луч — это поток отрицательно заряженных частиц, которые получили название «электроны».
По углу отклонения луча от первоначального направления Томсону удалось измерить удельный заряд электрона \(q/m\), который оказался приблизительно в \(2000\) раз больше, чем у иона водорода, удельный заряд которого уже был известен к тому времени. А это означало, что при том же заряде масса электрона примерно в \(2000\) раз меньше, чем масса иона водорода.
Заряд электрона равен элементарному электрическому заряду:
e=−1,6⋅10−19 Кл.
Масса электрона:
me=9,1⋅10−31 кг.
В \(1906\) году за открытие электрона Томсон стал лауреатом Нобелевской премии.
Так как колба с газом была герметично запаяна, то электронам было неоткуда взяться, кроме как из атомов газа, через который проходил электрический ток. А значит, атом не мог быть неделимой частицей! Перед учёными стал вопрос о том, как же всё-таки устроен атом.
Обрати внимание!
Открытие электрона доказывало, что атом не является неделимой частицей.
Модель Томсона
Сам Томсон предположил, что атом представляет собой равномерно распределённый по всему объёму атома положительный заряд. Внутри такого положительно заряженного «облака» содержатся маленькие отрицательно заряженные электроны, которые расположены случайным образом, как изюм в тесте пудинга. Суммарный заряд электронов по модулю равен заряду «облака», поэтому атом в целом нейтрален. Такая модель строения атома получила название «пудинговая модель атома» (рис. \(3\)).
Рис. \(3\). «Пудинговая модель атома»
Позднее Эрнест Резерфорд опроверг предположения о подобном строении атома. Его опыты по рассеянию альфа-частиц на золотой фольге позволили построить более точную модель строения атома.
Источники:
Рис. 1. Джозеф Джон Томсон.
Рис. 2. Схема установки, которую использовал Томсон. © ЯКласс.
Рис. 3. «Пудинговая модель атома».
3. «Пудинговая модель атома».
О чём поспорили Нобелевские лауреаты Альберт Эйнштейн и Нильс Бор
108 лет назад 28 февраля 1913 года датский физик Нильс Бор предложил планетарную модель строения атома, которая впоследствии стала основой квантовой механики. Однако многие современники Бора, в том числе Альберт Эйнштейн, считали эту теорию несостоятельной и даже безумной.
Модель датского физика Нильса Бора предполагала, что электроны движутся вокруг атомного ядра подобно планетам, обращающимся вокруг звезды. Эта теория, за которую Нильс Бор был награжден Нобелевской премией, позволила объяснить химические и оптические свойства атомов.
Её предпосылками стали опыты по изучению прохождения электрического тока через жидкости, проводимые Фарадеем. Эти опыты дали представление об электричестве как отдельных единичных зарядах. Величины этих зарядов были определены при изучении прохождения электрического тока через газы. Открытие ядер атома дало возможность Резерфорду в 1911 году построить одну из первых моделей строения атома.
28 февраля 1913 года Бор предложил свою теорию строения атома, в которой электрон в атоме не подчиняется законам классической физики. Согласно этой теории электрон вращается вокруг атома по строго стационарным круговым орбитам. Бор ввел понятие квантового соотношения между радиусом орбиты и скоростью электрона. В 1922 году за это открытие Бор получил Нобелевскую премию. Начиная с 1925 года Нильс Бор вместе со своими сподвижниками Вернером Гейзенбергом и Максом Борном сформировали принципы «Копенгагенской интерпретации» квантовой механики. Одним из постулатов работы было утверждение, что неопределенность в теории является фундаментальной и должна приниматься учеными.
В 1927 году на Пятой конференции по физике состоялся знаменитый диалог Эйнштейна и Бора. Эйнштейн, устав искать научные аргументы против безумных, как ему казалось, идей датского физика, в сердцах выпалил, что бог не играет с Вселенной в кости. На что Бор невозмутимо посоветовал оппоненту перестать говорить Богу, что ему делать. Тогда Бор, Гейзенберг и Борн не смогли победить Эйнштейна, но распространение копенгагенской интерпретации среди физиков было ускорено конференцией, и в конечном итоге она стала преобладающим взглядом на квантовую механику.
Тогда Бор, Гейзенберг и Борн не смогли победить Эйнштейна, но распространение копенгагенской интерпретации среди физиков было ускорено конференцией, и в конечном итоге она стала преобладающим взглядом на квантовую механику.12.2. Тайны атома (открытие микромира). Краткая история философии [Нескучная книга]
12.2. Тайны атома (открытие микромира)
До конца XIX в. в науке господствовало убеждение, что все физические тела состоят из очень маленьких частиц – молекул, не видимых глазу, но доступных наблюдению в мощный микроскоп. Однако сами молекулы состоят из еще более мелких частиц – атомов. Например, молекула воды состоит из одного атома кислорода и двух водорода. Атомы, считалось в науке прошлых столетий, – последний предел делимости вещества. Они представляют собой простейшие, мельчайшие и неделимые частицы, которые лежат в основе любого физического тела. Кроме того, если они неделимы, значит, постоянны и неизменны. Само вещество может меняться или превращаться как угодно, благодаря всевозможным атомным взаимодействиям. Сами же атомы пребывают всегда в одном и том же состоянии. Будучи неделимой вечной мировой основой, они не могут распадаться на части, рождаться, исчезать, переходить в другие формы и так далее. Вспомним, что слово «атом» было впервые употреблено древним философом Демокритом. Его идеи об атомах как последнем пределе вещества с небольшими изменениями существовали более двух тысяч лет. Они легли в основу механицизма классического естествознания, были в нем развиты и продолжены. В XIX в. эти представления доживали последние дни. Открытия в физике, сделанные на рубеже прошлого и нынешнего столетий, разрушили многовековые представления об атомах, произвели настоящую революцию в науке.
Сами же атомы пребывают всегда в одном и том же состоянии. Будучи неделимой вечной мировой основой, они не могут распадаться на части, рождаться, исчезать, переходить в другие формы и так далее. Вспомним, что слово «атом» было впервые употреблено древним философом Демокритом. Его идеи об атомах как последнем пределе вещества с небольшими изменениями существовали более двух тысяч лет. Они легли в основу механицизма классического естествознания, были в нем развиты и продолжены. В XIX в. эти представления доживали последние дни. Открытия в физике, сделанные на рубеже прошлого и нынешнего столетий, разрушили многовековые представления об атомах, произвели настоящую революцию в науке.
В самом конце XIX в. английский физик Джон Томсон открыл существование в атоме отрицательно заряженных частиц, которые получили название электроны. Поскольку атом в целом электрически нейтрален, то было сделано предположение, что помимо электронов в нем существуют также положительно заряженные частицы. Опыты английского физика Эрнеста Резерфорда привели его к выводу о том, что в любом атоме существует ядро – положительно заряженная частица, размер которой (10-12 см, или одна стомиллиардная часть миллиметра) очень мал по сравнению с размерами всего атома (10-8 см, или одна десятимиллионная часть миллиметра). Ядро меньше атома в 10 000 раз, но в нем почти полностью сосредоточена вся атомная масса. Кроме того, было обнаружено, что атомы одних элементов могут самопроизвольно превращаться в атомы других в результате ядерных излучений. Это явление, впервые открытое французским физиком Антуаном Анри Беккерелем, получило название радиоактивность (от лат. radiare – испускать лучи и activus – деятельный).
Опыты английского физика Эрнеста Резерфорда привели его к выводу о том, что в любом атоме существует ядро – положительно заряженная частица, размер которой (10-12 см, или одна стомиллиардная часть миллиметра) очень мал по сравнению с размерами всего атома (10-8 см, или одна десятимиллионная часть миллиметра). Ядро меньше атома в 10 000 раз, но в нем почти полностью сосредоточена вся атомная масса. Кроме того, было обнаружено, что атомы одних элементов могут самопроизвольно превращаться в атомы других в результате ядерных излучений. Это явление, впервые открытое французским физиком Антуаном Анри Беккерелем, получило название радиоактивность (от лат. radiare – испускать лучи и activus – деятельный).
Эти открытия убедительно показали, что атомы – не простейшие, неделимые и неизменные частицы вещества, а сложные, делимые и способные к превращению микрообъекты, имеющие определенное устройство. Одним из первых попытался выяснить строение атома Эрнест Резерфорд. Поскольку атом вследствие своих малых размеров недоступен никакому непосредственному наблюдению (даже с помощью сложнейших приборов), то о его устройстве можно говорить только умозрительно, на свой страх и риск нарисовать его строение. Умозрительная картина или модель атома, описывающая его структуру (строение), предложенная Резерфордом, получила название планетарная. Нам хорошо известно, что наша Солнечная система состоит из огромного центра – Солнца и вращающихся на разных расстояниях вокруг него девяти планет, одной из которых является Земля. Причем размеры и масса каждой планеты ничтожно малы по сравнению с размером и массой Солнца, то есть почти все вещество Солнечной системы сосредоточено в нем. Между Солнцем и планетами действуют силы тяготения (взаимного притяжения), обеспечивающие равномерное и стройное движение планет вокруг общего центра. Резерфорд предположил, что строение атома сходно с устройством Солнечной системы: в центре его находится положительно заряженное ядро, вокруг которого по разным орбитам движутся отрицательно заряженные электроны.
Поскольку атом вследствие своих малых размеров недоступен никакому непосредственному наблюдению (даже с помощью сложнейших приборов), то о его устройстве можно говорить только умозрительно, на свой страх и риск нарисовать его строение. Умозрительная картина или модель атома, описывающая его структуру (строение), предложенная Резерфордом, получила название планетарная. Нам хорошо известно, что наша Солнечная система состоит из огромного центра – Солнца и вращающихся на разных расстояниях вокруг него девяти планет, одной из которых является Земля. Причем размеры и масса каждой планеты ничтожно малы по сравнению с размером и массой Солнца, то есть почти все вещество Солнечной системы сосредоточено в нем. Между Солнцем и планетами действуют силы тяготения (взаимного притяжения), обеспечивающие равномерное и стройное движение планет вокруг общего центра. Резерфорд предположил, что строение атома сходно с устройством Солнечной системы: в центре его находится положительно заряженное ядро, вокруг которого по разным орбитам движутся отрицательно заряженные электроны. Вместо сил тяготения, действующих в Солнечной системе, в атоме действуют электрические силы: положительный заряд атомного ядра уравновешивается суммой зарядов электронов, и поэтому атом электрически нейтрален. У Резерфорда получилось, что каждый атом – это целый сложно устроенный мир, только очень малых размеров. По этому поводу Валерий Брюсов писал:
Вместо сил тяготения, действующих в Солнечной системе, в атоме действуют электрические силы: положительный заряд атомного ядра уравновешивается суммой зарядов электронов, и поэтому атом электрически нейтрален. У Резерфорда получилось, что каждый атом – это целый сложно устроенный мир, только очень малых размеров. По этому поводу Валерий Брюсов писал:
Быть может, эти электроны —
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков!
Еще, быть может, каждый атом —
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но также то – чего здесь нет.
Их меры малы, но все та же
Их бесконечность, как и здесь;
Там скорбь и страсть, как здесь, и даже
Там та же мировая спесь.
Модель атома Резерфорда очень наглядно описывала его строение. Однако впоследствии она столкнулась со множеством противоречий, и стало понятно, что она не совсем подходит для объяснения атомного устройства.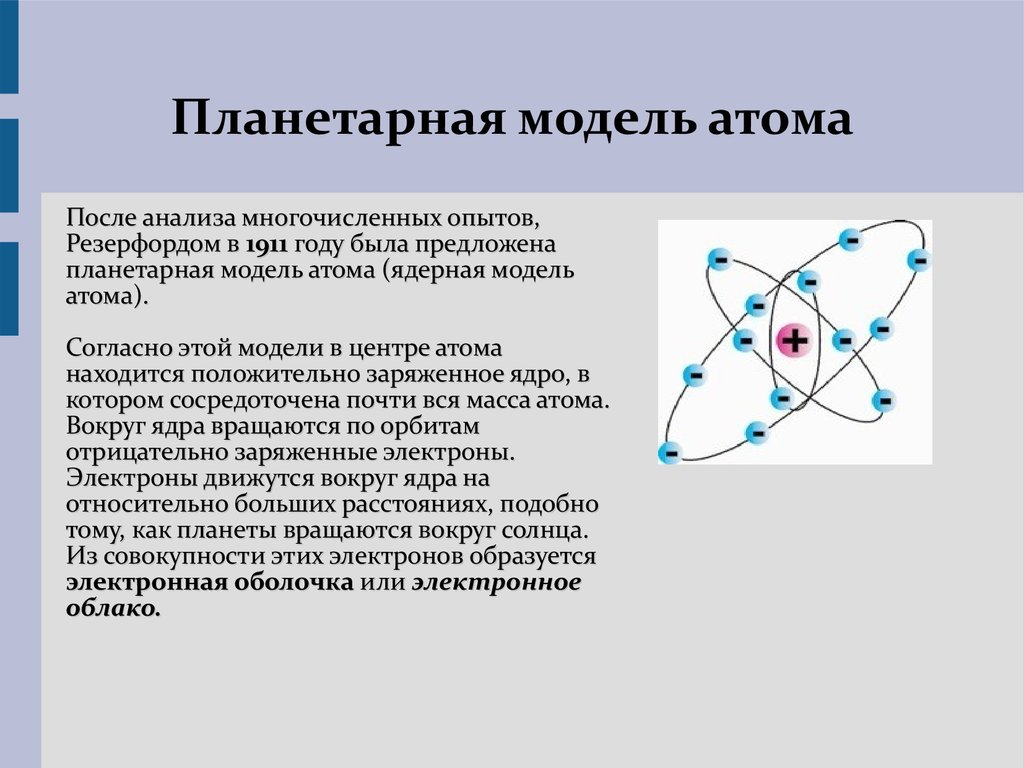 Вспомним теорию относительности Эйнштейна, согласно которой при значительном изменении масштабов (увеличении или уменьшении) изучаемых нами объектов принципы и законы, действующие в одних условиях, могут совершенно не действовать в других, правила одних областей реальности могут полностью противоречить правилам других. Если атом – столь малая величина, то почему бы не предположить, что для него существуют совершенно иные правила и законы, чем для нашего видимого макромира, что микромир строится абсолютно по другим принципам и все наши макропредставления бессильны что-либо описать или объяснить в микрообластях. Резерфордова модель атома, просто и наглядно говорившая о его устройстве, была родом из макромира, ведь она сравнивала его с Солнечной системой, использовала понятия ядра, центра, движущихся частиц-электронов, орбит движения (а это все макропонятия или макропредставления). Видимо, об атоме надо было говорить как-то иначе, неким другим, специфическим языком. Новую модель атома построил известный датский физик Нильс Бор.
Вспомним теорию относительности Эйнштейна, согласно которой при значительном изменении масштабов (увеличении или уменьшении) изучаемых нами объектов принципы и законы, действующие в одних условиях, могут совершенно не действовать в других, правила одних областей реальности могут полностью противоречить правилам других. Если атом – столь малая величина, то почему бы не предположить, что для него существуют совершенно иные правила и законы, чем для нашего видимого макромира, что микромир строится абсолютно по другим принципам и все наши макропредставления бессильны что-либо описать или объяснить в микрообластях. Резерфордова модель атома, просто и наглядно говорившая о его устройстве, была родом из макромира, ведь она сравнивала его с Солнечной системой, использовала понятия ядра, центра, движущихся частиц-электронов, орбит движения (а это все макропонятия или макропредставления). Видимо, об атоме надо было говорить как-то иначе, неким другим, специфическим языком. Новую модель атома построил известный датский физик Нильс Бор.
По его представлениям электрон – это не столько точка или твердый шарик, движущийся вокруг атомного ядра, сколько некий сгусток энергии, как бы размазанный вокруг ядра, но не равномерно, а с большей или меньшей плотностью на разных участках. Кроме того, надо говорить не об орбите движения электрона, а о его стационарном (неизменном) состоянии, в котором он может находиться, не излучая энергии. Если же это положение меняется, то есть электрон как бы переходит из одного стационарного состояния в другое, то он излучает или поглощает порцию энергии. Как видим, модель, предложенная Бором, была более сложной и менее понятной, чем Резерфордова, но и она не смогла с успехом объяснить атомное строение, потому что во многом использовала макроязык и макропонятия. Выяснилось, что процессы, происходящие в атоме, в принципе невозможно представить в виде какой-либо механической модели по аналогии с событиями в макромире. Даже понятия пространства и времени в существующей в макромире форме оказались неподходящими для описания микрофизических явлений. Отказавшись полностью от понятного естественного языка и наглядных моделей при изучении микромира, наука все более стала пользоваться абстрактным языком математики. Атом усилиями физиков-теоретиков постепенно превращался в ненаблюдаемый набор уравнений.
Отказавшись полностью от понятного естественного языка и наглядных моделей при изучении микромира, наука все более стала пользоваться абстрактным языком математики. Атом усилиями физиков-теоретиков постепенно превращался в ненаблюдаемый набор уравнений.
Мы уже говорили, что к концу XIX в. наука установила два вида существования материи – вещество и поле, во всем отличные и противоположные (вещество обладает корпускулярными свойствами, а поле – волновыми). На рубеже XIX–XX вв. выяснилось, что два эти вида материи не исключают один другого. Как это ни удивительно, но одни и те же объекты могут характеризоваться и свойствами вещества, и свойствами поля одновременно, то есть иметь как корпускулярные, так и волновые качества. Известный немецкий физик Макс Планк, исследуя процессы теплового излучения, пришел к ошеломляющему выводу, что при излучении энергия отдается или поглощается не непрерывно и не в любых количествах, но небольшими и неделимыми порциями, которые он назвал квантами (от лат. quantum – сколько). Квант – это порция энергии. Вдумаемся в это определение. Его первая часть – порция – подразумевает нечто определенное, ограниченное, вещественное, имеющее некие размеры, то есть частицу, или корпускулу. Вторая часть – энергия – подразумевает нечто непрерывное, безразмерное, невещественное, то есть поле. Стало быть, квант – это такой объект физической реальности, в котором совпадают или одновременно представлены и вещество, и поле, – объект, отличающийся корпускулярно-волновым дуализмом.
quantum – сколько). Квант – это порция энергии. Вдумаемся в это определение. Его первая часть – порция – подразумевает нечто определенное, ограниченное, вещественное, имеющее некие размеры, то есть частицу, или корпускулу. Вторая часть – энергия – подразумевает нечто непрерывное, безразмерное, невещественное, то есть поле. Стало быть, квант – это такой объект физической реальности, в котором совпадают или одновременно представлены и вещество, и поле, – объект, отличающийся корпускулярно-волновым дуализмом.
Эйнштейн перенес идею о квантах на область света и создал новое учение о нем. Вспомним, что Ньютон считал свет потоком корпускул, Гюйгенс и Юнг рассматривали его как волны, а Фарадей и Максвелл – как колебания электромагнитного поля. Эйнштейн совместил все эти представления и создал теорию, по которой свет имеет корпускулярно-волновую природу. Он распространяется квантами, то есть энергетическими порциями, которые были названы фотонами (от греч. photos – свет). С одной стороны, фотон – именно порция энергии и поэтому является своего рода частицей, или корпускулой, а с другой – порция именно энергии и поэтому является своего рода волной. Свет, по Эйнштейну, – это поток энергетических зерен, световых квантов или своеобразный фотонный дождь. Представление Эйнштейна о световых квантах помогло понять и наглядно представить явление фотоэффекта, сущность которого заключается в выбивании электронов из вещества под действием световых волн (каждый электрон вырывается одним фотоном). Все это убедительно подтвердило идею Эйнштейна, что свет ведет себя не только как волна, но и как поток корпускул. В опытах по дифракции и интерференции проявляются его волновые свойства, а при фотоэффекте – корпускулярные. Фотонная теория Эйнштейна относится к наиболее экспериментально подтвержденным физическим теориям.
С одной стороны, фотон – именно порция энергии и поэтому является своего рода частицей, или корпускулой, а с другой – порция именно энергии и поэтому является своего рода волной. Свет, по Эйнштейну, – это поток энергетических зерен, световых квантов или своеобразный фотонный дождь. Представление Эйнштейна о световых квантах помогло понять и наглядно представить явление фотоэффекта, сущность которого заключается в выбивании электронов из вещества под действием световых волн (каждый электрон вырывается одним фотоном). Все это убедительно подтвердило идею Эйнштейна, что свет ведет себя не только как волна, но и как поток корпускул. В опытах по дифракции и интерференции проявляются его волновые свойства, а при фотоэффекте – корпускулярные. Фотонная теория Эйнштейна относится к наиболее экспериментально подтвержденным физическим теориям.
Идея о квантах была перенесена и на представления об атоме, в результате чего появилась специфическая дисциплина – квантовая механика – наука, описывающая процессы, происходящие в микромире.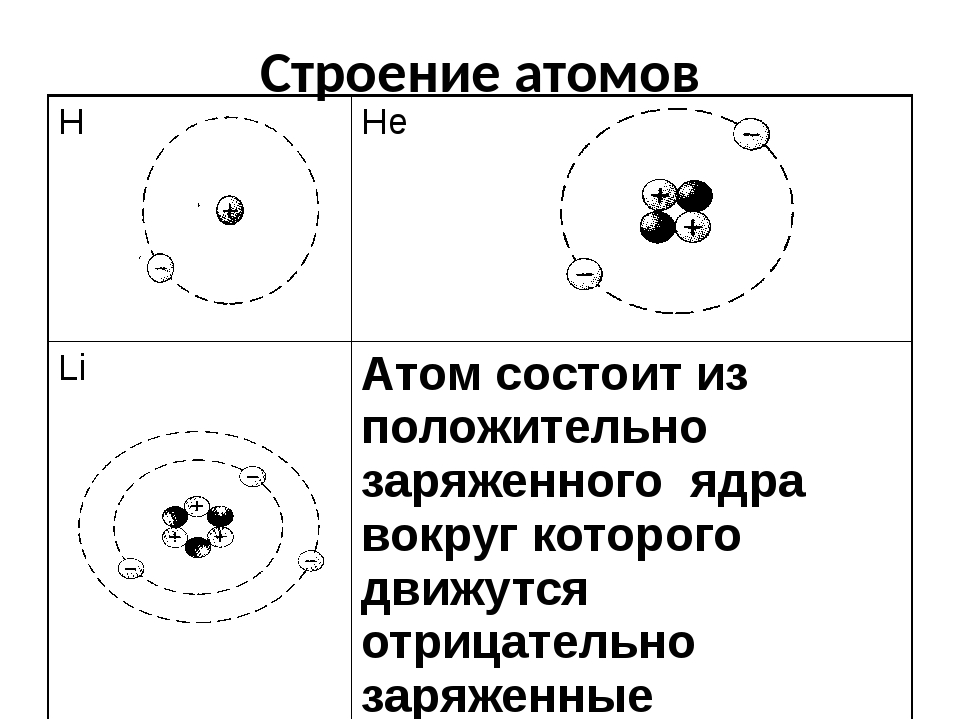 Одним из ее основных утверждений является мысль о том, что микрообъекты (электроны, например) обладают, подобно свету, корпускулярными и волновыми свойствами, и только при учете этой двойственности можно более или менее успешно получить общую картину микромира. Квантовая механика – сравнительно молодая научная дисциплина, ей около ста лет. Появившись в XX в., она уже достигла значительных результатов, но дальнейшие ее успехи, по всей видимости, впереди. Современная наука ждет от нее ответов на многие сложные вопросы, связанные не только с микромиром, но также касающиеся макро– и мегамиров, ведь три эти области существуют не изолированно, а представляют собой единую физическую реальность.
Одним из ее основных утверждений является мысль о том, что микрообъекты (электроны, например) обладают, подобно свету, корпускулярными и волновыми свойствами, и только при учете этой двойственности можно более или менее успешно получить общую картину микромира. Квантовая механика – сравнительно молодая научная дисциплина, ей около ста лет. Появившись в XX в., она уже достигла значительных результатов, но дальнейшие ее успехи, по всей видимости, впереди. Современная наука ждет от нее ответов на многие сложные вопросы, связанные не только с микромиром, но также касающиеся макро– и мегамиров, ведь три эти области существуют не изолированно, а представляют собой единую физическую реальность.
Проверь себя
1. Какие открытия в физике в конце XIX – начале XX в. разрушили представления об атомах как неделимых частицах вещества?
2. Что представляла собой модель атома, предложенная Резерфордом? Почему она называется планетарной?
3. Как выглядела модель атома, предложенная Нильсом Бором? В чем заключаются трудности изучения микромира?
4. Какое открытие было сделано Планком? Что такое квант? В чем проявляется его корпускулярно-волновая природа?
Какое открытие было сделано Планком? Что такое квант? В чем проявляется его корпускулярно-волновая природа?
5. Какую теорию света разработал Эйнштейн на основе представлений о квантах?
6. Что такое корпускулярно-волновой дуализм микромира, квантовая механика?
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесСтроение атома. Атомная физика :: Класс!ная физика
СТРОЕНИЕ АТОМА
Модель атома Томсона
1897 г.- Дж. Томсоном выдвинута модель строения атома.
Атом имеет форму шара. По всему объему атома с постоянной плотностью распределен положительный заряд. Внутри (как изюм в кексе) расположены электроны.
В целом атом электрически нейтрален.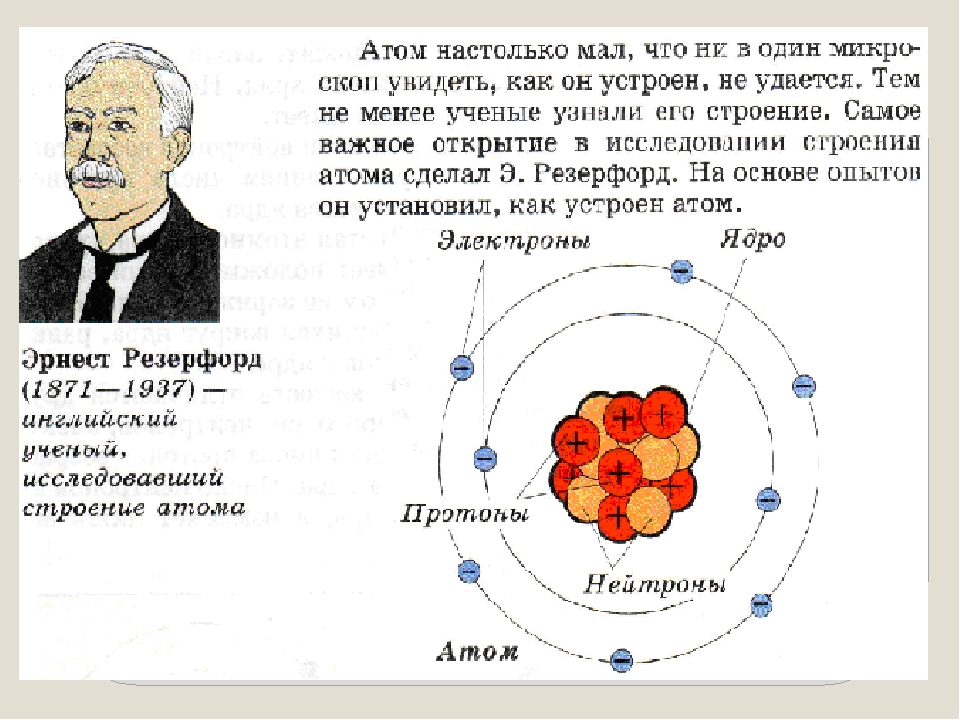
Когда электроны колеблются относительно центра сферы, атом излучает свет.
Опыт Резерфорда по рассеянию альфа-частиц
1906 г. – Э. Резерфорд проводит опыты для проверки состоятельности модели атома Томсона:
В вакууме в свинцовом стакане располагался источник радиоактивного излучения (альфа-частиц) – полоний(Ро).
Тонкая золотая фольга бомбардировалась положительно заряженными альфа-частицами, скорость которых около 20 ООО км /с.
На экране регистрировались вспышки от попадания на него альфа-частиц.
Кроме основного экрана следы от альфа-частиц были зафиксированы и на боковых экранах.
Зная о том, как взаимодействуют одноименно заряженные частицы, а они отталкиваются друг от друга, можно объяснить результаты опыта Резерфорда:
– частицы, которые отклонялись, пролетали недалеко от ядра
– частицы, которые отражались, попадали точно в ядро
– частицы, которые не испытывали отклонений, пролетали далеко от ядра
Понимание причин отклонения альфа-частиц позволило Э.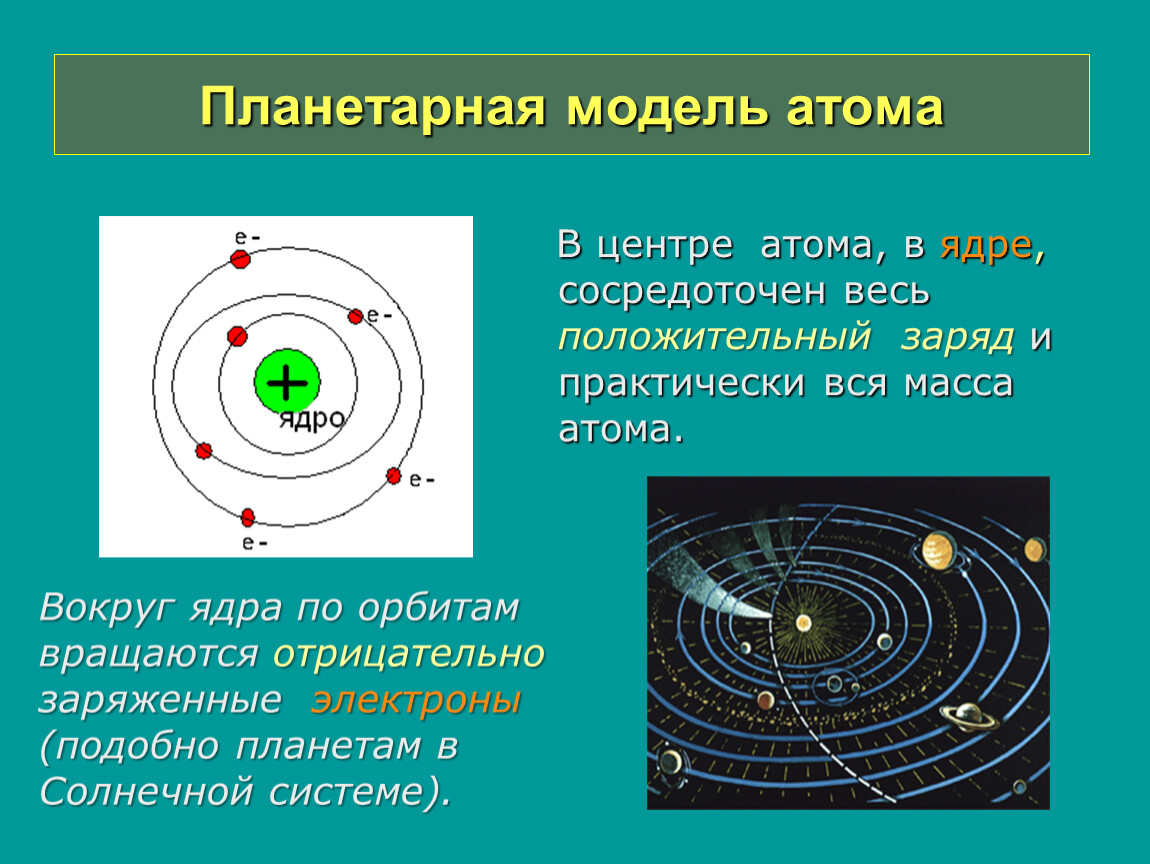 Резерфорду выдвинуть собственную планетарную (иначе ядерную) модель строения атома.
Резерфорду выдвинуть собственную планетарную (иначе ядерную) модель строения атома.
Атом по Резерфорду
– это положительно заряженное ядро в центре атома и электроны на орбитах вокруг ядра
– характер движения электронов определяется действием кулоновских сил со стороны ядра
– диаметр ядра в 100000 раз меньше диаметра атома
– масса ядра составляет 99,4% от массы всего атома
– заряд ядра составляет 99,4% от заряда всего атома
– заряд ядра по модулю равен сумме зарядов электронов, поэтому атом в целом нейтрален.
Однако, возникли противоречия между законами классической механики и электродинамики и предложенной Резерфордом моделью атома:
1. Согласно классической механике по модели атома Резерфорда атомы должны быть неустойчивы, т.к.:
электроны движутся по орбитам с ускорением, поэтому должны излучать электромагнитные волны
излучая, должны терять энергию
в результате должны упасть на ядро
тогда атом должен прекратить свое существование.
Однако, реальные атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, не излучая электромагнитные волны.
2. По законам классической электродинамики, электрон, приближаясь к ядру, должен двигаться все быстрее, излучая все более короткие электромагнитные волны, поэтому спектр излучения атома должен быть сплошным.
Однако, у реальных атомов спектр излучения является линейчатым.
Вспомни тему “Атомная физика” за 9 класс:
Радиоактивность.
Радиоактивные превращения.
Состав атомного ядра. Ядерные силы.
Энергия связи. Дефект масс.
Деление ядер урана.
Ядерная цепная реакция.
Ядерный реактор.
Термоядерная реакция.
Другие страницы по теме “Атомная физика” за 10-11 класс:
Строение атома
Квантовые постулаты Бора
Методы регистрации частиц
Естественная радиоактивность
Радиоактивный распад
Закон радиоактаивного распада
Ядерные силы
Открытие электрона
Открытие протона
Открытие нейтрона
Строение ядра атома
Изотопы
Энергия связи ядра
Ядерные реакции
Деление ядер урана. Цепная реакция
Цепная реакция
Ядерный реактор. Атомная бомба
Термоядерная реакция
Водородная бомба
Топливные ресурсы. Ядерная энергетика
А ЗНАЕТЕ ЛИ ВЫ?
Атом – именно это понятие было введено древнегреческим ученым Левкиппом для обозначения мельчайших единиц бытия.
____
Демокрит – один из основателей античной атомистики считал, что атомы – это неделимые материальные геометрические тела, вечные, неразрушимые, непроницаемые, различаются формой, положением в пустоте, величиной. По Демокриту атомы неделимы физически, но мысленно в них можно выделить части – точки, которые нельзя отторгнуть, они не имеют своего веса, но они тоже являются протяженными. Это минимальная величина, дальше неделимая, мысленная часть атома – “амера” (бесчастная). В самом мелком атоме, по мнению Демокрита, было семь амер: верх, низ, левое, правое, переднее, заднее, середина.
____
В 1903 году английский физик Джозеф Джон Томсон разработал “модель атома”, согласно которой атом – “сфера однородной положительной электризации”, в которую вкраплено определенное количество электронов, нейтрализующих положительный заряд. Эту модель сравнили с одним из традиционных атрибутов Англии – с пудингом. Электроны подобны изюминкам в пудинге.
Эту модель сравнили с одним из традиционных атрибутов Англии – с пудингом. Электроны подобны изюминкам в пудинге.
____
Английский физик Э. Резерфорд в 1911 году уже знал это, но на Сольвеевском конгрессе в Брюсселе промолчал, так как это свидетельствовало о катастрофе. Через два года он получил пакет от датского физика Нильса Бора из Копенгагена, который подтвердил правильность его открытия. Их современник, оценивая сложившуюся ситуацию, писал: “Это было так, точно из-под ног ушла земля, и нигде не было видно твердой почвы, на которой можно было строить…”.
Речь идет о планетарной модели атома Э. Резерфорда и об открытиях Н. Бора, все это свидетельствовало о катастрофе классической физики!
___
Нильс Бор писал: «Перед нами – безумная теория. Вопрос в том, достаточно ли она безумна, чтобы быть верной?»
Тайна материи
К тому времени, когда физики (включая Мари Кюри, Эрнеста Резерфорда и Альберта Эйнштейна) собрались на Сольвеевскую конференцию 1911 года, у них был новый насущный вопрос, на который нужно было ответить: что внутри атома? НАЖМИТЕ ДЛЯ УВЕЛИЧЕНИЯ
J.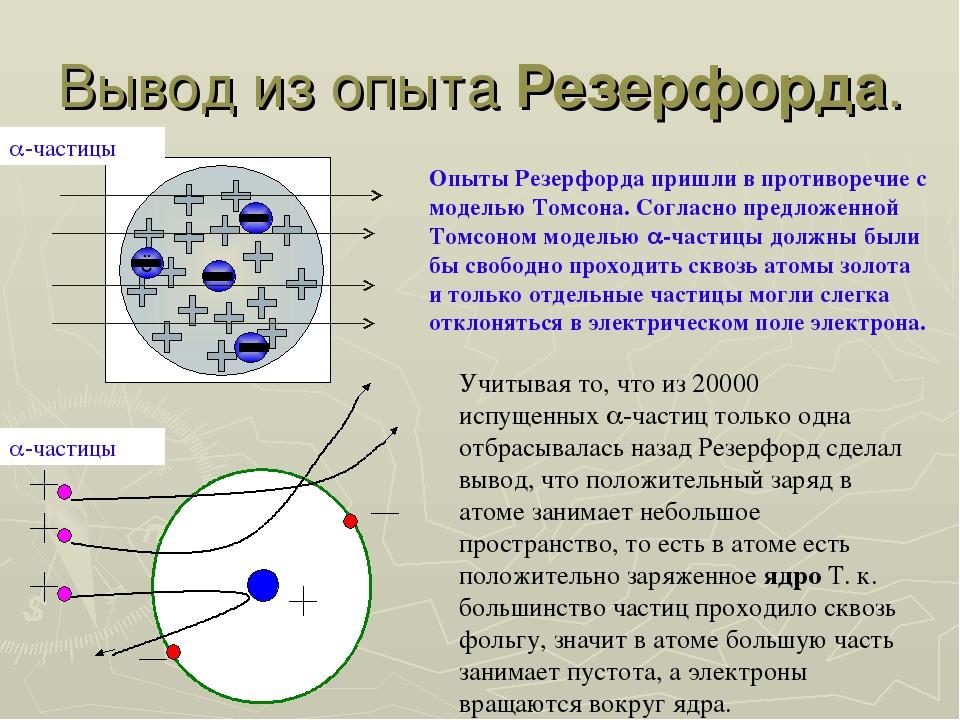 J. Томсон из Кембриджского университета открыл электрон в 1897 году, положив начало гонке за остальными частями атома.
J. Томсон из Кембриджского университета открыл электрон в 1897 году, положив начало гонке за остальными частями атома.
Открытие Томсоном электрона произошло в результате его исследования трубки Крукса, ранней версии электронно-лучевых трубок, которые позже стали широко использоваться в телевизорах.Электрический ток излучал свечение, проходя от катода на одном конце к аноду на другом. Томсон обнаружил, что даже когда он использовал разные металлы для катода, полученные электроны всегда были одинаковыми – это признак того, что электрон был частью каждого атома.
Изучение Мари Кюри любопытных лучей, исходящих от урана, привело к открытию радиоактивности и двух новых элементов: полония и радия. Фото: ACJC
Открытие Мари и Пьера Кюри того, что радий светится в темноте, привело к осознанию того, что радиоактивность – это атомы, разваливающиеся на части и выделяющие энергию.Это означало, что внутри должны быть более мелкие части, которые все еще ждут открытия. Фотография: ACJC .
Фотография: ACJC .
В 1910 году Резерфорд и двое его аспирантов использовали радиоактивные альфа-частицы, чтобы сделать удивительное открытие о структуре атома.
Видение атома Резерфордом: плотное ядро, называемое ядром, содержащее положительный заряд атома и большую часть его массы, окруженное крошечными отрицательно заряженными электронами, вращающимися по орбите на гораздо большем расстоянии от ядра, чем предполагает этот рисунок.
В 1913 году физик Гарри Мозли обнаружил простую связь между рентгеновским спектром элемента и его атомным номером. Это привело к открытию положительно заряженной частицы, называемой протоном, и осознанию того, что каждый элемент определяется числом протонов в его ядре: его атомным номером.
Манчестерская физическая лаборатория Резерфорда включала одну из лучших групп ученых, когда-либо собранных в одном месте.Наряду с Гарри Мозли в их число входили Ханс Гейгер (изобретатель счетчика Гейгера), Чарльз Г. Дарвин (внук великого биолога) и Джеймс Чедвик, получивший Нобелевскую премию за открытие нейтрона. НАЖМИТЕ ДЛЯ УВЕЛИЧЕНИЯ
Дарвин (внук великого биолога) и Джеймс Чедвик, получивший Нобелевскую премию за открытие нейтрона. НАЖМИТЕ ДЛЯ УВЕЛИЧЕНИЯ
Открытия Мозли и Резерфорда подняли загадочный вопрос об атоме: почему атомный вес элементов возрастает намного быстрее, чем их атомные номера? Загадка была решена после открытия Джеймсом Чедвиком нейтрона в 1932 году.
Используя нейтроны для бомбардировки атомов урана, итальянский физик Энрико Ферми обнаружил, по его мнению, первые элементы, помимо урана. За это он получил Нобелевскую премию 1938 года.
Четыре немецких ученых, включая давних сотрудников Отто Хана и Лизу Мейтнер, обнаружили, что Ферми фактически разделил уран пополам на гораздо более легкие элементы – результат, который почти никто не считал возможным.
По иронии судьбы, в определенном смысле открытие атомной структуры подтвердило правоту древних греков: на самом деле материя состоит всего из нескольких вещей в сочетании – не воздуха, воды, земли и огня, а протонов, нейтронов и электронов.
Неизменный, неделимый атом
Один из самых глубоких сдвигов в нашем понимании материи произошел за 40-летний период, начавшийся на пороге 20-го века. До этого момента почти все ученые придерживались двух непоколебимых убеждений о материи:
- Во-первых, атомы были самыми маленькими единицами материи. У каждого элемента в Периодической таблице был свой уникальный вид атома – это то, что отличает один элемент от другого.Большинство химиков считали, что более тонкой резки не существует. Действительно, само слово «атом» происходит от греческого atomos , что означает «неразрезанный».
- Во-вторых, эти атомы были стабильными и постоянными. Древняя мечта алхимика превратить один элемент в другой была изгнана раз и навсегда. Теперь химики были уверены, что элементы были и всегда будут одинаковыми – навсегда закрепленными.
Однако к концу этого 40-летнего периода серия быстрых открытий, сделанных учеными по всей Европе, разрушила оба этих фундаментальных принципа. Неизменный, неделимый атом был развенчан. На его место пришла радикально новая точка зрения, согласно которой материя была более податливой, более нестабильной и более могущественной.
Неизменный, неделимый атом был развенчан. На его место пришла радикально новая точка зрения, согласно которой материя была более податливой, более нестабильной и более могущественной.
Томсон обнаруживает электрон
Первый намек на то, что этот вопрос все еще может преподносить сюрпризы, был сделан в 1897 году, когда физик Дж. Дж. Томсон из Кембриджского университета Англии обнаружил то, что казалось немыслимо маленькой частицей. Томсон намеревался изучить электрические лучи, которые проходят через стеклянное устройство, называемое трубкой Крукса, освещая дальний конец таким образом, что это приводило в восторг толпу, до сих пор непонятную электричеством.Когда Томсон поднес магнит к трубе, он увидел, что он искривляет траекторию луча. Он понял, что электричество должно состоять из отрицательно заряженных частиц, которые вскоре стали называть «электронами». Но Томсон понял, что электрон – это не просто единица электричества, потому что даже когда он использовал разные металлы для генерации лучей, полученные электроны всегда были одинаковыми. Его смелый вывод заключался в том, что электрон должен составлять крошечный кусочек каждого атома – почти в две тысячи раз меньше, чем самый маленький атом.
Его смелый вывод заключался в том, что электрон должен составлять крошечный кусочек каждого атома – почти в две тысячи раз меньше, чем самый маленький атом.
Электрон Томсона был настолько диковинным, что многие ученые поначалу отказывались верить в существование чего-либо столь крошечного. Но уже в следующем году открытия, которые начали сыпаться из лабораторий Мари и Пьера Кюри, начали переломить ситуацию.
Мария Кюри и радиоактивность
Марии Склодовской запретили учиться в университете в ее родной Польше, поэтому она приехала изучать естественные науки в одно из немногих мест в мире, где она могла бы это сделать: в Париже.Вскоре после окончания Сорбонны она познакомилась и вышла замуж за французского физика по имени Пьер Кюри. После рождения первого ребенка она намеревалась стать первой женщиной-ученым, получившей докторскую степень во Франции. Нуждаясь в теме для своей диссертации, она рассматривала рентгеновские лучи, которые только что были открыты и были предметом разговоров в научном мире. Но вместо этого Мари предпочла сосредоточиться на другом недавно открытом луче, испускаемом элементом уран.
Но вместо этого Мари предпочла сосредоточиться на другом недавно открытом луче, испускаемом элементом уран.
Подобно рентгеновским лучам, «урановые лучи» могли проникать сквозь толстую черную бумагу и создавать изображение на фотопластинке; они также «ионизировали» воздух вокруг себя, делая воздух лучше проводником электричества.Используя изящные инструменты, изобретенные Пьером, Мари тщательно проверила все другие известные элементы, чтобы увидеть, обладает ли какой-либо из них аналогичными способностями. В начале 1898 года она обнаружила, что торий ведет себя точно так же. Поскольку это свойство не ограничивалось ураном, ему требовалось новое название. Мари назвала это «радиоактивностью». Она продолжила использовать радиоактивность, чтобы идентифицировать два новых элемента: полоний, названный в честь ее родины, и радий.
После того, как они выделили его в достаточном количестве, Кюри обнаружили, что радий обладает еще одним загадочным свойством: он светится в темноте, казалось, вечно. Откуда взялась эта энергия? Кюри не могли принять решение, но их открытия побудили других во всем мире сделать вывод, что энергия возникла в результате распада атомов. Атом радия разрушался, выплевывая части себя и генерируя при этом энергию. Эта теория имела глубокий смысл: если радиоактивность – это распад атомов, то атомы должны иметь частей. Внутри должны быть более мелкие детали, которые все еще ждут открытия. Благодаря Кюри перед учеными возник новый неотложный вопрос: что находится внутри атома?
Откуда взялась эта энергия? Кюри не могли принять решение, но их открытия побудили других во всем мире сделать вывод, что энергия возникла в результате распада атомов. Атом радия разрушался, выплевывая части себя и генерируя при этом энергию. Эта теория имела глубокий смысл: если радиоактивность – это распад атомов, то атомы должны иметь частей. Внутри должны быть более мелкие детали, которые все еще ждут открытия. Благодаря Кюри перед учеными возник новый неотложный вопрос: что находится внутри атома?
В свете открытий Кюри невероятно крошечный электрон Томсона внезапно обрел смысл: это была часть атома.Теперь началась гонка, чтобы обнаружить остальные части атома и понять, как они подходят друг другу.
Резерфорд обнаруживает ядро
К 1910 г. считалось общепризнанным, что Дж. Дж. Крошечный отрицательно заряженный электрон Томсона был частью атома. Но это оставило без ответа два больших вопроса: поскольку большинство атомов электрически нейтральны, где в атоме положительные заряды, необходимые для компенсации отрицательных электронов? А поскольку электроны составляют лишь крошечную его часть, где же остальная масса атома?
Одним из ученых, работавших над ответом на эти вопросы, был физик Эрнест Резерфорд из Манчестерского университета в Англии. Резерфорд уже получил Нобелевскую премию за открытие, что атомы радия при распаде выделяют различные виды частиц (альфа и бета). Теперь он попросил двух своих аспирантов, Эрнеста Марсдена и Ханса Гейгера, использовать альфа-частицы для исследования структуры атома. Они направили луч альфа-частиц на ультратонкий лист золотой фольги. Большую часть времени альфа-частицы проходят сквозь него. Но время от времени один из снарядов отскакивал практически прямо им в лицо.«Это было самое невероятное, что когда-либо случалось со мной», – вспоминает Резерфорд. «Это было почти так, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас!»
Резерфорд уже получил Нобелевскую премию за открытие, что атомы радия при распаде выделяют различные виды частиц (альфа и бета). Теперь он попросил двух своих аспирантов, Эрнеста Марсдена и Ханса Гейгера, использовать альфа-частицы для исследования структуры атома. Они направили луч альфа-частиц на ультратонкий лист золотой фольги. Большую часть времени альфа-частицы проходят сквозь него. Но время от времени один из снарядов отскакивал практически прямо им в лицо.«Это было самое невероятное, что когда-либо случалось со мной», – вспоминает Резерфорд. «Это было почти так, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас!»
В конце 1910 года Резерфорд однажды пришел в лабораторию и объявил, что знает, что означает этот удивительный результат: атом должен быть в основном пустым пространством, но иметь невероятно плотный твердый центр. В результате работы Резерфорда появилось совершенно новое видение атома. Его положительный заряд и почти вся масса были сосредоточены в крошечном центральном ядре – ядре. А вокруг ядра на большом расстоянии в масштабе атома кружились отрицательно заряженные электроны.
А вокруг ядра на большом расстоянии в масштабе атома кружились отрицательно заряженные электроны.
“Одна из самых замечательных особенностей атома заключается в том, что он в основном состоит из ничего!” говорит физик Мэрилендского университета Джим Гейтс.
«Я думаю, что ощущение в тех коридорах, лабораториях Манчестера, должно быть, вызывало большое волнение», – говорит историк Массачусетского технологического института Дэвид Кайзер. «Они почувствовали, что Резерфорд и его команда буквально открыли новый взгляд на материю.”
Мозли и атомный номер
Следующее критическое открытие атома было сделано другим членом манчестерской лаборатории Резерфорда, физиком Гарри Мозли. В 1912 году немецкие ученые обнаружили, что рентгеновские лучи можно расщеплять или «дифрагировать» на волны разной длины, точно так же, как свет можно расщеплять на разные цвета. В следующем году Мозли показал, что каждый химический элемент имеет свой собственный уникальный спектр рентгеновских лучей, аналогичный спектрам света, которые так помогли идентифицировать новые элементы с середины 1800-х годов. Что еще более удивительно, Мозли обнаружил удивительно простую взаимосвязь между рентгеновским спектром элемента и его «атомным номером».
Что еще более удивительно, Мозли обнаружил удивительно простую взаимосвязь между рентгеновским спектром элемента и его «атомным номером».
До этого атомный номер просто относился к номеру ячейки элемента в Периодической таблице. Но результаты Мозли показали, что атомный номер – это больше, чем удобная метка. Он представлял собой положительный заряд ядра атома, и он неизменно увеличивался на одно число от одного элемента к другому. Выводы Мозли заключались в том, что ядро - это не одна большая положительная капля, а набор положительно заряженных частиц, число которых увеличивается с каждым более тяжелым элементом.
Опираясь на работу Мозли, Резерфорд вскоре открыл следующую часть атома – протон – и показал, что каждый элемент Периодической таблицы определяется числом протонов в его ядре: его атомным номером. Атомный номер элемента – это то, что придает этому элементу его идентичность: добавьте еще один протон или уберите его, и вы получите другой элемент. «Мозли и атомное число – это действительно решающий момент, когда мы узнаем, что на самом деле представляет собой элемент», – говорит историк из Университета Джона Хопкинса Лоуренс Принсипи.
Чедвик обнаруживает нейтрон
Открытие Гарри Мозли важности атомного числа подняло новый тревожный вопрос об атоме: когда вы перемещаетесь по Периодической таблице, атомные номера элементов увеличиваются на одну цифру от одного элемента к другому. Водород – 1, гелий – 2, литий – 3 и т. Д. Но атомные веса элементов растут намного быстрее. Водород имеет атомный вес 1, который приходится на его одинокий протон.Гелий имеет два протона, но атомный вес четыре; литий состоит из трех протонов и имеет атомный вес 7. Разрыв между атомным номером и атомным весом становится все шире и шире. Что могло объяснить эту недостающую массу? Есть ли еще одна часть атома, которую еще предстоит открыть?
Наконец, ответ пришел в 1932 году, когда другой из «Мальчиков Резерфорда», физик Джеймс Чедвик, открыл последнюю часть атома: нейтрон. Нейтрон имеет почти такую же массу, что и протон, и оба они занимают ядро.За исключением водорода, который не содержит нейтронов, почти каждый атом имеет как минимум столько же нейтронов, сколько протонов. Эти нейтроны составляют остальную часть атомного веса каждого элемента – и они решили загадку недостающей массы. Но нейтрон, как следует из названия, электрически нейтрален, и это необычное свойство вскоре придаст ему центральную роль в событиях, которые открыли шокирующие новые вещи об атоме.
Эти нейтроны составляют остальную часть атомного веса каждого элемента – и они решили загадку недостающей массы. Но нейтрон, как следует из названия, электрически нейтрален, и это необычное свойство вскоре придаст ему центральную роль в событиях, которые открыли шокирующие новые вещи об атоме.
Расщепление атома
Как только нейтрон был открыт, ученые поняли, что это идеальный снаряд для исследования внутренностей атома.В отличие от тех положительно заряженных альфа-частиц, которые использовали Резерфорд и его ученики, нейтрон не будет отталкиваться при приближении к ядру. Поскольку у него нет заряда, он может войти прямо внутрь.
Одним из первых, кто использовал нейтрон таким образом, был итальянский физик по имени Энрико Ферми. В 1934 году Ферми начал стрелять нейтронами по атомам урана, создавая поток фрагментов, которые он затем проанализировал. Он обнаружил, что нейтрон иногда отщепляет часть ядра урана, понижая его атомный номер и превращая его в другой элемент, на несколько точек ниже в Периодической таблице.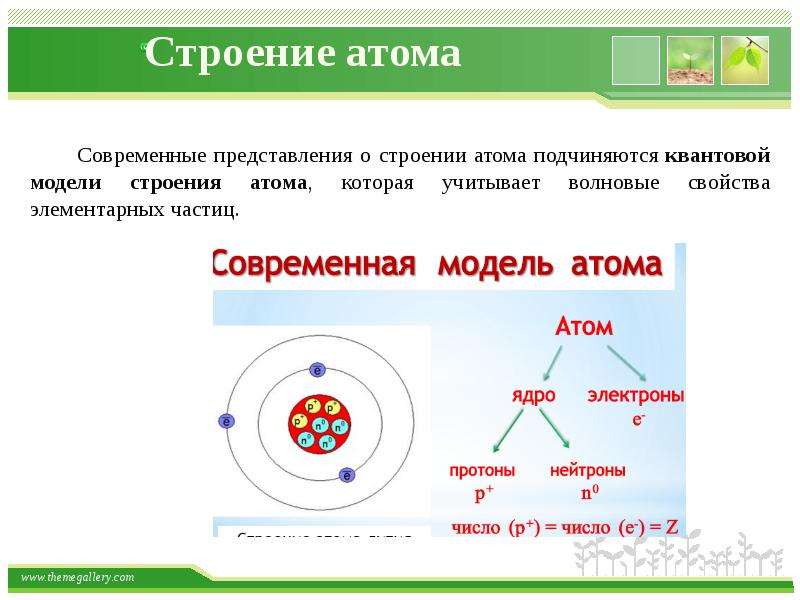 Но некоторые фрагменты Ферми не соответствовали ни одному из элементов чуть ниже урана. Он пришел к выводу, что иногда приходящий нейтрон поглощается ядром урана … а затем спонтанно превращается в протон, повышая атомный номер атома и превращая его в другой элемент на тяжелее на , чем уран.
Но некоторые фрагменты Ферми не соответствовали ни одному из элементов чуть ниже урана. Он пришел к выводу, что иногда приходящий нейтрон поглощается ядром урана … а затем спонтанно превращается в протон, повышая атомный номер атома и превращая его в другой элемент на тяжелее на , чем уран.
За открытие первых двух элементов, помимо урана, Ферми получил Нобелевскую премию в 1938 году. Но как только он пожал руку королю Швеции, немецкие ученые сделали открытие, которое докажет, что он ошибался.Химики Отто Хан и Фриц Штрассман повторили эксперименты Ферми, но вместо того, чтобы найти новые элементы тяжелее урана, они обнаружили хорошо известные элементы, которые были намного ниже в Периодической таблице – примерно вдвое тяжелее урана. Озадаченный, Хан написал своему давнему сотруднику Лизе Мейтнер, еврейскому физику, бежавшему из Германии после прихода нацистов. Мейтнер поняла, что полученные данные означают, что атом раскололся пополам, что почти никто не мог себе представить. Ее коллега Отто Фриш ввел термин, под которым мы сегодня знаем этот процесс: ядерное «деление».”
Ее коллега Отто Фриш ввел термин, под которым мы сегодня знаем этот процесс: ядерное «деление».”
Новый взгляд на материю
Огромная энергия, высвободившаяся при разделении атома, имела серьезные последствия для мира, находящегося на грани войны. Всего за шесть лет открытие ядерного деления приведет к созданию атомной бомбы. Это также нанесло бы последний удар по старому образу нерасщепляемого, изменчивого атома.
За четыре десятилетия, прошедшие с тех пор, как Дж.Дж. Томсон намеревался понять эти загадочные лучи в своей трубке Крукса, серия открытий, сделанных учеными по всей Европе, показала, что атомы не являются мельчайшими единицами материи; они не были зафиксированы навсегда.Теперь стало ясно, что внутри атомов есть более мелкие части – и что изменения в этих частях изменят идентичность самих атомов.
По иронии судьбы, эти открытия подтвердили некоторые из самых древних представлений о материи:
- Мечта алхимика превратить свинец в золото все еще не была практическим путем к богатству.
 Но было возможным для одного элемента превратиться в другой. Фактически, это все время происходит спонтанно в радиоактивных элементах.
Но было возможным для одного элемента превратиться в другой. Фактически, это все время происходит спонтанно в радиоактивных элементах. - И, несмотря на открытие многих новых элементов за эти четыре десятилетия, теперь стало ясно, что материя действительно состоит из нескольких вещей в комбинации, как это предполагали алхимики и древние греки много веков назад. Не воздух, вода, земля и огонь … а протоны, нейтроны и электроны. Вся материя состоит только из этих трех частиц, смешанных в разных соотношениях. «Удивительно, как далеко природа смогла продвинуться с этим необычным и простым рецептом», – говорит химик из Университета Брандейса Грегори Петско.
Базовая структура атома
В этой лекции вы узнаете, как была открыта каждая из этих частиц и как результаты нескольких поколений научной работы в конечном итоге привели к нашему пониманию самой фундаментальной единицы материи: атома. .
Атомы состоят из 3 типов частиц, называемых субатомными частицами: положительно заряженных протонов, отрицательно заряженных электронов и нейтронов, которые не имеют заряда.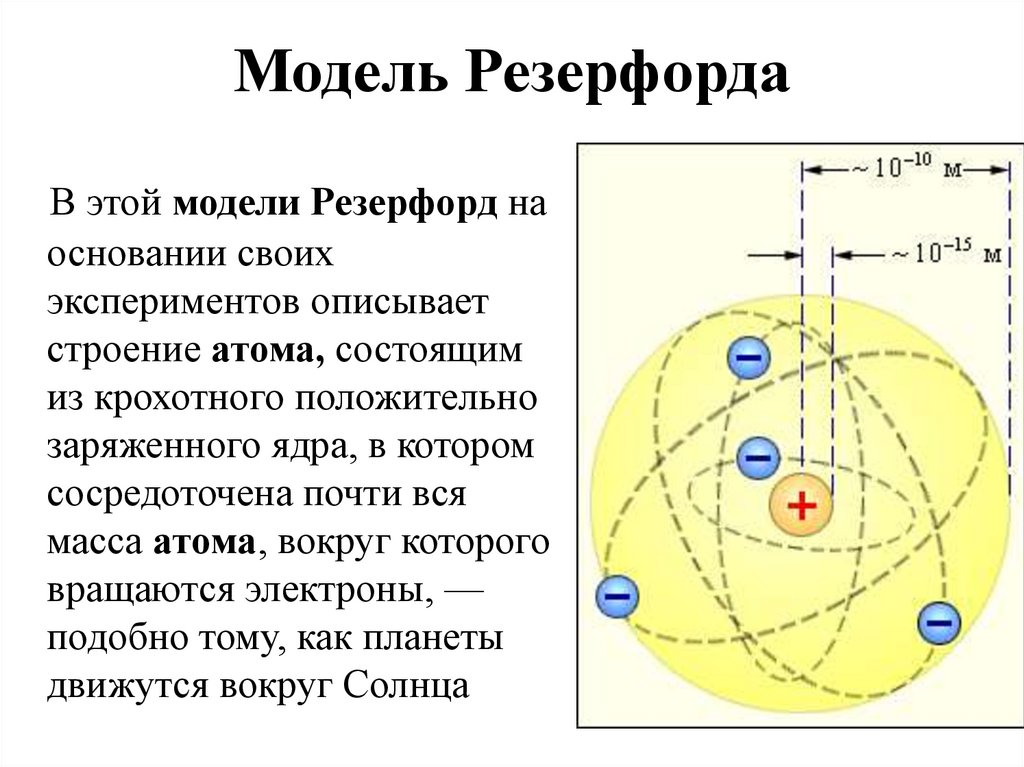 Протоны и нейтроны почти равны по массе и находятся в плотном ядре в центре атома.Но гораздо меньшие по размеру, отрицательно заряженные электроны вращаются вокруг этого ядра, уравновешивая положительный заряд, обеспечиваемый протонами.
Протоны и нейтроны почти равны по массе и находятся в плотном ядре в центре атома.Но гораздо меньшие по размеру, отрицательно заряженные электроны вращаются вокруг этого ядра, уравновешивая положительный заряд, обеспечиваемый протонами.
ИСТОКИ АТОМИЧЕСКОЙ ТЕОРИИ
- Идея атомов была впервые предложена древнегреческими философами, которые постулировали, что существует лишь горстка фундаментальных веществ, которые объединяются различными способами, образуя все остальные. Греки широко считали, что этими элементами являются воздух, вода, земля и огонь, а также считали, что частицы этих элементов абсолютно неделимы.
- Сегодня мы знаем, что ни один из них на самом деле не является элементами, и мы также знаем, что атомы истинных элементов на самом деле могут быть разделены, но при этом они превращаются в новый элемент.
 Тем не менее греческий термин «атом», означающий «неделимый», прижился и до сих пор используется для обозначения наименьшего количества данного элемента, которое может существовать.
Тем не менее греческий термин «атом», означающий «неделимый», прижился и до сих пор используется для обозначения наименьшего количества данного элемента, которое может существовать.
- Дискурс о природе материи и ее основных единицах замедлился почти до полной остановки с падением Древней Греции, и только в начале -го -го века концепция атома была возрождена, прежде всего как результат работы Джона Далтона.У Далтона не было сложных научных приборов, которыми мы пользуемся сегодня, поэтому у него не было возможности непосредственно видеть атомы или экспериментировать с ними. Однако у него был острый ум и работа Антуана Лавуазье и других.
- Используя относительно простые наблюдения, Дальтон смог сформулировать здравую атомную теорию. Он обнаружил, что когда 2 элемента объединяются в соединение, масса всех продуктов равна массам всех исходных материалов.Это закон сохранения массы.
- Он также обнаружил, что когда 2 элемента объединяются, чтобы сформировать более одного соединения, веса одного из элементов, которые объединяются с фиксированным весом другого, находятся в соотношении очень простых целых чисел.
 Это закон множественных пропорций.
Это закон множественных пропорций.
- Именно сочетание этих двух законов дало Дальтону неопровержимый аргумент в пользу существования неделимых атомов, которые объединяются в этих простых целочисленных соотношениях для образования молекул.
- Но у Дальтона не было возможности эффективно исследовать структуру предложенных им атомов. Его наблюдения доказали их существование, но они не могли точно объяснить, из чего состоят сами атомы. Нам придется подождать еще один век, прежде чем технология догонит атом, дав нам возможность изучить внутреннюю работу этого замечательного конструкта природы.
- Первым из этих достижений является электронно-лучевая трубка, которая была разработана в конце 19-го, 90-го, 18-го, 90-го века, и еще десять лет назад использовалась в телевизорах.Электронно-лучевые трубки сыграли важную роль в продвижении человеческого понимания атомов.
- Используя электронно-лучевую трубку, Дж.
 Дж. Томсон смог создать изолированные пучки чистых электронов, измерив их массу, скорость и заряд. Измерения Томсона привели его к поразительному выводу: электроны были намного меньше атомов.
Дж. Томсон смог создать изолированные пучки чистых электронов, измерив их массу, скорость и заряд. Измерения Томсона привели его к поразительному выводу: электроны были намного меньше атомов.
- Это привело Томсона к предложению первой структурной модели атома. Спустя более чем 100 лет после того, как Дальтон вновь популяризировал концепцию атомов, наконец была предложена первая попытка объяснить их структуру.Томсон постулировал, что атомы состоят из небольших отрицательно заряженных электронов, которые он наблюдал, – заключенных в положительно заряженную сферическую матрицу с очень низкой плотностью, составляющую остальную часть его массы.
- Набросок этой модели с электронами, присыпанными на положительно заряженной сфере, вызывает образы изюма в миске с пудингом, за что она получила прозвище модели сливового пудинга Томсона.
- Но эта первая попытка объяснить атомную структуру была недолгой, потому что менее чем через два десятилетия после того, как Томсон предложил модель сливового пудинга, его протеже Эрнест Резерфорд провел эксперимент, который должен был основываться на модели Томсона, но вместо этого опроверг ее.
 .
.
- Резерфорду приписывают открытие так называемых альфа-частиц, которые представляют собой гораздо более крупные заряженные частицы (более чем в 1000 раз больше, чем электроны), созданные во время радиоактивного распада урана. Но Резерфорд наиболее известен не тем, что открыл эти частицы, а тем, что он сделал с ними в следующий раз.
- Резерфорду было любопытно узнать, как эти относительно большие энергичные частицы будут взаимодействовать с атомами, когда они проходят через тонкую фольгу, поэтому он направил луч альфа-частиц на кусок золотой фольги, окружающий фольгу на специальном флуоресцентном экране. который загорится при ударе альфа-частицы.Если предположить, что модель Томсона верна, ожидалось, что альфа-частицы просто пройдут через фольгу, рассеиваясь лишь незначительно, если вообще рассеиваясь.
- По мере продвижения эксперимента он заметил, что самое яркое пятно находилось прямо за золотой фольгой, как он и ожидал.
 Но Резерфорд был ошеломлен, когда он обратил свое внимание на другую сторону экрана и увидел, что несколько частиц отклоняются почти прямо обратно к источнику.
Но Резерфорд был ошеломлен, когда он обратил свое внимание на другую сторону экрана и увидел, что несколько частиц отклоняются почти прямо обратно к источнику.
- Очевидно, что модель Томсона не была правильной.Если бы масса атомов золота была распределена по всему их объему, то альфа-частица не могла бы отразиться обратно к источнику.
- Результаты Резерфорда убедительно показали, что атомы состоят в основном из пустого пространства с высококонцентрированным ядром, содержащим большую часть своей массы лишь в небольшой части общего объема атома. Это могло бы объяснить, почему в редких случаях альфа-частица отскакивала обратно. Только чрезвычайно плотная точка вещества, занимающая небольшой объем атома, могла бы выдержать удар альфа-частицы и заставить ее рикошетить обратно в исходном направлении.
- Итак, в центре атомов должна была быть чрезвычайно плотная, но исчезающе маленькая точка массы. Тогда Резерфорд понял, что атомы в основном состоят из пустого пространства с плотной точкой массы в центре.
 Его модель, объясняющая это, получила название модели Резерфорда, иногда также называемой ядерной моделью, потому что она первая признает, что большая часть массы атома находится в маленьком плотном ядре в его центре.
Его модель, объясняющая это, получила название модели Резерфорда, иногда также называемой ядерной моделью, потому что она первая признает, что большая часть массы атома находится в маленьком плотном ядре в его центре.
- Резерфорд обнаружил, что атомы состоят из плотного положительно заряженного ядра, окруженного очень легкими отрицательно заряженными электронами.В то время как атомы имеют диаметр около 100 пикометров, или около одной десятой нанометра, работа Резерфорда в конечном итоге привела к открытию, что радиус типичного ядра составляет всего около 1/100 000 от радиуса его электронного облака, то есть 1 фемтометр. , или 0,000001 нм.
- Резерфорд определил, что массивные положительно заряженные частицы сосредоточены в ядре атома. Были открыты протоны.
- По мере продолжения исследований радиоактивности были некоторые наблюдения об атомных ядрах, которые не складывались.В частности, исследователи облучили бериллий альфа-частицами, чтобы произвести новый вид излучения – тот, который не отскакивал от ядер, как альфа-частицы Резерфорда, а вместо этого врезался в них с силой, выбивая протоны из атомов-мишеней.

- Окончательный ключ к пониманию этих необычных наблюдений пришел в 1932 году, когда Джеймс Чедвик, бывший ученик одного из ассистентов Резерфорда, завершил инвентаризацию субатомных частиц. Чедвик рассуждал, что излучение бериллия могло лучше проникать в другие атомные ядра, потому что оно было незаряженным.
- В то время как альфа-частицы, используемые Резерфордом, несли положительный заряд и отталкивались положительными ядрами атомов, с которыми они столкнулись, отправляя их обратно, эти новые частицы, хотя и массивные, должны быть незаряженными.
- Отсутствие электростатического отталкивания позволило этим новым частицам поразить другие ядра с большой силой – силой, которую Чедвик использовал для оценки массы одной из этих новых частиц, которую он назвал нейтронами. Неудивительно, что они были всего на долю процента больше протонов.
- Поскольку протоны и нейтроны очень похожи по массе и составляют почти всю массу атома, химики используют единицу массы, называемую атомной единицей массы (а.
 е.м.), для сравнения масс атомов друг с другом.
е.м.), для сравнения масс атомов друг с другом.
- К 1932 году объединенная мысль древних греков, Далтона, Томсона, Резерфорда, Чедвика и многих других привела нас к пониманию атомной структуры, которая выглядит примерно так, как мы видим сегодня в популярных изображениях атома.
- Все атомы состоят из плотного центрального ядра вещества, называемого ядром. В этом ядре находится один или несколько протонов. В случае с водородом он всего один. Атом элемента водорода – простейший атом.
- Вокруг этого плотного положительно заряженного ядра находятся электроны. В случае с водородом только один электрон уравновешивает положительный заряд протона в ядре. Это законченный атом водорода с ядром и электронным облаком вокруг него.Мы иногда называем эту версию водорода протием, потому что его ядро содержит только один протон.
- Число протонов в ядре – это то, что придает элементам идентичность, поэтому мы можем добавить нейтрон к атому водорода и все еще иметь водород.
 Но это делает атом водорода примерно вдвое больше его первоначальной массы. Мы называем этот тип водорода, в котором также присутствует нейтрон, что делает его более массивным, – дейтерием.
Но это делает атом водорода примерно вдвое больше его первоначальной массы. Мы называем этот тип водорода, в котором также присутствует нейтрон, что делает его более массивным, – дейтерием.
- Мы можем снова увеличить массу атома водорода, добавив еще один нейтрон, чтобы получить тритий – еще одну форму водорода, которая в 3 раза больше массы его простейшей формы.Все три атома являются водородом, но отличаются массой. Мы называем эти атомы изотопами друг друга.
- Если мы добавим еще один протон к ядру атома и еще один электрон к его облаку, чтобы сбалансировать заряд, у нас теперь есть новый элемент, потому что количество протонов в ядре изменилось.
- Мы можем оценить атомную массу элементарного изотопа, просто сложив количество протонов и нейтронов в конкретном изотопе.
- Есть много элементов, которые существуют в природе в виде двух или более изотопов. Фактически, большинство из них. В этом случае периодическая таблица указывает среднюю массу данного элемента в природе.

- Когда количество протонов и электронов не сбалансировано, мы создаем частицы, которые несут общий общий заряд. Эти заряженные частицы могут иметь свойства, резко отличающиеся от свойств соответствующих нейтральных атомов.
- Эти заряженные атомы называются ионами. В общем, если есть избыточные электроны, мы получаем отрицательно заряженный ион, называемый анионом. Если вместо этого имеется избыток протонов, мы получаем положительно заряженный ион, называемый катионом.
1 Если отрицательно заряженные электроны притягиваются к положительно заряженным атомным ядрам, что удерживает электронное облако атома или иона от коллапса?
2 Сколько нейтронов, протонов и электронов в следующих атомах и ионах?
a Атом плутония 244
b Ион оксида (O2-), полученный из наиболее распространенного изотопа кислорода
ответов
2а) 94 протона, 150 нейтронов, 94 электрона;
2b) 8 протонов, 8 нейтронов, 10 электронов.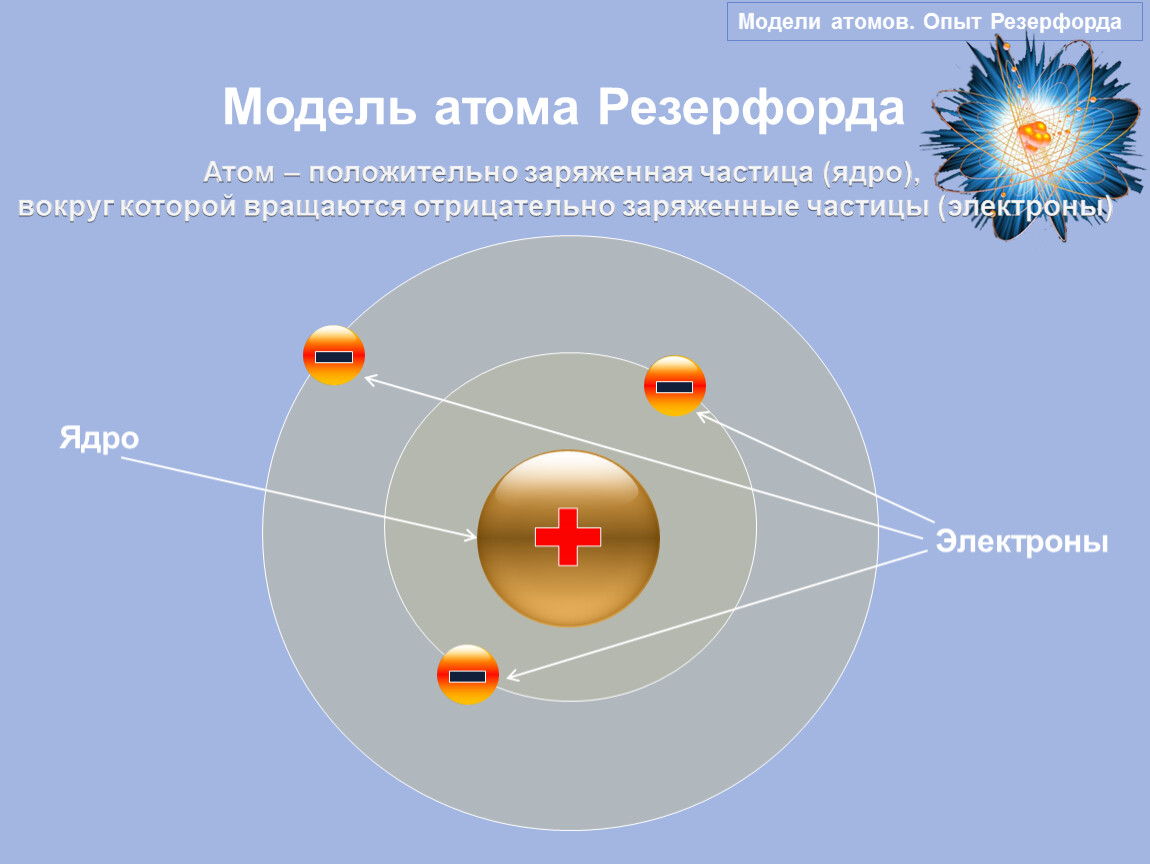
Из серии лекций «Химия и наша Вселенная»
Преподавал профессор Рон Б. Дэвис-младший, доктор философии
вопросов и ответов – Если в мире нет возможности увидеть атом, то как мы узнаем, что атом состоит из протонов, электронов, нейтронов, ядра и электронного облака?
Если в мире нет возможности увидеть атом, то как мы узнаем, что атом состоит из протонов, электронов, нейтронов, ядра и электронного облака?
Ученые доказали существование этих субатомных частиц тремя способами.Это прямое наблюдение, косвенное наблюдение или предполагаемое присутствие и предсказания на основе теории или предположений.
Ученые 1800-х годов смогли многое сделать о субатомном мире на основе химии. Великая Периодическая таблица элементов Менделеева дала ученым две очень важные вещи. Регулярность таблицы и наблюдаемые комбинации химических соединений побудили некоторых ученых сделать вывод, что атомы обладают регулярными повторяющимися свойствами и, возможно, имеют схожие структуры. Ученые сделали множество предположений и некоторых теоретических предсказаний о том, какова на самом деле природа атомной структуры. Было обнаружено, что веса элементов увеличиваются по мере того, как элементы продвигаются по периодической таблице, и, похоже, существует число, называемое атомным номером, которое объясняет обычные химические свойства. Еще одна важная вещь, которую сделала диаграмма, заключалась в том, чтобы помочь химикам предсказать элементы, которые они не нашли. Этот бизнес по заполнению дыр продолжается и сегодня, поскольку каждые несколько лет в конец таблицы добавляются новые элементы.Многому удалось научиться с помощью логики и разума, правильно собирая предыдущие знания. Бреши в этих знаниях были заполнены умозаключениями, предположениями и открытиями.
Ученые сделали множество предположений и некоторых теоретических предсказаний о том, какова на самом деле природа атомной структуры. Было обнаружено, что веса элементов увеличиваются по мере того, как элементы продвигаются по периодической таблице, и, похоже, существует число, называемое атомным номером, которое объясняет обычные химические свойства. Еще одна важная вещь, которую сделала диаграмма, заключалась в том, чтобы помочь химикам предсказать элементы, которые они не нашли. Этот бизнес по заполнению дыр продолжается и сегодня, поскольку каждые несколько лет в конец таблицы добавляются новые элементы.Многому удалось научиться с помощью логики и разума, правильно собирая предыдущие знания. Бреши в этих знаниях были заполнены умозаключениями, предположениями и открытиями.
Другие ученые, изучающие эффекты разряда электричества в газах, сделали несколько прямых открытий. J.J. Томпсон был первым, кто заметил и понял маленькие частицы, называемые электронами. Они были названы катодными лучами, потому что они исходили от катода или отрицательного электрода этих газоразрядных трубок. Было быстро выяснено, что электроны могут быть преобразованы в лучи и преобразованы в изображения, которые в конечном итоге станут телевизионными.Электроны также могут производить что-то еще. Рентген открыл рентгеновские лучи в 1895 году. Его открытие было побочным продуктом изучения электронов. Протоны также можно было наблюдать напрямую, а также ионы в виде «анодных» лучей. Эти положительные частицы составляли другую половину атомного мира, которую химики уже разработали. Химики измерили массу или вес элементов. Периодическая диаграмма и химические свойства доказали, что существует также атомный номер. Этот атомный номер в конечном итоге был идентифицирован как заряд ядра или количество электронов, окружающих атом, которое почти всегда находится в нейтральном или сбалансированном состоянии.
Было быстро выяснено, что электроны могут быть преобразованы в лучи и преобразованы в изображения, которые в конечном итоге станут телевизионными.Электроны также могут производить что-то еще. Рентген открыл рентгеновские лучи в 1895 году. Его открытие было побочным продуктом изучения электронов. Протоны также можно было наблюдать напрямую, а также ионы в виде «анодных» лучей. Эти положительные частицы составляли другую половину атомного мира, которую химики уже разработали. Химики измерили массу или вес элементов. Периодическая диаграмма и химические свойства доказали, что существует также атомный номер. Этот атомный номер в конечном итоге был идентифицирован как заряд ядра или количество электронов, окружающих атом, которое почти всегда находится в нейтральном или сбалансированном состоянии.
В 1911 году Резерфорд доказал существование ядра. Он делал это напрямую, стреляя альфа-частицами в другие атомы, такие как золото, и наблюдал, что иногда они отскакивают назад тем же путем, которым пришли. Это никак не могло быть объяснено нынешней картиной атома, который считался однородной смесью. Резерфорд непосредственно доказал экспериментами по рассеянию, что в центре было что-то тяжелое и твердое. Ядро было обнаружено. Около 20 лет считалось, что ядро состоит из количества протонов, равного атомному весу, и нескольких электронов для уменьшения заряда, поэтому атомный номер оказался правильным.Это очень тревожило многих ученых. Были прогнозы и догадки, что чего-то не хватает.
Это никак не могло быть объяснено нынешней картиной атома, который считался однородной смесью. Резерфорд непосредственно доказал экспериментами по рассеянию, что в центре было что-то тяжелое и твердое. Ядро было обнаружено. Около 20 лет считалось, что ядро состоит из количества протонов, равного атомному весу, и нескольких электронов для уменьшения заряда, поэтому атомный номер оказался правильным.Это очень тревожило многих ученых. Были прогнозы и догадки, что чего-то не хватает.
В 1932 году Чедвик обнаружил, что тяжелая нейтральная частица испускается некоторыми радиоактивными атомами. Эта частица была примерно той же массы, что и протон, но не имела электрического заряда. Это был «недостающий кусок» (знаменитые последние слова). Ядро теперь можно было бы гораздо лучше объяснить, используя нейтроны и протоны для определения атомного веса и атомного номера. Это позволило лучше понять атомный мир.Теперь вокруг ядра были электроны, равные атомному номеру, состоящие из нейтронов и протонов.
Рентген г-на Рентгена позволил ученым измерить размер атома. Рентгеновские лучи были достаточно маленькими, чтобы различить атомные облака. Это было сделано путем рассеяния рентгеновских лучей на атомах и измерения их размера, как это сделал Резерфорд ранее, столкнув атомы с другими ядрами, начиная с альфа-частиц.
1930-е годы были также временем изобретения и использования первых практических ускорителей частиц.Эти ранние машины создавали пучки протонов. Эти лучи можно использовать для измерения размера атомного ядра. И поиск продолжается сегодня. Ученые все еще заполняют недостающие части в мире элементарных частиц. Где это закончится? Примерно в 1890 году ученые оплакивали смерть физики и размышляли о жизни, сводящейся к измерению следующего десятичного знака! Открытия, сделанные в 1890-х годах, доказали, что поверхность была только поцарапана. В каждом десятилетии 1900-х границы сдвигались к все меньшим и меньшим объектам.Взрыв знаний не замедлился, и по мере того, как каждый порог был пройден, количество новой науки кажется больше, даже когда мы исследуем меньшие измерения. Текущие теории (если они верны) подразумевают, что за следующим горизонтом ожидает открытия еще больше.
Текущие теории (если они верны) подразумевают, что за следующим горизонтом ожидает открытия еще больше.
Автор:
Пол Бриндза, руководитель экспериментального зала, руководитель отдела дизайна (Другие ответы Пол Бриндза)
Связанные страницы:
Как люди действительно узнают, что атомы существуют, даже если они их не видят?
Какой пример косвенного доказательства, которое ученые используют для изучения атома?
Новое, «экзотическое состояние материи», обнаруженное в атомах
Атомы, имеющие решающее значение для свойств материи, широко известны как строительные блоки вселенной.Возвращаясь к урокам естествознания в начальной школе, вы могли вспомнить, что атомы состоят из положительно заряженных протонов, нейтральных нейтронов и отрицательных электронов. Но, условно говоря, между этими субатомными частицами очень много пустого пространства.
Электроны обычно вращаются по орбите далеко от центра своего атомного ядра. Если эти строительные блоки могут быть заполнены таким большим количеством пустого пространства, группа ученых из Венского технологического университета и Гарвардского университета хотела посмотреть, можно ли заполнить эту пустоту чем-то еще, например, другими атомами.(По теме: «Как студент сфотографировал одиночный атом»)
Если эти строительные блоки могут быть заполнены таким большим количеством пустого пространства, группа ученых из Венского технологического университета и Гарвардского университета хотела посмотреть, можно ли заполнить эту пустоту чем-то еще, например, другими атомами.(По теме: «Как студент сфотографировал одиночный атом»)
Сколько планет в солнечной системе? Как он образовался в галактике Млечный Путь? Узнайте факты о происхождении Солнечной системы, а также о ее планетах, лунах и астероидах.
Вместе с Ридом (атом Берга)В квантовой физике ученые могут создавать ридберговские атомы, в которых один или несколько высоковозбужденных электронов вращаются вдали от ядра. (Связано: «Жуткая квантовая запутанность выявляет невидимые объекты»)
«Среднее расстояние между электроном и его ядром может достигать нескольких сотен нанометров – это более чем в тысячу раз больше радиуса атома водорода», Йохим Бургдёрфер, директор Института теоретической физики Венского технологического университета, сообщает в пресс-релизе.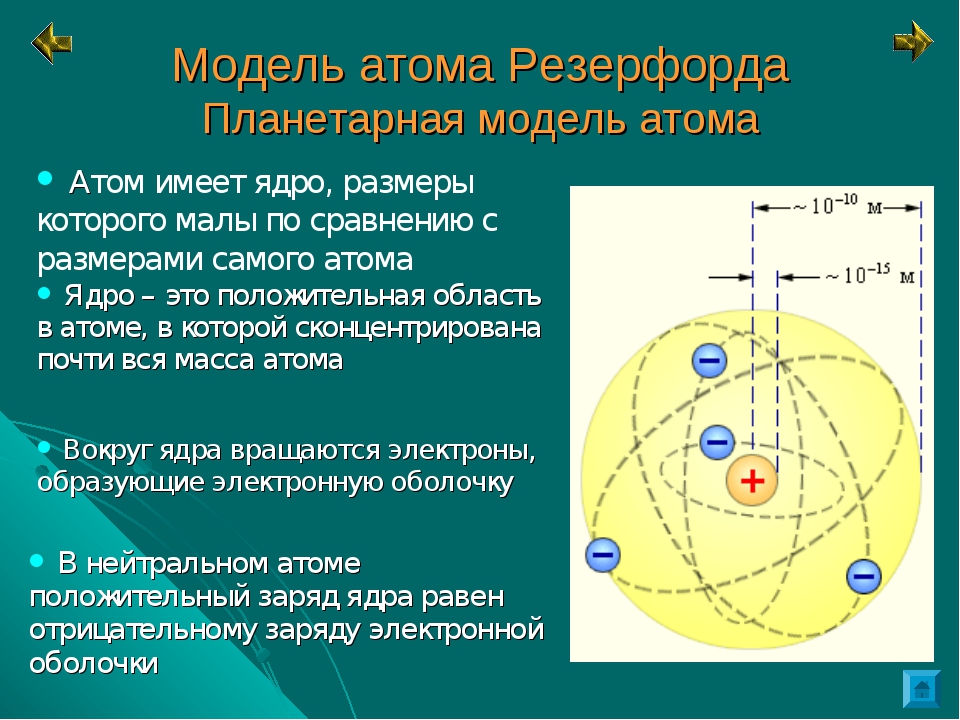
Итак, в этом новом исследовании, опубликованном в Physical Review Letters , исследователи создали конденсат Бозе-Эйнштейна из атомов стронция, охлаждая разбавленный газ бозонов, тип субатомных частиц, как можно ближе к абсолютному нулю. . Затем с помощью лазера они передали энергию одному из этих атомов, превратив его в ридберговский атом с большим атомным радиусом. Этот радиус был больше нормального расстояния между двумя атомами в конденсате.
Оказывается, нейтральные атомы практически не влияют на более широкий путь электронов этого ридберговского атома из-за отсутствия заряда.Но электрон по-прежнему улавливает рассеянные нейтральные атомы на своем пути, что не позволяет ему перейти в другое состояние вещества.
Компьютерное моделирование показывает, что это взаимодействие является слабым, уменьшая энергию системы и создавая связь между ридберговскими атомами и другими атомами в пределах электронной орбиты.
«Это в высшей степени необычная ситуация», – сказал Шухей Йошида, профессор Университета Вены, который также принимал участие в исследовании. «Обычно мы имеем дело с заряженными ядрами, связывающими электроны вокруг себя.Здесь у нас есть электрон, связывающий нейтральные атомы ».
«Обычно мы имеем дело с заряженными ядрами, связывающими электроны вокруг себя.Здесь у нас есть электрон, связывающий нейтральные атомы ».
Это новое экзотическое состояние вещества, получившее название ридберговских поляронов, может происходить только при низких температурах. Частицы движутся быстрее, и связь разрывается по мере нагрева.
« Ибо Для нас это новое, слабо связанное состояние материи представляет собой захватывающую новую возможность исследования физики ультрахолодных атомов, – продолжает Бургдёрфер. – Таким образом можно исследовать свойства конденсата Бозе-Эйнштейна в очень малых масштабах с очень высокой точностью.”
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права.Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
1/12
1/12
Составное изображение галактики Мессье 81 (M81) показывает то, что астрономы называют спиральной галактикой «грандиозного дизайна», где каждое из ее рукавов полностью закручено вниз. центр.M81, расположенная примерно в 12 миллионах световых лет от нас в созвездии Большой Медведицы, является одной из самых ярких галактик, видимых в телескоп с Земли.
Составное изображение галактики Мессье 81 (M81) показывает то, что астрономы называют спиральной галактикой «грандиозного дизайна», где каждое из ее рукавов полностью закручено в центр. M81, расположенная примерно в 12 миллионах световых лет от нас в созвездии Большой Медведицы, является одной из самых ярких галактик, видимых в телескоп с Земли.
Фотография любезно предоставлена NASA / JPL-Caltech / ESA / Harvard-Smithsonian CfAОбнаружение одноатомной структуры приводит к более эффективному катализатору – ScienceDaily
Катализаторы – это материалы, широко используемые в промышленности для ускорения реакций при производстве бензина, фармацевтических препаратов и для очистки выхлоп автомобиля.Обычно они содержат дорогие драгоценные металлы, что может сделать затраты на производство и обработку экономически непривлекательными.
Один класс катализаторов, одноатомные катализаторы, эффективно использует дорогой металл, поддерживая его в виде изолированных атомов на другом дешевом материале. До сих пор структура этих изолированных атомов при окислении окиси углерода до двуокиси углерода не была известна.
Айман М. Карим, доцент кафедры химической инженерии, и Хунлян Синь, доцент кафедры химической инженерии, оба из Технического колледжа Вирджинии, определили структуру иридиевых одноатомных катализаторов окисления монооксида углерода.Идентификация структуры и механизма реакции поможет в разработке лучших и более экономичных катализаторов.
В журнальной статье «Идентификация активного комплекса для окисления CO на одноатомных катализаторах Ir-на-MgAl2O4», опубликованной в журнале « Nature Catalysis », открытие показывает, что эффективность до 25 раз выше, чем у традиционных катализаторов. из более крупных структур или наночастиц иридия.
«Наблюдение за работой катализатора из одного атома показывает, что химическая реакция может быть простой издалека, но все же сложной для понимания, если мы углубимся в детали атомного уровня», – сказал Карим об исследовании, которое финансировалось Управлением исследований армии.«Однако раскрытие этих деталей открывает путь к разработке более эффективных катализаторов».
Юбин Лу и Цзямин Ван, оба докторанты факультета химической инженерии Технологического института Вирджинии, внесли свой вклад в это исследование. Лу руководил экспериментами, а Ван отвечал за вычислительную работу.
«Это исследование предоставляет очень подробную информацию на атомном уровне о структуре и активности нанесенных одиночных атомов благородных металлов», – пояснил Лу. «Мы применили различные инструменты определения характеристик и квантово-химические расчеты, чтобы показать, как работает одноатомный катализатор.«
В число сотрудниковвходят Саймон Р. Бэр, выдающийся научный сотрудник Стэнфордского источника синхротронного излучения, а также ученые из Тихоокеанской северо-западной национальной лаборатории.
История Источник:
Материалы предоставлены Virginia Tech . Примечание. Содержимое можно редактировать по стилю и длине.
«Открытие атомного мира и составных частей материи» Рошель Форрестер :: SSRN
Как происходят изменения: теория философии истории, социальных изменений и культурной эволюции, (2009) Best Publications Limited
17 стр. Добавлено: 8 ноя 2016 Последняя редакция: 22 ноября 2016 г.
Дата написания: 7 ноября 2016 г.
Аннотация
Переход от традиционного западного и китайского взглядов на элементы, включающие такие материалы, как вода, воздух, земля, дерево, металл и огонь, к химическим элементам, составляющим периодическую таблицу, атомам, частицам, таким как протоны, нейтроны и т. Д. электронов, а затем и кварков.Порядок открытия этих идей о первичных составляющих материи был необходим, поскольку они не могли быть открыты в каком-либо другом порядке. Это произошло потому, что природа имеет особую структуру, а у нас есть особое место в природе. Традиционное представление об элементах можно было получить невооруженным глазом, а затем было обнаружено представление о природе как о состоящей из химических элементов периодической таблицы, поскольку она включает разложение традиционных элементов, таких как воздух и вода.Это привело к идее, что для каждого элемента существует отдельный атом, который объясняет различия между элементами. Субатомные частицы были обнаружены в необходимом порядке: внешние частицы, такие как электрон, были обнаружены раньше, а внутренние частицы, такие как кварки, были обнаружены позже. На порядок обнаружения частиц также влияют свойства частиц. Заряды частиц, их масса и способность выживать вне частиц, которые они составляют, а также другие свойства сделают частицу труднее или легче для обнаружения.Порядок открытия неизбежен и определяется структурой Вселенной. Структура Вселенной включает в себя структуру атома и частиц, составляющих атом, и свойства атома, и частиц, составляющих атом.
Ключевые слова: атомы, протоны, нейтроны, электроны, кварки, открытие субатомных частиц, открытие протона, открытие нейтрона, открытие электронов, открытие кварков, философия истории, культурная эволюция, социальные изменения ,
Классификация JEL: A00
Рекомендуемое цитирование: Предлагаемая ссылка
Уничтожитель атомов обнаружил новые странные субатомные частицы | Наука
Экзотические субатомные частицы, состоящие из пяти кварков, которые физики считали открытыми еще в 2003 году, теперь наконец-то оказались в сумке.Так говорят физики, работающие в лаборатории ЦЕРН в Женеве, Швейцария, которые утверждают, что нашли убедительные доказательства существования так называемых пентакварков в обломках столкновений протонов высоких энергий.
По словам Гая Уилкинсона, представителя LHCb, одного из четырех основных детекторов Большого адронного коллайдера (LHC), открытие «заполнило большую дыру» в теории, описывающей, как материя состоит из фундаментальных частиц, известных как кварки. ), которая стояла за находкой. Эта теория, выдвинутая физиком Мюрреем Гелл-Манном в 1964 году, описывает, как протоны и нейтроны, составляющие атомные ядра, сами состоят из трех кварков и как другие частицы, известные как мезоны, состоят из пар кварков и их аналогов из антивещества, антикварков. .Однако схема Гелл-Манна также указывала на существование пентакварков, состоящих из четырех кварков и антикварка. Отсутствие каких-либо доказательств существования таких частиц за последние 50 лет, по словам Уилкинсона, «не нанесло этой теории дурную славу, но доставляло все большие неудобства».
Чтобы поймать неуловимую добычу, Уилкинсон и его коллеги изучили распад лямбда-b-частиц, создаваемых протонами, сталкивающимися внутри LHCb. Они измерили объединенную энергию двух продуктов распада – протона и мезона, известного как Дж / пси, который состоит из «очаровательного» кварка и антикварка, – а затем подсчитали, сколько раз они записали каждое значение энергии для тысяч столкновения они изучали.Они обнаружили, что количество пар с определенной энергией – чуть менее пяти масс протона – было намного больше, чем можно было бы ожидать случайно. (Энергия и масса эквивалентны, согласно уравнению Эйнштейна E = mc 2 .) Исследователи пришли к выводу, что это была масса мимолетного «чармониевого» пентакварка, содержащего два верхних кварка, один нижний кварк, один очаровательный кварк и один антихарм. кварк.
LHCb собрал данные еще в 2011 и 2012 годах, но команда Уилкинсона воздержалась от объявления о своем открытии, чтобы избежать участи тех, кто ранее заявлял о наблюдениях пентакварков.Двенадцать лет назад около дюжины исследовательских групп со всего мира объявили, что у них есть доказательства существования более легкого пентакварка, известного как тета-плюс, но более подробные исследования показали, что все утверждения были иллюзорными.
Чтобы убедиться, что их результат был надежным, коллаборация LHCb использовала данные, показывающие не только энергию частиц, образовавшихся при столкновениях в ЦЕРНе, но и их направления. Пропустив эти данные с помощью компьютерной модели, они обнаружили, что они могут добиться согласования экспериментальных результатов и выходных данных модели только тогда, когда они включили в процесс распада лямбда-b два пентакварка чармония, один из которых имеет массу 4.45 гигаэлектронвольт (ГэВ), а другой – 4,38 ГэВ. (Для сравнения, вес протона составляет 0,94 ГэВ.) Исследование было загружено на сервер arXiv и отправлено в журнал Physical Review Letters.
Физики, не входящие в коллаборацию, согласны с тем, что результат выглядит убедительным. «Похоже, они нашли убедительные доказательства наличия пентакваркового состояния« тяжелого кварка », – говорит Кен Хикс из Университета Огайо. Кертис Мейер из Университета Карнеги-Меллона в Питтсбурге, штат Пенсильвания, согласен.«Читая статью, я не увидел ничего, на что я мог бы легко указать как на потенциальную проблему», – говорит он, хотя добавляет, что «при любом таком результате подтверждение очень важно».
LHC снова был запущен в апреле после двухлетнего простоя, чтобы модернизировать машину для работы на более высоких энергиях. По словам Уилкинсона, теперь свежие данные, которые поступят в LHCb, должны позволить ученым изучить структуру пентакварков. На данный момент неясно, объясняет он, все ли пять кварков тесно связаны друг с другом внутри новой частицы, или вместо этого три кварка группируются вместе, как внутри протонов и нейтронов, а два других образуют отдельный мезон – что-то вроде два атома соединяются в молекулу.
Уилкинсон говорит, что, поскольку пентакварки могут образовываться внутри коллапсирующих звезд, их открытие может рассказать нам больше о том, из чего состоят звезды и как они развиваются.



 Выводы по уроку.
Выводы по уроку. Домашнее задание. § 6. Упр. 4,
5. Рассмотреть строение атомов: Fe, B, Ag.
Домашнее задание. § 6. Упр. 4,
5. Рассмотреть строение атомов: Fe, B, Ag.
 Модуль № 107
“Атомная гипотеза. Основные сведения о строении
атома”.
Модуль № 107
“Атомная гипотеза. Основные сведения о строении
атома”.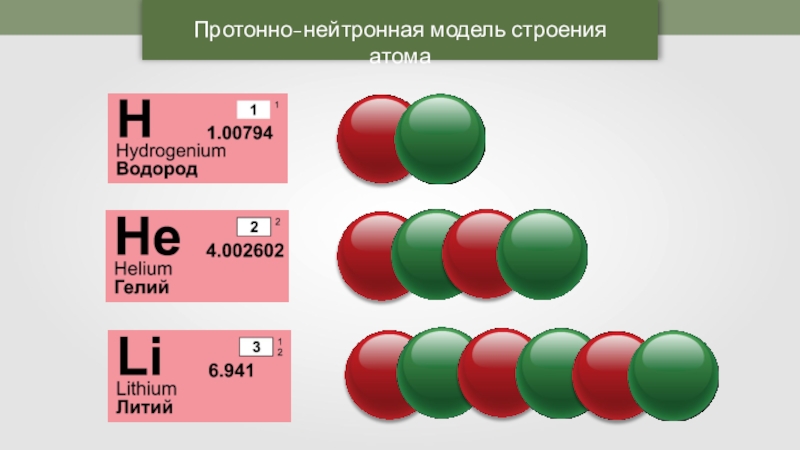 Но было возможным для одного элемента превратиться в другой. Фактически, это все время происходит спонтанно в радиоактивных элементах.
Но было возможным для одного элемента превратиться в другой. Фактически, это все время происходит спонтанно в радиоактивных элементах. Тем не менее греческий термин «атом», означающий «неделимый», прижился и до сих пор используется для обозначения наименьшего количества данного элемента, которое может существовать.
Тем не менее греческий термин «атом», означающий «неделимый», прижился и до сих пор используется для обозначения наименьшего количества данного элемента, которое может существовать. Это закон множественных пропорций.
Это закон множественных пропорций.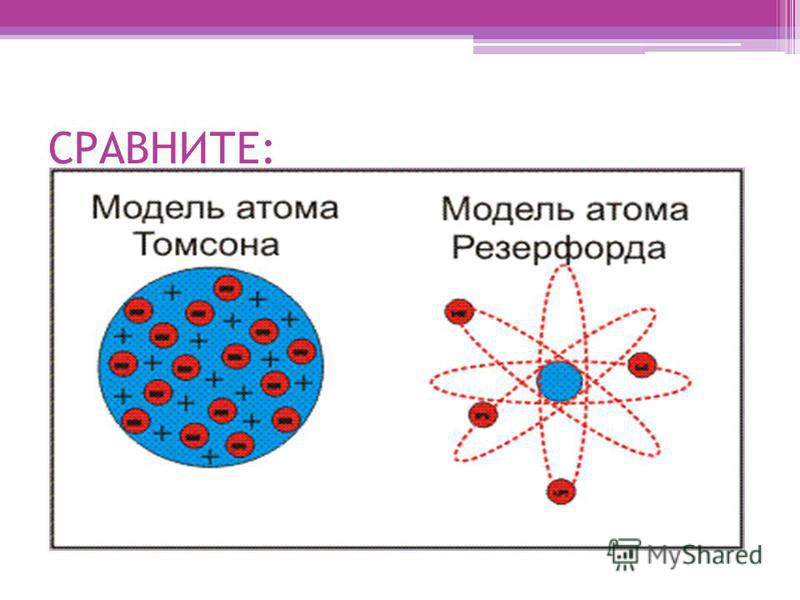 Дж. Томсон смог создать изолированные пучки чистых электронов, измерив их массу, скорость и заряд. Измерения Томсона привели его к поразительному выводу: электроны были намного меньше атомов.
Дж. Томсон смог создать изолированные пучки чистых электронов, измерив их массу, скорость и заряд. Измерения Томсона привели его к поразительному выводу: электроны были намного меньше атомов. .
. Но Резерфорд был ошеломлен, когда он обратил свое внимание на другую сторону экрана и увидел, что несколько частиц отклоняются почти прямо обратно к источнику.
Но Резерфорд был ошеломлен, когда он обратил свое внимание на другую сторону экрана и увидел, что несколько частиц отклоняются почти прямо обратно к источнику.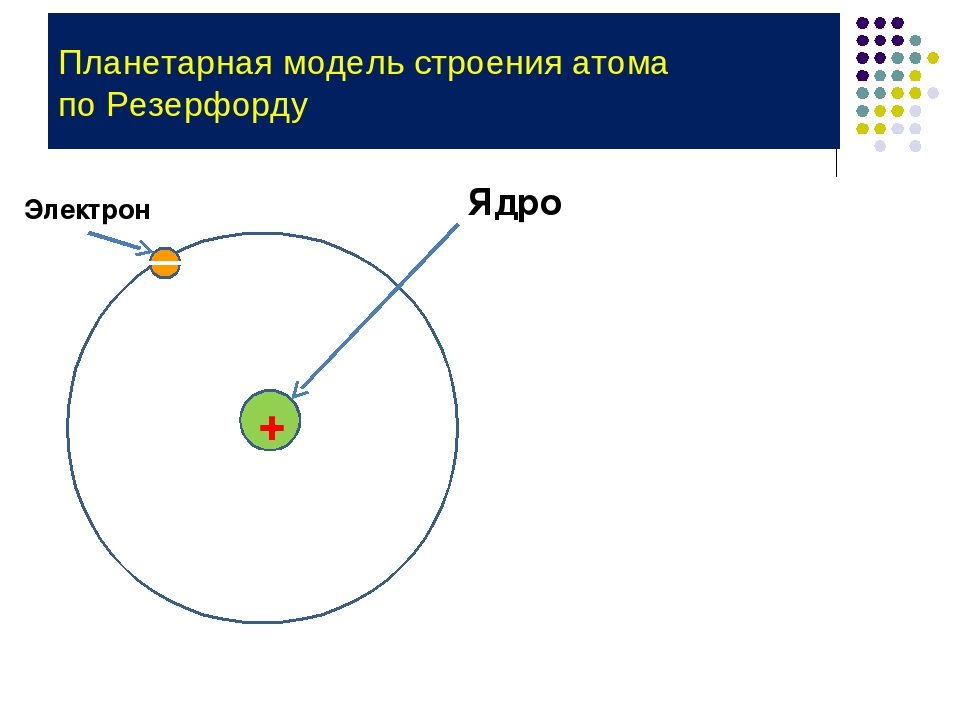 Его модель, объясняющая это, получила название модели Резерфорда, иногда также называемой ядерной моделью, потому что она первая признает, что большая часть массы атома находится в маленьком плотном ядре в его центре.
Его модель, объясняющая это, получила название модели Резерфорда, иногда также называемой ядерной моделью, потому что она первая признает, что большая часть массы атома находится в маленьком плотном ядре в его центре.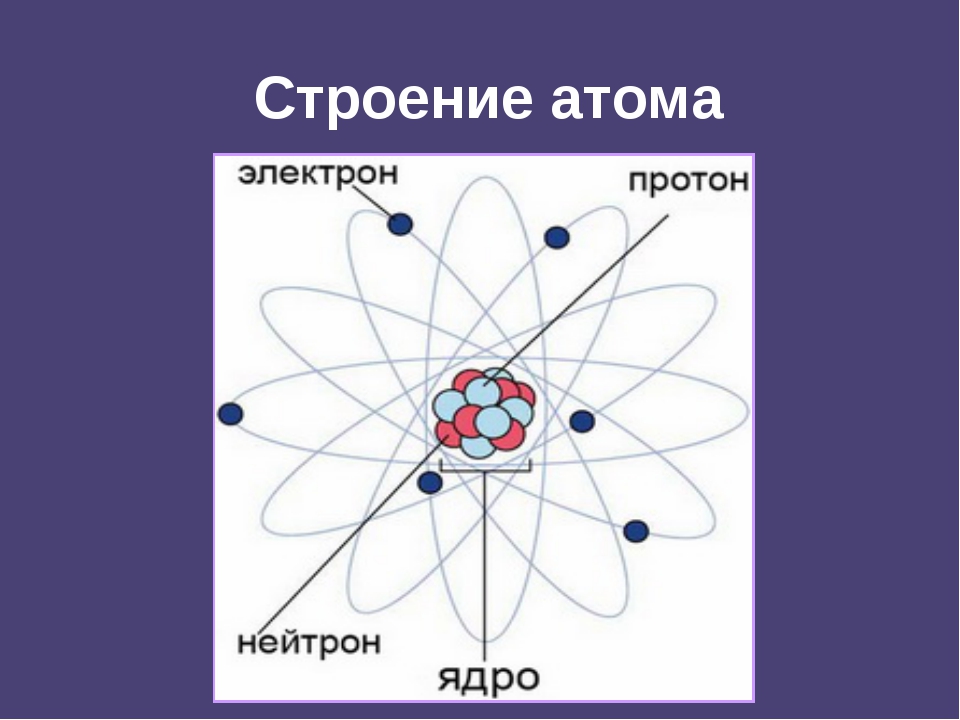
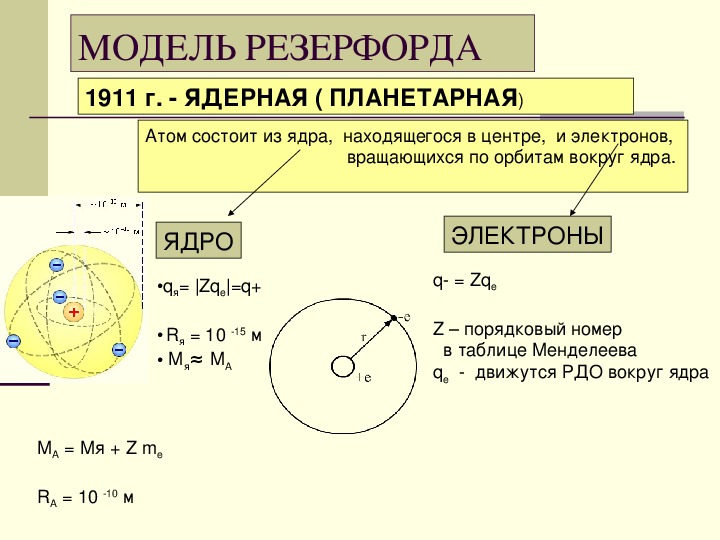 е.м.), для сравнения масс атомов друг с другом.
е.м.), для сравнения масс атомов друг с другом. Но это делает атом водорода примерно вдвое больше его первоначальной массы. Мы называем этот тип водорода, в котором также присутствует нейтрон, что делает его более массивным, – дейтерием.
Но это делает атом водорода примерно вдвое больше его первоначальной массы. Мы называем этот тип водорода, в котором также присутствует нейтрон, что делает его более массивным, – дейтерием.