ПромМетиз +7 (812) 385-76-07 Палладий
Главная » Справочная информация » Таблица металлов » Палладий
Общие сведения.
Палладий – это простое вещество с атомным номером 46. Оно относится к категории пластичных переходных металлов и обладает серебристо-белой расцветкой. В периодической таблице элементов Менделеева палладий располагается в побочной подгруппе восьмой группе и находится в пятом периоде. Атомная масса вещества составляет 106.42 грамма на один моль. Название элемента на латыни – Palladium, а сокращённое обозначение от этого слова – Pd.
История.
Палладий является одним из тех элементов, которые смогли быть открыты благодаря царской водке – довольно сильной по своему воздействию кислотой. Она реагирует с большинством металлов, что позволяет обеспечить использование в различных целях. В результате процесса взаимодействия царской водки и платиновой руды, образовался осадок с относительно высокой концентрацией палладия. Путём нескольких реакций удалось осуществить выделение необходимого элемента. Первый палладий был получен именно таким способом в 1803 оду. Он отличался содержанием в своём составе достаточно высокого количества примесей.
Путём нескольких реакций удалось осуществить выделение необходимого элемента. Первый палладий был получен именно таким способом в 1803 оду. Он отличался содержанием в своём составе достаточно высокого количества примесей.
Нахождение в природе и получение.
Если рассматривать процентное содержание палладия в земной коре, то оно будет крайне мало. Данный элемент присутствует в количествах меньших, чем серебро и некоторые другие вещества. Он считается одним из самых редких металлов на планете. На данный момент, геологам известно более трёх десятков минералов, которые содержат в своём составе данный элемент. Особый интерес представляют два типа руды: паладистое золото и платина. Они содержат 40 и 10 процентов палладия, соответственно. Самые крупные месторождения располагаются на территории России в Уральских горах. Достаточно большое количество этого элемента можно встретить в США и Австралии. Чтобы получить палладий из руды необходимо провести многоэтапную переработку. Только после того, как она будет завершена, можно выделить чистый элемент.
Только после того, как она будет завершена, можно выделить чистый элемент.
Физические и химические свойства.
Палладий по своим физическим свойствам относится к металлам платиновой группы. Элемент отличается своей пластичностью и некоторыми другими свойствами. Чтобы повысить характеристики, могут применяться сплавы с кобальтом, никелем и рутением. В первую очередь, они позволяют увеличить твёрдость. Плотность палладия составляет 12 тонн на один кубический метр. Переход в жидкое состояние происходит при нагреве до 1554 градусов, а в газовую форму – 2940.
Химические свойства палладия не отличаются своим разнообразием, поскольку элемент достаточно устойчив. Не происходят реакции с водой, раствором аммиака, разбавленными кислотами или щелочами, а также некоторыми другими соединениями. Взаимодействие возможно с концентрированной азотной и соляной кислотой, галогенами, царской водкой или серой.
Применение.
В чистом виде палладий нашёл своё место при необходимости обеспечения некоторых типов реакций, где он выступает в качестве катализатора. Подобная область использования не представлена широко, поскольку стоимость элемента весьма высока.
Хлорид палладия используется в гальванотехнике. Он является активным веществом и наносится тончайшим слоем на некоторые платы в электронике. Благодаря своим свойствам, в данной сфере металл приобрёл наиболее широкое применение. Прежде всего, в электротехнике элементом производится покрытие контактов для обеспечения устойчивости к сульфидам.
Палладий используется в ювелирном деле, поскольку встречается весьма редко. Даже незначительная примесь к золоту меняет цвет последнего на светло-серый.
Палладий, свойства атома, химические и физические свойства
Палладий, свойства атома, химические и физические свойства.
Поделиться в:
Pd 46 Палладий
106,42(1) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10
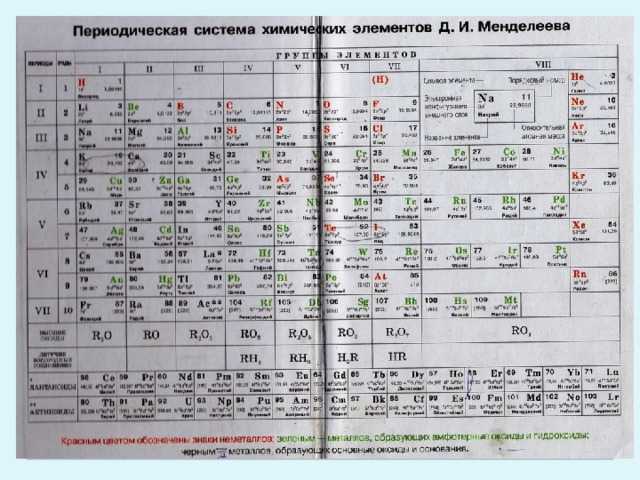
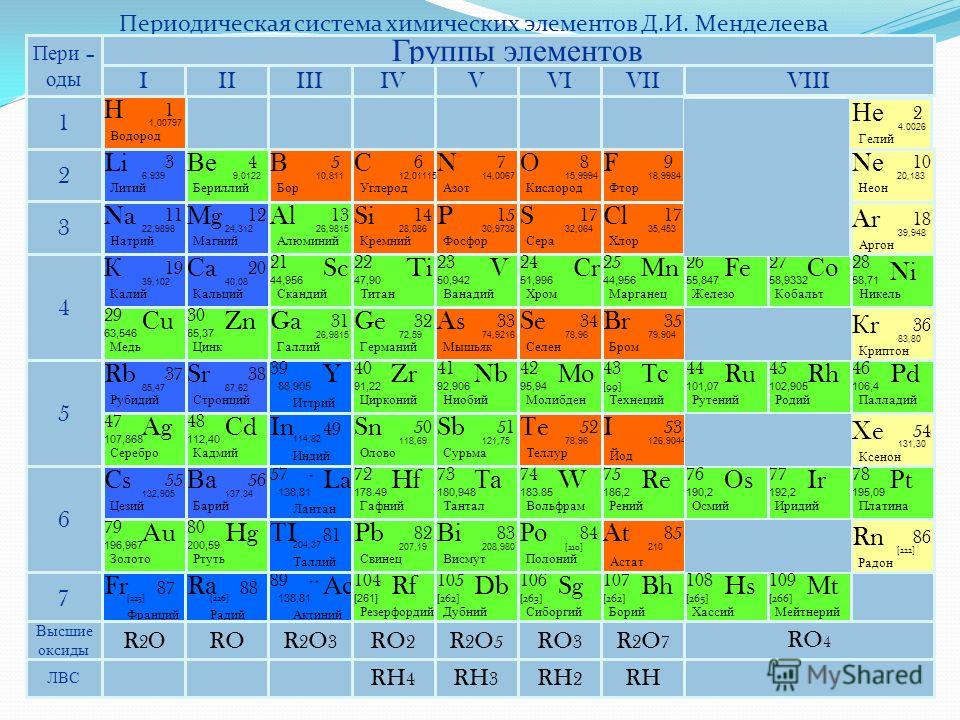
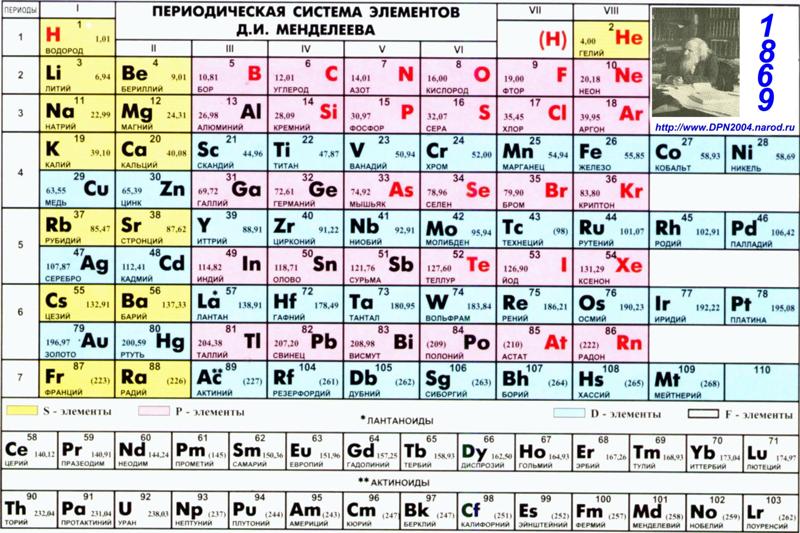
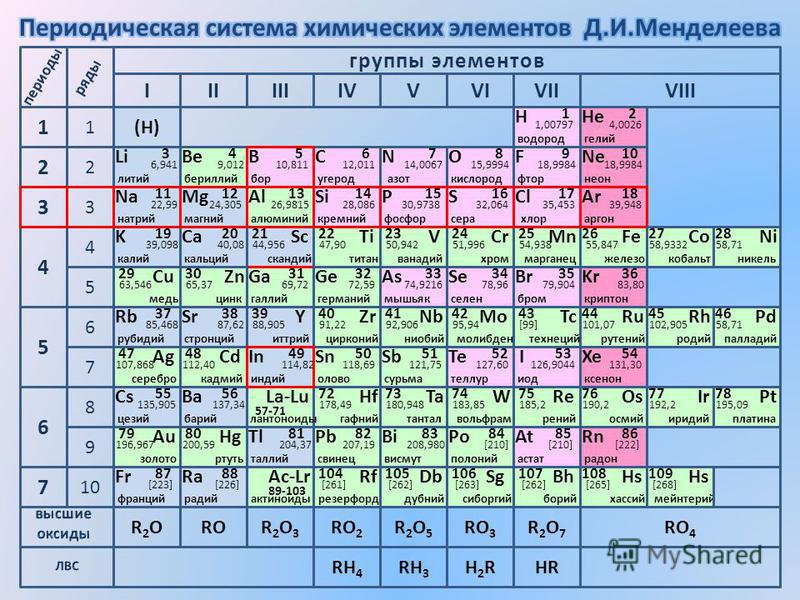
Палладий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 46. Расположен в 10-й группе (по старой классификации — побочной подгруппе восьмой группы), пятом периоде периодической системы.
И. Менделеева с атомным номером 46. Расположен в 10-й группе (по старой классификации — побочной подгруппе восьмой группы), пятом периоде периодической системы.
Атом и молекула палладия. Формула палладия. Строение атома палладия
Цена на палладий
Изотопы и модификации палладия
Свойства палладия (таблица): температура, плотность, давление и пр.
Физические свойства палладия
Химические свойства палладия. Взаимодействие палладия. Химические реакции с палладием
Получение палладия
Применение палладия
Таблица химических элементов Д.И. Менделеева
Атом и молекула палладия. Формула палладия. Строение атома палладия:
Палладий (лат. Palladium, назван по имени астероида Паллада) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Pd и атомным номером 46. Расположен в 10-й группе (по старой классификации – побочной подгруппе восьмой группы), пятом периоде периодической системы.
Палладий – металл. Относится к группе переходных металлов, а также к драгоценным, цветным металлам и металлам платиновой группы.
Палладий обозначается символом Pd.
Как простое вещество палладий при нормальных условиях представляет собой пластичный металл серебристо-белого цвета.
Молекула палладия одноатомна.
Химическая формула палладия Pd.
Электронная конфигурация атома палладия 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 или 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s0. Потенциал ионизации (первый электрон) атома палладия равен 804,38 кДж/моль (8,336839(10) эВ).
Потенциал ионизации (первый электрон) атома палладия равен 804,38 кДж/моль (8,336839(10) эВ).
Строение атома палладия. Атом палладия состоит из положительно заряженного ядра (+46), вокруг которого по четырем оболочкам движутся 46 электронов. При этом 46 электронов находится на внутреннем уровне, а 0 электронов – на внешнем. Поскольку палладий расположен в пятом периоде, оболочек всего пять. Однако пятая оболочка не заполнена электронами. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома палладия на 4d-орбитали находятся пять спаренных электронов. На внешнем энергетическом уровне атома палладия на s-орбитали электроны отсутствуют. В свою очередь ядро атома палладия состоит из 46 протонов и 60 нейтронов. Палладий относится к элементам d-семейства.
Радиус атома палладия (вычисленный) составляет 169 пм.
Атомная масса атома палладия составляет 106,42(1) а. е. м.
Палладий, свойства атома, химические и физические свойства
Изотопы и модификации палладия:
Свойства палладия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Палладий |
| 102 | Прежнее название | |
| 103 | Латинское название | Palladium |
| 104 | Английское название | Palladium |
| 105 | Символ | Pd |
| 106 | Атомный номер (номер в таблице) | 46 |
| 107 | Тип | Металл |
| Группа | Переходный, драгоценный, цветной металл, металл платиновой группы | |
| 109 | Открыт | Уильям Гайд Волластон, Великобритания, 1803 г. |
| 110 | Год открытия | 1803 г. |
| 111 | Внешний вид и пр. | Пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 6,3·10-7 % |
| 120 | Содержание в морях и океанах (по массе) | |
| 121 | Содержание во Вселенной и космосе (по массе) | 2,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 3,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000066 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 106,42(1) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 169 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 139 пм |
| 207 | Радиус иона (кристаллический) | Pd+ 73 (2) пм, Pd2+ 78 (4) пм, 100 (6) пм, Pd3+ 90 (6) пм Pd4+ 75,5 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 163 пм |
| 209 | Электроны, Протоны, Нейтроны | 46 электронов, 46 протонов, 60 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 10-ая группа (по старой классификации – побочная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, IV |
| 303 | Электроотрицательность | 2,20 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 804,38 кДж/моль (8,336839(10) эВ) |
| 305 | Электродный потенциал | Pd2+ + 2e– → Pd, Eo = +0,987 В |
| 306 | Энергия сродства атома к электрону | 54,24(2) кДж/моль (0,56214(12) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 12,023 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 10,38 г/см3 (при 1554,9 °C и иных стандартных условиях |
| 402 | Температура плавления* | 1554,9 °C (1828,05 K, 2830,82 °F) |
| 403 | Температура кипения* | 2963 °C (3236 K, 5365 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 16,74 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 358 кДж/моль |
| Удельная теплоемкость при постоянном давлении | ||
| 410 | Молярная теплоёмкость* | 25,98 Дж/(K·моль) |
| 411 | Молярный объём | 8,851 см³/моль |
| 412 | Теплопроводность | 71,8 Вт/(м·К) (при стандартных условиях), 71,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решеётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | a = 3,890 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 274 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-05-3 |
Примечание:
205* Эмпирический радиус атома палладия согласно [1] и [3] составляет 137 пм.
206* Ковалентный радиус палладия согласно [1] и [3] составляет 139±6 пм и 128 пм соответственно.
401* Плотность палладия согласно [3] и [4] составляет 12,02 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления палладия согласно [3] и [4] составляет 1554 °С (1827,15 K, 2829,2 °F).
403* Температура кипения палладия согласно [3] и [4] составляет 2666,85 °C (2940 K, 4832,33 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) палладия согласно [3] и [4] составляет 17,24 кДж/моль и 17 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) палладия согласно [3] и [4] составляет 372,4 кДж/моль и 353 кДж/моль соответственно.
410* Молярная теплоёмкость палладия согласно [3] составляет 25,8 Дж/(K·моль).
Физические свойства палладия:
Химические свойства палладия. Взаимодействие палладия.
 Химические реакции с палладием:
Химические реакции с палладием:
Получение палладия:
Применение палладия:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29.
 Медь
Медь - 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63.
 Европий
Европий - 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96.
 Кюрий
Кюрий - 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Palladium
- https://de.wikipedia.org/wiki/Palladium
- https://ru.wikipedia.org/wiki/Палладий
- http://chemister.
 ru/Database/properties.php?dbid=1&id=256
ru/Database/properties.php?dbid=1&id=256 - https://chemicalstudy.ru/palladiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
палладий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле палладия палладий
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 571
Палладий | Периодическая таблица | The Guardian
Элемент этой недели — палладий, который обозначен атомным символом Pd и атомным номером 46.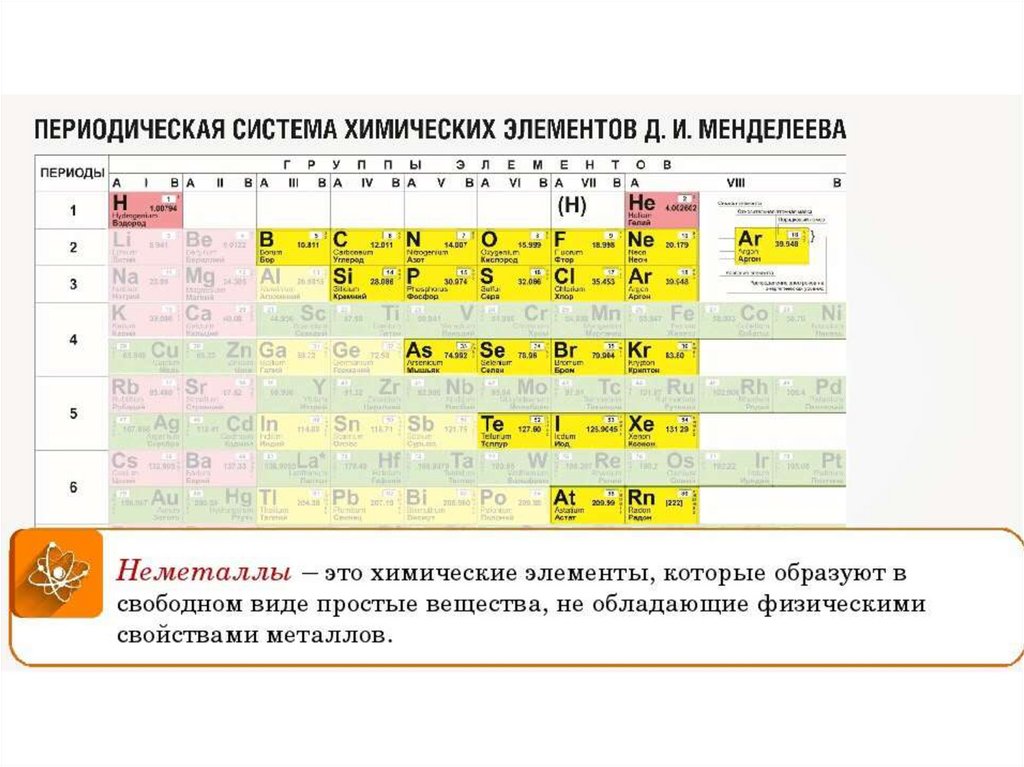 Как вы можете видеть на изображении выше, этот редкий металл имеет блестящий серебристо-белый цвет. Вместе с двумя элементами предыдущей недели, родием и рутением, палладий входит в так называемую платиновую группу, в которую также входят иридий, осмий и, конечно же, платина. Эти переходные металлы, которые объединяются в группы 8, 9, и 10 в периодах 5 и 6 таблицы Менделеева имеют схожие физические и химические свойства и, как правило, одновременно встречаются в одних и тех же месторождениях полезных ископаемых. Как и другие члены платиновой группы, палладий встречается редко и, следовательно, весьма ценен. Из металлов платиновой группы палладий отличается тем, что имеет самую низкую температуру плавления и наименьшую плотность.
Как вы можете видеть на изображении выше, этот редкий металл имеет блестящий серебристо-белый цвет. Вместе с двумя элементами предыдущей недели, родием и рутением, палладий входит в так называемую платиновую группу, в которую также входят иридий, осмий и, конечно же, платина. Эти переходные металлы, которые объединяются в группы 8, 9, и 10 в периодах 5 и 6 таблицы Менделеева имеют схожие физические и химические свойства и, как правило, одновременно встречаются в одних и тех же месторождениях полезных ископаемых. Как и другие члены платиновой группы, палладий встречается редко и, следовательно, весьма ценен. Из металлов платиновой группы палладий отличается тем, что имеет самую низкую температуру плавления и наименьшую плотность.
Подобно элементу прошлой недели, родию, большая часть палладия используется в автомобильных каталитических преобразователях. Эти металлы действуют как катализаторы; агент, который ускоряет химическую реакцию, не изменяясь и не поглощаясь этой реакцией.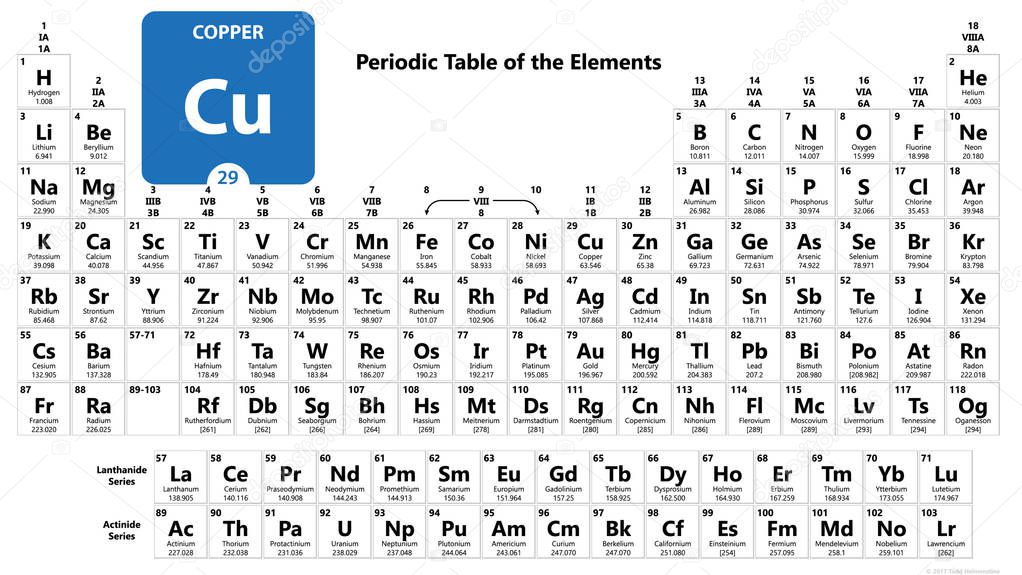
Различные переходные металлы или их комбинации используются в качестве катализаторов для различных применений, в зависимости от типа загрязняющих веществ, которые необходимо нейтрализовать. В то время как родий используется в качестве катализатора восстановления (где электроны присоединяются к молекулам), палладий используется в качестве катализатора окисления (где электроны удаляются из молекул). Например, при восстановлении оксидов азота высвобождаются кислород (O 2 ) и азот (N 2 ), тогда как при окислении монооксида углерода (CO) образуется диоксид углерода (CO 2 ). Палладий особенно полезен для удаления несгоревших и частично сгоревших углеводородов из выхлопных газов автомобилей с выделением газа H 2 . Он также хорошо работает при первом запуске «холодного» двигателя автомобиля.
Помимо использования в автомобильной промышленности, палладий используется в керамических конденсаторах электронных устройств, таких как компьютеры и мобильные телефоны, в качестве пломб для зубов, в ювелирных изделиях и в свечах зажигания. Палладий не играет известной биологической роли в большинстве живых существ.
Палладий не играет известной биологической роли в большинстве живых существ.
Профессор немного рассказывает нам о палладии:
Посетите канал Periodicvideos на YouTube [ссылка на видео].
.. .. .. .. .. .. .. .. .. .. .. ..
Видеожурналист Брэди Харан – человек с камерой, а Ноттингемский университет – это место с химиками. Вы можете следить за Брейди в твиттере @periodicvideos и за университетом Ноттингема в твиттере @UniNottingham
Вы уже встречались с этими элементами:
Родий: Rh , атомный номер 45
Рутений: Ru , атомный номер 44
Технеций: Tc , атомный номер 43
Ниобий: Ni , атомный номер 41
Цирконий: Zr , атомный номер 40
Иттрий: Y , атомный номер 39
Sr, атомный номер , Sr, атомный номер 38
Рубидий: Rr , атомный номер 37
Криптон: Kr , атомный номер 36
Бром: Br , атомный номер 9 9027 85 0027 Se , атомный номер 34
Мышьяк : As , атомный номер 33
Германий: Ge , атомный номер 32
Галлий: Ga , атомный номер 31
Цинк , атомный номер 30
Медь: Cu , атомный номер 29
Никель: Ni , атомный номер 28
Кобальт: Co , атомный номер 2 0027 29 : 05 27 27 27 7 Fe , атомный номер 26
Марганец: Mn , атомный номер 25
Хром: Cr , атомный номер 24
Ванадий: V , атомный номер 900 23
8 9 028 , атомный номер 22
Скандий: Sc , атомный номер 21
Кальций: Ca , атомный номер 20
Калий: 7 29 K 180, 0
Аргон: Ar , атомный номер 18
Хлор: Cl , атомный номер 17
Сера: S , атомный номер 16
Фосфор: P 3 5 Sili 90, атомный номер 1509070 con: Si , атомный номер 14
Алюминий: Al , атомный номер 13
Магний: Mg , атомный номер 12
Натрий: Na 29 10, 02 атомный номер
Неон: Ne , атомный номер 10
Фтор: F , атомный номер 9
Кислород: O , атомный номер 8
Азот: N : 095 Углерод 7 027 C , атомный номер 6
Бор: B , атомный номер 5
Бериллий: Be , атомный номер 4 5 Гелий: He , атомный номер 2
Водород: H , атомный номер 1
Вот замечательная интерактивная Периодическая таблица элементов, с которой действительно весело играть!
. . .. .. .. .. .. .. .. .. .. .. ..
. .. .. .. .. .. .. .. .. .. .. ..
twitter: @GrrlScientist
facebook: grrlscientist
evil google+: grrlscientist
электронная почта: [email protected]
Pt и Pd
Pt и Pd- Ресурс
- Периодическая таблица
- Платина и палладий
Отделение платины и палладия от жидких сред
Платина и палладий — это редкие, химически стойкие металлы, которые ценятся за их полезность в различных областях: от катализаторов органических реакций до ювелирных украшений и микроэлектроники.
46
Pd
Палладий
78
Платина
Платина
Кислотное галогеновое выщелачивание
Многие горнодобывающие проекты осуществляются, в ходе которых руды выщелачиваются в окислительных и кислотных условиях. В этих условиях анионообменные смолы AmberLite™ показали себя стабильно и надежно.
Дополнительную информацию об извлечении драгоценных металлов из растворов кислого галогенного выщелачивания можно получить, связавшись с нами.
Восстановление катализатора
Когда драгоценные металлы используются в качестве гетерогенных или гомогенных катализаторов, часть металла может быть потеряна в процессе, что приведет к дальнейшей неконтролируемой реакции, проблемам с качеством и более высоким затратам из-за потери стоимости металла. Эти металлы могут быть извлечены с помощью поглотителя ионообменной смолы.
Aqueous Streams
Во многих случаях AmberSep™ 43600 отлично справляется с загрузкой платины и палладия. В других матрицах смола, функционализированная тиолом, такая как AmberSep™ GT74 Смола может стать более эффективным решением. Смола AmberSep™ 21K XLT должна быть протестирована в крепких солевых растворах. Во многих случаях смола AmberLyst™ A21 отлично справляется с загрузкой платины и палладия; эта слабоосновная анионная смола эффективна в нейтральных и кислых условиях.
В любом из этих вариантов ионообменные смолы можно регенерировать или использовать для извлечения металла. Поставщики катализаторов также могут перерабатывать смолы, содержащие драгоценные металлы, для восстановления потерянных металлов.
Органические потоки
Для извлечения драгоценных металлов из потоков на основе органических растворителей также эффективна сухая смола AmberLyst™ A21, но смолу следует использовать в сухом виде. Кинетика неводного обмена медленнее, поэтому необходимо обеспечить достаточное время контакта. Для получения дополнительной информации о приготовлении смолы см. «Обработка органических растворителей».
Гальванические ванны
Анионообменные смолы AmberLite™ обычно используются для извлечения платины и палладия из отработанных растворов гальванических ванн. Как правило, насыщенная смола поглощает до 60 унций металла на кубический фут (60 г/л), а металл извлекается путем термического разложения (дымления).
Дополнительную информацию о извлечении драгоценных металлов выпариванием можно получить, связавшись с нами.
Selective Platinum Resin
DuPont предлагает функционализированную тиуронием смолу под названием AmberSep™ 43600 Resin. Смола представляет собой макропористый продукт с однородным размером частиц, обладающий хорошей кинетикой обмена и обладающий высокой селективностью в отношении МПГ. Это прочный и прочный продукт для смолы в целлюлозных применениях. Обратите внимание, что тиурониевая группа подвергается щелочному гидролизу, поэтому продукт следует использовать в условиях pH от кислой до нейтральной.
ПРИМЕЧАНИЕ. Если продукты DuPont описываются как «экспериментальные» или «разрабатываемые»: (1) технические характеристики продукта могут быть определены не полностью; (2) требуется анализ опасностей и осторожность при обращении и использовании; (3) у DuPont больше шансов изменить спецификации и/или прекратить производство; и (4) хотя DuPont может время от времени предоставлять образцы таких продуктов, DuPont не обязана поставлять или иным образом коммерциализировать такие продукты для любого использования или применения.
